МЕЖГОСУДАРСТВЕННЫЙ СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ (МГС)
INTERSTATE COUNCIL FOR STANDARDIZATION, METROLOGY AND CERTIFICATION
(ISC)
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ГОСТ
EN 14122—
2020
ПРОДУКЦИЯ ПИЩЕВАЯ
Определение содержания витамина В1 методом высокоэффективной жидкостной хроматографии
(EN 14122:2014, IDT)
Издание официальное
Москва Российский институт стандартизации 2024
ГОСТ EN 14122—2020
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Научно-производственным республиканским унитарным предприятием «Белорусский государственный институт стандартизации и сертификации» (БелГИСС) на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Государственным комитетом по стандартизации Республики Беларусь
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июня 2020 г. № 131-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166)004—97 | Код страны по МК (ИСО 3166) 004—97 | Сокращенное наименование национального органа по стандартизации |
Армения | АМ | ЗАО «Национальный орган по стандартизации и метрологии» Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджи кета н да рт |
Узбекистан | uz | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 24 апреля 2024 г. № 534-ст межгосударственный стандарт ГОСТ EN 14122—2020 введен в действие в качестве национального стандарта Российской Федерации с 1 ноября 2024 г. с правом досрочного применения
5 Настоящий стандарт идентичен европейскому стандарту EN 14122:2014 «Продукты пищевые. Определение витамина В1 методом высокоэффективной жидкостной хроматографии» («Foodstuffs — Determination of vitamin B1 by high performance liquid chromatography», IDT).
Европейский стандарт разработан техническим комитетом по стандартизации CEN/TC 275 «Анализ пищевых продуктов. Горизонтальные методы» Европейского комитета по стандартизации (CEN).
При применении настоящего стандарта рекомендуется использовать вместо ссылочного европейского стандарта соответствующий ему межгосударственный стандарт, сведения о котором приведены в дополнительном приложении ДА
6 ВЗАМЕН FOCTEN 14122—2013
II
ГОСТ EN 14122—2020
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
© Оформление. ФГБУ «Институт стандартизации», 2024
В Российской Федерации настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
III
ГОСТ EN 14122—2020
Содержание
1 Область применения..................................................................1
2 Нормативные ссылки..................................................................1
3 Сущность метода.....................................................................1
4 Реактивы............................................................................2
5 Оборудование.......................................................................3
6 Методика проведения испытания........................................................4
7 Вычисление.........................................................................6
8 Прецизионность......................................................................7
9 Протокол испытания..................................................................8
Приложение А (справочное) Примеры хроматограмм.........................................9
Приложение В (справочное) Данные прецизионности.......................................11
Приложение С (справочное) Альтернативные системы высокоэффективной жидкостной
хроматографии..........................................................14
Приложение D (справочное) Соединение витамина В1 2-(1-гидроксиэтил)тиамин (ГЭТ), образующееся при проведении послеколоночной дериватизации................15
Приложение ДА (справочное) Сведения о соответствии ссылочного европейского стандарта межгосударственному стандарту...........................................16
Библиография........................................................................17
IV
ГОСТЕМ 14122—2020
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ПРОДУКЦИЯ ПИЩЕВАЯ
Определение содержания витамина В1 методом высокоэффективной жидкостной хроматографии
Foodstuffs.
Determination of vitamin B1 by high performance liquid chromatography
Дата введения — 2024—11—01 с правом досрочного применения
Предупреждение — Применение настоящего стандарта может быть связано с проведением опасных операций, использованием вредных веществ, опасного оборудования. В задачи настоящего стандарта не входит решение всех вопросов безопасности, связанных с его применением. Ответственность за соблюдение техники безопасности и установление необходимых ограничений при применении настоящего стандарта несет его пользователь.
1 Область применения
Настоящий стандарт устанавливает метод определения содержания витамина В1 в пищевой продукции с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с применением ферментативной обработки и предколоночной или послеколоночной дериватизации. Данный метод был валидирован в двух межлабораторных исследованиях. В первом исследовании проводился анализ проб цельнозерновой муки, сухого молока/сухого молока, полученного методом распылительной сушки, смеси лиофилизированных овощей и лиофилизированной свиной печени в пределах от 0,295 до 0,807 мг/100 г. Во втором исследовании анализировали пробы раствора для энтерального питания, пищевой продукции для детского питания с овощами, сухого молока, цельнозерновой муки с фруктами, дрожжей, продуктов переработки зерна, шоколадного порошка и биологически активной добавки к пище в диапазоне от 0,11 до 486 мг/100 г. Содержание витамина В1 представляет собой массовую долю общего тиамина, включая его фосфорилированные производные.
Для получения более подробной информации о валидации см. раздел 8 и приложение В.
2 Нормативные ссылки
В настоящем стандарте использована нормативная ссылка на следующий стандарт [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения)]:
EN ISO 3696, Water for analytical laboratory use — Specification and test methods (ISO 3696) (Вода для лабораторного анализа. Технические требования и методы испытаний)
3 Сущность метода
Тиамин извлекают из пищевой продукции путем кислотного гидролиза с последующим дефосфорилированием, используя ферментативную обработку, и определяют его количество методом ВЭЖХ с предколоночной или послеколоночной дериватизацией до тиохрома. Для количественной оценки используют метод внешнего стандарта. Для получения дополнительной информации см. [1]—[7].
Издание официальное
1
ГОСТ EN 14122—2020
4 Реактивы
Для проведения анализа, если не указано иное, используют только реактивы признанной аналитической чистоты и воду не ниже первой степени чистоты по EN ISO 3696 или бидистиллированную воду.
4.1 Метанол для ВЭЖХ, массовая доля w(CH3OH) > 99,8 %.
4.2 Раствор уксусной кислоты, молярная концентрация с(СН3СООН) = 0,02 моль/дм3.
4.3 Изобутанол, и/(С4Н10О) > 98 %.
4.4 Дигидрофосфат натрия, w(NaH2PO4) > 99,8 %.
4.5 Соляная кислота, w(HCI) = 36 %.
4.6 Раствор соляной кислоты, с(НО) = 0,1 моль/дм3.
4.7 Раствор серной кислоты, c(H2SO4) = 0,05 моль/дм3.
4.8 Гидроксид натрия, w(NaOH) > 99 %.
4.9 Раствор гидроксида натрия, массовая концентрация p(NaOH) =150 г/дм3.
4.10 Раствор гидроксида натрия, p(NaOH) = 200 г/дм3.
4.11 Гексацианоферрат (III) калия, wjK3[Fe(CN)6]} > 99 %.
4.12 Раствор гексацианоферрата (III) калия, p{K3[Fe(CN)6]} = 10 г/дм3.
4.13 Щелочной раствор гексацианоферрата (III) калия (для предколоночной дериватиза-ции), p{K3[Fe(CN)6]} = 0,4 г/дм3.
2,0 см3 раствора гексацианоферрата (III) калия (см. 4.12) помещают в мерную колбу вместимостью 50 см3 и объем содержимого колбы доводят до метки раствором гидроксида натрия (см. 4.9). Раствор готовят в день проведения испытания.
4.14 Щелочной раствор гексацианоферрата (III) калия (для послеколоночной дериватиза-ции), p{K3[Fe(CN)6]} = 0,5 г/дм3.
2,5 см3 раствора гексацианоферрата (III) калия (см. 4.12) помещают в мерную колбу вместимостью 50 см3 и объем содержимого колбы доводят до метки раствором гидроксида натрия (см. 4.10).
4.15 Фермент или смесь ферментов, способные высвобождать витамин В1 из пищевой продукции в виде свободного тиамина.
Примечание 1 — Для получения прецизионных данных, указанных в таблице В. 1, была использована така-диастаза, произведенная компанией Pfaltz and Bauer1). Для получения прецизионных данных, указанных в таблицах В.2 и В.З, была использована смесь р-амилазы из ячменя и така-диастазы, произведенной Serva1 \
Примечание 2 — Проблему неполного дефосфорилирования можно решить с помощью раздельного количественного определения ТМФ (тиамина монофосфата), см. [7].
4.16 Раствор ацетата натрия, c(CH3COONa-ЗН2О) = 2,5 моль/дм3.
4.17 Раствор ацетата натрия, c(CH3COONa-3H2O) = 0,5 моль/дм3.
4.18 Подвижные фазы ВЭЖХ.
Примеры соответствующих смесей с объемными долями метанола (см. 4.1) от 10 % до 50 % в воде или использования фосфатного или ацетатного буфера представлены в приложениях А и С. Также представлен вариант подвижной фазы с использованием ион-парного реагента.
4.19 Раствор фосфатный буферный (pH 3,5), с(КН2РО4) = 9,0 ммоль/дм3.
4.20 Тетраэтиламмоний хлорид, w(C8H20NCI) > 98 %.
4.21 Натрия гептансульфонат, w(C7H15NaO3S) > 98 %.
4.22 Раствор ацетатный буферный (pH 4,0), с(СН3СООН) = 50 ммоль/дм3.
4.23 Стандартные вещества.
4.23.1 Тиамина хлорид гидрохлорид, w(C12H17CIN4OSHCI) > 99 %.
Используется для метода внешнего стандарта, см. 6.3.
4.23.2 Тиамина монофосфат хлорид, w(C12H17CIN4O4PS) > 98 %.
Используется для проверки ферментов, см. 6.2.2.
4.23.3 Тиамина пирофосфат хлорид (кокарбоксилаза), h/(C12H19CIN4O7P2S) > 98 %.
Используется для проверки ферментов, см. 6.2.2.
1 > Информация о поставщиках така-диастазы Pfaltz & Bauer, Уотербери, СТ 06708, США (№ Т00040) и Serva приведена для удобства пользователей настоящего стандарта и не является рекламой CEN указанной продукции. Допускается использовать аналогичную продукцию при условии обеспечения идентичных результатов.
2
ГОСТ EN 14122—2020
4.24 Основные растворы
4.24.1 Основной раствор тиамина хлорида гидрохлорида, p(C12H17CIN4OS • HCI) = 0,1 мг/см3.
Растворяют точно взвешенное количество стандартного вещества тиамина хлорида гидрохлорида (см. 4.23.1) в определенном объеме соответствующего растворителя, например 10 мг стандартного вещества витамина В1 в 100 см3 раствора соляной кислоты (см. 4.6). Срок хранения раствора — четыре недели при температуре 4 °C.
4.24.2 Основной раствор тиамина монофосфата, p(C12H17CIN4O4PS) = 0,1 мг/см3.
Растворяют точно взвешенное количество тиамина монофосфата хлорида (см. 4.23.2) в определенном объеме соответствующего растворителя, например 10 мг тиамина монофосфата хлорида в 100 см3 раствора соляной кислоты (см. 4.6). Срок хранения раствора — четыре недели при температуре минус 20 °C.
4.24.3 Основной раствор тиамина пирофосфата, p(C12H19CIN4O7P2S) = 0,1 мг/см3.
Растворяют точно взвешенное количество тиамина пирофосфата хлорида (см. 4.23.3) в определенном объеме соответствующего растворителя, например 10 мг тиамина пирофосфата хлорида в 100 см3 раствора соляной кислоты (см. 4.6).
4.24.4 Определение точной концентрации тиамина хлорида гидрохлорида
10 см3 раствора тиамина хлорида гидрохлорида (см. 4.24.1) переносят в мерную колбу вместимостью 100 см3 и объем содержимого колбы доводят до метки раствором соляной кислоты (см. 4.6). Оптическую плотность данного раствора измеряют на УФ-спектрометре (см. 5.1) при максимальной длине волны 247 нм И247) в кювете с длиной оптического пути 1 см, используя раствор соляной кислоты (см. 4.6) в качестве раствора сравнения. Массовую концентрацию раствора тиамина хлорида гидрохлорида р, мкг/см3, рассчитывают по формуле
^tJWJOOO (^
р е ’
где е — молярный коэффициент поглощения тиамина хлорида гидрохлорида при максимальной длине волны 247 нм £ = 14 200 дм3 • моль-1 • см-1. Данное значение рассчитывается исходя из коэффициента экстинкции eJc^ 421 в 0,1 моль/см3 HCI [8], [7] и молярной массы М = 337,21. Значение округляют до четырех значащих цифр;
М — молярная масса, г/моль. Значение равно 337,21;
А247 — значение оптической плотности раствора тиамина хлорида гидрохлорида.
4.25 Стандартные растворы
4.25.1 Стандартный раствор тиамина хлорида гидрохлорида, p(C12H17CIN4OS-HCI) ~ от 1 до 10 мкг/см3.
В мерную колбу вместимостью 100 см3 переносят пипеткой от 1 до 10 см3 раствора тиамина хлорида гидрохлорида (см. 4.24.1) и объем содержимого колбы доводят до метки подходящим растворителем, например раствором соляной кислоты (см. 4.6). Раствор можно хранить в течение месяца при температуре 4 °C в темном месте.
4.25.2 Стандартный раствор тиамина монофосфата, p(C12H17CIN4O4PS) ~ от 1 до 10 мкг/см3.
В мерную колбу вместимостью 100 см3 переносят пипеткой от 1 до 10 см3 раствора тиамина монофосфата (см. 4.24.2) и объем содержимого колбы доводят до метки подходящим растворителем, например раствором соляной кислоты (см. 4.6). Раствор можно хранить в течение месяца при температуре 4 °C в темном месте.
4.25.3 Стандартный раствор тиамина пирофосфата, p(C12H19CIN4O7P2S) = от 1 до 10 мкг/см3.
В мерную колбу вместимостью 100 см3 переносят пипеткой от 1 до 10 см3 раствора тиамина пирофосфата (см. 4.24.3) и объем содержимого колбы доводят до метки, например, раствором соляной кислоты (см. 4.6). Раствор можно хранить в течение месяца при температуре 4 °C в темном месте.
5 Оборудование
Используют стандартное лабораторное оборудование, стеклянную посуду, в том числе оборудование, перечисленное ниже:
5.1 УФ-спектрометр, пригодный для измерения оптической плотности при определенной длине волны (247 нм) с соответствующими кюветами с длиной оптического пути 1 см.
3
ГОСТ EN 14122—2020
5.2 Автоклав или нагревательный прибор, автоклав для экстракции проб, например электрического типа, работающий под давлением, со считывающим устройством давления или температуры, плитка электрическая или водяная баня.
5.3 Система ВЭЖХ
Система ВЭЖХ состоит из насоса, устройства для ввода проб, флуоресцентного детектора с длиной волны возбуждения и эмиссии, установленных на уровнях 366 и 435 нм соответственно (см. приложение С), а также устройства для обработки данных, например интегратора.
5.4 Колонка для ВЭЖХ
5.4.1 Общие положения
Допускается использовать колонку другого внутреннего диаметра и длины, заполненную сорбентом с размером частиц, отличным от указанных в настоящем стандарте. Условия хроматографического разделения подбирают применительно к используемой колонке для обеспечения сопоставимости результатов анализов. Критерием пригодности аналитической колонки является отделение пика тиамина от пиков других компонентов матрицы пробы2) на уровне базовой линии.
5.4.2 Колонка для ВЭЖХ при анализе с использованием предколоночного окисления
Аналитические колонки, например Lichrospher® 60 RP Select В2), размер частиц 5 мкм, диаметр от 4,0 до 4,6 мм, длина от 100 до 250 мм.
5.4.3 Колонка для ВЭЖХ при анализе с использованием послеколоночного окисления
Аналитические колонки, например Supelco® LC-18-DB2), размер частицы 5 мкм, диаметр от 4,0 до 4,6 мм, длина от 100 до 250 мм.
5.5 Фильтровальное устройство
Фильтрация подвижной фазы, а также раствора анализируемой пробы через мембранный фильтр с размером пор 0,45 мкм до использования или ввода проб продлевает срок службы колонок.
5.6 Послеколоночный реакторный насос и трубка для дериватизации, подходящая система подачи реактива, Т-образная соединительная трубка и трубка для дериватизации (например, 10 м х 0,33 мм).
6 Методика проведения испытания
6.1 Подготовка анализируемой пробы
Гомогенизируют анализируемую пробу. Твердую продукцию измельчают в соответствующей мельнице и перемешивают. Перед измельчением пробу рекомендуется охладить, чтобы не подвергать ее воздействию высоких температур в течение длительного времени.
6.2 Подготовка раствора анализируемой пробы
6.2.1 Экстракция
В конической колбе взвешивают от 2 до 10 г анализируемой пробы с точностью до 1 мг. Добавляют от 60 до 200 см3 раствора соляной (см. 4.6) или серной кислоты (см. 4.7). Значение pH раствора не должно быть выше 2,0. Накрывают колбу предметным стеклом и автоклавируют пробу для испытания при температуре 121 °C в течение 30 мин или нагревают ее при температуре 100 °C в течение 60 мин.
Исследования, проводимые Европейским бюро стандартов (BCR), показали, что можно применять обширный диапазон условий для кислотного гидролиза (температура от 95 °C до 130 °C, продолжительность от 15 до 60 мин), при этом чем выше температура, тем меньше продолжительность гидролиза.
6.2.2 Ферментативная обработка
После охлаждения до комнатной температуры к экстракту добавляют раствор ацетата натрия (см. 4.16) или (см. 4.17) до достижения значения pH, оптимального для действия, предполагаемого к использованию фермента, и добавляют подходящее количество фермента или смеси ферментов (см. 4.15). Инкубируют полученную смесь в течение промежутка времени и при температуре, оптимальных для используемого фермента или смеси ферментов. После охлаждения до комнатной температуры переносят раствор в мерную колбу, используя дистиллированную воду или другой соответствующий растворитель, и доводят раствор анализируемой пробы до заданного объема Vts.
2) Подходящие силикагелевые наполнители для колонок, имеющиеся в продаже: Lichrosorb® Si 60, Spherisorb® Si, Hypersil® Si и Lichrospher® 100 DIOL. Подходящие наполнители колонок для обращенно-фазовой хроматографии: Spherisorb® ODS, p-Bondapak radial С18, Supelco® LC-18-DB и Hypersil® ODS. Информация приведена для удобства пользователей настоящего стандарта и не является рекламой CEN указанной продукции.
4
ГОСТ EN 14122—2020
Для каждого используемого фермента необходимо установить оптимальное значение pH, оптимальные продолжительность и температуру инкубирования.
Для установления оптимальных условий дефосфорилирования проводят процедуру ферментативной обработки проб с добавленным известным количеством тиамина монофосфата хлорида (см. 4.23.2) или тиамина пирофосфата хлорида (см. 4.23.3), а также проб, аналогичных исследуемой пробе по составу матрицы и являющихся аттестованными образцами сравнения.
Количество тиамина, внесенное с ферментом или смесью ферментов (4.15), должно учитываться при расчете результата.
Примечание — Для определения прецизионности результатов испытаний, указанных в таблицах В.1, В.2 и В.З, для дефосфорилирования использовали така-диастазу и смесь р-амилазы из ячменя и така-диастазы при следующих условиях. Значение pH экстракта довели раствором ацетата натрия (см. 4.16 или 4.17) до 4,0 и 4,5 соответственно и добавили 100 мг така-диастазы и 10 мг р-амилазы на грамм пробы. Смесь инкубировали при температуре от 37 °C до 45 °C в течение от 4 до 24 ч, см. [5], [10], [16].
6.2.3 Раствор анализируемой пробы
При необходимости раствор анализируемой пробы (см. 6.2.2) фильтруют через фильтровальную бумагу или мембранный фильтр с размером пор 0,45 мкм или центрифугируют. Полученный раствор является раствором анализируемой пробы для окисления (см. 6.3.2 или 6.3.3).
6.3 Окисление тиамина с образованием тиохрома
6.3.1 Общие положения
Допускается проводить предколоночное (см. 6.3.2) или послеколоночное (см. 6.3.3) окисление.
6.3.2 Предколоночное окисление тиамина
6.3.2.1 Проведение этапа окисления тиамина
Пипеткой переносят по 1 см3 ферментативно обработанной пробы (см. 6.2.3), стандартного раствора (см. 4.25.1) или холостого раствора, т. е. раствора соляной кислоты (см. 4.6) или раствора серной кислоты (см. 4.7), в зависимости от того, какой из них использовался в соответствии с 6.2.1, в подходящие стеклянные флаконы или колбы, добавляют 1 см3 щелочного раствора гексацианоферрата (III) калия (см. 4.13). Взбалтывают раствор анализируемой пробы в течение фиксированного периода времени (10 с), дают отстояться в течение установленного периода времени (1 мин).
С целью удаления из раствора анализируемой пробы веществ, мешающих анализу, и предотвращения порчи колонки для ВЭЖХ рекомендуется нейтрализовать раствор анализируемой пробы (с помощью Н3РО4) или выполнить очистку методом твердофазной экстракции (см. [5]).
После фильтрации через мембранный фильтр с размером пор 0,45 мкм получают раствор анализируемой пробы, пригодный для ввода в систему обращенно-фазовой ВЭЖХ (см. 6.3.2.2).
В качестве альтернативы допускается после окисления раствора проводить экстракцию порцией изобутанола (см. 4.3) объемом 1,5 см3, а полученный экстракт вводить в колонку.
Примечание — Окислительное преобразование тиамина в тиохром может быть ингибировано в некоторой пищевой продукции. Данное явление часто характерно для пищевой продукции, содержащей какао, но также может наблюдаться и в другой пищевой продукции. Если есть подозрение на наличие данной проблемы, рекомендуется проверить степень извлечения, добавив в экстракт пробы соответствующий объем стандартного раствора тиамина перед проведением процедуры окисления.
6.3.2.2 Идентификация при ВЭЖХ с применением предколоночного окисления тиамина
В систему ВЭЖХ вводят одинаковые соответствующие объемы стандартных растворов, а также растворов анализируемой и холостой проб (см. 6.3.2.1). Идентифицируют тиохром путем сравнения времени удерживания индивидуальных пиков на хроматограммах раствора анализируемой пробы и стандартного раствора. Идентификация пиков также может быть выполнена путем добавления определенного количества стандартного вещества в раствор анализируемой пробы.
Ниже приведены условия хроматографического анализа, которые обеспечивают удовлетворительное качество хроматографического разделения и количественного определения (см. приложение С для альтернативных условий ВЭЖХ и рисунок А.1 для примеров хроматограмм).
Колонка: Lichrospher® RP Select В, 5 мкм, 250 х 4,0 мм.
Подвижная фаза: метанол (см. 4.1): ацетатный буфер (см. 4.22) (40 : 60).
Скорость потока: 0,7 см3/мин.
Объем введенной пробы: 20 мм3.
Детектор: флуориметрический: длина волны возбуждения 366 нм, длина волны
эмиссии 435 нм.
5
ГОСТ EN 14122—2020
6.3.3 Послеколоночное окисление тиамина
6.3.3.1 Проведение этапа окисления тиамина
Окисление тиамина с образованием тиохрома осуществляют, применяя послеколоночную реакцию со щелочным раствором гексацианоферрата (III) калия (см. 4.14) в качестве дериватизирующего агента, который непрерывно добавляют (0,3 см3/мин) через Т-образную соединительную трубку в элюент для ВЭЖХ.
Примечание — Одним из факторов, влияющих на этап послеколоночного окисления, является концентрация гидроксида натрия в реакционной смеси. Чрезмерно высокую концентрацию гидроксида натрия в дерива-тизирующем реагенте можно компенсировать уменьшением или увеличением скорости его подачи.
6.3.3.2 Идентификация при ВЭЖХ с применением послеколоночного окисления тиамина
В систему ВЭЖХ вводят одинаковые соответствующие объемы стандартных растворов тиамина хлорида гидрохлорида (см. 4.25.1), а также растворов анализируемой пробы (см. 6.2.3). Идентифицируют тиохром путем сравнения времени удерживания индивидуальных пиков на хроматограммах раствора анализируемой пробы и стандартного раствора вещества (см. 4.25.1). Идентификация пиков также может быть выполнена путем добавления тиамина хлорида гидрохлорида в раствор анализируемой пробы.
Ниже приведены условия хроматографического анализа, которые обеспечивают удовлетворительное качество хроматографического разделения и количественного определения (см. приложение С для альтернативных условий ВЭЖХ и рисунок А.2 для примеров хроматограмм).
Колонка: Supelco® LC-18-DB, 5 мкм, 250 х 4,6 мм.
Подвижная фаза: метанол (см. 4.1): фосфатный буфер (см. 4.19), содержащий 1 г/дм3
тетраэтиламмония хлорида (см. 4.20) и 5 ммоль/дм3 натрия гептан-сульфоната (см. 4.21) (35 : 65).
Скорость потока: 1,0 см3/мин.
Объем введенной пробы: 20 мм3.
Реагент для послеколоноч
ного окисления: щелочной раствор гексацианоферрата (III) калия (см. 4.14).
Скорость подачи реагента: 0,3 см3/мин.
Детектор: флуориметрический: длина волны возбуждения 368 нм, длина вол
ны эмиссии 440 нм.
Примечание — При анализе проб некоторых видов пищевой продукции, например сырой свинины, на хроматограмме может присутствовать дополнительный пик 2(1-гидроксиэтил)тиамина, см. приложение D.
6.4 Определение
Для выполнения количественного определения методом внешнего стандарта интегрируют площади пиков (желательно) или определяют высоты пиков (допустимо) пробы, сравнивают результаты с соответствующими значениями тиохрома, используя градуировочный график. Проверяют линейность градуировочной зависимости.
7 Вычисление
Результат определения вычисляют, используя градуировочный график или соответствующие программы системы обработки данных, или приведенный ниже упрощенный способ вычисления. Рассчитывают массовую долю витамина В1 в пересчете на тиамина хлорид гидрохлорид и/, мг/100 г пробы, по формуле
As • Р • Ms 100
Ast • mg 1 000 ’
(2)
где Ats — площадь или высота пика тиохрома на хроматограмме раствора анализируемой пробы, выраженные в единицах площади или высоты;
Ast — площадь или высота пика тиохрома на хроматограмме стандартного раствора, выраженные в единицах площади или высоты;
Vts — объем раствора анализируемой пробы (см. 6.2.2), см3;
6
ГОСТ EN 14122—2020
р — массовая концентрация стандартного раствора тиамина хлорида гидрохлорида (см. 4.25.1), мкг/см3;
ms — масса пробы (см. 6.2.1), г;
100 — коэффициент пересчета массовой доли на 100 г;
1 000 — коэффициент пересчета мкг/100 г в мг/100 г.
Результат определения содержания витамина В^ мг/100 г, представляют в пересчете на тиамина хлорид гидрохлорид (М = 337,28). При необходимости представления результата определения в виде содержания витамина В1 в пересчете на тиамин (C12H17N4OS, М = 265,37) полученный результат умножают на коэффициент 0,787, при пересчете на тиамина хлорид (C12H17CIN4OS, М = 300,82) — на коэффициент 0,892.
8 Прецизионность
8.1 Общие положения
Данные прецизионности для метода частично основываются на данных различных методов ВЭЖХ. применяемых для определения тиамина в ходе международного сравнительного исследования, организованного Европейской комиссией в рамках Программы стандартных измерений и испытаний на пробах цельнозерновой муки (CRM 121), сухого молока/сухого молока, полученного методом распылительной сушки (CRM 421), смеси лиофилизированных овощей (CRM 485) и лиофилизированной свиной печени (CRM 487). Статистические данные, полученные в ходе исследования, приведены в таблице В.1 (приложение В). Кроме того, данные прецизионности включают результаты совместного французского исследования проб раствора для энтерального питания, пищевой продукции для детского питания с овощами, сухого молока, цельнозерновой муки с фруктами, дрожжей, продуктов переработки зерна, шоколадного порошка и биологически активной добавки к пище. Результаты, полученные в ходе исследования, приведены в таблицах В.2 и В.З (приложение В).
8.2 Повторяемость
Абсолютная разность между двумя независимыми результатами испытаний, полученными при исследовании идентичного анализируемого материала одним и тем же оператором, использовавшим одно и то же оборудование в пределах самого короткого промежутка времени, не должна превышать предел повторяемости г более чем в 5 % случаев.
Значения для тиамина хлорида гидрохлорида:
Мука цельнозерновая Сухое молоко/сухое молоко, полученное | х = 0,452 мг/100 г | г= 0,043 мг/100 г |
методом распылительной сушки | х = 0,645 мг/100 г | г - 0,071 мг/100 г |
Смесь лиофилизированных овощей | х = 0,295 мг/100 г | г = 0,039 мг/100 г |
Лиофилизированная свиная печень | х = 0,807 мг/100 г | г - 0,088 мг/100 г |
Раствор для энтерального питания | х = 0,11 мг/100 г | г= 0,02 мг/100 г |
Детское питание с овощами | х = 0,20 мг/100 г | г = 0,05 мг/100 г |
Сухое молоко | х = 0,56 мг/100 г | г= 0,1 мг/100 г |
Цельнозерновая мука с фруктами | х = 1,04 мг/100 г | г= 0,2 мг/100 г |
Дрожжи | х = 1,31 мг/100 г | г= 0,34 мг/100 г |
Продукты переработки зерна | х = 1,42 мг/100 г | г = 0,16 мг/100 г |
Продукты переработки зерна | х = 2,95 мг/100 г | г= 0,49 мг/100 г |
Шоколадный порошок | х = 1,55 мг/100 г | г = 0,36 мг/100 г |
Биологически активная добавка к пище | х = 486 мг/100 г | г = 111 мг/100 г |
8.3 Воспроизводимость
Абсолютная разность между двумя независимыми результатами испытаний, полученными при исследовании идентичного анализируемого материала в двух лабораториях, не должна превышать предел воспроизводимости R более чем в 5 % случаев.
7
ГОСТ EN 14122—2020
Значения для тиамина хлорида гидрохлорида:
Мука цельнозерновая Сухое молоко/сухое молоко, полученное | х = 0,452 мг/100 г | ^ = 0,190 мг/100 г |
методом распылительной сушки | х = 0,645 мг/100 г | R = 0,243 мг/100 г |
Смесь лиофилизированных овощей | х = 0,295 мг/100 г | R = 0,178 мг/100 г |
Лиофилизированная свиная печень | х = 0,807 мг/100 г | R = 0,623 мг/100 г |
Раствор для энтерального питания | х = 0,11 мг/100 г | К = 0,1 мг/100 г |
Детское питание с овощами | х = 0,20 мг/100 г | К = 0,12 мг/100 г |
Сухое молоко | х = 0,56 мг/100 г | R = 0,25 мг/100 г |
Цельнозерновая мука с фруктами | х = 1,04 мг/100 г | R = 0,55 мг/100 г |
Дрожжи | х = 1,31 мг/100 г | R = 0,48 мг/100 г |
Продукты переработки зерна | х = 1,42 мг/100 г | 7? = 0,75 мг/100 г |
Продукты переработки зерна | х = 2,95 мг/100 г | R = 1,16 мг/100 г |
Шоколадный порошок | х = 1,55 мг/100 г | R = 0,8 мг/100 г |
Биологически активная добавка к пище | х = 486 мг/100 г | К = 212 мг/100 г |
9 Протокол испытания
Протокол испытания должен соответствовать требованиям EN ISO/IEC 17025 [17] и содержать следующие данные:
а) всю информацию, необходимую для идентификации пробы;
Ь) ссылку на настоящий стандарт или используемый метод;
с) дату и время отбора проб (если известно);
d) дату получения пробы;
е) дату проведения испытания;
f) результаты и единицы измерения, в которых выражены результаты;
д) любые особенности, которые наблюдались в ходе проведения испытания;
h) любые операции, не установленные в настоящем стандарте или рассматриваемые в качестве дополнительных, которые могли повлиять на результаты.
8
ГОСТ EN 14122—2020
Приложение А (справочное)
Примеры хроматограмм
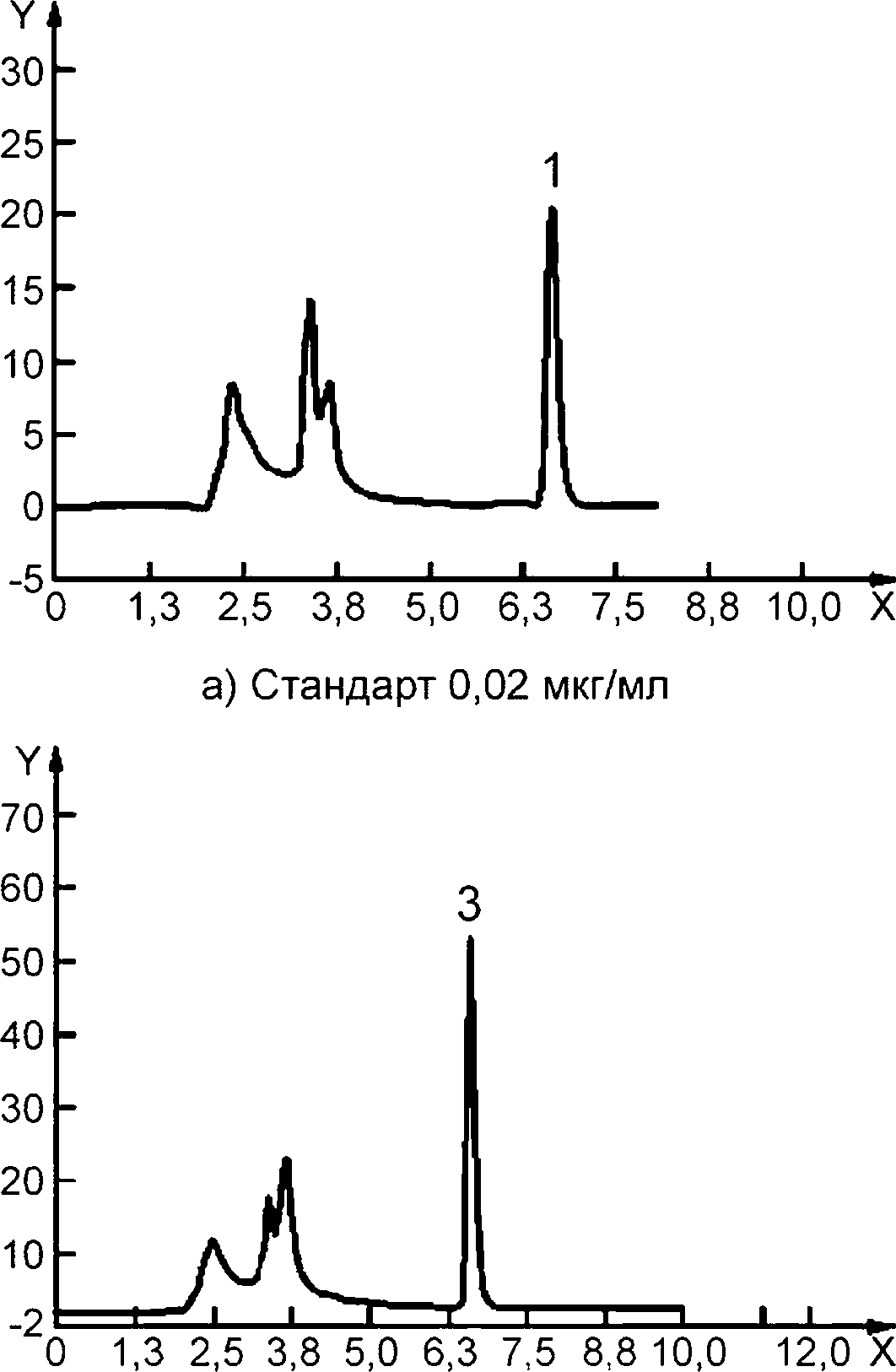
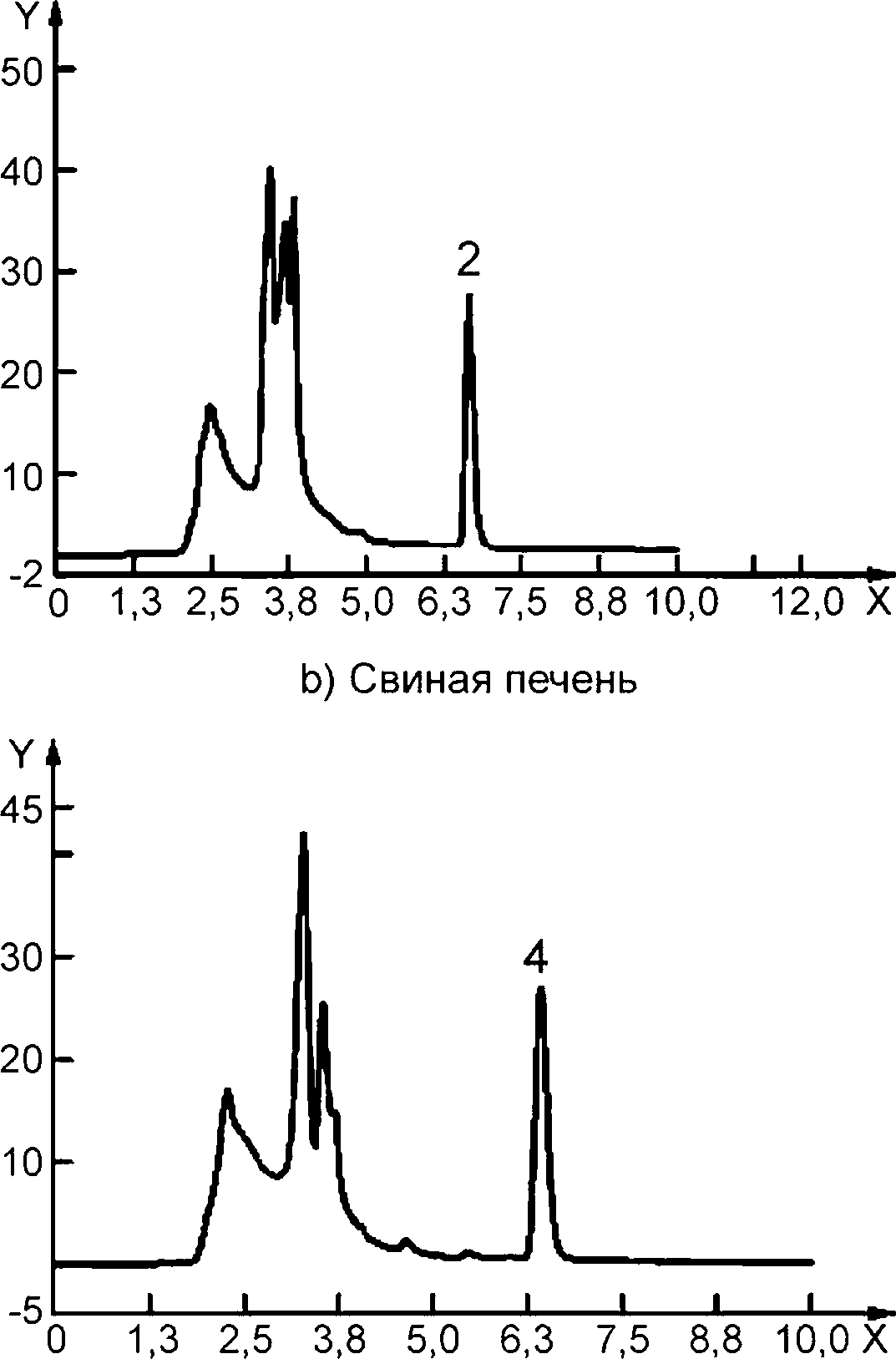
с) Смесь для детского питания
d) Треска
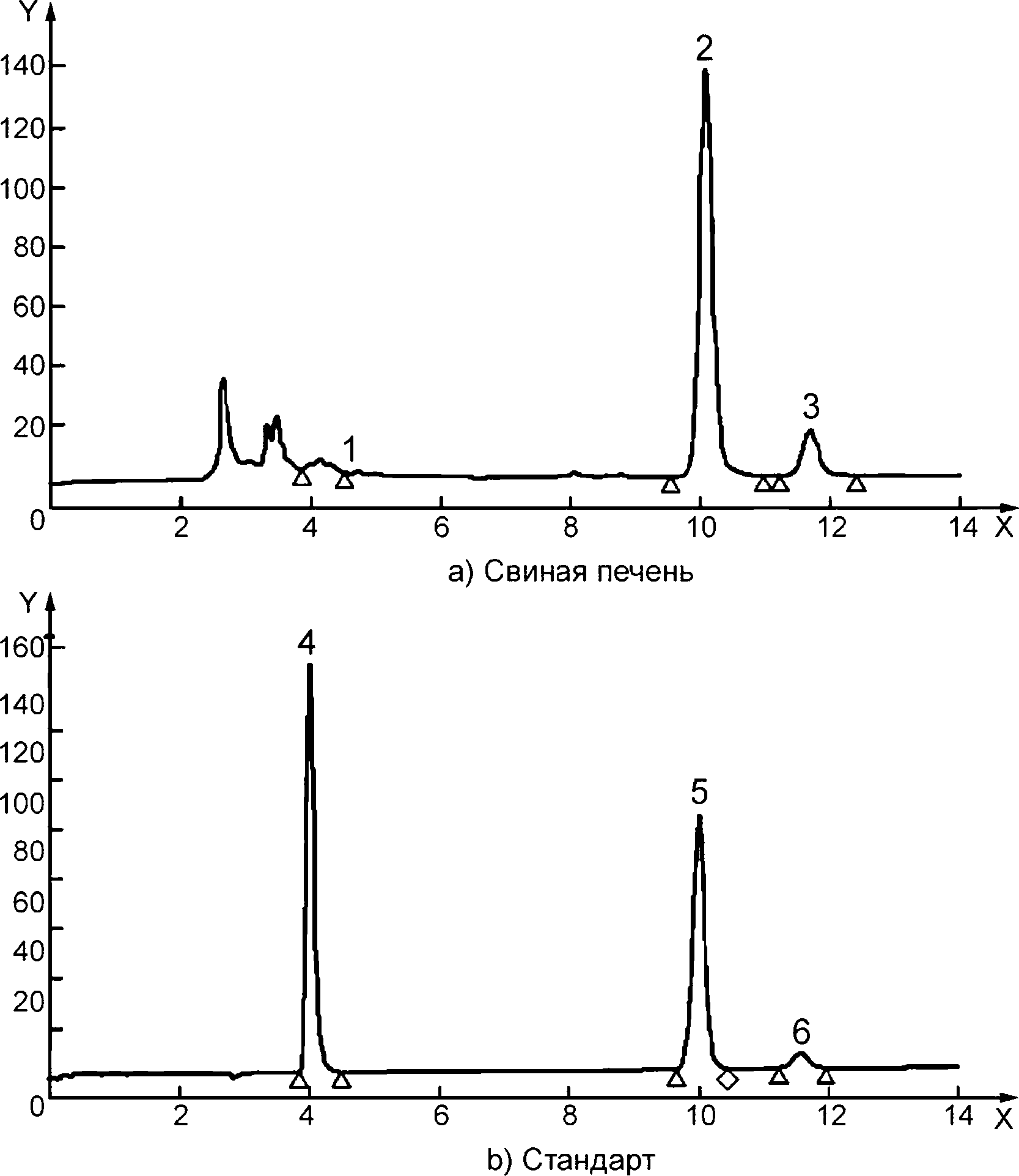
Y — флюоресценция; X — время, мин; 1 — тиамин в стандарте, 0,02 мкг/см3, время удерживания 6,620 мин; 2 — тиамин в свиной печени, время удерживания 6,616 мин; 3 — тиамин в смеси для детского питания, время удерживания 6,619 мин; 4 — тиамин в треске, время удерживания 6,614 мин
Колонка: | Gemini С18, 5 мкм, 250 х 4,6 мм (110 А). |
Подвижная фаза: | метанол (см. 4.1): вода pH 9 (40 : 60). |
Скорость потока: | 0,8 см3/мин. |
Объем введенной пробы: | 20 мм3. |
Детектор: | флуориметрический: длина волны возбуждения 366 нм, длина волны эмиссии 475 нм. |
Рисунок А.1 — Примеры хроматограмм ВЭЖХ-разделения тиамина с применением предколоночной дериватизации
9
ГОСТ EN 14122—2020
Y,
125
100

L_1__I__Illi t-.l_i.-l—1__l_l__I__1—1__I__I—I__I__I__i i r, o 2,5 5,0 7,5 10,0 X
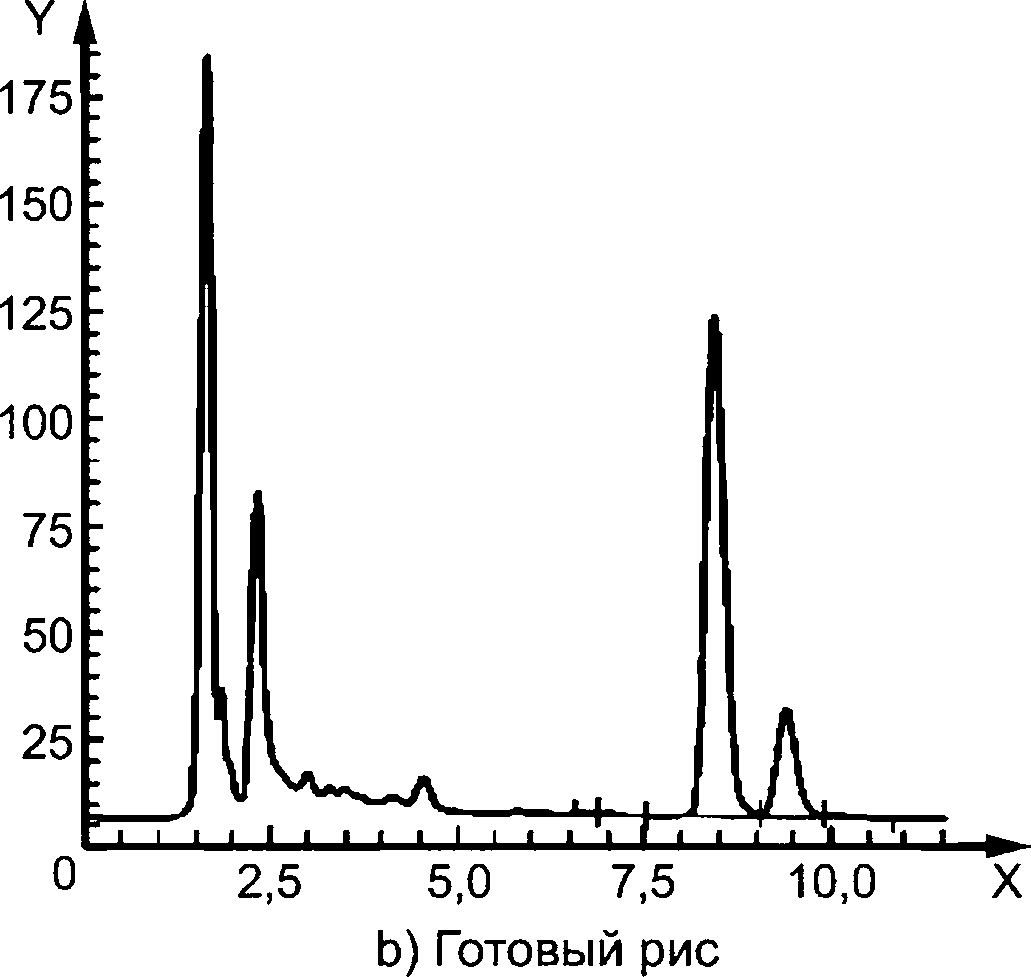
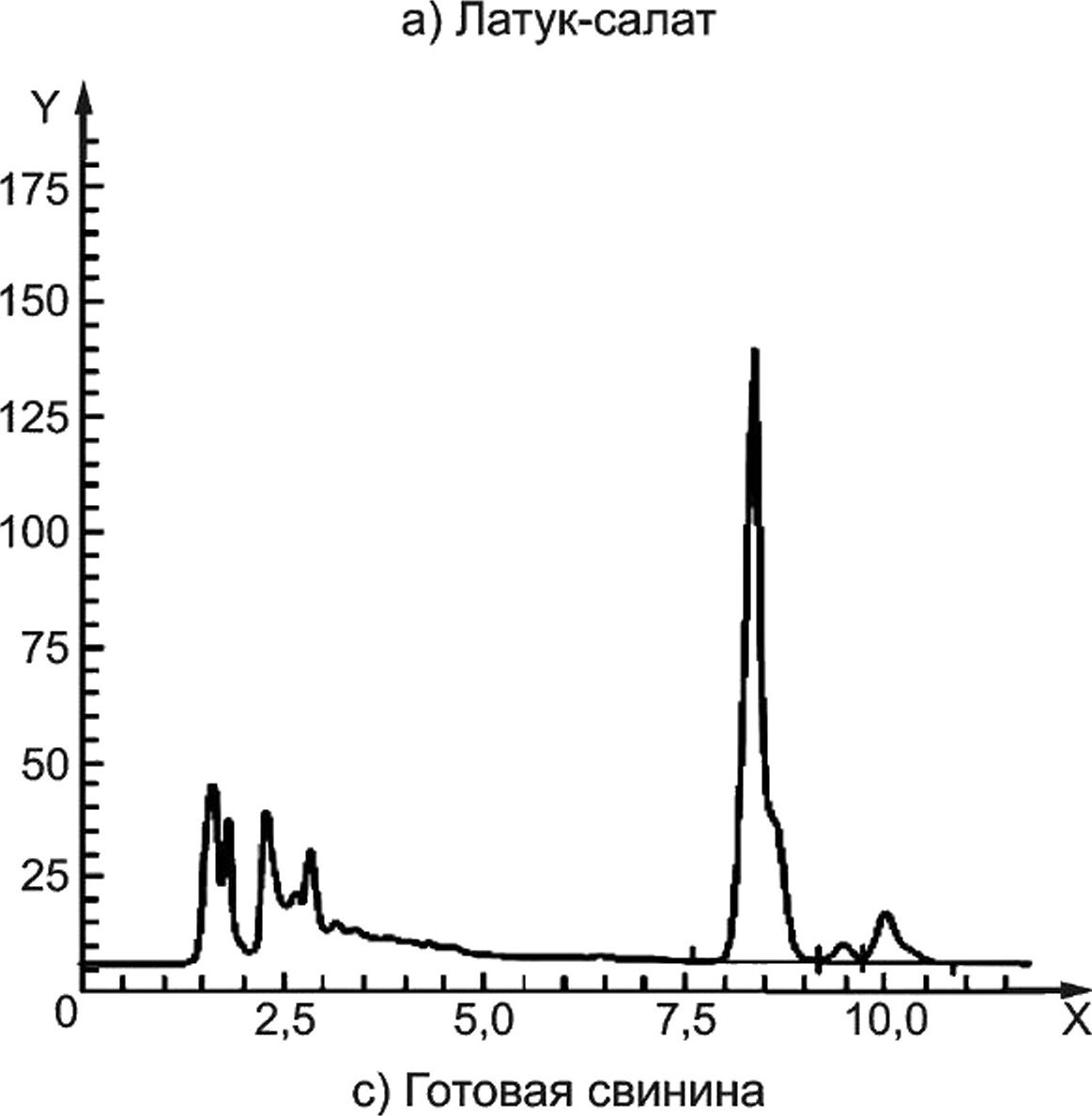
Y — флюоресценция; X — время, мин
Колонка:
Подвижная фаза:
Скорость потока:
Объем введенной пробы:
Реагент для послеколоночного окисления:
Скорость подачи реагента:
Детектор:
Purospher® RP С18, с блокированными остаточными группами, 5 мкм, 250 х 4,6 мм.
метанол (см. 4.1) : фосфатный буфер, pH 3,5, c(NH4H2PO4) =10 ммоль/дм3, содержащий 1 г/дм3 тетраэтиламмония хлорида (см. 4.20), и 5 ммоль/дм3 натрия гептансульфоната (см. 4.21) (35 : 70).
1,5 см3/мин.
3 мм3.
щелочной раствор гексацианоферрата (III) калия (см. 4.14).
0,3 см3/мин.
флуориметрический: длина волны возбуждения 365 нм, длина волны эмиссии 435 нм.
Примечание — Дополнительная хроматограмма для мяса/печени приведена в приложении D.
Рисунок А.2 — Примеры хроматограмм ВЭЖХ-разделения тиамина в латук-салате а), готовом рисе Ь) и готовой свинине с) с применением послеколоночной дериватизации
10
ГОСТ EN 14122—2020
Приложение В (справочное)
Данные прецизионности
Данные, приведенные в таблице В.1, получены в результате межлабораторных испытаний [10], проведенных в соответствии с Руководством по аттестации образцов сравнения (EU SMT Certification Study Guidelines). Исследование было организовано Институтом исследования пищевой продукции, г. Норвич, Великобритания (Institute of Food Research, Norwich, UK), по заданию Бюро эталонов Европейского сообщества (EU Community Bureau of Reference). Данные, приведенные в таблицах В.2 и В.З, были получены в ходе межлабораторного испытания во Франции [5].
Таблица В.1 —Данные прецизионности для цельнозерновой муки, сухого молока/сухого молока, полученного методом распылительной сушки, смеси лиофилизированных овощей и лиофилизированной свиной печени
Пробы | CRM 121 Цельнозерновая мука | CRM 421 Сухое молоко/ сухое молоко, полученное методом распылительной сушки | CRM485 Смесь лиофилизированных овощейа | CRM 487 Лиофилизированная свиная печень |
Год межлабораторного испытания | 1996 | 1996 | 1996 | 1996 |
Количество лабораторий | 13 | 14 | 12 | 15 |
Количество проб | 2 | 2 | 2 | 2 |
Количество лабораторий, оставшихся после исключения выбракованных | 13 | 14 | 12 | 15 |
Количество выбракованных лабораторий | 0 | 0 | 0 | 0 |
Количество полученных результатов | 65 | 70 | 58 | 72 |
Среднее значение х, мг/100 г | 0,452 | 0,645 | 0,295 | 0,807 |
Стандартное отклонение повторяемости sr, мг/100 г | 0,015 | 0,025 | 0,012 | 0,031 |
Коэффициент вариации повторяемости, % | 3,2 | 3,8 | 4,2 | 3,9 |
Значение предела повторяемости г[г= 2,83 х sr], мг/100 г | 0,043 | 0,071 | 0,039 | 0,088 |
Стандартное отклонение воспроизводимости sR, мг/100 г | 0,053 | 0,085 | 0,063 | 0,182 |
Коэффициент вариации воспроизводимости, % | 11,8 | 13,2 | 13,3 | 22,6 |
Значение предела воспроизводимости R [R = 2,83 х sR], мг/100 г | 0,190 | 0,243 | 0,178 | 0,623 |
Значение индекса Горвица в соответствии с [13] | 0.9 | 1,1 | 1,0 | 1,9 |
а Смесь из сахарной кукурузы, моркови и высушенных томатов (10:1:1). | ||||
Примечание — В результате рассматриваемого международного сравнительного исследования данные были получены с использованием установленных методов и являются идентичными собственным систематическим процедурам анализа участвующих лабораторий с системами ВЭЖХ, описанными в приложении С.
11
ГОСТ EN 14122—2020
Таблица В.2 — Данные прецизионности для раствора для энтерального питания, детского питания с овощами, сухого молока, цельнозерновой муки с фруктами и дрожжей
Пробы | Раствор для энтерального питания | Детское питание с овощами | Сухое молоко | Цельнозерновая мука с фруктами | Дрожжи |
Год исследования | 1995 | 1995 | 1995 | 1995 | 1995 |
Количество лабораторий | 10 | 10 | 10 | 10 | 10 |
Количество проб | 1 | 1 | 1 | 1 | 1 |
Количество лабораторий, оставшихся после исключения выбракованных | 8 | 10 | 10 | 10 | 10 |
Количество выбракованных лабораторий | 2 | 0 | 0 | 0 | 0 |
Количество полученных результатов | 16 | 20 | 20 | 20 | 20 |
Среднее значение х, мг/100 г | 0,11 | 0,2 | 0,56 | 1,04 | 1,31 |
Стандартное отклонение повторяемости sr | 0,01 | 0,02 | 0,04 | 0,07 | 0,12 |
Коэффициент вариации повторяемости, % | 7 | 8 | 7 | 7 | 9 |
Значение предела повторяемости г \г = 2,83 х sr], мг/100 г | 0,02 | 0,05 | 0,1 | 0,2 | 0,34 |
Стандартное отклонение воспроизводимости sR, мг/100 г | 0,04 | 0,04 | 0,08 | 0,19 | 0,17 |
Коэффициент вариации воспроизводимости, % | 32 | 21 | 16 | 19 | 13 |
Значение предела воспроизводимости R [R = 2,83 х sR], мг/100 г | 0,1 | 0,12 | 0,25 | 0,55 | 0,48 |
Значение индекса Горвица в соответствии с [13] | 2,0 | 1,5 | 1,3 | 1,7 | 1,2 |
Таблица В.З — Данные прецизионности для продуктов переработки зерна, шоколадного порошка и биологически активной добавки к пище
Пробы | Продукт переработки зерна | Продукт переработки зерна | Шоколадный порошок | Биологически активная добавка к пище |
Год исследования | 1995 | 1995 | 1995 | 1995 |
Количество лабораторий | 10 | 10 | 10 | 10 |
Количество проб | 1 | 1 | 1 | 1 |
Количество лабораторий, оставшихся после исключения выбракованных | 9 | 9 | 9 | 9 |
Количество выбракованных лабораторий | 1 | 1 | 1 | 1 |
Количество полученных результатов | 18 | 18 | 18 | 18 |
Среднее значение х, мг/100 г | 1,42 | 2,95 | 1,55 | 486 |
Стандартное отклонение повторяемости sr | 0,06 | 0,18 | 0,13 | 39 |
Коэффициент вариации повторяемости, % | 4 | 6 | 8 | 8 |
Значение предела повторяемости г \г = 2,83 х sr], мг/100 г | 0,16 | 0,49 | 0,36 | 111 |
Стандартное отклонение воспроизводимости sR, мг/100 г | 0,27 | 0,41 | 0,28 | 75 |
12
Окончание таблицы В.З
ГОСТ EN 14122—2020
Пробы | Продукт переработки зерна | Продукт переработки зерна | Шоколадный порошок | Биологически активная добавка к пище |
Коэффициент вариации воспроизводимости, % | 19 | 14 | 19 | 15 |
Значение предела воспроизводимости R[R = 2,83 х sR], мг/100 г | 0,75 | 1,16 | 0,8 | 212 |
Значение индекса Горвица в соответствии с [13] | 1,8 | 1,5 | 1,8 | 3,4а |
а В 1980 году Горвиц и др. опубликовал оценку 1 000 межлабораторных сравнений. На основании данных исследований был сделан вывод, что значение индекса Горвица = 1 с допустимыми пределами от 0,5 до 2,0 указывает на удовлетворительную межлабораторную прецизионность данных. Было выявлено, что соответствующие относительные стандартные отклонения в пределах лаборатории, как правило, составляют от половины до двух третей межлабораторных относительных стандартных отклонений. Постоянные отклонения от соотношения в нижней части диапазона (значения <0,3 или 0,5) могут указывать на наличие усреднения, о котором не было сообщено, или отличную подготовку и опыт. | ||||
13
ГОСТ EN 14122—2020
Приложение С (справочное)
Альтернативные системы высокоэффективной жидкостной хроматографии
Удовлетворительное качество хроматографического разделения и количественного определения обеспечивается при соблюдении следующих условий хроматографического анализа [10].
Таблица С.1 — Альтернативные условия ВЭЖХ
Колонка | Размеры колонки, мм х мм | Подвижная фаза (V: V) | Детектор (возбуждение/ эмиссия), нм | Поток, см3/мин | Режим окисления |
Radial silica® 10 мкм | 250 х 4,6 | Этанол : фосфатный буфер, pH = 7,4, с(К2НРО4) = 0,1 моль/дм3 (50 : 50) | Ф: 365/435 | 3,0 | ПКа |
Supelco® LC-18-DB 5 мкм | 250 х 4,6 | Метанол : фосфатный буфер, pH = 3,5, с(КН2РО4) = 9 ммоль/дм3, содержащий тетраэтиламмоний хлорид, p(C8H20NCI) = 1 г/дм3 и натрия гептансульфонат, c(C7H15NaO3S) = 5 ммоль/дм3 (35 : 65) | Ф: 368/420 | 1,0 | ПК |
Lichrospher® RP18 5 мкм | 250 х 4,6 | Метанол : натрия гептансульфонат, c(C6Hi3NaO3SH2O) = 1 ммоль/дм3, pH = 3,0 (70 : 30) | Ф: 375/435 | 1,5 | ПК |
Eurospher® 100-С18 5 мкм | 250 х 4,6 | Натрия дигидрогенфосфат, c(NaH2PO4) = 10 ммоль/дм3): натрия перхлорат, c(NaCIO4) = 0,15 моль/дм3 (50 : 50) | Ф: 375/435 | 1,0 | ПК |
Lichrospher® RP Select В 5 мкм | 250 х 4,6 | Метанол : ацетатный буфер, pH = 4,0, c(CH3COONa) = 50 ммоль/дм3 (40 : 60) | Ф: 366/435 | 0,7 | пдкь |
p-Bondapak® radial C18 5 мкм | 250 х 4,6 | Метанол : ацетатный буфер, pH = 4,5, c(CH3COONa) = 0,5 моль/дм3 (40 : 60) | Ф: 366/435 | 0,8 | ПДК |
Spherisorb® ODS2 5 мкм | 250 х 4,6 | Метанол : фосфатный буфер, pH = 4,0, с(КН2РО4) = 0,1 моль/дм3 (70 : 30) | Ф: 375/435 | 1,0 | ПДК |
Lichrospher® RP18 10 мкм | 250 х 4,6 | Калия дигидрогенфосфат с(КН2РО4) = 10 ммоль/дм3 : диметилформамид (80 :20) | Ф: 368/440 | 1,5 | ПДК |
Hamilton® PRP-1 5 мкм | 150 х 4,6 | Метанол : вода (40 : 60), pH, доведенный до 4,5 уксусной кислотой | Ф: 366/435 | 1,0 | ПДК |
Hamilton® PRP-1 5 мкм | 150 х 4,1 | Метанол : вода (35 : 65); pH = 9,0, доведенный хлористым аммонием w(NH3) = 25 % | Ф: 366/435 | 1,0 | ПДК |
Hypersil® NH2APS2 5 мкм | 250 х 4,6 | Дихлорметан : метанол (95 : 5) | Ф: 365/440 | 1,0 | ПДК |
a ПК — послеколоночная дериватизация. b ПДК — предколоночная дериватизация. | |||||
14
ГОСТ EN 14122—2020
Приложение D (справочное)
Соединение витамина В1 2-(1 -гидроксиэтил)тиамин (ГЭТ), образующееся при проведении послеколоночной дериватизации
Как правило, содержание витамина В1 рассматривалось как тиамин и его фосфатные производные. Однако использование метода послеколоночной дериватизации может показать два пика для тиамина и различимый пик дополнительного метаболита 2-(1-гидроксиэтил)тиамина (ГЭТ), в качестве подтверждения см. [11], [12] и рисунок D.1. Если используется метод предколоночной дериватизации, совместно элюируют два соединения — тиамин и ГЭТ.
Относительное содержание ГЭТ по сравнению с тиамином зависит от типа пробы. В мясе и печени содержание ГЭТ составляет от 7 % до 23 % от содержания тиамина. В дрожжах содержание составляло 3,8 %, в то время как в белой капусте, брокколи, овсяной муке, смеси для детского питания, сухом молоке и пшенице содержание было незначительным — ниже 2 %, см. [7].
При проведении количественного определения витамина В1 в пищевой продукции с помощью послеколоночной дериватизации рекомендуется включать отдельное количественное определение тиамина и ГЭТ при анализе проб мяса, а также проводить проверку на появление ГЭТ на хроматограмме при испытании других типов проб.
Y — флюоресценция; X — время, мин; 1 — тиамина монофосфат (ТМФ) в свиной печени, время удерживания 4,034 мин; 2 — тиамин в свиной печени, время удерживания 10,136 мин; 3 — 2-(1-гидроксиэтил)тиамин (ГЭТ) в свиной печени, время удерживания 11,741 мин; 4 — ТМФ в стандарте, время удерживания 4,034 мин; 5 — тиамин в стандарте, время удерживания 10,044 мин; б — ГЭТ в стандарте, время удерживания 11,613 мин
Примечание — Информация о ВЭЖХ приведена в [7].
Рисунок D.1 —Хроматограмма экстракта CRM 487 свиной печени а) и стандарта 0,1 мкг/см3 ТМФ (тиамина монофосфата), 0,1 мкг/см3 тиамина и 0,01 мкг/см3 ГЭТ (2-(1-гидроксиэтил)тиамина) Ь)
15
ГОСТ EN 14122—2020
Приложение ДА (справочное)
Сведения о соответствии ссылочного европейского стандарта межгосударственному стандарту
Таблица ДА.1
Обозначение ссылочного европейского стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
EN ISO 3696 (ISO 3696) | IDT | ГОСТ ISO 3696—2013 «Вода для лабораторного анализа. Технические требования и методы контроля»1) (ISO 3696:1987) |
Примечание — В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - IDT — идентичный стандарт. | ||
1) В Российской Федерации действует ГОСТ Р 52501—2005 (ИСО 3696:1987) «Вода для лабораторного анализа. Технические условия».
16
ГОСТ EN 14122—2020
Библиография
[1] BOGNAR A. Bestimmung von Riboflavin und Thiamin in Lebensmitteln mit Hilfe der Hochleistungs-flussigkeitschro-matographie (HPLC). Dtsch. Lebensmitt. Rundsch. 1981,77 pp. 431—436 (Определение рибофлавина и тиамина в пищевой продукции с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ))
[2] HASSELMANN С., FRANCK D., GRIMM Р., DIOP Р.А., SOULES С. High-performance liquid chromatographic analysis of thiamin and riboflavin in dietic foods. J. Micronutr. Anal. 1989, 5 pp. 269—279 (Высокоэффективный хроматографический анализ тиамина и рибофлавина в диетической пищевой продукции)
[3] BOGNAR A. Determination of vitamin В1 in food by High-Performance-Liquid-Chromatography and post-column derivatization. Fresenius J. Anal. Chern. 1992, 343 pp. 155—156 (Определение витамина В1 методом высокоэффективной жидкостной хроматографии и послеколоночным окислением)
[4] HAGG М., KUMPULAINEN J. Thiamin and riboflavin contents in domestic and imported cereal products in Finland. J. Food Compos. Anal. 1993, 6 pp. 299—306 (Содержание тиамина и рибофлавина в отечественных и импортируемых в Финляндию крупяных продуктах)
[5] ARELLA F., LAHELY S., BOURGUIGNON J.B., HASSELMANN С. Liquid chromatographic determination of vitamin B1 and B2 in foods. A collaborative study. Food Chern. 1996, 56 pp. 81—86 (Определение витаминов В1 и В2 методом высокоэффективной жидкостной хроматографии в пищевой продукции)
[6] EITENMILLER R.R., LANDEN W.O. Vitamin Analysis for the Health and Food Sciences. CRC Press, Boca Raton, London, New York, Washington, D.C., 1999, pp. 271—297 (Анализ витаминов для валеологии и науки о продуктах питания)
[7] JAKOBSEN J. Optimisation of the determination of thiamin, 2-(1-hydroxyethyl)thiamine, and riboflavin in food samples by use of HPLC. Food Chern. 2008, 106 pp. 1209—1217 (Оптимизация определения тиамина, 2-(1-гидроксиэтил )тиамина и рибофлавина в пробах пищевой продукции с помощью ВЭЖХ)
[8] DAWSON R.M.C., ELLIOTT D.C., ELLIOT W.H., JONES К. Data for Biochemical Research. Oxford Science Publication 3rd. ISBN 0 19 855299 8, 1989 (Данные биохимического исследования)
[9] HAGG M. Effect of various commercially available enzymes in the liquid chromatographic determination with external standardization of thiamin and riboflavin in foods. J. AOAC Int. 1994, 77 pp. 681—686 (Влияние различных имеющихся в продаже ферментов в жидкостном хроматографическом определении с применением внешних стандартов тиамина и рибофлавина в пищевой продукции)
[10] FINGLAS Р.М., SCOTT K.J., WITTHOFT С.М., VAN DEN BERG H., DE FROIDMONT-GORTZ I.The certification of the mass fractions of vitamins in four reference materials: Wholemeal flour (CRM 121), milk powder (CRM 421), lyophilised mixed vegetables (CRM 485) and lyophilised pig’s liver (CRM 487). EUR-report 18320, Office for Official Publications of the European Communities, Luxembourg, 1999 (Сертификация массовых долей витаминов в четырех эталонных материалах: цельнозерновой муке (CRM 121), сухом молоке (CRM 421), смеси лиофилизированных овощей (CRM 485) и лиофилизированной свиной печени (CRM 487))
[11] TAKASHI U., YUKIKO Т„ KOHEI М„ MARI Т, KANAME К. Simultaneous determination of 2 (l-hydro-xyethyl)thiamin and thiamin in foods by high performance liquid chromatography with post-column deri-vatisation. Vitamins (Japan). 1990, 64 pp. 379—385 (Одновременное определение 2(1-гидроксиэтил)тиамина и тиамина в пищевой продукции методом высокоэффективной жидкостной хроматографии с послеколоночной дериватизацией)
[12] TAKASHI U„ YUKIKO Т„ KOHEI М„ MARI Т„ KANAME К. Distribution and stability of 2(1-hydro-xyethyl) thiamin and thiamin in foods. Vitamins (Japan). 1991,65 pp. 249—256 (Распределение и стабильность 2(1-гидроксиэтил) тиамина и тиамина в пищевой продукции)
[13] HORWITZ W., ALBERT R. The Horwitz Ratio (HorRat): A useful Index of Method Performance with Respect to Precision. J. AOAC Int. 2006, 89 pp. 1095—1109 (Индекс Горвица: приемлемый индекс эффективности метода с точки зрения прецизионности)
[14] THOMPSON М. Recent trends in inter-laboratory precision at and sub-ppb concentra
tions in relation to fitness for purpose criteria in proficiency testing. Analyst (Lond.). 2000, 125 pp. 385—386 (Последние тенденции в межлабораторной точности в концентрациях частей на млрд (ppb) и субчастей на млрд (sub-ppb) в отношении пригодности критериев назначения в квалификационных испытаниях)
[15] HORWITZ W., KAMPS L.R., BOYER K.W. Quality assurance in the analysis of foods and trace constituents. J. AOAC Int. 1980, 63 pp. 1344—1354 (Обеспечение качества при анализе пищевой продукции и примесных компонентов)
[16] OLLILAINEN V., FINGLAS Р.М., VAN DEN BERG H., DE FROIDMONT-GORTZ I. Certification of В-Group Vitamins (B1, B2, B6 and B12) in Four Food Reference Materials. J. Agric. Food Chern. 2001,49 pp. 315—321 (Сертификация витаминов группы В (В^ В2, В6 и В12) в четырех эталонных материалах пищевой продукции)
[17] EN ISO/IEC 17025:2005 Allgemeine Anforderungen an die Kompetenz von Pruf- und Kalibrier-laboratorien (ISO/IEC 17025:2005) (Общие требования к компетентности испытательных и калибровочных лабораторий)
17
ГОСТ EN 14122—2020
УДК 664:543.544:006.354
МКС 67.050
IDT
Ключевые слова: продукция пищевая, определение, витамин Bv тиамин, высокоэффективная жидкостная хроматография
18
Технический редактор И.Е. Черепкова
Корректор М.В. Бучная Компьютерная верстка И.А. Налейкиной
Сдано в набор 25.04.2024. Подписано в печать 06.05.2024. Формат 60x84%. Гарнитура Ариал. Усл. печ. л. 2,79. Уч.-изд. л. 2,37.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.

