ГОСТ 34555-2019
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Определение токсичности при повторном/многократном воздействии с одновременным определением оценки репродуктивной/эмбриональной токсичности скрининговым методом
Methods of testing the chemicals of human hazard. Determination of repeated/multiple dose toxicity with simultaneous assessment of reproduction/developmental toxicity by screening method
МКС 75.080
11.020
11.120.01
Дата введения 2020-06-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июля 2019 г. N 120-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС N 8-2020).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 8 августа 2019 г. N 473-ст межгосударственный стандарт ГОСТ 34555-2019 введен в действие в качестве национального стандарта Российской Федерации с 1 июня 2020 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD, Test N 422:2016* "Руководство по испытанию химических веществ. Комбинированное исследование токсичности при многократных воздействиях с помощью оценки репродуктивной/эмбриональной токсичности скрининговым методом" ("Guideline for testing of chemicals. Combined repeated dose toxicity study with the reproduction/developmental toxicity screening test", MOD), путем:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- включения в текст стандарта дополнительного раздела, фраз, сокращений, выделенных курсивом*;
________________
* В оригинале обозначения и номера стандартов и нормативных документов приводятся обычным шрифтом. - .
- изменения структуры документа для приведения в соответствие с правилами, установленными ГОСТ 1.5 (подразделы 4.2 и 4.3).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА.
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
ВНЕСЕНА поправка, опубликованная в ИУС N 8, 2020 год
Поправка внесена изготовителем базы данных
Введение
Руководящие документы OECD по испытаниям химических веществ периодически пересматриваются в соответствии с научно-техническим прогрессом. Первоначально метод испытаний по настоящему руководству был принят в 1996 г. на основе регламентированной процедуры "Объединенное исследование повторяющегося введения дозы и репродуктивный/эмбриональной токсичности с использованием скринингового метода" и обсуждался на двух совещаниях экспертов в Лондоне в 1990 г. [1] и в Токио в 1992 г. [2].
Настоящий метод объединяет часть скринингового метода определения репродуктивной/эмбриональной токсичности на основе опыта, полученного в странах - членах OECD при использовании исходного метода для существующих химических веществ с большим объемом производства, и экспериментальных исследованиях с веществами положительного контроля [3], [4] и часть руководства по определению токсичности при многократных введениях доз в соответствии с Руководством OECD Test N 407:2008.
Настоящее руководство было дополнено конечными точками, соответствующими нарушениям, связанным с эндокринной системой, для продолжения высокоприоритетной деятельности, начатой в OECD в 1998 г. по пересмотру существующих руководств по испытаниям и разработке новых руководств по испытаниям для скрининга и исследования веществ, потенциально нарушающих работу эндокринной системы [5]. В этом контексте в 2008 г. руководство OECD Test N 407:2008 было актуализировано введением дополнительных параметров, подходящих для обнаружения эндокринной активности исследуемых химических веществ. Цель актуализации настоящего руководства заключалась во включении в скрининг важных конечных точек, связанных с нарушениями эндокринной системы, когда периоды воздействия охватывают критические периоды развития (пренатальный и постнатальный периоды).
_______________
Действует ГОСТ 32641-2014 "Методы испытания по воздействию химической продукции на организм человека. Определение токсичности при повторном/многократном пероральном поступлении вещества на грызунах. 28-дневный тест".
В настоящее руководство на основании технико-экономического обоснования научных и технических вопросов с учетом возможности адаптации плана испытаний [7] были включены выбранные дополнительные конечные точки, касающиеся нарушений эндокринной системы и являющиеся частью OECD Test N 443 "Расширенное изучение репродуктивной токсичности на одном поколении".
Настоящий метод исследования предназначен для получения информации о воздействии исследуемого химического вещества на мужскую и женскую репродуктивную функцию, включая функцию половых желез, спаривание, зачатие, эмбриональное развитие и роды. Настоящий метод не является альтернативой и не заменяет существующие методы испытаний OECD Test N 414![]() , OECD Test N 415
, OECD Test N 415![]() , OECD Test N 416
, OECD Test N 416![]() или OECD Test N 443.
или OECD Test N 443.
_______________
![]() Действуют ГОСТ 32380-2013 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке токсического воздействия на пренатальное развитие", ГОСТ 32378-2013 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной токсичности одного поколения", ГОСТ 34554-2019 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной токсичности двух поколений" соответственно.
Действуют ГОСТ 32380-2013 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке токсического воздействия на пренатальное развитие", ГОСТ 32378-2013 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной токсичности одного поколения", ГОСТ 34554-2019 "Методы испытания по воздействию химической продукции на организм человека. Испытания по оценке репродуктивной токсичности двух поколений" соответственно.
1 Область применения
Настоящий стандарт устанавливает требования к проведению исследования токсичности химических веществ при многократном воздействии с одновременным определением репродуктивной/эмбриональной токсичности скрининговым методом, что позволяет получить информацию о возможной опасности веществ для здоровья, которая может появиться при повторных воздействиях за относительно короткий промежуток времени. Определение токсикологических характеристик вещества при повторном воздействии возможно только после получения информации, полученной при исследовании острой токсичности.
Метод по настоящему стандарту применяют для веществ, для которых затруднительно использовать 90-дневное исследование (малотоннажное производство), или как предварительное исследование перед долгосрочным.
Метод включает скрининговое исследование для определения репродуктивной/эмбриональной токсичности и может быть использован для получения предварительной информации о влиянии вещества на мужскую и женскую репродуктивную функцию.
Метод предназначен для специалистов организаций здравоохранения, осуществляющих государственный санитарный надзор, иных учреждений, проводящих реализацию мероприятий по медицинской профилактике неблагоприятного воздействия химической продукции на здоровье человека.
2 Термины, определения и сокращения
2.1 В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1.1 андрогенная активность (androgenicity): Способность химического вещества действовать в организме млекопитающих как естественный андрогенный гормон (например, тестостерон).
2.1.2 антиандрогенная активность (antiandrogenicity): Способность химического вещества подавлять действие природного андрогенного гормона (например, тестостерона) в организме млекопитающих.
2.1.3 антиэстрогенная активность (antioestrogenicity): Способность химического вещества подавлять действие природного эстрогенного гормона (например, эстрадиола 17![]() ) в организме млекопитающих.
) в организме млекопитающих.
2.1.4 антитироидная активность (antithyroid activity): Способность химического вещества подавлять действие природного гормона щитовидной железы (например, ![]() ) в организме млекопитающих.
) в организме млекопитающих.
2.1.5 эмбриотоксичность (developmental toxicity): Проявления репродуктивной токсичности, отражающие пренатальные, перинатальные, постнатальные, структурные или функциональные нарушения у потомства.
2.1.6 доза (dose): Количество вводимого исследуемого вещества.
Примечание - Доза выражается в виде массы исследуемого химического вещества на единицу массы тела подопытного животного в сутки (например, мг/кг массы тела) или в виде постоянной концентрации в пище.
2.1.7 дозировка (dosage): Обобщающий термин, включающий дозу, частоту и продолжительность введения.
2.1.8 очевидная токсичность (evident toxicity): Обобщающий термин, характеризующий наличие явных признаков токсичности после введения исследуемого химического вещества.
Примечание - Признаки токсичности должны быть достаточными для оценки опасности и такими, чтобы увеличение вводимой дозы могло привести к развитию тяжелых токсических признаков и вероятной смертности.
2.1.9 ослабление фертильности (impairment of fertility): Расстройство мужских и женских репродуктивных функций или способностей.
2.1.10 материнская токсичность (maternal toxicity): Неблагоприятное воздействие на беременных самок, происходящее как непосредственно (прямое воздействие), так и опосредованно (косвенное воздействие).
2.1.11 NOAEL (no observable adverse effects level): Аббревиатура для уровня отсутствия наблюдаемого вредного воздействия; означает максимальный уровень дозы, не вызывающей обнаруживаемого вредного воздействия на здоровье.
2.1.12 эстрогенная активность (oestrogenicity): Способность химического вещества действовать как природный эстрогенный гормон (например, эстрадиол 17![]() ) в организме млекопитающего.
) в организме млекопитающего.
2.1.13 репродуктивная токсичность (reproduction toxicity): Неблагоприятное воздействие на потомство и/или ослабление мужских и женских репродуктивных функций или способностей.
2.1.14 тироидная активность (thyroid activity): Способность химического вещества действовать в организме млекопитающих как естественный гормон щитовидной железы (например, Т3).
2.1.15 валидация (validation): Научный метод, предназначенный для характеристики требований к процедуре испытаний, ограничений метода испытаний и демонстрации его надежности и соответствия конкретной цели.
2.2 В настоящем стандарте применены следующие сокращения:
AGD - аногенитальное расстояние;
LD - день лактации;
PND - послеродовой день;
SIDS - набор данных скрининговой информации;
Т4 - гормон тироксин;
TSH - гормон тиреотропин.
3 Основные положения
3.1 Определение пероральной токсичности при анализе и оценке токсических характеристик исследуемого химического вещества с использованием многократного введения доз может быть выполнено после получения предварительной информации о токсичности путем испытаний на острую токсичность. Результаты исследований должны содержать информацию о возможной опасности для здоровья, возникающей при многократном воздействии вещества за относительно ограниченный промежуток времени.
Метод включает базовое исследование токсичности при повторяющихся введениях доз, которое может быть использовано для химических веществ, 90-дневное исследование которых не является обоснованным (например, когда объем производства не превышает определенных пределов), или в качестве предварительного изучения перед длительным исследованием. При проведении исследований для определения, оценки и использования клинических признаков в качестве гуманных конечных точек для подопытных животных следует руководствоваться документом [7].
3.2 Настоящий стандарт предусматривает скрининговый метод оценки репродуктивной/эмбриональной токсичности и может быть использован для получения предварительной информации о возможных воздействиях химического вещества на мужскую и женскую репродуктивную функцию, включая функцию половых желез, поведение при спаривании, зачатие, развитие эмбриона и роды, или для оценки токсикологических свойств исследуемых химических веществ на ранней стадии, и исследуемых химических веществах, которые могут представлять опасность. Настоящий метод не дает полной информации по всем аспектам онтогенеза репродуктивной системы, а предлагает только ограниченные средства для выявления постнатальных проявлений пренатального воздействия или эффектов, которые могут быть вызваны при постнатальном воздействии. Избирательность конечных точек (среди прочих причин) и непродолжительность исследования по настоящему методу не обеспечивают доказательств для утверждения об отсутствии воздействия на репродукцию/развитие. При отсутствии данных других испытаний на репродуктивную/эмбриональную токсичность положительные результаты полезны для первоначальной оценки опасности и способствуют принятию решений о необходимости и сроках проведения дополнительных исследований.
3.3 Результаты, полученные с помощью характеристик, связанных с эндокринной системой, следует рассматривать в контексте "концептуальной основы OECD для исследования и оценки химических веществ, разрушающих эндокринную систему" (уровень 4 анализа in vivo [8]). Однако наличие признаков эндокринного раздражения не может считаться достаточным доказательством того, что испытуемое химическое вещество является эндокринным разрушителем.
3.4 В настоящем стандарте особое внимание уделяется неврологическим эффектам как конкретной конечной точке и подчеркивается необходимость тщательных клинических наблюдений за животными для получения максимально возможной информации. Метод должен определить химические вещества с нейротоксическим потенциалом, для которых может потребоваться дальнейшее углубленное изучение этого аспекта, и указать основные критерии иммунологического воздействия.
3.5 При отсутствии данных других исследований системной токсичности, репродуктивной/эмбриональной токсичности, нейротоксичности и/или иммунотоксичности положительные результаты полезны для первоначальной оценки опасности и способствуют принятию решений о необходимости и сроках проведения дополнительных испытаний. Настоящее исследование может быть полезным в рамках SIDS для оценки исследуемых химических веществ, для которых мало токсикологической информации (или она отсутствует), и может служить альтернативой проведению двух отдельных испытаний на токсичность при повторных/многократных дозах (руководство [9]) и репродуктивной/эмбриональной токсичности (руководство [10]), соответственно. Исследование также может быть использовано при определении диапазона доз для более обширных исследований репродуктивной/эмбриональной токсичности или в других необходимых случаях.
3.6 Обычно предполагают, что существуют различия в чувствительности между беременными и небеременными животными. Соответственно сложнее определить адекватные уровни доз в совмещенном испытании для оценки как общей системной токсичности, так и специфической репродуктивной/эмбриональной токсичности, чем при проведении отдельных испытаний. Кроме того, интерпретация результатов испытаний общей системной токсичности может быть сложнее, чем результатов отдельного исследования с повторяющимися дозами, особенно когда сыворотку и гистопатологические параметры оценивают в разных исследованиях. Из-за указанных технических сложностей при выполнении совместного скринингового исследования требуется значительный опыт тестирования на токсичность. С другой стороны, кроме меньшего числа вовлеченных животных, совместное испытание позволяет лучше дифференцировать прямые воздействия на репродуктивное/эмбриональное развитие и вторичные, обусловленные другими (системными) эффектами.
3.7 В настоящем стандарте используют более продолжительный период введения доз, чем при обычном 28-дневном исследовании. При этом используют меньшее число животных каждого пола в каждой группе по сравнению с обычным 28-дневным исследованием с повторяющимся введением доз в дополнение к определению репродуктивной/эмбриональной токсичности скрининговым методом.
3.8 Настоящий стандарт предусматривает пероральное введение исследуемого химического вещества. При использовании других путей воздействия может потребоваться модификация метода.
3.9 При испытании смеси веществ для получения данных по намеченной регламентированной цели следует учитывать, могут ли быть обеспечены адекватные результаты и, если да, то почему. Такие аспекты не нужны, если существует нормативное требование для испытания смеси.
4 Принцип исследования
4.1 Исследуемое химическое вещество вводят градуированными дозами нескольким группам животных мужского и женского полов. Самцам вводят дозу не менее четырех недель (не менее двух недель до и после спаривания, и во время спаривания), включая день перед запланированным умерщвлением. Для доказательства тестикулярной токсичности проводят гистологические исследования яичек, так как из-за ограниченного периода введения доз мужским особям перед спариванием фертильность не является особенно чувствительным показателем. Считается, что сочетание периода введения доз перед спариванием в две недели и последующего наблюдения за спариванием/фертильностью с введением доз не менее четырех недель и последующей подробной гистологией семенников обеспечивает определение большинства воздействий на мужскую фертильность и сперматогенез.
4.2 Женские особи получают дозы на протяжении всего исследования: две недели перед спариванием (не менее двух полных циклов течки), время зачатия, срок беременности и не менее 13 дней после родов, до дня планируемого умерщвления.
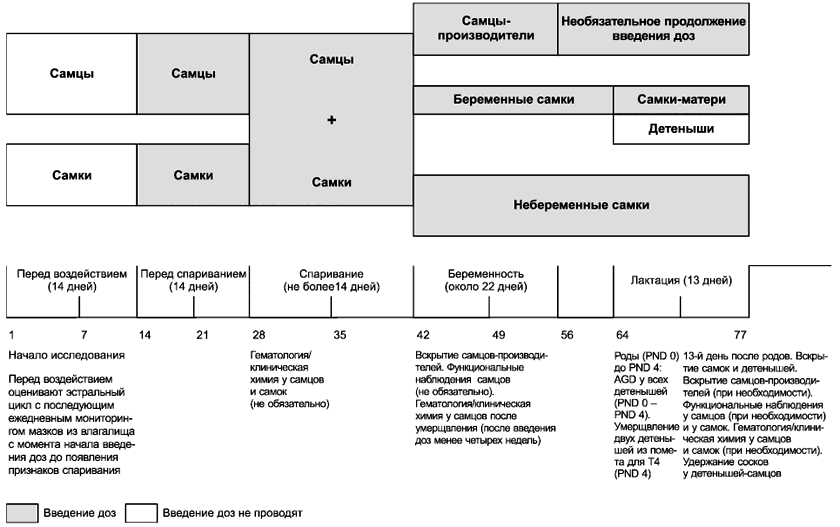
4.3 Продолжительность исследования после адаптации и оценки астрологического цикла перед введением дозы зависит от поведения женских особей и составляет приблизительно 63 дня (не менее 14 дней до спаривания, до 14 дней спаривания, 22 дня беременности, 13 дней кормление, см. приложение А).
4.4 Во время введения вещества животных каждый день обследуют на наличие признаков токсичности. Животных, погибших или умерщвленных во время испытания, подвергают аутопсии, а животных, выживших до окончания исследования, умерщвляют и проводят аутопсию.
5 Сущность метода
5.1 Выбор вида животных
В настоящем стандарте рекомендуется использовать крыс, при использовании других видов грызунов следует привести подробное обоснование. В международной утвержденной программе для выявления эндокринных нарушений по руководству [9] единственным использованным видом животных была крыса. Не используют штаммы животных с низкой плодовитостью или общеизвестной высокой частотой дефектов развития. Для испытаний используют здоровых животных, не подвергавшихся спариванию и экспериментальным исследованиям. Подопытных животных характеризуют по виду, линии, полу, массе и возрасту. На начало исследования различие массы животных не должно превышать ±20% от средней массы животных каждого пола. Если проводят предварительное исследование перед долгосрочным исследованием или исследование поколения, предпочтительно в обоих исследованиях использовать животных одной линии из одного источника.
5.2 Условия содержания и кормления
5.2.1 Все процедуры должны соответствовать нормативным документам по уходу за лабораторными животными. Температура в помещении с подопытными животными должна быть (22±3)°С. Относительная влажность - не менее 30% и не более 70% (кроме периода уборки помещения). Освещение должно быть искусственным с последовательностью: 12 ч - свет, 12 ч - темнота. Для кормления можно использовать обычные лабораторные рационы с неограниченным количеством питьевой воды. На выбор пищи может повлиять необходимость обеспечения подходящего смешивания с исследуемым химическим веществом при его введении таким способом.
5.2.2 Животных размещают в клетках индивидуально или небольшими группами одного пола. При групповом содержании в каждую клетку помещают не более пяти животных. Спаривание проводят в клетках, подходящих для этой цели. Беременных самок содержат индивидуально и обеспечивают материалами для обустройства гнезда. Кормящих самок содержат в клетках индивидуально со своим потомством.
5.2.3 Корм регулярно анализируют на наличие загрязнений. Образец корма сохраняют до завершения отчета.
5.3 Подготовка животных
Здоровых молодых половозрелых животных распределяют методом случайной выборки на подопытные группы и по клеткам. Клетки размещают таким образом, чтобы свести к минимуму возможное влияние от размещения клеток. Каждому животному присваивают индивидуальный идентификационный номер и содержат в клетках не менее пяти дней до начала исследования для обеспечения акклиматизации к лабораторным условиям.
5.4 Подготовка доз
5.4.1 Рекомендуется вводить исследуемое химическое вещество перорально, если другие пути введения не считают более подходящими. При выборе перорального способа введения исследуемое химическое вещество вводят через зонд. Альтернативно возможно введение исследуемого химического вещества с пищей или питьевой водой.
5.4.2 При необходимости исследуемое вещество растворяют или суспендируют в подходящем растворителе (носителе). Рекомендуется сначала рассмотреть возможность использования водного раствора/суспензии, потом раствора/суспензии в масле (например, кукурузном), а затем - возможность растворения в других растворителях (носителях). Для неводных носителей должны быть известны токсические характеристики. Следует определить стабильность и однородность исследуемого химического вещества в растворителе.
6 Проведение исследований
6.1 Число и пол животных
Рекомендуется, чтобы каждая группа на начало исследования содержала не менее 10 самцов и 12-13 самок. У самок предварительно определяют овариальный цикл. Животных, у которых отсутствуют типичные 4-5-дневные циклы, не включают в исследование; поэтому рекомендуется иметь дополнительное количество самок, для обеспечения 10 самок в группе. В случае исключения самок из-за выраженного токсического воздействия это позволит обеспечить не менее восьми беременных самок в группе, что обычно является минимально допустимым числом беременных самок в группе. Основной целью является получение достаточного количества беременностей и потомства для обеспечения значимости результатов оценки потенциальной возможности воздействия исследуемого химического вещества на фертильность, беременность, материнское поведение и поведение потомства, а также на рост и развитие потомства F1 от зачатия до 13-го дня после родов. При запланированном промежуточном умерщвлении увеличивают число животных за счет дополнительных групп-спутников из 10 животных (пять самцов и пять самок) для контрольной группы и группы с максимальной дозой для исследования эффектов обратимости, персистенции или отсроченного проявления системных токсических эффектов не менее 14 дней после завершения введения доз. Животных этих групп не спаривают и, следовательно, не используют для оценки репродуктивной/эмбриональной токсичности.
6.2 Выбор дозы
6.2.1 Обычно в исследовании используют не менее трех подопытных групп и контрольную группу. При отсутствии доступных данных о токсичности исследуемого вещества может быть проведено исследование по выбору диапазона доз (животные одной линии из одного источника), который будут использовать в испытаниях. За исключением введения исследуемого химического вещества, за животными контрольной группы ухаживают идентично подопытным группам. Если для введения исследуемого химического вещества используют носитель (растворитель), животные контрольной группы должны получать его в максимально используемом объеме.
6.2.2 Уровни доз выбирают с учетом любых имеющихся данных по токсикологии и токсикокинетике. Следует также учитывать, что могут быть различия в чувствительности между беременными и небеременными животными. Максимальный уровень дозы выбирают таким образом, чтобы вызвать токсические воздействия, а не смерть или очевидные страдания. После этого выбирают нисходящую последовательность уровней дозы, чтобы продемонстрировать любой ответ, связанный с введением доз, и отсутствие наблюдаемого вредного воздействия при самом низком уровне дозы. Как правило, оптимальным является 2-4-кратный диапазон снижения уровня дозы, и добавление четвертой подопытной группы предпочтительнее, чем использование очень больших интервалов (например, более чем в 10 раз) между дозами.
6.2.3 В условиях наблюдаемой общей токсичности (снижение массы тела, воздействие на печень, сердце, легкие или почки и т.д.) или других изменений, которые могут не являться токсическими реакциями (снижение потребления пищи, увеличение печени), следует осторожно интерпретировать наблюдаемые влияния на чувствительные эндокринные конечные точки.
6.3 Определение предельной дозы
Если при пероральном введении дозы не менее 1000 мг/кг массы тела в сутки или эквивалентном процентном содержании в пище или питьевой воде (на основе определения массы тела), с использованием процедур настоящего стандарта, не наблюдают токсических эффектов, и если на основании данных о структурно родственных веществах токсичность не ожидается, то можно не проводить полное исследование с использованием нескольких уровней доз. Допускается проводить исследования с более высоким уровнем предельной дозы в случае предполагаемого воздействия на человека таких уровней дозы. При других способах введения, таких как ингаляционный или нанесение на кожу, физико-химические свойства исследуемых веществ часто могут потребовать максимально достижимой концентрации.
6.4 Введение доз
6.4.1 Животным вводят исследуемое вещество ежедневно в течение семи дней в неделю. При принудительном введении разовой дозы исследуемого химического вещества животным применяют желудочный зонд или интубационную канюлю. Максимальный объем однократно вводимой жидкости зависит от размера подопытного животного и не должен превышать 1 мл/100 г, для водных растворов допускается использовать 2 мл/100 г массы тела. Для веществ, вызывающих раздражение или эрозию, выраженность которых возрастает с увеличением концентрации, обеспечивают постоянство вводимого объема для всех уровней доз путем изменения концентрации.
6.4.2 При введении исследуемых химических веществ с пищей или питьевой водой важно убедиться, что количество исследуемого химического вещества не нарушает нормальное питание или водный баланс. При введении исследуемого вещества с пищей используют постоянную концентрацию в пище (мг/кг или ppm) или постоянный уровень дозы на основе массы тела животного; используемый способ должен быть зафиксирован. Введение исследуемого вещества через желудочный зонд проводят ежедневно в одно и то же время и корректируют не менее одного раза в неделю, для обеспечения постоянного уровня дозы относительно массы тела животного. Если настоящее исследование используют как предварительное перед длительным или полным исследованием репродуктивной токсичности, то в обоих случаях следует использовать одинаковый корм.
6.5 Программа исследования
6.5.1 Введение доз животным обоих полов начинают не менее чем за две недели до спаривания после пятидневной акклиматизации и проверки самок на нормальные эстральные циклы (в течение двух недель до начала исследования). Исследование планируют таким образом, чтобы оценку эстрального цикла начинать вскоре после достижения животными полной половой зрелости. Этот срок для крыс разных линий в разных лабораториях может незначительно отличаться, например, для крыс линии Sprague Dawley - 10 недель, Wistar около 12 недель. Самок с потомством умерщвляют на 13-й день после родов или вскоре после него. Чтобы обеспечить возможность забора крови у самки натощак (если этот вариант является предпочтительным), самки и их потомство необязательно должны быть умерщвлены в тот же день. День родов (а именно когда роды завершены) считают нулевым днем после родов. Небеременных самок умерщвляют на 24-26-й день после последнего дня спаривания. Введение доз животным обоих полов продолжают весь период спаривания; самцам продолжают вводить вещество после спаривания до достижения не менее чем 28-дневного периода введения доз, затем их умерщвляют или продолжают введение доз для возможного проведения второго спаривания (при необходимости).
6.5.2 Беременным самкам дозы вводят ежедневно в течение всей беременности и, по крайней мере, до 13-го дня после родов включительно или до дня умерщвления. Введение доз в исследованиях с введением химического вещества ингаляцией или нанесением на кожу продолжают не менее чем до 19-го дня беременности включительно и возобновляют не позже четвертого послеродового дня (PND 4).
6.5.3 Животных в группе-спутнике, предназначенных для последующих наблюдений, не спаривают. Их содержат не менее 14 дней после первого запланированного умерщвления самок без введения химического вещества с целью выявления отсроченного воздействия, персистирования или восстановления после токсического воздействия.
6.5.4 Схема испытания, предусматривающая максимальную длительность исследования, на основе полного 14-дневного периода спаривания приведена в приложении А.
6.6 Эстральные циклы
Наблюдать за эстральными циклами следует до начала эксперимента, чтобы отобрать самок с регулярной цикличностью (см. 6.1). Ежедневно контролируют вагинальные мазки с начала эксперимента до появления признаков спаривания. При наличии опасений о последствиях острого стресса, который с началом введения доз может изменить эстральные циклы, подопытных животных подвергают воздействию в течение двух недель, а затем ежедневно берут вагинальные мазки для контроля эстрального цикла не менее двух недель перед спариванием и во время спаривания до появления признаков спаривания. При получении вагинальных/цервикальных клеток следует соблюдать осторожность для предотвращения нарушения слизистой оболочки, что может вызвать ложную беременность [8], [11].
6.7 Процедура спаривания
Обычно в исследовании используют спаривание 1:1 (одна самка и один самец), за исключением случаев случайной гибели самца. Самку оставляют с самцом до наступления беременности или в течение двух недель. Каждое утро самок проверяют на наличие спермы или вагинальной пробки. Нулевым днем беременности считают день обнаружения вагинальной пробки или спермы. При неудавшемся спаривании допускается повторное спаривание с проверенными самцами той же группы.
При установлении факта беременности самки самца отсаживают в прежнюю клетку.
6.8 Размер помета
6.8.1 На четвертый день после рождения размер каждого помета может быть скорректирован путем отбора по четыре-пять детенышей каждого пола методом случайной выборки, в зависимости от размера помета в используемой линии крыс. У двух лишних детенышей берут образцы крови, объединяют и используют для определения уровня тироксина (Т4) в сыворотке крови. Выборочная элиминация детенышей, основанная, например, на массе тела или AGD, нецелесообразна. Если число детенышей мужского или женского пола не достигает четырех или пяти особей на помет, допускается частичная корректировка (например, шесть самцов и четыре самки). Если в помете недостаточно детенышей (нет двух лишних детенышей) для сбора крови с целью оценки уровня Т4 в сыворотке, используют двух детенышей, которых обычно сохраняют. Если число детенышей в помете меньше необходимого уровня (8 или 10 детенышей в помете), для оценки Т4 в сыворотке крови предпочтительно использовать двух детенышей женского пола, чтобы сохранить больше детенышей мужского пола для оценки сохранения (удержания) соска на PND 13; однако по возможности число сохраненных детенышей женского пола в каждом помете должно быть не менее двух.
6.8.2 Если размер помета не корректируют, на 4-й день после рождения двух детенышей из помета умерщвляют и берут образцы крови для измерения концентрации гормонов щитовидной железы в сыворотке. По возможности это должны быть детеныши женского пола, чтобы сохранить детенышей мужского пола для оценки наличия (удержания) сосков.
7 Наблюдения
7.1 Общие клинические наблюдения проводят не менее одного раза в день в одно и то же время с учетом периода предполагаемого максимального воздействия дозы. Фиксируют состояние здоровья животных. Не менее двух раз в день всех животных проверяют на наличие клинических проявлений заболеваемости и случаев смерти.
Животные, обнаруженные в предсмертном состоянии и/или демонстрирующие сильные боли и признаки тяжелых мучений, должны быть гуманным образом подвергнуты эвтаназии.
7.2 Подробный клинический осмотр всех животных проводят один раз перед первым введением дозы (для обеспечения сравнения объектов исследования) и затем не менее одного раза в неделю во время исследования. Наблюдения проводят вне клетки на стандартной площадке каждый день в одно и то же время. Результаты тщательно записывают; желательно с использованием балльной системы оценки, четко установленной в испытательной лаборатории. Следует свести к минимуму изменение условий испытания и обеспечить проведение наблюдений персоналом, не осведомленным о введенном веществе. Записи о состоянии животных должны включать, но не ограничиваться, изменение состояния кожи, меха, глаз, слизистых оболочек, секрецию и экскрецию и вегетативную активность (например, слезотечение, пилоэрекция, размер зрачка, необычный характер дыхания). Также регистрируют изменение походки, позы и реакции на манипуляцию, а также наличие клонических или тонических движений, стереотипии (например, чрезмерный уход за шерстью, повторяющиеся движения по кругу), осложненные или затянувшиеся роды или странное поведение (например, самокалечение, хождение задом наперед) [12].
7.3 Одновременно проводят исследование сенсорной реактивности на воздействие разных раздражителей (например, слуховых, зрительных и проприоцептивных) [8], [11], [13], оценку силы захвата [14] и двигательной активности [15] пяти самцов и пяти самок, выбранных случайным образом из каждой группы. Более подробная информация о процедурах исследования приведена в соответствующих ссылках. Тем не менее можно использовать альтернативные процедуры. У самцов функциональные исследования проводят в конце периода введения доз незадолго до планового умерщвления, но перед забором крови на гематологический или биохимический анализ (см. 9.2, 9.3, 10.1, 10.2, включая сноску 1). Самки во время функциональных исследований должны находиться в физиологически сопоставимых состояниях и проходить испытания один раз в течение последней недели лактации (например, LD 6-13), незадолго до планового умерщвления. По возможности сокращают время отъема потомства от самок.
7.4 Функциональные исследования в конце наблюдения в рамках предварительного исследования можно не проводить перед проведением соответствующего 90-дневного исследования субхронической токсичности. В этом случае функциональные исследования включают в последующее исследование. С другой стороны, наличие данных о функциональных наблюдениях из этого исследования может способствовать выбору уровней доз для последующего субхронического или долгосрочного исследования.
7.5 В исключительных случаях функциональные исследования могут быть опущены для групп животных, проявляющих признаки токсичности, которые будут мешать проведению функционального исследования.
7.6 Продолжительность беременности фиксируют и отсчитывают от нулевого дня беременности. Каждый приплод должен быть осмотрен в возможно короткий срок после рождения для определения числа и пола детенышей, мертворожденных, родившихся малорослыми (детеныши, которые значительно меньше детенышей контрольной группы) и наличия серьезных аномалий.
7.7 Живых детенышей подсчитывают, устанавливают пол. Приплод взвешивают в течение 24 ч после родов (нулевой или первый день после родов), на четвертый день и 13-й день после родов. В дополнение к наблюдению за родительскими особями (см. 7.2, 7.3) фиксируют любое аномальное поведение потомства.
7.8 AGD у каждого детеныша измеряют в один и тот же день послеродового периода между PND 0 и PND 4. В день измерения AGD регистрируют массу тела детеныша; AGD должно быть нормализовано по массе тела детеныша, предпочтительно по значению кубического корня из массы тела [16]. Число сосков/ареол у детенышей мужского пола подсчитывают на PND 12 или PND 13, как рекомендовано в [17].
8 Масса тела, потребление пищи и воды
8.1 Самцов и самок взвешивают в день введения первый дозы, далее не менее одного раза в неделю и при окончании исследования. Во время беременности самок взвешивают в нулевой, 7-й, 14-й и 20-й дни, в течение 24 ч после родов (нулевой или первый день после родов) и как минимум на 4-й и 13-й день после родов. Результаты наблюдений фиксируют отдельно для каждого взрослого животного.
8.2 Перед спариванием, во время беременности и лактации не менее одного раза в неделю измеряют потребление пищи. Измерение потребления пищи во время спаривания не является обязательным. Если исследуемое вещество вводят с питьевой водой, в эти периоды измеряют потребление воды.
9 Гематология
9.1 Один раз во время исследования проводят гематологическое исследование крови у пяти самцов и пяти самок, выбранных случайным образом из каждой группы: гематокрит, средняя концентрация гемоглобина, содержание эритроцитов, ретикулоцитов, общий и дифференциальный подсчеты лейкоцитов, содержание тромбоцитов и время свертывания крови. Если исследуемое вещество или его предполагаемые метаболиты обладают окислительными свойствами (или предполагают их наличие), определяют содержание метгемоглобина и телец Хайнца (Гейнца или Гейнца-Эрлиха).
9.2 Образцы крови отбирают с определенного участка. Во время отбора проб самки должны находиться в одинаковом физиологическом состоянии. Во избежание практических трудностей, связанных с возможностью изменения наступления беременности, отбор крови у самок желательно проводить перед началом спаривания или альтернативно непосредственно перед или при эвтаназии животных. Пробы крови самцов предпочтительно отбирать непосредственно перед эвтаназией животных или в качестве ее части. Альтернативно отбор крови у самцов также можно провести в конце периода, предшествующего спариванию, в наиболее подходящий период для обследования самок.
9.3 Пробы крови следует хранить в соответствующих условиях.
10 Клиническая биохимия
10.1 Определения клинических биохимических показателей для исследования основных токсических эффектов в тканях и, в частности, воздействия на почки и печень следует проводить на образцах крови, полученных от пяти самцов и пяти самок каждой группы. Рекомендуется ночное голодание животных до взятия крови [1]. Исследования плазмы или сыворотки крови должны включать определение содержания натрия, калия, глюкозы, общего холестерина, мочевины, креатинина, общего белка, альбумина, не менее двух ферментов (таких как аланинаминотрансфераза, аспартатаминотрансфераза и сорбитолдегидрогеназа), указывающих на гепатоцеллюлярные эффекты, и желчных кислот. Определение содержания дополнительных ферментов (печени или другого происхождения) и билирубина может предоставить полезную информацию при определенных обстоятельствах.
_______________
Ряд измерений в сыворотке и плазме, особенно для определения глюкозы, предпочтительно проводить натощак, из-за повышенной вариабельности показателей, которые неизбежно возникают в противном случае и имеют тенденцию маскировать более тонкие эффекты, затрудняя их интерпретацию. С другой стороны, голодание в ночное время может влиять на общий метаболизм (беременных) животных, нарушать лактацию и поведение кормящих особей, особенно в исследованиях по кормлению, и может нарушать суточную подверженность воздействию исследуемого химического вещества. Если применяют ночное голодание, клинические биохимические определения проводят после проведения функциональных наблюдений на четвертой неделе исследования у самцов. Самок следует оставлять на один день после отъема детенышей, например, PND 13). Самкам не дают пищи в течение ночи с 13-й на 14-й день лактации и для определения показателей клинической биохимии используют периферическую кровь.
10.2 Образцы крови с определенного участка отбирают по следующему графику:
- не менее чем у двух детенышей помета на четвертый день после рождения;
- у всех самок и не менее чем у двух детенышей помета при прекращении исследования на 13-й день;
- у всех взрослых самцов при прекращении исследования.
Все образцы крови хранят в соответствующих условиях. В сыворотке образцов крови, полученных у 13-дневных детенышей и взрослых самцов, определяют содержание гормонов щитовидной железы (Т4). При необходимости проводят оценку содержания Т4 в образцах крови самок и четырехдневных детенышей. При необходимости также проводят определение других гормонов. Для анализа тироидных гормонов (Т4 и TSH) кровь детенышей можно отбирать у всего помета и предпочтительно измерять как "общую".
10.3 При необходимости может быть проведен анализ мочи у пяти самцов, выбранных случайным образом из каждой группы, в последнюю неделю исследования. Ее собирают за фиксированный промежуток времени и определяют: внешний вид, количество, осмоляльность или относительную плотность, рН, наличие белка, глюкозы, крови/клеточных элементов крови.
10.4 Дополнительно можно провести исследования сывороточных маркеров общего повреждения тканей. Выполняют другие исследования, если известные свойства исследуемого химического вещества могут или предположительно влияют на соответствующие метаболические профили (содержание кальция, фосфатов, триглицеридов и глюкозы натощак, специфичных гормонов, метгемоглобина и холинэстеразы). Их необходимо идентифицировать в каждом конкретном случае.
10.5 На изменчивость и абсолютные концентрации при определении гормонов могут влиять следующие факторы:
- время умерщвления из-за суточных изменений концентрации гормонов;
- способ умерщвления для предотвращения дополнительного стресса для животных, который может повлиять на концентрации гормонов;
- могут отличаться калибровочные кривые аналитических наборов для определения гормонов.
10.6 Образцы плазмы, предназначенные для определения гормонов, должны быть получены в одно и то же время суток. Численные значения, полученные при анализе концентраций гормонов, отличаются в зависимости от имеющихся в продаже аналитических наборов.
10.7 Если исходные исторические данные некорректны, следует рассмотреть возможность определения гематологических и клинических биохимических показателей до начала введения доз или предпочтительно на группе животных, не включенных в подопытные группы. Данные для самок должны быть получены от кормящих животных.
11 Патологоанатомические исследования
11.1 Вскрытие животных
11.1.1 Всех взрослых животных, участвующих в исследовании, во время вскрытия (некропсии) подвергают подробному макроскопическому исследованию, включающему тщательный осмотр наружной поверхности тела, всех отверстий, а также черепной, грудной и брюшной полостей и их содержимого. Особое внимание уделяют органам репродуктивной системы. Регистрируют число мест имплантации. Вагинальные мазки исследуют в день вскрытия для определения стадии эстрального цикла и обеспечения корреляции с гистопатологией репродуктивных органов особей женского пола.
11.1.2 Яички и придатки яичек, а также леватор заднего прохода, бульбокавернозный мышечный комплекс, куперовы железы и головку полового члена от всех взрослых самцов взвешивают, а все органы взрослых животных с признаками макроскопических поражений: яичники, яички, придатки яичек и вспомогательные половые железы консервируют.
11.1.3 Консервируют щитовидные железы в соответствующей фиксирующей среде от всех взрослых особей мужского и женского пола и от одного 13-дневного детеныша мужского и женского пола каждого помета для последующего гистопатологического исследования. Массу щитовидной железы можно определить после фиксации. Для предотвращения повреждения ткани обрезку выполняют очень аккуратно и только после фиксации. Повреждение ткани может негативно сказаться на результатах гистопатологического анализа. Отбор крови проводят из определенного места непосредственно перед эвтаназией или как часть процедуры эвтаназии животных и хранят в соответствующих условиях (см. 10.2).
11.1.4 У пяти самок и пяти самцов, выбранных случайным образом из каждой группы, после вскрытия допускается дополнительно выделять печень, почки, надпочечники, тимус, селезенку, мозг и сердце, препарировать от прилегающих тканей и по возможности быстро взвешивать, не допуская высыхания.
Кроме того, у пяти взрослых самок и пяти самцов, выбранных случайным образом из каждой группы, сохраняют для последующих гистопатологических исследований с помощью обязательной консервации в соответствующей среде следующие органы и ткани: все органы с макроскопическими поражениями, мозг (наиболее важные области, включая большие полушария, мозжечок и варолиев мост), спинной мозг, глаз, желудок, тонкий и толстый кишечник (включая пейеровы бляшки), печень, почки, надпочечники, селезенка, сердце, тимус, трахея и легкие (накачивают воздухом и фиксируют), гонады (яички и яичники), вспомогательные половые органы (матка и шейка матки, придатки яичка, предстательная железа, семенные пузырьки плюс коагулирующие железы), влагалище, мочевой пузырь, лимфатические узлы (один узел, расположенный вблизи места введения вещества, и один, находящийся в удалении от места введения [18]), периферические нервы (седалищные и большеберцовые), желательно расположенные ближе к мышцам, скелетные мышцы и кости с костным мозгом (или со свежим аспиратом костного мозга). Для стандартных исследований яичек и придатков яичек используют фиксатор Буэна или модифицированный фиксатор Дэвидсона [18]-[20]; фиксация этих тканей формалином не рекомендуется. Для обеспечения быстрого проникновения фиксатора аккуратно и неглубоко прокалывают иглой белочную оболочку яичка с обеих сторон органа. Результаты клинических исследований и другие данные могут указывать на необходимость изучения дополнительных тканей. Также следует сохранить любые органы, которые могут являться органами-мишенями на основании известных свойств исследуемого вещества.
11.1.5 Ценные показания для эндокринных эффектов могут давать следующие ткани: половые железы (яичники и яички), вспомогательные половые органы (матка, включая шейку матки, придатки яичка, семенные пузырьки с коагуляционными железами, дорсолатеральный и вентральный отделы простаты), влагалище, гипофиз, мужские молочные железы и надпочечники. Изменения в мужских молочных железах изучены недостаточно, но этот параметр может быть очень чувствительным к веществам с эстрогенным действием. Наблюдение за органами/тканями, которые не приведены в 11.1.4, является необязательным.
11.1.6 Умерших и умерщвленных на 13-й день после родов детенышей внимательно осматривают на наличие выраженных внешних аномалий. Особое внимание уделяют наружным половым органам, которые изучают на наличие признаков изменения развития.
12 Гистопатология
12.1 Проводят полное гистопатологическое исследование консервированных органов и тканей животных из контрольной группы и группы с максимальной дозой (особое внимание уделяют стадии сперматогенеза в мужских половых железах и гистопатологии интерстициальной клеточной структуры яичек). При необходимости исследуют щитовидную железу детенышей и оставшихся взрослых животных. Эти исследования следует провести на животных других групп, если наблюдаются изменения в группе, получавшей максимальную дозу. В руководстве по гистопатологии [12] приведена подробная дополнительная информация по препарированию, фиксации, получению срезов и гистопатологии эндокринных тканей.
12.2 Все макроскопические поражения должны быть оценены. Для обоснования NOAEL должны быть исследованы органы-мишени животных в группах с другими уровнями доз, особенно тех, которые могут быть оценены как NOAEL.
12.3 При использовании группы-спутника проводят гистопатологию органов и тканей, для которых наблюдались эффекты, в подопытных группах.
13 Данные об исследовании
13.1 Данные для каждого животного должны быть предоставлены отдельно. Дополнительно все данные сводят в таблицу, отражающую число животных в каждой подопытной группе на начало исследования; число животных, умерших во время исследования или умерщвленных по гуманным соображениям, и время смерти или умерщвления каждого животного; число животных, способных к воспроизведению потомства; число беременных самок; число животных с признаками токсического воздействия и описание наблюдаемых признаков, включая время начала, продолжительность и тяжесть любых проявлений токсичности исследуемого вещества; тип гистопатологических изменений и все соответствующие данные по приплоду. Рекомендуемый пример табличной формы сводного отчета для оценки воздействия на репродуктивную/эмбриональную токсичность приведен в приложении В.
13.2 По возможности числовые результаты должны оцениваться соответствующим и общепринятым статистическим методом. При сравнении воздействия на основании диапазона доз следует избегать использования множественных t-критериев. Статистический метод выбирают при планировании исследования. Статистический анализ AGD и сохранения (удерживания) сосков проводят на основании данных, полученных для отдельных детенышей, принимая во внимание воздействие на детенышей. При необходимости детеныш является единицей анализа. Статистический анализ массы тела детеныша проводят на основании индивидуальных данных с учетом числа детенышей в помете. Из-за ограниченных аспектов исследования статистический анализ в форме испытания на "значимость" для многих конечных точек имеет ограниченную ценность, особенно для конечных точек в исследованиях репродуктивной токсичности. Некоторые из наиболее широко используемых методов, особенно параметрические исследования для определения основной тенденции, являются непригодными. При использовании статистического анализа выбранный метод должен соответствовать распределению исследуемой переменной и должен быть определен до начала исследования.
14 Оценка результатов
14.1 Результаты, полученные при исследовании токсичности, оценивают с точки зрения наблюдаемых эффектов, аутопсии и данных микроскопических исследований. Оценка включает взаимосвязь между дозой исследуемого вещества и наличием/отсутствием, количеством и тяжестью патологических изменений, включая макроскопические повреждения, выявление органов-мишеней, бесплодие, клинические нарушения, воздействие на репродуктивную функцию и потомство, изменения массы тела, влияние на смертность и любые другие токсические проявления.
14.2 В связи с непродолжительностью периода введения вещества при оценке воздействия на репродуктивную способность самцов вместе с данными по фертильности учитывают результаты гистопатологии яичек и придатков яичек (эпидидимисов). Для интерпретации результатов исследования может быть полезно использование существующих контрольных данных по репродуктивности и развитию (например, число детенышей в помете, AGD, сохранение (удерживание) сосков, уровень Т4 в сыворотке).
14.3 В связи с непродолжительностью периода введения вещества при оценке воздействия на репродуктивную способность самцов вместе с данными по фертильности следует учитывать результаты гистопатологии яичек и придатков яичек (эпидидимисов). Для интерпретации результатов исследования может быть полезно использование существующих контрольных данных по репродуктивности и развитию (например, число детенышей в помете, AGD, сохранение (удерживание) сосков, уровень Т4 в сыворотке).
14.4 Для контроля качества предлагается сбор существующих контрольных данных и вычисление коэффициентов вариации численных данных, особенно для параметров, связанных с обнаружением эндокринного нарушения. Эти данные можно использовать для сравнения при оценке результатов текущих исследований.
15 Отчет об исследовании
15.1 Отчет об исследовании должен включать следующие данные:
15.1.1 Исследуемое вещество:
- изготовитель, номер партии, срок годности, при наличии;
- стабильность исследуемого химического вещества, если известно.
15.1.2 Однокомпонентное вещество:
- внешний вид, растворимость в воде и соответствующие физико-химические свойства;
- химическая идентификация, например наименование по IUPAC, номер CAS, линейная нотация SMILES или InChl, структурная формула, чистота, при необходимости идентификация химических примесей и т.д.
15.1.3 Многокомпонентное вещество, UVBCs (вещество неизвестного или переменного состава, сложные продукты реакции или биологические материалы) и смеси:
- характеризуют химической идентификацией (см. 15.1.2), количественным соотношением и физико-химическими свойствами входящих компонентов.
15.1.4 Растворитель (носитель), при необходимости:
- обоснование выбора носителя, если это не вода.
15.1.5 Подопытные животные:
- используемые виды/линии;
- число, возраст и пол животных;
- источник, условия содержания, питание и т.д.;
- индивидуальная масса животных в начале эксперимента;
- обоснование выбора других видов животных, если это не крыса.
15.1.6 Условия проведения исследования:
- обоснование выбора уровня дозы;
- подробное описание химического состава исследуемого вещества/приготовления пищи, достигнутая концентрация, стабильность и однородность препарата;
- сведения о способе введения исследуемого химического вещества;
- пересчет химической концентрации в пище/питьевой воде (ppm) на фактическую дозу (мг/кг массы тела в сут), при необходимости;
- подробное описание качества пищи и воды;
- подробное описание процедуры рандомизации для выбора детенышей для выбраковки, если выбраковывали.
15.1.7 Результаты:
- масса тела/изменения массы;
- потребление пищи и воды, по возможности;
- данные токсической реакции по полу и дозе, включая фертильность, беременность и любые другие проявления признаков токсичности;
- длительность беременности;
- токсическое или иное воздействие на репродуктивность, потомство, рост после рождения и т.д.;
- характер, степень тяжести и продолжительность клинических наблюдений (обратимых или нет);
- сенсорная и двигательная активность животных, сила захвата;
- результаты гематологических исследований с соответствующими значениями физиологической нормы;
- результаты клинических биохимических исследований с соответствующими значениями физиологической нормы;
- число взрослых самок с нормальным или аномальным эстральным циклом и продолжительность цикла;
- число живого потомства и постимплантационная гибель плодов;
- число детенышей с явно выраженными аномалиями; макроскопическая оценка внешних гениталий, число малорослых детенышей;
- время смерти во время исследования или дожили до окончания;
- число имплантаций, число животных в помете и масса помета на время регистрации;
- масса тела детенышей;
- AGD всех детенышей (и масса тела в день измерения AGD);
- сохранение (удержание) сосков у детенышей-самцов;
- уровни гормонов щитовидной железы на 13-й день у детенышей и взрослых самцов (и при необходимости на 4-й день у самок и детенышей);
- данные по массе тела на момент умерщвления и массе органов родительских животных;
- результаты вскрытия;
- подробное описание гистологических данных;
- данные по абсорбции, при наличии;
- статистическая обработка, при необходимости.
15.1.8 Обсуждение результатов
Допускается при обсуждении результатов отразить взаимосвязь данного исследования с другими исследованиями.
15.1.9 Выводы.
16 Интерпретация результатов
Исследование обеспечивает возможность оценки токсичности вещества для репродутивной системы/эмбрионального развития, связанной с многократным введением доз. Поскольку особое внимание уделено общетоксическому действию и репродуктивной/эмбриональной токсичности, результаты этого исследования могут показать различия между репродуктивными/эмбриональными эффектами, появляющимися в отсутствие общей токсичности, и теми, которые проявляются только на уровнях воздействия, токсичных для взрослых особей (см. 3.2-3.6). Полученные результаты могут служить показанием для необходимости проведения дополнительных исследований и стать основой для разработки программы последующих исследований. Интерпретация результатов исследования репродуктивной системы и внутриутробного развития потомства приведена в руководстве [21]. Гистологическая оценка результатов эндокринных и репродуктивных исследований на грызунах, приведенная в руководстве [18], содержит информацию о подготовке и оценке (эндокринных) органов и вагинальных мазков, которая может быть полезна для настоящего стандарта.
Приложение А
(справочное)
Схема, предусматривающая максимальную длительность исследования, основанную на полном 14-дневном периоде спаривания
|
Рисунок А.1
Приложение В
(справочное)
Пример сводного отчета для оценки воздействия на репродуктивную/эмбриональную токсичность
Таблица В.1
Параметры | Результаты наблюдений | ||||
Уровень дозы (единицы измерения) | |||||
0 (контрольная группа) | … | … | … | … | |
Число пар на начало исследования | |||||
Число самок с признаками спаривания | |||||
Число забеременевших самок | |||||
Дни зачатия 1-5 (число самок) | |||||
Дни зачатия 6-... | |||||
Беременность = 21 день (число самок) | |||||
Беременность = 22 дня (число самок) | |||||
Беременность | |||||
Число самок с живыми детенышами | |||||
Число самок с живыми детенышами на 4-й день | |||||
Число желтых тел/на самку (в среднем) | |||||
Число эмбрионов/на самку (в среднем) | |||||
Число живых детенышей на самку при рождении (в среднем) | |||||
Число живых детенышей на самку к 4-му дню (в среднем) | |||||
Численное соотношение полов (самцы/самки) на момент рождения (в среднем) | |||||
Численное соотношение полов (самцы/самки) к 4-му дню (в среднем) | |||||
Масса приплода при рождении (средняя) | |||||
Масса приплода на 4-й день (средняя) | |||||
Масса детеныша при рождении (средняя) | |||||
Масса детеныша при измерении AGD (среднее значение для самцов и для самок) | |||||
AGD у детенышей в один и тот же постнатальный день, 4-й день после рождения (средние значения для самцов и самок с указанием PND) | |||||
Масса детеныша на 4-й день (средняя) | |||||
Масса детеныша на 13-й день (средняя) | |||||
Удержание сосков у детенышей мужского пола на 13-й день (среднее) | |||||
Аномальные детеныши | |||||
Самки с 0-го дня | |||||
Самки с 1-го дня | |||||
Самки со 2-го дня | |||||
Потеря потомства | |||||
Пренатальная (зародыши минус живорожденные) | |||||
Самки с 0-го дня | |||||
Самки с 1-го дня | |||||
Самки со 2-го дня | |||||
Самки с 3-го дня | |||||
Постнатальная (живорожденные минус живые к 13-му дню после родов) | |||||
Самки с 0-го дня | |||||
Самки с 1-го дня | |||||
Самки со 2-го дня | |||||
Самки с 3-го дня | |||||
| |||||
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа OECD Test N 422:2015 |
Введение | Введение |
1 | |
2 | |
3 | |
4 | |
5 | |
1 Область применения | - |
2 Термины, определения и сокращения (15, приложение 1) | Определения |
15 | |
3 Основные положения (6-14) | Основные положения |
3.1 | 6 |
3.2 | 7 |
3.3 | 8 |
3.4 | 9 |
3.5 | 10 |
3.6 | 11 |
3.7 | 12 |
3.8 | 13 |
3.9 | 14 |
4 Принцип исследования (16-19) | Принцип исследования |
4.1 | 16 |
4.2 | 17 |
4.3 | 18 |
4.4 | 19 |
5 Сущность метода (20-26) | Описание метода |
5.1 Выбор вида животных | Выбор вида животных |
20 | |
5.2 Условия содержания и кормления | Условия содержания и кормления |
5.2.1 | 21 |
5.2.2 | 22 |
5.2.3 | 23 |
5.3 Подготовка животных (24) | Подготовка животных |
24 | |
5.4 Подготовка доз | Подготовка доз |
5.4.1 | 25 |
5.4.2 | 26 |
6 Проведение исследований (27-41) | Проведение исследований |
6.1 Число и пол животных | Число и пол животных |
27 | |
6.2 Выбор дозы | Выбор дозы |
6.2.1 | 28 |
6.2.2 | 29 |
6.2.3 | 30 |
6.3 Определение предельной дозы | Определение предельной дозы |
31 | |
6.4 Введение доз | Введение доз |
6.4.1 | 32 |
6.4.2 | 33 |
6.5 Схема* исследования | Схема исследования |
___________________ * Текст документа соответствует оригиналу. - . | |
6.5.1 | 34 |
6.5.2 | 35 |
6.5.3 | 36 |
6.5.4 | 37 |
6.6 Эстральные циклы | Эстральные циклы |
38 | |
6.7 Процедура спаривания | Процедура спаривания |
39 | |
6.8 Размер помета | Размер помета |
6.8.1 | 40 |
6.8.2 | 41 |
7 Наблюдения (42-49) | Наблюдения |
7.1 | 42 |
7.2 | 43 |
7.3 | 44 |
7.4 | 45 |
7.5 | 46 |
7.6 | 47 |
7.7 | 48 |
7.8 | 49 |
8 Масса тела, потребление пищи и воды (50, 51) | Масса тела, потребление пищи и воды |
8.1 | 50 |
8.2 | 51 |
9 Гематология (52-54) | Гематология |
9.1 | 52 |
9.2 | 53 |
9.3 | 54 |
10 Клиническая биохимия (55-61) | Клиническая биохимия |
10.1 | 55 |
10.2 | 56 |
10.3 | 57 |
10.4 | 58 |
10.5 | 59 |
10.6 | 60 |
10.7 | 61 |
11 Патологоанатомические исследования (62-67) | Патология |
11.1 Вскрытие животных | Вскрытие животных |
11.1.1 | 62 |
11.1.2 | 63 |
11.1.3 | 64 |
11.1.4 | 65 |
11.1.5 | 66 |
11.1.6 | 67 |
12 Гистопатология (68-70) | Гистопатология |
12.1 | 68 |
12.2 | 69 |
12.3 | 70 |
13 Данные об исследовании (71, 72) | Данные об исследовании |
13.1 | 71 |
13.2 | 72 |
14 Оценка результатов (73-75) | Оценка результатов |
14.1 | 73 |
14.2 | 74 |
14.3 | 75 |
15 Отчет об исследовании (76) | Отчет об исследовании |
76 | |
16 Интерпретация результатов (77) | Интерпретация результатов |
77 | |
* | Библиография |
** | Приложение 1 |
Приложение А Схема, предусматривающая максимальную длительность исследования, основанную на полном 14-дневном периоде спаривания | Приложение 2 |
Приложение В Пример сводного отчета для оценки воздействия на репродуктивную/эмбриональную токсичность | Приложение 3 |
Приложение ДА Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа | - |
Библиография | - |
* Данный раздел приведен в конце стандарта для приведения в соответствие с требованиями ГОСТ 1.5. | |
Библиография
[1] | OECD (1990). Room Document No. 1 for the 14th Joint Meeting of the Chemicals Group and Management Committee. Available upon request at Organisation for Economic Cooperation and Development, Paris |
[2] | OECD (1992). Chairman's Report of the ad hoc Expert Meeting on Reproductive Toxicity Screening Methods, Tokyo, 27th-29th October, 1992. Available upon request at Organisation for Economic Cooperation and Development, Paris |
[3] | Mitsumori K., Kodama Y., Uchida O., Takada K., Saito M., Naito K., Tanaka S., Kurokawa Y., Usami M., Kawashima K., Yasuhara K., Toyoda K., Onodera H., Furukawa E., Takahashi M. and Hayashi Y. (1994). Confirmation Study, Using Nitro-Benzene, of the Combined Repeat Dose and Reproductive/Developmental Toxicity Test Protocol Proposed by the Organization for Economic Cooperation and Development (OECD). J. Toxicol, Sci., 19, 141-149 |
[4] | Tanaka S., Kawashima K., Naito K., Usami M., Nakadate M., Imaida K., Takahashi M., Hayashi Y., Kurokawa Y. and Tobe M. (1992). Combined Repeat Dose and Reproductive/Developmental Toxicity Screening Test (OECD): Familiarization Using Cyclophosphamide. Fundam. Appl. Toxicol., 18, 89-95 |
[5] | OECD (1998). Report of the First Meeting of the OECD Endocrine Disrupter Testing and Assessment (EDTA) Task Force, 10th-11th March 1998, Available upon request at Organisation for Economic Cooperation and Development, Paris |
[6] | OECD (2015). Feasibility Study for Minor Enhancements of TG 421/422 with ED Relevant Endpoints. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 217), Organisation for Economic Cooperation and Development, Paris |
[7] | OECD (2000). Guidance Document on the Recognition, Assessment, and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluations, Environment, Health and Safety Publications, Series on Testing and Assessment (No. 19), Organisation for Economic Cooperation and Development, Paris |
[8] | Goldman J.M., Murr A.S., Buckalew A.R., Ferrell J.M. and Cooper R.L. (2007). The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies, Birth Defects Research, Part B, 80 (2), 84-97 |
[9] | OECD Test No. 407: 2008. Guidelines for the Testing of Chemicals. Repeated Dose 28-Day Oral Toxicity Study in Rodents |
[10] | OECD Test No. 421: 2015. Guidelines for the Testing of Chemicals. Reproduction/Developmental Toxicity Screening Test |
[11] | Sadleir R.M.F.S. (1979). Cycles and Seasons, in Auston C.R. and Short R.V. (Eds.), Reproduction in Mammals: I. Germ Cells and Fertilization, Cambridge, New York |
[12] | IPCS (1986). Principles and Methods for the Assessment of Neurotoxicity Associated with Exposure to Chemicals. Environmental Health Criteria Document (No. 60) |
[13] | Moser V.C., McDaniel K.M. and Phillips P.M. (1991). Rat Strain and Stock Comparisons Using a Functional Observational Battery: Baseline Values and Effects of Amitraz. Toxicol. Appl. Pharmacol., 108, 267-283 |
[14] | Meyer O.A., Tilson H.A., Byrd W.C. and Riley M.T. (1979). A Method for the Routine Assessment of Fore- and Hindlimb Grip Strength of Rats and Mice. Neurobehav. Toxicol., 1, 233-236 |
[15] | Crofton K.M., Howard J.L., Moser V.C., Gill M.W., Reiter L.W., Tilson H.A., MacPhail R.C. (1991). Interlaboratory Comparison of Motor Activity Experiments: Implication for Neurotoxicological Assessments. Neurotoxicol. Teratol. 13, 599-609 |
[16] | Gallavan R.H. Jr, J.F. Holson, D.G., Stump, J.F. Knapp and V.L. Reynolds. (1999). "Interpreting the Toxicologic Significance of Alterations in Anogenital Distance: Potential for Confounding Effects of Progeny Body Weights", Reproductive Toxicology, 13: 383-390 |
[17] | OECD (2013). Guidance Document in Support of the Test Guideline on the Extended One Generation Reproductive Toxicity Study. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 151). Organisation for Economic Cooperation and Development, Paris |
[18] | OECD (2009). Guidance Document for Histologic Evaluation of Endocrine and Reproductive Tests in Rodents. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 106) Organisation for Economic Cooperation and Development, Paris |
[19] | Hess RA and Moore BJ. (1993). Histological Methods for the Evaluation of the Testis. In: Methods in Reproductive Toxicology, Chapin RE and Heindel JJ (Eds.). Academic Press: San Diego, CA, pp.52-85 |
[20] | Latendresse JR, Warbrittion AR, Jonassen H, Creasy DM. (2002). Fixation of Testes and Eyes Using a Modified Davidson's Fluid: Comparison with Bouin's Fluid and Conventional Davidson's fluid. Toxicol. Pathol. 30, 524-533 |
[21] | OECD (2008). Guidance Document on Mammalian Reproductive Toxicity Testing and Assessment. Environment, Health and Safety Publications, Series on Testing and Assessment (No. 43), Organisation for Economic Cooperation and Development, Paris |
УДК 615.038/615.012/615.014/615.2:006.354 | МКС 75.080 | MOD |
Ключевые слова: методы испытаний по воздействию химической продукции на организм человека, определение токсичности, повторное/многократное воздействие, оценка репродуктивной/эмбриональной токсичности, скрининговый метод | ||
Редакция документа с учетом
изменений и дополнений подготовлена