ГОСТ 32367-2020
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Угнетение репродуктивной способности Дафнии магна
Methods of testing the chemical products of the environmental hazard. Daphnia magna reproduction repression
МКС 75.080
11.020
11.120.01
Дата введения 2021-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июня 2020 г. N 131-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 октября 2020 г. N 905-ст межгосударственный стандарт ГОСТ 32367-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2021 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD Test N 211:2012* "Руководство по испытанию химических веществ. Испытание репродуктивной способности Daphnia magna" ("Guideline for Testing of Chemicals. Daphnia magna Reproduction Test", MOD) путем:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- включения дополнительных раздела 1 и подраздела 2.2, которые выделены в тексте курсивом;
- изменения его структуры для приведения в соответствие с правилами, установленными в ГОСТ 1.5 (подразделы 4.2 и 4.3).
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ 32367-2013
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Руководства Организации экономического сотрудничества и развития (OECD) по испытаниям химических веществ периодически пересматриваются в связи с научным прогрессом. Было установлено, что результаты испытаний, проведенных в соответствии с Руководством 202, Часть II "Анализ репродуктивной способности Daphnia sp." (принятым в апреле 1984 г.), могут носить изменчивый характер. В связи с этим была проведена большая работа по выявлению причин расхождений для усовершенствования метода испытаний. Новая редакция документа основана на результатах исследований и межлабораторных круговых испытаний, проведенных в 1992 г., 1994 г.
![]() и 2008 г.
и 2008 г.![]() .
.
________________
См. [1].
![]() См. [2].
См. [2].
![]() См. [3].
См. [3].
Основными различиями между первой (1984 г.) и второй (1998 г.) редакциями руководства являются:
a) рекомендуемым для использования видом животных является Daphnia magna;
b) продолжительность испытаний составляет 21 день;
c) для полустатических испытаний число особей, используемых при каждой исследуемой концентрации, сокращено до 40 и рекомендуется их разделение на четыре группы по 10 животных, чтобы не менее 10 особей содержались отдельно [однако для динамических (проточных) испытаний можно использовать разные схемы];
d) даны более конкретные рекомендации в отношении питательной среды и условий кормления.
Основные различия между версией 1998 г. и настоящей версией:
e) в 2008 г. в документ было введено приложение F для описания идентификации пола новорожденного животного, при необходимости. Как и в предыдущих версиях, соотношение полов в этом руководстве не является критическим параметром;
f) в 2012 г. итоговая переменная числа живого потомства, произведенного на один выживший родительский организм, была дополнена другой итоговой переменной по размножению Daphnia magna - общим числом живого потомства, воспроизведенного в конце испытания, на одну родительскую особь в начале испытания, исключая из анализа случайную и/или непреднамеренную смертность родительских особей. Целью ввода дополнительной переменной отклика является приведение данных в соответствие с другими руководствами OECD по воспроизводству беспозвоночных. Кроме того, настоящее руководство позволяет устранить источник ошибки, касающийся этой переменной отклика, а именно влияние случайной и/или непреднамеренной смертности родительских особей, если она произойдет во время периода воздействия;
g) дополнительные статистические указания для плана испытания и обработки результатов были включены как для ![]() (например,
(например, ![]() или
или ![]() ), так и для NOEC/LOEC;
), так и для NOEC/LOEC;
h) дополнительно включено проведение испытаний с использованием предельной дозы.
1 Область применения
Настоящий стандарт устанавливает методы испытаний для определения токсичности химических веществ путем угнетения репродуктивной способности Дафнии магна (далее - Daphnia magna).
2 Термины, определения и сокращения
2.1 В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1.1 результаты репродуктивности (reproductive output): Число живого потомства, полученного от родительских особей в течение периода испытаний.
2.1.2 родительские особи (parent animals): Самки Daphnia magna в начале испытания, репродуктивная способность которых является объектом исследования.
2.1.3 потомство (offspring): Молодые особи Daphnia magna, воспроизведенные родительской особью в ходе испытания.
2.1.4 случайная смертность (accidental mortality): Смертность, не связанная с воздействием исследуемого химического вещества, вызванная случайным инцидентом (т.е. известной причиной).
2.1.5 непреднамеренная смертность (inadvertent mortality): Смертность, не связанная с воздействием исследуемого химического вещества, вызванная неизвестной причиной.
2.1.6 наименьшая наблюдаемая эффективная концентрация [Lowest Observed Effect Concentration (LOEC)]: Минимальная концентрация исследуемого химического вещества, при которой в течение установленного периода воздействия наблюдается статистически значимое воздействие на воспроизводство и смертность родительских особей (при p<0,05) по сравнению с контролем.
Примечание - Все концентрации исследуемого химического вещества выше LOEC должны оказывать вредное воздействие, равное или большее, чем наблюдаемое при LOEC. Если эти два условия не выполняются, следует привести полное объяснение выбора именно этого значения LOEC (и соответственно NOEC).
2.1.7 концентрация ненаблюдаемого эффекта [No Observed Effect Concentration (NOEC)]: Концентрация исследуемого химического вещества ниже значения LOEC, которая в течение установленного периода воздействия не оказывает статистически значимого эффекта (при p<0,05) по сравнению с контролем.
2.1.8 ![]() : Концентрация растворенного в воде исследуемого вещества, которая в течение установленного периода воздействия приводит к снижению воспроизводства Daphnia magna на х процентов.
: Концентрация растворенного в воде исследуемого вещества, которая в течение установленного периода воздействия приводит к снижению воспроизводства Daphnia magna на х процентов.
2.1.9 естественный темп прироста популяции (intrinsic rate of population increase): Количественная оценка прироста популяции, объединяющая результаты репродуктивности и возрастной смертности.
________________
См. [4]-[6].
Примечание - Эта оценка будет равна нулю в устойчивых популяциях, положительной - в растущих популяциях и отрицательной - в сокращающихся популяциях. Последняя категория популяций является неустойчивой и в конечном счете обречена на вымирание.
2.1.10 предел обнаружения (limit of detection): Самая низкая концентрация вещества, которая может быть обнаружена, но не определена количественно.
2.1.11 предел определения (limit of determination): Самая низкая концентрация вещества, которая может быть определена количественно.
2.1.12 смертность (mortality): Состояние животного, когда его регистрируют как мертвое, т.е. когда оно неподвижно (не в состоянии плавать) или у него отсутствует движение конечностей или постабдомена в течение 15 с после легкого взбалтывания содержимого испытательного сосуда.
Примечание - При использовании другого определения об этом следует сообщить, указав ссылку на источник.
2.2 В настоящем стандарте использованы следующие сокращения:
pKa - отрицательный десятичный логарифм константы диссоциации;
COD - химическое потребление кислорода;
LOEC - наименьшая наблюдаемая эффективная концентрация (см. 2.1.6);
NOEC - концентрация ненаблюдаемого эффекта (см. 2.1.7);
TOC - общее содержание органического углерода;
TW-mean - средневзвешенное по времени значение.
3 Основные положения
3.1 Целью проведения испытаний является оценка воздействия химической продукции на репродуктивную функцию Daphnia magna. Для этого молодых самок Daphnia magna (родительские особи) в возрасте не более 24 ч в начале испытания подвергают воздействию исследуемого химического вещества, добавленного в воду в разных концентрациях. Продолжительность испытания составляет 21 день. В конце испытания оценивают общее число выжившего потомства. Результаты репродуктивности родительских особей можно выразить разными способами (например, числом живого потомства, произведенного животным в день, начиная с первого дня наблюдений), но эти данные необходимо указывать дополнительно к общему числу живого потомства, полученного в конце испытания. Из-за особой схемы полустатических испытаний по сравнению с другими руководствами по размножению беспозвоночных можно подсчитать число живого потомства, воспроизведенного каждой отдельной родительской особью. В отличие от других испытаний этот способ позволяет исключить потомство из оценки данных, если родительская особь умирает случайно и/или непреднамеренно в течение периода испытаний. В связи с этим (при наличии смертности родительских особей в параллельных испытаниях при воздействии химического вещества) следует рассмотреть вопрос о зависимости смертности от концентрации исследуемого вещества в испытании концентрация - ответ, например при наличии значительной регрессии отклика с положительным углом наклона (для этого можно использовать статистический анализ, подобный тренд-тесту Cochran - Armitage). При смертности, не соответствующей схеме концентрация - ответ, результаты этих параллельных испытаний со смертностью родительских особей должны быть исключены из анализа результатов испытаний. Если смертность соответствует схеме концентрация - ответ, смертность родительских особей относят к воздействию исследуемого вещества и результаты параллельных испытаний из анализа не исключают. Если родительская особь случайно умирает во время испытания от неправильного обращения, или от несчастного случая, или непреднамеренно из-за необъяснимого инцидента, не связанного с воздействием исследуемого вещества, или оказывается самцом, то параллельное исследование исключают из анализа (см. 8.1.1). Токсическое воздействие исследуемого вещества на результаты репродуктивности выражают в виде ![]() путем аппроксимации данных к соответствующей модели с использованием нелинейной регрессии для оценки концентрации, которая может вызвать снижение результатов репродуктивности на х процентов соответственно или альтернативно в виде значений NOEC/LOEC
путем аппроксимации данных к соответствующей модели с использованием нелинейной регрессии для оценки концентрации, которая может вызвать снижение результатов репродуктивности на х процентов соответственно или альтернативно в виде значений NOEC/LOEC. Исследуемые концентрации вещества предпочтительно должны охватывать диапазон значений минимальной использованной эффективной концентрации (например,
![]() ), и, следовательно, это значение вычисляют путем интерполяции, а не экстраполяции.
), и, следовательно, это значение вычисляют путем интерполяции, а не экстраполяции.
________________
См. [7].
3.2 Также следует приводить данные о выживании родительских особей и времени появления первого потомства. Другие параметры, связанные с воздействием вещества, такие как рост (например, длина) и возможный естественный темп прироста популяции, также могут быть рассмотрены (см. 7.5).
4 Информация об исследуемом веществе
4.1 Результаты испытаний на острую токсичность![]() , проведенных с помощью Daphnia magna, могут быть полезны при выборе подходящего диапазона исследуемых концентраций в испытаниях на репродуктивность. Должны быть известны растворимость в воде и давление паров исследуемого вещества и доступен надежный аналитический метод количественного определения содержания вещества в испытуемых растворах с заявленной эффективностью извлечения и пределом определения.
, проведенных с помощью Daphnia magna, могут быть полезны при выборе подходящего диапазона исследуемых концентраций в испытаниях на репродуктивность. Должны быть известны растворимость в воде и давление паров исследуемого вещества и доступен надежный аналитический метод количественного определения содержания вещества в испытуемых растворах с заявленной эффективностью извлечения и пределом определения.
________________
![]() См. ГОСТ 32536-2020 "Методы испытаний химической продукции, представляющей опасность для окружающей среды. Определение острой токсичности для дафний".
См. ГОСТ 32536-2020 "Методы испытаний химической продукции, представляющей опасность для окружающей среды. Определение острой токсичности для дафний".
4.2 Информация об исследуемом веществе, которая может быть полезна при установлении условий испытания, включает структурную формулу, чистоту вещества, стабильность на свету, стабильность в условиях испытания, pKa, ![]() (коэффициент распределения октанол - вода) и результаты испытаний на полную биоразлагаемость
(коэффициент распределения октанол - вода) и результаты испытаний на полную биоразлагаемость![]() .
.
________________
![]() См. [22], [23].
См. [22], [23].
5 Достоверность метода
Для обеспечения достоверности результатов испытаний в контроле(ях) должны быть соблюдены следующие критерии эффективности:
- смертность родительских особей (самок дафний) не должна превышать 20% в конце испытания;
- среднее число живых потомков, полученных от родительских особей, выживших в конце испытания, должно составлять не менее 60.
Примечание - Один и тот же критерий достоверности (20%) можно использовать для случайной и непреднамеренной родительских смертностей в контролях, а также для каждой из исследуемых концентраций химических веществ.
6 Описание метода
6.1 Оборудование
6.1.1 Испытательные сосуды и другие приспособления, вступающие в контакт с исследуемыми растворами, должны быть изготовлены из стекла или другого химически инертного материала. Испытательные сосуды обычно представляют собой стеклянные мерные стаканы.
6.1.2 Кроме того, необходимо дополнительное оборудование:
- прибор для измерения содержания кислорода (с микроэлектродом или другим подходящим устройством для измерения растворенного кислорода в небольших объемах);
- оборудование для контроля температуры;
- рН-метр;
- устройство для определения жесткости воды;
- оборудование для определения концентрации общего органического углерода (TOC) в воде или оборудование для определения химического потребления кислорода (COD);
- оборудование для контроля режима освещения и измерения интенсивности света.
6.2 Подопытные организмы
6.2.1 Видом, использованным в испытании, является Daphnia magna Straus.
________________
Можно использовать другие виды Daphnia, если они отвечают критериям пригодности (критерий касается результатов репродуктивности в контроле, и все виды должны ему соответствовать). При использовании других видов Daphnia они должны быть четко идентифицированы и их применение обосновано.
6.2.2 По возможности клон следует идентифицировать путем генотипирования. Проведенные исследования![]() показали, что репродуктивная способность клона А (полученного из IRCHA во Франции
показали, что репродуктивная способность клона А (полученного из IRCHA во Франции![]() ) стабильно соответствует критерию пригодности среднего значения не менее 60 живых потомков на одну родительскую особь, выживающих при культивировании в условиях настоящего стандарта. Можно использовать и другие клоны, если продемонстрировано, что культура Daphnia magna соответствует критериям пригодности для испытания.
) стабильно соответствует критерию пригодности среднего значения не менее 60 живых потомков на одну родительскую особь, выживающих при культивировании в условиях настоящего стандарта. Можно использовать и другие клоны, если продемонстрировано, что культура Daphnia magna соответствует критериям пригодности для испытания.
________________
![]() См. [1].
См. [1].
![]() См. [8].
См. [8].
6.2.3 В начале испытания возраст животных должен быть не более 24 ч, и они не должны относиться к первому поколению. Они должны быть получены от здоровой популяции (т.е. не иметь таких признаков стресса, как высокая смертность, наличие самцов и эфиппий, задержка производства первого поколения, обесцвеченные животные и т.д.). Условия культивирования животных (освещенность, температура, среда, кормление и число животных на единицу объема) должны быть аналогичными условиям, используемым при испытании. Если культуральная среда, используемая в испытании для Daphnia magna, отличается от обычной среды культивирования Daphnia magna, для предотвращения стресса родительских особей перед проведением испытания следует включить период адаптации приблизительно три недели (т.е. одно поколение).
6.3 Среда для культивирования
6.3.1 При проведении испытаний рекомендуется использовать среду определенного состава. Это позволит избежать попадания примесей (например, морских водорослей, почвенного экстракта), характеристики которых трудно определить, и расширит возможности стандартизации между лабораториями. Было установлено, что наиболее подходящими для этих целей являются среды Элендт (Elendt) М4![]() и М7 (см. приложение А). Однако и другие среды
и М7 (см. приложение А). Однако и другие среды![]() являются приемлемыми при условии, что продуктивность культуры Daphnia magna соответствует критериям пригодности для испытания.
являются приемлемыми при условии, что продуктивность культуры Daphnia magna соответствует критериям пригодности для испытания.
________________
![]() См. [9].
См. [9].
![]() См. [10], [11].
См. [10], [11].
6.3.2 При использовании сред, содержащих неопределяемые компоненты, они должны быть четко идентифицированы, и информация о них должна быть представлена в отчете об испытаниях. Особенно это касается содержания углерода, поскольку он может влиять на режим питания. Рекомендуется определить значение TOC и/или COD в исходном препарате органической добавки для оценки вклада TOC/COD в исследуемую среду. Также рекомендуется, чтобы содержание TOC в среде (т.е. перед внесением водорослей) было не более 2 мг/дм![]() *.
*.
________________
![]() См. [8].
См. [8].
![]() См. [12].
См. [12].
* Текст документа соответствует оригиналу. Здесь и далее. - .
6.3.3 При испытании веществ, содержащих металлы, важно понимать, что свойства среды для культивирования (например, жесткость, хелатообразующая способность) могут оказывать влияние на токсичность исследуемого вещества. Поэтому желательно использовать среду с полностью определенным составом. Однако в настоящее время единственными средами с полностью определенным составом, которые пригодны для долгоживущей культуры Daphnia magna, являются Elendt M4 и M7. Обе среды содержат хелатообразующий агент ЭДТА. Проведенные исследования![]() показали, что "очевидная токсичность" кадмия, как правило, ниже при выполнении испытаний в средах М4 и М7, чем в средах, не содержащих ЭДТА. Поэтому среды М4 и М7 не рекомендуется применять для испытания веществ, содержащих металлы, а также следует избегать использования других сред, содержащих известные хелатообразующие агенты. Для металлсодержащих веществ целесообразно использовать альтернативную среду, такую как, например, восстановленная жесткая пресная вода по нормативному документу
показали, что "очевидная токсичность" кадмия, как правило, ниже при выполнении испытаний в средах М4 и М7, чем в средах, не содержащих ЭДТА. Поэтому среды М4 и М7 не рекомендуется применять для испытания веществ, содержащих металлы, а также следует избегать использования других сред, содержащих известные хелатообразующие агенты. Для металлсодержащих веществ целесообразно использовать альтернативную среду, такую как, например, восстановленная жесткая пресная вода по нормативному документу![]() , не содержащая ЭДТА. Комбинация восстановленной жесткой пресной воды и экстракта морских водорослей
, не содержащая ЭДТА. Комбинация восстановленной жесткой пресной воды и экстракта морских водорослей пригодна для длительного выращивания Daphnia magna
![]() .
.
________________
![]() См. [2].
См. [2].
![]() См. [12].
См. [12].
См. [13].
![]() См. [2].
См. [2].
6.3.4 Концентрация растворенного кислорода должна быть не менее 3 мг/дм в начале и во время испытания. Значение рН должно быть в диапазоне от 6 до 9, и обычно оно не должно изменяться более чем на 1,5 единицы в любом испытании. Рекомендуется жесткость воды более 140 мг/дм
(по
![]() ). Испытания на этом уровне и выше продемонстрировали репродуктивную способность, соответствующую критериям достоверности
). Испытания на этом уровне и выше продемонстрировали репродуктивную способность, соответствующую критериям достоверности![]() .
.
________________
![]() См. [14], [15].
См. [14], [15].
6.4 Растворы для испытаний
6.4.1 Растворы для испытания выбранных концентраций обычно готовят разбавлением исходного раствора. Исходные растворы по возможности готовят без использования растворителей или диспергаторов путем перемешивания или встряхивания исследуемого вещества в среде для культивирования с использованием механических средств, таких как мешалки и качалки, или обработкой ультразвуком, или другим соответствующим методом. Систему для проведения испытаний подвергают воздействию концентрации исследуемого вещества до тех пор, пока не будет продемонстрировано поддержание стабильных концентраций до введения подопытных организмов. Если исследуемое вещество трудно растворяется в воде, используют процедуры, приведенные в документе![]() . Следует избегать использования растворителей или диспергаторов, но в некоторых случаях это может быть необходимым для получения подходящего концентрированного исходного раствора для воздействия.
. Следует избегать использования растворителей или диспергаторов, но в некоторых случаях это может быть необходимым для получения подходящего концентрированного исходного раствора для воздействия.
________________
![]() См. [16].
См. [16].
6.4.2 В дополнение к испытаниям исследуемых концентраций проводят параллельный контроль воды для разбавления и (если неизбежно его использование) соответствующий параллельный контроль растворителя. При проведении испытаний используют только растворители или диспергаторы, которые, как было показано, не оказывают существенного воздействия или оказывают только минимальное воздействие на переменную ответа. Примеры подходящих растворителей (например, ацетон, этанол, метанол, диметилформамид и триэтиленгликоль) и диспергаторов [например, кремофор RH 40 (HCO-40), 0,01%-ная метилцеллюлоза] приведены в документе![]() . При использовании растворителей или диспергаторов их конечная концентрация не должна превышать 0,1 см
. При использовании растворителей или диспергаторов их конечная концентрация не должна превышать 0,1 см/дм
![]() и должна быть одинаковой во всех испытательных сосудах, кроме контроля воды для разбавления. Следует приложить усилия, чтобы концентрация растворителя была минимальной.
и должна быть одинаковой во всех испытательных сосудах, кроме контроля воды для разбавления. Следует приложить усилия, чтобы концентрация растворителя была минимальной.
________________
![]() См. [14], [15].
См. [14], [15].
![]() См. [2].
См. [2].
![]() См. [2].
См. [2].
7 Проведение испытаний
7.1 Условия воздействия
7.1.1 Продолжительность испытания
Продолжительность испытания составляет 21 день.
7.1.2 Отсадка (размещение) особей
7.1.2.1 Родительских особей содержат отдельно, по одной на каждый испытательный сосуд, вмещающий обычно от 50 до 100 см среды (для Daphnia magna можно использовать сосуды меньшей вместимости, особенно для небольших дафний, например Ceriodaphnia dubia), если для проведения испытания не требуется проточная схема.
7.1.2.2 Иногда могут потребоваться ![]() объемы для удовлетворения требований аналитической процедуры, используемой для определения концентрации исследуемого вещества, но для проведения химического анализа также допустимо объединение параллельных контролей. При использовании объемов, превышающих 100 см
объемы для удовлетворения требований аналитической процедуры, используемой для определения концентрации исследуемого вещества, но для проведения химического анализа также допустимо объединение параллельных контролей. При использовании объемов, превышающих 100 см, может потребоваться увеличение порции корма для Daphnia magna в целях обеспечения достаточной доступности пищи и соответствия критериям пригодности.
7.1.3 Подопытные особи (организмы)
7.1.3.1 При проведении полустатических испытаний не менее 10 особей содержат индивидуально при каждой испытуемой концентрации и не менее 10 особей содержат индивидуально в контрольной группе.
7.1.3.2 Было показано, что при проведении проточных испытаний можно использовать 40 особей, разделенных на четыре группы по 10 особей для каждой испытуемой концентрации. Допускается использовать меньшее число подопытных особей, но рекомендуется использовать не менее 20 особей на концентрацию, разделенных на две или более групп с равным числом особей (например, четыре параллельные группы по пять Daphnia magna в каждой). Следует отметить, что при проведении испытаний, в которых особи содержатся группами, будет невозможно исключить любое потомство из статистического анализа, если произойдет непреднамеренная/случайная смертность материнской особи, когда началось размножение, и, следовательно, в этих случаях результат репродуктивности должен быть выражен как общее количество живого потомства, произведенного на одну родительскую особь, присутствующую в начале испытания.
________________
См. [1].
7.1.3.3 Отсадка (размещение) особей в испытательные сосуды должна происходить случайным образом, как и вся последующая обработка. В противном случае это может привести к неточным результатам, которые могут быть интерпретированы как результаты, зависящие от концентрации. При этом ошибки, связанные с усталостью оператора, или другие ошибки при обращении с подопытными организмами (при обработке), или порядок назначения концентрации и некоторые связанные со временем эффекты могут привести к более сильным воздействиям при более высоких концентрациях. Кроме того, если на результаты испытания может оказать влияние исходное состояние или условия окружающей среды, например расположение в лаборатории, следует рассмотреть возможность приостановки испытания.
7.1.4 Кормление
7.1.4.1 При полустатических испытаниях кормление желательно проводить ежедневно, но не менее трех раз в неделю (т.е. оно должно совпадать с обновлением среды). Следует принимать во внимание возможное разбавление воздействующих концентраций при добавлении пищи и избегать, по возможности, использования концентрированных суспензий водорослей из источника. О любых отклонениях от этого правила (например, при динамических испытаниях) следует сообщать в отчете.
7.1.4.2 Во время испытания рацион питания материнских особей должен состоять из живых одноклеточных водорослей (одного вида или более) следующих видов: Chlorella sp, Pseudokirchneriella subcapitata (ранее - Selenastrum capricornutum) и Desmodesmus subspicatus (ранее - Scenedesmus subspicatus). Каждая родительская особь должна быть обеспечена питанием на основе количества органического углерода (С). Исследования показали, что для Daphnia magna![]() уровень рациона от 0,1 до 0,2 мг C на дафнию в день достаточен для обеспечения необходимого количества живого потомства, соответствующего критериям достоверности испытания. Можно поддерживавать постоянный уровень питания в течение всего испытания или, если это будет сочтено целесообразным, в начале испытания можно использовать более низкую норму, а затем ее увеличивать с учетом роста родительских особей. В любом случае уровень рациона должен оставаться в рекомендованном диапазоне от 0,1 до 0,2 мг C на дафнию в день.
уровень рациона от 0,1 до 0,2 мг C на дафнию в день достаточен для обеспечения необходимого количества живого потомства, соответствующего критериям достоверности испытания. Можно поддерживавать постоянный уровень питания в течение всего испытания или, если это будет сочтено целесообразным, в начале испытания можно использовать более низкую норму, а затем ее увеличивать с учетом роста родительских особей. В любом случае уровень рациона должен оставаться в рекомендованном диапазоне от 0,1 до 0,2 мг C на дафнию в день.
________________
![]() См. [17].
См. [17].
7.1.4.3 При использовании косвенных методов измерения необходимого количества углерода в рационе, таких как определение количества клеток водорослей или поглощения света (используемых для удобства, поскольку измерение содержания углерода требует много времени), каждая лаборатория должна подготовить собственную номограмму для косвенных методов измерения содержания углерода в культурах водорослей (см. приложение Б). Номограммы проверяют не менее одного раза в год и чаще при изменении условий культивирования водорослей. Было установлено, что поглощение света является лучшим косвенным методом измерения содержания углерода, чем количество клеток![]() .
.
________________
![]() См. [18].
См. [18].
7.1.4.4 Кормление Daphnia magna осуществляют концентрированной суспензией водорослей для минимизации объема культуральной среды водорослей, вносимых в испытательные сосуды. Концентрирование водорослей может быть обеспечено центрифугированием с последующим суспендированием в культуральной среде Daphnia magna.
7.1.5 Освещение
Требования к освещению: 16 ч света при интенсивности, не превышающей 15-20 мкЭ·м·с
, измеренной на поверхности воды сосуда. Для светоизмерительных приборов, откалиброванных в люксах, эквивалентный диапазон 1000-1500 люкс для холодного белого света соответствует близкой к рекомендуемой интенсивности света от 15 до 20 мкЭ·м
·с
.
7.1.6 Температура
Температура испытуемой среды должна быть от 18°С до 22°С. Однако во время одного испытания температура не должна изменяться более чем на 2°С в указанных пределах, например: от 18°С до 20°С, от 19°С до 21°С или от 20°С до 22°С. Может быть целесообразным использование дополнительного испытательного сосуда для контроля температуры.
7.1.7 Аэрация
Испытательные сосуды не аэрируют во время испытания.
7.1.8 Схема испытания
7.1.8.1 Испытания по определению диапазона концентраций
7.1.8.1.1 При необходимости проводят испытания по определению диапазона концентраций, например с пятью концентрациями исследуемого вещества, с двумя параллельными опытами для каждого уровня концентрации и с контролем. Для определения концентраций, которые будут использоваться в испытании по определению диапазона концентраций, может быть полезна дополнительная информация, полученная при испытаниях со структурно родственными соединениями или из литературных источников об острой токсичности для Daphnia magna и/или других водных организмов.
7.1.8.1.2 Продолжительность испытания по определению диапазона концентраций составляет 21 день или другой период времени, достаточный для надежного прогнозирования уровней воздействия. В конце испытания оценивают репродуктивность Daphnia magna. Регистрируют число родительских особей и появление потомства.
7.1.8.2 Определительные испытания
7.1.8.2.1 Обычно используют не менее пяти испытуемых концентраций, охватывающих диапазон эффективной концентрации (например, ![]() ), расположенных в виде геометрической прогрессии с коэффициентом распределения, не превышающим 3,2. При этом используют соответствующее количество параллельных опытов для каждой испытуемой концентрации (см. 7.1.3.2, 7.1.3.3). При использовании менее пяти концентраций должно быть представлено обоснование. Не следует проводить испытания веществ выше предела их растворимости в испытуемой среде. Перед проведением испытания следует рассмотреть статистическую мощность плана испытаний и использование соответствующих статистических методов
), расположенных в виде геометрической прогрессии с коэффициентом распределения, не превышающим 3,2. При этом используют соответствующее количество параллельных опытов для каждой испытуемой концентрации (см. 7.1.3.2, 7.1.3.3). При использовании менее пяти концентраций должно быть представлено обоснование. Не следует проводить испытания веществ выше предела их растворимости в испытуемой среде. Перед проведением испытания следует рассмотреть статистическую мощность плана испытаний и использование соответствующих статистических методов. При определении диапазона концентраций учитывают:
________________
См. [7].
1) при оценке ![]() , воздействующей на репродукцию, рекомендуется использовать концентрации, достаточные для определения значения
, воздействующей на репродукцию, рекомендуется использовать концентрации, достаточные для определения значения ![]() с соответствующим уровнем достоверности. Концентрации, используемые при испытании, должны охватывать диапазон предполагаемого значения
с соответствующим уровнем достоверности. Концентрации, используемые при испытании, должны охватывать диапазон предполагаемого значения ![]() , чтобы его значение находилось путем интерполяции, а не экстраполяции. Преимущество для дальнейшего статистического анализа состоит в том, чтобы иметь дополнительно количество испытуемых концентраций (например, 10) и меньше повторов каждой концентрации (например, 5, сохраняя таким образом постоянным общее количество сосудов), а также 10 контролей;
, чтобы его значение находилось путем интерполяции, а не экстраполяции. Преимущество для дальнейшего статистического анализа состоит в том, чтобы иметь дополнительно количество испытуемых концентраций (например, 10) и меньше повторов каждой концентрации (например, 5, сохраняя таким образом постоянным общее количество сосудов), а также 10 контролей;
2) при оценке значений LOEC и/или NOEC самая низкая испытуемая концентрация должна быть достаточно низкой для того, чтобы результаты репродуктивности при этой концентрации не были значительно ниже, чем в контроле. В противном случае повторяют испытание с более низкой концентрацией;
3) при оценке значений LOEC и/или NOEC максимальная испытуемая концентрация должна быть достаточно высокой для того, чтобы результаты репродуктивности при этой концентрации были значительно ниже, чем в контроле. В противном случае повторяют испытание с повышенной максимальной концентрацией, если в качестве максимальной испытуемой концентрации в первоначальном испытании не была использована максимальная концентрация для испытания на хронические эффекты (т.е. 10 мг/дм).
7.1.8.2.2 Если в испытании по определению диапазона доз не наблюдают никаких эффектов при максимальной концентрации (например, при 10 мг/дм) или исследуемое вещество с высокой вероятностью будет иметь низкую/нулевую токсичность из-за отсутствия токсичности для других организмов и/или из-за низкого/нулевого поглощения (накопления), испытание по определению нарушения репродуктивной функции может быть выполнено как испытание предельной дозы с использованием концентрации (например, 10 мг/дм
) и контроля. Следует использовать десять параллельных опытов для воздействия и для контрольных групп. При выполнении испытания предельной дозы в проточной системе может потребоваться меньшее количество параллельных опытов. Испытание предельной дозы позволит продемонстрировать отсутствие статистически значимого эффекта при предельной концентрации, но при регистрации результатов обычно требуется проведение полного испытания.
7.1.9 Контроли
7.1.9.1 В дополнение к серии испытаний (указанных выше) следует провести серию контрольных испытаний питательной среды и, при необходимости, серию контрольных испытаний среды, содержащей растворитель или диспергатор. При этом концентрация растворителя или диспергатора должна быть такой, как в сосудах, содержащих исследуемое вещество. Число параллельных испытаний должно соответствовать 7.1.3.1 и 7.1.3.2.
7.1.9.2 Как правило, в хорошо проведенном испытании коэффициент вариации среднего числа живого потомства, произведенного на одну родительскую особь в контроле(ях), должен составлять не более 25%, и это следует указывать при планировании испытаний с индивидуально содержащимися организмами.
7.1.10 Обновление испытуемой среды
7.1.10.1 Частота обновления среды зависит от стабильности исследуемого вещества, но обновление среды следует проводить не менее трех раз в неделю. Если по результатам предварительных испытаний на стабильность по 4.2 исследуемое вещество в используемых концентрациях неустойчиво (т.е. его концентрация выходит за пределы диапазона от 80% до 120% номинальной концентрации или падает ниже 80% начальной концентрации) в течение максимального периода обновления среды (три дня), то обновление следует проводить чаще или использовать динамический (проточный) метод.
7.1.10.2 Если обновление среды проводят в полустатических испытаниях, то готовят вторую серию испытательных сосудов и пересаживают туда родительских особей с использованием, например, стеклянной пипетки подходящего диаметра. Объем среды, переносимой с Daphnia magna, должен быть минимальным.
7.2 Наблюдения
Результаты наблюдений регистрируют в протоколе испытаний (примеры приведены в приложениях В и Г). При необходимости проведения других измерений (см. 7.5) может потребоваться проведение дополнительных наблюдений.
7.3 Потомство
Потомство, произведенное каждой родительской особью, удаляют и ежедневно подсчитывают от момента появления первого потомства для предотвращения потребления ими пищи, предназначенной для родительских особей. Для целей настоящего стандарта подсчитывают только число живых особей, но регистрируют также наличие несозревших яиц или мертвого потомства.
7.4 Смертность
Смертность родительских особей желательно регистрировать ежедневно и одновременно с подсчетом потомства.
7.5 Другие параметры
Несмотря на то, что настоящий стандарт предназначен в первую очередь для оценки воздействия вещества на результаты репродуктивности, можно также определить и другие эффекты, позволяющие провести количественный статистический анализ. Результатом репродуктивности является зарегистрированное число живого потомства, произведенного во время испытания, на выжившую родительскую особь. Это можно сравнить с основной переменной ответа (результат репродуктивности на родительскую особь в начале испытания, которая непреднамеренно или случайно не погибла во время испытания). При наличии родительской смертности в параллельных испытаниях особей, подвергнутых воздействию исследуемого химического вещества, следует рассмотреть вопрос о том, соответствует ли смертность схеме концентрация - ответ, например при наличии значительной регрессии отклика в зависимости от концентрации исследуемого вещества с положительным наклоном (для этого можно использовать статистический тренд-тест Cochran - Armitage). Если смертность соответствует схеме концентрация - ответ, родительская смертность должна быть указана как влияние исследуемого вещества, и параллельные испытания не следует исключать из анализа результатов испытания. Измерения показателей роста очень желательны, поскольку они предоставляют информацию о возможных сублетальных эффектах и могут быть полезны в дополнение к измерению репродуктивности. В конце испытания рекомендуется измерение длины родительских особей (то есть длины тела без учета хвостовой иглы). Другие параметры, которые можно измерить или рассчитать, учитывают время для производства первого потомства (и последующих потомств), число и размер потомства на один организм, количество несозревших яиц, наличие новорожденных самцов или число эфиппий и, возможно, естественный темп прироста популяции (определение пола приведено в приложении Е).
7.6 Частота аналитических определений и измерений
7.6.1 Концентрацию кислорода, температуру, жесткость и рН измеряют не менее одного раза в неделю в свежеприготовленных и старых (перед обновлением) средах, в контроле(ях) и при самой высокой концентрации исследуемого вещества.
7.6.2 Во время испытаний периодически определяют концентрации исследуемого вещества.
7.6.3 При проведении полустатических испытаний концентрация исследуемого вещества должна оставаться в пределах ±20% номинального значения (т.е. от 80% до 120% в соответствии с 4.1, 4.2 и 7.1.10.1). Ее определяют для свежеприготовленных растворов максимальной и минимальной испытуемых концентраций и один раз - при обновлении в течение первой недели испытания (т.е. анализы должны быть проведены на образце одного и того же раствора - свежеприготовленного и обновленного). После этого эти определения повторяют не менее одного раза в неделю.
7.6.4 При проведении испытаний, в которых не предполагается, что концентрация исследуемого вещества будет сохраняться в пределах ±20% номинального значения, необходимо проанализировать все испытуемые концентрации свежеприготовленных и обновленных растворов. В тех ситуациях, когда установленная начальная концентрация исследуемого вещества не находится в пределах ±20% номинального значения, но были предоставлены достаточные доказательства, показывающие, что исходные концентрации являются воспроизводимыми и стабильными (т.е. в пределах от 80% до 120% исходных концентраций), химические определения на второй и третьей неделях могут быть сокращены до проведения испытаний максимальной и минимальной испытуемых концентраций. Во всех случаях определение концентраций исследуемого вещества до обновления проводят только в одном параллельном сосуде для каждой испытуемой концентрации.
7.6.5 При использовании динамического метода испытания режим отбора проб аналогичен приведенному для полустатических испытаний [но в этом случае измерение старых (перед обновлением) растворов не применимо]. Однако может быть целесообразным увеличение количества отборов проб в течение первой недели (например, три серии измерений) для подтверждения стабильности испытуемых концентраций. При проведении этих испытаний скорость потока разбавителя и исследуемого вещества проверяют ежедневно.
7.6.6 Если документально подтверждено, что концентрация исследуемого вещества удовлетворительно поддерживалась в пределах ±20% номинального значения или измеренной начальной концентрации на всех этапах испытания, то результаты могут быть основаны на номинальных или измеренных начальных значениях. Если отклонение от номинального значения или измеренной начальной концентрации превышает ±20%, результаты должны быть выражены в виде средневзвешенного по времени значения (руководство для его вычисления приведено в приложении Д).
8 Результаты и подготовка отчета
8.1 Обработка результатов
8.1.1 Целью настоящего стандарта является определение влияния исследуемого вещества на результаты репродуктивности. Для каждого испытательного сосуда (т.е. для параллельных испытаний) должно быть вычислено общее число живого потомства на родительскую особь. Кроме того, репродуктивность может быть вычислена на основе продуцирования живого потомства выжившим родительским организмом. Однако наиболее релевантной экологической характеристикой является общее число живого потомства, произведенного на одно родительское животное, которое не погибает случайно или непреднамеренно (см. 2.1.4 и 2.1.5). Если во время испытания родительская особь умирает случайно или непреднамеренно или оказывается самцом, этот сосуд исключают из испытания. В таком случае результаты исследования будут основаны на уменьшенном количестве параллельных испытаний. Если смертность родительской особи происходит в подвергающихся воздействию параллельных испытаниях, следует рассмотреть вопрос о соответствии смертности схеме концентрация - ответ, например, если существует значительная регрессия отклика в зависимости от концентрации исследуемого вещества с положительным наклоном (можно использовать статистический анализ, например тренд-тест Cochran - Armitage). Если смертность не соответствует схеме концентрация - ответ, то параллельные опыты со смертностью родительской особи исключают из анализа результатов испытания. Если смертность соответствует схеме концентрация - ответ, смертность родительской особи должна быть отнесена к влиянию исследуемого вещества, и параллельный опыт не исключают из анализа результатов испытания.
8.1.2 Таким образом, если для выражения воздействия используют LOEC и NOEC или ![]() , рекомендуется вычислять влияние на репродуктивность с использованием обеих переменных отклика, приведенных выше, таких как:
, рекомендуется вычислять влияние на репродуктивность с использованием обеих переменных отклика, приведенных выше, таких как:
- общее число живого потомства, продуцированного на родительскую особь, которая не погибла случайно или непреднамеренно во время испытания;
- число продуцированного живого потомства на выжившую родительскую особь.
Полученные значения используют затем в качестве конечного результата минимальных значений NOEC и LOEC или ![]() , вычисленного с использованием любой из этих двух переменных отклика.
, вычисленного с использованием любой из этих двух переменных отклика.
8.1.3 Перед использованием статистического анализа, например дисперсионного анализа ANOVA, сравнение результатов воздействия с контролем по критерию Стьюдента, тестом Даннетта, тестом Уильямса или тестом Джонкира-Терпстры с пошаговым снижением рекомендуется рассмотреть преобразование данных, если это необходимо для удовлетворения требований конкретного статистического метода. В качестве непараметрических альтернатив можно рассмотреть тесты Данна или Манна-Уитни. Для индивидуальных исследуемых веществ вычисляют 95%-ные доверительные интервалы.
8.1.4 Число выживших родительских особей в необработанных контролях является критерием достоверности и должно быть включено в отчет. Также все другие отрицательные эффекты, например аномальное поведение и токсикологически значимые признаки, должны быть приведены в окончательном отчете.
8.1.5 ![]()
Значения ![]() , включая связанные с ними нижние и верхние границы доверительного интервала, вычисляют с использованием соответствующих статистических методов (например, логистической функции или функции Вейбулла, усеченного метода Спирмена-Карбера или простой интерполяции). Для вычисления значений
, включая связанные с ними нижние и верхние границы доверительного интервала, вычисляют с использованием соответствующих статистических методов (например, логистической функции или функции Вейбулла, усеченного метода Спирмена-Карбера или простой интерполяции). Для вычисления значений ![]() ,
, ![]() или любого другого
или любого другого ![]() весь набор данных должен быть подвергнут регрессионному анализу.
весь набор данных должен быть подвергнут регрессионному анализу.
8.1.6 NOEC/LOEC
8.1.6.1 Если статистический анализ предназначен для определения NOEC/LOEC, используют соответствующие статистические методы в соответствии с. Как правило, побочные эффекты испытуемого вещества по сравнению с контролем исследуют с использованием односторонней проверки гипотез при статистической значимости
![]() 0,05.
0,05.
________________
См. [4].
8.1.6.2 Нормальное распределение и однородность дисперсии можно проверить соответствующим статистическим методом, например тестом Шапиро-Уилка и тестом Левена соответственно при статистической значимости ![]() 0,05. Может быть проведен односторонний анализ ANOVA с последующим использованием критерия множественных сравнений. Многочисленные сравнения (например, тест Даннетта) или тесты понижения тренда (например, тест Уильямса или тест Джонкира-Терпстры с понижением) могут быть использованы для вычисления существования значительных различий (
0,05. Может быть проведен односторонний анализ ANOVA с последующим использованием критерия множественных сравнений. Многочисленные сравнения (например, тест Даннетта) или тесты понижения тренда (например, тест Уильямса или тест Джонкира-Терпстры с понижением) могут быть использованы для вычисления существования значительных различий (![]() 0,05) между контролями и разными концентрациями исследуемого вещества (рекомендации по выбору метода приведены в документе
0,05) между контролями и разными концентрациями исследуемого вещества (рекомендации по выбору метода приведены в документе![]() ). В других случаях для определения NOEC и LOEC могут быть использованы непараметрические методы (например, тест Бонферрони-У в соответствии с тренд-тестами Холма или Джонкира-Терпстры).
). В других случаях для определения NOEC и LOEC могут быть использованы непараметрические методы (например, тест Бонферрони-У в соответствии с тренд-тестами Холма или Джонкира-Терпстры).
________________
![]() См. [7].
См. [7].
8.1.7 Испытание с использованием предельной дозы
8.1.7.1 При проведении испытания с использованием предельной дозы (сравнивают только контроль и одну исследуемую дозу) и при выполнении предварительных условий процедур проведения параметрического испытания (нормальность распределения, однородность) метрические ответы могут быть оценены с использованием t-критерия Стьюдента (t-тест). Если эти требования не выполняются, могут быть использованы испытания с неравной дисперсией (например, тест Уэлча) или непараметрический U-критерий Манна-Уитни.
8.1.7.2 Для определения существенных различий между контролями (контроль испытуемой среды и контроль растворителя или диспергатора) параллельные результаты каждого контроля могут быть проанализированы, как описано для испытаний с предельной дозой. Если результаты этих испытаний не обнаруживают существенных различий, все контроли и параллельные контроли растворителя могут быть объединены. В противном случае все результаты воздействий следует сравнивать с контролем растворителя.
8.2 Отчет о результатах испытаний
Отчет о результатах испытаний включает:
8.2.1 Исследуемое вещество:
- физическая природа и соответствующие физико-химические свойства;
- данные химической идентификации, включая чистоту.
8.2.2 Подопытный вид:
- клон (определен ли генотип), поставщик или источник (если известны) и условия культивирования. Если используют другой вид, а не Daphnia magna, то это необходимо указать и обосновать.
8.2.3 Условия испытаний:
- используемая процедура испытаний (например, полустатическая или динамическая, объем, число Daphnia magna на литр);
- длительность и интенсивность освещения;
- план испытаний (например, число параллельных испытаний для каждой концентрации, число родительских особей на параллельное испытание);
- сведения о среде, используемой для испытания;
- добавленный органический материал (при использовании), в том числе состав, источник, метод приготовления, TOC/COD основного раствора, оценка получающегося в итоге TOC/COD в испытательной среде;
- подробная информация о кормлении, включая количество (в мг C/Daphnia в день) и расписание (например, тип пищи, включая для водорослей наименование вида, и, если известно, штамм, условия культивирования);
- метод приготовления исходного раствора и частота обновления (приводят концентрации растворителя или диспергатора при их использовании).
8.2.4 Результаты:
- результаты любых предварительных исследований стабильности исследуемого вещества;
- номинальные испытуемые концентрации и результаты всех исследований по определению концентрации исследуемого вещества в испытательных сосудах (пример таблиц данных приведен в приложении Г);
- эффективность применяемого метода и предел измерения;
- качество воды в испытательных сосудах (значение рН, температура, концентрация растворенного кислорода, TOC и/или COD и жесткость, при применении) (пример таблицы данных приведен в приложении В);
- полный отчет о жизнеспособном потомстве от каждой родительской особи (пример таблицы данных приведен в приложении В);
- число и дата случаев гибели родительских особей (пример таблицы данных приведен в приложении В);
- коэффициент вариации для контроля результатов репродуктивности (основанный на общем числе жизнеспособного потомства на родительскую особь, дожившую до конца испытания);
- график общего числа живого потомства, произведенного на родительскую особь в каждом параллельном испытании, за исключением родительских особей, случайно или непреднамеренно погибших во время испытания, в зависимости от концентрации исследуемого вещества;
- при необходимости график общего числа живого потомства, произведенного на одну выжившую родительскую особь в каждом параллельном испытании, в зависимости от концентрации исследуемого вещества;
- при возможности указывают LOEC для воспроизводства, включая описание используемых статистических процедур, и указывают размер ожидаемого эффекта, который можно обнаружить (для обеспечения анализа мощности можно выполнить до начала испытания), и NOEC для воспроизводства, информацию о переменной отклика, использованной для вычисления значений LOEC и NOEC (общее число живого потомства на материнскую особь, которая не погибла случайно или непреднамеренно во время испытания, или как общее число живого потомства на выжившую материнскую особь), если целесообразно, также указывают LOEC или NOEC для смертности родительских особей;
- при необходимости указывают воспроизводимость для ![]() и доверительные интервалы (например, 90%-ный или 95%-ный) и график подогнанной модели, использованной для ее вычисления, наклон кривой концентрация - отклик и ее стандартную ошибку;
и доверительные интервалы (например, 90%-ный или 95%-ный) и график подогнанной модели, использованной для ее вычисления, наклон кривой концентрация - отклик и ее стандартную ошибку;
- другие наблюдаемые биологические эффекты или измерения (например, рост родительских особей), включая соответствующее обоснование;
- объяснение любого отклонения от настоящего стандарта.
Приложение А
(обязательное)
Подготовка среды Элендт (Elendt) М7 и М4
А.1 Адаптация к средам Элендт М7 и М4
В некоторых случаях могут наблюдаться трудности при пересадке Daphnia magna в питательные среды М4 и М7. Данные трудности можно преодолеть путем постепенной адаптации, т.е. постепенной пересадкой дафний из собственной среды в 30%-ную, потом в 60%-ную и затем в 100%-ную Elendt. Период адаптации может составлять до одного месяца.
А.2 Подготовка
А.2.1 Следовые элементы
Сначала в воде подходящей чистоты, например деионизированной, дистиллированной или обратного осмоса, готовят отдельные исходные растворы (I) индивидуальных микропримесей в соответствии с таблицей А.1. Из этих исходных растворов (I) готовят исходные объединенные растворы (II) M4 и M7, содержащие все микропримеси (объединенные растворы).
Таблица А.1 - Приготовление исходных растворов микропримесей
Исходный раствор (I) (одно вещество) | Количество вещества, добавляемого к воде, мг/дм | Концентрация (по отношению к среде М4) | Исходный объединенный раствор (II), см | |
M4 | M7 | |||
| 57190 | 20000-кратная | 1,0 | 0,25 |
| 7210 | 20000-кратная | 1,0 | 0,25 |
LiCl | 6120 | 20000-кратная | 1,0 | 0,25 |
RbCl | 1420 | 20000-кратная | 1,0 | 0,25 |
| 3040 | 20000-кратная | 1,0 | 0,25 |
NaBr | 320 | 20000-кратная | 1,0 | 0,25 |
| 1230 | 20000-кратная | 1,0 | 0,25 |
| 335 | 20000-кратная | 1,0 | 0,25 |
| 260 | 20000-кратная | 1,0 | 1,00 |
| 200 | 20000-кратная | 1,0 | 1,00 |
KI | 65 | 20000-кратная | 1,0 | 1,00 |
| 43,8 | 20000-кратная | 1,0 | 1,00 |
| 11,5 | 20000-кратная | 1,0 | 1,0 |
| 5000 | 2000-кратная | - | - |
| 1991 | 2000-кратная | - | - |
21 Fe-EDTA* | - | 1000-кратная | 20,0 | 5,00 |
*Растворы ** Для приготовления исходных объединенных растворов (II) добавляют следующие количества исходных растворов (I) в воду (см | ||||
А.2.2 Среды М4 и М7
Среды M4 и M7 готовят с использованием основных растворов (II), макронутриентов и витаминов в соответствии с таблицей А.2.
Таблица А.2 - Среды M4 и M7
Компонент | Количество компонента, добавляемого в воду, мг/дм | Концентрации (для среды M4) | Количество компонентов для приготовления среды, см | |
M4 | M7 | |||
Исходные объединенные растворы (II), содержащие все микропримеси | 20-кратная | 50 | 50 | |
Основной раствор макроэлементов (отдельные вещества) | ||||
| 293800 | 1000-кратная | 1,0 | 1,0 |
| 246600 | 2000-кратная | 0,5 | 0,5 |
KCl | 58000 | 10000-кратная | 0,1 | 0,1 |
| 64800 | 1000-кратная | 1,0 | 1,0 |
| 50000 | 5000-кратная | 0,2 | 0,2 |
| 2740 | 10000-кратная | 0,1 | 0,1 |
| 1430 | 10000-кратная | 0,1 | 0,1 |
| 1840 | 10000-кратная | 0,1 | 0,1 |
Объединенный витаминный раствор* | 10000-кратная | 0,1 | 0,1 | |
*Объединенный витаминный раствор готовят добавлением трех витаминов к 1 дм | ||||
Тиамина гидрохлорид | 750,0 | 10000-кратная | - | - |
Цианокобаламин ( | 10,0 | 10000-кратная | - | - |
Биотин | 7,5 | 10000-кратная | - | - |
* Объединенный витаминный раствор хранят в замороженном состоянии небольшими порциями. Витамины добавляют к среде непосредственно перед использованием. Примечание 1 - Для предотвращения осаждения солей при приготовлении сред в мерную колбу вместимостью 1 дм ________________
Примечание 2 - Состав среды M4 приведен в нормативном документе ________________
| ||||
Приложение Б
(справочное)
Определение общего содержания органического углерода (TOC) и построение номограммы для определения его содержания в корме на основе водорослей
Установлено, что содержание углерода в водорослях, подаваемых в качестве корма, не обязательно измерять непосредственно, а можно построить корреляционную зависимость (т.е. номограмму) с замещающими показателями, такими как содержание углерода от численности клеток водорослей или способности к поглощению света.
Более точно TOC может быть измерен методом высокотемпературного окисления, а не ультрафиолетовым (УФ) или персульфатным методами
________________
См. [19].
Для построения номограммы необходимо центрифугированием отделить водоросли от среды культивирования с последующим ресуспендированием в дистиллированной воде. Измеряют замещающий параметр концентрации TOC в каждом образце три раза. Должен быть проанализирован контроль, содержащий только дистиллированную воду, и концентрацию TOC в дистиллированной воде вычитают из концентрации TOC образца водорослей, содержащихся в пробе.
Номограммы должны быть линейными в требуемом диапазоне концентраций углерода. Ниже приведены примеры номограмм.
Примечание - Номограммы, приведенные на рисунках Б.1-Б.3, не предназначены для проведения вычислений, и лаборатории должны подготовить собственные номограммы.
|
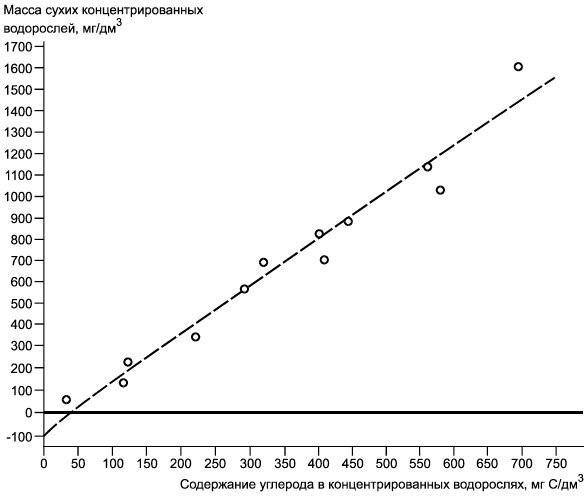
Примечание - Пример регрессии массы сухих концентрированных водорослей в миллиграммы углерода на дециметр кубический (мг/дм). Данные получены по содержанию углерода (C/дм
) в концентрированных суспензиях водорослей Chlorella vulgaris var. viridis (CCAP 211/12) полунепрерывных серий культивируемых клеток, повторно суспендированных в дистиллированной воде. Коэффициент корреляции 0,980.
Рисунок Б.1 - Номограмма зависимости содержания углерода. Регрессия массы сухих концентрированных водорослей (мг/дм) в мг С/дм
|
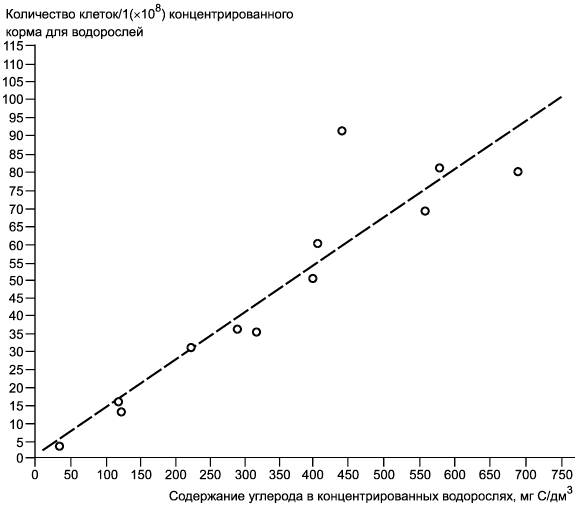
Примечание - Пример регрессии количества клеток в миллиграммы углерода на дециметр кубический (мг/дм). Данные получены по содержанию углерода (C/дм
) в концентрированных суспензиях водорослей Chlorella vulgaris var. viridis (CCAP 211/12) полунепрерывных серий культивируемых клеток, повторно суспендированных в дистиллированной воде. Коэффициент корреляции 0,926.
Рисунок Б.2 - Номограмма зависимости содержания углерода. Регрессия количества клеток/1(х10) в мг С/дм
|
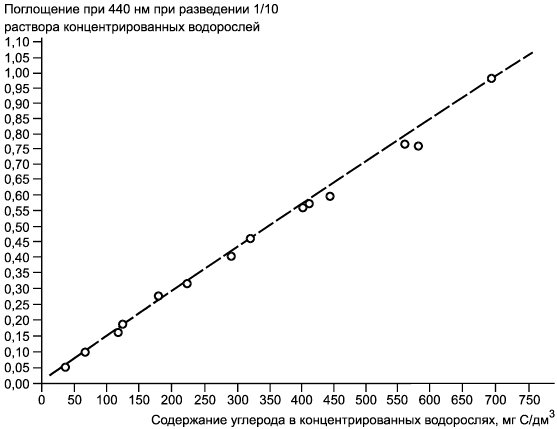
Примечание - Пример регрессии поглощения в миллиграммы углерода на дециметр кубический (мг/дм). Длина оптического пути 1 см. Данные получены по содержанию углерода (C/дм
) в концентрированных суспензиях водорослей Chlorella vulgaris var. viridis (CCAP 211/12) полунепрерывных серий культивируемых клеток, повторно суспендированных в дистиллированной воде. Коэффициент корреляции 0,998.
Рисунок Б.3 - Номограмма зависимости содержания углерода. Зависимость поглощения от мг C/дм
Приложение В
(справочное)
Пример записи данных по обновлению среды, результатов физико-химического мониторинга среды, кормления, воспроизводства и смертности Daphnia magna
Таблица В.1 - Пример записи данных
Номер опыта | Дата начала | Клон | Среда | Вид пищи | Исследуемое вещество | Номинальная концентрация | ||||||||||||||||||
День | ||||||||||||||||||||||||
Обновление среды (отметка) | ||||||||||||||||||||||||
Значение рН* | Новая | |||||||||||||||||||||||
Старая | ||||||||||||||||||||||||
Содержание | Новая | |||||||||||||||||||||||
Старая | ||||||||||||||||||||||||
Температура, °С * | Новая | |||||||||||||||||||||||
Старая | ||||||||||||||||||||||||
Кормление (отметка) | ||||||||||||||||||||||||
Число живых особей ** | Общее число | |||||||||||||||||||||||
Сосуд 1 | ||||||||||||||||||||||||
Сосуд 2 | ||||||||||||||||||||||||
Сосуд 3 | ||||||||||||||||||||||||
Сосуд 4 | ||||||||||||||||||||||||
Сосуд 5 | ||||||||||||||||||||||||
Сосуд 6 | ||||||||||||||||||||||||
Сосуд 7 | ||||||||||||||||||||||||
Сосуд 8 | ||||||||||||||||||||||||
Сосуд 9 | ||||||||||||||||||||||||
Сосуд 10 | ||||||||||||||||||||||||
Общее число | ||||||||||||||||||||||||
Смерть взрослых особей *** | ||||||||||||||||||||||||
* Указывают номер испытательного сосуда. ** Число недоразвитых потомков указывают как "АВ" в соответствующей ячейке. *** Смерть взрослых особей указывают как "М" в соответствующей ячейке. | ||||||||||||||||||||||||
Приложение Г
(справочное)
Пример записи результатов химического анализа
Таблица Г.1 - Измеренная концентрация
Номиналь- | Проба в течение 1-й недели | Проба в течение 2-й недели | Проба в течение 3-й недели | |||
обновленная | перед обновлением | обновленная | перед обновлением | обновленная | перед обновлением | |
Таблица Г.2 - Измеренная концентрация в процентах от номинальной
Номиналь- | Проба в течение 1-й недели | Проба в течение 2-й недели | Проба в течение 3-й недели | |||
обновленная | перед обновлением | обновленная | перед обновлением | обновленная | перед обновлением | |
Приложение Д
(обязательное)
Вычисление средневзвешенных по времени значений
Д.1 Средневзвешенные значения
Поскольку концентрация исследуемого вещества может снижаться в период между обновлениями среды, необходимо вычислить концентрацию, которая может рассматриваться как представительная в диапазоне концентраций, используемых при проведении испытания родительских особей Daphnia magna. Выбор должен быть основан как на биологических, так и на статистических данных. Например, если показано, что на воспроизводство влияет в основном максимальная концентрация, при испытании следует использовать максимальную концентрацию. Однако, если полагают, что преобладает кумулятивный или долговременный эффект токсичного вещества, следует брать в расчет среднюю концентрацию. В этом случае лучше всего подходит средневзвешенная по времени концентрация, так как она учитывает вариации концентраций по времени.
|
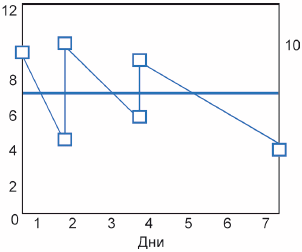
Рисунок Д.1 - Пример средневзвешенной по времени кривой
На рисунке Д.1 приведен пример (упрощенный) испытания длительностью семь дней с обновлением среды в нулевой, второй и четвертый дни:
- зигзагообразная линия показывает концентрацию во время испытания. Падение концентрации, как предполагается, происходит по причине экспоненциального разложения;
- шесть квадратиков в конце линий представляют наблюдаемые концентрации, измеренные в начале и в конце каждого периода обновления;
- горизонтальная линия показывает положение значения средневзвешенной по времени концентрации.
Средневзвешенное по времени значение вычисляют таким образом, чтобы площадь средневзвешенной концентрации над линией и площадь под линией были равны. Пример расчета приведен в таблице Д.1.
Таблица Д.1 - Вычисление средневзвешенного по времени значения
Обновление, номер | Число дней | Концентрация 0 | Концентрация 1 | Ln (концентрации 0) | Ln (концентрации 1) | Площадь |
1 | 2 | 10,000 | 4,493 | 2,303 | 1,503 | 13,767 |
2 | 2 | 11,000 | 6,037 | 2,398 | 1,798 | 16,544 |
3 | 3 | 10,000 | 4,066 | 2,303 | 1,403 | 19,781 |
Общее число дней - 7 | Общая площадь: 50,092 | |||||
Среднее значение: 7,156 | ||||||
Площадь S области под экспоненциальной кривой каждого периода обновления вычисляют по формуле
![]() , (1)
, (1)
где Концентрация 0 - измеренная концентрация в начале каждого периода обновления;
Концентрация 1 - измеренная концентрация в конце каждого периода обновления;
Ln (Концентрации 0) - натуральный логарифм концентрации 0;
Ln (Концентрации 1) - натуральный логарифм концентрации 1;
Число дней - число дней между обновлениями.
Средневзвешенным по времени значением (TW-mean) является общая площадь, деленная на число дней.
Следует иметь в виду, что при проведении испытаний репродуктивности с Daphnia magna таблица должна быть расширена до 21 дня.
Очевидно, что при проведении наблюдений только в начале и в конце каждого периода обновления невозможно подтвердить, что разложение вещества проходит экспоненциально. Другая кривая может привести к иным результатам. Тем не менее наиболее вероятным является экспоненциальное падение концентрации, и приведенная кривая является наиболее подходящей при отсутствии другой информации.
Следует соблюдать осторожность, если химический анализ не обнаружил вещество в конце периода обновления. При отсутствии возможности оценить скорость разложения вещества в растворе невозможно получить и реальную площадь под кривой и, следовательно, разумное средневзвешенное по времени значение.
Приложение Е
(справочное)
Рекомендации по определению пола новорожденных Daphnia magna
Проявление особей мужского пола происходит при изменении условий окружающей среды, таких как сокращение светового дня, колебания температуры, снижение концентрации пищи, возрастание плотности популяции, а также является известным ответом на регуляторы роста насекомых
![]() .
.
________________
См. [20].
![]() См. [21].
См. [21].
В условиях, когда стрессогенный фактор химического вещества вызывает уменьшение репродуктивного потомства у партеногенных самок, можно ожидать увеличения числа самцов. На основании доступной информации невозможно предсказать, что будет более чувствительным - соотношение полов или конечная точка воспроизводства (уменьшение потомства). Поскольку основная цель настоящего стандарта состоит в оценке количества произведенного потомства, наблюдение за появлением самцов необязательно. Если эту необязательную конечную точку оценивают в испытании, то следует использовать дополнительный критерий достоверности испытания - не более 5% самцов в контроле.
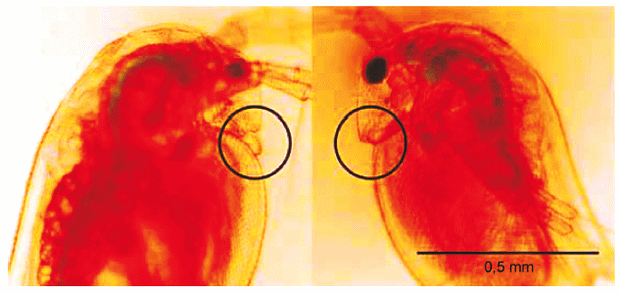
Наиболее практичный и простой способ различить пол дафнии - это использовать их фенотипические характеристики, поскольку самцы и самки генетически идентичны, а их пол определяется окружающей средой. Самцы и самки различаются по длине и морфологии первых усиков, которые у самцов длиннее, чем у самок (см. рисунок Е1). Это различие распознается сразу после рождения, другие вторичные половые признаки развиваются по мере взросления.
Для определения пола новорожденных особей от каждой родительской особи пересаживают с помощью пипетки в чашку Петри с питательной средой. Количество среды должно быть минимальным для ограничения перемещения животных. Рассмотреть первые усики можно под бинокулярным микроскопом (10-60 крат).
|
Рисунок E.1 Самец (слева) и самка (справа) Daphnia magna в возрасте 24 ч.
Примечание - Самца можно отличить от самки по длине и морфологии первых усиков, обведенных на рисунке кружком.
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа OECD, Test N 211:2012 |
Введение (1-3) | Введение |
1 Область применения | |
2 Термины, определения и сокращения (приложение 1) | |
3 Основные положения (4, 5) | Основные положения |
3.1 | 4 |
3.2 | 5 |
4 Информация об исследуемом веществе (6, 7) | Информация об исследуемом веществе |
4.1 | 6 |
4.2 | 7 |
5 Достоверность метода (8) | Достоверность метода |
6 Описание метода (9-19) | Описание метода |
6.1 Оборудование | Оборудование |
6.1.1 | 9 |
6.1.2 | 10 |
6.2 Подопытные организмы | Подопытные организмы |
6.2.1 | 11 |
6.2.2 | 12 |
6.2.3 | 13 |
6.3 Среда для культивирования | Среда для культивирования |
6.3.1 | 14 |
6.3.2 | 15 |
6.3.3 | 16 |
6.3.4 | 17 |
6.4 Растворы для испытаний | Растворы для испытаний |
6.4.1 | 18 |
6.4.2 | 19 |
7 Проведение испытаний (20-50) | Проведение испытаний |
7.1 Условия воздействия | Условия воздействия |
7.1.1 Продолжительность испытания | Продолжительность испытания |
7.1.2 Отсадка (размещение) особей | Отсадка (размещение) особей |
7.1.2.1 | 21 |
7.1.2.2 | 22 |
7.1.3 Подопытные особи (организмы) | Подопытные особи (организмы) |
7.1.3.1 | 23 |
7.1.3.2 | 24 |
7.1.3.3 | 25 |
7.1.4 Кормление | Кормление |
7.1.4.1 | 26 |
7.1.4.2 | 27 |
7.1.4.3 | 28 |
7.1.4.4 | 29 |
7.1.5 Освещение | Освещение |
7.1.6 Температура | Температура |
7.1.7 Аэрация | Аэрация |
7.1.8 Схема испытания | Схема испытания |
7.1.8.1 Испытание по определению диапазона концентраций | Испытание по определению диапазона концентраций |
7.1.8.1.1 | 33 |
7.1.8.1.2 | 34 |
7.1.8.2 Определительные испытания | Определительные испытания |
7.1.8.2.1 | 35 |
7.1.8.2.2 | 36 |
7.1.9 Контроли | Контроли |
7.1.9.1 | 37 |
7.1.9.2 | 38 |
7.1.10 Обновление испытуемой среды | Обновление испытуемой среды |
7.1.10.1 | 39 |
7.1.10.2 | 40 |
7.2 Наблюдения | Наблюдения |
7.3 Потомство | Потомство |
7.4 Смертность | Смертность |
7.5 Другие параметры | Другие параметры |
7.6 Частота аналитических определений и измерений | Частота аналитических определений и измерений |
7.6.1 | 45 |
7.6.2 | 46 |
7.6.3 | 47 |
7.6.4 | 48 |
7.6.5 | 49 |
7.6.6 | 50 |
8 Результаты и подготовка отчета (51-60) | Результаты и подготовка отчета |
8.1 Обработка результатов | Обработка результатов |
8.1.1 | 51 |
8.1.2 | 52 |
8.1.3 | 53 |
8.1.4 | 54 |
8.1.5 |
|
8.1.6 NOEC/LOEC | NOEC/LOEC |
8.1.6.1 | 56 |
8.1.6.2 | 57 |
8.1.7 Испытание с использованием предельной дозы | Испытание с использованием предельной дозы |
8.1.7.1 | 58 |
8.1.7.2 | 59 |
8.2 Отчет о результатах испытаний | Отчет о результатах испытаний |
* | Библиография |
** | Приложение 1 Термины и определения |
Приложение А Подготовка среды Элендт (Elendt) М7 и М4 | Приложение 2 Подготовка среды Элендт (Elendt) М7 и М4 |
Приложение Б Определение общего содержания органического углерода (TOC) и построение номограммы для определения его содержания в корме на основе водорослей | Приложение 3 Определение общего содержания органического углерода (TOC) и построение номограммы для определения его содержания в корме на основе водорослей |
Приложение В Пример записи данных по обновлению среды, результатов физико-химического мониторинга среды, кормления, воспроизводства и смертности Daphnia | Приложение 4 Пример записи данных по обновлению среды, результатов физико-химического мониторинга среды, кормления, воспроизводства и смертности Daphnia |
Приложение Г Пример записи результатов химического анализа | Приложение 5 Пример записи результатов химического анализа |
Приложение Д Вычисление средневзвешенных по времени значений | Приложение 6 Вычисление средневзвешенных по времени значений |
Приложение Е Рекомендации по определению пола новорожденных Daphnia | Приложение 7 Рекомендации по определению пола новорожденных Daphnia |
Приложение ДА Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа | |
Библиография | |
*Библиография размещена в конце настоящего стандарта. ** Приложение 1 размещено в разделе 2 настоящего стандарта. Примечание - После заголовков разделов настоящего стандарта приведены в скобках номера аналогичных им параграфов международного документа. | |
Библиография
[1] | OECD Test Guidelines Programme. Report of the Workshop on the Daphnia magna Pilot Ring Test, Sheffield University, U.K., 20-21 March 1993 |
[2] | OECD (1997). Report of the Final Ring Test of the Daphnia magna Reproduction Test. Environmental Health and Safety Publications, Series on Testing and Assessment No.6. OECD, Paris |
[3] | OECD (2008). Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. Environmental Health and Safety Publications, Series on Testing and Assessment, No. 88. OECD, Paris |
[4] | Wilson, E.O. and Bossert, W.H. (1971). A Primer of Population Biology. Sinauer Associates Inc. Publishers |
[5] | Poole, R.W. (1974). An Introduction to quantitative Ecology. Mc Graw Hill Series in Population Biology, New York, p 532 |
[6] | Meyer, J.S., Ingersoll, C.G., McDonald, L.L. and Boyce, M.S. (1986). Estimating uncertainty in population growth rates: Jackknife vs bootstrap techniques. Ecology, 67, 1156-1166 |
[7] | OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. Environmental Health and Safety Publications, Series on Testing and Assessment No. 54. OECD, Paris |
[8] | Baird, D.J., et al. (1991). A comparative study of genotype sensitivity to acute toxic stress using clones of Daphnia magna Straus. Ecotox. and Environ. Safety, 21, 257-265 |
[9] | Elendt, B.-P. (1990). Selenium deficiency in Crustacea; An ultrastructural approach to antennal damage in Daphnia magna Straus. Protoplasma, 154, 25-33 |
[10] | EPA (2002). Methods for Measuring the Acute Toxicity of Effluents and Receiving Waters to Freshwater and Marine Organisms. Fifth Edition. EPA/821/R-02/012. U.S. Environmental Protection Agency, Office of Water, Washington, DC. www.epa.gov/waterscience/methods |
[11] | Vigano, L. (1991). Suitability of commercially available spring waters as standard medium for culturing Daphnia magna. Bull. Environ. Contam. Toxicol., 47, 775-782 |
[12] | ASTM. (2008) Standard Guide for Conducting Acute Toxicity Tests with Fishes, Macroinvertebrates, and Amphibians. In: Annual Book of ASTM Standards; Water and Environmental Technology, vol. 11.04; ASTM E729-96 (2007) American Society for Testing and Materials, Philadelphia, PA |
[13] | Baird, D.J., et al. (1989). The long term maintenance of Daphnia magna Straus for use in ecotoxicological tests; problems and prospects. In: Proceedings of the 1st European Conference on Ecotoxicology. Copenhagen 1988 (H. |
[14] | Parkhurst, B.R., J.L. Forte. And G.P. and Wright (1981) Reproducibility of a life-cycle toxicity test with Daphnia magna. Bull. Environ. Contam. and Toxicol., 26: 1-8 |
[15] | Cowgill, U.M. and Milazzo, D.P. (1990). The sensitivity of two cladocerans to water quality variables: salinity and hardness. Arch. Hydrobiol., 120(2): 185-196 |
[16] | OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environmental Health and Safety Publications, Series on Testing and Assessment No. 23. OECD, Paris |
[17] | Sims, I.R., S.Watson. and D.Holmes (1993) Toward a standard Daphnia juvenile production test. Environ. Toxicol. and Chem., 12, 2053-2058 |
[18] | Sims, I. (1993). Measuring the growth of phytoplankton: the relationship between total organic carbon with three commonly used parameters of algal growth. Arch. Hydrobiol., 128, 459-466 |
[19] | ISO 10694: 1995(R2016) Soil quality - Determination of organic and total carbon after dry combustion (elementary analysis) London WC1V 6HB |
[20] | Hobaek A. and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71:2255-2268; Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206 |
[21] | Oda S., Tatarazako N., Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174 |
[22] | OECD Test No. 301:1992 "Guideline for testing of chemicals. Ready biodegradability" |
[23] | OECD Test No. 310: 2014 "Guidelines for the Testing of Chemicals. Ready Biodegradability - |
УДК 615.038/615.012/615.014/615.2:006.354 | МКС | 75.080 | MOD |
11.020 | |||
11.120.01 | |||
Ключевые слова: методы испытаний химической продукции, опасность для окружающей среды, угнетение репродуктивной способности Daphnia magna | |||
Электронный текст документа
и сверен по:
, 2020