ГОСТ Р 58164-2018/ISO/TR 22442-4:2010*
________________
* Поправка (ИУС N 12-2018)
Группа Р23
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ, ИСПОЛЬЗУЮЩИЕ ТКАНИ И ИХ ПРОИЗВОДНЫЕ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ
Часть 4
Принципы уничтожения и/или инактивации возбудителей трансмиссивной губчатой энцефалопатии (ТГЭ) и валидация этих процессов
Medical devices utilizing animal tissues and their derivatives. Part 4. Principles for elimination and/or inactivation of transmissible spongiform encephalopathy (TSE) agents and validation assays for those processes
ОКС 11.020
ОКП 93 9000
Дата введения 2019-01-01
Предисловие
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 422 "Оценка биологического действия медицинских изделий"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 5 июля 2018 г. N 385-ст
4 Настоящий стандарт идентичен международному документу ISO/TR 22442-4:2010* "Медицинские изделия, использующие ткани и их производные животного происхождения. Часть 4. Принципы уничтожения и/или инактивации возбудителей трансмиссивной губчатой энцефалопатии и валидация этих процессов" (ISO/TR 22442-4:2010 "Medical devices utilizing animal tissues and their derivatives - Part 4: Principles for elimination and/or inactivation of transmissible spongiform encephalopathy (TSE) agents and validation assays for those processes", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
ВНЕСЕНА поправка, опубликованная в ИУС N 12, 2018 год
Поправка внесена изготовителем базы данных
Введение
ИСО (Международная организация по стандартизации) является всемирной федерацией органов национальных стандартов (организации - члены ИСО). Работу по подготовке международных стандартов обычно осуществляют технические комитеты ИСО. Каждая из данных организаций, заинтересованных в предмете деятельности, с целью которой создавался технический комитет, имеет право быть представленной в этом комитете. Международные правительственные и неправительственные организации также принимают участие в работе во взаимодействии с ИСО. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Международные стандарты разрабатывают в соответствии с правилами, приведенными в части 2 Директив ИСО/МЭК.
Основной задачей технических комитетов является подготовка международных стандартов. Проекты международных стандартов, принятые техническими комитетами, распространяются организациям-членам для голосования. Публикация в качестве международного стандарта требует одобрения по меньшей мере 75% организаций - членов с правом голоса.
В исключительных случаях если данные, собранные техническим комитетом, отличны от публикуемых в качестве международного стандарта ("последнее слово техники", например), комитет может принять решение простым голосованием большинства опубликовать технический отчет. Этот отчет по своей сути является справочным, который действителен до тех пор, пока данные, предоставляемые в нем, носят актуальный характер.
Необходимо обратить внимание на возможность того, что некоторые элементы настоящего стандарта могут быть объектами патентного права. ИСО не несет ответственности за выявление подобного рода фактов.
Настоящий стандарт подготовлен Техническим комитетом ИСО/ТК 194 "Биологическая оценка медицинских изделий", подкомитет ПК 1 "Безопасность изделий из животной ткани".
ИСО 22442 состоит из следующих частей под общим наименованием "Изделия медицинские, использующие ткани и их производные животного происхождения":
- часть 1 "Применение менеджмента риска";
- часть 2 "Контроль источников, забора и обработки";
- часть 3 "Валидация уничтожения и/или инактивации вирусов и возбудителей трансмиссивной губчатой энцефалопатии (ТГЭ)";
- часть 4 "Принципы уничтожения и/или инактивации переносчиков грибковой энцефалопатии и валидация этих процессов".
В целом ряде медицинских изделий используют материалы животного происхождения. Ткани животного происхождения и их производные, применяемые в разработке и производстве медицинских изделий, придают им те функциональные характеристики, которые обеспечивают преимущества над изделиями, изготовленными из материалов неживотного происхождения.
Медицинские изделия отличаются как по природе, так и по количественному содержанию материалов животного происхождения. Эти материалы могут составлять основную часть изделия (например, клапаны сердца крупного рогатого скота или свиньи, имплантаты из костной ткани для стоматологии или ортопедии, гемостатические изделия), служить покрытием изделия или его пропиткой (в частности, коллаген, желатин, гепарин) или использоваться в процессе производства изделия (будучи производными жиров, такими как олеаты и стеараты, эмбриональная телячья сыворотка, ферменты, культуральные среды).
Настоящий стандарт является техническим отчетом (ТО), предлагающим способы разработки и проведения валидации процессов (способов), используемых для снижения риска ятрогенной передачи трансмиссивной губчатой энцефалопатии (ТГЭ) при производстве медицинских изделий, полученных из нежизнеспособных животных тканей. В настоящем стандарте инфекционный возбудитель именуется "возбудитель ТГЭ", а не прион для единообразия с другими частями ИСО 22442. Также представлены последние данные по человеческим тканям и ТГЭ, которые по аналогии могут быть применены к другим животным тканям.
Ятрогенная передача возбудителей ТГЭ человеку, заболевшему болезнью Крейтцфельдта-Якоба (CJD), однозначно отнесена к воздействиям аллографта твердой мозговой оболочки человека (Hannah, E.L., Belay, E.D. et al., 2001), используемого в хирургии в качестве заплаток, и гормонов, экстрагируемых из гипофиза человека (Mills, J.L., Schonberger, L.B. et al., 2004), являющихся нежизнеспособными тканями. Субклиническое инфицирование возбудителем варианта болезни Крейтцфельдта-Якоба (vCJD) было обнаружено при аутопсии пациента с гемофилией, и достоверно доказано заражение пациента при его лечении фактором коагуляции, полученным из обработанной плазмы человека (Агентство Великобритании по охране здоровья, 2009 г.):
http://www.hpa.org.uk/webw/HPAweb&HPAwebStandard/HPAweb_С/1234859690542?р=1231252394302 и http://www.dh.qov.uk/en/Publicationsandstatistics/Publications/PublicationsPolicyAndGuidance/DH_100357
Кроме того, ткани роговицы также могут являться переносчиком возбудителя CJD (Kennedy, Hoganetal, 2001 г.), а несколько трансфузионных концентратов эритроцитов привели к передачи vCJD (Llewelyn, Hewitt et al., 2004; Peden, Head et al., 2004; Peden, Ritchie and Ironside, 2005).
Воздействие агента бычьей спонгиформной энцефалопатии (БСЭ) привело к возникновению более чем 210 случаев vCJD во всем мире, большинство из них, по всей вероятности, возникли из-за приема в пищу инфицированных говяжьих продуктов. Хотя кроме описанных ятрогенных инфекций vCJD не были установлены другие случаи передачи возбудителя БСЭ, полученного через медицинские или ветеринарные продукты, высока вероятность того, что медицинское изделие, зараженное возбудителем БСЭ от жвачного животного, может служить источником заражения. В действительности, в двух ветеринарных вакцинах, полученных из нежизнеспособных тканей овцы, содержалась ТГЭ, обусловленная овечьей/козьей почесухой (скрейпи), которой заразились овцы [Всемирная организация здравоохранения (ВОЗ), 2006 г.]. Случаев заражения человека возбудителем почесухи не отмечено.
В основном в настоящем стандарте применена терминология, предлагаемая ВОЗ (Руководство WHO по распространению инфицирующей активности тканей при трансмиссивной губчатой энцефалопатии, 2006 г.), однако международного консенсуса относительно как терминологии возможной молекулярной природы трансмиссивных возбудителей [только белковая или прионная теория (Prusiner 1982) в настоящий момент более общепринятая], так и конкретной роли различных форм прионного белка, кодированного носителем, в репликации инфекционных агентов или патогенезе заболевания не существует. Единственной целью ТО является предложение стратегий для валидации эффективных методов, которые могут снизить риск случайной передачи ТГЭ медицинскими изделиями, приготовленными с использованием нежизнеспособных животных тканей.
ИСО включают как нормативные, так и справочные приложения, также напрямую связанные с темой настоящего стандарта. Все термины, определенные в настоящем стандарте, применяются дословно.
Ввиду отсутствия тщательно отработанных этапов процесса, по мере прохождения которых могут быть достоверно уничтожены возбудители ТГЭ, следует использовать животных и тканевых источников низкого риска.
Хотя это неприменимо напрямую к методам валидации, предназначенным для снижения риска инфицирования возбудителями ТГЭ для медицинских изделий, произведенных из нежизнеспособных животных тканей, компетентные органы Великобритании и США провели опрос среди экспертов по возможным аспектам валидационных исследований для изделий, подлежащих подавлению инфекционной активности возбудителя ТГЭ в крови человека, потенциально инфицированной этими возбудителями. Данные этого опроса могут быть полезными при валидации методов, используемых для тканей животного происхождения, в частности: при предварительном анализе материала, содержащего возбудитель ТГЭ с высокими показателями инфекционности; выборе изучаемых возбудителей, вызывающих конкретную инфекцию, и дизайне исследований с использованием пробы на белок ![]() в качестве предварительной скрининговой стратегии для отсеивания малоинформативных методов. Эти методы требовались для подтверждения значительного снижения инфекционности, продемонстрированного при исследованиях, проводимых на экспериментальных животных, инфицированных возбудителями ТГЭ. Для того чтобы метод был признан потенциально полезным, в ходе исследования должны быть получены сходные результаты по крайней мере в двух повторах измерений титра возбудителя ТГЭ. Соответствие этому критерию позволит признать метод приемлемым для применения на практике. Получение доказательства того, что метод снижает уровень инфекционной активности для эндогенно-инфицированных тканей и что весь технологический процесс уничтожает всю обнаруживаемую инфекцию, является желаемым, но на данной момент не представляется достижимым. Ограничивающие факторы - это очень низкие титры инфекционного агента в большинстве тканей, за исключением тканей нервной системы, и ограниченное число животных, которое достоверно заражено природными вариантами возбудителей ТГЭ до последующих изменений при адаптации к новому виду. Отсутствие стандартных эталонных инфицированных возбудителями ТГЭ материалов человека и животных с известным титром и биологическими характеристиками также считается дополнительным препятствием к разработке валидационных исследований (ВОЗ, 2006 г., приложение 2). Учитывая исключительно малочисленные исследования по валидации методов для повышения безопасности в отношении ТГЭ при использовании медицинских изделий, полученных из крови человека и других тканей человека, - изделий, участвующих в ятрогенных передачах, необходимо способствовать новым валидационным исследованиям методов, которые будут направлены на улучшение безопасности в отношении ТГЭ при использовании медицинских изделий, полученных из тканей животного происхождения.
в качестве предварительной скрининговой стратегии для отсеивания малоинформативных методов. Эти методы требовались для подтверждения значительного снижения инфекционности, продемонстрированного при исследованиях, проводимых на экспериментальных животных, инфицированных возбудителями ТГЭ. Для того чтобы метод был признан потенциально полезным, в ходе исследования должны быть получены сходные результаты по крайней мере в двух повторах измерений титра возбудителя ТГЭ. Соответствие этому критерию позволит признать метод приемлемым для применения на практике. Получение доказательства того, что метод снижает уровень инфекционной активности для эндогенно-инфицированных тканей и что весь технологический процесс уничтожает всю обнаруживаемую инфекцию, является желаемым, но на данной момент не представляется достижимым. Ограничивающие факторы - это очень низкие титры инфекционного агента в большинстве тканей, за исключением тканей нервной системы, и ограниченное число животных, которое достоверно заражено природными вариантами возбудителей ТГЭ до последующих изменений при адаптации к новому виду. Отсутствие стандартных эталонных инфицированных возбудителями ТГЭ материалов человека и животных с известным титром и биологическими характеристиками также считается дополнительным препятствием к разработке валидационных исследований (ВОЗ, 2006 г., приложение 2). Учитывая исключительно малочисленные исследования по валидации методов для повышения безопасности в отношении ТГЭ при использовании медицинских изделий, полученных из крови человека и других тканей человека, - изделий, участвующих в ятрогенных передачах, необходимо способствовать новым валидационным исследованиям методов, которые будут направлены на улучшение безопасности в отношении ТГЭ при использовании медицинских изделий, полученных из тканей животного происхождения.
Необходимо отметить, что, как сообщалось выше, отсутствуют прямые свидетельства того, что ткани животного происхождения вызывают какие-либо ятрогенные инфекции возбудителями ТГЭ у человека (Minor, Newhametal. 2004). Тем не менее случаи с пищевыми продуктами, содержащими агент БСЭ, и перенос на пастбищах почесухи овцам овечьими ветеринарными вакцинами, полученными из тканей животных, предполагают, что риск ятрогенных передач возбудителей ТГЭ (кроме БСЭ) от животных к человеку хотя и является теоретическим, но остается заслуживающим пристального внимания.
1 Область применения
Настоящий стандарт определяет способы разработки и проведения валидационных методов с целью выявления возможности снижения риска ятрогенной передачи ТГЭ при производстве медицинских изделий, полученных из нежизнеспособных животных тканей.
Методы удаления возбудителей ТГЭ, используемые при обработке животных тканей, должны также снизить риск передачи инфекций ТГЭ через нежизнеспособные ткани человеческого происхождения; однако настоящий стандарт (ТО) не затрагивает этот вопрос. В нем приведена последняя актуальная информация по тканям человека и ТГЭ, которая может быть применена по аналогии к другим животным тканям.
Настоящий стандарт не включает валидацию методов исследования материалов, определяемых как имеющие "незначительный риск" контаминации возбудителями ТГЭ, приведенные в списке приложения С ИСО 22442-1:2007.
Настоящий стандарт предназначен для выработки окончательного проекта международных стандартов, включенных в серии ИСО 22442, а также в ИСО 14160.
Настоящий стандарт базируется на материалах дискуссии (см. ИСО 22442-3), относящейся к теме возбудителей ТГЭ, и обобщает последние открытия в области исследований об уничтожении возбудителей ТГЭ. При дальнейшем развитии понимания подходов к дезактивации и уничтожению возбудителей ТГЭ настоящий стандарт будет пересмотрен.
2 Нормативные ссылки
Следующие документы* необходимы для применения настоящего стандарта. При датированной ссылке применимо только указанное издание. При ссылке без даты применимо последнее издание указанного документа, включая все поправки:
________________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 22442-1, Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management (Изделия медицинские, использующие ткани животных и их производные. Часть 1. Применение менеджмента риска)
ISO 22442-2, Medical devices utilizing animal tissues and their derivatives - Part 2: Controls on sourcing, collection and handling (Изделия медицинские, использующие ткани животных и их производные. Часть 2. Контроль за происхождением, сбором и обработкой)
ISO 22442-3, Medical devices utilizing animal tissues and their derivatives - Part 3: Validation of the elimination and/ or inactivation of viruses and transmissible spongiform encephalopathy (TSE) agents [Медицинские изделия, использующие животные ткани и их производные. Часть 3. Валидация уничтожения и/или инактивации вирусов и возбудителей трансмиссивной губчатой энцефалопатии (ТГЭ)
ISO 14160, Sterilization of health care products-Liquid chemical sterilizing agents for single-use medical devices utilizing animal tissues and theirderivatives-Requirements for characterization, development, validation and routine control of a sterilization process for medical devices (Стерилизация медицинской продукции. Жидкие химические стерилизующие вещества для одноразовых медицинских изделий, использующих ткани животных и их производные. Требования к описанию характеристик, разработке, валидации и текущему контролю процесса стерилизации медицинских изделий)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 22442-1, ИСО 22442-2, ИСО 22442-3 и ИСО 14160.
4 Уничтожение возбудителей ТГЭ: основные требования
4.1 Общие положения
4.1.1 Возбудители ТГЭ, представляющие интерес
БСЭ крупного рогатого скота является единственным возбудителем ТГЭ животного происхождения, который на данный момент известен как инфекция, передающаяся человеку (т.е. зооноз). Почесуха, хотя теоретически и представляет опасность, не признается зоонозом, несмотря на столетний опыт. Тем не менее отдельные компетентные управляющие органы внедрили профилактические правила, которые запрещают использование животных из стад, где была выявлена почесуха, как источник инъекционных материалов овечьего и козьего происхождения [например, протоколы заседания экспертной комиссии по ТГЭ Управления по контролю за продуктами и лекарствами США (FDA) 3 июня 1999 г.: http://www.fda.gov/ohrms/dockets/ac/cber99.htm#Transmissible%20Sponqiform, директива Европейского Союза от 2003 [OJL105, 26.4.2003 стр. 18, http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2003:105:0018:0023:EN:PDF] и японское уведомление 177 http://www.nihs.qo.jp/cqtp/cqtp/quidline/03052001.pdf|. Подверженность овец и коз заражению агентом БСЭ относительно недавно стала проблемой (ВОЗ, 2006). Несмотря на то что свиньи могут быть заражены экспериментальным путем возбудителем БСЭ (Wells, Hawkinsetal, 2003; Castilla, Gutierrez-Adanetal, 2004), заражение не происходило при алиментарном пути введения агента, что указывало на отсутствие естественного пути передачи возбудителя ТГЭ свиньям, в связи с чем большинство специалистов, представляющих компетентные органы, пришли к консенсусу, что ткани свиней являются маловероятным источником заражения человека любым возбудителем ТГЭ. То же касается тканей других животных, редко используемых в производстве медицинских изделий, таких как лошади. Животные, не чувствительные к заражению возбудителями ТГЭ алиментарным путем, не рассматриваются Европейским агентством по оценке лекарственных средств (ЕМЕА) как "ТГЭ-значимые виды животных"; ткани таких видов животных не рассматриваются в качестве факторов риска заражения возбудителями ТГЭ при производстве медицинских продуктов для использования в медицине и в ветеринарии согласно руководству ЕМЕА от 2004 года: http://www.emea.europa.eu/pdfs/human/bwp/TSE%20NFG%20410-rev2.pdf.
4.1.2 Используемые ткани животного происхождения
Ткани животного происхождения, применяемые в настоящее время в нежизнеспособной форме для производства медицинских изделий, включают клапаны сердца свиньи, бычий перикардий и бычий коллаген. До сих пор не представлено доказательств того, что какие-либо из этих тканей содержат агент ТГЭ (ВОЗ, 2006 г.), однако количество таких экспериментов было незначительным, а используемые тесты имели низкую чувствительность обнаружения ТГЭ. Причем существует вероятность того, что практически любая ткань животных, забранная в результате обычного забоя, может быть случайно загрязнена тканями более высокого риска инфицирования. Правила и процедуры, требующие удаления, разделения и безопасную утилизацию материалов трупов животных "конкретного риска", особенно трупов старых животных, способны уменьшить, но не полностью устранить этот риск. Европейская комиссия недавно предложила "пропорциональные риску правила для использования животных субпродуктов" с целью выявления и управления рисками, связанными с выбором сырья животного происхождения (см. правила ЕС 1069/2009).
4.1.3 Ткани, инфицированные возбудителями ТГЭ
Агенты могут контаминировать ткани двумя способами: 1) в процессе болезни, вызванной переносчиками ТГЭ, или 2) при попадании агента в ткань из инфицированной ткани (например, в результате контакта с тканями нервной системы, лимфоретикулярными клетками или кровью из тканей). Второй, или "экзогенный", источник контаминации возбудителем ТГЭ может быть связан с забором ткани от зараженного источника либо от инструментов или поверхностей, зараженных возбудителем ТГЭ из предыдущего источника.
Такое разделение следует принимать во внимание по нескольким причинам. Эндогенно-инфицированные ткани [кроме тканей центральной нервной системы (ЦНС), которые, как установлено, инфицированы в значительно большей степени, чем другие ткани] в организме инфицированного животного, как правило, содержат очень небольшие количества агента, поэтому разработать адекватные модели для валидации методов уничтожения эндогенной инфекции достаточно сложно с точки зрения логистики. Экзогенная контаминация моделируется гораздо проще путем добавления в ткани экспериментальных животных определенного количества возбудителя ТГЭ известного происхождения, с конкретными биологическими характеристиками и известным количеством инфекционного агента, что определяется методом титрования на чувствительных животных. Некоторые штаммы возбудителя почесухи и один штамм, полученный при БСЭ (301V), адаптированные к размножению до высоких титров в грызунах, особенно показательны в качестве моделей экзогенного инфицирования (см. приложение С.1 ИСО 22442-3:2007 и приложение D ИСО 22442-3:2007). Выбор моделей для валидационных исследований ограничен несколькими факторами:
a) хотя находящийся в конкретной ткани не адаптированный к пересевам возбудитель ТГЭ может считаться наиболее "адекватным" в целях валидации способов инактивации/удаления, степень инфекционности таких агентов обычно неизвестна и ниже, чем инфекционность агентов, адаптированных к грызунам (Wells, 2007);
b) для работы с возбудителем БСЭ и штаммами, полученными при БСЭ и адаптированными к грызунам, согласно нормативным требованиям необходимы лаборатории с высоким уровнем безопасности, который не всегда доступен. В основном исследования с возбудителем почесухи, адаптированным к грызунам, считаются применимыми, но с поправкой на то, что выявляемая устойчивость различных штаммов ТГЭ к инактивации не одинакова (Peretz, Supattapone et al., 2006).
5 Потенциальные методы уничтожения возбудителей ТГЭ
5.1 Методы инактивации инфекционной активности возбудителей ТГЭ
5.1.1 Общие положения
Многие контролирующие органы рекомендуют, чтобы, по мере возможности, возбудители ТГЭ, потенциально заражающие сырьевые материалы, были инактивированы, а не просто удалены из сырья. Наличие остаточного активного агента может стать впоследствии постоянным риском случайной контаминации изделия, полученного из ткани, а также контаминации производственных помещений и оборудования многоразового использования. К сожалению, большинство физических и химических методов, являющихся эффективными для инактивации переносчиков ТГЭ, достаточно травматичны и часто влияют на функциональные характеристики тканей. Для санации помещений и оборудования, которое не может быть уничтожено после однократного использования или защищено от прямого контакта с потенциально зараженными материалами, предпочтительны методы деконтаминации, которые надежно инактивируют возбудителей ТГЭ, а не просто их удаляют.
5.1.2 Физические методы инактивации инфекционной активности возбудителей ТГЭ
5.1.2.1 Тепловая обработка
При быстром нагревании с постоянным перемешиванием суспензии тканей грызунов, инфицированных почесухой, наблюдали относительно быструю, в течение нескольких минут, потерю инфекционности (Rohwer 1984), которая достигала предела выявляемых значений переносчиков ТГЭ. Тем не менее мацераты и сухие препараты агентов ТГЭ частично сохранили патогенность даже после длительного теплового воздействия (Asher, Pomeroy et al, 1986; Asher, Pomeroy et al., 1987; Taylor, Fraser et al., 1994). Сухой жар оказался менее эффективным, чем влажный, для инактивации возбудителей ТГЭ (Taylor, 2001). [Действительно, в двух публикациях, описывающих передачу ятрогенной CJD при оперативных вмешательствах, хирургические инструменты были стерилизованы сухим жаром (Nevin, McMenemy et al., 1960; Foncin, Gaches et al., 1980)]. В одной серии исследований было обнаружено, что небольшая инфекционность источника почесухи (скрейпи) сохранялась в пепле после сожжения в печи при температуре не выше 600°С (Brown, Liberski et al., 1990), но не при более высокой температуре (Brown, Rau et al., 2004). Изделия из биотканей практически не выносят тепловую обработку, необходимую для инактивации источников ТГЭ, без потери функции.
Предполагалось, что для эффективной деконтаминации возбудителей ТГЭ необходимо воздействие пара в автоклаве пористой загрузки в течение по меньшей мере 18 мин при давлении 20 бар. Однако это не подтвердилось (Taylor and McBride, 1987). Согласно рекомендациям ВОЗ, 1999, такая обработка не пригодна для деконтаминации поверхности, загрязненной засохшей тканью из источника, зараженного ТГЭ. Консультант Центра контроля заболеваемости США (USCDC) предупредил, что многие патогены переносят тепловую и химическую обработку, если зараженные поверхности не были тщательно очищены, и что для безопасного повторного использования всех медицинских устройств необходима тщательная обработка критических поверхностей [Rutala W, экспертная комиссия по ТГЭ Управления по контролю за продуктами и лекарствами США (FDA) 17 июля 2003, посещение страницы 16 июля 2009: http://www.fda.qov/ohrms/dockets/ac/03/slides/3969s1.htm]. Тем не менее тот же консультант (Rutala, 2010) отметил, что ввиду крайней редкости ятрогенных передач CJD, связанных с хирургическими инструментами (не отражены в медицинской литературе с 1980), можно предположить, что текущие стандартные методы санации и конечная стерилизация хирургических инструментов, возможно, являются эффективными для удаления агента CJD и сокращают риск до неопределяемых уровней.
Такая наблюдаемая эффективность, скорее всего, является комбинированным эффектом предварительной очистки и влажного жара, а потенциальная эффективность только одного из этих методов оказалась недостаточной (Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz, 2001, Департамент здравоохранения Великобритании, 2009).
5.1.2.2 Радиация
Возбудители ТГЭ устойчивы к инактивации как ультрафиолетовым так и ионизирующим излучениями (Alper, Haig et al., 1966; Latarjet, Muel et al., 1970; Latarjet, 1979).
5.1.3 Химические методы инактивации инфекционной активности возбудителей ТГЭ
5.1.3.1 Обработка щелочным гидролизом
Воздействие гидроксида NaOH (1N, особенно при повышенных температурах) признано эффективным для подавления инфекционности ТГЭ как в водных суспензиях, так и в тканях, высохших на поверхностях (Taylor, 2000), и широко используется в лабораториях, занимающихся переносчиками ТГЭ (Brown, Rohwer et al., 1984; Baron, Safar et al., 2001). Однако применение NaOH связано с большими рисками (щелочные свойства которого особенно проявляются в горячем состоянии и потенциально взрывоопасного при контакте с алюминием) (http://www.certified-lye.com/safety.html). Коррозирующие свойства NaOH для автоклавов, возможно, преувеличены, так как этого можно избежать, если достаточно осторожно помещать растворы в контейнерах во избежание прямого контакта с внутренней поверхностью автоклава (Brown and Merritt, 2003; Brown, Merritt et al., 2005).
Обработка гидрооксид кальция ![]() Ca(OH)2, широко применяемая при производстве желатина, оказывается гораздо менее эффективной, чем гидрооксид натрия NaOH для инактивации инфекционности возбудителей почесухи и БСЭ из инфицированных препаратов костей животных, хотя повышение температуры заметно увеличивало эффективность обработки (Grobben, Steele et al., 2005; Grobben, Steele et al., 2006; Grobben, Steele et al., 2006).
Ca(OH)2, широко применяемая при производстве желатина, оказывается гораздо менее эффективной, чем гидрооксид натрия NaOH для инактивации инфекционности возбудителей почесухи и БСЭ из инфицированных препаратов костей животных, хотя повышение температуры заметно увеличивало эффективность обработки (Grobben, Steele et al., 2005; Grobben, Steele et al., 2006; Grobben, Steele et al., 2006).
Некоторые соединения на щелочной основе (смеси химических веществ с щелочными растворами) считают такими же эффективными, как низкие концентрации щелочи. Эффективность зависит от конкретного соединения, а также от температуры обработки и концентрации конкретного продукта. Эти методы являются менее разрушительными для биотканей, но в настоящее время отсутствуют исследования по сравнению их эффективности с эффективностью обработки высокими концентрациями щелочи.
5.1.3.2 Обработка кислотами
Переносчики ТГЭ значительно, если не полностью, могут быть инактивированы воздействием концентрированной муравьиной кислоты (Brown, Liberski et al., 1990) и, как недавно доказано, уксусной кислотой в растворе додецилсульфата натрия (Peretz, Supattapone et al., 2006).
5.1.3.3 Обработка галоидом и другими окисляющими агентами
Гипохлорит натрия (домашний хлорсодержащий отбеливатель при концентрациях 5%) был признан эффективным для инактивирования инфекционности возбудителей ТГЭ в суспензиях и на поверхностях, контаминированных агентом почесухи (Taylor, 2000), и широко используется в тех случаях, когда коррозия металлов не является проблемой (Brown and Merritt, 2003; Taylor, 2004). Хлорамин и другие галоиды оказались менее эффективными (Asher, 1986). Раствор перекиси водорода также показал неэффективность для деконтаминации источников ТГЭ (Taylor, 2004), хотя в низкотемпературной газовой форме он может быть более эффективным (Langeveld, Wang et al., 2003; Fichet, Comoy et al., 2004; Yakovleva, Janiak et al., 2004; Yan, Stitz et al., 2004; Fichet, Antloga et al., 2007).
5.1.3.4 Обработка феноловыми дезинфектантами
В ходе исследований продемонстрировано, что патентованный феноловый дезинфектант подавляет инфекционность источника почесухи в зараженной суспензии до предела ее обнаружения (Ernst and Race, 1993; Race and Raymond, 2004). Обработка самим фенолом не способствует ингибированию инфекционности (Asher, Gibbs et al., 1986).
5.1.3.5 Обработка протеазой
Основанные на широко принятой прионной теории исследования по изучению действия различных вариантов обработки протеазой на инфекционность возбудителей ТГЭ показали различные результаты (Langeveld, Wang et al., 2003; Fichet, Comoy et al., 2004; Yakovleva, Janiak et al., 2004; Yan, Stitz et al., 2004; Jackson, McKintosh et al., 2005). Как было отмечено выше, тщательная очистка, несомненно, важна для освобождения поверхностей от зараженности (Rutala and Weber, 2004), и обработка протеазой, возможно, способствует этому процессу. Однако остается неясным, обладают ли протеазы дополнительным специфическим свойством по инактивации переносчиков ТГЭ путем расщепления прионного белка.
5.1.3.6 Обработка гуанидином и другими хаотропными химическими веществами
Согласно научным данным, обработка гуанидином (Manuelidis, 1997) и другими хаотропными химическими веществами (Prusiner, Groth et al., 1993) снижает инфекционность. В некоторых публикациях предполагается, что обнаруженная инактивация была обратимой при удалении хаотропного химического вещества (Prusiner, Groth et al., 1993; McKenzie, Bartz et al., 1998).
5.1.3.7 Комбинированная обработка
Отдельные исследования показывают, что комбинации обработок, инактивирующие возбудители ТГЭ и имеющие различное химическое и физическое действие, могут быть более эффективными, чем каждая обработка в отдельности (Fichet, Comoy et al., 2004). Примеры потенциально эффективных комбинированных обработок включают сочетание NaOH с нагревом (Taguchi, Tamai et al., 1991), кипячение в нейтральном чистящем средстве (Taylor, 2004) и действие уксусной кислоты в растворе чистящего средства (Peretz, Supattapone et al., 2006). Потенциального повреждения автоклавов можно избежать путем использования закрытых контейнеров для предотвращения контакта NaOH с внутренней поверхностью автоклава (Brown and Merritt, 2003; Brown, Merritt et al., 2005).
5.1.3.8 Потенциальные способы удаления возбудителей ТГЭ из медицинских изделий, полученных из нежизнеспособной ткани
В настоящее время отсутствует информация об экспериментальной валидации методов для анализа изделий, полученных из тканей, с целью снижения инфицированности возбудителем ТГЭ, за исключением двух публикаций. В одном исследовании для удаления источника почесухи из твердой мозговой оболочки хомяка использовали NaOH (Diringer and Braig, 1989), а в другом - применяли высокие температуры и давление в случае мясного продукта с инфицированием агентом почесухи (Brown, Meyer et al., 2003). В обоих случаях несмотря на то что наблюдали значительное снижение инфицированности, ни один из использованных методов инактивации не приводил к подавлению инфекционности до уровня ниже порога выявления.
Примечание - В медицинской литературе сообщается о разнообразных методах, используемых в настоящее время для стерилизации изделий, полученных из нежизнеспособной ткани человека (включая гамма-облучение с радиопротекторами или без них, а также различные химические дезинфицирующие и стерилизующие реагенты, среди них детергенты, перекись водорода, спирты, окислители [McAllister, Joyce et al., 2007) и гидроксид натрия (Hannah, Belay et al., 2001)]; по крайней мере, некоторые из этих обработок в определенной степени ухудшали функциональные характеристики изделий (McAllister, Joyce et al., 2007). Посредством некоторых методов достигалось значительное снижение количества экспериментально добавленных бактерий (гарантированный уровень стерильности [SAL] 10. Значение SAL, рекомендуемое РОА для имплантированных клеток человека, тканей и продуктов, полученных из тканей, которые переносят стерилизацию, равно 10
).
5.1.3.9 Неэффективная обработка
Газообразная окись этилена, спирты, ртутьсодержащие дезинфектанты и некоторые другие виды обработки, которые обычно используют для дезинфекции или стерилизации поверхностей, оказались непригодными для обеззараживания агентов ТГЭ; исследования с такими обработками весьма ограничены (Asher, 1986). Альдегиды не только не инактивировали возбудителей ТГЭ, но и могли стабилизировать их инфекционность или ее проявление (Taylor and McBride, 1987; Brown, Liberski et al., 1990). Другие неэффективные методы обработки приведены в документе правительства Великобритании (DoHACDPTSEWG, приложение С), в котором приведен список неэффективных методов обработки.
5.2 Методы удаления инфекционной активности возбудителей ТГЭ без инактивации инфекционности
Хотя физические методы, такие как хроматография, седиментация, фильтрация и фракционирование, потенциально способны уменьшить степень инфекционности возбудителей ТГЭ в сложных биологических системах [например, кровь и ее компоненты и плазма и ее фракции (Foster, 2004)], маловероятно, что селективное удаление возбудителей ТГЭ из неповрежденных нежизнеспособных тканей выполнимо.
6 Экспериментальная валидация методов уничтожения возбудителей ТГЭ в медицинских изделиях, содержащих нежизнеспособные ткани животного происхождения
6.1 Общие положения
При том, что лишь небольшое количество исследований посвящено использованию методов снижения или элиминации возбудителей ТГЭ из экзогенно контаминированных тканей человека, практически нет работ по деконтаминации тканей животного происхождения. Как изложено в серии стандартов ИСО 22442 (четыре части стандарта), наиболее подходящим методом для уменьшения риска является тщательный отбор животных и тканей низкого риска, а также надлежащий производственный процесс (GMP) для сокращения возможностей экзогенной контаминации нервными тканями и, в меньшей степени, лимфоретикулярными и кишечными тканями (McAllister and Joyce, 2007).
6.2 Определение группы продуктов для проведения валидационных исследований с возбудителями ТГЭ
В целях реализации предмета настоящего стандарта определение групп продуктов применимо так же, как и в определении групп, описанных в разделе 4 AAMI TIR37:2007, которые подходят для валидационного анализа методов уничтожения/удаления возбудителей ТГЭ из медицинских изделий, использующих нежизнеспособные ткани животного происхождения. Продукты, выбранные для валидационного исследования, должны, по возможности точно, соответствовать коммерческим продуктам и, с точки зрения одного эксперта или более, быть приемлемыми в качестве реалистичных и репрезентативных представителей всего семейства продуктов (основной продукт, эквивалентный продукт или имитированный продукт, как определено в 4.3.2-4.3.4 AAMI TIR37:2007).
6.3 Выбор и исследование продукта для установления и подтверждения инфицирующей дозы возбудителя ТГЭ
В настоящем стандарте определение происхождения исследуемого продукта, условий отбора проб, выбор большого числа партий для тестирования, методы работы с жидкими экстрактами из исследуемых продуктов (так как прямые оценки образцов изделия в целом на животных обычно невыполнимы) должны быть сходными с описанными в параграфе 5 AAMI TIR37:2007, которые подходят для валидации процессов уничтожения/удаления возбудителей ТГЭ в медицинских изделиях, полученных при использовании нежизнеспособных тканей животного происхождения. Необходимо отметить, что анализ возбудителей ТГЭ либо в предварительных иммунных тестах определения устойчивого к проте-азам белка ![]() , либо особенно в последующих тестах на животных, которые технически значительно более сложные, времязатратные (месяцы или годы для биооценки) и дорогостоящие в сравнении с тестами на культурах бактерий и грибов, что необходимо учитывать при выборе количества повторов при исследованиях.
, либо особенно в последующих тестах на животных, которые технически значительно более сложные, времязатратные (месяцы или годы для биооценки) и дорогостоящие в сравнении с тестами на культурах бактерий и грибов, что необходимо учитывать при выборе количества повторов при исследованиях.
6.4 Материалы, инфицированные возбудителями ТГЭ
Из немногочисленных, но постепенно накапливающихся данных следует, что, хотя все возбудители ТГЭ имеют сравнимые биологические и физические характеристики, включая высокую резистентность к инактивации различными воздействиями, разные штаммы значительно различаются в степени этой резистентности (Taylor, 2000) (Peretz, Supattapone et al., 2006). При анализе инфицированных тканей целесообразно выбирать штаммы возбудителя ТГЭ, более устойчивые к изучаемому методу инактивации, учитывая, что используемый материал имеет отношение к производственному процессу. Несмотря на то что худший вариант в производстве мало реалистичен, логистика моделей валидации обычно включает использование тканей с очень высокими концентрациями возбудителя ТГЭ (как правило, это суспензии инфицированной ткани мозга, фрагменты или мацераты). Причем следует учитывать, что такие материалы, очень часто приготовляемые из мозга грызунов, инфицированных штаммами возбудителя ТГЭ, адаптированными к грызунам (особенно возбудитель почесухи), могут не соответствовать тканям, инфицированным естественным путем по количеству или биологическим и физическим свойствам возбудителя или по другим характеристикам матрикса (исходной ткани).
Тем не менее в основном не представляется возможной валидация способов уничтожения возбудителей ТГЭ из сырьевых материалов, за исключением контаминации штаммами возбудителя ТГЭ, адаптированными к грызунам, по нескольким причинам:
a) титры возбудителя ТГЭ в тканях, инфицированных естественным путем, неизвестны, так же как и чувствительность доступных видов грызунов инфицированию полевыми изолятами (как правило, слабая). Ткани, кроме тканей мозга, имеют гораздо более низкие количества ![]() (часто не обнаруживаемые) и более низкие значения инфекционности, чем ткани мозга;
(часто не обнаруживаемые) и более низкие значения инфекционности, чем ткани мозга;
b) хорошо охарактеризованные стандартные эталонные материалы, приготовленные из тканей животных, инфицированных естественным путем, пока широко недоступны;
c) трансгенные мыши [или другие грызуны, например европейские лесные полевки (Nonno, DiBari et al., 2006)], чувствительные к инфицированию полевыми изолятами возбудителей ТГЭ, широко не доступны, за исключением отдельных исследовательских лабораторий.
6.5 Пригодность биометодов на животных (обычные и трансгенные мыши, другие грызуны, сельскохозяйственные животные)
Возбудители ТГЭ, адаптированные к грызунам, обычно получаемые из штаммов овечьей почесухи, а в последнее время также при БСЭ, использовали в экспериментальных исследованиях для изучения методов ингибирования инфекционности агентов, добавленных в различные сырьевые материалы или промежуточные продукты. Штамм возбудителя почесухи 263К, адаптированный к хомякам (Nazor, 2005), и схожие штаммы (Peretz, Scott et al., 2001), исследованные на сирийских золотистых хомячках, были особенно полезными. Штамм 301V агента БСЭ, адаптированный к мышам и исследованный на обычных мышах, позволяет лучше спрогнозировать возможное распространение возбудителя БСЭ в тканях крупного рогатого скота (Grobben, Steele et al., 2005).
Трансгенные мыши, разработанные для экспрессии аминокислотной последовательности гена PRNP других видов, могут быть полезными в отдельных случаях, но при этом возможны некоторые проблемы:
a) у мышей с чрезмерной экспрессией прионных белков развиваются нетрансмиссивные неврологические заболевания, гистопатологически напоминающие ТГЭ, что иногда затрудняет интерпретацию результатов исследования инфекционности (Nazor, Seward, et al., 2007);
b) большинство линий PRNP-трансгенных мышей в настоящее время могут быть получены только непосредственно от разработчиков.
По сравнению с отдельными линиями обычных мышей к настоящему времени преимущество мышей с экспрессией аминокислотной последовательности бычьего гена PRNP не было доказано, хотя отдельные линии могут быть более чувствительными. Возбудители ТГЭ, полученные от человека, не часто вызывают заболевание у обычных мышей, и, так как исследования, использующие нечеловекообразных приматов, становятся все более трудно выполнимыми, трансгенные мыши с экспрессией аминокислотной последовательности гена PRNP человека становятся наиболее практичными для изучения инфекционности возбудителей ТГЭ или инфекционного процесса. Как отмечено, европейские лесные полевки высокочувствительны к ряду возбудителей ТГЭ (Cartoni, Schinina et al. 2005; Nonno, DiBari et al., 2006; ВОЗ, 2006; Cartoni, Schinina et al., 2007), однако они оказались относительно менее чувствительными, чем мыши, к возбудителю БСЭ и к появляющемуся штамму Nor98 возбудителя почесухи; к тому же разводимые полевки широко недоступны.
Можно утверждать, что способы уничтожения инфекционности возбудителей ТГЭ животного происхождения должны быть надлежащим образом изучены, используя материалы от естественно зараженных животных на восприимчивых к этому штамму животных того же вида; хотя исследования патогенеза БСЭ на телятах (ВОЗ, 2006; Masujin, Matthews et al., 2007) и почесухи у овец (Hadlow, Race et al., 1979; Hunter, Foster et al., 2002; Hunter and Houston, 2002; Hunter, 2003) были весьма ограниченными, в целом изучение подавления инфекционности возбудителей ТГЭ на крупных животных не практикуется.
6.6 Перспективы разработок клеточных культур для исследования инфекционной активности возбудителей ТГЭ
Существует описание нескольких клеточных линий, которые поддерживают размножение отдельных возбудителей ТГЭ (Klohn, Stoltze et al., 2003; Kocisko, Morrey et al., 2004; Kocisko, Engel et al., 2005; ВОЗ, 2006; Liu, Sun et al., 2008). Хотя на клетках не было продемонстрировано какого-либо выраженного цитопатического эффекта, в некоторых случаях белок ![]() детектировался. Такой клеточный тест оказался гораздо более чувствительным, чем прямое обнаружение белка
детектировался. Такой клеточный тест оказался гораздо более чувствительным, чем прямое обнаружение белка ![]() в исходной инфицированной ткани. К сожалению, подобные методы на клеточных культурах не были разработаны для обнаружения возбудителей БСЭ, полевых изолятов возбудителей почесухи овец или возбудителей ТГЭ человеческого происхождения. Дополнительно представляли проблему ложно-положительные результаты обнаружения белка
в исходной инфицированной ткани. К сожалению, подобные методы на клеточных культурах не были разработаны для обнаружения возбудителей БСЭ, полевых изолятов возбудителей почесухи овец или возбудителей ТГЭ человеческого происхождения. Дополнительно представляли проблему ложно-положительные результаты обнаружения белка ![]() (Vorberg, Raines et al., 2004). Разработка надежных и чувствительных методов на основе клеточных культур для возбудителей ТГЭ животных будут значительно способствовать валидации методов уничтожения агентов в материалах животного происхождения.
(Vorberg, Raines et al., 2004). Разработка надежных и чувствительных методов на основе клеточных культур для возбудителей ТГЭ животных будут значительно способствовать валидации методов уничтожения агентов в материалах животного происхождения.
6.7 Корреляции между количеством белка 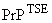 и методами оценки инфекционной активности возбудителей ТГЭ
и методами оценки инфекционной активности возбудителей ТГЭ
Хотя белок ![]() обычно обнаруживают в тканях и экстрактах тканей, инфицированных возбудителями ТГЭ, ряд исследователей не смогли обнаружить
обычно обнаруживают в тканях и экстрактах тканей, инфицированных возбудителями ТГЭ, ряд исследователей не смогли обнаружить ![]() в материалах с высокой заражающей активностью (Lasmezas, Deslys et al., 1997; Manuelidis, Fritch et al., 1997; Manson, Jamieson et al., 1999; Race, Meade-White et al., 2002; Barron, Campbell et al., 2007; Piccardo, Manson et al., 2007). Более того, иммунореактивные белки со свойствами
в материалах с высокой заражающей активностью (Lasmezas, Deslys et al., 1997; Manuelidis, Fritch et al., 1997; Manson, Jamieson et al., 1999; Race, Meade-White et al., 2002; Barron, Campbell et al., 2007; Piccardo, Manson et al., 2007). Более того, иммунореактивные белки со свойствами ![]() были обнаружены в тканях, не содержащих источника, передающего губчатую энцефалопатию. Несколько исследователей пришли к заключению, что в тканях животных, которые никогда не подвергались действию возбудителей ТГЭ, может происходить индукция инфекционной активности (Yuan, Xiao et al., 2006; Deleault, Harris et al., 2007; Castilla, 2008; Jackson et al., 2009). Существующие противоречивые результаты требуют скорейшего прояснения (Aguzzi, 2007), и их необходимо учитывать при интерпретации результатов исследований на белок
были обнаружены в тканях, не содержащих источника, передающего губчатую энцефалопатию. Несколько исследователей пришли к заключению, что в тканях животных, которые никогда не подвергались действию возбудителей ТГЭ, может происходить индукция инфекционной активности (Yuan, Xiao et al., 2006; Deleault, Harris et al., 2007; Castilla, 2008; Jackson et al., 2009). Существующие противоречивые результаты требуют скорейшего прояснения (Aguzzi, 2007), и их необходимо учитывать при интерпретации результатов исследований на белок ![]() .
.
Несмотря на то что в нескольких публикациях сообщалось, что новые методы на основе выявления белка ![]() более чувствительны, чем биологические тесты на грызунах (Safar, Cohen et al., 2000; Safar, Scott et al., 2002; Lee, Long et al., 2005; Safar, Geschwind et al., 2005; Castilla, Saa et al., 2006; Soto, Estrada et al., 2006), данные результаты следует независимо проверять в сравнительных слепых и рандомизированных исследованиях.
более чувствительны, чем биологические тесты на грызунах (Safar, Cohen et al., 2000; Safar, Scott et al., 2002; Lee, Long et al., 2005; Safar, Geschwind et al., 2005; Castilla, Saa et al., 2006; Soto, Estrada et al., 2006), данные результаты следует независимо проверять в сравнительных слепых и рандомизированных исследованиях.
6.8 Снижение инфекционной активности или невозможность ее определения в пределах чувствительности метода детектирования
Подтвержденное снижение инфекционной активности (или, в качестве предварительного этапа, определение количества ![]() ) считают информативным при использовании надежных методов с достаточным количеством повторных экспериментов и проб в каждом эксперименте для обеспечения воспроизводимости результатов. Также, как и для оценки снижения инфекционности другими инфекционными агентами, следует крайне осторожно воспринимать результаты разных методов, особенно когда снижение составляет менее 1000-кратного. По этой причине рекомендовано проведение двух валидированных способов снижения инфекционности, основанных на разных химико-физических принципах [("ортогональность" (Trejo, Hotta et al., 2003)] в любой производственной схеме, предназначенной для снижения риска контаминации. В описании биологических продуктов в регламентах FDA обозначено следующее: при использовании каждого из двух способов снижение инфекционности по меньшей мере в 10000 раз позволит утверждать о снижении риска контаминации определенным патогеном до приемлемого уровня в условиях проведения производственного процесса (Farshid, Taffs et al., 2005).
) считают информативным при использовании надежных методов с достаточным количеством повторных экспериментов и проб в каждом эксперименте для обеспечения воспроизводимости результатов. Также, как и для оценки снижения инфекционности другими инфекционными агентами, следует крайне осторожно воспринимать результаты разных методов, особенно когда снижение составляет менее 1000-кратного. По этой причине рекомендовано проведение двух валидированных способов снижения инфекционности, основанных на разных химико-физических принципах [("ортогональность" (Trejo, Hotta et al., 2003)] в любой производственной схеме, предназначенной для снижения риска контаминации. В описании биологических продуктов в регламентах FDA обозначено следующее: при использовании каждого из двух способов снижение инфекционности по меньшей мере в 10000 раз позволит утверждать о снижении риска контаминации определенным патогеном до приемлемого уровня в условиях проведения производственного процесса (Farshid, Taffs et al., 2005).
6.9 Определение количества повторных валидации, необходимых для обоснования вывода о снижении инфекционности, а не о разбросе данных при проведении исследования
Количество повторных исследований и повторных анализов в каждом исследовании определено в большой степени разбросом данных при анализе и изучаемым способом снижения патогенности. Предлагаемый метод определения необходимого количества валидационных исследований должен быть надежным, т.е. валидационные исследования следует проводить при тех же условиях, при которых осуществляется производственный процесс (pH, ионная сила, температура и органическая нагрузка).
6.10 Необходимость валидации способов поэтапного уменьшения количества белка 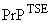 и инфекционной активности по сравнению с процессом валидации в целом
и инфекционной активности по сравнению с процессом валидации в целом
Несмотря на то что представляется рациональным валидировать эффективность всего производственного процесса путем выраженной инактивации соответствующего инфицирующего агента ТГЭ, внесенного в исходный материал в условиях контролируемого пилотного эксперимента, моделирующего технологический процесс получения конечного продукта, полностью свободного от детектируемого инфицирующего агента, такая валидация может быть не достижимой по нескольким причинам. Вводимая в исходный материал начальная инфекционная активность при экспериментальном моделировании ТГЭ может быть незначительной; различные этапы могут существенно разбавить количество введенного исходного материала в конечном продукте, что может повлиять на достоверность получаемого результата при валидации. Если в образце инфицирующая доза существенно снизилась в результате разбавления, то можно получить ложно отрицательный результат. Решением этой проблемы может быть проведение исследования большего количества образцов, что чаще всего невыполнимо. Соотношение "поверхность - объем" не соблюдается в уменьшенных пилотных моделях.
Таким образом, аналогично методам вирусной деконтаминации биологических продуктов (QA5 "Оценка вирусной безопасности биотехнологических продуктов, полученных из клеточных линий человеческого или животного происхождения", Международная конференция по гармонизации, 1998, посещение страницы 16 июля 2009: http://www.emea.europa.eu/pdfs/human/ich/029595en.pdf) в случае возбудителей ТГЭ требуется введение большего количества промежуточных стадий для имитации реальных условий технологического процесса в целом, а затем проведение расчета потенциальной общей эффективности всей схемы производства путем добавления ортогональных понижающих коэффициентов в логарифмическом масштабе для получения общего понижающего показателя в логарифмическом масштабе, учитывая сопутствующие неопределенности.
Понижающие коэффициенты каждого этапа со сходной инактивацией или механизмом уничтожения не должны быть добавлены в кумулятивный понижающий коэффициент. Дальнейшее руководство по валидационным исследованиям приведено в ИСО 22442-3.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 22442-1 | IDT | ГОСТ Р ИСО 22442-1-2011 "Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 1. Менеджмент риска" |
ISO 22442-2 | IDT | ГОСТ Р ИСО 22442-2-2011 "Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 2. Контроль отбора, сбора и обработки" |
ISO 22442-3 | IDT | ГОСТ Р ИСО 22442-3-2011 "Изделия медицинские, использующие ткани и их производные животного происхождения. Часть 3. Валидация уничтожения и/или дезактивации вирусов и агентов инфекционной губчатой энцефалопатии" |
ISO 14160 | IDT | ГОСТ ISO 14160-2011 "Стерилизация одноразовых медицинских изделий, содержащих материалы животного происхождения. Валидация и текущий контроль стерилизации с помощью жидких стерилизующих средств" |
Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
[1] | ISO 14160, Sterilization of health care products-Liquid chemical sterilizing agents for single-use medical devices utilizing animal tissues and their derivatives-Requirements for characterization, development, validation and routine control of a sterilization process for medical devices |
[2] | ISO 22442-1, Medical devices utilizing animal tissues and their derivatives - Part 1: Application of risk management |
[3] | ISO 22442-2, Medical devices utilizing animal tissues and their derivatives - Part 2: Controls on sourcing, collection and handling |
[4] | ISO 22442-3, Medical devices utilizing animal tissues and their derivatives - Part 3: Validation of the elimination and/ or inactivation of viruses and transmissible spongiform encephalopathy (TSE) agents |
[5] | Aguzzi, A. (2007). "Prion biology: the quest for the test" Nat Methods 4(8): 614-6 |
[6] | Alper, T.D. Haig, et al. (1966). "The exceptionally small size of the scrapie agent" Biochemical and Biophysical Research Communications 22: 278-284 |
[7] | Asher, D. (1986). Slow viral infections: Safe handling of the agents of subacute spongiform encephalopathies. Laboratory Safety: Principles and Practices. B. Miller. Washington, DC, American Society for Microbiology. 1: 59-71 |
[8] | Asher, D., K.Pomeroy, et al. (1987). Attempts to disinfect surfaces contaminated with etiologic agents of the spongiform encephalopathies. Vll-th International Congress of Virology, Edmonton, Alberta, Canada |
[9] | Asher, D., K.Pomeroy, et al. (1986). Practical inactivation of scrapie agent on surfaces. IX-th International Congress of Infectious and Parasitic Diseases, Munich, Germany, FuturamedVerlag |
[10] | Asher, D.M., С.J.Gibbs, Jr., et al. (1986). Slow viral infections: safe handling of the agents of the subacute spongiform encephalopathies. Laboratory Safety: Principles and Practice. B.M.Miller, D.H.M. |
[11] | Baron, H., J.Safar, et al. (2001). Prions. Disinfection, Sterilization and Preservation. S.Block. Philadelphia, Lippincott Williams and Wilkins 1: 659-674 |
[12] | Barron, R.M., S.L.Campbell, et al. (2007). "High titers of transmissible spongiform encephalopathy infectivity associated with extremely low levels of PrPSc in vivo" J Biol Chem 282 (49): 35878-86 |
[13] | Brown, P., P.P.Liberski, et al. (1990). "Resistance of scrapie infectivity to steam autoclaving after formaldehyde fixation and limited survival after ashing at 360°C: practical and theoretical implications" Journal of Infectious Diseases 161: 467-472 |
[14] | Brown, P., R.Meyer, et al. (2003). "Ultra-high-pressure inactivation of prion infectivity in processed meat: a practical method to prevent human infection" ProcNatlAcadSci U S A 100(10): 6093-7 |
[15] | Brown, P., E.H.Rau, et al. (2004). "Infectivity studies of both ash and air emissions from simulated incineration of scrapie-contaminated tissues" Environ Sci Technol 38(22): 6155-60 |
[16] | Brown, P., R.Rohwer, et al. (1984). "Sodium hydroxide disinfection of Creutzfeldt-Jakob disease virus" New England Journal of Medicine 310: 727 |
[17] | Brown, S.A. and K.Merritt (2003). "Use of containment pans and lids for autoclaving caustic solutions" Am J Infect Control 31(4): 257-60 |
[18] | Brown, S.A., K.Merritt, et al. (2005). "Effects on instruments of the World Health Organization-recommended protocols for decontamination after possible exposure to transmissible spongiform encephalopathy-contaminated tissue." J Biomed Mater Res B AppI Biomater 72(1): 186-90 |
[19] | Cartoni, C., M.E.Schinina, et al. (2007). "Quantitative profiling of the pathological prion protein allotypes in bank voles by liquid chromatography-mass spectrometry" J Chromatogr B AnalytTechnol Biomed Life Sci 849(1-2): 302-6 |
[20] | Cartoni, C., M.E.Schinina, et al. (2005). "Identification of the pathological prion protein allotypes in scrapie-infected heterozygous bank voles (Clethrionomysglareolus) by high-performance liquid chromatography-mass spectrometry" J Chromatogr A 1081(1): 122-6 |
[21] | Castilla, J. (2008). De novo generation of prion infectivity in a cell-free system (announced). Cambridge healthtech Institute 12 Annual Transmissible Spongiform Encephalopathies [Symposium]. Baltimore |
[22] | Castilla, J., A.Gutierrez-Adan, et al. (2004). "Subclinical bovine spongiform encephalopathy infection in transgenic mice expressing porcine prion protein" J Neurosci 24(21): 5063-9 |
[23] | Castilla, J., P.Saa, et al. (2006). "Protein misfolding cyclic amplification for diagnosis and prion propagation studies" Methods Enzymol 412: 3-21 |
[24] | Deleault, N.R., В.T.Harris, et al. (2007). "Formation of native prions from minimal components in vitro" ProcNatlAcadSci U S A 104(23): 9741-6 |
[25] | Diringer, H. and H.R.Braig (1989). "Infectivity of unconventional viruses in dura mater" Lancet 1(8635): 439-40 |
[26] | Ernst, D.R. and R.E.Race (1993). "Comparative analysis of scrapie agent inactivation methods" Journal of Virological Methods (Amsterdam) 41(2): 193-201 |
[27] | Farshid, M., R.E.Taffs, et al. (2005). "The clearance of viruses and transmissible spongiform encephalopathy agents from biologicals" Curr Opin Biotechnol 16(5): 561-7 |
[28] | Fichet, G., K.Antloga, et al. (2007). "Prion inactivation using a new gaseous hydrogen peroxide sterilisation process" J Hosp Infect 67(3): 278-86 |
[29] | Fichet, G., E.Comoy, et al. (2004). "Novel methods for disinfection of prion-contaminated medical devices" Lancet 364(9433): 521-6 |
[30] | Foncin, J.F., J. Gaches, et al. (1980). "Transmission iatrogeneinterhumaine possible de maladie de Creutzfeldt-Jakob avec atteinte des grains du cervelet" Rev Neurol (Paris) 136: 280 |
[31] | Foster, P.R. (2004). "Removal of TSE agents from blood products"Vox Sang 87 Suppl 2: 7-10 |
[32] | Grobben, A.H., P.J. Steele, et al. (2006a). "Inactivation of BSE infectivity on chips of bone by autoclaving during the manufacture of gelatine" Vet Rec 158(3): 94-6 |
[33] | Grobben, A.H., P.J.Steele, et al. (2006b). "Inactivation of transmissible spongiform encephalopathy agents during the manufacture of dicalcium phosphate from bone" Vet Rec 158(11): 361-6 |
[34] | Grobben, A.H., P.J.Steele, et al. (2005). "Inactivation of the BSE agent by the heat and pressure process for manufacturing gelatine" Vet Rec 157(10): 277-81 |
[35] | Hadlow, W., R.Race, et al. (1979). Natural infection of sheep with scrapie virus. New York, Academic Press |
[36] | Hannah, E.L., E.D.Belay, et al. (2001). "Creutzfeldt-Jakob disease after receipt of a previously unimplicated brand of dura mater graft" Neurology 56(8): 1080-3 |
[37] | Hunter, N. (2003). "Scrapie and experimental BSE in sheep" Br Med Bull 66: 171-83 |
[38] | Hunter, N., J.Foster, et al. (2002). "Transmission of prion diseases by blood transfusion" J Gen Virol 83(Pt 11): 2897-905 |
[39] | Hunter, N. and F.Houston (2002). "Can prion diseases be transmitted between individuals via blood transfusion: evidence from sheep experiments" Dev Biol (Basel) 108: 93-8 |
[40] | Jackson, G.S., E.McKintosh, et al. (2005). "An enzyme-detergent method for effective prion decontamination of surgical steel" J Gen Virol 86(Pt 3): 869-78 |
[41] | Kennedy, R.H., R.N.Hogan, et al. (2001). "Eye banking and screening for Creutzfeldt-Jakob disease" Arch Ophthalmol 119(5): 721-6 |
[42] | Kimberlin, R.H. and C.A.Walker (1977). "Characteristics of a short incubation model of scrapie in the golden hamster" Journal of General Virology (London) 34: 295-304 |
[43] | Klohn, P.C., L.Stoltze, et al. (2003). "A quantitative, highly sensitive cell-based infectivity assay for mouse scrapie prions" ProcNatlAcadSci U S A 100(20): 11666-71 |
[44] | Kocisko, D.A., A.L.Engel, et al. (2005). "Comparison of protease-resistant prion protein inhibitors in cell cultures infected with two strains of mouse and sheep scrapie" Neurosci Lett 388(2): 106-11 |
[45] | Kocisko, D.A., J.D.Morrey, et al. (2004). "Evaluation of new cell culture inhibitors of protease-resistant prion protein against scrapie infection in mice" J Gen Virol 85(Pt 8): 2479-83 |
[46] | Langeveld, J.P., J.J.Wang, et al. (2003). "Enzymatic degradation of prion protein in brain stem from infected cattle and sheep" J Infect Dis 188(11): 1782-9 |
[47] | Lasmezas, C.I., J.P.Deslys, et al. (1997). "Transmission of the BSE agent to mice in the absence of detectable abnormal prion protein" Science 275(5298): 402-5 |
[48] | Latarjet, R. (1979). Inactivation of the agents of scrapie, Creutzfeldt-Jakob disease, and kuru by radiations. Slow transmissible diseases of the nervous system. S.B.Prusiner and W.J.Hadlow. New York, Academic Press, Inc. 2: 387-407 |
[49] | Latarjet, R., B.Muel, et al. (1970). "Inactivation of the scrapie agent by near monochromatic ultraviolet light" Nature 227: 1341-1343 |
[50] | Lee, I.S., J.R.Long, et al. (2005). "Selective precipitation of prions by polyoxometalate complexes" J Am ChemSoc 127(40): 13802-3 |
[51] | Llewelyn, C.A., P.E.Hewitt, et al. (2004). "Possible transmission of variant Creutzfeldt-Jakob disease by blood transfusion" Lancet 363(9407): 417-21 |
[52] | Liu, Y., R.Sun, et al. (2008). "A rapid accurate culture assay for infectivity in transmissible encephalopathies" J Neurovirol 14(5): 352-61 |
[53] | Manson, J.C., E.Jamieson, et al. (1999). "A single amino acid alteration (101L) introduced into murine PrP dramatically alters incubation time of transmissible spongiform encephalopathy" Embo J 18(23): 6855-64 |
[54] | Manuelidis, L. (1997). "Decontamination of Creutzfeldt-Jakob disease and other transmissible agents" J Neurovirol 3(1): 62-5 |
[55] | Manuelidis, L., W.Fritch, et al. (1997). "Evolution of a strain of CJD that induces BSE-like plaques" Science 277(5322): 94-8 |
[56] | Masujin, K., D.Matthews, et al. (2007). "Prions in the peripheral nerves of bovine spongiform encephalopathy-affected cattle" J Gen Virol 88(Pt 6): 1850-8 |
[57] | McAllister, D.R., M.J.Joyce, et al. (2007). "Allograft update: the current status of tissue regulation, procurement, processing, and sterilization" Am J Sports Med 35(12): 2148-58 |
[58] | McKenzie, D., J.Bartz, et al. (1998). "Reversibility of scrapie inactivation is enhanced by copper" J Biol Chem 273(40): 25545-7 |
[59] | Mills, J.L., L.B.Schonberger, et al. (2004). "Long-term mortality in the United States cohort of pituitary-derived growth hormone recipients" J Pediatr 144(4): 430-6 |
[60] | Minor, P., J.Newham, et al. (2004). "Standards for the assay of Creutzfeldt-Jakob disease specimens" J Gen Virol 85(Pt6): 1777-84 |
[61] | Nazor, K.E., Т.Seward, et al. (2007). "Motor behavioral and neuropathological deficits in mice deficient for normal prion protein expression" Biochim Biophys Acta 1772(6): 645-53 |
[62] | Nevin, S., W.H.McMenemy, et al. (1960). "Subacute spongiform encephalopathy: a subacute form of encephalopathy attributable to vascular dysfunction (spongiform cerebral atrophy)" Brain 83: 519-564 |
[63] | Nonno, R., M.A.Di Bari, et al. (2006). "Efficient transmission and characterization of Creutzfeldt-Jakob disease strains in bank voles" PLoS Pathog 2(2): e12 |
[64] | Peden, A.H., M.W.Head, et al. (2004). "Preclinical vCJD after blood transfusion in a PRNPcodon 129 heterozygous patient" Lancet 364(9433): 527-9 |
[65] | Peden, A.H., D.L.Ritchie, et al. (2005). "Risks of transmission of variant Creutzfeldt-Jakob disease by blood transfusion" Folia Neuropathol 43(4): 271-8 |
[66] | Peretz, D., M.R.Scott, et al. (2001). "Strain-specified relative conformational stability of the scrapie prion protein" Protein Sci 10(4): 854-63 |
[67] | Peretz, D., S.Supattapone, et al. (2006). "Inactivation of prions by acidic sodium dodecyl sulfate" J Virol80(1): 322-31 |
[68] | Piccardo, P., J.C.Manson, et al. (2007). "Accumulation of prion protein in the brain that is not associated with transmissible disease"ProcNatlAcadSci U S A104(11): 4712-7 |
[69] | Prusiner, S.B. (1982). "Novel proteinaceous infectious particles cause scrapie" Science 216: 136-144 |
[70] | Prusiner, S.B., D.Groth, et al. (1993). "Attempts to restore scrapie prion infectivity after exposure to protein denaturants" Proceedings of the National Academy of Sciences of the United States of America 90(7): 2793-2797 |
[71] | Race, R., K.Meade-White, et al. (2002). "Subclinical scrapie infection in a resistant species: persistence, replication, and adaptation of infectivity during four passages" J Infect Dis 186 Suppl 2: S166-70 |
[72] | Race, R.E. and G.J.Raymond (2004). "Inactivation of transmissible spongiform encephalopathy (prion) agents by environLpH" J Virol 78(4): 2164-5 |
[73] | Rohwer, R.G. (1984). "Scrapie infectious agent is virus-like in size and susceptibility to inactivation" Nature (london) 308: 658-662 |
[74] | Rohwer, R.G. (1984). "Virus-like sensitivity of scrapie agent to heat inactivation" Science 223: 600-602 |
[75] | Rutala, W.A. and D.J.Weber (2004). "Disinfection and sterilization in health care facilities: what clinicians need to know"Clin Infect Dis 39(5): 702-9 |
[76] | Rutala, W.A. and D.J.Weber (2004). "The benefits of surface disinfection" Am J Infect Control 32(4): 226-31 |
[77] | Rutala, W.A. and D.J.Weber (2010). "Guideline for disinfection and sterilization of prion-contaminated medical instruments" Infect Control HospEpidemiol 31(2): 107-17 |
[78] | Safar, J., F.E.Cohen, et al. (2000). "Quantitative traits of prion strains are enciphered in the conformation of the prion protein" Arch VirolSuppI (16): 227-35 |
[79] | Safar, J.G., M.D.Geschwind, et al. (2005). "Diagnosis of human prion disease" ProcNatlAcadSci USA 102(9): 3501-6 |
[80] | Safar, J.G., M.Scott, et al. (2002). "Measuring prions causing bovine spongiform encephalopathy or chronic wasting disease by immunoassays and transgenic mice" Nat Biotechnol 20(11): 1147-50 |
[81] | Soto, C., L.Estrada, et al. (2006). "Amyloids, prions and the inherent infectious nature of misfolded protein aggregates" Trends Biochem Sci 31(3): 150-5 |
[82] | Taguchi, F., Y.Tamai, et al. (1991). "Proposal for a procedure for complete inactivation of the Creutzfeldt-Jakob disease agent" Arch Virol 119(3-4): 297-301 |
[83] | Taylor, D. (2004). Transmissible degenerative encephalopathies: inactivation of the unconventional causal agents. Russell, Hugo and Ayliffe's Principles and Practice of Disinfection, Preservation and Sterilization. A. Fraise, P. Lambert and J.-Y.Maillard.Maiden, Massachusetts, Blackwell Publishing.1: 324-341 |
[84] | Taylor, D.M. (2000). "Inactivation of transmissible degenerative encephalopathy agents: A review" Vet J 159(1): 10-17 |
[85] | Taylor, D.M. (2001). "Resistance of transmissible spongiform encephalopathy agents to decontamination" ContribMicrobiol7: 58-67 |
[86] | Taylor, D.M. (2004). "Resistance of transmissible spongiform encephalopathy agents to decontamination"Contrib Microbiol 11: 136-45 |
[87] | Taylor, D.M., H.Fraser, et al. (1994)."Decontamination studies with the agents of bovine spongiform encephalopathy and scrapie" Arch Virol 139(3-4): 313-26 |
[88] | Taylor, D.M. and P.A.McBride (1987). "Autoclaved, formol-fixed scrapie mouse brain is suitable for histopathological examination, but may still be infective" Acta Neuropathol (Berl) 74(2): 194-6 |
[89] | Trejo, S.R., J.A.Hotta, et al. (2003). "Evaluation of virus and prion reduction in a new intravenous immunoglobulin manufacturing process" Vox Sang 84(3): 176-87 |
[90] | UK Department of Health. TSE Decontamination and Waste Disposal Guidance(Transmissible spongiform encephalopathy agents: safe working and the prevention of infection: Annex С (November 2009) (http://www.dh.gov.uk/prod_consum_dh/groups/dh_digitalassets/@dh/@ab/documents/digitalasset/dh_108602.pdf) |
[91] | UK Health Protection Agency Press Release (2009 Feb 17) "vCJD abnormal prion protein found in a patient with haemophilia at post mortem. Evidence of infection with the agent (abnormal prion protein) that causes variant Creutzfeldt-Jakob Disease (vCJD) has been found at post mortem in the spleen of a person with haemophilia" Volume, DOI |
[92] | Vorberg, I., A.Raines, et al. (2004). "Acute formation of protease-resistant prion protein does not always lead to persistent scrapie infection in vitro" J Biol Chem 279(28): 29218-25 |
[93] | Wells, G.A., S.A.Hawkins, et al. (2003). "Studies of the transmissibility of the agent of bovine spongiform encephalopathy to pigs" J Gen Virol 84(Pt4): 1021-31 |
[94] | Wells, G.A., T.Konold, et al. (2007). "Bovine spongiform encephalopathy: the effect of oral exposure dose on attack rate and incubation period in cattle" J Gen Virol 88(Pt4): 1363-73 |
[95] | World Health Organization. (1999). "WHO General Considerations for Effective TSE Agent Decontamination in Healthcare Settings" Retrieved Oct 15, 2003, 2003, from www.who.int/emc-documents/tse/docs/whocdscsraph2003.pdf |
[96] | World Health Organization (2006). WHO Guidelines on Tissue Infectivity Distribution in Transmissible Spongiform Encephalopathies, Geneva |
[97] | Yakovleva, O., A.Janiak, et al. (2004). "Effect of protease treatment on plasma infectivity in variant Creutzfeldt-Jakob disease mice" Transfusion 44(12): 1700-5 |
[98] | Yan, Z.X., L.Stitz, et al. (2004). "Infectivity of prion protein bound to stainless steel wires: a model for testing decontamination procedures for transmissible spongiform encephalopathies" Infect Control Hosp Epidemiol 25(4): 280-3 |
[99] | Yuan, J., X.Xiao, et al. (2006). "Insoluble aggregates and protease-resistant conformers of prion protein in uninfected human brains" J Biol Chem 281(46): 34848-58 |
[100] | Bundesgesundheitsbl-Gesundheitsforsch-Gesundheitsschutz 2001 44: 1115-1126, Springer Verlag (2001), "Anforderungen an die Hygiene bei der Aufbereitung von Medizinprodukten", publication in German, English translation can be obtained under (http://www.infection-prevention.eu/Nutzerdaten/File/germany_hygiene_requirements_for_reprocessing_medical_devices.pdf) |
[101] | DoH ACDP TSE WG - annex С "General principles of decontamination and waste disposal", published in November 2009 (http://www.dh.gov.uk/prod_consum_dh/groups/dh_digitalassets/@dh/@ab/documents/digitalasset/dh_108602.pdf) |
УДК 615.46:002:006.354 | ОКС 11.020 | Р 23 | ОКП 93 9000 |
Ключевые слова: изделия медицинские, ткань животного происхождения | |||
Редакция документа с учетом
изменений и дополнений подготовлена

