ГОСТ ISO 10993-4-2020
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
Изделия медицинские
ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 4
Исследования изделий, взаимодействующих с кровью
Medical devices. Biological evaluation of medical devices. Part 4. Selection of tests for interactions with blood
МКС 11.020
Дата введения 2021-03-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 31 августа 2020 г. N 132-П)
За принятие проголосовали:
Краткое наименование страны по | Код страны | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 16 октября 2020 г. N 866-ст межгосударственный стандарт ГОСТ ISO 10993-4-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 марта 2021 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-4:2017* "Оценка биологического действия медицинских изделий. Часть 4. Исследование изделий, взаимодействующих с кровью" ("Biological evaluation of medical devices - Part 4: Selection of tests for interactions with blood", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВЗАМЕН ГОСТ ISO 10993-4-2011
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
ISO (Международная организация по стандартизации) является федерацией национальных органов по стандартизации (органов - членов ISO). Работу по подготовке международных стандартов проводят через технические комитеты ISO. Каждая организация-член, заинтересованная в области деятельности, для которой создан технический комитет, имеет право быть представленной в данном комитете. Международные правительственные и неправительственные организации также принимают участие в работе ISO. ISO тесно сотрудничает с Международной Электротехнической Комиссией (IEC) по вопросам стандартизации электротехнической продукции.
Процедуры, примененные при разработке настоящего стандарта, а также процедуры, предназначенные для его дальнейшей поддержки, приведены в Директиве ISO/IEC, часть 1. В частности, следует обратить внимание на различные критерии утверждения для различных типов документов ISO. Настоящий стандарт составлен в соответствии с редакционными правилами Директив ISO/IEC, часть 2 (www.iso.org/directives). Следует обратить внимание на возможность того, что некоторые элементы настоящего стандарта могут быть объектом патентных прав.
ISO не несет ответственности за обозначение каких-либо таковых патентных прав. Детали каких-либо патентных прав, обозначенных при разработке настоящего стандарта, будут включены во введении и/или в списке полученных патентных деклараций ISO (см. www.iso.org/patents).
Любая торговая марка, упомянутая в настоящем стандарте, является информацией, приведенной для удобства пользователей и не является рекламой.
Для разъяснения добровольного характера стандартов, значений конкретных терминов ISO и выражений, связанных с оценкой соответствия, а также информации о приверженности ISO принципам ВТО по техническим барьерам в торговле (TBT) см. следующий URL: www.iso.org/iso/foreword.html.
Настоящий стандарт разработан Техническим комитетом ISO/TC 194 "Биологическая и клиническая оценка медицинских изделий".
Данное третье издание отменяет и заменяет второе издание (ISO 10993-4:2002), которое технически пересмотрено.
Оно также включает изменение ISO 10993-4:2002/Amd 1:2006.
Были сделаны следующие изменения:
a) пересмотрены некоторые определения и добавлены новые определения;
b) объединены таблицы 1 и 2 в одну новую таблицу 1 с реорганизованными категориями исследований и заголовками для подчеркивания и раздельного рассмотрения гемолиза, индуцированного материалами и механическими воздействиями, а также исследований in vitro и in vivo для оценки риска тромбоза;
c) объединены таблицы 3 и 4 в одну новую таблицу 2 с упрощенным списком рекомендуемых и наиболее распространенных тестов;
d) обновлено приложение B, включающее описание только наиболее распространенных используемых тестов для оценки взаимодействий изделий с кровью;
e) добавлено приложение C, содержащее описание тромбоза in vivo и методов исследования;
f) обновлено приложение D, бывшее приложением C в предыдущем издании, и теперь включает добавленную информацию по механически индуцированному гемолизу;
g) добавлено приложение E, включающее описание исследования комплемента и сведения о лучших методах исследования;
h) добавлены приложения F и G, включающие менее распространенные методы, используемые для оценки взаимодействий с кровью, и методы исследований, которые не рекомендуется применять в доклинической оценке взаимодействия медицинского изделия с кровью, соответственно. Многие из этих методов ранее были включены в приложение B;
i) небольшие стилистические и лексические уточнения внесены в текст;
j) реорганизован список литературы и обновлен дополнительными и более актуальными источниками.
Выбор и планирование методов исследований взаимодействия медицинских изделий с кровью должны учитывать конструкцию изделия, материалы, клиническое применение, условия использования и риск-выгоду.
Такой уровень конкретности может быть описан только в вертикальных стандартах, применяемых к конкретному или ограниченному виду медицинских изделий.
Первоначальным источником для разработки настоящего стандарта была публикация "Guidelines for blood/material interactions" ("Руководство по взаимодействию материалов с кровью"), отчет Национального института болезней сердца, легких и крови [14], главы 9 и 10. Эта публикация была впоследствии пересмотрена [15].
1 Область применения
Настоящий стандарт распространяется на медицинские изделия (МИ), включая материалы, предполагаемые для изготовления МИ, взаимодействующие с кровью, и устанавливает общие требования к оценке их биологического действия.
В настоящем стандарте приведены:
a) классификация МИ, предназначенных для использования в контакте с кровью, основанная на применении и длительности контакта, в соответствии с ISO 10993-1;
b) фундаментальные принципы для оценки биологического действия МИ при контакте с кровью;
c) рекомендации по выбору методов исследований МИ в соответствии с конкретными видами и категориями.
Методы исследований МИ конкретных видов должны быть установлены в соответствующих стандартах с учетом требований к МИ и обеспечивать точность измерений.
Настоящий стандарт устанавливает общие требования к проведению оценки биологического действия МИ и не устанавливает методы испытаний МИ конкретных видов.
Для серийно выпускаемых МИ, безопасность которых подтверждена, дополнительные исследования на соответствие настоящему стандарту не требуются.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения).
ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования в процессе менеджмента рисков)
ISO 10993-12, Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (Биологическая оценка медицинских изделий. Часть 12. Приготовление проб и стандартные образцы)
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, ISO 10993-12, а также следующие термины с соответствующими определениями.
ИСО и МЭК ведут терминологические базы данных для использования в стандартизации по следующим адресам:
- электропедия МЭК: доступна на http://www.electropedia.org/;
- платформа онлайн-просмотра ИСО: доступна на http://www.iso.org/obp.
3.1 антикоагулянт (anticoagulant): Агент, предотвращающий или задерживающий свертывание крови.
Пример - Гепарин, этилендиаминтетрауксусная кислота (ЭДТА), цитрат натрия.
3.2 взаимодействие изделие/кровь (blood/device interaction): Взаимодействие между МИ и кровью или компонентом крови и МИ.
3.3 коагуляция (coagulation): Процесс, обусловленный каскадом активации факторов свертывания (коагуляции) крови.
Примечание 1 - Факторы каскадной коагуляции и фибринолитической системы могут быть определены при контакте крови с МИ методами in vitro и in vivo.
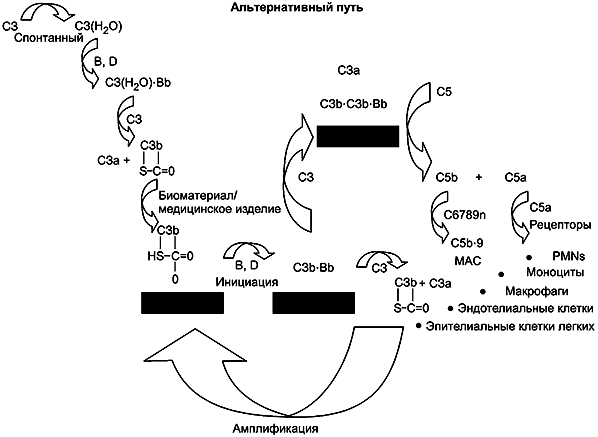
3.4 система комплемента (complement system): Гуморальная составляющая естественной иммунной системы, состоящая более чем из 30 различных белков плазмы, включая ферменты, кофакторы и клеточные рецепторы, которые могут быть задействованы в развитии тромбоза.
Примечание 1 - Эффекторные молекулы, получаемые из компонентов комплемента, являются возможными компонентами явлений воспаления, фагоцитоза и лизиса клеток. Настоящий стандарт не распространяется на активацию комплемента, связанную с иммунотоксичностью, гиперчувствительностью и выделением анафилатоксинов (см. ISO/TR 10993-20).
Примечание 2 - Следует учитывать, что активация системы комплемента может способствовать и ускорять гемолиз, активацию тромбоцитов и лейкоцитов, а также тромбоз на поверхностях материала МИ (см. приложение E).
3.5 прямой контакт с кровью (direct blood contact): Контакт, при котором МИ или материал МИ вступает в непосредственный контакт с кровью или ее компонентами.
3.6 тромбоэмболизация (embolization): Процесс, при котором тромб крови или инородное тело попадает в кровоток и может его частично или полностью перекрыть и вызвать затрудненный ток крови ниже по потоку.
3.7 тест-система ex vivo (ex vivo test system): Тест-система, в которую кровь поступает непосредственно от человека или подопытного животного в камеру для исследований, расположенную вне тела.
Примечание 1 - При использовании экспериментальной модели на животных кровь может быть сразу введена обратно в кровоток животному (рециркуляция) или собрана в пробирки для исследования (однократный проток). В каждом случае камера для исследований находится вне тела.
3.8 гематология (haematology): Раздел медицины, изучающий кровь, включая количественный анализ клеточных и плазменных компонентов крови.
3.9 гематокрит (haematocrit): Отношение объема всех форменных элементов к объему цельной крови.
3.10 гемолиз (haemolysis): Высвобождение гемоглобина из эритроцитов из-за разрушения клеточной мембраны или из-за ее частичного повреждения.
3.11 гемосовместимое МИ (haemocompatible): Изделие или материал изделия, находящиеся в контакте с кровью без каких-либо заметных клинически значимых негативных реакций (например, тромбоз, гемолиз (см. 3.10), активация тромбоцитов, лейкоцитов и комплемента) и/или других отрицательных эффектов, связанных с кровью.
3.12 непрямой контакт с кровью (indirect blood contact): Контакт, при котором МИ, используемое в качестве проводника, вступает в контакт с кровотоком только при входе в кровеносно-сосудистую систему.
Пример - Изделия доставки лекарственных средств и парентерального питательного раствора.
3.13 промышленно выпускаемое изделие; промышленное изделие сравнения; LMCD (legallymarketed comparator device; LMCD): Серийно изготавливаемое и признанное безопасным МИ, используемое в качестве сравнительного контроля в оценке безопасности исследуемого изделия методами in vitro или in vivo, со сходными конструкцией, материалом/материалами и клиническим применением.
Примечание 1 - Рекомендуется применять LMCD, реализацию которого осуществляют в том же регионе, в котором проводят исследования МИ.
3.14 отсутствие контакта с кровью (non-blood-contact): Контакт МИ с организмом пациента, при котором не происходит прямого или непрямого контакта МИ с кровью.
3.15 коллоидно-осмотическое давление (colloidal osmotic pressure): Общее влияние белков или других веществ с высокой молекулярной массой на осмотическую активность плазмы.
3.16 тромбоциты (platelets): Безъядерные клетки, присутствующие в крови и способствующие тромбообразованию за счет их адгезии к поверхности, высвобождением тромбоцитарных факторов свертывания и/или агрегацией, приводящими к формированию гемостатической пробки.
3.17 адгезия тромбоцитов (platelet adherent): Способность тромбоцитов (см. 3.16) прилипать к поверхности материала МИ.
Примечание 1 - Данное свойство испытываемого МИ, как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и/или LMCD при контакте с кровью.
Примечание 2 - Адгезия тромбоцитов не обязательно сопровождается их активацией, т.е. тромбоциты на поверхности могут быть или не быть активированными.
3.18 тромбинообразующее свойство (thrombin generating): Свойство МИ, проявляющееся при контакте с кровью и способствующее или ускоряющее процессы образования тромбина.
Примечание 1 - Данное свойство испытываемого МИ, как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и/или LMCD при контакте с кровью.
3.19 тромбогенное свойство (thrombogenic): Свойство МИ, проявляющееся при контакте с кровью и способствующее формированию тромба.
Примечание - Данное свойство испытываемого МИ, как правило, исследуют при сравнении с отрицательным контролем, положительным контролем и/или LMCD при контакте с кровью.
3.20 тромбоэмболизация (thromboembolization): Процесс, при котором происходит частичная или полная непроходимость кровеносного сосуда за счет переноса оторвавшегося тромба (см. 3.21) ниже по потоку.
3.21 тромб (thrombus): Коагулированная смесь эритроцитов, скопившихся тромбоцитов (см. 3.16), фибрина и других клеточных элементов.
3.22 тромбоз (thrombosis): Формирование тромба (см. 3.21) in vivo, ex vivo или в имитированных условиях in vitro, вызванное активацией системы свертывания крови и тромбоцитов (см. 3.16) в крови.
Примечание 1 - Тромбоз также может происходить в областях кровеносного сосуда или изделия при наличии стаза (остановки кровотока).
3.23 цельная кровь (whole blood): Нефракционированная кровь, забранная у человека или подопытного животного.
Примечание 1 - Кровь может быть без антикоагулянтов или с антикоагулянтами, например содержать цитрат натрия или гепарин.
4 Обозначения и сокращения
В настоящем стандарте применены следующие обозначения и сокращения:
Bb - содержащий ферменты фрагмент фактора B, произведенный расщеплением (фактором D) при активации альтернативного пути;
![]() -ТГ (
-ТГ (![]() -TG) - бета-тромбоглобулин;
-TG) - бета-тромбоглобулин;
C4d - продукт деградации C4 активации комплемента классическим путем;
C3a, C5a - продукты расщепления комплемента из C3 и C5;
CH-50 - количество комплемента, требуемого для лизиса 50% суспензии RBC;
D-димер (D-Dimer) - определенные продукты распада фибрина (перекрестно связанный фибрин F XIII), состоящие из D-фрагментного димера;
ИФА (ELISA) - метод иммуноферментного твердофазного анализа;
ПДФ (FDP) - продукты деградации фибрина/фибриногена;
ФПА (FPA) - фибринопептид А;
F1.2 - некаталитический фрагмент, отщепленный от протромбина при его преобразовании в тромбин (также называемый F1+2);
iC3b - неактивная форма C3b, субфрагмент C3;
ИП (IFU) - инструкция по применению;
НПВ (IVC) - нижняя полая вена;
МРТ (MRI) - магнитно-резонансная томография;
ПЭТ (PET) - позитрон-эмиссионная томография;
ТФ-4 (PF-4) - тромбоцитарный фактор 4;
ПОТ (PRP) - плазма, обогащенная тромбоцитами;
ПВ (РТ) - протромбиновое время;
ЧТВ (РТТ) - частичное (парциальное) тромбопластиновое время;
SC5b-9 - продукт терминального пути активации комплемента;
РЭМ (SEM) - растровая электронная микроскопия;
ТАК (ТАТ) - тромбин-антитромбиновый комплекс;
ТКК (ТСС) - терминальный комплекс комплемента; также известен как мембраноатакующий комплекс (МАК), вычисляемый измерением SC5b-9;
ТВ (ТТ) - тромбиновое время;
TxB2 - тромбоксан B2.
5 Классификация медицинских изделий, контактирующих с кровью, в соответствии с ISO 10993-1
5.1 Медицинские изделия, не контактирующие с кровью
МИ, не контактирующими с кровью, являются изделия, которые не имеют прямого или непрямого контакта с кровью или с составляющими крови, находящимися в организме или возвращенными в организм. Диагностическое изделие in vitro и пробирка для забора крови являются примерами МИ, не контактирующих с кровью. Некоторые МИ, такие системы как интродьюсеры для имплантатов, могут содержать как контактирующие, так и не контактирующие с кровью компоненты.
5.2 Медицинские изделия, присоединяемые извне
5.2.1 Общие положения
К МИ, присоединяемым извне, относят изделия, контактирующие с циркулирующей кровью и служащие в качестве проводников для входа в сосудистую систему. Некоторые МИ могут иметь компоненты или составляющие с различными типами контакта (прямой и непрямой). Перечень МИ, приведенный в настоящем разделе, не является исчерпывающим.
5.2.2 Медицинские изделия, присоединяемые извне, находящиеся в непрямом контакте с кровью
К МИ, присоединяемым извне, находящимся в непрямом контакте с кровью, относят следующие изделия:
- изделия для сбора крови;
- канюли;
- аппараты для реинфузии крови;
- изделия для хранения и введения крови и ее продуктов (например, трубки и мешки);
- набор магистралей для циркулирующей крови;
- внутрисосудистые катетеры.
5.2.3 Медицинские изделия, присоединяемые извне, находящиеся в прямом контакте с циркулирующей кровью
К МИ, присоединяемым извне, находящимся в прямом контакте с циркулирующей кровью, относят следующие изделия:
- оборудование для атерэктомии;
- мониторы крови с прямым или непрямым контактом;
- аппараты искусственного кровообращения;
- изделия для адсорбции определенных веществ из крови;
- оборудование для донорского и терапевтического афереза;
- экстракорпоральные мембранные оксигенаторы;
- оборудование для гемодиализа/гемофильтрации;
- интервенционные сердечно-сосудистые изделия;
- внутрисосудистые катетеры (баллонные, для визуализации, лазерные, ультразвуковые);
- фильтры удаления лейкоцитов;
- подкожные системы поддержки кровообращения;
- катетеры ретроградной коронарной перфузии;
- сосудистые проволочные проводники/кондукторы.
5.3 Имплантируемые медицинские изделия
К имплантируемым МИ, помещаемым в основном или полностью внутрь сердечно-сосудистой системы, относят следующие изделия:
- кольца для аннулопластики;
- артериовенозные шунты;
- мониторы крови (имплантируемые);
- вспомогательные устройства для системы кровообращения (искусственный желудочек сердца, искусственное сердце, интрааортальные баллонные насосы);
- приборы для эмболизации;
- эндоваскулярные синтетические сосудистые трансплантаты;
- имплантируемые электроды дефибриллятора и кардиовертера;
- фильтры для нижней полой вены;
- катетеры для внутренней доставки лекарств;
- внутрисосудистые оксигенаторы (искусственные легкие);
- механические или биологические клапаны сердца;
- электроды кардиостимулятора;
- хирургические синтетические или биологические сосудистые протезы;
- стенты кровеносных сосудов.
6 Характеристика процессов взаимодействия медицинских изделий с кровью
6.1 Общие требования
ВНИМАНИЕ - Надежные доказательства могут быть предоставлены для обоснования выбора категорий испытаний для тестирования изделия. Например, метод исследование in vivo на наличие тромбоза часто является предпочтительным методом для тестирования изделия в категории тромбоза. Тем не менее в отдельных случаях письменные обоснования, которые включают сочетание исследований из категорий свертывания, тромбоцитов, гематологии и комплемента, могут быть использованы в качестве замены исследования тромбоза.
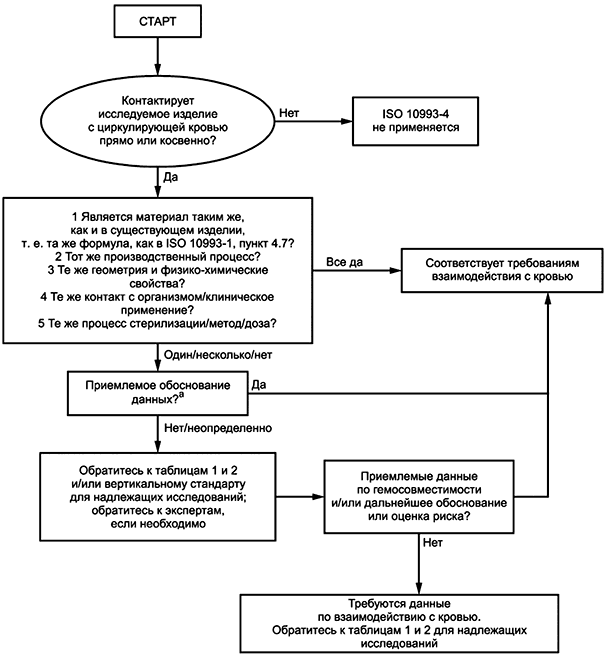
6.1.1 На рисунке 1 приведен алгоритм принятия решения о необходимости проведения испытаний МИ на гемосовместимость. Взаимодействия МИ с кровью подразделяют на несколько категорий в зависимости от измеряемой первичной реакции крови. В таблице 1 приведены примеры МИ, контактирующих с циркулирующей кровью, и категории исследования, соответствующие каждому МИ. Приведенный перечень МИ не является всеобъемлющим. Выбор категории исследования для МИ, не включенных в таблицу, осуществляют с учетом характеристик конкретного МИ и его применения.
Для МИ, на которые существует конкретный международный стандарт (вертикальный стандарт), требования к биологической оценке и методам испытаний, изложенные в этом вертикальном стандарте, имеют приоритет над общими требованиями, установленными в настоящем стандарте.
6.1.2 При исследовании следует использовать адекватную модель или систему, которые имитируют геометрию и условия контакта МИ с кровью при применении по назначению. При моделировании условий контакта МИ с кровью должны быть учтены продолжительность контакта, соответствующие значения температуры, данные о стерильности, виде и концентрации антикоагулянта (см. 6.1.12), состояние кровотока. Например, при исследовании МИ, у которых возможно вычислить значение площади поверхности (например, сосудистый стент), определяют необходимый объем жидкости для тест-системы in vitro в зависимости от исследуемой площади поверхности МИ, в см, по отношению к объему жидкости для тест-системы in vitro. Для определения количества пробы, используемой в тест-системе, у МИ сложной геометрии или у которых невозможно вычислить значение площади поверхности (например, дисперсия частиц поливинилового спирта (ПВС), используемого в качестве эмболов) - определяют массу вместо площади поверхности.
Исследования проводят только на той части МИ, которая контактирует с кровью прямо или косвенно. Методы исследования и регистрируемые параметры выбирают с учетом последних научных достижений в данной области.
Природу и концентрацию антикоагулянта выбирают в зависимости от конкретного применения МИ и вида проводимого метода. Исследования проводят с учетом информации о природе и концентрации выбранного антикоагулянта с целью прогнозирования возможности получения положительных и отрицательных ответов. Информация для испытаний на животных представлена в 6.1.6 и C.2, для исследований in vivo и ex vivo - в 6.1.12, для исследований in vitro - в 6.3.1, для катетеров и проводников - в A.3.
Результаты исследования гемосовместимости МИ зависят от площади поверхности МИ, контактирующей с кровью, поэтому такие методы (например, активация системы комплемента) не применяют к изделиям непрямого контакта.
6.1.3 При проведении исследований используют контроли (положительные и отрицательные), кроме тех случаев, когда их исключение обосновано. Там, где это возможно, исследование должно включать соответствующее изделие-аналог, используемое в клинической практике (т.е. LMCD), или хорошо охарактеризованный материал [6].
Контроль должен включать отрицательные и положительные эталонные материалы. Все исследуемые материалы и LMCD должны соответствовать всем требованиям контроля качества и гарантий качества изготовителя и испытательной лаборатории. Для всех испытанных МИ в протоколе должны быть указаны наименование и адрес изготовителя, класс и тип МИ.
6.1.4 При исследовании материалов, предполагаемых для изготовления компонентов МИ, допускается проводить скрининг-анализ. При этом следует учитывать, что предварительные испытания не могут заменить исследования целого стерильного МИ или его компонента в условиях, которые имитируют или ужесточают условия их клинического применения.
Примечание 1 - Следует учитывать, что изменения в производственном процессе (включая использование производственных приспособлений), которые могут изменять свойства поверхности или химический состав целого МИ, также могут повлиять на его гемосовместимость.
Примечание 2 - Если старение может повлиять на свойства готового МИ (например, свойства биологически активных покрытий, содержащих гепарин, могут изменяться с течением времени), то проводят испытания образцов после их старения.
6.1.5 Испытания, которые не имитируют условия эксплуатации МИ, не могут точно прогнозировать характер его взаимодействий с кровью, которые могут произойти при применении по назначению. Точность и достоверность результатов краткосрочных (скрининговых) исследований in vitro или ex vivo для прогнозирования гемосовместимости МИ считают более высокими, если при применении по назначению его используют не для длительного или постоянного, а для кратковременного контакта с кровью.
Примечание - Упрощенные испытания материалов, предполагаемых для изготовления компонентов МИ (например, при структурном и функциональном химическом модифицировании поверхности), являются важным этапом в идентификации, оптимизации и выборе материала изделия.
6.1.6 При испытаниях на животных МИ, предполагаемое к применению ex vivo (внешний контакт), исследуют ex vivo; МИ, предполагаемое к применению in vivo (имплантаты), исследуют in vivo на экспериментальной модели, имитирующей наиболее точно возможные условия клинического применения. Протокол должен содержать подробное описание вида исследования (см. 6.2.1) и метода испытаний.
|
________________
Для изделий прямого и непрямого контакта необходимость исследования гемосовместимости следует рассматривать, основываясь на надлежащем анализе риска, включая предшествующие исследования гемосовместимости, клинические данные, данные по экстрагируемости/выщелачиваемости и/или информацию по характеристикам поверхности. Например, для изделий с прямым контактом исследование экстрагируемости/выщелачиваемости может быть недостаточным, если морфология поверхности изменена, даже при неизменной химии экстрагируемости/выщелачиваемости (см. ISO 10993-1).
Рисунок 1 - Алгоритм принятия решения о необходимости проведения испытаний МИ на гемосовместимость
Таблица 1 - МИ, присоединяемые извне, и имплантируемые МИ, включая их компоненты, контактирующие с циркулирующей кровью, и рекомендуемые виды исследований в зависимости от крови
Примеры МИ | Категория исследования | ||||||
Гемолиз | Тромбоз | ||||||
Инду- | Инду- | in vitro | in vivo/ | ||||
циро- | циро- | Коа- | Акти- | Ком- | Гема- | ex vivo | |
МИ, присоединяемые извне | |||||||
Мониторы крови (временные/ex vivo) | X | X | X | X | |||
Оборудование для хранения и введения крови (например, наборы для инфузии/трансфузии), изделия для сбора крови, магистрали для циркулирующей крови | X | X | X | X | |||
Катетеры, помещаемые на менее чем 24 ч (например, оборудование для атэректомии, внутрисосудистые ультразвуковые катетеры, катетеры антеградной/ретроградной коронарной перфузии, проволочные направители/хирургические кондукторы); канюли | X | X | X | X | X | ||
Катетеры, помещаемые на более чем 24 ч (например, парентеральные питательные катетеры, центральные венозные катетеры; канюли) | X | X | X | X | X | ||
Аппараты для реинфузии крови | X | X | X | ||||
Изделия для адсорбции определенных веществ из крови | X | X | X | X | X | ||
Оборудование для донорского и терапевтического афереза и системы сепарации клеток | X | X | X | X | X | ||
Аппараты искусственного кровообращения | X | X | X | X | X | X | X |
Оборудование для гемодиализа/гемофильтрации | X | X | X | X | X | X | X |
Фильтр удаления лейкоцитов | X | X | X | X | X | X | |
Подкожные системы поддержки кровообращения | X | X | X | X | X | X | X |
Имплантируемые МИ | |||||||
Кольца для аннулопластики, механические клапаны сердца | X | X | X | ||||
Приборы для эмболизации | X | X | |||||
Эндоваскулярные трансплантаты | X | X | |||||
Имплантируемые электроды дефибриллятора и кардиовертера | X | X | |||||
Интрааортальные баллонные насосы | X | X | X | ||||
Электроды кардиостимулятора | X | X | |||||
Синтетические протезы кровеносных сосудов и заплаты, включая артериовенозные шунты | X | X | |||||
Сосудистые стенты | X | X | |||||
Биоклапаны сердца, биопротезы кровеносных сосудов и заплаты и А-В шунты | X | X | |||||
Искусственное сердце | X | X | X | ||||
Фильтры полой вены | X | X | |||||
Искусственные желудочки сердца | X | X | X | ||||
| |||||||
6.1.7 Методы исследования in vitro применяют для скрининга внешних присоединяемых изделий или имплантатов, а также возможных первичных стадий взаимодействия изделий/материалов с кровью, но они могут неточно прогнозировать результаты оценки гемосовместимости образцов при длительном, многократном или постоянном контакте изделий с кровью (см. 6.3.1).
Примечание - Для новых изделий или изделий с измененными геометрическими параметрами может понадобиться исследование при физиологическом потоке крови. Для долгосрочных катетеров или постоянных имплантатов тест-системы in vitro могут быть недостаточны из-за проблематичности стабильности состояния крови во время испытаний.
6.1.8 Для МИ или его компонентов, которые вступают в короткий/кратковременный контакт с циркулирующей кровью (например, ланцеты, гиподермические иглы, капиллярные трубки, используемые менее 1 мин), исследования на гемосовместимость, как правило, не проводят.
Примечание 1 - Для МИ, изготовленных с использованием материалов, покрытия которых могут остаться в контакте с кровью после удаления МИ, требуется проведение исследований на гемосовместимость.
Примечание 2 - Если отдельные компоненты изделия (например, корпус шприца) находятся в контакте с жидкостями, которые в итоге будут инъецированы пациенту, а длительность контакта до введения не уточнена или превышает 1 мин, то необходим тест на гемолиз для этой части изделия, даже если само изделие будет в контакте с циркулирующей кровью менее 1 мин.
6.1.9 Одноразовое лабораторное оборудование, используемое для сбора крови и проведения анализов крови in vitro, следует оценивать таким образом, чтобы убедиться в отсутствии какого-либо существенного влияния на результаты проводимого исследования.
6.1.10 Если методы выбраны в соответствии с вышеизложенными требованиями и испытания проводят в условиях, имитирующих условия применения по назначению, то результаты исследования будут с наибольшей вероятностью прогнозировать гемосовместимость изделия в клинической практике. Для МИ, используемых в диапазоне различных условий, необходимо рассмотреть крайние и средние условия. Тем не менее различия между видами животных и другие факторы могут ограничить прогнозируемость любого исследования.
6.1.11 Из-за индивидуального характера реактивности крови у животных различных видов, при возможности, используют кровь человека (за исключением установленных методов исследования с кровью животных, таких как некоторые тесты на гемолиз). При необходимости использования животных, например для оценки изделий, применяемых для длительного или многократного воздействия или постоянного контакта с кровью, необходимо учитывать межвидовые различия в реактивности крови.
Показатели крови и реактивность у человека и приматов очень схожи [204]. Использование таких животных, как кролик, свинья, теленок, овца или собака, также может быть приемлемым для конкретного типа исследования. Однако, так как межвидовые различия могут быть значительными (например, адгезия тромбоцитов [148], [150], тромбоз [44] и гемолиз [47] при контакте крови с чужеродным материалом, как правило, менее выражено у собак, чем у человека), все результаты испытаний на крови животных следует интерпретировать с осторожностью. Выбранные виды и используемое количество животных должны быть обоснованы (см. ISO 10993-2).
Примечание - Использование приматов для исследований гемосовместимости in vivo и функциональных свойств МИ запрещено законом ЕС (86/609/EEC) и отдельными государственными законами.
6.1.12 Следует избегать применения антикоагулянтов в тестах in vivo и ex vivo, кроме случаев, когда изделие предназначено для функционирования в их присутствии. Так как тип и концентрация используемого антикоагулянта влияют на взаимодействия изделия с кровью, то их выбор должен быть обоснован. Изделия, используемые с антикоагулянтами, должны быть исследованы в диапазоне концентраций антикоагулянтов, используемых в клинической практике и/или приведенных в инструкции по применению (ИП) изделия или другой соответствующей литературе. Межвидовые различия также следует учитывать при определении необходимой концентрации антикоагулянтов.
6.1.13 При модифицировании МИ, должны быть проведены исследования его гемосовместимости и функциональные свойства. К модифицированию МИ относят изменения конструкции, формы, химического состава поверхности или объемных свойств материала, текстуры, пористости или других свойств. Моделирование потока in vitro, соответствующего условиям эксплуатации МИ, может быть использовано для оценки влияния технологии модифицирования на его гемосовместимость.
6.1.14 Следует провести достаточное количество выполняемого теста, включая соответствующие контроли для статистической обработки полученных результатов. Вариативность некоторых методов исследования требует, чтобы измерения были повторены достаточное число раз для определения их достоверности. Повторные исследования, проводимые дополнительно в течение продолжительного периода контакта МИ с кровью, дают информацию о временной зависимости процессов взаимодействия изделия с кровью [213]-[216]. Необходимо соблюдать баланс между необходимостью статистического анализа результатов и состоянием животных в исследованиях in vivo (см. ISO 10993-2).
6.1.15 Рекомендации, содержащиеся в 6.1, вместе с рисунком 1 и таблицей 1, являются руководством для выбора методов исследований, перечисленных в таблице 2. Дальнейшее руководство по доклинической оценке приведено в приложениях A-G. Необходимо следовать следующей процедуре:
a) определить, какие потенциальные виды взаимодействия с кровью (см. 6.2) являются подходящими к рассмотрению для установления безопасности конкретного МИ относительно его гемосовместимости (см. примеры в таблице 1);
b) оценить существующую информацию в каждой категории исследований для МИ;
c) если существует достаточная информация по гемосовместимости МИ, то подготовить соответствующее обоснование сделанного заключения о том, что дальнейшее исследование не является необходимым.
Примечание - Отличие в составе, форме, свойствах поверхности, технологии производства, способе стерилизации и/или области клинического применения может ограничить использование информации по безопасности сходного продукта относительно его гемосовместимости;
d) если информации по категории или категориям исследований недостаточно, то необходимые исследования выбирают, основываясь на примерах, приведенных в таблицах 1 и 2, чтобы получить дополнительную информацию по гемосовместимости МИ.
6.2 Категории исследований для оценки взаимодействия медицинских изделий с кровью
6.2.1 Рекомендуемые исследования для оценки взаимодействия медицинских изделий с кровью
Рекомендуемые исследования классифицированы по типу изделия (см. примеры в таблице 1). Исследования разделяют на следующие категории, основываясь на соответствующем биологическом ответе крови, ее компонентов или систем крови на контакт с МИ:
- гемолиз:
- индуцированный материалом;
- индуцированный механическим воздействием;
- тромбоз:
- in vitro:
- коагуляция (активация свертывающей системы крови);
- активация тромбоцитов;
- активация системы комплемента;
- гематология;
- in vivo/ex vivo.
Принципы и научное обоснование для этих исследований приведены в приложениях A-E.
Таблица 2 - Распространенные исследования, используемые для оценки взаимодействия изделий с кровью
Категория исследований | |
Гемолиз | Индуцированный материалом [например, ASTM (Американское общество по испытанию материалов) [17], NIH (Национальный институт здоровья) [28], MHLW (Министерство здравоохранения, труда и социального обеспечения) [22]] |
Индуцированный механическим воздействием | |
Тромбоз (in vivo, ex vivo) | Макроскопический анализ |
Тромбоз in vitro | |
Коагуляция | Маркеры образования тромбина (например, ТАК, F1.2), фибрина (например, ФПА), проба ЧТВ |
Активация тромбоцитов | Подсчет тромбоцитов (% потери) и какой-либо индикатор активации (например, продукты высвобождения или маркеры поверхности тромбоцитов, такие как |
Гематология | Общий анализ крови (CBC), активация лейкоцитов |
Система комплемента | SC5b-9 (C3a по усмотрению) |
Не все испытания необходимы в каждой категории, и результаты испытаний в каждой категории могут быть неэквивалентными. | |
6.2.2 Медицинские изделия, не контактирующие с кровью
Исследования МИ, не контактирующих с кровью, на гемосовместимость не проводят.
6.2.3 Медицинские изделия, присоединяемые извне, и имплантируемые медицинские изделия
После использования таблицы 1 для сравнения нового исследуемого изделия со сходными существующими изделиями и отмечая потенциальные виды исследований, следует использовать таблицу 2, приложения A и E как руководства для выбора конкретных адекватных испытаний для оценки гемосовместимости изделия.
6.2.4 Ограничения
При проведении исследований и анализе полученных результатов для адекватной оценки гемосовместимости изделий следует основываться на существующих научных и технологических данных, а также учитывать условия конкретного применения изделий. Например:
a) гемосовместимость материалов/МИ в условиях высокого (артериального) кровотока может отличаться от таковой в условиях низкого (венозного) кровотока;
b) в процессе исследований с кровью могут взаимодействовать как исследуемые материалы/МИ, так и не исследуемый материал, например тест-системы. Следует соблюдать осторожность и отличать эффекты воздействия на кровь, связанные с исследуемым материалом, от эффектов, вызванных другими факторами;
c) испытания, которые основываются только на одном методе для оценки взаимодействия МИ с кровью, могут менее точно прогнозировать истинный ответ, чем испытания, которые включают несколько различных методов на гемосовместимость изделия;
d) иммунологические исследования для детектирования белковых индикаторов при тестировании гемосовместимости МИ, например TAК, C3a и т.д., как правило, коммерчески доступны при использовании крови человека, но они в большинстве случаев непригодны для крови других видов.
6.3 Виды исследований
6.3.1 Исследования in vitro
Исследования in vitro (модельные условия) должны учитывать имитацию ожидаемых наиболее неблагоприятных условий клинического применения МИ. Экспериментальные параметры учитывают для каждого метода in vitro, включая гематокрит, природу и количество антикоагулянта, пробоподготовку, срок хранения тестируемого образца, срок хранения крови/компонента крови, условия хранения тестируемого образца, содержание кислорода в воздушной среде, pH, температуру, рандомизацию при отборе образцов, отношение площади поверхности образца к объему крови, а для динамических исследований - характеристики потока жидкости, особенно скорость потока, скорость сдвига и давление/давления. Испытания следует начинать с минимальной задержкой, как правило, в течение 4 ч после забора крови, так как после забора некоторые свойства крови быстро изменяются. Альтернативы к последнему могут быть возможны при валидации методов с использованием крови не в ближайшее время после ее забора. Полученные образцы крови после проведения испытаний также могут быть заморожены до будущего анализа, если процесс заморозки/оттаивания не влияет на их исследуемые свойства.
Примечание - Клинически адекватные типы и количества антикоагулянта могут быть или не быть подходящими в зависимости от тест-системы и возможности различить результаты положительных и отрицательных контролей.
При оценке гемосовместимости модифицированного изделия результаты исследований in vitro на гемолиз, тромбоз, реакцию тромбоцитов и активацию свертывающей системы крови могут быть оценены при сравнении с результатами, полученными для используемых в клинике исходных МИ (см. A.1.4).
6.3.2 Исследования ex vivo
Исследования ex vivo следует проводить, если МИ предназначено для применения ex vivo, например внешнее присоединяемое изделие. Исследование ex vivo допустимо, если МИ предназначено для применения in vivo, например для оценки острой реакции на имплантат, такой, например, как протез кровеносных сосудов. Такое испытание не должно заменять имплантационный тест.
Существуют методы ex vivo для мониторинга адгезии тромбоцитов, образования тромбоэмболов, осаждения фибриногена, массы тромба, адгезии лейкоцитов, убыли тромбоцитов и активации тромбоцитов [44], [46], [47], [50], [54], [70], [78], [80]. Скорость кровотока измеряют ультразвуковым методом (ультразвуковая расходометрия), основанным на эффекте Доплера, или электромагнитным методом (электромагнитная расходометрия). Изменения в скорости потока указывают на интенсивность и скорость отложения тромбов и эмболизации. Непосредственно процесс формирования тромбов оценивают макро- и/или микроскопическими методами визуализации. Возможно использование других более совершенных и технически сложных устройств [53], [69], [73], [74], [79].
6.3.3 Испытания in vivo
Испытание in vivo предусматривает имплантацию материала или МИ животным. Сосудистые заплаты, катетеры и стенты, протезы кровеносных сосудов, кольца для аннулопластики, протезы клапанов сердца и вспомогательные системы кровообращения являются примерами МИ, исследуемых in vivo. Учитывая разнообразие применений МИ, контактирующих с кровью, экспериментальные модели in vivo должны быть соответственно разнообразны для адекватной имитации их применения по назначению.
Степень "проходимости доступа или изделия (т.е. незатрудненный кровоток через изделие)" является общепринятым положительным или отрицательным результатом при проведении ряда исследований in vivo. После удаления (реимплантации) МИ определяют процент окклюзии и массу тромба. Склонность тромбов, сформировавшихся на поверхности изделия, к эмболизации дистальных органов должна быть тщательно оценена макро- и микроскопическим исследованиями органов ниже по потоку от имплантированного изделия. Дополнительно полезна гистологическая оценка окружающих тканей и органов. Почки особенно имеют тенденцию захватывать тромбы, оторвавшиеся от внутренней поверхности изделий, имплантированных выше по потоку от почечных артерий (например, искусственный желудочек сердца, искусственное сердце, протезы аортальных клапанов), и попавшие в циркулирующую кровь [184], [187], [236], [237].
Существуют испытания in vivo, которые не требуют терминальной стадии для лабораторных животных при получении результатов. Артериограммы или внутрисосудистое ультразвуковое исследование (ВСУЗИ/IVUS - технология визуализации с использованием катетера) применяют для определения проходимости или осаждения тромбов на поверхности изделий. Рентгеновские снимки используют для мониторинга осаждения тромбоцитов в различные периоды времени in vivo; выживаемость тромбоцитов и их убыль могут быть использованы в качестве индикаторов взаимодействий изделия с кровью и пассивации его поверхности за счет формирования неоинтимы или адсорбции белков [46], [72], [79].
В некоторых экспериментальных моделях in vivo характер взаимодействия МИ с кровью могут определять неосновные свойства материала, влияющие на его гемосовместимость. Параметры потока, механические свойства, пористость и конструкция имплантата могут быть более важными, чем совместимость материала МИ с кровью. Например, системы с низкой скоростью потока могут давать значительно отличающиеся результаты по сравнению с тем же материалом, оцененным в системе с высокой скоростью потока. Результаты, полученные in vivo, более значимы, чем результаты испытаний in vitro.
Протоколы исследований in vivo должны содержать четко выделенные разделы, в которых для каждой выбранной категории тестов, т.е. гемолиз, тромбоз, коагуляция, тромбоциты, гематология и система комплемента, должны быть приведены и обсуждены полученные результаты.
Приложение A
(справочное)
Доклинические исследования изделий и протезов для сердечно-сосудистой системы
A.1 Общие положения
A.1.1 Основание
В настоящем приложении представлены рекомендации по выбору методов для оценки гемосовместимости МИ, предназначенных для сердечно-сосудистой хирургии. Раздел 6 содержит руководство для определения необходимости проведения исследований, включая рекомендации по выбору категории исследований для конкретных МИ и перечень конкретных методов для оценки гемосовместимости МИ, не контактирующих с кровью, присоединяемых извне и имплантируемых МИ. Классификация основных процессов взаимодействий МИ с кровью, влияющих на его гемосовместимость, приведена в A.1.2.
A.1.2 Классификация
A.1.2.1 Процессы взаимодействия с кровью, которые, как правило, влияют на МИ и могут иметь или не иметь нежелательное воздействия на животное или человека, включают:
a) адсорбцию белков плазмы, липидов, кальция или других веществ из крови на поверхность изделия или абсорбцию таких веществ в МИ;
b) адгезию тромбоцитов, лейкоцитов или эритроцитов на поверхность изделия или абсорбцию их компонентов в МИ;
c) формирование псевдоинтимы или неоинтимы на поверхности, контактирующей с кровью, и тканевой капсулы на внешней поверхности МИ;
d) изменения механических и других свойств МИ.
A.1.2.2 Процессы взаимодействия с кровью, потенциально обладающие нежелательным воздействием на животное или человека, включают:
a) активацию тромбоцитов, лейкоцитов или других клеток или активацию путей свертывающей системы крови, фибринолиза или системы комплемента;
b) образование тромба на поверхности МИ;
c) эмболизацию тромбического или другого материала с поверхности МИ другой области кровеносной системы;
d) повреждение клеток циркулирующей крови, приводящее к анемии, гемолизу, лейкопении, тромбоцитопении или изменению функции клеток крови;
e) повреждение клеток и тканей, прилегающих к МИ;
f) гиперплазия интимы или накопление другой ткани на изделии либо вблизи него, приводящие к снижению потока или влияющие на другие функции МИ;
g) адгезия и рост бактерий или других возбудителей инфекции на изделии или вблизи него.
Примечание - Для вышеуказанных пунктов b), c) и d) некоторые МИ (например, спирали эмболизации) требуют формирования тромба для функционирования.
A.1.3 Преимущества и ограничения экспериментальных моделей на животных
Модели на животных позволяют наиболее точно имитировать условия функционирования МИ при применении по назначению до реального его использования для пациента. Данные модели позволяют осуществлять мониторинг состояния МИ и проводить систематическое контролируемое исследование основных свойств, характеризующих его взаимодействие с кровью. При этом выбор экспериментальной модели может быть ограничен требованиями размера, доступностью необходимых видов и стоимостью животных. Например, в экспериментальной модели МИ может не функционировать по полному спектру его клинического применения из-за анатомических ограничений лабораторного животного. Следует учитывать физиологические отличия и сходства выбранного вида животного и человека, особенно связанные с системой свертывания крови, функциями тромбоцитов и фибринолизом, а также с ответом на такие фармакологические вещества, как анестетики, антикоагулянты, тромболитики, антитромбоцитарные агенты и антибиотики. Из-за межвидовых и индивидуальных отличий животных в реактивности и разной интенсивности ответов на различные изделия данные, полученные от одного вида, следует с осторожностью интерпретировать для других видов животных. Приматы, такие как бабуины, обладают большим сходством с человеком по гематологическим показателям, механизму свертывания крови и строению сердечно-сосудистой системы [50]. Дополнительным преимуществом приматов является то, что многие иммунологические пробы на тромбообразование, разработанные для человека, включающие определение ТФ-4, ![]() -TH ФПА, ТАК и F1.2, приемлемы для использования на приматах.
-TH ФПА, ТАК и F1.2, приемлемы для использования на приматах.
В моделях in vivo, как правило, используют собак, что позволяет получить ценную информацию; тем не менее тромбоз, индуцированный тестируемым изделием, у них возникает быстрее, чем у человека. Указанное различие допускается рассматривать как преимущество данной модели (модель ускоренных испытаний или модель с жесткими условиями) при оценке вероятности тромбообразования при тестировании изделий. Свиней и овец, как правило, считают подходящими моделями благодаря сходству их сердечно-сосудистой системы и гематологических показателей с человеком [71], [148]-[150]. Следует учитывать влияние протокола хирургического вмешательства при имплантации на результаты исследования и иметь соответствующие контроли. Для окончательного решения об использовании модели in vivo или in vitro следует руководствоваться доступностью животного и правилами этического обращения с ним (см. ISO 10993-2), а также доступностью и преимуществом (ограничениями) моделей in vitro для получения статистически достоверных и надежных результатов и выводов [213]-[216].
A.1.4 Преимущества и ограничения моделей in vitro
Модели контакта изделия с кровью in vitro являются привлекательными подходами к исследованию гемосовместимости медицинских материалов и изделий для сердечно-сосудистой системы, так как они позволяют:
a) избегать дорогостоящих животных моделей;
b) проводить тестирование с большим количеством образцов исследуемого изделия вместе с контролями и материалами сравнения, используя одновременно одну партию крови;
c) использовать кровь человека или животного при стандартизированных условиях потока, температуре и антикоагулянтной схеме;
d) исследовать наиболее неблагоприятные условия, связанные с аккумуляцией продуктов активации без удаления их почками, печенью или другими органами и отсутствием ингибирующих активацию функций эндотелиальных клеток;
e) исключать искажающие факторы, связанные с имплантацией изделия/повреждением тканей в тестах in vivo.
Исследование in vitro МИ должно максимально точно имитировать варианты условий контакта МИ с кровью при его клиническом применении. Проведение исследований при условиях, отличающихся от клинических (например, отличие в виде или концентрации антикоагулянтов, условиях потока и др.), может затруднить интерпретацию результатов. При необходимости следует руководствоваться ИП на МИ или литературой по общей медицинской практике относительно вида и концентрации используемых в клинике антикоагулянтов. Если возможно, то необходимо провести исследование по полному спектру условий клинического применения изделия. Например, для оценки гемолиза и активации тромбоцитов, индуцированных механическими воздействиями, тестирование, как правило, проводят при наибольшей скорости кровотока. Исследование тромбообразования при взаимодействии изделия с кровью предпочтительно проводить при минимально возможной скорости кровотока, что важно для повышения надежности оценки безопасности изделия. Так как выявлено, что ответы крови могут значительно различаться у разных видов [47], [148], [149], [150], применение крови человека наиболее достоверно для интерпретации результатов. Другим преимуществом использования крови человека является тот факт, что это позволяет использовать более расширенный набор методов, так как наиболее современные биоаналитические методы основываются на компонентах крови/эпитопах человека. В то же время существуют определенные ограничения объема крови, который может быть получен от одного человеческого донора. Использование крови от одного крупного животного может быть более практичным в случаях, когда модель, предназначенная для имитации клинически адекватных условий, требует большого объема крови.
Для исследования гемосовместимости материала/изделия в целом использовалась классическая модель петли Чэндлера in vitro [43] или ее модификации [193]-[195], [199], [200], [203] для обеспечения физиологического или квазифизиологического потока. В качестве альтернативы потока используют легкое взбалтывание крови, что может быть полезным в отдельных случаях при исследовании гемосовместимости материалов/изделий. Для оценки влияния модели in vitro на кровь необходимо контролировать гемолиз и общее количество клеток крови для определения пригодности крови для проведения исследований. Эти модели являются эффективными для скрининговых исследований, особенно для изделий с краткосрочным контактом с кровью.
A.1.5 Протоколы исследований моделей на животных
Тромбоз, тромбоэмболия, кровотечение и инфекция являются основными сдерживающими факторами для использования и дальнейшей разработки современных сердечно-сосудистых протезов. Для МИ с ограниченным временем воздействием на кровь (менее 24 ч) важные измерения связаны со степенью быстрых изменений гематологических и гемодинамических параметров, а также факторов, характеризующих функционирование изделия, с образованием массы тромбов и возможной эмболией. При длительном, многократном или постоянном контакте (более 24 ч и более 30 суток соответственно) внимание уделяют серийным методам измерений, которые могут дать информацию относительно времени тромбообразования и тромбоэмболии, убыли компонентов циркулирующей крови, развития гиперплазии интимы и инфекции. В обоих типах воздействия и категориях контакта важна оценка гемолиза и функции тромбоцитов. На образование тромбов могут оказывать значительное влияние характер хирургического вмешательства, разнообразные, зависящие от времени, тромболитические и тромбоэмболитические эффекты, инфекции, вызванные изделием, и возможные изменения свойств контактирующей поверхности, например гиперплазия интимы, фиброзная инкапсуляция и эндотелиализация. Следует учитывать, что тип/типы и количество антикоагулянта могут иметь существенное влияние на результаты. Например, использование применяемых в клинической практике концентраций антикоагулянтов и антитромбоцитарных препаратов может значительно уменьшить или полностью блокировать ответные реакции тромбоцитов, процессы свертывания крови и тромбоза.
Последствия взаимодействия чужеродных поверхностей с кровью могут быть различными: от множественного тромбоза и эмболии до малозаметных эффектов, таких как ускорение процессов, снижающих концентрацию компонентов крови, задействованных в нормальном гемостазе. Последнее может быть не клинически значимым. Например, уменьшение количества тромбоцитов при контакте МИ с кровью может быть таким незначительным, что оно не влияет на общее число тромбоцитов. С другой стороны, МИ с большой площадью поверхности может привести к существенному снижению количества тромбоцитов или факторов свертывания крови, что может значительно повлиять на общее число тромбоцитов и изменить нормальный гемостаз.
Вне зависимости от вида экспериментальной модели на животных и конкретного исследования (гемолиз, тромбоз, свертывание крови, тромбоциты, гематология и система комплемента) в протоколе исследования in vivo должна быть представлена достаточная детализация методов и критериев для оценки обоснования выбранной категории исследований. Ретроспективный отчет о результатах конкретной категории тестов без первоначального обоснования в протоколе программы исследования, как правило, рассматривают как неприемлемый документ для подачи регистрационной заявки.
A.2 Канюли, используемые для прямого сосудистого доступа и канюли для непрямого доступа
Термин "канюли" используют в двух, достаточно различных, случаях клинического применения. В одном варианте канюли вводят прямо через кожу в один или более основных кровеносных сосудов. Это делается для предоставления постоянного и прямого широкого доступа к системе кровообращения. Например, канюли большого диаметра используют при операциях в условиях искусственного кровообращения как изделие доступа локального действия для обеспечения циркуляции потока крови в процессе оксигенации. Тестирование таких канюлей должно проходить в условиях контакта с кровью, адекватно имитирующих их клиническое применение, так как они могут потенциально вызывать определенные изменения в концентрациях клеток в циркулирующей крови, а также влиять на активацию факторов свертывания или компонентов системы комплемента. Интенсивность реакции крови зависит от целого ряда факторов, таких как место имплантации, метода введения, индивидуальных факторов и режима антикоагулянтной терапии. Термин "канюли" также используется для трубчатых изделий гораздо меньшего диаметра, которые вводят только подкожно и которые могут быть использованы для ограниченного (менее 24 ч) или длительного (менее 30 сут) непрямого контакта с кровью. Такие канюли, например, применяют при инфузии инсулина посредством помп, для введения медикаментов и для подкожного измерения уровней глюкозы в крови. Последний тип канюль, как и другие изделия, служащие в качестве непрямого кровотока (см. 5.2.2), как правило, требует меньшего количества тестов, чем изделия с прямым контактом с циркулирующей кровью (см. 5.2.3 и 5.3).
A.3 Катетеры и хирургические кондукторы
Большинство применяемых для исследования канюль, контактирующих с кровью, подходят и для исследования катетеров, контактирующих с кровью, и проволочных проводников/кондукторов. Местонахождение или положение катетеров в артериальной или венозной системе крови может значительно повлиять на взаимодействие МИ с кровью. Рекомендуется одновременно проводить контрольные исследования на противоположной артерии или вене, используя зарегистрированное МИ со сходными свойствами и материалом/материалами. Следует с большой осторожностью удалять катетер, чтобы не оторвался, возможно, образовавшийся тромб. Испытание изделия in situ дает возможность оценить степень участия повреждений интимы или мест ввода катетеров или кондукторов в процессе образования тромба. Измерения кровотока по Доплеру являются более информативными, чем ангиография. Модель венозного или артериального имплантата с антикоагулянтной схемой, соответствующей клиническому применению изделий, может быть полезным инструментом для оценки реакции крови на контакт с изделием, особенно в случае нового материала или покрытия изделия с улучшенными антитромбогенными свойствами [143], [161]-[163] (см. приложение C, C.3).
С другой стороны, подходящая модель in vitro может быть более чувствительной для обнаружения разных реакций крови на различные поверхности материала.
В случаях, когда требуется введение антикоагулянтов, выбор типа и концентрации антикоагулянтов должен быть основан на клиническом применении изделия, но быть достаточно доказательным, что при этом не будет получен ложный положительный или отрицательный результат. Например, во время тестирования тромборезистентность гепаринового покрытия МИ может быть полностью затушевана присутствием нормальных (клинических) уровней антикоагулянта (например, раствора гепарина) в крови. При снижении концентрации гепарина в крови эффективность гепаринового покрытия относительно уменьшения вероятности формирования тромбов становится более явной. В случаях, когда применение МИ может быть без антикоагулянтов, тестирование следует проводить также без антикоагулянтов.
Информация по валидации теста с конкретным типом и уровнем антикоагулянтов должна демонстрировать способность отличать положительные ответы от отрицательных результатов.
A.4 Экстракорпоральные оксигенаторы крови, гемодиализаторы/устройства для гемофильтрации, оборудование для доноров и терапевтического афереза, устройства для избирательной адсорбции веществ из крови
Ответы крови на искусственное кровообращение могут быть значительными и острыми. Многие параметры, такие как наличие отсосов крови, состав кристаллоидного раствора, предварительно вводимого в аппарат искусственного кровообращения, гипотермия, контакт крови с воздухом и длительность искусственного кровообращения, влияют на показатели исследования. Тромбоэмболы в отводящих магистралях могут быть обнаружены в периодически сменяемых фильтрах крови ex vivo или ультразвуковыми, или другими неинвазивными методами. Накопление тромбов допускается оценивать непосредственно во время работы аппарата искусственного кровообращения, отслеживая такие функциональные показатели, как падение давления в оксигенаторе и скорость массопереноса кислорода. Временная индуцированная оксигенатором дисфункция тромбоцитов, связанная с избирательной реакцией, высвобождением альфа-гранул, наблюдалась у пациентов на искусственном кровообращении [158]; также информативны другие исследования функции и реакции высвобождения тромбоцитов.
Как аппарат искусственного кровообращения, так и гемодиализаторы могут стать причиной активации системы комплемента. Это может привести к клинически значимым легочным лейкостазам с последующим повреждением легких и их функций [5], [11], [16], [129]-[147]. По этим причинам целесообразно дать количественную оценку активации системы комплемента или возможной лейкопении при контакте крови с такими МИ (см. приложение E).
Благодаря большому отношению площади поверхности к объему циркулирующей крови оборудование для терапевтического афереза и устройства для избирательной адсорбции веществ из крови могут быть потенциальной причиной активации системы комплемента, системы свертывания крови, путей активации тромбоцитов и лейкоцитов. Исследование гемосовместимости МИ с большой площадью поверхности следует проводить по тем же принципам, что и тестирование экстракорпоральных оксигенаторов и гемодиализаторов.
A.5 Искусственные желудочки сердца и искусственные сердца
При функционировании эти МИ могут вызывать значительные изменения различных компонентов крови и в системах крови. К факторам, обусловливающим такой эффект, относят большую площадь чужеродных поверхностей, контактирующих с кровью, высокие режимы потока и участки с нарушенным потоком, таким как турбулентность или расщепленный поток. Тестирование таких изделий может включать в себя измерение гемолиза, исследование процессов тромбообразования, формирования фибрина, тромбоэмболизации, генерации тромбина, жизнеспособности и активации тромбоцитов, активации системы комплемента и тщательный мониторинг функционального состояния печени, почек, легких и центральной нервной системы. Важным компонентом тестирования является детальный патолого-морфологический анализ внутренних органов [236], [237].
A.6 Искусственные клапаны сердца
При проведении оценки гемосовместимости искусственных клапанов сердца важную роль играют инвазивное, неинвазивное и гидродинамическое in vitro исследования.
Одним из наиболее эффективных способов скрининга дисфункций искусственных клапанов является аускультация [186]. В двухмерной эхокардиографии и эхокардиографии в М-режиме используют ультразвуковое излучение для формирования изображений сердца. Отражения от материалов с различным акустическим сопротивлением воспринимаются и обрабатываются для формирования изображения, позволяющего изучить структуру протезных клапанов. Механические протезы излучают сильные эхо-сигналы, и движение окклюдера, как правило, может быть четко отображено. Качество изображения может зависеть от конкретного исследуемого клапана. Эхокардиография также может быть полезной при оценке функции протезов клапанов тканевого происхождения. Выявляют разрастания, тромбы и утолщения створок клапана. Используя традиционную и цветовую доплеровскую эхокардиографию потока, возможно идентифицировать и приблизительно оценить величину регургитации [2], [185]-[187].
Рекомендуется также исследовать жизнеспособность и агрегацию тромбоцитов, тромбоз и гемолиз, индуцированные контактом протезов с кровью, измерить давление и скорость потока, а также провести аутопсию клапана и прилегающих тканей [205], [206].
A.7 Протезы кровеносных сосудов
В различные участки венозной и артериальной системы могут быть имплантированы пористые и непористые материалы. Выбор места имплантации определяется главным образом анатомическими особенностями модели in vivo и местом имплантации при клиническом применении. Проходимость каждого протеза увеличивается при большем диаметре и меньшей длине. Проходимость протеза может быть установлена пальпацией по пульсу некоторых участков дистальных/периферических кровеносных сосудов и методом ангиографии. Также могут быть использованы ультразвуковое исследование, МРТ и ПЭТ. Также рекомендуются систематические измерения количества тромбоцитов, компонентов высвобождения тромбоцитов, продуктов деградации фибриногена/фибрина и активированных белков системы свертывания крови. Ценную информацию может представить аутопсия протеза и прилегающих сосудистых сегментов для их гистологического анализа. Для детального исследования гемосовместимости МИ необходим систематический визуальный и гистологический анализ продольного и поперечного срезов проксимального и дистального анастомозов, а также репрезентативных центральных частей протеза [4], [205]. Как и со многими другими МИ сердечно-сосудистой системы, для их эффективного функционирования следует использовать соответствующие клинические протоколы антикоагуляционной терапии.
A.8 Фильтры нижней полой вены, стенты и стентированные протезы
Фильтры нижней полой вены (фильтры НПВ), стенты и стентированные протезы допускается исследовать методами ангиографии и ультразвукового излучения. Допускается применять методики [205], используемые при исследовании сосудистых протезов (см. A.7).
Приложение В
(справочное)
Рекомендуемые лабораторные исследования. Основные положения, научное обоснование и интерпретация
B.1 Основные положения
B.1.1 Основание
Общие положения и научные основы наиболее часто используемых тестов для категорий гемолиза, тромбоза, системы свертывания крови, тромбоцитов, гематологии и системы комплемента (см. 6.2) приведены в B.1-B.3. См. приложения C, D и E для дальнейшей информации по методам тестирования для категорий биологического ответа крови на контакт с чужеродной поверхностью (тромбоз, гемолиз и система комплемента).
Дополнительные и менее распространенные методы могут быть полезны для дальнейшей оценки конкретных стадий взаимодействий МИ с кровью (см. приложение F). Из-за биологического разнообразия и технических ограничений точность и информативность многих из этих методов требуют тщательного внимания к методологии и осторожности в интерпретации результатов. В приложении G приведен перечень нерекомендуемых тестов.
В B.4 представлено описание методологии для исследований факторов плазмы крови, специфичных для системы свертывания крови, активации тромбоцитов и лейкоцитов, активации системы комплемента, используя метод твердофазного иммуноферментного анализа (ИФА) или другие аналогичные методы.
Подробное описание с примерами исследований (испытаний) и моделей приведено в стандартах, указанных в библиографии.
B.1.2 Исследования in vitro в сравнении с исследованиями ex vivo и in vivo
B.1.2.1 Целый ряд моделей in vitro, ex vivo и in vivo интенсивно используют для исследования гемосовместимости материалов/изделий [1]-[30], [42]-[147], [157]-[237]. Следует выбирать модель, наиболее подходящую к назначению МИ и цели исследования, а также в соответствии с ISO 10993-12 относительно надлежащего приготовления образцов и контролей.
Не существует единой модели in vitro, ex vivo или in vivo, подходящей для МИ различного назначения. Следовательно, должна быть обоснована адекватность модели относительно исследуемого объекта.
Тесты in vivo представляют более реалистичную имитацию условий конечного применения МИ, но осложнены следующими факторами:
- выбор подходящего лабораторного животного;
- межвидовая и индивидуальная вариативность в ответах [47], [71], [148]-[150];
- малочисленность видоспецифичных коммерческих тест-наборов для общепринятых индикаторов тромбоза и системы свертывания крови [58]-[60];
- повышенные затраты, этические и статистические вопросы, связанные с использованием лабораторных животных.
B.1.2.2 Следует сверить с "вертикальными" стандартами для предпочтительных моделей [1]-[41]. См. [186] для молодых овец в качестве ускоренной модели для исследования кальцификации биопротеза клапана, см. [187] для взрослых свиней или овец для исследования клапанов, размещенных вне сердечно-сосудистой системы и in situ имплантированных клапанов, см. [217]-[231] для моделей замены бедренной вены на взрослых собаках и овцах, используемых при испытаниях образцов протезов кровеносного сосуда малого и большого диаметра, см. [232]-[235] для модели коронарных сосудов на свиньях, широко используемой для исследований конструкций коронарных стентов.
B.1.2.3 Как описано в других частях ISO 10993, тщательно проведенные исследования in vitro предлагают валидированные скрининговые инструменты для оценки биологической безопасности МИ и материалов.
Важными факторами в модели in vitro, которые требуют конкретизации, являются:
- объем цельной крови в выбранной тест-системе (например, трубка, петля или другая модель);
- время контакта с кровью;
- температура крови;
- состояние кровотока;
- тип и концентрация антикоагулянта;
- значение удельной площади контакта с кровью, т.е., отношение площади поверхности материала/изделия (см) к объему цельной крови в системе (мл);
- площадь поверхности самой тест-системы, контактирующей с кровью (см).
Примечание 1 - "Фаза контакта с кровью" исследования in vitro требует четкого определения условий контакта тестируемого материала/МИ с кровью. Чем лучше условия исследования имитируют клиническое применение материала/МИ, тем выше становится адекватность модели и оцениваемого параметра.
Примечание 2 - В следующей за фазой контакта "Фазе испытания" исследуют конкретные характеристики крови, плазмы крови или самого материала/МИ. Исследование в "Фазе испытания" обычно направлено на одну или более из общих категорий, т.е. гемолиз, тромбоз, система свертывания крови, тромбоциты, гематология и система комплемента.
В B.2 и B.3 приведены общепринятые методы, используемые для оценки основных категорий биологического ответа крови при контакте с поверхностью МИ (см. таблицу 2).
B.2 Тромбоз
B.2.1 Макроскопический анализ. Забор и оценка, аутопсия дистальных органов
Макроскопический анализ всегда должен быть включен в основную оценку изделия, так как данный вид исследования изделия имеет особую важность при оценке биологических ответов крови in vivo на имплантированные МИ. Данный метод позволяет тщательно и подробно определить распределение, видимый размер и характер клеточных и белковоподобных депозитов, а также выявить наличие любой природы эмболий [7], [205]-[207].
Проявление некропсии дистальных органов является обоснованием необходимости исследования периферийных эффектов (таких, как эмболии), имплантированных МИ. Важность этого анализа зависит от применения изделия, и он используется для изделий со средней или высокой степенью риска тромбоэмболии или эмболизации материала/изделия, например таких, как механические клапаны сердца и интрааортальные баллон-насосы [206].
В этом типе исследований как ключевые моменты выделяются и соответственно маркируются изображения (изделия и прилегающих тканей и т.д.) на цветной пленке или цифровые камеры с небольшим и/или большим увеличением с высоким разрешением.
B.2.2 Степень окклюзии, свободная и покрытая тромбом площадь поверхности
Степень окклюзии сосудов может быть количественно оценена в процентах методами визуализации во время прижизненного этапа исследования с помощью контрастной рентгенографии и ультразвукового исследования. Степень окклюзии также может быть проанализирована визуально после удаления имплантированного изделия. Процент окклюзии может служить количественным критерием интенсивности тромботического процесса на внутренней поверхности изделия. Тем не менее отсутствие окклюзии не исключает наличие тромботического процесса, так как тромбы могли оторваться, образуя эмболы, или сместиться до измерения степени окклюзии. Окклюзия может быть вызвана не только тромбозом, но и гиперплазией интимы, особенно в перианастомотических местах в сосудистых протезах. Таким образом, вспомогательное микроскопическое исследование полезно для определения характера окклюзивного процесса. Определения площади поверхности, покрытой тромбами и свободной от них, являются полуколичественными или количественными методами, которые могут быть использованы на сравнительной основе с исследуемыми и/или контрольными МИ.
B.2.3 Оптическая микроскопия
Этот полуколичественный метод позволяет получить информацию о плотности распределения адгезированных на поверхности клеток, наличии клеточных агрегатов, составе инкапсулирующей ткани, интенсивности ответа на инородное тело, присутствии тромба или фибрина на поверхности материалов. Также возможна оценка пространственного распределения этих отложений на материалах или МИ.
Для полимерных или биологических материалов и изделий могут быть использованы метод заливки в парафине и специальные красители для гистологической оценки поверхности МИ.
Для металлических и керамических материалов и изделий полезны более современные методики заливки тугим пластиком и приготовления срезов для сохранения неповрежденной поверхности материала/изделия после ее контакта с кровью и тканями [207]-[211].
B.2.4 Растровая электронная микроскопия (РЭМ)
Обоснование и интерпретация метода РЭМ аналогичны оптической микроскопии (см. B.2.3). Метод РЭМ имеет преимущество перед методами оптической микроскопии, так как дает более подробную информацию о тонкой структуре изучаемых объектов. Количественный анализ требует достаточного количества повторных измерений для установления степени воспроизводимости результатов. Метод РЭМ лучше всего подходит для визуализации состояния поверхности. РЭМ также допускается использовать для анализа срезов, если дополнительные подробности относительно структурных особенностей взаимодействий клеток и тромба являются информативными [70], [71], [143], [205], [206]. Морфологическая оценка активации тромбоцитов и лейкоцитов, фибрина и формирования тромба при контакте изделия с циркулирующей кровью или ее компонентами (например, плазмой, обогащенной тромбоцитами) по сравнению с контролями может также дать ценную информацию [143], [173].
B.3 Гемосовместимость in vitro
B.3.1 Гемолиз. Методы исследования
Гемолиз считают основным экспресс-тестом, потому что повышенный уровень гемоглобина плазмы in vivo является абнормальным и может указывать на лежащую в основе гемопатологию или сосудистую проблему. При корректном проведении исследования повышенный уровень гемоглобина плазмы указывает на гемолиз, т.е. на процесс высвобождения содержания эритроцитов (RBC), что может быть связано с хрупкостью мембраны эритроцитов или повреждением эритроцитов. При оценке процесса взаимодействия материала/изделия с кровью гемолиз может произойти по следующим причинам:
a) прямой контакт крови с поверхностью/поверхностями материала/изделия (гемолиз, индуцированный материалом);
b) непрямой контакт крови с химическими веществами, экстрагируемыми из материала/изделия (гемолиз, индуцированный материалом);
c) воздействие турбулентности и повышенные (т.е. не физиологические) значения сдвиговых напряжений при тестировании изделия (гемолиз, индуцированный механическим воздействием).
См. приложение D для более подробных деталей по исследованию гемолиза.
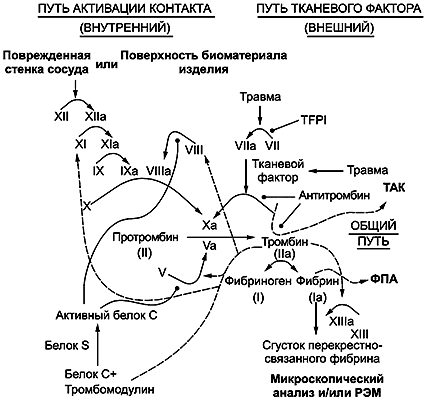
B.3.2 Активация системы свертывания крови. Методы исследований
B.3.2.1 Общие положения
Каскадный механизм свертывания крови имеет два параллельных пути, путь контактной активации (внутренний путь) и путь тканевого фактора (внешний путь), которые сливаются для формирования общего пути. Последний включает белок тромбин, который катализирует формирование фибрина, главного компонента тромба. Выявлено, что основным путем для начала свертывания крови является путь тканевого фактора; свертывание крови, связанное с МИ/материалами, контактирующими с кровью, происходит путем контактной активации. Сами пути являются серией каскадных реакций активации, при которых неактивные проферменты (называемые зимогенами) последовательно взаимодействуют с их гликопротеиновыми кофакторами для превращения в активные компоненты. Реакции заканчиваются образованием активного тромбина, который затем катализирует формирование фибрина. Факторы свертывания, как правило, обозначают римскими цифрами с добавлением строчной буквы "а" для их активной формы (см. рисунок B.1).
Оценку коагуляционной активности, т.е. степени изменения концентрации белков в крови, участвующих в формировании тромбина и фибрина (см. рисунок B.1), всегда выполняют методами лабораторно-клинического анализа, измеряющими концентрации ключевых белков в плазме, участвующих в каскадном процессе свертывания крови. Концентрации таких белков системы свертывания крови в норме (состояние гомеостаза) известны так же, как и некоторые повышенные их концентрации, наблюдаемые в клинике при различных коагулопатиях. Основанием использования этих методов для исследования гемосовместимости МИ является то, что биологически безопасные материалы и изделия не должны проявлять чрезмерную коагуляционную активность, которая может подвергнуть пациента риску тромбоза и тромбоэмболий. Высокие уровни коагуляционной активности могут быть индикатором повышенной способности материала/изделия индуцировать прямо или опосредованно острый тромбоз или тромбоэмболии. Для измерения коагуляционной активности клинико-диагностические лаборатории часто используют методы ИФА. В основном исследовании, зависящем от наличия соответствующих антител к видоспецифичным эпитопам-мишеням белков свертывания крови, которое может быть проведено in vivo или in vitro, образцы крови забирают при определенных условиях с последующей пробоподготовкой и анализом согласно ИП тест-набора. Типичные определенные условия или факторы, важные в модели in vitro, приведены в B.1.2.3. Сравнение результатов с надлежащими контролями, такими как отрицательные контроли (например, базовые уровни или отсутствие воздействия материала/изделия на кровь) и результаты для зарегистрированного аналога тестируемого изделия/материала, является обязательным. Статистически достоверная более высокая активация свертывающей системы крови исследуемым материалом/МИ по сравнению с контролями может быть индикатором того, что применение материала/изделия имеет высокий риск осложнений, связанных со свертыванием крови. Примеры белков активации свертывающей системы крови, для которых существуют коммерчески доступные тест-наборы ИФА, включают ТАК (комплексы тромбин-антитромбин), F.1.2 (фрагмент белка, высвобождаемый из протромбина при формировании тромбина) и ФПА (фрагмент белка, высвобождаемый из фибриногена при формировании фибрина).
Белки, указывающие на активацию свертывающей системы крови, как правило, регистрируют в фазах инициации, распространения и завершения коагуляции [56], [57]. Это отражает начальную реакцию или реакции формирования, период каскада/усиления обратной связи и период замедления/деактивации, когда критичные прекурсоры могут быть использованы или измеренный белок деактивирован белками обратной связи отрицательного контроля. Различия в концентрациях белков активации свертывающей системы крови с течением времени могут достигать порядка величин. Следовательно, необходимо учитывать важный фактор того, когда фаза активации в действительности происходит во время контакта материала/МИ с кровью. Например, степень воздействия исследуемых материалов при перемешивании с кровью может быть совершенно разной для каждой фазы свертывания. Кроме того, так как степень активации белка свертывающей системы крови, как правило, пропорциональна площади поверхности (ПП), контактирующей с кровью, ПП материала/МИ может значительно повлиять на результаты. По этой причине важно обозначить исследуемое соотношение ПП к объему крови (значение экспозиционной дозы) в каждом исследовании. При возможности значение экспозиционной дозы может рассматриваться как переменная для понимания специфичности действия материала на кровь. Значение экспозиционной дозы от 3,0 см до 6,0 см
/ мл крови (исходя из толщины изделия) соответствует значениям, установленным в ISO 10993-12. Другие значения экспозиционной дозы, которые в 1,5 и 2,0 раза больше, допускается также использовать, так как чем больше площадь поверхности, тем теоретически выше чувствительность системы свертывания на тестируемый материал.
Существует физическое ограничение на количество тестируемого материала, которое может быть исследовано, из-за объема тест-системы, например пробирки, и заданного значения экспозиционной дозы. В таком случае использование гистологических срезов материалов изделия может быть более результативным. Если изделие содержит более одного материала, то следует соблюдать пропорцию в каждом срезе готового изделия. Следует соблюдать осторожность и избегать использования срезов, которые могут привести к появлению существенного количества поверхностей, не контактирующих с кровью.
Существует ряд механизмов, которые возникли в процессе эволюции для контроля каскада свертывания крови. Одним из этих механизмов является белок антитромбин. Антитромбин является ингибитором сериновой протеазы, который может связывать и деактивировать сериновые протеазы тромбина, активированные факторы свертывания крови IXa, Xa, XIa и XIIa. При активном состоянии антитромбин при взаимодействии с гепарином изменяет свою конформацию, что значительно увеличивает его скорость ингибирования протеаз.
Примечание - Исследование методом ИФА факторов свертывания крови представляет собой "фазу испытания" (см. B.1.2), т.е. испытывают образцы крови, полученные после контакта крови с МИ или материалом in vitro или in vivo.
Многие стандартные анализы на свертывание крови предназначены для обнаружения клинических нарушений в системе свертывания, которые приводят к замедленному свертыванию или чрезмерному кровотечению, скорее, отклонениям, которые ускоряют свертывание крови/тромбоз. Протоколы для оценки взаимодействия МИ с кровью необходимо соответствующим образом модифицировать, чтобы измерить уменьшение времени свертывания крови после инкубации крови с материалом/МИ.
Существует взаимосвязь между системами свертывания крови и комплемента [143]-[147].
|
Рисунок B.1 - Каскадный механизм активации свертывающей системы крови
B.3.2.2 Тест-наборы ИФА на тромбин-антитромбин (ТАК), F1.2 и фибрин (ФПА)
Тест-наборы ИФА, непосредственно регистрирующие процессы формирования тромбина (ТАК, F1.2) и фибрина (ФПА), коммерчески доступны. Результатом является количественная оценка имеющихся в пробе тромбина и образующего фибрина, которые отражают уровень происходящей коагуляционной активности и могут быть проявлением возникающего тромбоза. См. B.4 для получения подробной информации о методе ИФА.
B.3.2.3 Частичное тромбопластиновое время (ЧТВ)
ЧТВ - это время свертывания рекальцифицированной цитратной плазмы при добавлении частичного тромбопластина, который не содержит активатор. Частичный тромбопластин является суспензией фосфолипидов, который, как правило, экстрагируют из тканевого тромбопластина, гомогената из мозга или легкого млекопитающих. Сокращение ЧТВ после контакта с материалом при стандартных условиях указывает на активацию внутреннего пути коагуляции крови. Гепарин и другие антикоагулянты вызывают продление ЧТВ [23].
Реагенты для измерения активированного частичного тромбопластинового времени (АЧТВ) включают активатор, такой как каолин, целит или эллаговая кислота. Реагентов с такими активаторами необходимо избегать при оценке биологического действия МИ, контактирующих с кровью или материалами МИ, потому что они маскируют свертывание крови, вызванное материалами или МИ.
При исследовании процесса коагуляции при контакте крови с медицинскими материалами/изделиями само МИ или материал служат активатором свертывания крови. Соответствующие материалы положительного и отрицательного контроля следует применять при их наличии. Должен быть включен отрицательный контроль, непосредственно плазма крови без инкубации с материалом/МИ.
B.3.3 Тромбоциты. Методы исследования
B.3.3.1 Общие положения
Оценка состояния тромбоцитов и процессов их активации подробно описаны в научной литературе, например, см. [69]-[94]. Тем не менее для МИ и материалов, контактирующих с кровью, наиболее используемыми методами являются простой подсчет тромбоцитов и измерение белков, высвобождаемых при дегрануляции тромбоцитов (тромбоцитарные белки дегрануляции) после инкубации МИ или материалов с кровью в контролируемых условиях. Нормальные уровни тромбоцитов и тромбоцитарных белков дегрануляции в состоянии покоя (гомеостаз) установлены (см. информацию о продукте коммерческого тест-набора ИФА), как и отдельные абнормальные уровни, наблюдаемые при различных клинических тромбоцитопатиях. Основанием проведения такого тестирования МИ является то, что соответствующие материалы и конструкции МИ не должны обладать способностью адгезировать и/или активировать большое количество тромбоцитов, что может подвергнуть пациента риску. Существенное снижение количества тромбоцитов и/или их дегрануляция могут быть индикатором тенденции материала/МИ индуцировать или способствовать этим процессам, которые могут привести к осложнениям в виде кровотечения или тромбоза. Для измерения количества тромбоцитов используют обычный дифференциальный счетчик клеток, степень активации/дегрануляции тромбоцитов оценивают измерением концентрации хорошо определяемых белков из альфа-гранул тромбоцитов методом ИФА. Клинические лаборатории, как правило, используют тест-наборы для измерения концентрации белков из альфа-гранул методом ИФА. В основном данный тест, который может быть проведен in vivo либо in vitro, будет зависеть от наличия соответствующих антител к видоспецифичным эпитопам-мишеням белка гранул тромбоцитов. Образцы крови забирают при определенных условиях, пробы подготавливают и анализируют согласно инструкциям изготовителя. Стандартные конкретные условия или факторы, важные для модели in vitro, приведены в B.1.2.3. Сравнение результатов с соответствующими контролями, такими как отрицательные контроли (например, базовые уровни или тест-система без воздействия материала/изделия), и результатов испытания изделия/материала - аналога, является обязательным. Снижение количества тромбоцитов и повышение концентрации тромбоцитарных белков дегрануляции, которые статистически и биологически достоверно отличаются от контролей, могут быть индикатором того, что тестируемый материал/изделие при контакте с кровью может с большой вероятностью индуцировать процессы адгезии и активации тромбоцитов. В перечень белков из альфа-гранул тромбоцитов, для которых существуют коммерчески доступные тест-наборы ИФА, входят:
- ТФ-4 (тромбоцитарный фактор 4), белок из 70 аминокислот с высокой аффинностью к связыванию с гепарином. Главной физиологической ролью ТФ-4 является нейтрализация гепариноподобных молекул на эндотелиальной поверхности кровеносных сосудов, что приводит к ингибированию локальной активности антитромбина III и способствует свертыванию крови;
- ![]() -ТГ (бета-тромбоглобулин, хемокин для фибробластов и нейтрофилов).
-ТГ (бета-тромбоглобулин, хемокин для фибробластов и нейтрофилов).
Примечание - Тромбин - компонент каскада свертывания крови, являющийся мощным агонистом тромбоцитов и который может немедленно вызвать дегрануляцию тромбоцитов. Высокие уровни тромбина будут коррелировать с высокими уровнями дегрануляции тромбоцитов.
Как и при свертывании крови, на убыль тромбоцитов влияет площадь поверхности, контактирующая с кровью. Таким образом, площадь поверхности (ПП) МИ/материала влияет на результат подсчета количества тромбоцитов в объеме крови. По этой причине следует конкретизировать отношение ПП к объему крови (значение экспозиционной дозы) в каждом исследовании. Значение экспозиционной дозы допускается рассматривать как переменную для понимания специфичности эффекта материала. Значения экспозиционной дозы от 3,0 см до 6,0 см
/мл крови (основываясь на толщине МИ) соответствуют значениям, установленным в ISO 10993-12. Другие значения экспозиционной дозы, как превосходящие данное отношение в 1,5 и 2,0 раза, допускается использовать, так как более большие площади поверхности теоретически увеличат чувствительность реакции тромбоцитов на тестируемый материал.
Активация тромбоцитов - это процесс, который происходит в течение времени (от минут до часов) и признан потенциально обратимым до определенной точки. После ее прохождения он может необратимо прогрессировать вплоть до значительного изменения формы клеток, потери цитоплазматических составляющих, отшелушивания микрочастиц и полного разрушения. Процесс зависит от типа и количества стимулирующих агентов. Существует множество известных мощных стимуляторов, называемых агонистами тромбоцитов, примерами которых являются тромбин, АДФ и коллаген. Сами чужеродные поверхности, такие как МИ, контактирующие с кровью, также могут вести себя как агонисты, так как они могут индуцировать выработку тромбина. Дополнительно тромбоциты могут прикрепляться к этим поверхностям, оставаться в адгезированном состоянии или открепляться от поверхности в активированном или неактивированном состоянии и пройти через изменения формы, ведущие к разрушению тромбоцитов. Таким образом, оценка степени активации тромбоцитов при заданном времени контакта изделия/материала с кровью будет более достоверной при использовании агентов, позволяющих "задержать" тромбоциты в их физическом и биохимическом состоянии в конкретной временной точке. Следовательно, если оценка состояния тромбоцитов не может быть проведена немедленно после удаления исследуемого материала или изделия из тест-системы, то применяют ряд веществ для предотвращения дальнейшей активации тромбоцитов и стабилизации состояния тромбоцитов [88]-[91]. Примерами этих агентов являются кислый цитрат декстрозы (ACD), цитрат, теофиллин, аденозин, дипиридамол (CTAD) и другие стабилизирующие тромбоциты реагенты, такие как ThromboFix![]()
. Применение таких стабилизаторов возможно, если доказано, что не существует их негативного влияния при заданном времени исследования, такого как, например, артефактное воздействие на активацию тромбоцитов.
________________
ThromboFix
![]() является примером коммерчески доступного подходящего продукта. Эта информация приводится для удобства пользователей данного документа и не является поддержкой ISO названного продукта.
является примером коммерчески доступного подходящего продукта. Эта информация приводится для удобства пользователей данного документа и не является поддержкой ISO названного продукта.
B.3.3.2 Количество тромбоцитов
Из-за ключевой роли тромбоцитов в предотвращении кровотечения и в общем процессе тромбоза следует определить количество тромбоцитов [45], [121]. Значительное снижение числа тромбоцитов в крови, контактирующей с изделием, может быть вызвано адгезией тромбоцитов, агрегацией тромбоцитов, секвестрацией тромбоцитов (например, в селезенке) или формированием тромба на материалах или изделиях. Уменьшение количества тромбоцитов после имплантации МИ также может быть вызвано ускоренным разрушением или удалением тромбоцитов из кровообращения. Для подсчета тромбоцитов в цельной крови могут быть использованы различные антикоагулянты [151]-[156].
Методики забора крови должны быть воспроизводимыми. Тромбоциты могут стать гиперактивными/активированными при разнообразных условиях, включая неправильный забор крови. Методы агрегометрия тромбоцитов и проточная цитометрия применяют для подтверждения нормальной реактивности и активации тромбоцитов.
B.3.3.3 Активация тромбоцитов: высвобождение гранулярных тромбоцитарных белков: ![]() -ТГ, ТФ-4, TxB2 и морфологические изменения тромбоцитов
-ТГ, ТФ-4, TxB2 и морфологические изменения тромбоцитов
Применение ряда материалов или МИ может вызвать активацию тромбоцитов, которая может привести к следующему:
a) высвобождение веществ гранул тромбоцитов, таких как ![]() -ТГ, ТФ-4, TxB2 и серотонин;
-ТГ, ТФ-4, TxB2 и серотонин;
b) изменение морфологии тромбоцитов;
c) высвобождение микрочастиц из тромбоцитов.
Активированные тромбоциты являются протромбогенными. Активация тромбоцитов может быть оценена различными способами, такими как оптическая и электронная микроскопии для исследования морфологии адгезированных на поверхности материала/изделия тромбоцитов, измерение ![]() -ТГ, ТФ-4 и TxB2, высвобожденных из активированных тромбоцитов.
-ТГ, ТФ-4 и TxB2, высвобожденных из активированных тромбоцитов.
![]() -ТГ и ТФ-4 являются белками, которые содержатся в альфа-гранулах тромбоцитов и высвобождаются в больших количествах после активации тромбоцитов [85]-[87], [106]. Оба этих белка могут быть измерены с помощью коммерчески доступных тест-наборов ИФА. Повышение активации тромбоцитов может произойти посредством множества путей, связанных с МИ и материалами. Контакт поверхности МИ/материала с кровью, турбулентность и чрезмерные сдвиговые напряжения потока крови могут вызвать активацию тромбоцитов. Активация тромбоцитов может быть вызвана сильными агонистами, например тромбином в процессе тромбообразования при контакте материала/МИ с кровью или из-за локального повреждения стенки кровеносного сосуда. Высокие уровни TxB2, измеряемые ИФА, указывают на высокие уровни своего предшественника тромбоксана A2, сильного агониста тромбоцитов, который считают продуктом активированных тромбоцитов; TxB2 также относят к надежному, независимому от вида животных, маркеру активации тромбоцитов. См. B.3.3.1 и B.4, где подробно изложена общая методология ИФА. Также может быть информативной оценка активации тромбоцитов путем исследования морфологических изменений адгезированных тромбоцитов при их активации на поверхности материала/МИ [70], [71], [173].
-ТГ и ТФ-4 являются белками, которые содержатся в альфа-гранулах тромбоцитов и высвобождаются в больших количествах после активации тромбоцитов [85]-[87], [106]. Оба этих белка могут быть измерены с помощью коммерчески доступных тест-наборов ИФА. Повышение активации тромбоцитов может произойти посредством множества путей, связанных с МИ и материалами. Контакт поверхности МИ/материала с кровью, турбулентность и чрезмерные сдвиговые напряжения потока крови могут вызвать активацию тромбоцитов. Активация тромбоцитов может быть вызвана сильными агонистами, например тромбином в процессе тромбообразования при контакте материала/МИ с кровью или из-за локального повреждения стенки кровеносного сосуда. Высокие уровни TxB2, измеряемые ИФА, указывают на высокие уровни своего предшественника тромбоксана A2, сильного агониста тромбоцитов, который считают продуктом активированных тромбоцитов; TxB2 также относят к надежному, независимому от вида животных, маркеру активации тромбоцитов. См. B.3.3.1 и B.4, где подробно изложена общая методология ИФА. Также может быть информативной оценка активации тромбоцитов путем исследования морфологических изменений адгезированных тромбоцитов при их активации на поверхности материала/МИ [70], [71], [173].
B.3.4 Гематология. Методы исследования
B.3.4.1 Общий анализ крови (ОАК)
Общий анализ крови (как правило, называемый ОАК) является жизненно важным исследованием, применяемым ежедневно в больничных гематологических лабораториях. Его основной целью является быстрое и точное измерение концентраций различных популяций клеток в крови пациента, когда абнормальные показатели могут предоставить раннюю и жизненно важную информацию по целому ряду потенциальных отклонений. ОАК используют для определения количества или соотношения лейкоцитов и эритроцитов в организме. Анализ включает подсчет тромбоцитов. При исследовании гемосовместимости материала/изделия данные ОАК предоставляют основную информацию о влиянии взаимодействия изделия/материала с форменными элементами крови. Подсчеты тромбоцитов и лейкоцитов до и после контакта крови с материалом/изделием необходимы для регистрации убыли активированных тромбоцитов и лейкоцитов за счет формирования тромба, индуцированного поверхностью материала/МИ, и, таким образом, позволяют оценить тромбогенный потенциал тестируемых образцов [24].
B.3.4.2 Активация лейкоцитов
Активация лейкоцитов может быть определена микроскопическим исследованием поверхности МИ на предмет активированных лейкоцитов. Простой, более количественный метод включает применение коммерческого тест-набора ИФА для определения количества эластазы полиморфоядерного лейкоцита (ПМЯ), выделенного в плазму после активации, вызванной взаимодействием материала или изделия с кровью. Другой подход, основанный на принципе, что тромбы, прилегающие к материалу, будут содержать большое количество тромбоцитов и лейкоцитов, включает оценку снижения их количества в крови [24].
B.3.5 Система комплемента. Методы исследования на C3a и SC5b-9
Система комплемента существует в плазме крови в форме биохимического каскада, который функционирует как защитный механизм, предназначенный для поддержки или "дополнения" способности антител выводить патогенные агенты из организма. Она является частью иммунной системы, называемой "врожденной иммунной системой". Здесь, в отличие от защиты антителами, активность ответа не приобретается и не адаптируется с течением времени. Система комплемента формирует фундаментальную линию защиты, которая функционирует параллельно и может опосредовать конкретные механизмы антител. Система комплемента тем не менее может быть приведена в действие поверхностью или поверхностями материалов, инородных организму, включая контактирующие с кровью МИ [129], [138].
Система состоит из некоторого количества белков, обнаруживаемых в крови, которые, как правило, циркулируют в качестве неактивных прекурсоров. Белки комплемента обозначаются как "C" с последующей арабской цифрой для нативного белка, а для расщепленного - со строчной "а" или "b", чтобы обозначить фрагмент. В условиях низкого уровня спонтанно образованного реактивного C3b присутствие материала/МИ может запустить ответ амплификации, конечным итогом которого станет выработка медиаторов воспаления, например C5a, и цитотоксичных белковых комплексов, например мембраноатакующий комплекс (МАК), который может стимулировать целый ряд воспалительных ответов, включая хемотаксис лейкоцитов, выработку активных форм кислорода (АФК) и экспрессию цитокинов [129], [130], см. рисунок B.2.
Существует множество белков и фрагментов белков, которые составляют систему комплемента, и они могут быть разделены по трем путям активации: классический путь комплемента, альтернативный путь комплемента и маннозо-связывающий лектиновый путь. Именно альтернативный путь активации системы комплемента считается наиболее вероятным при контакте медицинских материалов/МИ с кровью.
Доступны несколько коммерческих тест-наборов ИФА для оценки белков системы комплемента в крови. Так как C3a является всегда присутствующим в крови фрагментом, концентрация которого увеличивается при активации системы комплемента, то он считается ее хорошим общим индикатором. Кроме того, растворимая форма терминального МАК - фрагмента SC5b-9 также может быть оценена методом ИФА. Фрагмент SC5b-9, как правило, считают более важным маркером, указывающим на полную степень активации системы комплемента. Повышенные уровни любого из компонентов комплемента указывают на активацию всей системы комплемента. Для изделий с большой площадью поверхности, таких как фильтры для гемодиализа и системы искусственного кровообращения, характерны высокие уровни активированных компонентов комплемента [129]-[138], [143], и этот эффект обусловлен активацией лейкоцитов и секвестрацией лейкоцитов в легких [130], [137].
Измерение фрагментов компонентов комплемента имеет несколько недостатков. Во-первых, тест-наборы ИФА только измеряют компоненты комплемента в жидкой фазе (сыворотка или плазма). Они не регистрируют компоненты комплемента, которые активированы и адсорбированы на поверхности изделия. В зависимости от природы материала/МИ на их поверхности может находиться значительное количество активированных адсорбированных компонентов комплемента, которые не обнаруживаются коммерческими тест-наборами ИФА. Во-вторых, для многих из коммерчески доступных наборов существуют видоспецифичность и высокие базовые/фоновые уровни, наблюдаемые при стандартном исследовании in vitro. В связи с этим следует включить и обосновать необходимые контроли. Классический метод CH-50 применим при исследовании общей активации системы комплемента, индуцированной поверхностью материала/МИ, в сыворотке человека, быка, свиньи и кролика. Тем не менее чувствительность CH-50 при измерении активации комплемента после контакта с материалами/изделиями низкая, учитывая, что методом CH-50 измеряют остаточную активность комплемента и часто только небольшую часть системы комплемента, активируемую материалами/МИ. Другим удобным методом измерения активации комплемента in vitro является регистрация увеличения концентрации C3- или C5-конвертазы комплемента, определяемой конверсией субстрата. В [18] и [19] также приведена информация об активации системы комплемента. В приложении E приведена дополнительная информация об активации системы комплемента, связанной с медицинскими материалами и МИ. См. B.4, где подробно изложена общая методология ИФА.
|
![]() - поверхность биоматериала/изделия
- поверхность биоматериала/изделия
Рисунок B.2 - Альтернативный путь комплемента
Примечание - Факторы, отмеченные красным, измеримы коммерчески доступными тест-наборами.
B.4 Существующие методологии исследования факторов плазмы крови, специфичных для системы свертывания крови, активации тромбоцитов, лейкоцитов и системы комплемента (используя ИФА или аналогичные методы)
B.4.1 Общие положения
Оценка свертывания крови, активации тромбоцитов, других клеток крови и комплемента долгое время основывалась на клинических анализах, измеряющих в плазме уровни ключевых белков, образующихся в процессе каскада активации или высвобождающихся при активации или повреждении различных типов клеток. В таком случае клинические лаборатории часто полагаются на тест-наборы, использующие распространенный метод ИФА. В основном исследовании, которое может быть in vivo или in vitro, использование того или иного метода будет зависеть от наличия соответствующих антител/тест-наборов к видоспецифичным эпитопам-мишеням белка. Пробы крови забирают при определенных условиях, подготавливают и анализируют согласно инструкциям изготовителя тест-наборов. Определенные условия могут включать время контакта материала/изделия с кровью, концентрацию и тип антикоагулянта, температуру, наличие потока, гематокрит и другие факторы. Сравнение результатов с необходимыми контролями, такими как отрицательные контроли (например, базовые уровни или отсутствие контакта материала/МИ с кровью), и результатов для промышленно выпускаемого изделия-аналога является обязательным. Значения параметров активации, которые статистически и биологически значимо выше, чем в контролях, могут означать, что материал/изделие представляет собой более высокий уровень риска для пациента из-за большой вероятности активации системы свертывания, тромбоцитов или комплемента при его контакте с кровью. В примеры белков свертывающей системы, для которых существуют коммерчески доступные тест-наборы ИФА, включают ТАК (комплексы тромбин-антитромбин), F.1.2 (фрагмент белка, высвобождаемый из протромбина при формировании тромбина) и ФПА (фибринопептид А, высвобождаемый из фибриногена при формировании фибрина). Существуют коммерческие наборы ИФА для оценки активации тромбоцитов (например, высвобождение альфа-гранулами ![]() -ТГ и ТФ-4) и активации комплемента (например, формирование C3a и SC5b9).
-ТГ и ТФ-4) и активации комплемента (например, формирование C3a и SC5b9).
B.4.2 Общие методы и регистрация результатов анализа
B.4.2.1 Общие положения
В протоколе исследований указывают сведения и прикладывают документацию в соответствии с настоящим разделом.
B.4.2.1.1 Справочные документы
ИП протокола ИФА, прикладываемая изготовителем.
B.4.2.2 Хранение и стабильность
В протоколе указывают условия хранения и стабильности используемых реагентов комплекта и крови/плазмы крови.
B.4.2.3 Процедура
B.4.2.3.1 Приготовление образца
Должны быть предоставлены общие инструкции. Результаты исследования зависят от ПП исследуемого МИ или исследуемого материала МИ. По этой причине следует обозначить отношение ПП к объему крови (значение экспозиционной дозы) в каждом исследовании. Значения экспозиционной дозы от 3,0 см до 6,0 см
/мл крови (основываясь на толщине изделия) соответствуют значениям, установленным в ISO 10993-12. Другие значения экспозиционной дозы, такие как превосходящие данное отношение в 1,5 и 2,0 раза, допускается использовать, так как более высокие площади поверхности теоретически увеличивают чувствительность реакции крови и ее компонентов на исследуемую поверхность.
Следует указать способ ингибирования реакции после времени инкубации, т.е. привести наименование и концентрацию/концентрации ингибирующего агента/агентов.
B.4.2.3.2 Коэффициент разбавления (КР)
Должна быть предоставлена детальная информация о применяемых коэффициентах разведения, растворителях и т.д.
ВНИМАНИЕ - Может наблюдаться значительная интер- и интрадонорская вариативность, что делает сложным определение единственного идеального КР. Следовательно, рекомендуется использование как минимум двух КР исследуемого образца для того, чтобы охватить все значения проб образца на стандартной кривой абсорбции. Значения абсорбции образца должны быть в диапазоне, обозначенном самым низким и самым высоким стандартами. В противном случае образцы должны быть исследованы повторно с новым КР так, чтобы результаты находились в диапазоне стандартной кривой.
B.4.2.3.3 Выбор данных при исследовании с множественными КР
Если все или некоторые образцы исследовались без разбавления, при низком и высоком разбавлении, для отчета берут значения, требующие наименьшего КР, находящегося на стандартной кривой абсорбции. Допустимо, если образцы "без разбавления" содержат отдельные значения вне кривой, все образцы "низкого разбавления" находятся на кривой, а образцы "высокого разбавления" содержат отдельные значения ниже кривой, для отчета о показателях "низкого разбавления", где все значения находятся на кривой при том же КР.
B.4.2.3.4 Приготовление стандартов
Подробно описывают процедуры получения стандартной кривой и приготовления контролей.
B.4.2.3.5 Метод
Подробно описывают последовательные этапы выполнения метода в целом, включая информацию о каких-либо отступлениях от ИП набора ИФА.
B.4.2.3.6 Оценка
Подробно описывают выполненные вычисления для определения значений концентраций измеряемого белка в плазме крови.
B.4.2.3.7 Статистический анализ
Подробно описывают методы статистического анализа.
B.4.2.3.8 Ограничения и ошибки
Должны быть приведены все ограничения или ошибки, такие как неправильная методика забора крови; например, неправильное соотношение образца крови и раствора цитрата (или другого антикоагулянта, такого как гепарин) может привести к ложно завышенным значениям белка системы свертывания крови; неправильно выбранный антикоагулянт может привести к повышению всех фоновых значений и т.д.
B.4.2.3.9 Сравнительный интервал
Должны быть приведены известные нормальные и абнормальные концентрации измеряемого белка в плазме и ожидаемые значения контролей.
B.4.3 Приложения
Должна быть приведена информация по рекомендуемому коэффициенту разбавления, формы данных пробы ИФА, контрольные листы для выполненного метода ИФА и т.д.
Приложение C
(справочное)
Тромбоз. Методы исследования in vivo
C.1 Общие положения
Для исследования процессов тромбообразования применялись многочисленные подходы. Тем не менее для МИ и материалов, контактирующих с кровью, природа тромбоза in vivo привела к тому, что методы, приведенные в C.2 и C.3, стали более широко применять для оценки тромбоза, связанного с МИ. Эти методы применяют для оценки изделий для постоянного и временного контакта с кровью. В настоящем стандарте показано, что разнообразие областей применения МИ, контактирующих с кровью, диктует необходимость разнообразия моделей in vivo для того, чтобы адекватным образом имитировать условия клинического применения конкретного МИ.
Метод, приведенный в C.2, общепринят как наиболее подходящий подход к оценке изделий на предмет тромбоза, так как при этом методе данное изделие оценивают в его предназначенной имплантируемой конфигурации в модели на животных. Главными элементами в этой работе являются отработка протокола исследований на животных согласно ISO 10993-2 с тщательной имитацией клинического применения МИ и включение в протокол подробных методов и анализов, используемых для оценки степени тромбоза.
Метод, приведенный в C.3, применяют реже, и он не является общепринятым во всем мире. Тем не менее он может требоваться или запрашиваться отдельными регулирующими органами. Метод называют "модель не антикоагулянтной венозной имплантации" (НАВИ), т.е. при имплантации не используют антикоагулянт, и "модель антикоагулянтной венозной имплантации" (АВИ), т.е. имплантация выполняется с использованием антикоагулянта. Сам метод включает введение изделий в форме катетера или материалов изделия, которым придана форма катетера, в вены животных на период до 4 ч с последующей макроскопической оценкой количества тромба на поверхности материала/катетера. Недостатки и преимущества метода представлены в таблицах C.3 и C.4, соответственно. Из-за отмеченных недостатков и во избежание ложного вывода о тромбогенности материалов и изделий интерпретация данных, полученных при использовании этой модели, требует особой осторожности [143], см. также A.3.
Когда тестируемое изделие является изделием катетерного типа, имплантируемым в вену, методы в C.2 и C.3 эквивалентны.
C.2 Имплантационный тест in vivo готового медицинского изделия в доклиническом исследовании на животных
Испытания in vivo на животных проводят на МИ, предназначенных для имплантации при клиническом применении (см. 6.1.6, 6.3.2 и 6.3.3). Протоколы должны включать подробные методы для исследования процессов взаимодействия изделия с кровью, например анализ:
a) самого изделия;
b) образцов крови после испытания МИ;
c) состояние тканей и органов.
Такое доклиническое исследование должно использовать модели in vivo, которые имитируют условия при практическом применении МИ, например место имплантации, геометрию, поток, длительность контакта, температуру, стерильность и т.д. (см. 6.1.2), и включать необходимые контроли, например изделие-аналог (см. 6.1.3). Следует проводить тестирование только на настоящих готовых изделиях или их компонентах (см. 6.1.4), так как исследования на МИ-полуфабрикатах и исследование в плохо имитированных условиях применения не будут с высокой точностью прогнозировать функционирование изделий в клинической практике (см. 6.1.6).
Соответственно МИ, предназначенные для функционирования ex vivo, и МИ для функционирования in vivo должны быть исследованы на адекватных моделях ex vivo и in vivo соответственно. Антикоагулянты в моделях ex vivo и in vivo должны совпадать с типом и количеством антикоагулянтов, используемых при клиническом применении изделия, и соответствовать ИП к МИ (см. 6.1.12). Выполнение достаточного количества повторов исследования, методы статистического анализа и его результаты должны быть использованы в исследованиях на животных (см. 6.1.14 и [213]-[216]).
Исследования следует проводить, если возможно, в следующих категориях тестов: тромбоз, свертывание крови, тромбоциты, гематология и активация комплемента, как описано в таблице 2. Как пример, один тест может состоять из макроскопического исследования и РЭМ анализа изделия для оценки степени тромбоза, связанного с изделием. Осмотр состояния органов ниже по кровотоку (например, легкое и почка) для установления признаков тромбоэмболий поможет при оценке вероятности тромбоэмболии, связанной с МИ. Если присутствуют соответствующие антитела, то процесс свертывания крови может быть оценен измерением в плазме крови концентраций индикаторов коагуляции и формирования фибрина, например ТАК и ФПА, измеряемых методом ИФА. Также простой подсчет тромбоцитов и/или измерение маркеров активации тромбоцитов, например ![]() -ТГ, могут быть использованы для оценки влияния МИ на тромбоциты. Обычный дифференциальный подсчет клеток крови и свободного гемоглобина в плазме допускается применять для общей оценки факторов гематологии и оценки механического повреждения клеток крови. Для МИ с большой площадью поверхности, с учетом наличия антител, количества в плазме различных факторов комплемента, может быть использован для оценки активации комплемента по альтернативному пути.
-ТГ, могут быть использованы для оценки влияния МИ на тромбоциты. Обычный дифференциальный подсчет клеток крови и свободного гемоглобина в плазме допускается применять для общей оценки факторов гематологии и оценки механического повреждения клеток крови. Для МИ с большой площадью поверхности, с учетом наличия антител, количества в плазме различных факторов комплемента, может быть использован для оценки активации комплемента по альтернативному пути.
Желательно, чтобы исследуемое МИ не влияло слабо или оказывало одинаковое влияние на измеряемый параметр по сравнению с результатами, наблюдаемыми на МИ-аналоге. Более высокие результаты, чем на МИ-аналоге, могут быть обоснованы с помощью анализа риска/преимущества. При исследовании МИ без аналогов должны быть выбраны и обоснованы соответствующие контроли. Такие оценки предпочтительны с использованием метода, приведенного в C.3, так как этот метод наиболее полно имитирует применение in vivo. Следует свериться с "вертикальными" стандартами в различных областях МИ. Для последних допускается применять стандарты, указанные в библиографии.
Примечание 1 - Для МИ в форме катетера, предназначенных для имплантации в венозную систему кровообращения, модели имплантации с антикоагулянтами или без, см. C.3, являются адекватным подходом к исследованию in vivo этих МИ.
Примечание 2 - Для МИ в форме катетера, предназначенных для имплантации в артериальную систему кровообращения, модели имплантации с антикоагулянтом (АВИ) или без (НАВИ), см. C.3, являются адекватным подходом к исследованию in vivo этих МИ.
См. также 6.3.3 и приложения A и B.
C.3 In vivo НАВИ и АВИ исследования на тромбогенность
Сущность исследований НАВИ и АВИ заключается во введении изделия в форме катетера (или другой подходящей формы) или материала МИ, которому придана форма катетера, в вену крупного животного. Данный вид теста необходим в случаях, например, когда требуется оценка тромбогенности новых катетеров, покрытия, материала или при изменении поставщика или технологического этапа обработки материала/МИ. В самой модели используют несколько венозных позиций (см. рисунки C.1 и C.2). При отсутствии (НАВИ) или в присутствии (АВИ) антикоагулянтов допустима имплантация двух или трех имплантатов для инкубации in situ на период до 4 ч (случаи меньшего и большего времени инкубации должны быть обоснованы, учитывая конкретное применение изделия). Затем имплантаты удаляют и оценивают на предмет количества видимых тромбов на поверхности образцов. Наиболее часто используют модель бедренной или яремной вены собаки. Тестируемый материал/МИ размещают в одной из вен, а контрольный материал или аналоговое МИ помещают на контралатеральной (расположенной на противоположной стороне тела) вене. Исследование требует от двух до трех крупных животных, с чередующимися местами имплантации объекта тестирования и контроля во избежание предвзятости и оценки тромба на изделиях, используя метод подсчета, такой как приведен в таблицах C.1 и C.2. Результаты могут быть дополнены гравиметрическим анализом обнаруженного тромба и исследованием проходимости сосудов. Тромбогенность тестируемого изделия должна быть эквивалентна или быть меньше по сравнению с соответствующими, при их наличии, промышленными аналогами, или должны быть обоснованы другие критерии оценки. Следует удостовериться, что исследованы все контактирующие с кровью при клиническом применении компоненты изделия. Различные мировые регулирующие органы рекомендуют, чтобы было имплантировано до 15 см объекта тестирования и контроля для обеспечения адекватного воздействия в течение исследования. В зависимости от конфигурации МИ может потребоваться создание специального изделия для сокращения длины компонентов при сохранении того же соотношения материалов, что и в готовом изделии. В качестве альтернативы если необходимо, то МИ может быть поделено на несколько исследуемых образцов.
Для МИ и материалов, предназначенных для имплантации в артерии, методы тестирования должны быть соответственно изменены на имплантацию объектов тестирования в артериальную позицию.
ВНИМАНИЕ - Вариативность в результатах наблюдалась между:
a) исследовательскими центрами;
b) сотрудниками, проводящими исследования;
c) повторными исследованиями на том же материале;
d) показателями, полученными от контролей [143].
В таблице C.3 обобщены основные недостатки моделей НАВИ и АВИ. В таблице C.4 представлены некоторые отмеченные преимущества моделей НАВИ и АВИ. Величайшей ценностью модели может быть тестирование материалов, преднамеренно измененных для сокращения времени острого формирования тромба, например при оценке гепариновых покрытий.
|
1 - бедренная вена; 2 - яремная вена
Рисунок C.1 - Основные позиции при имплантации изделий, используемые в моделях НАВИ/АВИ
|
1 - НПВ-НПВ (где НПВ - нижняя полая вена); 2 - ВПВ-НПВ (где ВПВ - верхняя полая вена); 3 - НПВ-АА (где АА - абдоминальная аорта)
Рисунок C.2 - Другие, менее часто используемые позиции при имплантации изделий, в моделях НАВИ/АВИ
ВНИМАНИЕ - Имплантация в указанные позиции требует внимательного рассмотрения артефактов, обусловленных возможным взаимодействием имплантированных изделий и/или неопределенности места формирования тромба.
Таблица C.1 - Схема А подсчета НАВИ/АВИ
Описание оценки формирования тромба | Оценка |
Отсутствие значительного тромбоза (очень маленький сгусток приемлем при введении) | 0 |
Минимальный тромбоз, одно местоположение | 1 |
Минимальный тромбоз, множественные местоположения | 2 |
Значительный тромбоз, от | 3 |
Значительный тромбоз, более | 4 |
Просвет сосуда полностью закрыт | 5 |
Таблица C.2 - Схема В подсчета НАВИ/АВИ
Описание оценки формирования тромба | Оценка |
Тромб отсутствует или минимален и, при наличии, может быть связан с местом венотомии имплантата | 0 |
Тромб минимальный, при наблюдении покрывает от 1% до 25% поверхности материала | 1 |
Тромб умеренный, при наблюдении покрывает от 26% до 50% поверхности материала | 2 |
Тромб серьезный, при наблюдении покрывает от 51% до 75% поверхности материала | 3 |
Тромб обширный, при наблюдении покрывает от 76% до 100% поверхности материала | 4 |
Таблица C.3 - Недостатки ("подводные камни") при использовании моделей НАВИ или АВИ
Фак- | Описание | Предостережения |
1 | Позиция имплантата | Условия высокого потока ведут к низким уровням тромбообразования, связанного с поверхностью, и наоборот. Следовательно, небольшие различия в анатомических факторах, таких как намеченные диаметры сосудов и/или позиции венозных клапанов, могут иметь потенциальное влияние на количество наблюдаемого тромба. Дополнительно, если имплантат помещен под углом или в позиции, которая изменяет кровоток, создавая вихревые движения, ведущие к стазу крови, формирование тромба может произойти безотносительно свойств материала исследуемого изделия |
2 | Методика имплантации | Каждый объект исследования и контроль должны быть идентичны и точно введены в вены-мишени при расположении каждого в идентичной позиции (предпочтительно центральное расположение с отсутствием контакта со стенкой сосуда) |
3 | Степень контакта изделия со стенкой сосуда | Данный фактор относится к повреждению стенки сосуда/эндотелиальной денудации в течение периодов имплантации и инкубации. Сам имплантат может способствовать тромбозу в результате механического контакта со стенкой сосуда, который индуцирует повреждение и активацию тканевого фактора. В данном случае фактор материала может играть второстепенную роль в степени наблюдаемого тромба, а геометрия МИ может играть главную роль |
4 | Время/период инкубации | Главный измеряемый параметр протяженности поверхностно ассоциированного тромба имеет тенденцию быть интенсивным в течение первых |
5 | Методика эксплантирования | В зависимости от состава и протяженности поверхностно ассоциированного тромба на образце измеряемый/подсчитываемый материал тромба может быть хрупким и быстро отшелушиваемым в течение забора МИ/экспозиции. Без особой предосторожности этот материал, часто называемый "рукавным тромбом", может "отскребаться", если образец забран или задет в месте имплантации. Некоторые исследователи используют фиксацию перфузии in situ, чтобы смыть неприлегающие элементы крови и одновременно перекрестно связать МИ/тромб/сосуд в более сильную (и более физиологическую) геометрию |
6 | Материал/поверхность материала | Данная модель применялась для оценки тромбогенного потенциала новых материалов, оценки изменений процесса на существующих зарегистрированных материалах и для квалификации новых поставщиков. Часто легально продающееся изделие сравнения (LMCD) или материал используются в качестве контроля, который предоставляет равно вариативные результаты |
7 | Нетромбоадгезивные материалы | Работа специалистов в данной области [177]-[179] продемонстрировала, что гидрофильные поверхности могут быть тромбогенными (и тромбоэмболическими), но не тромбоадгезивными. Этот тест дает проходные баллы МИ и материалам, которые являются тромбогенными и тромбоадгезивными |
8 | Тромботический потенциал реципиента/ | Результаты работы в данной области [56], [57], [180] выявили, что реципиенты (лабораторные животные) могут иметь существенно разные "тромботические потенциалы", т.е. различную способность к формированию тромба при воздействии медицинских имплантатов и других факторов. Это может привести к значительным отличиям в подсчетах тромботического потенциала между разными испытуемыми |
9 | Статистическая достоверность | В соответствии с ISO 10993-2 в сочетании с вариативностью ответов, наблюдаемых между изделиями и материалами-аналогами и между объектами исследования (лабораторными животными), получение статистически значимого заключения часто является невозможным |
10 | Опыт испытателя | Подготовка и навыки испытателя, оценивающего по балльной системе процесс формирования тромба, являются чрезвычайно важными. Некоторые могут затрудняться в отличии настоящего тромба in vivo от ложного тромба [по/досмертных (агональных) формирований сгустков] |
11 | Влияние антикоагулянтной схемы | Почти все МИ и материалы, исследуемые в модели АВИ, получают нулевой балл и проходят испытание. Это ставит под вопрос цель и обоснование использования модели АВИ. В модели НАВИ большинство гидрофобных материалов демонстрируют различные степени тромбообразования, а гидрофильные материалы демонстрируют незначительные уровни тромбоза |
12 | Размер имплантата к диаметру сосуда | Кроме потенциального повреждения стенки сосуда, если размер имплантата слишком велик относительно диаметра сосуда, он может повлиять на кровоток (стагнация), предрасполагая к тромбозу. Поперечная область имплантата должна занимать не более 50% просвета сосуда |
Таблица C.4 - Преимущества использования моделей НАВИ или АВИ
Фак- | Описание | Предостережения |
1 | Изучение формирования тромба | Модель НАВИ, как известно, последовательно демонстрирует значительное формирование тромбов in vivo на гидрофобных полимерах, особенно после 1 ч или менее воздействия. В таком виде модель НАВИ подходит для исследования формирования тромба. Например, она может быть полезным инструментом для исследования влияния тромба на функциональные свойства изделий, такие как внутрисосудистые сенсоры [143] |
2 | Оценка покрытий, предназначенных для снижения тромбогенности | Покрытия, нанесенные на поверхности изделия для снижения его тромбогенности, должны продемонстрировать измеряемые различные и последовательные ответы, т.е. ниже, чем неизмененные контроли, при тестировании на модели НАВИ. |
3 | Оценка покрытий, предназначенных для увеличения тромбогенности | Покрытия, нанесенные на поверхности МИ для увеличения тромбогенности, должны продемонстрировать измеряемые различные и последовательные ответы, т.е. выше, чем немодифицированные контроли, при исследовании на модели НАВИ или АВИ. |
4 | Скрининг материалов для сердечно-сосудистого применения | Модели НАВИ и АВИ являются наиболее подходящими для испытаний МИ катетерного типа, предназначенных для введения в сосудистую систему на короткие периоды времени. Множество материалов и конструкций изделий допускается исследовать в этой модели с использованием контралатерального кровеносного сосуда для оценки контроля или немодифицированной версии исследуемых изделий |
Приложение D
(справочное)
Гематология/гемолиз. Методы исследования. Оценка гемолитических свойств медицинских изделий и материалов для медицинских изделий
D.1 Общие положения
Настоящее приложение содержит обзор известных методов исследования гемолиза с последующим обсуждением вопросов, относящихся к возможности этих методов охарактеризовать гемосовместимость медицинских материалов/МИ. Гемолиз является временной функцией воздействия материала на кровь и крови на свойства материала, как поверхностная энергия, морфология поверхности и химия поверхности. Гемолиз является функцией местных механических сил и биохимических факторов.
D.2 Причины гемолиза
D.2.1 Осмотическое давление (гемолиз, индуцированный осмотическим давлением)
Мембрана эритроцита является полупроницаемой мембраной. Перепад давления возникает, когда такая мембрана разделяет два раствора с различными концентрациями. Осмотическое давление происходит, когда мембрана непроницаема для пассивного движения раствора, но позволяет проход чистого растворителя, такого как вода. Такой перепад давления может вызвать разбухание эритроцитов и разрыв клеточной мембраны с выделением свободного гемоглобина [175]. Осмотическая резистентность может варьироваться среди эритроцитов млекопитающих [95]-[98].
D.2.2 Механические факторы (гемолиз, индуцированный механическим воздействием)
Динамические факторы жидкой среды: скорость кровотока, турбулентность и нефизиологические силы сдвига - могут деформировать мембрану эритроцита и потенциально вызвать разрыв мембраны. Последнее может быть потенциально усугублено изделиями с механическим управлением и/или сложными путями потока. Примерами МИ являются:
- системы афереза и сепарации клеток;
- фильтры артериальной крови [11], [36];
- насосы вспомогательного кровообращения [29], [30], [124], [157];
- системы искусственного кровообращения [5], [10], [11], [13], [37], [41];
- системы кардиотомии/венозного резервуара [10], [11];
- устройства поддержания кровообращения [9];
- системы гемодиализа [16], [28], [41];
- механические клапаны сердца [2];
- искусственные желудочки сердца [236], [237].
D.2.3 Биохимические факторы (гемолиз, индуцированный материалом)
Изменения структуры мембраны на молекулярном уровне могут повлиять на прочность и эластические свойства мембраны эритроцита. Недостаток питательных веществ или метаболической энергии (АТФ) может привести к потере дискообразной формы и микровезикуляции гемоглобина. Другие агенты, например экстрагируемые из МИ, бактериальные токсины, pH и изменения в метаболизме, индуцированные температурой, способны также повредить мембрану эритроцита [95]. Эти изменения могут вызвать разрыв мембраны при осмотических давлениях ниже критического значения. Целесообразно провести предварительное исследование для определения критического значения давления, при котором мембрана эритроцита разрывается (осмотическая резистентность).
D.3 Клиническая значимость гемолиза
D.3.1 Токсические эффекты
Повышенные уровни свободного гемоглобина могут спровоцировать токсические эффекты или инициировать процессы, которые способны вызвать нагрузку на почки или другие органы [175]. Концентрация свободного гемоглобина является информативным параметром, характеризующим степень повреждения эритроцитов, а также косвенным индикатором повреждения мембраны других элементов крови.
D.3.2 Тромбоз и анемия
Внутрисосудистый гемолиз способствует тромбозу из-за каскада событий, включающих высвобождения АДФ из эритроцитов и фосфолипидов [106], с последующей активацией тромбоцитов и дегрануляции протромботических агентов. Когда гемолиз вызывает клинически значимое снижение количества эритроцитов, это может привести к анемии и нарушению способности переноса кислорода с последующим отрицательным действием на мозг и другие органы или ткани.
D.4 Оценка достоверности результатов гемолитического исследования
Величина гемолиза зависит от времени контакта материала с кровью и от свойств самого материала, таких как энергия, морфология и химический состав поверхности. Гемолиз также может быть обусловлен функцией напряжения сдвига кровотока, взаимодействием с мембраной клетки, характером слоев адсорбированных белков, стабильностью потока, наличием пузырьков воздуха и варьируемыми характеристиками самой крови (источник, возраст донора и биохимический состав) [108], [112], [113]. Эти переменные следует адекватно контролировать для сравнения гемолитической активности материалов и МИ. Спектр методов оценки гемолиза варьирует от упрощенных до очень сложных моделей. Известен ряд моделей in vitro и in vivo для проведения теста в потоке крови. Значения гемолитической активности являются параметрами сравнения относительно материалов или МИ, исследуемых на той же модели в конкретной лаборатории, а не абсолютными величинами. Методы исследования in vitro способны количественно выразить малые концентрации гемоглобина плазмы, который может быть неизмерим в условиях in vivo (например, из-за связывания гемоглобина плазмы с гаптоглобином и быстрого удаления из организма). Допустимы методы определения концентрации лактатдегидрогеназы и гаптоглобина как индикаторов гемолиза в условиях исследования in vivo.
Невозможно определить универсальный уровень для приемлемых и неприемлемых значений гемолиза для всех МИ и возможных их применений. Гемолитическая активность МИ может быть в начальный период замаскирована травмой от хирургической процедуры. МИ может вызвать значительный гемолиз, но может являться единственным возможным способом лечения в ситуации с угрозой для жизни. Следует учитывать, что гемосовместимый материал не является гемолитическим. На практике многие МИ могут вызвать гемолиз, но их преимущество при клиническом использовании перевешивает риск, связанный с этим отрицательным воздействием на кровь. Следовательно, если МИ вызывает гемолиз, следует подтвердить, что МИ предоставляет клиническое преимущество и что гемолиз находится в клинически допустимых пределах. Критерий допустимости основан на какой-либо форме оценки риска и выгоды. Следующие вопросы являются предложениями для разработки такой оценки:
- Какова длительность воздействия МИ на пациента?
- Какой уровень гемолиза вызывает материал или МИ? Продолжается гемолиз весь период времени воздействия МИ на пациента? Продолжается гемолиз после удаления МИ?
- Каковы относительные риски и преимущества других существующих методов лечения?
- Каковы гемолитические свойства этих известных методов лечения? Как данное МИ сопоставляется с этими другими методами?
- Насколько эффективно исследуемое МИ по сравнению с другими формами лечения? Более эффективное МИ может вызвать значительный гемолиз во время использования, но эффективность применения МИ приносит большую пользу для пациента, чем другие способы лечения.
D.5 Исследование гемолиза. Общие положения
D.5.1 Методы
D.5.1.1 Общие положения
Гемолиз эритроцитов исследуют in vitro. Прямыми методами определяют гемолиз путем физических и химических взаимодействий исследуемого материала с эритроцитами. Непрямыми методами определяют гемолиз посредством веществ, экстрагируемых из исследуемых объектов. [17] является стандартом непосредственно по исследованиям гемолитических свойств материалов (в основном обусловленных химическими факторами), зависящих от размера изделия и его сложности. Настоящий стандарт не применим для исследования гемолитической активности целых, неповрежденных МИ. В [17], [22] и [28] приведены примеры методологий, конкретно разработанных для исследования гемолиза МИ и составляющих их материалов. Разработан стандарт [20] для оценки гемолиза, вызванного наночастицами медицинского назначения. В своей простейшей форме, при контакте сильно разбавленных суспензий эритроцитов с исследуемыми материалами, значения гемолиза, как правило, вычисляют как процентное содержание гемоглобина, который был высвобожден в супернатант относительно общего количества гемоглобина в данной суспензии клеток, т.е. значение концентрации свободного гемоглобина/концентрации общего гемоглобина, умноженное на 100%. Если все эритроциты суспензии разрушены, то наблюдается 100%-ный гемолиз.
В дополнение к исследованию материалов, входящих в состав изделий, необходимо провести испытания целых МИ для оценки влияния на гемолиз структуры изделия, физико-механических взаимодействий крови с материалами, с учетом диапазона условий клинического применения изделий (например, скорость кровотока, обороты в минуту, давление, время функционирования), назначения изделий и гемодинамических факторов. Гемолитическая активность многих изделий, вызванная гемодинамическими силами и взаимодействием с поверхностями в условиях потока, превышает значения гемолиза, вызванного химическими свойствами материалов. Для адекватной имитации условий клинического применения при исследовании гемолитического потенциала изделий в условиях потока следует учитывать гематокрит крови и другие факторы [30], [37], [41], [124]. Для определения наиболее возможного максимального значения гемолиза для данного изделия испытания in vitro, как правило, проводят при самой высокой скорости кровотока, для которой, как ожидается, будет использовано тестируемое изделие. Ссылки на документы, в которых представлены протоколы при исследовании гемолиза, индуцированного механическими воздействиями, включают ссылки на [5], [37], [41] и [124].
Концентрация гемоглобина в плазме значительно ниже, чем общая концентрация гемоглобина в крови. Концентрация свободного гемоглобина in vivo, как правило, составляет от 0 до 10 мг/дл, в то время как нормальный диапазон общей концентрации гемоглобина в крови составляет от 11000 до 18000 мг/дл. По этой причине применялись различные методы для измерения широкого диапазона концентраций гемоглобина, которые могут встречаться в течение исследования гемолиза.
ВНИМАНИЕ - Некоторые используемые методы оценки гемолитического действия изделий предлагают допустимый уровень гемолиза, индуцированного материалом, ниже которого риск не существует или низок, основываясь на исторически принятых и не валидированных показателях [14], [17], [28]. Тем не менее более высокие приемлемые уровни гемолиза, индуцированного материалом, могут быть обоснованы исходя из соответствующего анализа риск/польза.
Исследователи должны отдавать себе отчет в том, что на гемолиз могут негативно влиять химические вещества в медицинских материалах или растворах, которые могут изменять осмотическую резистентность эритроцитов (например, отдельные буферы и стабилизаторы, такие как формальдегид или глутаральдегид), вызывать преципитацию гемоглобина (например, ионы меди или цинка) или изменять спектр абсорбции гемоглобина (например, полиэтиленгликоль или этанол) [115], [170].
D.5.1.2 Измерения общей концентрации гемоглобина в крови
Аналитические методы, приведенные в D.5.1.2.1 и D.5.1.2.2, классически применялись для определения общих концентраций гемоглобина (Hb) в крови [106]. Общая концентрация гемоглобина в крови также может быть измерена калиброванными счетчиками клеток крови и гемоглобинометров.
D.5.1.2.1 Гемоглобинцианидный метод
Первый классический метод - цианметагемоглобиновый анализ был опубликован Международным комитетом по стандартизации в гематологии [121]. Цианметагемоглобиновый (гемоглобинцианид; HiCN) анализ достаточно удобен, прост для автоматизации и имеет внутренний стандарт сравнения (HiCN). Метод основан на окислении гемоглобина с последующим формированием гемоглобинцианида, который имеет широкий максимум поглощения при 540 нм. Применяют лизирующие агенты, такие как детергенты, которые, в дополнение к высвобождению гемоглобина из эритроцита, снижают мутность (источник помехи как ложная поглощаемость при 540 нм) от преципитации белка. Для общей концентрации гемоглобина спектральные помехи из-за плазмы минимальны и поглощаемость образца может быть напрямую сравнена со стандартным раствором HiCN.
Широкая полоса поглощения (абсорбции) HiCN в этой области позволяет использовать простые фотометры с набором фильтров, а также узкополосные спектрофотометры для ручного или автоматического обнаружения. Применение сравнительного стандарта HiCN предоставляет возможность сопоставлять результаты, полученные разными лабораториями, использующими этот метод. Главным недостатком является потенциальный риск для здоровья при использовании растворов цианида, так как цианореагенты при закислении выделяют HCN. Утилизация реагентов и отходов также связана со значительными трудностями и затратами.
D.5.1.2.2 Определение гемоглобина по концентрации железа
Второй классический метод определения общей концентрации гемоглобина основан на определении концентрации железа гемоглобина в растворе. Железо сначала отделяют от гемоглобина, как правило, кислотой или сжиганием пробы. Затем его титруют с ![]() или соединяют с реагентом для окрашивания, интенсивность которого может быть измерена фотометрическим методом. Данный способ слишком сложен для обычной работы и редко применим.
или соединяют с реагентом для окрашивания, интенсивность которого может быть измерена фотометрическим методом. Данный способ слишком сложен для обычной работы и редко применим.
D.5.1.3 Измерения концентраций гемоглобина в плазме или в супернатанте
Следующие два метода использовались для измерения концентраций гемоглобина в плазме или в супернатанте.
D.5.1.3.1 Прямые оптические и дополнительные химические методы
Из-за многих различных факторов (например, традиция, простота применения и утилизация химических отходов, наличие стандартных растворов) существует множество различных способов для измерения гемоглобина в плазме в качестве индикатора гемолиза, притом что ни один метод широко не применяют. Методы подразделяют на две категории:
- прямые оптические методы, т.е. основанные на измерении пика поглощения оксигемоглобина при 415, 541 или 577 нм напрямую (на фотоколориметре) или по спектрам поглощения в видимой области на спектрофотометре;
- дополнительные химические методы, т.е. измерение концентрации гемоглобина, основанное на химической реакции с реагентами, такими как бензидин-подобные хромогены и перекись водорода, или формировании цианмета гемоглобина [109]. Все эти исследования могут быть выполнены вручную или автоматически.
Популярный метод определения концентрации гемоглобина основан на его каталитическом эффекте окисления производного бензидина, такого как тетраметилбензидин, перекисью водорода. Скорость формирования окрашенного продукта (обнаруживаемого фотометрически при 600 нм) прямо пропорциональна концентрации гемоглобина. Преимуществами этого метода являются простота автоматизации (коммерческое оборудование), исключение потенциально токсичных и экологически опасных цианореагентов и наличие наборов стандартов гемоглобина, калиброванных против основных сравнительных стандартов HiCN. Пределы обнаружения пробы (такие низкие, как 5,0 мг/дл) сопоставимы с гемоглобинцианидным методом [106]. Основными недостатками являются потенциальный риск для здоровья при использовании бензидиновых красителей и расходы, связанные с утилизацией реагентов и отходов. Сообщаемый динамический диапазон этого метода низок (от 5 до 50 мг/дл) [116], и возможное ингибирование реакции (до 40%) [117] может произойти из-за хелатирующих кальций антикоагулянтов, например цитратов, оксалатов, ЭДТК [116], альбумина [104] или других неспецифических компонентов плазмы [106], которые могут препятствовать окислению ![]() .
.
В связи с этим дополнительным химическим методом допускается заменять прямые оптические методы, приведенные в [102], [105] или [118], с сопоставимой чувствительностью и воспроизводимостью. Следует учитывать, что невозможно исключить химически индуцированные изменения гемоглобина и его спектров, которые могут сделать некоторые гемоглобиновые пробы недействительными. Следует сделать поправки, компенсирующие фоновые помехи эндогенной плазмы, так как они также могут изменить спектры гемоглобина [109]. Исследователь должен учитывать эти ограничения определения гемоглобина в плазме и удостовериться, что он использует достоверную методику [104], [109], [115], [170]. Это включает оценку исследуемого супернатанта на наличие преципитата и сравнение его оптических спектров (например, от 400 до 700 нм) со спектрами изолированного оксигемоглобина.
D.5.1.3.2 Иммунонефелометрический метод
Иммунонефелометрический метод основан на определении гемоглобина плазмы посредством нефелометрии с применением коммерчески доступного антитела. Метод пригоден для обычной работы. Существует хорошая корреляция и сопоставимость с оптическими методами [107].
D.5.2 Консервация крови и компонентов крови
В настоящем подразделе приведены сведения о лучших методах сохранения компонентов крови человека, продемонстрированных Американской Ассоциацией Банков Крови [99] и Советом Европы [101]. Материалы и МИ следует исследовать, используя кровь, биохимическое состояние которой имитирует условия, при которых МИ будет функционировать в клинической практике, например надлежащий выбор антикоагулянта, минимальное использование консервантов крови и соответствующий pH крови [151]-[156].
Для применения при заборе крови были разработаны растворы антикоагулянтов, которые предотвращают свертывание крови и обеспечивают сохранность эритроцитов в течение определенного временного интервала. Все эти растворы содержат цитрат натрия, лимонную кислоту и глюкозу; дополнительно некоторые содержат аденин, гуанозин, маннитол, сахарозу, сорбитол и/или фосфат, также см. [151]-[156]. Хотя гепарин не применяют для консервации крови, его часто используют в клинике в качестве антикоагулянта при хирургических вмешательствах.
Свертывание крови предотвращают связыванием цитратом кальция. Эритроциты метаболизируют глюкозу во время хранения. Две молекулы аденозинтрифосфата (АТФ) вырабатываются фосфорилированием аденозиндифосфата (АДФ) на каждую молекулу глюкозы, метаболизированную путем цикла анаэробного гликолиза Эмбдена-Мейергофа-Парнаса. Молекулы АТФ поддерживают энергетические потребности эритроцитов для поддержания упругости мембраны и определенных функций мембранного переноса. При конверсии АТФ в АДФ выделяется энергия, необходимая для поддержания этих функций. Для увеличения времени консервации крови следует снизить щелочность среды добавлением лимонной кислоты к раствору антикоагулянта. Это обеспечивает необходимую высокую концентрацию ионов водорода для консервации эритроцитов при 4°С. Увеличение кислотности в течение консервации снижает скорость гликолиза. Концентрация аденозиновых нуклеотидов (АТФ, АДФ, АМФ) падает со временем консервации, но добавление аденозина к раствору антикоагулянта позволяет синтезировать замену АМФ, АДФ и АТФ.
При приготовлении концентратов эритроцитов значительная порция глюкозы и аденина удаляется с плазмой. Достаточная жизнеспособность эритроцитов после удаления плазмы может поддерживаться только для не сильно концентрированных суспензий клеток. Нормальные цитрат-фосфат-декстроза (ЦФД)-аденин концентраты эритроцитов не должны иметь объемное содержание эритроцитов более 0,80. Даже если удалено более 90% плазмы, жизнеспособность эритроцитов может поддерживаться введением ряда добавок или суспензионной среды. Хлорид натрия, аденин и глюкоза необходимы для жизнеспособности, в то время как маннитол или сахароза могут быть применены для дальнейшей стабилизации клеточной мембраны и предотвращения гемолиза [99].
Пригодность контейнеров для хранения продуктов крови оценивают различными методами, которые измеряют качество продукта крови [103], [106]. Контейнер с эритроцитарной массой, содержащей соответствующий антикоагулянт, хранят в вертикальном виде при температуре от 1°С до 6°С при статических условиях. Через определенные интервалы измеряют количество свободного гемоглобина плазмы для оценки жизнеспособности и качества сохраняемого продукта. Качество сохраняемого продукта может быть улучшено осторожным перемешиванием раз в неделю. Сохранность продукта в контейнере косвенно свидетельствует о проницаемости контейнера для выделяющегося в результате метаболизма эритроцитов двуокиси углерода при отсутствии других мешающих факторов.
D.5.3 Защита персонала при работе с кровью
Должны быть утверждены соответствующие инструкции, регламентирующие работу и защиту персонала, получающего, обрабатывающего и работающего с потенциально зараженной кровью человека. Потенциально зараженные материалы включают кровь и другие физиологические жидкости, продукты, оборудование, бывшее или имеющее контакт с кровью или другими физиологическими жидкостями и материалами, используемыми при культивировании организмов, вызывающих инфекции, переносимые с кровью [114].
D.5.4 Забор крови из вены пациента (флеботомия)
Невозможно гарантировать 100%-ную стерильность поверхности кожи при флеботомии, поэтому необходима стандартизованная процедура подготовки области прокола вены. Следует дать антисептическому раствору высохнуть на поверхности кожи до венопункции и убедиться, что никакого дальнейшего контакта не произошло с поверхностью кожи до введения флеботомической иглы [99].
Система закрытых контейнеров (т.е. не содержащая комнатного воздуха) предпочтительна для забора крови во избежание микробной контаминации. Проколы иглы в резиновой пробке флакона с образцом должны быть полностью закрыты после удаления иглы, иначе частичный вакуум, созданный после охлаждения крови, может втянуть загрязненный воздух [99].
Примечание - Использование вакуумной пробирки может потенциально вызвать легкий гемолиз [125]-[127].
Кровь, собранная в открытой системе, может быть загрязнена воздействием комнатного воздуха и не считается стерильной. Микробная контаминация является известной причиной гемолиза.
D.5.5 Выбор вида
Исследование гемолиза следует проводить на эритроцитах человека. Несколько факторов могут затруднить этот выбор или сделать его невозможным. В некоторых странах запасы крови человека ограничены и должны сохраняться для трансфузий человеку. Следует учитывать критерии здоровой донорской крови человека и животных. Кровь имеет ограниченный "срок хранения", и может быть затруднено получить клетки крови человека в заданное время. Для эритроцитов животных следует учитывать разницу в стабильности мембран клеток разных видов, чтобы обеспечить 100%-ный гемолиз при получении общего количества гемоглобина, содержащегося в эритроцитах. Отрицательные контроли должны вызывать минимальный гемолиз, чтобы не маскировать активность тестируемого материала. Выявлено, что эритроциты кролика и человека имеют сходные гемолитические свойства, в то время как эритроциты обезьяны более чувствительны, а эритроциты морской свинки - менее чувствительны к внешним воздействиям [95]-[98], [123].
D.5.6 Оценка степени гемолиза при контакте изделия/материала с кровью или ее компонентами in vitro, ex vivo и in vivo
Величина гемолиза может быть оценена при контакте материалов или изделий с кровью методами in vitro, in vivo и ex vivo. Методы in vitro используют при исследовании материалов и изделий, методы ex vivo и in vivo - для оценки изделий, которые могут содержать более одного материала.
Возможны оценки in vivo и ex vivo в моделях на животных или при клинических исследованиях.
Необходимо обоснование для любого из следующих планов исследования. В первом случае исследуемое изделие сравнивают с коммерчески доступными изделиями с известными допустимыми уровнями гемолиза. Во втором случае объект исследования оценивают на предмет клинически значимых последствий гемолиза.
Целью испытаний in vivo или ex vivo является характеристика гемолитического потенциала МИ. Предварительные тесты in vitro допускается проводить с использованием свежей или просроченной крови человека или животных. Для МИ, предназначенных для применения ex vivo, общей практикой является рециркуляция крови через изделие в условиях, имитирующих клинические, но преднамеренно в более жестких условиях относительно условий его нормального функционирования (например, наивысшая скорость кровотока). Для некоторых МИ далее проводят модельные эксперименты ex vivo на животных или ограниченные контролируемые исследования на человеке. Дизайн этих исследований зависит от размера МИ и его функционального назначения.
D.5.7 Прямой контакт по сравнению с непрямыми методами
Необходимые условия экстракции установлены в ISO 10993-12. Некоторые методы требуют прямого контакта МИ с эритроцитами, в то время как другие описывают приготовление экстракта, который затем вносят в суспензию эритроцитов. Выбор испытания должен быть основан на самом изделии и условиях его применения. Если изделие применяют при повышенных температурах, то следует проводить экстракцию при условиях, установленных ISO 10993-12.
Приложение E
(справочное)
Система комплемента. Методы исследования
E.1 Исходные данные
Активацию системы комплемента связывают с наблюдаемыми в некоторых случаях в клинической практике отрицательными реакциями при экстракорпоральных методах лечения, особенно при гемодиализе [129]-[132] и искусственном кровообращении [133]-[136]. Как правило, при такой терапии применяют МИ с большими площадями поверхности контакта с кровью и относительно короткими периодами контакта. Активация комплемента, как правило, происходит на ранней стадии, вскоре после контакта крови с поверхностью МИ; до сих пор нет сообщений о ее активации на поздних сроках контакта. Выявлено, что активация системы комплемента при контакте крови с материалом/МИ обусловлена адсорбцией целого ряда белков плазмы, включая ключевые белковые компоненты системы комплемента C3 и C3b (C3b·Bb, C3b·C3b·Bb соответственно; см. рисунок B.2). Белок конвертазы C5 катализирует расщепление C5, приводящее к выработке C5a и C5b. Белок C5a является известным эффектором опосредованной рецепторами активации нейтрофилов и моноцитов, а фрагмент C5b - признанным начальным компонентом комплемента, участвующего в формировании мембраноатакующего комплекса (МАК) комплемента, который связывается с клетками крови, что приводит к их активации и/или лизису. Лейкоциты могут взаимодействовать с фрагментами C3 и C4 при их адсорбции на поверхности материала с последующей адгезией к поверхности и активацией клеток. Активация нейтрофилов и моноцитов, формирование и активность МАК, адгезия и активация лейкоцитов на поверхности материалов являются причиной архетипической патофизиологии, наблюдаемой при клиническом применении изделия с большой площадью поверхности [136]. В [138] приведена критическая роль фрагмента C5a как медиатора во многих из этих отрицательных реакций. Дозозависимые ответы, идентичные ответам при настоящем диализе, наблюдались в имитированном гемодиализе и инфузии очищенного C5a. Дальнейшие исследования в этой области показали, что материалы, поверхности которых являются сильно нуклеофильными (гидроксил- и аминсодержащими), имеют наибольшую способность к активации комплемента, а различные изменения поверхности, которые уменьшают ее электроноизбыточность/нуклеофильность, значительно нивелируют классические клинические проявления активации системы комплемента. Данный вывод поддерживается другими исследователями, изучающими взаимоотношение активации комплемента материалами для МИ и биологического ответа на чужеродную поверхность [136], [137].
Вывод о том, что гидроксил- и аминсодержащие группы на поверхности МИ при контакте с кровью приводят к активации системы комплемента, стимулировал разработку новых материалов, в которых этих химических групп не было или они были заблокированы. Подобное изменение химических свойств поверхности материалов существенно уменьшило активацию комплемента для МИ с большей площадью поверхности и кратковременным контактом. Такое внимание к активации комплемента МИ с большой площадью контакта с кровью послужило стимулом для разработки методов модифицирования для снижения активации системы комплемента для всех МИ, вне зависимости от их площади поверхности и длительности контакта с кровью. В настоящее время рабочая группа (the Working Group) не выявила каких-либо научных работ или клинических отчетов об отрицательных событиях, связанных с активацией системы комплемента МИ средней и малой площадью поверхности. Таким образом, в настоящее время отсутствуют соответствующие новые ссылки, которые связывают активацию комплемента и последующие отрицательные реакции пациента при контакте крови с МИ в зависимости от площади поверхности. Следует отметить, что при применении МИ наблюдаются классические анафилактические реакции. Причиной этих реакций скорее являются используемые препараты, чем МИ или материалы изделия [139]-[142]. Некоторые ложные выводы об активации системы комплемента с исследуемыми МИ могли возникнуть в результате таких отчетов [143].
Как и при оценке активации системы свертывания крови, процессов тромбообразования и активации тромбоцитов, существует несколько методов молекулярной биологии (например, ИФА) для мониторинга уровня активации пути комплемента в крови. Примеры белков комплемента, для которых существуют коммерчески доступные комплекты ИФА, включают, но не ограничиваются фрагментами C3a, C5a и SC5b9. Несмотря на сильную связь опосредованной комплементом патофизиологии с фрагментом C5a, классическое исследование комплемента сконцентрировалось на оценке фрагмента компонента C3a и комплекса SC5b9. Совокупно с этими возможностями существуют методы оценки связанных с активацией системы комплемента ответов, таких как адгезия лейкоцитов (используя РЭМ) и активация лейкоцитов (например, используя биопробы для оценки высвобождения эластазы из полиморфоядерных лейкоцитов (ПМЯ)).
E.2 Исследования активации комплемента и документация (рекомендуется при составлении отчета о результатах исследования комплемента в научных или нормативных целях)
Общие методы и документация, используемые при исследовании активации системы комплемента методом ИФА, приведены в B.4.
Как и другие биологические реакции, такие как активация белков свертывающей системы крови, активация компонентов системы комплемента, как правило, состоит из фазы инициации, развития и окончания [56], [57], [137]. Это отражает начальные реакции формирования конвертазы C3 и C5, амплификацию каскада обратной связи и период замедления/деактивации, когда критичные прекурсоры могут быть израсходованы или активированные белки могут потерять активность из-за короткого периода полураспада или деактивации посредством белков обратной связи отрицательного контроля. Так, ожидаются различия в уровнях белков комплемента в порядке их каскадной активации. Как следствие конкретная фаза каскадной активации системы комплемента во время непосредственного контакта материала/изделия с кровью является важным фактором. То есть влияние исследуемых материалов на активацию системы комплемента при инкубации с кровью может быть достаточно различным для каждой из фаз. Кроме того, так как активация комплемента в основном пропорциональна площади поверхности, контактирующей с кровью, площадь поверхности (ПП) изделия или материала изделия может сильно влиять на результаты измерений. По этой причине значение экспозиционной дозы - отношение ПП к объему крови (цельной, плазмы или сыворотки) должно быть приведено в каждом исследовании. Если допустимо, значение экспозиционной дозы может варьироваться для понимания специфичности эффекта материала. Значения экспозиционной дозы от 3,0 см до 6,0 см
/мл крови (основываясь на толщине изделия) соответствуют значениям, установленным в ISO 10993-12. Другие значения экспозиционной дозы, такие как больше данного отношения в 1,5 и 2,0 раза, допускается использовать, так как более высокие значения площади поверхности теоретически увеличат чувствительность ответа на исследуемый материал.
Примечание - Существует физическое ограничение на количество тестируемого материала, которое может быть испытано, что связано с объемом тест-системы, например пробирки и заданного значения экспозиционной дозы.
E.3 Методы исследования активации системы комплемента
Анализ существующих многочисленных методов для оценки активации системы комплемента в исследовательских лабораториях показал, что наибольшее распространение получило использование коммерческих тест-наборов. Тем не менее установлен ряд различий между лабораторными методами, которые перечислены ниже.
a) Кровь и антикоагулянты: кровь, используемая для инкубации с исследуемым материалом, значительно различалась между лабораториями. Например, использовали коммерчески доступную сыворотку человека, свежую и замороженную цитратную плазму человека, свежую сыворотку и свежую гепаринизированную цельную кровь человека. Влияние этих различных биологических сред на результаты активации комплемента не исследовано, за исключением применения ЭДТК/EDTA в качестве антикоагулянта. Хорошо известно, что активация комплемента классическим путем зависит от содержания кальция, а альтернативным путем - от магния. Таким образом, применение мощных хелаторов кальция/магния, таких как ЭДТК, свяжет свободный кальций и магний и отключит активацию комплемента, что сделает большинство измерений с использованием этих антикоагулянтов близкими к базовым уровням белков комплемента.
Учитывая вышесказанное, в настоящее время нет стандартов для крови или препаратов крови для применения в испытаниях на комплемент. Тем не менее при использовании сыворотки сыворотка должна быть функционально интактна и сохранять способность к активации комплемента. Если используют цельную кровь или плазму, следует тщательно выбирать такой тип антикоагулянта, который не ингибирует или не стимулирует активацию системы комплемента, индуцированную изделием.
b) Отношение площади поверхности исследуемого объекта к объему крови (цельная, плазма или сыворотка): в ряде лабораторий используют значение отношения площади к объему крови (цельной, плазмы или сыворотки), рекомендуемое ISO 10993-12 для экстракта. Некоторые лаборатории не уточняют это значение и/или применяют, в зависимости от вида материала/МИ, различные значения. Так как на активацию комплемента влияет площадь поверхности (ПП), то стандартизированные и записанные в отчете значения ПП важны для межлабораторных и внутреннего контролей результатов и их интерпретации.
c) Применение контролей: использование полимерных материалов в качестве отрицательного (таких, как полипропилен, полиэтилен) и положительного (например, латекс или ацетат целлюлозы) контролей, относительно правомочно. Использование жидких отрицательного (раствор солей) и положительного (компонент яда кобры) контролей не корректно. Использование отрицательного и положительного контролей, предоставляемых в коммерчески доступных комплектах, относительно правомочно.
d) Активация комплемента МИ, контактирующими с кровью, признана феноменом поверхности. В связи с этим исследование с экстрактом МИ не является допустимым. Исследование активации комплемента МИ/материалом всегда следует проводить методом прямого контакта с кровью или ее компонентами. Материал отрицательного контроля, такой как полиэтилен (ПЭ), должен быть включен в исследование вместе с материалом положительного контроля, таким как немодифицированная целлюлоза, например Cuprophan![]() (если доступен). Соответственно, применение жидкого отрицательного контроля, такого как раствор солей, не является подходящим отрицательным контролем для тестирования активации комплемента поверхностью МИ. С другой стороны, мощный жидкий активатор комплемента, такой как компонент яда кобры, может быть использован для демонстрации работы тест-системы при условиях данного эксперимента.
(если доступен). Соответственно, применение жидкого отрицательного контроля, такого как раствор солей, не является подходящим отрицательным контролем для тестирования активации комплемента поверхностью МИ. С другой стороны, мощный жидкий активатор комплемента, такой как компонент яда кобры, может быть использован для демонстрации работы тест-системы при условиях данного эксперимента.
________________
![]() Cuprophan является примером коммерчески доступного продукта. Эта информация приводится для удобства пользования настоящим стандартом и не является поддержкой ISO указанного продукта.
Cuprophan является примером коммерчески доступного продукта. Эта информация приводится для удобства пользования настоящим стандартом и не является поддержкой ISO указанного продукта.
e) Подготовка калибровочной кривой/разведения: лаборатории использовали различные разбавления стандарта для выработки стандартной кривой, которая охватывает большинство уровней исследуемых и контрольных образцов. Например, в зависимости от активности комплемента используют разбавления 1:100, 1:200, 1:1000 и 1:10000. Самым важным фактором является то, что все образцы в итоге находятся между низким и высоким показателями активности системы комплемента на калибровочной кривой.
f) Время инкубации для исследуемых объектов и контролей: время инкубации образцов материалов с кровью (плазмой, сывороткой) различалось между лабораториями и составляли 60, 90 или 30, 60 и 90 мин.
g) Время инкубации после добавления хромогенного субстрата: в отчетах приведены значения от 15 до 30 мин.
h) Оценка исследуемого образца: метод оценки, используемый в лабораториях (получен положительный или отрицательный результат), был различен. Большинство лабораторий проводили сравнительный статистический анализ результатов исследуемого образца с положительными и отрицательными контролями полимерных материалов и/или жидкими контролями. Некоторые лаборатории включали сравнение с историческими/существующими значениями с результатами для изделия-аналога и/или особую математическую формулу, включающую отрицательные и положительные контроли как часть конечной оценки.
Не существует установленного критерия приемлемого уровня активации комплемента изделием для принятия решения его клинического применения. Включение коммерческого изделия как образца сравнения при исследовании активации системы комплемента исследуемым изделием/материалом будет полезным для интерпретации полученных результатов. Результаты, полученные для коммерческих изделий, могут быть использованы для оценки клинической пригодности исследуемого МИ.
Если МИ сравнения не продается легально в данном регионе, в котором осуществляют регистрацию исследуемого изделия, то местные регулирующие органы могут затребовать проведение исследования этого МИ сравнения вместе с регистрируемым МИ.
Приложение F
(справочное)
Менее распространенные методы лабораторных исследований
F.1 Общие положения
Настоящее приложение и таблица F.1 описывают методы исследований, которые применяли в основном для оценки взаимодействия МИ/материала с кровью, но их широко не использовали для целей регистрации МИ. Методы исследований представлены в справочных целях с оговоркой, что они не могут быть стандартизированы или коррелированны с их клиническим применением. Так как стратегия доклинической оценки биологической безопасности МИ должна быть концентрирована на применении наиболее значимых и широко принятых методов тестирования (см. приложение B), рекомендуется проявлять осторожность при включении каких-либо методов из приложения F в регистрационные заявки. Методы лабораторных исследований, которые не рекомендуется применять, приведены в приложении G.
Таблица F.1 - Менее распространенные методы лабораторных исследований для оценки взаимодействия МИ с кровью
Категории исследований | |
Тромбоз | Снижение потока, гравиметрический анализ, перепад давления в изделии, анализ адсорбированного белка, методы визуализации |
Тромбоз in vitro | |
Активация системы свертывания крови | Генерация тромбина с использованием хромогенных субстратов, продукты деградации фибриногена и фибрина (ПДФ), D-димер |
Тромбоциты | Оценка количества адгезированных тромбоцитов, метод проточной цитометрии для исследования активации тромбоцитов, формирование микрочастиц тромбоцитов, гамма-визуализация тромбоцитов, меченных радиоизотопами, агрегация тромбоцитов |
Гематология | Проточная цитометрия, активации лейкоцитов, оценки адгезии клеток крови, комплексы тромбоцит-лейкоцит (PLC) |
Система комплемента | Концентрация компонентов Bb, C3bBb, C5a |
| |
F.2 Тромбоз
F.2.1 Снижение потока крови
Параметры потока (скорость или объем) измеряют после определенного интервала времени испытания изделия. Измерения допускается выполнять как во время проведения эксперимента, так и до и после его окончания. Обоснование и интерпретация результатов в соответствии с B.2.1.
F.2.2 Гравиметрический анализ (масса тромба)
Измерение проводят после удаления МИ с места имплантации. Обоснование и интерпретация результатов представлены в B.2.1. Разница между массой реимплантированного (после удаления) МИ и его массой до имплантации может отразить количество образовавшегося тромба. Следует учитывать, что не вся разница в массе может быть массой образовавшегося тромба.
F.2.3 Перепад давления в изделии
Перепад давления в МИ измеряют до и после исследования.
F.2.4 Анализ адсорбированного белка (метод связывания антител)
Адсорбция белка на исследуемые материалы или изделия, которая происходит сразу после контакта с кровью; например, первый слой или поверхностный слой при достижении равновесия считают потенциально влияющим на функционирование изделия и/или результат его клинического применения. После качественной микроскопической оценки образования фибрина и отложения тромбоцитов на поверхности материалов возможна количественная оценка адсорбированного белка путем измерения количества меченых антител, специфических к таким белкам, как фибриноген или рецепторы мембраны тромбоцита. После контакта с кровью материалы сначала отмывают физиологическим раствором для удаления слабо адсорбированных белков и компонентов крови. Затем поверхность материалов или экстракты с поверхностей инкубируют с мечеными антителами для качественного или количественного анализа. Дополнительно возможно измерение общего количества адсорбированного белка напрямую без использования антител [164], [181]-[183].
F.2.5 Методы визуализации. Ангиография, внутрисосудистый ультразвук, доплеровский ультразвук, КТ и МРТ
Возможен выбор среди этих методов для определения проходимости или степени сужения имплантата или кондуита и для обнаружения отложения тромба на изделиях во время их функционирования in vivo.
F.3 Свертывание крови
F.3.1 Оценка образования тромбина с использованием хромогенных субстратов
В присутствии фосфолипидов материалы, находящиеся в контакте с интактной системой свертывания крови, будут инициировать генерацию тромбина, который возможно измерить конверсией хромогенного субстрата [61]-[63].
F.3.2 Продукты деградации фибриногена и фибрина (ПДФ)
При нормальном физиологическом фибринолизе продуцируется ПДФ X, Y, C, D и E в концентрациях менее 2 мг/мл плазмы. Как правило, низкий уровень ПДФ поддерживается низкой скоростью реакции деградации и высокой скоростью выведения ПДФ из кровообращения. В результате повышенной активации плазминогена при патологической деградации фибрина и фибриногена образуется ПДФ от 2 до 40 мг/мл или более [64]. Исследование в основном полезно для оценки гемосовместимости имплантируемых МИ. Рекомендуется применять коммерчески доступные методы, такие как ИФА.
При дисфибриногенемии, афибриногенемии и гипофибриногенемии наблюдается увеличение значений ПВ, ЧТВ и ТВ [45].
F.3.3 D-димер
Повышенный уровень D-димера указывает на активацию механизма свертывания крови. D-димеры являются продуктами деградации плазмином перекрестно-связанного фибрина FXIII (коагуляция и фибринолиз). Рекомендуется применение ИФА и/или пробы РИА для количественного измерения данных белков [65], [66].
F.4 Тромбоциты
F.4.1 Оценка адгезии тромбоцитов
Адгезия клеток крови [167] является измерением гемосовместимости материала при рассмотрении в сочетании с дистальной эмболизацией или признаками активации одного или более гематологических факторов.
Разработаны различные методы для измерения адгезии клеток на поверхности, например К-баллы Куники [75]. Большинство из методов основаны на том, что определенная часть тромбоцитов удаляется из нормальной цельной крови в результате прохождения ее через колонку со стеклянными шариками при контролируемых условиях потока или давления.
Альтернативным методом является прямой подсчет адгезированных на поверхности тромбоцитов. После контакта с кровью или плазмой, обогащенной тромбоцитами, при стандартизированных условиях тестируемую поверхность отмывают от неадгезированных клеток, фиксируют и готовят для световой микроскопии или РЭМ. Подсчитывают количество адгезированных тромбоцитов на единицу площади с анализом их морфологии (например, количество распределения, степень формирования агрегата). В качестве альтернативы допускается использовать тромбоциты, заранее меченные 51Cr или 111In [70]-[73]. Выявлено, что альтернативный неизотопный метод, ЛДГ и методы кислой фосфатазы, которые оценивают активность ферментов в целом, после лизиса адгезированных тромбоцитов тоже являются ценными инструментами для исследования процессов адгезии тромбоцитов на поверхности [83], [84].
F.4.2 Анализ активации тромбоцитов методом проточной цитометрии
Применение ряда МИ может привести к активации тромбоцитов или появлению микрочастиц тромбоцитов [173]. Маркеры поверхностной активации тромбоцитов оценивали проточной цитометрией на экспрессию P-селектина (ГМП-140) или экспрессию активированного гликопротеина Ib и IIB/IIIa, используя моноклональные антитела. Различные эпитопы активированных тромбоцитов распознают методом проточной цитометрии, используя два антитела: одно специфичное к тромбоцитам (т.е. ГП Ib или ГП IIb/IIIa) и другое специфичное к активации тромбоцитов (P-селектин) [69].
F.4.3 Гамма-визуализация радиомеченых тромбоцитов
Сильное гамма-излучение 111In позволяет использовать его для визуализации тромбоцитов [46], [47], [50], [72]. Методом определяют распределение адгезированных тромбоцитов и их число на поверхности. Метод применяют для исследования МИ, присоединяемых извне, и имплантируемых МИ.
F.4.4 Агрегатометрия
Агрегация тромбоцитов [74] индуцируется добавлением агентов (например, АДФ, эпинефрин, коллаген и тромбин), вызывающих индуцированную агрегацию, к плазме, обогащенной тромбоцитами (ПОТ), при непрерывном ее перемешивании. По мере агрегации тромбоцитов и седиментации их агрегатов плазма постепенно становится прозрачнее. Оптическую систему (агрегометр тромбоцитов) применяют для обнаружения изменений в светопропускании, а записывающее устройство графически записывает изменение интенсивности проходящего света по сравнению с исходным значением. Замедленная или сниженная агрегация тромбоцитов может быть вызвана активацией тромбоцитов и высвобождением тромбоцитарных гранул, повышенным АДФ или некоторыми лекарствами (например, ацетилсалициловой кислотой или нестероидными противовоспалительными средствами). Интенсивность индуцированной агрегации тромбоцитов зависит от вида животных вплоть до ее отсутствия. Спонтанная агрегация тромбоцитов, проходящая без добавления агонистов, является абнормальным явлением, указывающим на активацию тромбоцитов. Агрегаты тромбоцитов могут быть обнаружены методом WU/HOAK [79].
F.5 Гематология
F.5.1 Состояние и морфология лейкоцитов
Степень активации лейкоцитов измеряют методом проточной цитометрии по увеличению маркеров лейкоцитов, таких как L-селектин и CD 11b, и по изменению количественного распределения в субпопуляциях лимфоцитов. Допускается оценивать активацию лейкоцитов по морфологическим изменениям, которым лейкоциты подвергаются при активации на поверхности МИ. Как правило, для этого применяют метод РЭМ [173].
F.5.2 Оценки адгезии клеток крови
Адгезия клеток крови [167] при комбинированном исследовании с процессами эмболизации дистальных органов или признаками активации одного или более гематологических факторов является одним из показателей гемосовместимости материала/изделия. С использованием такого метода [167] было установлено, что адгезия выделенных из крови периферических лимфоцитов собаки и полиморфоядерных лейкоцитов к стеклянным шарикам, покрытым поли(гидроксиэтилметакрилатом) (pHEMA), ниже, чем к шарикам, покрытым полистиролом и некоторыми другими полимерами.
F.5.3 Комплексы тромбоцит-лейкоцит (PLC)
Образование комплексов PLC может быть измерено методом проточной цитометрии, и их количество может служить индикатором активации лейкоцитов и тромбоцитов после контакта МИ и материалов [85].
F.6 Система комплемента
F.6.1 Оценка активации комплемента по фрагментам Bb, C3bBb и C5a
Из этих трех белков компонентов комплемента фрагмент C5a считают одним из наиболее критичных факторов комплемента при активации комплемента во время контакта изделия с кровью [145]. Тем не менее рутинный тест на наличие C5a не является необходимым, учитывая низкую чувствительность коммерчески доступных наборов ИФА для обнаружения данного белка in vitro.
Приложение G
(справочное)
Методы лабораторных исследований, не применяемые в доклинической оценке биологической безопасности медицинского изделия
G.1 Общие положения
Методы лабораторных исследований, сведения о которых приведены в таблице G.1 и в настоящем приложении, регулирующие органы не применяют или не признают применяемыми в доклинической оценке биологической безопасности МИ, контактирующего с кровью. Данные методы считают устаревшими или недостаточными/неприменимыми для доклинической оценки МИ.
Таблица G.1 - Методы лабораторных исследований, не применяемые в доклинической оценке биологической безопасности МИ
Категории исследований | |
Гемосовместимость in vitro | |
Свертывание крови | АЧТВ, ПВ и ТВ |
Тромбоциты | Время кровотечения, период жизни тромбоцитов (время выживания) |
Гематология | Подсчет ретикулоцитов |
Система комплемента | CH-50, конвертаза C3, конвертаза C5 |
G.2 Свертывание крови
G.2.1 Активированное частичное тромбопластиновое время, протромбиновое время и тромбиновое время
Данные методы применяют для определения нарушения в системе свертывания крови, связанного с абнормальными уровнями факторов свертывания крови у пациента.
Различные активирующие вещества для определения АЧТВ, ПВ и ТВ, например каолин или цеолит, доступны коммерчески. Тесты АЧТВ, ПВ не применяют при оценке in vitro тромбогенных свойств МИ, потому что активирующие вещества маскируют какую-либо активацию, вызванную МИ или его составляющими материалами.
В связи с этим активирующие агенты, как правило, не применяют при оценке гемосовместимости МИ и/или материалов.
G.3 Тромбоциты
G.3.1 Время кровотечения
Коммерческая доступность стерильного одноразового устройства, предназначенного для осуществления разреза кожи стандартной глубины и длины при стандартных условиях, значительно повысила воспроизводимость и достоверность результатов испытания по определению времени кровотечения [67]. Увеличение времени кровотечения указывает на снижение функций тромбоцитов или количество тромбоцитов; последнее может быть определено отдельно. Увеличение времени кровотечения в сочетании с нормальным количеством тромбоцитов наблюдалось при применении МИ, присоединяемых извне, с ограниченным временем функционирования (например, искусственное кровообращение) [158]. Для проведения испытания допускается использовать лабораторных животных. Возможно измерение времени кровотечения in vitro. Данный метод не используют для исследования гемосовместимых свойств МИ.
G.3.2 Время жизни тромбоцитов
Для определения времени жизни тромбоцитов их выделяют из крови пациента и метят 51Cr или 111In [46], [15], [72], [148]. Данные изотопы метят все тромбоциты, присутствующие в образце крови, независимо от их времени жизни, изотопы достаточно крепко связаны с тромбоцитами, поэтому они не захватываются другими клетками и не участвуют повторно во время тромбообразования. Изотоп 111In имеет преимущество как сильный гамма-источник, что позволяет метить меньшее число тромбоцитов и упрощает подсчет количества локальных отложений тромбоцитов с одновременным измерением времени жизни клеток. Укороченный период жизни тромбоцитов указывает на ускоренное их удаление из кровообращения посредством иммунных, тромботических или других процессов. Данное испытание не рекомендуется применять для доклинической оценки МИ, контактирующих с кровью.
G.4 Гематология
G.4.1 Количество ретикулоцитов
Увеличенное количество ретикулоцитов в пробе крови указывает на повышенное образование эритроцитов в костном мозге. Это может быть в ответ на снижение массы эритроцитов, вызванное хронической кровопотерей (кровотечением), гемолизом или другими механизмами [55], [77], [111]. Данный тест не применяют при оценке МИ и/или материалов, контактирующих с кровью.
G.5 Система комплемента
G.5.1 Оценка активации комплемента CH-50, конвертазы C3, конвертазы C5
Снижение значения CH-50 является индикатором общей активации системы комплемента. Повышенные уровни любого из компонентов системы комплемента указывают на активацию системы комплемента. Некоторые материалы активируют комплемент, а активированные компоненты комплемента, в свою очередь, активируют лейкоциты, что приводит к их агрегации и секвестрации в легких [129], [130], [132], [137].
Измерение in vitro продуктов расщепления компонентов системы комплемента имеет недостаток из-за видоспецифичности системы комплемента и высоких нормальных концентраций фрагментов компонентов. Классический метод CH-50 рекомендуется выполнять с использованием сыворотки человека, теленка, свиньи и кролика.
Другим функциональным методом измерения активации комплемента in vitro является генерация C3- или C5-конвертазы комплемента, определяемой по конверсии субстрата. Также существуют коммерчески доступные комплекты ИФА для ключевых компонентов комплемента.
Данные испытания, как правило, применяют для оценки активации системы комплемента при контакте МИ с кровью.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение международного стандарта | Степень | Обозначение и наименование межгосударственного стандарта |
ISO 10993-1 | IDT | ГОСТ ISO 10993-1-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования" |
ISO 10993-12 | IDT | ГОСТ ISO 10993-12-2015 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы" |
Примечание - В настоящем стандарте использовано следующее условное обозначение степени соответствия стандартов: | ||
Библиография
Международные стандарты | |
[1] | ISO 3826-3, Plastics collapsible containers for human blood and blood components - Part 3: Blood bag systems with integrated features (Контейнеры складные пластмассовые для человеческой крови и ее компонентов. Часть 3. Системы упаковки крови со встроенными элементами) |
[2] | ISO 5840 (all parts), Cardiovascular implants - Cardiac valve prostheses (Сердечно-сосудистые имплантаты. Протезы клапанов сердца) |
[3] | ISO 5841-3, Implants for surgery - Cardiac pacemakers - Part 3: Low-profile connectors (IS-1) for implantable pacemakers (Имплантаты для хирургии. Кардиостимуляторы. Часть 3. Низкопрофильные соединители [IS-1] для имплантируемых кардиостимуляторов) |
[4] | ISO 7198, Cardiovascular implants and extracorporeal systems - Vascular prostheses - Tubular vascular grafts and vascular patches (Имплантаты для сердечно-сосудистой системы. Сосудистые протезы. Трубчатые сосудистые графты и заплаты) |
[5] | ISO 7199, Cardiovascular implants and artificial organs - Blood-gas exchangers (oxygenators) (Сердечно-сосудистые имплантаты и искусственные органы. Системы газообмена с кровью (оксигенаторы)) |
[6] | ISO 10993 (all parts), Biological evaluation of medical devices (Изделия медицинские. Оценка биологического действия медицинских изделий) |
[7] | ISO 12891-1, Retrieval and analysis of surgical implants - Part 1: Retrieval and handling (Извлечение и анализ хирургических имплантатов. Часть 1. Извлечение и порядок обращения) |
[8] | ISO 14708-2, Implants for surgery - Active implantable medical devices - Part 2: Cardiac Pacemakers (Имплантаты для хирургии. Активные имплантируемые медицинские устройства. Часть 2. Электрокардиостимуляторы) |
[9] | ISO 14708-5, Implants for surgery - Active implantable medical devices - Part 5: Circulatory support devices (Имплантаты для хирургии. Активные имплантируемые медицинские устройства. Часть 5. Устройства, поддерживающие систему кровообращения) |
[10] | ISO 15674, Cardiovascular implants and artificial organs - Hard-shell cardiotomy/venous reservoir systems (with/without filter) and soft venous reservoir bags (Имплантаты сердечно-сосудистые и искусственные органы. Кардиотомические/венозные системы резервуаров (с/без фильтра) с твердой оболочкой и мягкие венозные резервуары) |
[11] | ISO 15675, Cardiovascular implants and artificial organs - Cardiopulmonary bypass systems - Arterial blood line filters (Имплантаты сердечно-сосудистые и искусственные органы. Системы искусственного кровообращения. Фильтры для линий артериальной крови) |
[12] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories (Общие требования к компетентности испытательных и калибровочных лабораторий) |
[13] | ISO 8637, Cardiovascular implants and extracorporeal systems - Haemodialysers, haemodiafilters, haemofilters and haemoconcentrators (Сердечно-сосудистые имплантаты и искусственные органы. Гемодиализаторы, гемодиафильтры, гемофильтры и гемоконцентраторы) |
Национальные стандарты | |
[14] | Guidelines for blood/materiall interactions. Report of the National Heart, Lung, and BloodInstitute Working Group, U.S. Department of Health and Human Services, Public Health Service, National Institutes of Health. NIH Publication No.85-2185, revised September 1985. Available from Biomaterials Program, Bioengineering Research Group, Division of Heart and Vascular Diseases, NHLBI, Two Rockledge Center, 6701 Rockledge Drive, Bethesda, MD 20892, USA |
[15] | Harker L.A., Ratner B.D., Didisheim P. eds. Cardiovascular Biomaterials and Biocompatibility. Supplement to Cardiovasc. Pathol.2 (3). Suppl, Jul-Sept 1993, pp.1S-224S |
[16] | ANSI/AAMI RD16. Hemodialyzers, hemodiafilters, and hemoconcentrators. In: International Organization for Standardization and Association for the Advancement of Medical Instrumentation, editor. Cardiovascular implants and artificial organs. American National Standards Institute; 2007. p.30 |
[17] | ASTM F756-13, Standard practice for assessment of hemolytic properties of materials |
[18] | ASTM F1984-99, Standard practice for testing whole blood complement activation in serum by solid materials |
[19] | ASTM F2065-00E1, Standard practice for testing for alternative pathway complement activation in serum by solid materials |
[20] | ASTM E2524-08(2013), Standard test method for analysis of hemolytic properties of nanoparticles |
[21] | GB/T 16175, Biological evaluation test methods for medical organic silicon materials |
[22] | MHLW Notification by Director, OMDE, Yakushokuki-hatsu 0301 No.20, March 1, 2012, Basic Principles of Biological Safety Evaluation Required for Application for Approval to Market Medical Devices |
[23] | ASTM 2382, Standard test method for assessment of intravascular medical device materials on partial thromboplastin time (PTT) |
[24] | ASTM F2888-13, Standard test method for platelet leukocyte count - An in-vitro measure for haemocompatibility assessment of cardiovascular materials |
[25] | Anticoagulant Sodium Citrate Solution U.S.P. In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay. U.S. Pharmacopeia; 2006d. p.168; PF 31(3), p.731 |
[26] | NIH. Public Health Service Policy on Humane Care and Use of Laboratory Animals; Health Research Extension Act of 1985: Public Law 89-544. In: Office of Extramural Research; OLAW, editor. Office of Laboratory Animal Welfare; 2002. (a/k/a OLAW, 2002) |
[27] | USDA. 9 CFR: Code of Federal Regulations: Chapter 1; Subchapter A - Animal Welfare. In: Animal Welfare Information Center U, editor. Government Printing Office; 2004 |
[28] | NIH. Evaluation of hemodialyzers and dialysis membranes. Report of a Study Group for the Artificial Kidney-Chronic Uremia Program NIAMDD-1977. Chapter two. In vitro characterization of hemodialyzers. Artif. Organs. 1977, 1 (2) pp.59-77 |
[29] | ASTM F1830-97, Standard practice for selection of blood for in vitro evaluation of blood pumps |
[30] | ASTM F1841-97, Standard practice for assessment of haemolysis in continuous flow blood pumps |
Руководящие документы Департамента по продуктам питания и лекарственным средствам (FDA) США | |
[31] | CDRH. Class II special controls guidance document for certain percutaneous transluminal coronary angioplasty (PTCA) catheters-Document No. 1605. In: Office of Device Evaluation (ODE); Division of Cardiovascular Devices; Interventional Cardiology Devices Branch, editor. DRAFT guidance for industry and FDA staff: FDA; 2008. p.34 |
[32] | CDRH. Class II special controls guidance document: indwelling blood gas analyzers - Document No.1126. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Anesthesiology and Respiratory Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2001. p.16 |
[33] | CDRH. Coronary drug-eluting stents: nonclinical and clinical studies. In: Center for Devices and Radiological Health (CDRH); Center for Drug Evaluation and Research (CDER); and Office of Combination Products (OCP), editor. DRAFT guidance for industry: FDA; 2008. p.89 |
[34] | CDRH. Coronary drug-eluting stents: nonclinical and clinical studies - Companion Document No.6255. In: Center for Devices and Radiological Health (CDRH); Center for Drug Evaluation and Research (CDER); and Office of Combination Products (OCP), editor. DRAFT guidance for industry: FDA; 2008. p.32 |
[35] | CDRH. Guidance for annuloplasty rings 510(k) submissions - Document No.1358. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2001. p.17 |
[36] | CDRH. Guidance for cardiopulmonary bypass arterial line blood filter 510(k) submissions - Document No.1622. In: Office of Device Evaluation (ODE); Division of Cardiovascular Respiratory and Neurology Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2000. p.8 |
[37] | CDRH. Guidance for cardiopulmonary bypass oxygenators 510(k) submissions - Document No.1361. In: Office of Device Evaluation (ODE); Division of Cardiovascular and Respiratory Devices; Circulatory Support and Prosthetic Devices Branch, editor. Final guidance for industry and FDA staff: FDA; 2000. p.23 |
[38] | G95-1. 1997 Blue Book Memorandum: Use of International Standard ISO-10993, "Biological Evaluation of Medical Devices Part 1: Evaluation and Testing" (Replaces #G87-1 #8294). FDA <http://www.fda.gov/MedicalDevices/DeviceRegulationandGuidance/GuidanceDocuments/ucm080735.htm>. Accessed 04/15/ 2010 |
[39] | Tripartite Subcommittee for Medical Devices. Tripartite Biocompatibility Guidance for Medical Devices. In: Office of Device Evaluation (ODE) in FDA's Center for Devices and Radiological Health (CDRH), editor. General Program Memorandum #G87-1. FDA; 1986 |
[40] | FDA. 21 CFR 58(b) (3): Good Laboratory Practices (GLP) for Non-Clinical Laboratory Studies, In: Department of Health and Human Services, editor. Volume 1, Code of Federal Regulations. FDA; 2004 |
[41] | Implanted Blood Access Devices for Hemodialysis - Draft Guidance for Industry and Food and Drug Administration Staff. January 21, 2016, available at http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-meddev-gen/documents/document/ucm308598.pdf |
Тромбоз | |
[42] | Bosch T., Schmidt B., Blumenstein M., Gurland H.J. Thrombogenicity markers in clinical and ex vivo assessment of membrane biocompatibility. Contrib. Nephrol. 1987, 59 pp.90-98 |
[43] | CHANDLER A.B. In vitrothrombotic coagulation of the blood; a method for producing a thrombus. Lab. Invest. 1958, 7 (2) pp.110-114 |
[44] | Cooper S.L., Fabrizius D.J., Grasel T.G. Methods of assessment of thrombosis ex vivo. Ann. N.Y Acad. Sci. 1987, 516 pp.572-585 |
[45] | Corriveau D.M., & Fritsma G.A. Hemostasis and thrombosis in the clinical laboratory. Lippincott, Philadelphia, 1988 |
[46] | Dewanjee M.K. Methods of assessment of Thrombosis in vivo. In: Blood in contact with natural and artificial surfaces: Annals of the New York Academy of Sciences, (Leonard E.F., Turitto V.T., Vroman L. eds.). New York Academy of Sciences, New York, N.Y., 1987, pp.541-71 |
[47] | Dewanjee M.K., Kapadvanjwala M., Sanchez A., Elson R., Serafini A.N., Zilleruelo G.E. Quantitation of comparative thrombogenicity of dog, pig, and human platelets in a hemodialyzer. ASAIO J. 1992, 38 (2) pp.88-90 |
[48] | Didisheim P, Olsen D.B., Farrar D.J., Portner P.M., Griffith B.P, Pennington D.G. Infections and thromboembolism with implantable cardiovascular devices. ASAIO Trans. 1989, 35 (1) pp.54-70 |
[49] | Grotemeyer K.H., Viand R., Beykirch K. [Thrombocyte function in vasomotor and migraine headaches]. Dtsch. Med. Wochenschr. 1983, 108 (20) pp.775-778 |
[50] | Harker L.A., Kelly A.B., Hanson S.R. Experimental arterial thrombosis in nonhuman primates. Circulation. 1991, 83 (6,) pp.IV41-IV55 |
[51] | Hoch J.R., & Silver D. Hemostasis and Thrombosis. In: Moore WS, editor. Vascular Surgery: A Comprehensive Review. 3rd ed. Philadelphia: W.B.Saunders; 1991. pp.63-79 |
[52] | Kay L. Essentials of Haemostasis and Thrombosis. Churchill Livingstone, Edinburgh, 1988 |
[53] | Lewis J., Sweeney J., Baldini L., Friedland G.H., Salzman E.W. Assessment of thromboresistance of intravenous cannulae by 125I-fibrinogen scanning. J.Biomed. Mater. Res. 1985, 19 (2) pp.99-113 |
[54] | Zingg W., Ip W.F., Sefton M.V., Mancer K. A chronic arteriovenous shunt for the testing ofbiomaterials and devices in dogs. Life Support Syst. 1986, 4 (3) pp.221-229 |
Система свертывания крови | |
[55] | Henry J.B. Haematology and Coagulation. In: Clinical Diagnosis and Management By Laboratory Methods. (Henry J.B. ed.). W.B.Saunders, Philadelphia, Eighteenth Edition, 1991, pp.556-603. |
[56] | Brummel-Ziedens K.E., Orfeo T., Rosendaal F.R., Undas A., Rivard G.E., Butenas S. Empirical and theoretical phenotype discrimination. J.Thromb. Haemost. 2009, 7 (1) pp.181-186 |
[57] | Brummel-Ziedens K.E., Vossen C.Y., Rosendaal F.R., Umezaki K., Mann K.G. The plasma hemostatic proteome: thrombin generation in healthy individuals. J.Thromb. Haemost. 2005, 3 pp.1472-1481 |
[58] | Boisclair M.D., Lane D.A., Wilde J.T., Ireland H., Preston F.E., Ofosu F.A. A comparative evaluation of assays for markers of activated coagulation and/or fibrinolysis: thrombin-antithrombin complex, D-dimer and fibrinogen/fibrin fragment E antigen. Br. J. Haematol. 1990, 74 (4) pp.471-479 |
[59] | Pelzer H., Schwarz A., Heimburger N. Determination of human thrombin-antithrombinIII complex in plasma with an enzyme-linked immunosorbent assay. Thromb. Haemost. 1988, 59 (1) pp.101-106 |
[60] | Sommeijer D.W., Van Oerle R., Reitsma P.H., Timmerman J.J., Meijers J.C., Spronk H.M., Cate H.T. Analysis of blood coagulation in mice: pre-analytical conditions and evaluation of a homemade assay for thrombin-antithrombin complexes. Thromb. J. 2005, 3 p.12 |
[61] | Gatt A., van Veen J.J., Woolley A.M., Kitchen S., Cooper P., Makris M. Thrombin generation assays are superior to traditional tests in assessing anticoagulation reversal in vitro. Thromb. Haemost. 2008, 100 pp.350-355 |
[62] | Hemker H.C., Giesen P., Al Dieri R., Regnault V., de Smedt E., Wagenvoord R. Calibrated automated thrombin generation measurement in clotting plasma. Pathophysiol. Haemost. Thromb. 2003, 33 pp.4-15 |
[63] | Hemker H.C., Giesen P., AlDieri R., Regnault V., de Smed E., Wagenvoord R. The calibrated automated thrombogram (CAT): a universal routine test for hyper- and hypocoagulability. Pathophysiol. Haemost. Thromb. 2002, 32 pp.249-253 |
[64] | Gaffney P.J., Edgell T., Creighton-Kempsford L.J., Wheeler S., Tarelli E. Fibrin degradation product (FnDP) assays: analysis of standardization issues and target antigens inplasma. Br. J. Haematol. 1995 May, 90 (1) pp.187-194 |
[65] | Nieuwenhuizen W. A reference material for harmonisation of D-dimer assays. Fibrinogen subcommittee of the Scientific and Standardization Committee of the International Society of Thrombosis and Hemostasis. Thromb. Haemost. 1997, 77 pp.1031-1033 |
[66] | Spannagl M., Haverkate F., Reinauer H., Meijer P. The performance of quantitative D-dimer assays in laboratory routine. Blood Coagul. Fibrinolysis. 2005, 16 pp.439-443 |
[67] | Lethagen S., & Kling S. New bleeding time devices with retractable blades evaluated inchildren, healthy volunteers and patients with prolonged bleeding time. Thromb. Haemost. 1993 Oct 18, 70 (4) pp.595-597 |
[68] | Kottke-Marchant K. Performance and interpretation of routine coagulation assays. In: Laboratory Haematology Practice. Wiley. Blackwell, Oxford, England, May 15, 2012, pp.420-34 |
Тромбоциты | |
[69] | Chignier E., Parise M., Mcgregor L., Delabre C., Faucompret S., Mcgregor J. A P-selectin/CD62P monoclonal antibody (LYP-20), in tandem with flow cytometry, detects in vivo activated circulating rat platelets in severe vascular trauma. Thromb. Haemost. 1994, 72 (5) pp.745-749 |
[70] | Goodman S.L., Lelah M.D., Lambrecht L.K., Cooper S.L., Albrecht R.M. In vitro vs. ex vivo platelet deposition on polymer surfaces. Scan. Electron Microsc. 1984, (Pt 1) pp.279-290 |
[71] | Goodman S.L., Cooper S.L., Albrecht R.M. Activation of platelets from humans, canines, and macaques on polymer surfaces. In: |
[72] | ICSH. Recommended method for indium-111 platelet survival studies. International Committee for Standardization in Haematology. Panel on Diagnostic Applications of Radionuclides. J. Nucl. Med. 1988, 29 (4) pp.564-566 |
[73] | Karwath R., Schurer M., Wolf H. Measurement of platelet adhesiveness onto artificial surfaces using Cr-51 and In-111 labeled platelets. Studia Biophysica. 1989, 131 pp.117-123 |
[74] | Kundu S.K., Heilmann E.J., Sio R., Garcia C., Ostgaard R.A. Characterization of an In vitro Platelet Function Analyzer, PFA-100TM. Clin. Appl. Thromb. Hemost. 1996, 2 (4) pp.241-249 |
[75] | Kunicki T.J., Tuccelli M., Becker G.A., Aster R.H. A study of variables affecting the quality of platelets stored at "room temperature". Transfusion. 1975, 15 (5) pp.414-421 |
[76] | Lewis S.M., Rowan R.M., Kubota F. Evaluation of a prototype for a reference platelet counter. J. Clin. Pathol. 1990, 43 (11) pp.932-936 |
[77] | NCCLS. Methods for reticulocyte counting (Flow cytometry and supervitwal dyes); Approved Guideline (H44-A, Vol.17 No.15).Volume H44-A, Vol.17. Clinical and Laboratory Standards Institute; 1997 |
[78] | Palatianos G.M., Dewanjee M.K., Robinson R.P., Novak S., Dewanjee P.K., Kapadvanjwala M., Hsu L.C., Sfakianakis G.N., Kaiser G.A. Quantitation of platelet loss with indium-111 labeled platelets in a hollow-fiber membrane oxygenator and arterial filter during extracorporeal circulation in a pig model. ASAIO Trans. 1989, 35 (3) pp.667-670 |
[79] | Wu K.K., & Hoak J.C. A new method for the quantitative detection of platelet aggregates inpatients with arterial insufficiency. Lancet. 1974, 2 (7886) pp.924-926 |
[80] | Zingg W., Ip W.F., Sefton M.V., Mancer K. A chronic arteriovenous shunt for the testing of biomaterials and devices in dogs. Life Support Syst. 1986, 4 (3) pp.221-229 |
[81] | Best Collaborative. Platelet radiolabelling procedure: The Biomedical Excellence for Safer Transfusion (BEST) Collaborative. Transfusion. 2006, 46 () pp.59-66 |
[82] | Holme S., Heaton A., Roodt J. Concurrent label method with 111In and 51Cr allows accurate evaluation of platelet viability of stored concentrates. Br. J. Haematol. 1993, 84 pp.717-723 |
[83] | Fushimi F., Nakayama M., Nishimura K., Hiyoshi T Platelet adhesion, contact phase coagulation activation, and C5a generation of polyethylene glycol acid-grafted high flux cellulosic membrane with varieties of grafting amounts. Artif. Organs. 1998 Oct, 22 (10) pp.821-826 |
[84] | Tamada Y., Kulik E., Ikada Y. Simple method for platelet counting, in Biomaterials, Vol 16, Issue 3, 1995, pp.259-261 |
[85] | Gorbet M.B., & Sefton M.V. Biomaterial-associated thrombosis: roles of coagulation factors, complement, platelets and leukocytes, Maud B.Gorbet, Michael V.Sefton, in Biomaterials 25 (2004), pp.5681-5703 |
[86] | Kottke-Marchant K. Clinical perspectives on platelet function testing. Medical Laboratory Observer, May, 44(5): 8-14 (2012) |
[87] | Anderson J.M., & Kottke-Marchant K. Platelet interactions with biomaterials and artificialdevices. CRC Critical Reviews in Biocompatibility. 1985, 1 pp.111-204 |
[88] | Schmidt V., & Hilberg T. ThromboFix platelet stabilizer: advances in clinical platelet analyses by flow cytometry? Platelets. 2006 Jun, 17 (4) pp.266-273 |
[89] | Hu H., Daleskog M., Li N. Influences of fixatives on flow cytometric measurements of platelet P-selectin expression and fibrinogen binding. Thromb. Res. 2000 Nov 1, 100 (3) pp.161-166 |
[90] | Muriithi E.W., Belcher P.R., Menys V.C., Chaudhry M.A., Raco L., Day S.P. Quantitative detection of platelet aggregates in whole blood without fixation. Platelets. 2000 Feb, 11 (1) pp.33-37 |
[91] | Macey M., Azam U., McCarthy D., Webb L., Chapman E.S., Okrongly D. Evaluation of the anticoagulants EDTA and citrate, the ophylline, adenosine, and dipyridamole (CTAD) for assessing platelet activation on the ADVIA 120 haematology system. Clin. Chem. 2002 Jun, 48 (6 Pt 1) pp.891-899 |
[92] | Dimitrievska S., Maire M., Diaz-Quijada G.A., Robitaille L., Ajji A., Yahia L. Low thrombogenicity coating of nonwoven PET fiber structures for vascular grafts. Macromol. Biosci. 2011 Apr 8, 11 (4) pp.493-502 |
[93] | De Somer F., Van Belleghem Y., Foubert L., |
[94] | Cenni E., Granchi D., Verri E., Cavedagna D., Gamberini S., Falsone G. CD62, thromboxane B2, and beta-thromboglobulin: a comparison between different markers of platelet activation after contact with biomaterials. J. Biomed. Mater. Res. 1997 Sep 5, 36 (3) pp.289-294 |
Гематология (включая гемолиз) | |
[95] | Coldman M.F., Gent M., Good W. The identical effect of electrolyte and non-electrolyte on the osmotic fragility of mammalian erythrocytes. Comp. Biochem. Physiol., 1970, Pergamon Press, printed in Great Britain, Vol.33, pp.157-165 |
[96] | Coldman M.F., Gent M., Good W. Relationships between osmotic fragility and other species-specific variables of mammalian erythrocytes, Comp. Biochem. Physiol., 1970, Pergamon Press, printed in Great Britain, Vol.34, pp.759-772 |
[97] | Matsuzawa T., Ikarashi Y. Haemolysis of various mammalian erythrocytes in sodium chloride, glucose and phosphate-buffer solutions. Lab. Anim. 1979, 13 pp.329-331 |
[98] | Coldman M.F., Gent M., Good W. The osmotic fragility of mammalian erythrocytes in hypotonic solutions of sodium chloride. Comp. Biochem. Physiol., 1969, Pergamon Press, printed in Great Britain, Vol.31, pp.605-609 |
[99] | AABB. Standards for blood banks and transfusion services. In: AABB Committee on Standards, editor. Washington, DC: American Association of Blood Banks 1994. p.v |
[100] | Bednar R., Bayer P.M. Correction: measurements of plasma hemoglobin. Clin. Chem. 1993, 39 (9) pp.2027-2028 |
[101] | Council of Europe. Recommendation No.R (95) 15: Guide to the preparation, use and quality assurance of blood components. In: Committee of Ministers to Member States, editor. 13th ed. 13th ed. Strasbourg: Council of Europe Pub.; 2007. p.271 |
[102] | Cripps C.M. Rapid method for the estimation of plasma haemoglobin levels. J. Clin. Pathol. 1968, 21 (1) pp.110-112 |
[103] | EDQM. Sterile plastic containers for human blood and blood components (3.2.3). European Pharmacopoeia 5.0: European Directorate for the Quality of Medicines and Healthcare; 1997b. pp.175-179 |
[104] | Fairbanks V.F., Ziesmer S.C., O'Brien P.C. Methods for measuring plasma hemoglobin in micromolar concentration compared. Clin. Chem. 1992, 38 (1) pp.132-140 |
[105] | Harboe M. A method for determination of hemoglobin in plasma by near-ultraviolet spectrophotometry. Scand. J. Clin. Lab. Invest. 1959, 11 (1) pp.66-70 |
[106] | Henry J.B. Haematology and Coagulation. In: Clinical Diagnosis and Management by Laboratory Methods. (Henry J.B. ed.). W.B.Saunders, Philadelphia, Eighteenth Edition, 1991, pp.556-603. |
[107] | Lammers M., Gressner A.M. Immunonephelometric quantification of free haemoglobin. J. Clin. Chem. Clin. Biochem. 1987, 25 (6) pp.363-367 |
[108] | Lampert R.H., Williams M.C. Effect of surface materials on shear-induced haemolysis. J. Biomed. Mater. Res. 1972, 6 (6) pp.499-532 |
[109] | Malinauskas R.A. Plasma hemoglobin measurement techniques for the in vitro evaluation of blood damage caused by medical devices. Artif. Organs. 1997, 21 (12) pp.1255-1267 |
[110] | Miale J.B. Laboratory medicine, haematology. St. Louis: Mosby; 1982. [64] p. of plates; xi, 1084 pp |
[111] | Mosby Year Book. A Color Atlas of Comparative, Diagnostic and Experimental Haematology. Mosby-Year Book Europe Ltd, London, England, 1994 |
[112] | Obeng E.K., Cadwallader D.E. In vitro dynamic method for evaluating the hemolytic potential of intravenous solutions. J. Parenter. Sci. Technol. 1989, 43 (4) pp.167-173 |
[113] | Offeman R.D., Williams M.C. Material effects in shear-induced haemolysis. Biomater. Med. Devices Artif. Organs. 1979, 7 (3) pp.359-391 |
[114] | OSHA. 29 CFR Regulation Part 1910: Occupational Safety and Health Standards - 1910.1030: Bloodborne pathogens. In: National Archives and Records Administration, editor. Washington, DC: US Department of Labor; 2008 |
[115] | Reed K.W., Yalkowsky S.H. Lysis of human red blood cells in the presence of various cosolvents. J. Parenter. Sci. Technol. 1985, 39 (2) pp.64-69 |
[116] | SIGMA DIAGNOSTICS. Plasma Hemoglobin: Quantitative, colormetric determination in plasma at 600 nm (Procedure No.527, April 1991). Sigma Diagnostics, St. Louis, MO, 1991 |
[117] | Standefer J.C., Vanderjagt D. Use of tetramethylbenzidine in plasma hemoglobin assay. Clin. Chem. 1977, 23 (4) pp.749-751 |
[118] | Taulier A., Levillain P., Lemonnier A. Value of derivative spectrophotometry for the determination of plasma and urinary hemoglobin. Comparison with the method using Allen'scorrection]. Ann. Biol. Clin. (Paris). 1986, 44 (3) pp.242-248 |
[119] | Kottke-Marchant K. ed. Laboratory Haematology Practice. John Wiley & Sons, Ltd, Oxford, England, 2012 |
[120] | Dudash L.A., Klingman F.L., Bastijanic J.M., Kottke-Marchant K., Marchant R.E. Cross-reactivity of cell-selective CRETAWAC peptide with human and porcine endothelial cells. J. Biomed. Mater. Res. A. 2014 Aug, 102 (8) pp.2857-2863 |
[121] | WHO. Recommended methods for the visual determination of white cells and platelet counts. In: Expert panel of Cytometry of the International Committee for Standardization in Haematology, editor. WHO/LAB/88.3: World Health Organization; 1988. p.8 |
[122] | Zwart A., Van Assendelft O.W., Bull B.S., England J.M., Lewis S.M., Zijlstra W.G. Recommendations for reference method for haemoglobinometry in human blood (ICSH standard 1995) and specifications for international haemi-globinocyanide standard (4th edition). J ClinPathol 1996; 49 (4): 271-4. (PREVIOUSLY CITED AS International Committee for Standardization in Haematology) |
[123] | Wennberg A., Hensten-Pettersen A. Sensitivity of erythrocytes from various species to invitro hemolyzation. J. Biomed. Mater. Res. 1981, 15 (3) pp.433-435 |
[124] | Mueller M.R., & Schima H. In vitro hematological testing of rotary blood pumps: Remarks on standardization and data interpretation. Artif. Organs. 1993, 17 (2) pp.103-110 |
[125] | Lippi G., Blanckaert N., Bonini P., Green S., Kitchen S., Palicka V. Haemolysis: an overview of the leading cause of unsuitable specimens in clinical laboratories. Clin. Chem. Lab. Med. 2008, 46 pp.764-772. Available at: http://dx.doi.org/10.1515/CCLM.2008.170 |
[126] | Sharp M.K., & Mohammad S.F. Scaling of haemolysis in needles and catheters. Ann Biochem Engineer. 1998, 26 pp.788-797 |
[127] | Savory J., & Bill J.G. Haemolysis of specimens drawn in the ER [Q&A]. Lab. Med. 1996, 27 p.802 |
[128] | Kennedy C., Angemuller S., King R. A comparison of haemolysis rates using intravenous catheters versus venipuncture tubes for obtaining blood samples. J. Emerg. Nurs. 1996, 22 pp.566-569 |
Система комплемента | |
[129] | Chenoweth D.E. Complement activation produced by biomaterials. ASAIO Trans. 1986, 32 (1) pp.226-232 |
[130] | Craddock P.R., Fehr J., Brigham K.L., Kronenberg R.S., Jacob H.S. Complement and leukocyte-mediated pulmonary dysfunction in hemodialysis. N. Engl. J. Med. 1977, 296 pp.769-774 |
[131] | Chenoweth D.E. Complement activation during hemodialysis: clinical observations, proposed mechanisms and theoretical implications. Artif. Organs. 1984, 8 pp.231-287 |
[132] | Hakim R.M., Breillatt J., Lazarus J.M., Port F.K. Complement activation and hypersensitivity reactions to dialysis membranes. N. Engl. J. Med. 1984, 311 pp.878-882 |
[133] | Chenoweth D.E., Cooper S.W., Hugli T.E., Stewart R.W., Blackstone E.H., Kirlin J.W. Complement activation during cardiopulmonary bypass: evidence for generation of C3a and C5a anaphylatoxins. N. Engl. J. Med. 1981, 304 (9) pp.497-503 |
[134] | Velthuis H., Jansen P.G., Hack C.E., Eijsman L., Wildevuur C.R. Specific complement inhibition with heparin-coated extracorporeal circuits. Ann. Thorac. Surg. 1996, 61 pp.1153-1157 |
[135] | Fitch J.C., Rollins S., Matis L., Alford B. Pharmacology and biological efficacy of arecombinant, humanized, single-chain antibody C5 complement inhibitor in patients undergoingcoronary artery bypass surgery with cardiopulmonary bypass. Circulation. 1999, 100 pp.2499-2506 |
[136] | Hsu L.C. Heparin-coated cardiopulmonary bypass circuits: current status. Perfusion. 2001, 16 pp.417-428 |
[137] | Johnson R.J. 2013 'The complement system', in Ratner B, Hoffman A, Schoen F, and Lemons J (eds), Biomaterials Science: An Introduction to Materials in Medicine, 3rd Ed., Oxford, UK, Elsevier Academic Press, 533-545 |
[138] | Johnson R.J., Burhop K.E., Van Epps D.E. Infusion of ovine C5a into sheep mimics theinflammatory response of hemodialysis. J. Lab. Clin. Med. 1996, 127 pp.456-469 |
[139] | Neidhart P.P., Meier B., Polla B.S., Schifferli J.A., Morel D.R. Fatal anaphylactoid response to protamine after percutaneous transluminal coronary angioplasty. Eur. Heart J. 1992, 13 (6) pp.856-858 |
[140] | Laroche D., Aimone-Gastin I., Dubois F. Mechanisms of severe, immediate reactions to iodinated contrast material. Radiology. 1998, 209 (1) pp.183-190 |
[141] | Bergamaschini L., Mannucci P.M., Federici A.B., Coppola R., Guzzoni S., Agostini A. Posttransfusion anaphylactic reactions in a patient with severe von Willebrand disease: role of complement and alloantibodies to von Willebrand factor. J. Lab. Clin. Med. 1995, 125 (3) pp.348-355 |
[142] | Bergamaschini L., Santangelo T., Faricciotti A., Ciavarella N., Mannucci P.M., Agostoni A. Study of complement-mediated anaphylaxis in humans. The role of IgG subclasses (IgG1 and/or IgG4) in the complement-activating capacity of immune complexes. J. Immunol. 1996, 156 (3) pp.1256-1261 |
[143] | Wolf M.F., & Anderson J.M. Practical approach to blood compatibility assessments: general considerations and standards. In: Biocompatibility and performance of medical devices (Boutrand J.-P. ed.). Woodhead Publishing Ltd, 2012 |
[144] | Blajchman M.A., & Ozge-Anwar A.H. The role of the complement system in hemostasis. Prog. Hematol. 1986, XIV, pp.149-182 |
[145] | Johnson R.J. Complement activation during extracorporeal therapy: biochemistry, cell biology and clinical relevance. Nephrol. Dial. Transplant. 1994, 9 pp.36-45 |
[146] | Fiane A.E., Videm V., Lingaas P.S., Heggelund L., Nielsen E.W., Geiran O.R. Mechanism of complement activation and its role in the inflammatory response after thoracoabdominal aorticaneurysm repair. Circulation. 2003 Aug 19, 108 (7) pp.849-856 |
[147] | Speidl W.S., Katsaros K.M., Kastl S.P, Zorn G., Huber K., Maurer G. Coronary late lumen loss of drug eluting stents is associated with increased serum levels of the complement components C3a and C5a. Atherosclerosis. 2010 Jan, 208 (1) pp.285-289 |
Экспериментальные модели на животных | |
[148] | Dewanjee M.K., Kapadvanjwala M., Sanchez A., Elson R., Serafini A.N., Zilleruelo G.E., Sfakianakis G.N. Quantitation of comparative thrombogenicity of dog, pig, and human platelets in a hemodialyzer. ASAIO J. 1992, 38 (2) pp.88-90 |
[149] | Didisheim P., Dewanjee M.K., Frisk C.S., Kaye M.P., Fass D.N. Animal Models for predicting clinical performance of biomaterials for cardiovascular use. In: Boretos J.W., Eden M., National Institutes of Health (U.S.), editors. Contemporary biomaterials: material and host response, clinical applications, new technology, and legal aspects. Park Ridge, N.J., U.S.A.: Noyes Publications; 1984a. pp.132-179 |
[150] | Didisheim P., Stropp J.Q., Borowick J.H., Grabowski E.F. Species differences in platelet adhesion to biomaterials: Investigation by a two-stage technique. Trans. Am. Soc. Artif. Intern. Organs. 1979, 2 pp.124-132 |
Антикоагуляция | |
[151] | EDQM. Anticoagulant and Preservative solutions for human blood: Anticoagulant acid-citrate-glucose solutions (ACD) and Anticoagulant citrate-phosphate-glucose solution (CPD). European Pharmacopoeia 5.0: European Directorate for the Quality of Medicines and Healthcare; 1997a. pp.400-403 |
[152] | Anticoagulant Citrate Dextrose Solution In U.S.P Ian DeVeau, editor. USP 28: (USP Citric Acid RS); Assay for total citrate. U.S. Pharmacopeia; 2006a. p 165; PF 31 (3), p.727 |
[153] | Anticoagulant Citrate Phosphate Dextrose U.S.P In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay for total citrate and total phosphate. U.S. Pharmacopeia; 2006b. p 165; PF 31 (3), p.730 |
[154] | Anticoagulant Citrate Phosphate Dextrose Adenine Solution U.S.P In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay for total citrate and total phosphate. U.S.Pharmacopeia; 2006c. p 166; PF 31 (3), p.728 |
[155] | Anticoagulant Heparin Solution U.S.P. In: Biologics and Biotechnology-Blood and Blood Products Committee, editor. USP 11: (USP Endotoxin RS) Assay for heparin sodium; Assay for sodium chloride (RB 1-Oct-2009). U.S. Pharmacopeia; 2009 |
[156] | Anticoagulant Sodium Citrate Solution U.S.P. In: Larry Callahan, editor. USP 28: (USP Citric Acid RS); Assay. U.S. Pharmacopeia; 2006d. p 168; PF 31 (3), p.731 |
Системы вспомогательного кровообращения | |
[157] | Mueller M.R., Schima H., Engelhardt H., Salat A., Olsen D.B., Losert U., Wolner E. In vitro hematological testing of rotary blood pumps: remarks on standardization and data interpretation. Artif. Organs. 1993, 17 (2) pp.103-110 |
Искусственное кровообращение | |
[158] | Harker L.A., Malpass T.W., Branson H.E., Hessel E.A |
[159] | Moen O., Fosse E., Dregelid E., Brockmeier V., Andersson C., Hogasen K., Venge P., Mollnes T.E., Kierulf P. Centrifugal pump and heparin coating improves cardiopulmonary bypass biocompatibility. Ann. Thorac. Surg. 1996, 62 (4) pp.1134-1140 |
[160] | Palatianos G.M., Dewanjee M.K., Robinson R.P., Novak S., Dewanjee P.K., Kapadvanjwala M., Hsu L.C., Sfakianakis G.N., Kaiser G.A. Quantitation of platelet loss with indium-111 labeled platelets in a hollow-fiber membrane oxygenator and arterial filter during extracorporeal circulation in a pig model. ASAIO Trans. 1989, 35 (3) pp.667-670 |
Катетеры | |
[161] | Leach K.R., Kurisu Y., Carlson J.E., Repa I., Epstein D.H., Rness M., Sahatjian R., Hunter D.W., Casteneda-Zuniga W.R., Amplatz K. Thrombogenicity of hydrophilically coated guidewires and catheters. Radiology. 1990, 175 (3) pp.675-677 |
[162] | Lee K.H., Han J.K., Byun Y., Moon H.T., Yoon C.J., Kim S.J., Choi B.I. Heparin-coated angiographic catheters: an in vivo comparison of three coating methods with different heparin release profiles. Cardiovasc. Intervent. Radiol. 2004, 27 (5) pp.507-511 |
[163] | Roberts G.M., Roberts E.E., Davies R.L., Lawrie B.W. Thrombogenicity of arterial catheters and guidewires. Br. J. Radiol. 1977, 50 (594) pp.415-418 |
Общие положения | |
[164] | Cao L., Chang M., Lee C.Y., Castner D.G., Sukavaneshvar S., Ratner B.D., Horbett T.A. Plasma-deposited tetraglyme surfaces greatly reduce total blood protein adsorption, contactactivation, platelet adhesion, platelet procoagul ant activity, and in vitro thrombus deposition. J. Biomed. Mater. Res. A. 2007, 81 (4) pp.827-837 |
[165] | Dawids S.G. Test procedures for the blood compatibility of biomaterials. Dordrecht; Boston: Kluwer Academic Publishers; 1993. xii, 684 p |
[166] | EMEA. Validation of Analytical Procedures: Text and Methodology-Q 2 (R1), (CPMP/ICH/381/95); and Note for guidance on Validation of Analytical Procedures: Methodology-Q 2 B (CPMP/ICH/281/95). In: ICH Harmonised Tripartite Guideline, (Unit H.M.E. ed.). European Medicines Agency, 1995 |
[167] | Kataoka K., Maeda M., Nishimura T., Nitadori Y., Tsuruta T., Akaike T., Sakurai Y. Estimation of cell adhesion on polymer surfaces with the use of "column-method". J.Biomed. Mater. Res. 1980, 14 (6) pp.817-823 |
[168] | Levy R.J. Cardiovascular Biomaterials and Biocompatibility. In: Cardiovascular Pathology, No.3. (Ratner B.D., & Didisheim P. eds.). Suppl, Harker, LA, Vol.2, 1993, pp.1S-224S. |
[169] | NHLBI. Guidelines for blood/material interactions. Bethesda, MD: National Heart Lung and Blood Institute; 1985 September 1985. Report nr NIH: 85-2185 |
[170] | Northup S.J. Hemocompatilbility: Not all devices are created equal. MDDI. 1997 January, 1997 pp.145-150 |
[171] | Ratner B.D., Hoffman A.S., Schoen F.J., Lemons J.E. Biomaterials Science, Third Edition: An Introduction to Materials in Medicine. Elsevier Academic Press; 2012. 864 p |
[172] | Sefton M.V., Gemmell C.H., Gorbet M.B. What really is blood compatibility? J.Biomater. Sci. Polym. Ed. 2000, 11 (11) pp.1165-1182 |
[173] | Sefton M.V., Sawyer A., Gorbet M., Black J.P., Cheng E., Gemmell C., Pottinger-Cooper E. Does surface chemistry affect thrombogenicity of surface modified polymers? J. Biomed. Mater. Res. 2001, 55 (4) pp.447-459 |
[174] | Seyfert U.T., Biehl V., Schenk J. In vitro haemocompatibility testing of biomaterials according to the ISO 10993-4. Biomol. Eng. 2002, 19 (2-6) pp.91-96 |
[175] | Taber C.W., & Thomas C.L. Taber's Cyclopedic Medical Dictionary. In: Thomas CL, M.D., editor. Taber's Cyclopedic Medical Dictionary. 17th ed. Philadelphia: F.A.Davis Co.; 1993. p.2600 |
[176] | TRIPARTITE SUBCOMMITTEE FOR MEDICAL DEVICES. Tripartite Biocompatibility Guidance for Medical Devices. In: Office of Device Evaluation (ODE) in FDA's Center for Devices and Radiological Health (CDRH), editor. General Program Memorandum #G87-1. FDA; 1986 |
[177] | Ratner B.D. Blood compatibility - a perspective. Biomater. Sci. Polym. Ed. 2000, 11 pp.1107-1119 |
[178] | Hoffman A.S., Horbett T.A., Ratner B.D., Hanson S.R., Harker L.A. 1982 "Thrombotic events on grafted polyacrylamide-silastic surfaces as studied in a baboon", in Cooper S L, Peppas N A and Hoffman A S (eds), Biomaterials: interfacial Phenomena and Applications, 6, 59-80, American Chemical Society |
[179] | Llanos G.R., & Sefton M.V. Immobilization of poly (ethylene glycol) onto poly (vinyl alcohol) hydrogel: evaluation of thrombogenicity. J. Biomed. Mater. Res. 1993, 27 (11) pp.1383-1391 |
[180] | Kaplan S., Marcoe K.F., Sauvage L.R., Wu H.D., Mathesen S.R., Walker M.W. The effect of predetermined thrombotic potential of the recipient on small-caliber graft performance. J. Vasc. Surg. 1986, 3 (2) pp.311-321 |
[181] | Akizawa T., Kino K., Kinugasa E., Koshikawa S., Ikada Y., Kishida A., Hatanaka Y., Imamura K. Clinical effects of a polyethylene glycol grafted cellulose membrane on thrombogenicity and biocompatibility during hemodialysis. ASAIO Trans. 1990 Jul-Sep, 36 (3) pp.M640-M642 |
[182] | Ishihara K., Ziats N.P., Tierney B.P., Nakabayashi N., Anderson J.M. Protein adsorption from human plasma is reduced on phospholipid polymers. J.Biomed. Mater. Res. 1991, 25 pp.1397-1407 |
[183] | Mulvihill J.N., Faradji A., Oberling F., Cazenave J.P. Surface passivation by human albumin of plasmapheresis circuits reduces platelet accumulation and thrombus formation. Experimental and clinical studies. J.Biomed. Mater. Res. 1990, 24 pp.155-163 |
Искусственные клапаны сердца | |
[184] | Burns G.L., Pantalos G.M., Olsen D.B. The calf as a model for thromboembolic events with the total artificial heart. ASAIO Trans. 1987, 33 (3) pp.398-403 |
[185] | Rosengart T.K., Lang S.J. Valvular Heart Disease. In: Surgical Intensive CareBarrie P.S. & Shires G.T. eds. Little, Brown and Company, Boston, 1993, pp.577-612 |
[186] | Schoen F.J., Hirsch D., Bianco R.W., Levy R.J. Onset and progression of calcification in porcine aortic bio prosthetic valves implanted as orthotopic mitral valve replacements in juvenile sheep. J. Thorac. Cardiovasc. Surg. 1994 Nov, 108 (5) pp.880-887 |
[187] | Gallegos R.P., Nockel P.J., Rivard A.L., Bianco R.W. The current state of in-vivo pre-clinical heart valve evaluation. J of Heart Valve Disease, May; 14 (3) 2005 |
Гемодиализ | |
[188] | Kishida A., Akatsuka Y., Yanagi M., Aikou T., Maruyama I., Akashi M. In vivo and ex vivo evaluation of the antithrombogenicity of human thrombomodulin immobilized biomaterials. ASAIO J. 1995, 41 (3) pp.M369-M374 |
[189] | Mahiout A., Meinhold H., Jorres A., Krieg R., Kessel M., Tretzel J., Baurmeister U. Ex vivo model for pre-clinical evaluation of dialyzers containing new membranes. Life Support Syst. 1985, 3 () pp.448-452 |
[190] | Spencer P.C., Schmidt B., Samtleben W., Bosch T., Gurland H.J. Ex vivo model of hemodialysis membrane biocompatibility. Trans. Am. Soc. Artif. Intern. Organs. 1985, 31 pp.495-498 |
[191] | Ward R.A., Schmidt B., Blumenstein M., Gurland H.J. Evaluation of phagocytic cell function in an ex vivo model of hemodialysis. Kidney Int. 1990, 37 (2) pp.776-782 |
Модели in vitro | |
[192] | Chandler A.B. In vitro thrombotic coagulation of the blood; a method for producing a thrombus. Lab. Invest. 1958, 7 (2) pp.110-114 |
[193] | Munch K., Wolf M.F., Gruffaz P., Ottenwaelter C., Bergan M., SchroedeR P., Fogt E.J. Use of simple and complex in vitro models for multiparameter characterization of human blood-material/device interactions. J. Biomater. Sci. Polym. Ed. 2000, 11 (11) pp.1147-1163 |
[194] | Yoshizaki T., Tabuchi N., Van Oeveren W., Shibamiya A., Koyama T., Sunamori M. PMEA polymer-coated PVC tubing maintains anti-thrombogenic properties during in vitro whole blood circulation. Int. J. Artif. Organs. 2005, 28 (8) pp.834-840 |
[195] | Zimmermann A.K., Weber N., Aebert H., Ziemer G., Wendel H.P. Effect of biopassive and bioactive surface-coatings on the haemocompatibility of membrane oxygenators. J.Biomed. Mater. Res. B Appl. Biomater. 2007, 80 (2) pp.433-439 |
[196] | Tayama E., Ohtsubo S., Nakazawa T., Takami Y., Niimi Y., Makinouchi K., Glueck J.A., Nose Y. The simple in vitro thrombogenic test: modified methods for same priming pumps. Artif. Organs. 1997, 21 (12) pp.1305-1308 |
[197] | Amrani D.L., Lee C., Earle K., DiOrio J., Murphy M., Yang J. LiVecchi A. An In vitro Bovine percardial Haemocompatibility Testing System. J. Heart Valve Dis. 1998, 7 pp.268-272 |
[198] | Boswald M., Lugauer S., Bechert T., Greil J., Regenfus A., Guggenbichler J.P. Thrombogenicity testing of central venous catheters in vitro. Infection. 1999, 27 () pp.S30-S33 |
[199] | Van Oeveren W., Tielliu I.F., De Hart J. Comparison of modified chandler, roller pump, and ball valve circulation models for in vitro testing in high flow conditions: application inthrombogenicity testing of different materials for vascular applications. Int. J of Biomaterials. 2012; 673163, 7 pages |
[200] | Kolandaivelu K., Edelman E.R., Background L. Pulsatile, In Vitro Flow Circuit for Modeling Coronary Implant Thrombosis, in Transactions of the ASME, Vol.124, Dec. 2002 |
[201] | Kolandaivelu K., & Edelman E.R. Environmental influences on endovascular stent platelet reactivity: An in vitro comparison of stainless steel and gold surfaces, 2004 Wiley Periodicals, Inc. J.Biomed. Mater. Res. 2004, 70A pp.186-193 |
[202] | Kolandaivelu K., Leiden, Benjamin B., Edelman, Elazer R. Predicting response to endovascular therapies: Dissecting the roles of local lesion complexity, systemic comorbidity, and clinical uncertainty. J.Biomech. 2014, 47 pp.908-921 |
[203] | Stang K., Krajewski S., Neumann B., Kurz J., Post M., Stoppelkamp S. Haemocompatibility testing according to ISO 10993-4: Discrimination between pyrogen- and device-induced hemostatic activation. Mater. Sci. Eng. C. 2014, 42 pp.422-428 |
Модели in vitro по сравнению с моделями in vivo | |
[204] | Didisheim P., Dewanjee M.K., Kaye M.P., Frisk C.S., Fass D.N., Wahner H.W., Tirrell M.V., Zollman P.E. Nonpredictability of long-term in vivo response from short-term in vitro or ex vivo blood-material interactions. Trans. Am. Soc. Artif. Intern. Organs. 1984b, 30 pp.370-376 |
Патология | |
[205] | Anderson J.M., Cardiovascular Device Retrieval and Evaluation. In: Cardiovascular Biomaterials and Biocompatibility. Cardiovascular Pathology, No.3. (Ratner B.D., & Didisheim P eds.). Suppl, Harker, LA, Vol.2, 1993, pp.199S-208S |
[206] | Schoen F.J. Appendix: Pathology analysis of the cardiovascular system and prosthetic devices. Interventional and surgical cardiovascular pathology: clinical correlations and basic principles. Saunders, Philadelphia, 1989, pp.369-96 |
[207] | Grewe P.H., Thomas D., Machraoui A., Barmeyer J., Muller K.M. Coronary morphologic findings after stent implantation. Am. J. Cardiol. 2000, 85 (5) pp.554-558 |
[208] | Prado C.M., Viaro F., Baldo C.F., Augusto Vdos S., Rodrigues A.J., Evora P.R. Glycol methacrylate-embedding medium to study morphological alterations of saphenous vein underbrief and crescent pressurizations. Acta Cir. Bras. 2008, 23 () pp.77-82, discussion 82 |
[209] | Rippstein P., Black M.K., Boivin M., Veinot J.P., Ma X., Chen Y.X., Human P., Zilla P., O'Brien E.R. Comparison of processing and sectioning methodologies for arteries containing metallic stents. J. Histochem. Cytochem. 2006, 54 (6) pp.673-681 |
[210] | Singhrao S.K., Muller C.T., Gilbert S.J., Duance V.C., Archer C.W. An immunofluorescence method for postembedded tissue in the acrylic resin Technovit 9100 New using fluorescein isothiocyanate secondary detection. Microsc. Res. Tech. 2009, 72 (7) pp.501-506 |
[211] | Zhang Q., Wang J., Wu H., Zhang L., Zhou J., Ye Q., Shao X., Guan C., Xu J., Yang Y. et al. Low-temperature glycol methacrylate resin embedding method: A protocol suitable for bone marrow immunohistochemistry, PCR, and FISH analysis. Microsc Res Tech |
[212] |
|
Статистика | |
[213] | Festing MF. The design and statistical analysis of animal experiments. ILAR J. 2002, 43 (4) |
[214] | Festing MF. Altman DG. Guidelines for the design and statistical analysis of experiments using laboratory animals. ILAR J. 2002, 43 (4) |
[215] | Festing MF. Design and statistical methods in studies using animal models of development. ILAR J. 2006, 47 (1) |
[216] | Design and Analysis of Animal Studies in Pharmaceutical Development. Shein-ChungChow and Jen-pei Liu, Editors, Chapman & Hall CRC Biostatistics Series, 1998 |
Протезы кровеносных сосудов | |
[217] | Guidoin R., Douville Y Basle M.F., King M., Marinov G.R., Traore A., Zhang Z., Guillemot F., Dionne G., Sumanasinghe R. Biocompatibility studies of the Anaconda stent-graft and observations of nitinol corrosion resistance. J.Endovasc. Ther. 2004, 11 (4) pp.385-403 |
[218] | Guidoin R., Gosselin C. Martin L., Marois M., Laroche F., King M., Gunasekera K., Domurado D., Sigot-Luizard M.F., Blais P. Polyester prostheses as substitutes in the thoracic aorta of dogs. I. Evaluation of commercial prostheses. J.Biomed. Mater. Res. 1983, 17 (6) pp.1049-1077 |
[219] | Hoch JR. Silver D. Hemostasis and Thrombosis. In: Vascular Surgery: A Comprehensive Review, (Moore W.S. ed.). W.B.Saunders, Philadelphia, Third Edition, 1991, pp.63-79 |
[220] | Koskas F., Brocheriou I. Cluzel P., Singland J.D., Regnier B., Bonnot M., Kieffer E. Custom-made stent-grafts for aortic aneurysm repair using gianturco Z stents and woven polyester: healing in an animal model. Vasc. Endovascular Surg. 2005, 39 (1) pp.55-65 |
[221] | Toes G.J. Van Muiswinkel K.W., Van Oeveren W., Suurmeijer A.J., Timens W., Stokroos I., Van Den Dungen J.J. Superhydrophobic modification fails to improve the performance of small diameter expanded polytetrafluoroethylene vascular grafts. Biomaterials. 2002, 23 (1) pp.255-262 |
[222] | White R.A. Diagnosis and therapy of emergent vascular diseases. In: Textbook of critical care, (Shoemaker W.C., Society of Critical Care Medicine, ed.). Saunders, Philadelphia, Second Edition, 1989, pp.447-452 |
[223] | Wilson G.J. Macgregor D.C., Bridgeman J., Weber B.A., Binnington A.G., Pinchuk L. A Corethane/polyester composite vascular prosthesis for vascular access. Comparison with expanded polytetrafluoroethylene grafts in a canine model. ASAIO J. 1995, 41 (3) pp.M728-M734 |
[224] | Yoneyama T., Ishihara K. Nakabayashi N., Ito M., Mishima Y. Short-term in vivo evaluation of small-diameter vascular prosthesis composed of segmented poly(etherurethane)/2-methacryloyloxyethyl phosphorylcholine polymer blend. J. Biomed. Mater. Res. 1998, 43 (1) pp.15-20 |
[225] | Zilla P., Greisler H.P. Tissue engineering of vascular prosthetic grafts (Tissue Engineering Intelligence Unit). Landes Bioscience, 1999 |
[226] | Dudash L.A., Klingman F., Sarett S.M., Kottke-Marchant K., Marchant R.E. Endothelialcell attachment and shear response on biomimetic polymer-coated vascular grafts. J. Biomed. Mater. Res. A. 2012 Aug, 100 (8) pp.2204- 2210 |
[227] | Tang C., Klingman F., Larsen C.C., Kottke-Marchant K., Marchant R.E. Platelet and endothelial adhesion on fluoro-surfactant polymers designed for vascular graft modification. J. Biomed. Mater. Res. A. 2009, 88 (2) pp.348-358 |
[228] | Kottke-Marchant K., Anderson J.M., Rabinovitch A., Huskey R.A., Herzig R. The effect of heparin vs. citrate on the interaction of platelets with vascular graft materials. Thromb. Haemost. 1985, 54 pp.842-848 |
[229] | Kottke-Marchant K., Anderson J.M., Rabinovitch A. The platelet reactivity of vasculargraft prostheses: An in vitro model to test the effect of preclotting. Biomaterials. 1986, 7 pp.441-448 |
[230] | Kottke-Marchant K., Anderson J.M., Miller K.M., Marchant R.E., Lazarus H. Vascular graft associated complement activation and leukocyte adhesion in an artificial circulation. J. Biomed. Mater. Res. 1987, 21 pp.379-397 |
[231] | Kottke-Marchant K., Anderson J.M., Umemura Y., Marchant R.E. The effect of albumin coating on the in vitro blood compatibility of Dacron arterial prostheses. Biomaterials. 1989, 10 pp.147-155 |
Сосудистые стенты | |
[232] | Grewe PH. Thomas D., Machraoui A., Barmeyer J., Muller K.M. Coronary morphologicfindings after stent implantation. Am. J. Cardiol. 2000, 85 (5) pp.554-558 |
[233] | Rippstein P., Black MK. Boivin M., Veinot J.P, Ma X., Chen Y.X., Human P., Zilla P., O'Brien E.R. Comparison of processing and sectioning methodologies for arteries containing metallic stents. J. Histochem. Cytochem. 2006, 54 (6) pp.673-681 |
[234] | Schwartz R.S. Edelman E.R., Carter A., Chronos N.A., Rogers C., Robinson K.A., Waksman R., Machan L., Weinberger J., Wilensky R.L. Preclinical evaluation of drug-eluting stents for peripheral applications: recommendations from an expert consensus group. Circulation. 2004, 110 (16) pp.2498-2505 |
[235] | Kolandaivelu K., Leiden, Benjamin B., Edelman, Elazer R. Predicting response to endovascular therapies: Dissecting the roles of local lesion complexity, systemic comorbidity, and clinical uncertainty. J. Biomech. 2014, 47 pp.908-921 |
Искусственные желудочки сердца | |
[236] | Schoen F.J. Anderson J.M., Didisheim P., Dobbins J.J., Gristina A.G., Harasaki H., Simmons R.L. Ventricular assist device (VAD) pathology analyses: guidelines for clinical studies. J. Appl. Biomater. 1990, 1 pp.49-56 |
[237] | Wagner W.R. Schaub R.D., Sorensen E.N., Snyder T.A., Wilhelm C.R., Winowich S., Borovetz H.S., Kormos R.L. Blood biocompatibility analysis in the setting of ventricular assist devices. J. Biomater. Sci. Polym. Ed. 2000, 11 pp.1239-1259 |
УДК 615.46:002:006.354 | МКС 11.020 | IDT |
Ключевые слова: изделия медицинские, гемосовместимость, система свертывания, система комплемента, гемолиз, тромбоз, тромбоэмболия, активация тромбоцитов, гематология | ||
Электронный текст документа
и сверен по:
, 2020