ГОСТ Р ИСО 20395-2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
БИОТЕХНОЛОГИЯ
Требования к оценке эффективности методов количественного определения последовательностей нуклеиновых кислот-мишеней. Количественная ПЦР и цифровая ПЦР
Biotechnology. Requirements for evaluating the performance of quantification methods for nucleic acid target sequences. qPCR and dPCR
ОКС 07.080
Дата введения 2024-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Российский институт стандартизации" (ФГБУ "Институт стандартизации") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 326 "Биотехнологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 17 августа 2023 г. N 679-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 20395:2019* "Биотехнология. Требования к оценке эффективности методов количественного определения последовательностей нуклеиновых кислот-мишеней. Количественная ПЦР и цифровая ПЦР" (ISO 20395:2019 "Biotechnology - Requirements for evaluating the performance of quantification methods for nucleic acid target sequences - qPCR and dPCR", IDT).
Международный стандарт разработан Техническим комитетом ИСО/ТК 276 "Биотехнология" Международной организации по стандартизации (ИСО).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные и межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
5 ВВЕДЕН ВПЕРВЫЕ
6 Некоторое элементы настоящего стандарта могут являться объектами патентных прав
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Настоящий стандарт разработан для подтверждения аналитических требований в отношении количественного определения специфических последовательностей (мишеней) нуклеиновых кислот. Он также может быть применим для расширенного биопроизводства, биологических исследований и разработок, промышленной биотехнологии, инженерной биологии и передовой терапии, где необходимо продемонстрировать качество продукции, основываясь на измерениях и количественном определении специфических последовательностей-мишеней нуклеиновых кислот.
Количественное определение последовательностей-мишеней нуклеиновых кислот - это сквозное функциональное измерение, которое оказывает широкое воздействие на многие аспекты биотехнологии. Например, количественное определение биомаркеров нуклеиновых кислот с целью мониторинга эффективности биопроцессов и их соответствия качеству по расчетным параметрам для биофарматического производства и промышленной биотехнологии, характеристика чистоты и качества клеточных лекарственных препаратов для передовой терапии (ATMPs); оценка числа копий гена для оценивания активности и терапевтической эффективности генной терапии и аналитики контроля процессов для применения при редактировании генома и инженерной биологии.
Основополагающий метод полимеразной цепной реакции (ПЦР) изменил сферу анализа нуклеиновых кислот благодаря ее надежности и простоте. Научно-техническое развитие оборудования оказало воздействие на широкий спектр методов/приборов для количественного определения нуклеиновых кислот, основанных на ПЦР, и привело к последующему развитию таких методов, как:
- количественная ПЦР в реальном времени (кПЦР), предлагающая методы количественной оценки молекул ДНК и РНК относительно калибровочного материала или независимой пробы;
- цифровая ПЦР (цПЦР), предлагающая возможность выполнения количественного определения, отслеживаемого до СИ, посредством метода молекулярного подсчета, без необходимости построения калибровочной кривой.
Однако, проведение количественного определения нуклеиновых кислот на высоком уровне аналитического качества может быть проблематичным. Например, широко известно, что загрязненные или разложенные экстракты нуклеиновой кислоты могут повлиять на точность количественной оценки. Так же, плохо проработанный анализ кПЦР или цПЦР с низкой производительностью амплификации и специфичностью праймера может повлиять на точность количественной оценки. Кроме того, такие аспекты, как калибровочные растворы, градуировочные кривые, корректировка данных и обработка, могут оказать сильное влияние на точность количественной оценки последовательностей-мишеней нуклеиновых кислот.
Настоящий стандарт позволит улучшить достоверность получаемых данных, будет способствовать выбору и оптимизации процедур и обеспечит поддержку рабочих параметров, которые можно использовать при проведении количественного определения последовательностей-мишеней нуклеиновых кислот. Данные отраслей биотехнологии и биологической науки с высокой достоверностью измерений обеспечат взаимосогласованность данных, улучшенное качество продукции, сниженные риски и затраты и будут способствовать международной торговле.
В настоящем стандарте использованы следующие формулировки:
- "должен" указывает на требование;
- "следует" - на рекомендацию;
- "возможно" - на разрешение;
- "может" - на возможность или способность.
Более подробные данные приведены в Директивах ИСО/МЭК, часть 2.
1 Область применения
Настоящий стандарт устанавливает общие требования к оценке эффективности и обеспечению качества методов определения последовательностей нуклеиновых кислот (мишеней).
Настоящий стандарт применим к количественному определению последовательностей ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота) мишеней, используя методы амплификации либо цифровой ПЦР (цПЦР), либо количественной ПЦР в реальном времени (кПЦР). Он применяется к последовательностям-мишеням, присутствующим в молекулах нуклеиновых кислот, включая двухцепочечную ДНК (дцДНК), такую как геномная ДНК (гДНК) и плазмидная ДНК, одноцепочечную ДНК (оцДНК), комплементарную ДНК (кДНК) и одноцепочечную РНК (оцРНК), включая рибосомальную РНК (рРНК), матричную РНК (мРНК) и длинную и короткую некодирующую РНК [микроРНК (миРНК) и короткую интерферирующую РНК (киРНК)], а также двухцепочечную РНК (дцРНК).
Настоящий стандарт применим к нуклеиновым кислотам, полученным из биологических источников, таких как вирусы, прокариотические и эукариотические клетки, бесклеточные биологические жидкости (например, плазма или клетки) или лабораторных источников [например, олигонуклеотиды, синтетические генетические конструкции и транскрибированная in vitro (IVT) РНК].
Настоящий стандарт не применим к количественному определению очень коротких ДНК олигонуклеотидов (<50 оснований).
Настоящий стандарт включает:
- аналитический план, включая методы количественного определения (количественное определение числа копий нуклеиновой кислоты с использованием калибровочной кривой, как в кПЦР, или посредством подсчета молекул, как в цПЦР, количественный анализ относительно независимой пробы и пропорциональные измерения), и использование контрольных проб;
- количественную оценку общей массовой концентрации нуклеиновой кислоты и контроль качества пробы нуклеиновой кислоты, включая оценку качества нуклеиновой кислоты (чистота и целостность);
- метод ПЦР-анализа, оптимизацию, испытание на специфичность с помощью компьютерного моделирования и в лабораторных условиях;
- контроль и анализ качества данных, включая критерии приемки, установку пороговых значений и нормализацию;
- валидацию метода (прецизионность, линейность, предел количественного определения, предел обнаружения, правильность и устойчивость) по определенным требованиям для кПЦР и цПЦР;
- подходы к установлению метрологической прослеживаемости и оценке неопределенности измерений.
Настоящий стандарт не устанавливает критерии или требования к отбору проб биологического материала или обработке биологических проб (т.е. сбор, сохранность, транспортирование, хранение, обработка и экстракция нуклеиновой кислоты). Также он не устанавливает требования и критерии отбора проб для специфических областей применения (например, продукты питания или клиническое применение, где могут возникать определенные проблемы с матрицей).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения)]:
ISO/IEC Guide 98-3:2008, Uncertainty of measurement - Part 3: Guide to the expression of uncertainty in measurement (GUM:1995) [Неопределенность измерения. Часть 3. Руководство по выражению неопределенности измерения (GUM:1995)]
ISO/IEC Guide 99, International vocabulary of metrology - Basic and general concepts and associated terms (VIM) [Международный словарь по метрологии. Основные и общие понятия и соответствующие термины (VIM)]
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
ИСО и МЭК ведут терминологические базы данных для использования в области стандартизации по следующим адресам:
- платформа онлайн-просмотра ИСО: доступна по адресу: http://www.iso.org/obp;
- Электропедия МЭК: доступна по адресу: http://www.electropedia.org/.
3.1 ампликон (amplicon): Особый фрагмент ДНК или РНК, который является продуктом технологии амплификации ДНК, таким как цепная реакция полимеризации (ПЦР).
[ИСО 13495:2013, 3.3.1]
3.2 график амплификации (amplification plot): Графическое изображение генерации сигнала репортера (как правило, флуоресцентного) во время реакции кПЦР или цПЦР
Примечание 1 - Для систем кПЦР и некоторых систем цПЦР график амплификации показывает взаимоотношение между номером цикла (ось x) и флуоресцентным сигналом (ось y).
Примечание 2 - Для конечной точки цПЦР отображается флуоресцентный сигнал каждого разделения цПЦР. Для одного флуорофора одномерный график амплификации показывает число разделений (ось x) против конечного флуоресцентного сигнала (ось y). Многомерный график амплификации показывает флуоресцентный сигнал для каждого канала детектора на каждой оси.
3.3 калибровочная кривая; градуировочная кривая (calibration curve; standard curve): Выражение соотношения между показанием и соответствующим измеренным значением величины.
[Руководство ИСО/МЭК 99:2007, 4.31, изменено - примечания исключены]
3.4 калибратор (calibrator): Эталон, используемый при калибровке.
Примечание 1 - Термин "калибратор" используют только в определенных областях.
Пример - Пробу межпланшетного калибратора для кПЦР часто включают в каждый планшет для кПЦР в исследовании, включающем несколько планшетов для кПЦР или экспериментах, чтобы компенсировать отклонения между планшетами из-за факторов измерения приборов, таких как установки базовой линии и пороговых значений. Межпланшетный калибратор содержит целевую(ые) последовательность(и), выявляемую(ые) при ПЦР-анализе и измеренную(ые) с помощью того ПЦР-метода, что и анализируемые пробы.
[Руководство ИСО/МЭК 99:2007, 5.12, изменено - добавлен пример]
3.5 комплементарная ДНК; кДНК (complementary DNA; cDNA): Одноцепочечная ДНК, комплементарная для данной РНК и синтезированная в присутствии обратной транскриптазы для использования в качестве матрицы для ДНК амплификации.
3.6 число копий (copy number): Количество молекул (копий), содержащих определенную последовательность нуклеиновой кислоты.
[ИСО 16577:2016, 3.28, изменено - "ДНК последовательности" заменено на "содержащих определенную последовательность нуклеиновой кислоты"]
3.7 концентрация числа копий (copy number concentration): Количество молекул (копий), содержащих определенную последовательность нуклеиновой кислоты в определенном объеме.
Примечание 2 - Цикл количественного определения основывается либо на пороговых значениях, применяемых ко всем пробам, либо на регрессионном анализе сигнала, для каждой пробы.
[ИСО 16577:2016, 3,32 изменено в соответствии с Руководством MIQE [1] - добавлены примечания 1 и 2]
3.10 цифровая ПЦР; цПЦР (digital PCR; dPCR): Процедура, при которой матрицы нуклеиновых кислот распределяются во множество ячеек номинально эквивалентного объема таким образом, чтобы некоторые ячейки содержали матрицу, а другие нет, с последующей ПЦР-амплификацией последовательностей-мишеней и детектированием специфических ПЦР-продуктов, при условии подсчета количества ячеек с положительным и отрицательным сигналами для матрицы-мишени.
Примечание 1 - Считается, что последовательности-мишени нуклеиновых кислот распределены по ячейкам случайным образом и независимо во времени процесса разделения.
Примечание 2 - Подсчет положительных и отрицательных ячеек, как правило, основывается на детектировании конечной точки ПЦР-продуктов с последующим циклическим температурным воздействием, однако, контроль кПЦР в реальном времени кумуляции ПЦР продукта также возможен для некоторых цПЦР-платформ.
3.11 требуемый ген; GOI (gene of interest; GOI): Исследуемая последовательность-мишень гена.
Примечание 1 - Основные величины цПЦР для расчета лямбды - это количество положительных ячеек (NP) и общее количество ячеек (NT).
3.13 предел количественного определения; LOQ (limit of quantification; LOQ): Наименьшая концентрация или количество последовательностей-мишеней нуклеиновой кислоты на определенный объем, которую(ый) можно измерить с приемлемым уровнем достоверности в соответствии с условиями, указанными в методе.
Примечание 1 - Как правило, выражается как (фактическое) значение сигнала или измерения, которое дает оценку с определенным коэффициентом вариации (CV).
[ИСО 16577:2016, 3.91, изменено - заменено "содержание изучаемого аналита" на "количество последовательностей-мишеней нуклеиновой кислоты", "количество матриц" на "объем" и "относительное среднеквадратическое отклонение (RSD)" на "коэффициент вариации (CV)"]
[Руководство ИСО/МЭК 99:2007, 4.18, определение для "предела обнаружения"; примечания исключены]
3.15 линейность (linearity): Способность метода анализа в определенном диапазоне давать аналитический сигнал или результаты, пропорциональные количеству последовательностей-мишеней нуклеиновой кислоты, определяемой в лабораторной пробе.
Примечание 1 - В случае кПЦР порог цикла пропорционален логарифму по основанию 10 количества последовательностей-мишеней нуклеиновой кислоты.
Примечание 2 - Термин "линейность" часто связан с диапазоном линейности метода и означает способность метода предоставить сигнал или результат, прямо пропорциональный концентрации последовательности-мишени нуклеиновой кислоты.
[ИСО 16577:2016, 3.92, изменено - добавлены примечания 1 и 2; "количество аналита" заменено на "количество последовательностей-мишеней нуклеиновой кислоты"]
3.16 измеряемая величина (measurand): Величина, подлежащая измерению.
Примечание 1 - Спецификация измеряемой величины требует знаний рода величины, описания явления, тела или вещества, которым присуща эта величина, включая любые существенные составляющие, в том числе и химические.
Примечание 2 - Во втором издании VIM и в МЭК 60050-300:2001 измеряемая величина определяется как "величина, являющаяся объектом измерения".
Примечание 3 - Измерение, включая измерительную систему и условия, при которых оно выполняется, может изменить явление, тело или вещество таким образом, что измеренная величина может отличаться от измеряемой величины по определению. В этом случае необходимо вводить соответствующую поправку.
Пример 1 - На количество гена-мишени, измеренного с помощью ПЦР, влияет длина ампликона ПЦР-анализа и размер фрагмента матрицы (~ < длина ампликона).
Пример 2 - Денатурация ДНК в пробе в ssDNA влияет на количественное определение с помощью цПЦР, так как две нити разделены.
[Руководство ИСО/МЭК 99:2007, 2.23, изменено - изменены примечание 3 и примеры, и исключено примечание 4]
3.17 кривая плавления (melting curve): Анализ, описывающий характеристики диссоциации двухцепочечной ДНК, наблюдаемой при нагревании.
[ИСО 16577:2016, 3.107, изменено - исключено примечание 1]
[ИСО 16577:2016, 3.108]
3.19 матричная [информационная] РНК; мРНК (messenger RNA; mRNA): Подтип рибонуклеиновой кислоты, служащий матрицей для синтеза белка.
3.20 безматричный контроль; NTC (no template control; NTC): Контролируемая реакция, содержащая все реактивы, за исключением экстрагированной пробы матричной нуклеиновой кислоты.
Примечание 1 - Эта контролируемая реакция используется для демонстрации отсутствия загрязняющих нуклеиновых кислот. Вместо матричной ДНК, например, в реакцию добавляют соответствующий объем воды, не содержащей нуклеиновых кислот. Иногда используют термин "контроль ПЦР-реактива".
3.22 ячейки (partitions): Капли или полости номинально эквивалентного объема, в которых смесь цПЦР реагентов случайным образом распределяется, а затем амплифицируется с помощью ПЦР.
3.23 ПЦР-анализ; анализ (PCR assay, assay): Метод измерения кПЦР (см. 3.25) или цПЦР (см. 3.10) с использованием заданных олигонуклеотидных праймеров (и, в некоторых случаях, зонда или зондов), который используется для идентификации и/или количественного определения целевых нуклеиновых кислот.
3.24 эффективность ПЦР E (PCR efficiency E): Фракции молекул, амплифицируемые в каждом цикле ПЦР.
Пример - Если пробирка содержит 100 молекул-мишеней, а после одного цикла ПЦР содержит 180 молекул, то E = 0,8. Вычисленный коэффициент амплификации регистрируют как процент или долю от 1. А 100%-ная эффективность равна удвоению ампликона в течение каждого цикла.
3.25 количественная ПЦР в реальном времени; кПЦР (quantitative real-time PCR; qPCR): Энзиматическая процедура, сочетающая амплификацию специфических сегментов ДНК in vitro с количественной оценкой специфических ПЦР продуктов в процессе амплификации.
Примечание 1 - В то время как ПЦР воспроизводит копии соответствующей ДНК последовательности, флуоресцентный маркер флуоресцирует прямо пропорционально количеству присутствующей ДНК (что теоретически может быть рассчитано путем обратных вычислений для получения исходного количества определенной ДНК, присутствующей в пробе перед началом ПЦР).
[ИСО 16577:2016, 3.162, изменено - слово "количественная" добавлено к термину, а "количественная оценка" к определению]
3.26 референсный ген; эндогенный ген (reference gene; endogenous gene): Ген-мишень, присутствующий в каждой пробе в приблизительно равной концентрации, который устойчив к ответной флуктуации в связи с изменениями в биологических условиях или условиях исследования, или стабилен в определенных видах или таксоне.
Примечание 1 - Референсные гены традиционно считались генами "домашнего хозяйства". Однако при измерении РНК, могут использоваться мишени, которые не считаются генами домашнего хозяйства; следовательно, ссылочный термин сейчас - это референсный ген [1].
3.27 обратная транскрипция; RT (reverse transcription; RT): Процесс получения кДНК из матрицы РНК, используя ферментативную активность ревертазы, связанной с одним или более олигонуклеотидным праймером при подходящем наборе условий.
[ИСО 16577:2016, 3.180, изменено - "ДНК" заменено на кДНК"]
3.28 эффективность обратной транскрипции; эффективность RT (reverse transcription efficiency; RT efficiency): Соотношение молекул РНК, преобразованных в кДНК, выраженное в процентах.
Пример - Эффективность RT 80% означает, что 80% матриц РНК были преобразованы в кДНК.
3.29 отрицательный контроль RT [RT minus control; RT(-)]: ПЦР с обратной транскрипцией, содержащая матричную нуклеиновую кислоту испытуемой пробы и все реагенты амплификации, за исключением энзимов ревертазы.
Примечание 1 - Отрицательный контроль RT используют при количественной оценке РНК и фоновых величин, получаемых из остаточной геномной ДНК в пробе.
3.30 цПЦР с обратной транскрипцией; RT-цПЦР (reverse transcription dPCR; RT-dPCR): Процесс, с помощью которого нить РНК сначала обратно транскрибируется в свой ДНК-комплемент (комплементарная ДНК или кДНК) с использованием ревертазы, и результатирующая кДНК амплифицируется с помощью цПЦР
Примечание 1 - Этот процесс может быть одно- или двухэтапным.
Примечание 2 - При одноэтапной RT-цПЦР этапы RT и цПЦР амплификации выполняют один за другим в одной пробирке с ген-специфическими праймерами.
Примечание 3 - При двухэтапной RT-цПЦР этапы RT и цПЦР амплификации выполняют как две независимые реакции. В данном случае этап RT может использовать неспецифические праймеры (т.е. смесь олиго-dT праймеров и/или случайных олигонуклеотидов) для получения глобальной кДНК популяции из всех матриц в пробе РНК. кДНК затем используют для последующего анализа с помощью цПЦР и исследуют на интересующие последовательности с помощью ген-специфических ПЦР-праймеров.
3.31 количественная ПЦР с обратной транскрипцией; RT-кПЦР (reverse transcription qPCR; RT-qPCR): Процесс, с помощью которого нить РНК сначала обратно транскрибируется в свой ДНК-комплемент (комплементарная ДНК или кДНК) с использованием ревертазы, и результатирующая кДНК амплифицируется с помощью кПЦР.
Примечание 1 - Этот процесс может быть одно- или двухэтапным, также как и в случае с RT-цПЦР.
[ИСО 16577:2016, 3.181 изменено - добавлено примечание]
3.32 проба (sample): Небольшая часть или количество, взятые из популяции или партии, в идеале представляющие собой репрезентативную выборку из всего материала.
[ИСО 16577:2016, 3.185]
3.33 специфичность; аналитическая специфичность (specificity; analytical specificity): Способность методики измерения самостоятельно определить величину, которую необходимо измерить с ее помощью.
Пример - Специфичность ПЦР-анализа представляет собой его способность детектировать исключительно намеченные мишени, и чтобы на количественную оценку мишени не оказывала влияние перекрестная специфичность родственных или потенциально мешающих нуклеиновых кислот или условий, относящихся к пробе.
[ИСО 15193:2009, 3.9, изменено - добавлен пример]
3.34 одиночный нуклеотидный полиморфизм; SNP (single nucleotide polymorphism; SNP): Однонуклеотидные позиции в генетической последовательности, встречающиеся с ощутимой частотой в популяции.
[ИСО 25720:2009, 4.23]
3.35 однонуклеотидная вариация; SNV (single nucleotide variant; SNV): Вариация последовательности ДНК, встречающаяся, когда одиночный нуклеотид, A, T, C или G, в геноме (или другая последовательность-мишень) отличается в матрицах.
3.36 последовательность-мишень; последовательность-мишень нуклеиновой кислоты (target sequence; nucleic acid target sequence): Специфическая последовательность ДНК, предназначенная для детектирования, например, с помощью ПЦР.
[ИСО 16577:2016, 3.203]
3.37 матрица (template): Нить ДНК или РНК, задающая нуклеотидную последовательность вновь синтезированной нити ДНК или РНК, из которых две нити являются комплементарными.
[ИСО 16577:2016, 3.206]
3.38 испытуемая проба (test sample): Проба, подготовленная для испытания или анализа, всю или часть которой используют для испытания или анализа одновременно.
[ИСО 16577:2016, 3.210]
3.39 общая нуклеиновая кислота (total nucleic acid): Общее количество нуклеиновой кислоты в пробе после экстракции нуклеиновой кислоты, выраженное как концентрация по массе.
Примечание 1 - Общая нуклеиновая кислота относится к ожидаемому большинству видов в определенном экстракте (например, ДНК или РНК).
4 План проведения определения
4.1 Общие положения
План проведения количественного определения нуклеиновой кислоты должен включать выбор соответствующего типа и количества проб, этапы процесса ауторепродукции, контроль, который необходимо включить, потребность в методе случайного отбора проб и стандартную схему определения. Особые факторы, которые необходимо учитывать, приведены ниже. Оценка прецизионности анализа последовательности-мишени нуклеиновой кислоты на целевом диапазоне испытуемых проб при валидации (см. 8.2) метода анализа должна определять количество воссозданных реакций, выполненных в процессе стандартного анализа.
4.2 Метод количественного определения
4.2.1 Общие положения
Выбор методики количественной оценки будет зависеть от применения. Большая часть методологических подходов, которые можно использовать, а также требования к применению, приведены в 4.2.2-4.2.5.
4.2.2 Определение концентрации нуклеиновой кислоты с помощью количественной ПЦР с использованием калибровочной кривой
Калибровочную кривую строят, используя независимые измерительные эталоны с указанными абсолютными и относительными концентрациями [например, концентрация количества копий (копий/мкл), стандарты массового соотношения (г/кг), международная система измерений (СИ)], которые имеют такую же или аналогичную матрицу, что и испытуемые пробы.
Расхождение результатов калибровочной кривой должно отражать неопределенность измерений и распространяться на оценку неопределенности концентраций испытуемой пробы.
Калибровочные растворы должны быть равномерно распределены по диапазону концентраций, и предпочтительно выходить за его пределы [3]. Необходимо использовать минимум пять различных концентраций, каждая как минимум в двух экземплярах.
a - отрезок на калибровочной кривой;
b - наклон.
Примечание - "Абсолютное количественное определение" зачастую используется производителями оборудования в отношении оценки концентраций неизвестных проб с помощью калибровочной кривой. Это использование термина "абсолютное количественное определение" неправильное, так как калибровочную кривую строят с помощью калибровочных растворов известных концентраций.
4.2.3 Определение концентрации количества копий с помощью цПЦР с использованием подсчета молекул
цПЦР - это конечное измерение, которое дает возможность определить количество последовательностей-мишеней нуклеиновой кислоты без использования калибровочной кривой. Смесь цПЦР, содержащая испытуемый раствор, произвольно распределяется в отдельные ячейки номинально равного объема таким образом, чтобы некоторые ячейки не содержали матрицы нуклеиновой кислоты, а другие содержали одну или более матричных копий. Ячейки подвергаются термическому циклу до конечной точки, а затем считываются, чтобы определить фракции ячеек с положительной реакцией. Необходимо использовать статистику Пуассона [4] для оценки количества копий ДНК-мишени.
Объем ячейки, используемый в вычислении концентрации количества копий, должен основываться на эмпирических измерениях, выполненных при валидации оборудования или основанных на опубликованных отчетах, а неопределенность измерений объема ячейки должна быть отражена в суммарной неопределенности измерения концентрации количества копий (см. 10.4).
где D - фактор разведения по объему из испытуемого раствора в смесь цПЦР.
m - масса испытуемого раствора, мг;
Если матрица одноцепочечная, расчетная концентрация числа копий в испытуемом растворе означает концентрацию числа копий одноцепочечной матрицы. Если матрица включает конкатемер или тандемный повтор последовательности-мишени, матрицу необходимо дигерировать энзимом, имеющим участок рестрикции между последовательностями-мишенями, а не в пределах последовательности-мишени. Этап дигерирования необходим, чтобы все последовательности-мишени были независимыми и могли случайным образом распределиться в процессе разделения. Недостаточное дигерирование приведет к заниженной оценке концентрации количества копий мишени.
4.2.4 Относительное количественное определение с помощью кПЦР
где E - эффективность ПЦР;
Из-за отсутствия калибровочной кривой сравнение данных различных исследований требует включения межпланшетного калибратора или эталонной пробы, включенной в каждый планшет, чтобы нормализовать расхождения в установках пороговых значений [7].
Для измерений вариации числа копий с помощью количественной ПЦР, при условии, что амплификацию гена или делецию сравнивают с эталонным геном [7], требуется эталонная проба с известным соотношением 1:1, чтобы нормализовать возможные расхождения в эффективности количественной ПЦР между двумя ПЦР анализами.
Кроме того, процедуры измерения с помощью количественной ПЦР, применяющие методику относительной количественной оценки, должны включать дополнительную независимую эталонную пробу или эталонный контроль материала по каждому планшету количественной ПЦР, чтобы контролировать воспроизводимость метода количественного определения со временем, а также, в отличие от использования калибровочной кривой (см. 4.2.2), калибратор с независимо присвоенным значением отсутствует, и эффективность ПЦР не измеряют в каждом анализе.
Если статистическая обработка, включая предоставление доверительных интервалов или расширенную неопределенность измерений, основывается на допущении распределения, соответствующее допущение необходимо проверить на правильность. Такие проверки могут включать, например, статистическую проверку отклонения от предполагаемого распределения или проверку графика квантиль-квантиль. Необходимо сгенерировать как минимум 30 независимых единиц данных для любой проверки допущений по распределению.
Пример - Допущение нормальности необходимо проверить с помощью критерия Шапиро-Уилка или с помощью графика нормальной вероятности.
Примечание - Проверка допущений распределения не устанавливает доказательство определенного распределения. Скорее, она указывает на то, что отклонения от предполагаемого распределения не настолько большие, чтобы вызвать серьезное беспокойство относительно определенного набора данных.
Если статистический анализ выполняют с использованием логарифмически преобразованных данных, доверительные интервалы и неопределенности измерений должны регистрироваться на той же шкале. Если логарифмически преобразованные данные преобразовывают в линейную шкалу, доверительные интервалы и неопределенности измерений необходимо вычислить [8] или предоставить доказательство того, что симметричная аппроксимация доверительного интервала на линейной шкале достаточная для покрытия самого большого из двух асимметричных доверительных интервалов.
4.2.5 Определение отношения между двумя мишенями с помощью цПЦР
Для определения отношения (R) между мишенью A и мишенью B в одном и том же испытуемом растворе можно использовать двойной анализ цПЦР. При проведении исследования в условиях двойного анализа коэффициенты для объема, массы, плотности и разбавления исключают для двух мишеней, и в результате для измерения вычисляют по формуле
Более подробное руководство по величинам коэффициентов, основанным на цПЦР, приведено в [4], [7].
4.3 Метод нормализации
Методы количественной оценки, применяющие нормализацию, должны демонстрировать, что методика нормализации подходящая.
Нормализация должна минимизировать воздействие технической вариации, или "шума", чтобы способствовать определению истинной биологической вариации.
В [9] указано о систематической погрешности амплификации микроРНК (миРНК) в количественном определении, основанном на кПЦР. Это необходимо учитывать для результатов измерений нормализации микроРНК (миРНК).
Нормализация вводит поправку на коэффициенты, влияющие на пробу в целом вместо того, чтобы являться специфической для мишени нуклеиновой кислоты, и, тем самым, избегает источников искаженного измерения неспецифической вариации требуемого гена. Технические коэффициенты, контролируемые с помощью метода эффективной нормализации, включают изменчивость элементов выборки, порчу пробы при транспортировании и хранении, и выход экстракции нуклеиновой кислоты и обратную транскрипцию.
Существует множество методов нормализации технических расхождений, которые могут подойти для анализа ДНК или матричной РНК (мРНК) (экспрессия гена) [10]. Более подробное руководство по методам специфической нормализации приведено ниже.
a) Нормализация эталонных генов. Для количественной оценки геномной ДНК (гДНК), данные могут быть нормализованы к одному или более эталонным генам. Необходимо оценить много геномных локусов, чтобы убедиться, что выбранный маркер является репрезентативным для количества геномных копий [11]. Используемый(е) эталонный(е) ген(ы) необходимо оценить в части их стабильности в типах пробы.
b) Нормализация уровня экспрессии эталонных генов. Для исследования экспрессии генов целевое количество должно быть нормализовано к множественным эталонным генам в силу возможной изменчивой экспрессии в одном эталонном гене и последующей систематической погрешности в анализе GOI [1]. Эталонные гены для измерения мРНК и экспрессии миРНК должны быть эмпирически проверены в экспериментальных условиях и на типах проб, к которым применяют данный метод измерения. Можно использовать статистику для определения оптимального количества эталонных генов для нормализации [12]-[14].
c) Нормализацию уровня экспрессии всех исследуемых генов часто называют глобальной нормализацией. Этот вариант можно использовать, когда нельзя идентифицировать стабильные гены для использования в качестве эталонных (как в некоторых случаях измерения экспрессии миРНК [15] и исследованиях экспрессии одноклеточного гена), при условии, что измерено достаточно большое общее количество мишеней. Количество мишеней, необходимых для глобальной нормализации, должно быть оценено [16].
d) Нормализация количества используемого материала, в случаях, когда результат метода измерения, основанного на кПЦР или цПЦР, заявлен для определенной входной величины. Подходящие примеры - это количество клеток, объем крови или общее количество РНК. Для определенных применений, таких как основанных лишь на нескольких клетках, где экспрессия - стохастическая и входное количество определено независимо (например, с помощью микроскопирования), этот метод лучше, чем нормализация эталонных генов [17].
4.4 Контроль
К методу кПЦР или цПЦР должен применяться надлежащий контроль для оценки общего количества и надежности вырабатываемых данных. Вид контроля должен точно отражать испытуемые пробы. Методы должны устанавливать положительный и отрицательный контроль, включенный в каждый аналитический анализ. Примеры соответствующего контроля приведены в таблице 1.
Отрицательный контроль должен включаться наряду с испытуемыми пробами, чтобы и к установочному контролю ПЦР, и отрицательному контролю применялись одни и те же методы экстракции и подготовки, что и канализируемой пробе. Необходимо включить количество отрицательных контролей, а их подготовка должна перемежаться с подготовкой испытуемых проб, чтобы получить репрезентативную оценку уровня загрязнения в процессе анализа. Для методов RT-кПЦР или RT-цПЦР, отрицательный контроль должен включать RT(-)-контроль, содержащий пробы положительной РНК, которые были обработаны с помощью метода выделения РНК, который необходимо применять к испытуемым пробам.
Если применимо, чистота последовательности нуклеиновой кислоты материала положительного контроля должна проверяться с помощью глубокого секвенирования. Для материала положительного контроля, используемого для калибровки, должен указываться метод, с помощью которого определены значения величины.
Таблица 1 - Положительный и отрицательный контроль для методов количественного определения целевых нуклеиновых кислот
Тип контроля | Наименование контроля | Типовой состав | Причина включения |
Отрицательный | NTC | Реакция, содержащая воду или буферный раствор вместо матрицы нуклеиновой кислоты | Детектирование загрязнения измерения на этапе установки реакции (кПЦР/цПЦР для анализа ДНК; RT-кПЦР/цПЦР или RT для одно- или двухэтапного анализа ДНК или РНК, соответственно). Детектирование нежелательных продуктов амплификации, таких как амплифицированные первичные димеры, которые могут встречаться при использовании связывающих красителей дцДНК |
Отрицательный | Холостая проба для экстракции | Экстракция, содержащая воду или буферный раствор вместо испытуемой пробы | Контроль, осуществляемый вместе с испытуемой пробой, чтобы детектировать загрязнение на этапе экстракции |
Отрицательный | RT(-) | Реакция RT без добавления энзима RT | Амплификация гДНК (для анализа мРНК) |
Отрицательный | Специфичность | Матричная проба или контроль гДНК, не содержащий целевую матрицу | Характеристика и контроль доли ложноположительных результатов (например, 100%-ный дикий тип гДНК для количественной оценки SNV; немодифицированная разновидность для испытания ГМО) |
Положительный | Количественная оценка | Хорошо изученный биологический материал или раствор нуклеиновой кислоты | Количественная оценка функциональности компонентов реакции и оценка эффективности ПЦР-анализа. Оценка специфичности реакции для анализа генотипа с помощью анализа кривой плавления постамплификации |
Положительный | Количественная оценка | Хорошо изученный биологический материал или раствор нуклеиновой кислоты | В качестве количественного положительного контроля; также оценка количественных результатов измерения или калибровки |
Положительный | Внутренний положительный контроль | Холостая проба или матрица с добавлением чужеродной матрицы | Подтверждение того, что не имело место ингибирование реакции (контроль качества для ложноотрицательных результатов) |
Примечание - Категории контроля приведены в ИСО 24276. | |||
5 Контроль качества пробы. Количество общей нуклеиновой кислоты, целостность и чистота
5.1 Общие положения
Преаналитичекие методы и экстракция матрицы специфической нуклеиновой кислоты должны проводиться по необходимости для испытуемой пробы согласно соответствующим стандартам ИСО и руководствам, если применимо (например, серия ИСО 20184 и серия ИСО 20186).
Как правило, следует измерить общую массовую концентрацию нуклеиновой кислоты (обычно выражаемую как нг/мкл или мкг/мл), чтобы обеспечить соответствующую входную пробу на кПЦР или цПЦР, на показатели которой может повлиять вариация матрицы общей нуклеиновой кислоты реакции. Анализ деградированных проб может привести к получению данных низкого качества и неточному количественному определению. Кроме того, присутствие ингибиторов может выборочно повлиять на цПЦР и кПЦР[18].
Чтобы показать, что вводимые данные кПЦР/цПЦР стандартизированы и пробы нуклеиновой кислоты достаточно чистые, концентрированные и не содержат компонентов, которые ингибируют или увеличивают последующую кПЦР или цПЦР, необходимо описать следующие методы для характеристики очищенной пробы нуклеиновой кислоты:
- целостность нуклеиновой кислоты;
- чистоту нуклеиновой кислоты.
Если один из этих шагов или более не применимы или не целесообразны, должны быть указаны причины. Например, в некоторых информационных потоках вводные данные реакции будут нормализованы до входных величин, например, объем биологической жидкости (см. 4.3), а не общее количество нуклеиновой кислоты. Аналогичным образом, если выполняют одноклеточный анализ, количество общей нуклеиновой кислоты слишком маленькое для анализа целостности нуклеиновой кислоты, и анализ чистоты не применяют.
Используемые общие методы измерения концентрации общей нуклеиновой кислоты и оценки ее качества приведены в 5.2-5.4 вместе с требованиями к их применению.
5.2 Количественное определение общей нуклеиновой кислоты
5.2.1 Общие положения
Количественное определение общей нуклеиновой кислоты (ДНК или РНК, сообразно ситуации) может быть выполнено с помощью различных методов, включая ультрафиолетовую спектрофотометрию, флуоресцентный ДНК/РНК-анализ и кПЦР.
Однородность пробы нуклеиновой кислоты - это определяющий фактор в любом методе количественного определения. Проба нуклеиновой кислоты должна быть полностью растворена и тщательно перемешана перед проведением количественного определения. Должна быть предоставлена информация по вариации между дублирующими измерениями одной и той же пробы для типовых проб.
5.2.2 Спектрофотометрия
Нуклеиновые кислоты сильно поглощаются в УФ с максимумом в 260 нм или приблизительно указанному значению, таким образом, их можно количественно оценить путем измерения УФ-поглощения, используя спектрофотометр (см. приложение А). Необходимо учитывать следующие источники систематической погрешности, оказывающие воздействие на данный метод:
- все присутствующие виды нуклеиновых кислот участвуют в поглощении (т.е. ДНК, РНК, короткие олигонуклеотиды и свободные олигонуклеотиды), таким образом можно дать завышенную оценку концентрации интересующей нуклеиновой кислоты (например, ДНК);
- многие химические соединения поглощаются при 260 нм или приблизительно указанному значению (например, фенольные растворы, используемые для выделения или лизиса), тем самым представляя другой потенциальный источник положительной систематической погрешности.
Для того, чтобы результаты определения массовой концентрации прослеживались до СИ, необходима калибровка с помощью сертифицированного стандартного образца с составом, аналогичным составу испытуемой пробы.
5.2.3 Флуорометрия
Использование флуоресцентных красителей для количественного определения общей нуклеиновой кислоты - это альтернативный метод количественной оценки. Флуоресцентные методы зависят от характеристик флуоресценции небольших молекул или красителей при связывании с нуклеиновой кислотой. Необходимо учитывать потенциальные источники систематической погрешности, оказывающие воздействие на флуоресцентные методы, включая:
- состояние денатурации нуклеиновой кислоты;
- деградацию нуклеиновой кислоты, так как некоторые красители преимущественно связываются с молекулами, превышающими определенный размер;
- температуру;
- PН;
- воздействие УФ-света (фотообесцвечивание);
- химические загрязнители, которые могут повлиять на эффективность связывания (необходимо проверить информацию поставщика);
- химические загрязнители, которые вызывают гашение флюоресценции, так как это значительно влияет на флуорометрические показания. Тяжелые ионы, такие как анионы йодина или катионы цезия, а также нейтральные молекулы, такие как акриламиды, могут действовать как гасители.
Измерения связаны с калибровочным материалом или стандартным раствором нуклеиновой кислоты, следовательно, погрешность измерений зависит от точности значения, присвоенного калибровочному материалу, и от сходства состава испытуемой пробы и калибровочного материала. Также необходимо включить оценку положительного и отрицательного контроля.
5.2.4 Оценка концентрации общей ДНК с помощью кПЦР/цПЦР
кПЦР и цПЦР могут использоваться для количественного определения общей ДНК специфического таксономического назначения, например общая ДНК человека, общая бактериальная ДНК, общая грибковая ДНК, путем использования праймеров соответствующей таксономической специфичности в сочетании с преобразованием в массовую концентрацию, используя значение величины генома организма. В соответствии с данным методом измеряют количество амплифицируемой ДНК, не обязательно концентрации общей ДНК в пробе, следовательно, результаты необходимо интерпретировать вместе с информацией по целостности (см. 5.3) и чистоте (см. 5.4) пробы.
К методам, основанным на кПЦР/цПЦР, относительно количественного определения общей ДНК применяют следующие требования:
- специфичность: Должны быть предоставлены данные по специфичности ПЦР-анализа, включая коммерческие ПЦР-анализы. Для видоспецифических праймеров должно быть продемонстрировано отсутствие гомологии с другими видами. Для праймеров и зондов известных последовательностей специфичность необходимо проверять в соответствии с 6.1.4 и 6.2.5;
- метрологическая прослеживаемость: Для прослеживаемого количественного определения общего количества копий гДНК или массовой концентрации, калибровочная кривая должна основываться на эталонном материале, анализированном в отношении массовой концентрации и количества геномных копий на единицу объема. Должен быть указан источник эталонного материала;
- коммутативность калибрующего вещества: Эффективность ПЦР калибрующего вещества должна быть такой же, как эффективность ПЦР анализируемой пробы;
- отсутствие ПЦР-ингибирования: Отсутствие ингибирования в анализируемой пробе (см. 5.4);
- длина ампликона ПЦР-анализа для измерения общей концентрации ДНК должна соответствовать планируемому последующему анализу кПЦР/цПЦР, т.е. быть схожей по длине ампликона или сопровождаться свидетельствами целостности нуклеиновой кислоты.
5.3 Целостность нуклеиновой кислоты
Целостность нуклеиновой кислоты влияет на точность количественного определения специфических последовательностей-мишеней, и должна быть предоставлена информация, относящаяся к целостности пробы.
Методы, обычно используемые для оценки целостности пробы нуклеиновой кислоты с примерами применения, приведены в приложении В. Самые распространенные методы - это гель-электрофорез (капиллярный и блочный) и измерение ампликонов с разными размерами. Необходимо обратить внимание на положительный контроль и калибровочные материалы, используемые для принятия/отбрасывания целостности нуклеиновой кислоты в испытуемой пробе или для количественной оценки ее целостности. Примеры могут включать пробы высокого качества как положительный контроль для гель-электрофореза или интактную матрицу плазмиды для соотношения 5’/3’ или анализ ампликонов различных размеров. Кроме того, показатели методов измерения последующих кПЦР или цПЦР с испытуемыми пробами различной целостности необходимо анализировать, чтобы установить критерии целостности нуклеиновой кислоты.
5.4 Чистота нуклеиновой кислоты
Необходимо определить чистоту нуклеиновой кислоты. Это может включать, без ограничения, проверку:
- отсутствия мешающих химических примесей: органический растворитель, компоненты гликана и протеина, переносимые из матрицы пробы или на этапе экстракции;
- отсутствия загрязняющей гДНК в пробе РНК (по желанию на наличие РНК в пробе ДНК).
Могут быть применены различные подходы, включая, без ограничения:
a) УФ-спектрофотометрия. Присутствие потенциально загрязняющих органических веществ можно грубо определить, измерив показатели поглощения при 280 и 230 нм для протеинов, и при 230 нм для хаотропных солей и фенола. Критические параметры - это коэффициент поглощения от 260 до 280 нм и коэффициент поглощения от 260 до 230 нм (см. приложение А). Данный подход ограничен пробами с достаточной концентрацией для количественного определения общей нуклеиновой кислоты с помощью УФ-спектрофотометрии (см. 5.2.2).
c) Флюорометрический метод с определением специфичности для РНК или ДНК (см. 5.2.3).
d) Контролируемые реакции RT(-) или анализ, нацеленный на гДНК, также подходят для определения загрязнения гДНК в пробе РНК (см. 6.3.2).
Применения методов анализа чистоты нуклеиновой кислоты для ряда клинических препаратов приведены в [20].
6 Метод анализа и оптимизация для количественного определения последовательностей-мишеней нуклеиновой кислоты
6.1 Метод анализа
6.1.1 Общие положения
Требования к количественной оценке РНК и ДНК с помощью методов анализа цПЦР/RT-цПЦР и кПЦР/RT-кПЦР приведены ниже.
Примечание - В [21] также приведено руководство.
6.1.2 Выбор ампликона
Более короткие амликоны, как правило, амплифицируются с большей эффективностью, чем более длинные, но они должны иметь достаточную длину, чтобы в достаточной степени отличаться от возможных первичных димеров при использовании детектирования с помощью флюоресцентного красителя. Рекомендуется ампликон длиной 250 п.о. (bp) или менее для большинства цПЦР- и кПЦР-анализов. Необходимо избегать области, богатые GC, повторяющиеся области и области с общеизвестными SNP, за исключением случаев, когда целью является дифференциальное детектирование SNP [22]. Последовательности между праймерами должны дать результативный и специфический участок для связывания зондом, если используется химическое детектирование с помощью зонда.
Примечание - База данных точечных нуклеотидных полиморфизмов (dbSNP) - это курируемая база данных широко известных SNP в геноме человека. См. [23].
6.1.3 Создание праймера и зонда
Праймеры создают при температуре отжига от 50°C до 68°C, и они должны содержать от 40% до 60% содержания GC, при этом у них должны отсутствовать любые значимые вторичные структуры [22]. В оптимальном варианте, расхождение между температурами отжига пары праймеров должно составлять от 1°C до 2°C.
Длина зонда должна составлять <30 оснований. При использовании гидролизуемого зонда температура отжига зонда должна быть не менее чем на 5°C выше, чем температура праймеров. Кроме того, следует избегать гуанина на 5’-конце зонда из-за возможности гашения сигнала флуоресценции. Температура плавления зонда может быть увеличена за счет использования связующих веществ с малой бороздкой или модифицированных нуклеотидов (таких как закрытые нуклеиновые кислоты).
6.1.4 Оценка специфичности in silico
Анализы ПЦР должны быть разработаны для обеспечения специфичности, а специфичность должна проверяться с помощью компьютерного моделирования (in silico).
Праймеры и зонды ПЦР, предназначенные для целевой последовательности, также могут связываться с аналогичными последовательностями (например, гомологичными генами в пределах одного генома), если последовательности совпадают или отличаются всего на несколько пар оснований от нецелевой мишени. Если область между парой праймеров достаточно мала [<500 п.о. (bp)], ампликон может быть получен во время ПЦР. В этом случае может случиться так, что анализ не является специфичным для гена-мишени, поскольку нецелевая матрица может способствовать репортерному сигналу, если он присутствует. Добавление зонда в порядок проведения определения может улучшить специфичность.
Чтобы оценить специфичность по отношению к последовательности ампликона-мишени, праймеры и зонды должны быть проверены в сравнении с базой данных эталонов транскриптов или базой данных геномов на наличие необходимых матриц и базой данных (базами данных) возможных загрязняющих матриц (например, используя [24]). В случае идентификации потенциального нецелевого продукта ПЦР при первоначальном скрининге in silico должна быть оценена гомология последовательности зонда с возможным ампликоном, полученным в результате неспецифического связывания пары праймеров (например, с точки зрения числа несоответствий) для информирования о специфичности анализа на основе зонда.
микроРНК (миРНК) часто образуют семейства близкородственных последовательностей, которые могут отличаться только на 1-2 п.о. (bp), поэтому специфичность анализа микроРНК (миРНК) должна быть проверена in silico по сравнению с другими членами того же семейства микроРНК (миРНК), чтобы предсказать степень перекрестной реактивности и предоставить информацию для тестирования in vitro (см. 6.2.5). Следует также верифицировать специфичность анализа зрелой микроРНК (миРНК) по сравнению с первичной и исходной формами микроРНК (миРНК).
Примечание - База данных miRBase [25] представляет собой доступную для поиска базу данных опубликованных последовательностей миРНК и аннотаций, которая предоставляет информацию о последовательностях и семействах миРНК. Версии miRBase после miRBase16 могут содержать ложные миРНК, которые были идентифицированы с помощью NGS из-за небольших фрагментов РНК при подготовке библиотеки [26].
6.1.5 Метод RT-кПЦР/RT-цПЦР
Для количественного определения РНК эффект загрязнения gDNA в испытуемой пробе должен быть сведен к минимуму путем выбора областей, которые являются уникальными для последовательности РНК, если это возможно.
Пример - Для мишеней мРНК, которые подвергаются сплайсингу интронных последовательностей, анализ RT-кПЦР или RT-цПЦР может быть разработан с использованием праймеров, которые охватывают экзон-экзонные границы.
Анализ специфичности in silico должен включать поиск BLAST (средство поиска основного локального выравнивания) конкретной эталонной геномной последовательности. Влияние перекрестной реактивности должно быть охарактеризовано во время анализа специфичности (см. 6.2.5) и оптимизации метода с испытуемой пробой (см. 6.3.2).
Для методов RT, в которых для синтеза кДНК используют прайминг на основе олиго-dT, может возникать 3’-смещение из-за фрагментации транскрипта мРНК или снижения процессивности энзима RT по направлению к 5’-концу молекулы. Поэтому следует также учитывать расположение ампликона в транскрипте.
6.2 Оптимизация анализа с использованием очищенных проб
6.2.1 Общие положения
Показатели количественного определения нуклеиновых кислот должны быть оптимизированы. Требования к параметрам метода, которые следует учитывать для получения оптимизированных характеристик анализа, включая выходной сигнал, эффективность и специфичность ПЦР, перечислены ниже.
Анализы, основанные на количественном определении нуклеиновых кислот, можно приобрести у ряда коммерческих поставщиков. Анализы должны быть валидированы каждой лабораторией, прежде чем они будут использоваться в аналитических целях. Заявления поставщиков, касающиеся проведения анализов, должны проверяться на месте, и для получения оптимизированных результатов анализа может потребоваться проведение дополнительных анализов.
Идеальные материалы положительного контроля (см. 4.4) для начальной оптимизации анализа (см. 6.2.2, 6.2.3, 6.2.4) представляют собой простые матричные молекулы (например, плазмиды, олигонуклеотидные конструкции, РНК, транскрибированные in vitro), содержащие только интересующую область-мишень. Оптимизация анализа миРНК может быть выполнена с использованием синтетических олигонуклеотидов РНК той же последовательности. Они дополняют материалы положительного контроля с более сложной нуклеиновой кислотой (например, гДНК, общая РНК из клеточных линий), которые содержат возможные перекрестно-реактивные последовательности (например, псевдогены; изоформы транскриптов), что позволяет оценить специфичность (см. 6.2.5).
6.2.2 Оптимизация сигнала флуоресценции
Первоначальная оптимизация анализа кПЦР или цПЦР должна включать испытание диапазона температур отжига ПЦР, количества циклов ПЦР и концентраций праймеров/зондов для определения оптимальных условий для вывода флуоресцентного сигнала.
6.2.3 Эффективность амплификации (RT)-кПЦР
После оптимизации основных параметров анализа (см. 6.2.2) должна быть определена эффективность ПЦР-процедуры измерения, основанной на кПЦР или RT-кПЦР.
Эффективность ПЦР оценивают путем анализа калибровки или серии разведений ДНК (кПЦР) или РНК (RT-кПЦР) во время анализа (см. приложение С). Для RT-кПЦР необходимо выполнить калибровку РНК или серию разведений, поскольку это позволяет провести валидацию одинаковой эффективности RT в применимом линейном диапазоне анализа [28]. Для анализа RT-кПЦР эффективность ПЦР с калибровкой ДНК или серией разведений также может быть проанализирована для сбора информации об эффективности ПЦР-праймеров независимо от этапа RT.
Примечание - Теоретически эффективность ПЦР не может превышать 100%, поскольку количество молекул матрицы не может быть увеличено более чем в два раза в каждом цикле. Однако наблюдаемая эффективность ПЦР, вычисленная с помощью регрессионного анализа, может случайно превысить 100%. Если наблюдаемая эффективность ПЦР неоднократно превышает 100%, это может быть связано с присутствием ингибирующих веществ (см. 6.3.1) или артефактом в образцах стандартной кривой или параметрах анализа данных (см. приложение C).
6.2.4 Эффективность RT
Эффективность RT может сильно различаться [29]-[31], поэтому эффективность RT следует оценивать во время оптимизации анализа. Доказательства оптимизации эффективности RT могут включать:
- сравнение альтернативных энзимов/наборов RT [31];
- количественную оценку эффективности RT с использованием транскрибируемых in vitro РНК-матриц [30], [32].
Из-за короткой длины миРНК и киРНК методы, направленные на эти молекулы, обычно включают модифицированную стадию RT, включающую удлинение молекулы миРНК или праймеров "петля-на-стебле", чтобы удлинить последовательность-мишень до длины, подходящей для ПЦР-амплификации. Влияние метода миРНК RT на эффективность RT и специфичность анализа (см. 6.2.5) можно оценить путем сравнения альтернативных подходов во время оптимизации метода.
6.2.5 Специфичность
Должны быть оценены специфичность анализа к предполагаемой мишени и потенциальная перекрестная реактивность с гомологичными последовательностями (например, последовательностями SNP/SNV, псевдогенами, паралогами или ортологами), которые могут присутствовать в типовой биологической пробе. Для анализов, нацеленных на эукариотические геномные области, специфичность RT-кПЦР или RT-цПЦР для предполагаемого транскрипта РНК также следует оценивать путем испытания с использованием пробы гДНК. Специфичность анализа miRNA должна быть проанализирована в отношении синтетических олигонуклеотидов РНК, близкородственных для миРНК. Анализ специфичности праймера/зонда in silico (см. 6.1.4) может дать информацию для испытаний "мокрыми" лабораториями.
Измерения материалов положительного контроля (см. 4.4) следует сравнивать с измерениями аналогичных вводимых количеств близкородственных матриц, которые вероятно будут присутствовать в пробе. Для повышения специфичности анализа может потребоваться изменение температуры отжига ПЦР (см. 6.2.2).
Анализ кривой плавления также может быть выполнен в качестве доказательства специфичности праймера. Анализ кривой плавления представляет собой пост-ПЦР-анализ, выполняемый для оценки специфичности амплифицированных продуктов на основе их характеристик плавления. Реакции, проводимые в присутствии красителей, связывающих двухцепочечную ДНК (дцДНК), инкубируют в диапазоне повышающихся температур. Для детектирования одной последовательности-мишени нуклеиновой кислоты на графике производных должен наблюдаться один пик, что свидетельствует о том, что в реакции был получен один ампликон.
Для анализа должна быть вычислена доля ложноположительных результатов анализа, выраженная как доля (%) целевой концентрации матрицы или количества на реакцию. Частота ложноположительных результатов необходима для установления предела обнаружения LOD (см. 8.4).
6.3 Оптимизация метода с использованием испытуемых проб
6.3.1 Влияние ПЦР-ингибиторов на матрицу пробы
Пробы нуклеиновой кислоты, содержащие ингибирующие соединения (например, реагенты для приготовления проб, избыточный белок), могут привести к частичному или полному ингибированию последующей ПЦР. На присутствие ПЦР-ингибиторов также могут указывать спорадическая или поздняя амплификация, плохая воспроизводимость и нелинейность калибровочной кривой. Кроме того, в дополнение к оценке основных примесей химических веществ или нуклеиновых кислот, приведенных в 5.4, необходимо оценить влияние матрицы пробы на специфический анализ кПЦР/цПЦР, поскольку наблюдалась различная чувствительность анализов к ингибиторам [33].
Требования для измерения влияния матрицы пробы на показатели анализа и оценки специфического ингибирования ПЦР включают, без ограничения, следующее:
- количественное определение внутреннего контроля ПЦР, несущего последовательность-мишень нуклеиновой кислоты, такой как контрольный ампликон, плазмида, очищенная гДНК. Наличие и степень ингибирования (или усиления) можно определить путем приготовления контрольных реакций, содержащих:
a) внутренний контроль ПЦР, добавленный к экстрагированной матрице пробы;
b) только внутренний контроль ПЦР (т.е. в отсутствие экстрагированной пробы/матрицы);
c) только экстрагированная матрица пробы (т.е. без внутреннего контроля ПЦР) для измерения фоновой концентрации нуклеиновой кислоты-мишени (если она присутствует).
Для проверки статистической значимости с использованием соответствующего испытания (например, t-критерий) необходимо подготовить как минимум три повторения каждой контрольной реакции. При отсутствии модификации результатов анализа матрицей пробы количество целевой нуклеиновой кислоты, измеренное в контрольной пробе 1, равно сумме количеств, измеренных в контрольных пробах 2 и 3, в то время как если анализ ингибируется (или усиливается) матрицей пробы, количество в контрольной пробе 1 будет значительно меньше (или больше), чем сумма количеств, измеренных в контрольных пробах 2 и 3;
- анализ кинетики отдельных реакций [34] и/или расчет эффективности амплификации с использованием серии разведений [35], [36].
6.3.2 Наличие примесей нуклеиновых кислот в испытуемой пробе
Чувствительность анализа RT-кПЦР или RT-цПЦР к загрязнению гДНК (перенесенному с этапа экстракции) должна быть оценена, как описано в 6.1.5 и 6.2.5. Присутствие загрязняющей gDNA в испытуемой пробе следует идентифицировать с помощью RT(-)-контроля (см. 4.4). Следует избегать загрязнения гДНК с помощью использования ДНКазы (DNAse) в процессе подготовки РНК.
6.3.3 Валидированный диапазон измерений
Должен быть описан валидированный диапазон измерений для метода, который охватывает предел обнаружения LOD (см. 8.4), и указан линейный диапазон метода (см. 8.5).
Чтобы установить валидированный диапазон измерения метода, необходимо изучить ответную реакцию эталонных материалов (или, если эталонные материалы недоступны, собственных проб или проб с добавками), концентрации которых перекрывают интересующий диапазон и достигают предельного разведения.
Для количественного определения концентрации с помощью кПЦР с использованием калибровочной кривой (см. 4.2.2) количество целевой нуклеиновой кислоты в испытуемых пробах должно находиться в пределах диапазона концентраций, охватываемого калибровочной кривой.
Для цПЦР валидированный диапазон измерений должен быть указан как диапазон копий на реакцию (или значений ламбда), поскольку среднеквадратическая погрешность оценки концентрации Пуассона (см. 4.2.3) варьируется в зависимости от доли положительных ячеек [37], [38].
6.4 Контроль без матрицы
Все NTC и отрицательные контроли процессов не должны демонстрировать признаков ПЦР-амплификации. Любые неотрицательные результаты (например, праймер-димер для методов с использованием интеркалирующих красителей) должны быть подкреплены доказательствами (например, с использованием анализа кривой плавления в 6.2.5).
7 Контроль качества данных (QC) и анализ данных
7.1 Общие положения
Анализ данных включает изучение исходных данных, оценку их качества и надежности, установку порога флуоресценции и предварительную обработку экспортированных исходных данных.
7.2 Критерии соответствия
7.2.1 кПЦР
Графики амплификации кПЦР обычно показывают сигмоидальную кривую отклика, соответствующую трем фазам амплификации:
a) амплификация матрицы, которая ниже предела обнаружения флуоресцентного сигнала;
b) экспоненциальная амплификация, подтверждаемая линейным наклоном в зависимости от числа циклов;
c) плато, где компоненты реакции становятся предельными; возможно, что последний будет отсутствовать в испытуемых пробах, где фаза b) проявляется на последнем числе цикла.
Процедуры измерения должны включать оценку кривых амплификации испытуемых проб для подтверждения вышеупомянутых фаз амплификации и сравнение флуоресцентных сигналов базовой линии и фазы плато с сигналами проб положительного и отрицательного контроля (см. 4.4).
7.2.2 цПЦР
Для цПЦР на основе чипа анализ изображения должен отображать равномерную дисперсию пассивного эталонного красителя по ячейкам и отсутствие пузырьков воздуха внутри чипа. Кроме того, случайное распределение положительных и отрицательных результатов должно быть подтверждено визуально.
Для капельной цПЦР минимальное количество принимаемых капель должно соответствовать рекомендациям производителя или заданным пользователем значениям. Критерии качества, связанные с амплитудой флуоресценции капель, должны включать:
- на графике зависимости амплитуды флуоресценции капель от числа капель не должны присутствовать полосы капель с амплитудой флуоресценции ниже отрицательного кластера капель или выше положительного кластера капель, поскольку они могут указывать на аномалии в размере капель;
- на графике зависимости амплитуды флуоресценции капель от количества капель для повторных анализов цПЦР сдвиг амплитуды флуоресценции положительных и отрицательных кластеров капель между повторами должен быть минимальным;
- доля капель с промежуточной флуоресценцией (между отрицательными и положительными кластерами капель) должна быть минимизирована во время оптимизации анализа (см. 6.2). Долю капель с промежуточной флуоресценцией необходимо контролировать и учитывать в погрешности измерения (см. 10.4).
7.3 Установка пороговых значений
7.3.1 кПЦР
Пороговые значения должны устанавливаться:
- значительно выше базовой линии фоновой флуоресценции, чтобы быть уверенным в том, что любая кривая амплификации не пересечет порог преждевременно из-за фоновой флуоресценции;
- как можно ниже, чтобы гарантировать, что порог пересекает логарифмически-линейную фазу кривой амплификации, где на него не влияет фаза плато;
- на фиксированном уровне для всех проб, измеренных одним и тем же методом на одном и том же планшете.
7.3.2 цПЦР
Положительные и отрицательные контрольные материалы (см. 4.4) последовательности высокой чистоты имеют решающее значение для установки порогового значения цПЦР и должны быть интегрированы в рабочий процесс для установки порогового значения и категоризации ячеек с промежуточной флуоресценцией (так называемый "дождь"), для которых существует несколько подходов [41]-[43].
7.4 Первичная обработка данных
7.4.1 кПЦР с использованием калибровочной кривой
Приемлемые пределы наклона калибровочной кривой должны быть указаны на основании доверительного интервала, определенного для эффективности ПЦР во время оптимизации анализа (см. 6.2.3).
7.4.2 Относительное количественное определение (кПЦР)
Эффективность анализа должна быть скорректирована при вычислении относительных величин [5] (см. 4.2.4).
Полный рабочий процесс шагов первичной обработки для метода относительного количественного определения зависит от применения. Например, в исследованиях экспрессии отдельных клеток транскрипты-мишени зачастую экспрессируются гетерогенно и отсутствуют в части проб отдельных клеток, что требует использования подходов для обработки отсутствующих данных [6].
7.5 Идентификация выбросов
Данные необходимо проверять на наличие выпадающих значений, например, с помощью критериев Диксона или теста Грабба. При наличии нескольких выбросов следует проводить проверки, предназначенные для обнаружения множественных выбросов.
Примечание - В ИСО 16269-4 приведено руководство по обнаружению и обработке выбросов.
8 Валидация метода количественного определения нуклеиновых кислот
8.1 Общие положения
Метод количественного определения нуклеиновых кислот (кПЦР и цПЦР) должен быть валидирован. В ИСО 5725-1 приведено общее руководство по валидации метода. Должны быть предоставлены параметры эффективности метода с целью подтверждения того, что данный метод дает результаты, подходящие для предполагаемой цели с приемлемым уровнем неопределенности измерения.
Параметры эффективности метода могут включать технические требования:
- для специфичности (требования изложены в 6.2.5);
- прецизионности;
- предела количественного обнаружения LOQ;
- предела обнаружения LOD;
- правильности;
- линейности;
- устойчивости.
Требования к описанию данных характеристик для процедур измерения как кПЦР, так и цПЦР, приведены в 8.2-8.7, а конкретные аспекты для кПЦР и цПЦР приведены в 8.8 и 8.9, соответственно.
8.2 Прецизионность
Прецизионность - это мера изменчивости результатов независимых измерений, полученных для одной и той же пробы в оговоренных условиях. В зависимости от оговоренных условий прецизионность измерений можно разделить на повторяемость метода, внутрилабораторную прецизионность и воспроизводимость. В рамках одной лабораторной валидации должны быть определены и воспроизводимость метода, и внутрилабораторная прецизионность.
Количество повторных измерений (в рамках анализа) и независимых анализов должно быть достаточным для получения надежной оценки среднеквадратического отклонения SD. В ИСО 5725-1 приведено руководство по количеству повторных измерений, требуемых для соответствия заданной неопределенности в оценке среднеквадратического отклонения.
8.3 LOQ
Необходимо указать прецизионность, связанную с LOQ; например, как среднеквадратическое отклонение SD или относительное SD. LOQ вычисляют на основе анализа повторов концентраций пробы в нижней части линейного диапазона процедуры измерения.
Прецизионность оценок LOQ зависит от количества повторов, выполненных для каждой концентрации и приращения концентрации между пробами. Необходимо выполнить не менее 10 повторений для каждой концентрации с небольшим приращением концентрации (в два раза выше и ниже ожидаемой концентрации для LOQ) [45]-[47].
8.4 LOD
Частота ложноположительных результатов процедуры измерения должна быть охарактеризована как часть оценки специфичности (см. 6.2.5) и анализа отрицательного контроля (см. 4.4, 6.3.2 и 6.4). В приложениях, где LOD в основном определяют частотой ложноположительных результатов анализа, статистическое распределение истинно-положительных результатов может быть смоделировано теоретически. Например, частота ложноположительных результатов с использованием ДНК дикого типа в качестве матрицы является критической для определения LOD анализа цПЦР, измеряющего SNV, поэтому распределение истинно-положительных результатов моделируется теоретически [49].
Частоту детектирования истинно-положительных результатов следует оценивать на основе повторных измерений проб, содержащих целевые количества в нижней части рабочего диапазона процедуры измерения, где >0% и <100% реакций являются положительными и охватывают диапазон для требуемого уровня достоверности. Например, при 95%-ной достоверности, LOD является самой низкой концентрацией, при которой 95% повторов являются положительными. Калибровочные материалы или положительные пробы, для которых были установлены значение количества и неопределенность измерения, должны использоваться для характеристики частоты детектирования истинно-положительных результатов. Если выполняются разведения (объемные или гравиметрические), прецизионность разведений должна быть охарактеризована и использована для расчета неопределенности измерения концентрации, установленной как LOD.
Доля положительных повторов изображается на графике относительно концентрации калибровочных материалов, и она может быть интерполирована для получения большей прецизионности путем подгонки данных к сигмоидальной кривой, и получения доверительного интервала оценки LOD [47]. Прецизионность оценки LOD зависит от количества повторных проб для каждой концентрации и приращения концентрации между пробами. Необходимо выполнить не менее 10 повторов на уровень концентрации. Приращение концентрации должно быть не более чем двукратным.
Примечание - Если лаборатория не знает, где ожидать LOD, хорошая стратегия состоит в том, чтобы сначала оценить его, выполнив предварительное исследование всего с несколькими повторами при каждой концентрации и охватив более широкий диапазон концентраций, а затем выполнить большое количество повторов в узком диапазоне концентрации.
8.5 Линейность
Линейный диапазон процедуры измерения должен быть задокументирован.
Пробы, используемые для оценки линейности, должны быть репрезентативными для типичных испытуемых проб и могут представлять собой калибровочные материалы или серию разведений испытуемой пробы. Для серии разведений анализируют относительное количество.
Примечание - Дополнительная информация об определении линейности в цПЦР приведена в [50]. Дополнительная информация об использовании коэффициента корреляции для верификации линейности приведена в [51].
8.6 Правильность
Правильность измерения - это выражение того, насколько среднее значение бесконечного числа (т.е. большого числа в действительности) результатов, полученных с помощью метода, приближается к эталонному значению. Существует три основных подхода к получению подходящего эталонного значения:
a) использование сертифицированных эталонных материалов;
b) метод "введено-найдено" с использованием проб с добавками;
c) сравнение с результатами, полученными другим методом [52].
Для перечисления a) сертифицированный стандартный образец должен иметь матрицу, очень похожую на матрицу испытуемой пробы, и целевую концентрацию числа копий в том же диапазоне, что и стандартные пробы.
8.7 Устойчивость критерия
Во время испытания на устойчивость критерия необходимо исследовать влияние небольших отклонений в соответствующих параметрах метода на эффективность метода и результаты измерений. Соответствующими параметрами метода, которые могут повлиять на результат метода, являются концентрация и источник (производитель) праймеров и зондов, состав реагентов для ПЦР, термоциклер [53] и параметры циклической термообработки.
Как правило, считается, что метод цПЦР, являющийся методом ПЦР с анализом результатов по конечной точке, более устойчивый, чем методы кПЦР, однако амплитуда флуоресценции и температура отжига являются важными параметрами для дифференциации положительных и отрицательных ячеек, поэтому концентрация и источник (производитель) праймеров и датчики и температура отжига должны варьироваться во время испытания на устойчивость.
8.8 Особые принципы валидации метода кПЦР
8.8.1 Повторяемость кПЦР или RT-кПЦР
Повторяемость процедуры измерения, основанной на кПЦР или RT-кПЦР, должна быть выражена в соответствии с используемым методом количественного определения: для подхода, использующего калибровочную кривую (см. 4.2.2), среднеквадратическое отклонение SD единиц концентрации калибровочной кривой являются подходящими, в то время как для метода относительного количественного определения (см. 4.2.4) среднеквадратическое отклонение SD должно отражать конечное количество, вычисленное с помощью методики измерения.
8.8.2 Внутрилабораторная прецизионность и воспроизводимость кПЦР или RT-кПЦР
8.9 Особые принципы валидации метода цПЦР
9 Прослеживаемость и сопоставимость измерений количественного определения нуклеиновых кислот
9.1 Метрологическая прослеживаемость
Прослеживаемость результата измерения относится к метрологической прослеживаемости. Она соотносит результат с единицами СИ или другими согласованными стандартами/ссылками. Прослеживаемость важна для сопоставимости аналитических результатов (см. ИСО/МЭК 17025).
Метрологическую прослеживаемость результатов измерений цПЦР и кПЦР устанавливают в соответствии с ИСО 17511.
Величины со знаками подсчета, в том числе копии определенной последовательности нуклеиновых кислот, имеют значение один. Один по своей природе является элементом любой системы единиц. Величины с единицей один можно рассматривать как прослеживаемые до СИ [54]. Таким образом, формальная прослеживаемость до СИ может быть получена с помощью соответствующих валидированных процедур измерения.
В качестве процедуры измерения, основанной на подсчете, цПЦР может стать основой первичной эталонной процедуры измерения концентрации числа копий нуклеиновых кислот (для фрагментов нуклеиновых кислот, амплифицируемых в данных условиях экспериментальной ПЦР), при условии установления специфичности и полноты подсчета и заявления о неопределенности измерений [55], [56].
9.2 Использование стандартных образцов
Стандартные образцы следует использовать для обеспечения аналитической прослеживаемости результатов измерений и верификации показателей процесса измерения нуклеиновых кислот. При наличии соответствующих стандартных образцов на основе нуклеиновых кислот следует использовать их по назначению.
9.3 Калибровка приборов
Приборы, используемые для количественного определения нуклеиновых кислот, необходимо от-калибровать с использованием соответствующих калибраторов и/или стандартных образцов, при наличии. Вспомогательное оборудование, включая, помимо прочего, весы и микропипетки, также должно быть откалибровано.
10 Неопределенность измерений (MU) в измерениях кПЦР и цПЦР
10.1 Общие требования к расчету неопределенности измерений (MU)
Неопределенность измерений можно определить как оцениваемый диапазон значений, в пределах которого находится истинное значение измерения. Диапазон значений указывает на надежность результата измерения. Оценка неопределенности включает влияние как случайных, так и систематических погрешностей в процедуре измерения. При оценке факторов, влияющих на неопределенность результата измерения, следует учитывать все возможные источники изменчивости в процессе измерения. В приложении D приведен обзор источников неопределенности в измерениях кПЦР и цПЦР Должны быть оценены экспериментальные данные и другие источники информации, такие как опубликованные результаты и сертификаты калибровки, для создания бюджета неопределенности, отражающего ключевые этапы анализа, влияющие на результат измерения. Дополнительные указания для вычисления неопределенности измерения приведены в [57] для кПЦР и [58] для цПЦР
Вычисления неопределенности измерений для методов количественного анализа нуклеиновых кислот должны включать следующие оценки:
- повторяемость, прецизионность и воспроизводимость измерений кПЦР или цПЦР;
- систематическую погрешность измерений кПЦР или цПЦР;
- неопределенность значений, присвоенных эталонным материалам;
- неопределенность разведения испытуемых проб или калибровочных материалов (случайные ошибки в разведении могут быть зафиксированы во внутрилабораторной прецизионности, если повторы выполняются на протяжении всего процесса);
- неопределенность, связанную с нормализацией: неопределенность измерения эталонного(ых) гена(ов) или других генов, применяемых для нормализации (см. 4.3), должны быть надлежащим образом объединены в соответствии с формулой, используемой для вычисления нормализованного количества исследуемой мишени (например, среднее геометрическое множества количеств эталонных генов);
- другие факторы, которые могут повлиять на результат измерения.
Неопределенности должны быть объединены в соответствии с Руководством ИСО/МЭК 98-3. Коэффициент охвата, применяемый для вычисления расширенной неопределенности с заданным доверительным уровнем (например, 95%), должен учитывать количество выполненных повторов, которое определяет степени свободы, используемые для вычисления коэффициента охвата.
Анализы, проводимые при валидации метода, могут предоставить информацию по прецизионности (см. 8.2) и правильности (см. 8.6), которые можно использовать при вычислении неопределенности измерений.
Если концентрацию стандартных проб определяют путем калибровки по эталонному материалу (см. 4.2.2), неопределенность сертифицированной концентрации эталонного материала должна быть включена в суммарную неопределенность.
Примечание - Этот подход действителен только в тех случаях, когда не наблюдается существенной систематической погрешности, или систематическая погрешность скорректирована на указанное количество нуклеиновых кислот.
10.2 Неопределенность измерений кПЦР
10.3 Измерения, основанные на отношении
Дополнительное руководство по вычислению вклада прецизионности типа A в неопределенность измерений для измерений цПЦР на основе отношений (см. 4.2.5) приведено в [7].
10.4 Неопределенность измерений цПЦР
Неопределенность измерения цПЦР должна учитывать экспериментальные источники вариации; недостаточно вычислить неопределенность измерения исключительно на основе теоретических 95%-ных доверительных интервалов подсчета Пуассона [59]. Поскольку оценка Пуассона для количества нуклеиновых кислот является неотъемлемой частью количественного определения цПЦР (см. 4.2.3), экспериментальная репликация [например, выполненная в валидационных исследованиях (см. 8.2)] фиксирует этот источник неопределенности, и отдельного учета теоретической прецизионности обычно не требуется для вклада суммарной прецизионности в неопределенность измерения [см. формулу (11)] [60].
Примечание - Экспериментальные среднеквадратические отклонения могут значительно различаться. Можно вычислить ожидаемое среднеквадратическое отклонение на основе статистики Пуассона, чтобы подтвердить, что экспериментальное среднеквадратическое отклонение не дает нереально малого значения неопределенности.
Следует также учитывать следующие факторы, определенным образом влияющие на процедуры измерения на основе цПЦР:
a) неопределенность объема ячейки. Этот элемент необходим для количественного определения концентрации копий ДНК с помощью цПЦР (см. 4.2.3). Для измерений цПЦР на основе отношения (см. 4.2.5) неопределенность объема ячейки не требуется, однако, в особых случаях высоких значений лямбда неоднородность объема ячейки в реакции может внести вклад в неопределенность результата измерения на основе отношения [59], [61]. Опубликованные исследования можно использовать для оценки неопределенности объема ячейки [62]-[65]. Применяемое значение объема ячейки должно соответствовать типу используемых для цПЦР реагентов (мастермикс) [64];
b) классификация положительных и отрицательных ячеек. Вариация настроек пороговых значений флуоресценции влияет на количественную оценку с помощью цПЦР как концентрации числа копий, так и отношений [58], [66]. Следовательно, вклад этого источника неопределенности следует оценивать на основе данных, в которых пороговое значение было изменено для одного набора данных; например, анализ разными операторами или сравнение используемого альтернативного программного обеспечения.
11 Отчеты
Отчет должен содержать достаточно данных, чтобы можно было провести независимую оценку результатов количественного определения нуклеиновых кислот.
Элементы отчетности должны включать следующие, без ограничения:
- проба - идентификатор, дескрипторы источника;
- реагенты - наименование, источник, номер партии;
- синтез олигонуклеотидов - производитель, чистота;
- процедуры и условия подготовки проб;
- марка и модель используемого прибора и соответствующие настройки - включая условия циклической термообработки ПЦР и общий объем реакции;
- планы квалификации, валидации и верификации;
- результаты измерений с соответствующими единицами измерения и неопределенностью;
- процедура анализа данных;
- непредвиденные результаты наблюдения.
Конкретные методологические и рабочие параметры, которые должны быть подробно описаны для кПЦР и цПЦР, вместе с указанием первоочередности (необходимого/желательного), в соответствии с руководствами MIQE [1] и dMIQE [67], приведены в приложении E.
Приложение A
(справочное)
Спектрофотометрия
A.1 Общие положения
Спектрофотометрия является широко используемым методом количественного определения общего количества нуклеиновых кислот (см. 5.2.2) и оценки чистоты нуклеиновых кислот (см. 5.4). В данном приложении представлена информация о коэффициентах поглощения для измерений общей концентрации нуклеиновых кислот, критерии интерпретации химической чистоты и примеры результатов типового спектрофотометрического УФ-анализа.
A.2 Взаимосвязь между поглощением и общей концентрацией нуклеиновых кислот
Концентрацию нуклеиновой кислоты определяют с помощью закона Бэра-Ламберта, который прогнозирует линейную корреляцию между поглощением при длине волны 260 нм и концентрацией нуклеиновой кислоты с коэффициентом оптической плотности, зависящим от определяемых количественно видов нуклеиновой кислоты (дцДНК, оцДНК, оцРНК, дцРНК).
Показатель поглощения при 260 нм, равный 1,0, эквивалентен ~40 мкг/мл чистой оцРНК, ~46 мкг/мл чистой дцРНК и ~50 мкг/мл чистой дцДНК. Более точный количественный анализ нуклеиновых кислот может быть выполнен в денатурирующих условиях с одноцепочечной ДНК (оцДНК) с коэффициентом поглощения 37 мкг/мл.
A.3 Коэффициенты поглощения и чистота нуклеиновых кислот
Для высококачественной пробы ДНК показания коэффициента поглощения при 260 и 280 нм (соотношение 260/280) для чистой ДНК должны быть приближены к 1,8. Если отношение заметно ниже, это может указывать на присутствие белка, фенола или других загрязняющих веществ. Если отношение приближено к 2, это может указывать на загрязнение РНК.
Для высококачественной пробы РНК отношение 260/280 должно быть приближено к 2. Наблюдались случаи, когда показания коэффициента поглощения при 260 и 280 нм, равные 1,8, свидетельствуют о наличии приблизительно 70%-80% белка в пробах. Поскольку существует множество белков, которые ингибируют и ПЦР, и обратную транскрипцию, лаборатория должна определить свои пороговые значения для отбраковки или принятия пробы.
Следует отметить, что отношение 260/280 может варьироваться в зависимости от рН и ионной силы [68].
Отношение коэффициента поглощения при 260 нм к коэффициенту поглощения при 230 нм (отношение 260/230) в идеале должно находиться в диапазоне от 2,0 до 2,2. Если отношение заметно ниже ожидаемого, это может указывать на присутствие загрязняющих веществ, поглощающих при 230 нм.
Показания исходного поглощения следует вычесть из всех измерений (даже в случае отношения).
Дополнительное руководство приведено в ИСО 21571.
На рисунках A.1 и A.2 приведены примеры проб ДНК разного качества. Проба ДНК хорошего качества на рисунке A.1 демонстрирует отношение 260/280 от 1,8 до 2,0 и отношение 260/230 2,20. Проба ДНК низкого качества на рисунке A.2 не имеет определенного пика при 260 нм наравне с поглощением при 280 нм и большим пиком при 230 нм, что приводит к очень низкому отношению 260/230 (0,33), и отношение 260/230 <1,8.
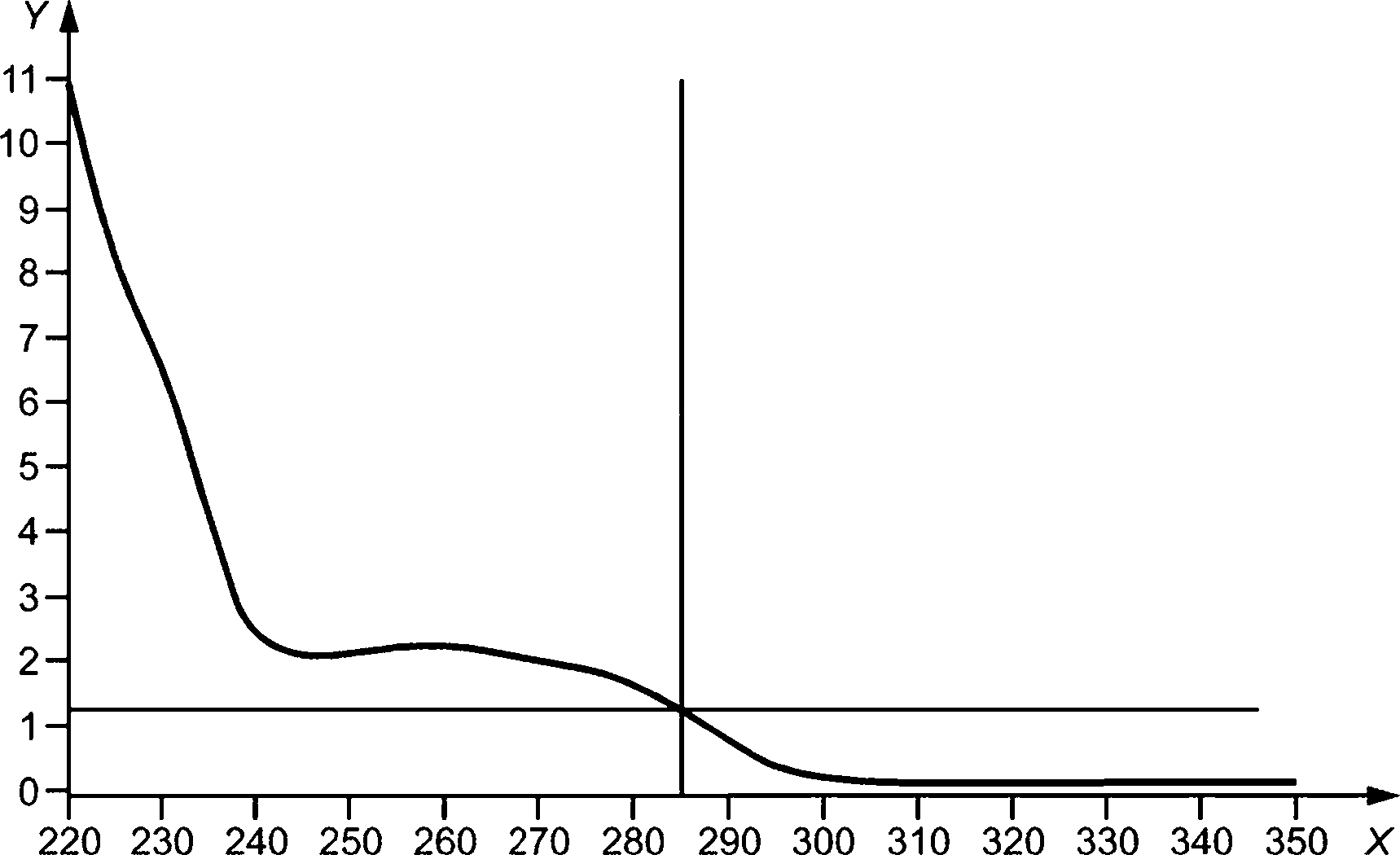 |
X - длина волны, нм; Y - поглощение
Рисунок A.1 - Пример считывания спектрофотометрических показаний для пробы ДНК высокого качества
Поглощение в диапазоне от 220 до 350 нм показано вместе с выходными данными для концентрации ДНК (нг/мкл) и отношениями поглощения.
 |
X - длина волны, нм; Y - поглощение
Рисунок A.2 - Пример считывания спектрофотометрических показаний для пробы ДНК низкого качества
Поглощение в диапазоне от 220 до 350 нм показано вместе с выходными данными для концентрации ДНК (нг/мкл) и отношениями поглощения.
Приложение B
(справочное)
Целостность нуклеиновой кислоты
B.1 Общие положения
Исследование целостности нуклеиновой кислоты позволяет оценить факторы, которые могут повлиять на эффективность процедуры измерения, основанной на кПЦР- или цПЦР, как, например, наличие деградации нуклеиновой кислоты (короткие фрагменты) или высокомолекулярной ДНК (см. 5.3). Методы оценки распределения размеров фрагментов ДНК или РНК в пробе перечислены в B.2 и B.3, соответственно. Примеры методов анализа целостности нуклеиновых кислот, применяемых к ряду клинических проб, приведены в [20].
B.2 Методы оценки целостности ДНК
B.2.1 Электрофорез
Для клеточной гДНК полоса с высокой молекулярной массой обычно присутствует в верхней части геля. Пятна или кометные хвосты свидетельствуют о деградации и фрагментации пробы. Наоборот, для бесклеточной ДНК ожидается размер фрагмента основного пика примерно 130-170 пар оснований (bp) [69]. Для некоторых приборов специальные алгоритмы обеспечивают количественный показатель целостности ДНК, основанный на особенностях электрофоретического анализа.
B.2.2 ПЦР длинных фрагментов
ПЦР длинных фрагментов можно использовать для амплификации последовательностей до 15 т.п.н. (kb) с использованием определенных типов полимераз. Она дает качественную оценку целостности ДНК [70].
B.2.3 ПЦР-анализ с ампликонами разной длины
Одна и та же геномная область нацелена на несколько наборов праймеров для ПЦР с разными длинами ампликонов и обеспечивает индекс или отношение амплифицируемых молекул при разных размерах фрагментов [71]-[74].
B.3 Методы оценки целостности РНК
B.3.1 Электрофорез
Электрофоретические профили представляют отчетливые полосы для разных групп молекул [рибосомаль-ная РНК (рРНК) разного размера, малая РНК и т.д.] и показывают смещение размера фрагмента, связанное с деградацией. Специальные алгоритмы обеспечивают количественный показатель целостности РНК, основанный на особенностях электрофоретического анализа [75].
Алгоритмы, которые основаны в основном на характеристиках электрофоретического анализа рРНК, подходят для оценки целостности молекул РНК высокого качества, где пики рРНК различимы. Для прокариотической РНК для оценки целостности используют отношение рРНК 23S и 16S субъединиц рибосомы. Для эукариотической РНК используют отношение рРНК из 28S рРНК и 18S субъединиц рибосомы. Однако, если качество РНК серьезно снижено (например, после формалиновой фиксации ткани), эти алгоритмы не подходят для оценки качества молекул мРНК.
B.3.2 RT-кПЦР для отношения 5’/3’ мРНК
Этот анализ целостности основан на измерении отношения количеств мишени, расположенной на 5’-конце, и мишени, расположенной на 3’-конце одного и того же транскрипта, с использованием RT-праймирования на основе олиго-dT. Это обеспечивает относительную меру целостности мРНК. Если РНК не повреждена, ожидается одинаковая концентрация при использовании каждого анализа (отношение равно 1), тогда как более высокое число копий 3’-анализа по сравнению с 5’ ожидается, если РНК деградировала [76].
Эффективность стратегии RT-праймирования на основе 3’ следует валидировать с использованием типовых испытуемых проб, поскольку может оказаться, что она неинформативна для высокофрагментированной РНК.
B.3.3 RT-кПЦР-анализ повторяющихся элементов
Концентрация экспрессируемых повторяющихся последовательностей (например, AluJ) может быть измерена как индикатор амплифицируемости мРНК [76]. Должна быть включена контрольная проба высокой целостности, чтобы явно свидетельствовать о деградации пробы.
B.3.4 Анализы RT-кПЦР с ампликонами разной длины
Что касается целостности ДНК, этот подход может быть применен к целостности РНК путем измерения одного и того же транскрипта с ампликонами разной длины [77].
Приложение C
(справочное)
Эффективность ПЦР
C.1 Общие положения
ПЦР-эффективность кПЦР как правило, проверяют путем построения калибровочной кривой или серией разведений (см. 6.2.3). В данном приложении приведена информация по порядку проведения определения и вычислению эффективности ПЦР.
C.2 Порядок проведения определения
Для оценки эффективности кПЦР калибровочные материалы или проба для приготовления серии разведений ("стандартные растворы"), формирующие стандартную кривую, должны состоять из очищенной матричной ДНК. Это могут быть синтетические олигонуклеотиды, очищенная плазмида, очищенная гДНК или очищенный продукт ПЦР. Для оценки эффективности RT-кПЦР стандартные растворы должны состоять из очищенной матричной РНК: например, РНК транскрибированная in vitro, или очищенная клеточная РНК. Стандартные растворы могут быть приготовлены из высококонцентрированного сырья, которое последовательно разбавляют.
Рекомендуется нуклеиновая кислота-носитель (без перекрестной реактивности с анализом) для поддержания общего содержания нуклеиновой кислоты в реакционной смеси эквивалентным в серии разведений, особенно для молекул с низкой молекулярной массой, таких как олигонуклеотиды или плазмидная ДНК, которые могут прилепляться к пробиркам. Стандартная кривая должна охватывать как можно более широкий диапазон концентраций и быть применимой к планируемому использованию процедуры измерения.
Точная оценка эффективности ПЦР характеризуется узким доверительным интервалом. Это достигается с помощью большого количества стандартов. Рекомендуется как минимум 24 измерения, распределенные, например, в виде четырех повторов при шести различных концентрациях [78].
C.3 Вычисления
Предлагаются следующие показатели качества и параметры испытаний:
a) Повторяющиеся данные проверяют на наличие выбросов. Выбросы могут быть идентифицированы, например, с помощью испытания проб тестом Грабба относительно остатка. Рекомендуется использовать доверительный интервал 95%.
1) Если обнаружен один выброс, данные и анализ должны быть пересмотрены для определения причины выброса. Если причина идентифицирована и может быть исключена, данный выброс может быть удален из анализа, а оставшиеся данные могут быть использованы для построения стандартной кривой;
2) Если более одного выброса обнаружено для пробы, данные, соответствующие этой пробе, не должны использоваться для построения стандартной кривой.
b) Данные кПЦР из "стандартных растворов" вычисляют по формуле с помощью линейной регрессии
y = a + bx, (C.1)
a - отрезок прямой;
b - градиент.
Необходимо оценить коэффициент корреляции линейной регрессии (см. 6.2.3).
Можно выполнить дополнительное испытание на линейность, например, путем оценки с помощью проведения испытаний или сравнения линейной аппроксимации с многочленами второго и третьего порядка по формулам:
где c - коэффициент члена второго порядка;
d - коэффициент члена третьего порядка.
Важность подгоночных параметров c и d сравнивают c наклоном b. Значительное взвешивание c и d предполагает отклонение от линейности при низкой и/или высокой концентрации.
Если данные показывают отклонение от линейности, крайняя точка данных должна быть удалена, а оставшиеся данные, теперь охватывающие более узкий диапазон, должны быть проверены на линейность.
Для данных кПЦР отклонение от линейности часто наблюдается при высокой концентрации, особенно на определенных приборах. Это отклонение может быть связано с неправильным вычитанием базовой линии программным обеспечением прибора из-за раннего увеличения флуоресценции наиболее концентрированной пробы. Отклонение от линейности может сильно повлиять на оценку эффективности ПЦР, поскольку пробы, имеющие отклонения, с экстремальными концентрациями и, из-за более сильного эффекта линейной регрессии, оказывают сильное влияние на подгонку, в результате чего оценки эффективности ПЦР значительно выше 100%, что теоретически невозможно. Если возможно, следует внести коррективы в подход к установлению базовой линии или процедуру измерения, валидированную в узком диапазоне концентраций (см. 6.3.3).
со среднеквадратической погрешностью SE - по формуле
и доверительным интервалом (CI) - по формуле
n - количество экспериментов, проведенных для определения эффективности ПЦР.
Приложение D
(справочное)
Неопределенность измерений
D.1 Общие положения
Как обработка биологической пробы (отбор проб из исходного материала, хранение, экстракция нуклеиновых кислот), так и измерение нуклеиновых кислот влияют на неопределенность значения количества, полученного с помощью метода измерения на основе кПЦР или цПЦР. Результаты могут быть систематическими; связаны с положительной или отрицательной систематической погрешностью (например, экстракция нуклеиновых кислот или эффективность RT<100%), или случайными (относящиеся к прецизионности применяемых методов). Составной экспериментальный план с повторением для разных этапов всего процесса обеспечивает прецизионность и прогнозирует случайные воздействия на неопределенность измерения в результате [79].
Обзор источников неопределенности, которые могут повлиять на измерения кПЦР и цПЦР, представлен в D.2 и D.3, чтобы помочь разработчикам методов кПЦР или цПЦР учесть факторы, которые могут иметь значение при разработке соответствующего бюджета неопределенности измерений.
D.2 Источники неопределенности для всего процесса (кПЦР)
Возможные источники неопределенности во всем процессе от биологической пробы до количественного определения нуклеиновых кислот изображены на рисунке D.1 для процедуры измерения, основанной на кПЦР. Для RT-кПЦР уникальные источники неопределенности включают обработку ДНКазой и RT. Для методов кПЦР, использующих калибровочную кривую (см. 4.2.2), имеют значение источники неопределенности в значении, присвоенном калибровочному материалу.
 |
Рисунок D.1 - Причинно-следственная диаграмма. Весь процесс вклада неопределенности для процедуры измерений, основанной на кПЦР
Центральная стрелка представляет экспериментальный процесс от пробы до метода количественного определения. Ветви, ведущие в последовательность эксперимента, характеризуют источники изменчивости, вносящие вклад в неопределенность на различных этапах процесса. Адаптировано из [80].
D.3 Источники неопределенности для цПЦР
Источники неопределенности, влияющие на цПЦР, изображены на рисунке D.2 для процедуры измерения на основе капельной цПЦР, применяемой для количественного определения концентрации числа копий (см. 4.2.3).
 |
Примечание - Воспроизведено с разрешения [58].
Рисунок D.2 - Причинно-следственная диаграмма. Вклад неопределенности для процедуры измерения, основанной на цПЦР
Приложение E
(справочное)
Карты контроля MIQE и dMIQE
E.1 Общие положения
Требования к информации для разработки методов кПЦР или цПЦР в соответствии с настоящим стандартом разделяют многие из требований к публикации экспериментальных данных из экспериментов кПЦР и цПЦР, изложенных в "Минимальная информация для публикации результатов экспериментов количественной ПЦР в реальном времени" (MIQE) и "Минимальная информация для публикации результатов экспериментов цифровой ПЦР" (dMIQE) [1], [67]. Карты контроля MIQE и dMIQE приведены, чтобы информировать разработчиков методов кПЦР и цПЦР об аспектах всего процесса (включая отбор проб, извлечение нуклеиновых кислот, измерение), которые могут быть описаны.
E.2 Карта контроля MIQE
В таблице E.1 приведены данные по методологическим и рабочим параметрам, приведенным в карте контроля для публикации данных экспериментов, основанных на кПЦР, опубликованные в руководстве MIQE [1].
Таблица E.1 - Карта контроля MIQE [воспроизведено с разрешения Американской ассоциации клинической химии (AACC)]
Пункт для проверки | Значимость |
ПЛАН ЭКСПЕРИМЕНТА | |
Определение экспериментальной и контрольной групп | E |
Количество в каждой группе | E |
Анализ проведен головной лабораторией или исследовательской лабораторией? | D |
Подтверждение вкладов автора | D |
ПРОБА | |
Описание | E |
Объем/масса обрабатываемой пробы | D |
Микроскопическое или макроскопическое препарирование | E |
Процедура обработки | E |
Если заморожена - каким способом и как быстро? | E |
Если химически связанная - с чем, как быстро? | E |
Условия и период хранения пробы [особенно для химически связанных формалином и залитых парафином (FFPE) проб] | E |
ЭКСТРАКЦИЯ НУКЛЕИНОВОЙ КИСЛОТЫ | |
Процедура и/или оборудование | E |
Наименование набора и данные по модификации | E |
Источник дополнительных используемых реагентов | D |
Данные по обработке ДНКазы или РНКазы | E |
Оценка загрязнения (ДНК или РНК) | E |
Количественное определение нуклеиновой кислоты | E |
Прибор и метод | E |
Чистота (А260/А280) | D |
Частота выявления | D |
Метод/прибор определения целостности РНК | E |
RIN/RQI или транскриптов 3’ и 5’ | E |
Следы электрофореза | D |
Испытание на ингибирование (разведения , спайк и прочее) | E |
ОБРАТНАЯ ТРАНСКРИПЦИЯ | |
Полные условия реакции | E |
Количество РНК и реакционный объем | E |
Праймирующий олигонуклеотид (при использовании GSP) и концентрация | E |
Обратная транскриптаза и концентрация | E |
Температура и время | E |
Производитель реагентов и каталожные номера | D |
с и без RT | D |
Условия хранения кДНК | D |
ИНФОРМАЦИЯ О МИШЕНИ кПЦР | |
Учетный номер последовательности | E |
Расположение ампликона | D |
Длина ампликона | E |
Скрининг специфичности in silico (BLAST и т.д.) | E |
Псевдогены, ретропсевдогены или другие гомологи? | D |
Выравнивание последовательности | D |
Анализ вторичной структуры ампликона | D |
Расположение каждого праймера по экзону или интрону (если применимо) | E |
Какие сплайс-варианты являются целевыми? | E |
ОЛИГОНУКЛЕТИДЫ кПЦР | |
Последовательности праймеров | E |
Идентификационный номер RTPrimerDB | D |
Последовательности зондов | D |
Расположение и идентичность любых модификаций | E |
Производитель олигонуклеотидов | D |
Метод очистки | D |
ПРОТОКОЛ кПЦР | |
Полные условия реакции | E |
Объем реакции и количество кДНК/ДНК | E |
Праймер, (зонд), концентрации Mg++ и dNTP | E |
Идентификация и концентрация полимеразы | E |
Наименование и производитель буфера/набора | E |
Точный химический состав буфера | D |
Добавки (SYBR Green I, DMSO и др.) | E |
Производитель планшетов/пробирок и каталожный номер | D |
Полные параметры термоциклирования | E |
Настройка реакции (ручная/роботизированная) | D |
Производитель прибора для кПЦР | E |
ВАЛИДАЦИЯ кПЦР | |
Доказательства оптимизации (из градиентов) | D |
Специфичность (гель, последовательность, плавление или расщепление) | E |
Для SYBR Green I, NTC | E |
Стандартные кривые с наклоном и точкой пересечения с осью Y | E |
Эффективность ПЦР, рассчитанная по наклону | E |
Доверительный интервал для эффективности ПЦР или среднеквадратическая ошибка | D |
стандартной кривой | E |
Линейный динамический диапазон | E |
Изменение на нижнем пределе | E |
Доверительные интервалы во всем диапазоне | D |
Доказательства для предела обнаружения | E |
При мультиплексном анализе эффективность и LOD каждого анализа | E |
АНАЛИЗ ДАННЫХ | |
Программа анализа кПЦР (источник, версия) | E |
Определение метода | E |
Идентификация выброса и его размещение | E |
Результаты NTC | E |
Обоснование количества и выбор референсных генов | E |
Описание метода нормализации | E |
Количество и соответствие биологических повторов | D |
Количество и этап (RT или кПЦР) технических повторов | E |
Повторяемость (вариации внутри анализа) | E |
Воспроизводимость (изменение между анализами, % CV) | D |
Анализ мощности | D |
Статистические методы значимости результатов | E |
Программное обеспечение (источник, версия) | E |
Представление данных по или необработанных данных с использованием языка разметки данных ПЦР в реальном времени (RDML) | D |
Обозначения: E - необходимые; D - желаемые. | |
E.3 Опросной лист dMIQE
В таблице E.2 приведены данные по методологическим и рабочим параметрам, приведенным в опросном листе для публикации данных экспериментов, основанных на цПЦР, опубликованные в руководстве dMIQE.
Таблица E.2 - Опросной лист dMIQE [воспроизведено с разрешения Американской ассоциации клинической химии (AACC)]
Пункт для проверки | Значимость |
ПЛАН ЭКСПЕРИМЕНТА | |
Определение экспериментальной и контрольной групп | E |
Количество в каждой группе | E |
Анализ проведен головной лабораторией или исследовательской лабораторией? | D |
Анализ мощности | D |
ПРОБА | |
Описание | E |
Объем/масса обрабатываемой пробы | E |
Микроскопическое или макроскопическое препарирование | E |
Процедура обработки | E |
Если заморожена - каким способом и как быстро? | E |
Если химически связанная - с чем, как быстро? | E |
Условия и период хранения пробы [особенно для FFPE проб] | E |
ЭКСТРАКЦИЯ НУКЛЕИНОВОЙ КИСЛОТЫ | |
Количественное определение - прибор/метод | E |
Условия хранения: температура, концентрация, продолжительность, буфер | E |
Количественное определение ДНК или РНК | E |
Прибор/метод количественной оценки/оценки целостности, например, RIN/RQI и маркировки или 3’:5’ | E |
Информация по структуре матрицы | E |
Модификация матрицы (расщепление, обработка ультразвуком, предварительная амплификация и т.д.) | E |
Обработка матрицы (начальный нагрев или химическая денатурация) | E |
Ингибиторное разведение и спайк | E |
Оценка загрязнения ДНК образца РНК | E |
Данные об обработке ДНКазы, если выполнялась | E |
Производитель используемых реагентов и каталожный номер | D |
Хранение нуклеиновой кислоты: температура, концентрация, продолжительность, буфер | E |
ОБРАТНАЯ ТРАНСКРИПЦИЯ (при необходимости) | |
Метод праймирования кДНК + концентрация | E |
Одно- или двухэтапный протокол | E |
Количество РНК, используемое на реакцию | E |
Данные по компонентам и условиям реакции | E |
Эффективность RT | D |
Предполагаемые копии, измеренные с добавлением и без добавления RT | D |
Производитель используемых реагентов и каталожный номер | D |
Объем реакции (для двухэтапной реакции обратной транскрипции) | D |
Хранение кДНК: температура, концентрация, продолжительность, буфер | D |
ИНФОРМАЦИЯ О МИШЕНИ цПЦР | |
Учетный номер последовательности | E |
Расположение ампликона | D |
Длина ампликона | E |
Скрининг специфичности in silico (BLAST и т.д.) | E |
Псевдогены, ретропсевдогены или другие гомологи? | D |
Выравнивание последовательности | D |
Анализ вторичной структуры ампликона и содержание GC | D |
Расположение каждого праймера по экзону или интрону (если применимо) | E |
Какие сплайс-варианты являются целевыми? | E |
ОЛИГОНУКЛЕТИДЫ цПЦР | |
Последовательности праймеров и/или последовательность окружения ампликона | E |
Идентификационный номер RTPrimerDB | D |
Последовательности зондов | D |
Расположение и идентичность любых модификаций | E |
Производитель олигонуклеотидов | D |
Метод очистки | D |
ПРОТОКОЛ цПЦР | |
Полные условия реакции | E |
Объем реакции и количество РНК/кДНК/ДНК | E |
Праймер, (зонд), концентрации Mg++ и dNTP | E |
Идентификация и концентрация полимеразы | E |
Каталожный номер и производитель буфера/набора | E |
Точный химический состав буфера | D |
Добавки (SYBR Green I, DMSO и др.) | E |
Производитель планшетов/пробирок и каталожный номер | D |
Полные параметры термоциклирования | E |
Настройка реакции | D |
Гравиметрическое или объемное разбавление (ручное/роботизированное) | D |
Общий подготовленный объем реакции ПЦР | D |
Номер ячейки | E |
Объем отдельной ячейки | E |
Общий объем измеренных ячеек (эффективный размер реакции) | E |
Вариация объема ячейки/среднеквадратическое отклонение | D |
Исчерпывающая информация и надлежащее использование контролей | E |
Производитель прибора цПЦР | E |
ВАЛИДАЦИЯ цПЦР | |
Данные оптимизации для анализа | D |
Специфичность (при измерении редких мутаций, последовательностей патогенов и т.д.) | E |
Предел обнаружения калибровочного контроля | D |
При мультиплексном анализе, сравнение с одиночными анализами | E |
АНАЛИЗ ДАННЫХ | |
Среднее количество копий на ячейку ( или эквивалент) | E |
Программа анализа цПЦР (источник, версия) | E |
Идентификация выброса и его размещение | E |
Результаты NTC | E |
Примеры положительных и отрицательных результатов экспериментов в качестве дополнительных данных | E |
При необходимости, обоснование количества и выбора эталонных генов | E |
При необходимости, описание метода нормализации | E |
Количество и соответствие биологических повторов | D |
Количество и этап (RT или кПЦР) технических повторов | E |
Повторяемость (вариации внутри анализа) | E |
Воспроизводимость (различия между анализами/пользователями/лабораториями и т.д.) | D |
Вариация и доверительный интервал эксперимента | E |
Статистические методы, используемые для анализа | E |
Отправка данных с использованием RDML | D |
Обозначения: E - необходимые; D - желаемые. | |
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов национальным и межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO/IEC Guide 98-3:2008 | IDT | ГОСТ 34100.3-2017/ISO/IEC Guide 98-3:2008 "Неопределенность измерения. Часть 3. Руководство по выражению неопределенности измерения" |
ISO/IEC Guide 99 | - | * |
* Соответствующий национальный, межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Официальный перевод данного международного стандарта находится в Федеральном информационном фонде стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: - IDT - идентичный стандарт. | ||
Библиография
[1] | Bustin S.A., Benes V., Garson J.A., Hellemans J., Huggett J., Kubista M. et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clin Chem 2009; 55:611-22 |
[2] | Kubista M., Andrade J.M., Bengtsson M., Forootan A., Jonak J., Lind K. et al. The real-time polymerase chain reaction. MoI Aspects Med 2006; 27:95-125 |
[3] | Barwick V.J., Preparation of Calibration Curves: A Guide to Best Practice (2003). LGC Limited doi: 10.13140/ RG.2.2.36338.76488 |
[4] | Dube S., Qin J., Ramakrishnan R., Mathematical analysis of copy number variation in a DNA sample using digital PCR on a nanofluidic device. PloS One 2008; 3:e2876 |
[5] | Pfaffl M.W. A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Res 2001; 29:e45 |
[6] | Stahlberg A., Rusnakova V., Forootan A., Anderova M., Kubista M. RT-qPCR work-flow for single-cell data analysis. Methods 2013; 59:80-8 |
[7] | Whale A.S., Huggett J.F, Cowen S., Speirs V., Shaw J., Ellison S.L. et al. Comparison of microfluidic digital PCR and conventional quantitative PCR for measuring copy number variation. Nucleic Acids Res 2012; 40:e82 |
[8] | Bland J.M., Altman D.G, Transformations, means, and confidence intervals. BMJ 1996; 312: 1079 |
[9] | Cui X., Yu S., Tamhane A., Causey Z.L., Steg A., Danila M.I. et al. Simple regression for correcting Ct bias in RT-qPCR low-density array data normalization. BMC Genomics 2015; 16:82 |
[10] | Huggett J., Dheda K., Bustin S., Zumla A. Real-time RT-PCR normalisation; strategies and considerations. Genes Immun 2005; 6:279-84 |
[11] | Devonshire A.S., Whale A.S., Gutteridge A., Jones G., Cowen S., Foy C.A., Huggett J.F., Towards standardisation of cell-free DNA measurement in plasma: controls for extraction efficiency, fragment size bias and quantification. Anal Bioanal Chem 2014; 406:6499-512 |
[12] | Vandesompele J., De Prefer K., Pattyn F., Poppe В., Van Roy N., De Paepe A., Speleman F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biol 2002; 3:Research0034 |
[13] | Andersen C.L., Jensen J.L., Orntoft T.F., Normalization of real-time quantitative reverse transcription-PCR data: a model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Res 2004; 64:5245-50 |
[14] | Pfaffl M.W., Horgan G.W., Dempfle L., Relative expression software tool [REST] for group-wise comparison and statistical analysis of relative expression results in real-time PCR. Nucleic Acids Res 2002; 30:e36 |
[15] | Mestdagh P., Van Vlierberghe P., De Weer A., Muth D., Westermann F., Speleman F., Vandesompele J. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biol 2009; 10:R64 |
[16] | Livak K.J., Wills Q.F., Tipping A.J., Datta K., Mittal R., Goldson A.J. et al. Methods for qPCR gene expression profiling applied to 1440 lymphoblastoid single cells. Methods 2013; 59:71-9 |
[17] | Bengtsson M., Stahlberg A., Rorsman P., Kubista M. Gene expression profiling in single cells from the pancreatic islets of Langerhans reveals lognormal distribution of mRNA levels. Genome Res 2005; 15:1388-92 |
[18] | Nixon G., Garson J.A., Grant P., Nastouli E., Foy C.A., Huggett J.F. A comparative study of sensitivity, linearity and resistance to inhibition of digital and non-digital PCR and LAMP assays for quantification of human cytomegalovirus. Anal Chem 2014; 86:4387-94 |
[19] | Nolan T., Hands R.E., Ogunkolade W, Bustin S.A., SPUD: a quantitative PCR assay for the detection of inhibitors in nucleic acid preparations. Anal Biochem 2006; 351:308-10 |
[20] | Betsou F., Bulla A., Cho S.Y., Clements J., Chuaqui R., Coppola D. et al. Assays for Qualification and Quality Stratification of Clinical Biospecimens Used in Research: A Technical Report from the ISBER Biospecimen Science Working Group. Biopreserv Biobank 2016; 14:398-409 |
[21] | Rodriguez A., Rodriguez M., C rdoba J.J., Andrade M.J., Design of primers and probes for quantitative real-time PCR methods. Methods Mol Biol 2015; 1275:31-56 |
[22] | Nolan T., Huggett J., Sanchez E. Good practice guide for the application of quantitative PCR (qPCR). doi: 10.13140/RG.2.2.15943.96162 |
[23] | www.ncbi.nlm.nih.gov/snp |
[24] | www.ncbi.nlm.nih.gov/tools/primer-blast/ |
[25] | www.mirbase.org/ |
[26] | Ludwig N., Becker M., Schumann T., Speer T., Fehlmann T., Keller A., Meese E. Bias in recent miRBase annotations potentially associated with RNA quality issues. Sci Rep 2017; 7:5162 |
[27] | Lievens A., Jacchia S., Kagkli D., Savini C., Querci M. Measuring Digital PCR Quality: Performance Parameters and Their Optimization. PloS One 2016; 11:e0153317 |
[28] | Devonshire A.S., Elaswarapu R., Foy C.A., Applicability of RNA standards for evaluating RT-qPCR assays and platforms. BMC Genomics 2011; 12:118 |
[29] | Stahlberg A., Hakansson J., Xian X., Semb H., Kubista M. Properties of the reverse transcription reaction in mRNA quantification. Clin Chem 2004; 50:509-15 |
[30] | Sanders R., Mason D.J., Foy C.A., Huggett J.F. Evaluation of digital PCR for absolute RNA quantification. PloS One 2013; 8:e75296 |
[31] | Stahlberg A., Kubista M., Pfaffl M. Comparison of reverse transcriptases in gene expression analysis. Clin Chem 2004; 50:1678-80 |
[32] | Fox B.C., Devonshire A.S., Baradez M.O., Marshall D., Foy C.A. Comparison of reverse transcription-quantitative polymerase chain reaction methods and platforms for single cell gene expression analysis. Anal Biochem 2012; 427:178-86 |
[33] | Huggett J., Novak T., Garson J., Green C., Morris-Jones S., Miller R., Zumla A. Differential susceptibility of PCR reactions to inhibitors: an important and unrecognised phenomenon. BMC Res Notes 2008; 1:70 |
[34] | King C., Debruyne R., Kuch M., Schwarz C., Poinar H. A quantitative approach to detect and overcome PCR inhibition in ancient DNA extracts. BioTechniques 2009; 47:941-9 |
[35] | Stahlberg A., Aman P., Ridell B., Mostad P., Kubista M. Quantitative real-time PCR method for detection of B-lymphocyte monoclonality by comparison of kappa and lambda immunoglobulin light chain expression. Clin Chem 2003; 49:51-9 |
[36] | Sidstedt M., Romsos E.L., Hedell R., Ansell R., Steffen C.R., Vallone P.M. et al. Accurate Digital Polymerase Chain Reaction Quantification of Challenging Samples Applying Inhibitor-Tolerant DNA Polymerases. Anal Chem 2017; 89:1642-9 |
[37] | Weaver S., Dube S., Mir A., Qin J., Sun G., Ramakrishnan R. et al. Taking qPCR to a higher level: Analysis of CNV reveals the power of high throughput qPCR to enhance quantitative resolution. Methods 2010; 50:271-6 |
[38] | Devonshire A.S., Honeyborne I., Gutteridge A., Whale A.S., Nixon G., Wilson P. et al. Highly reproducible absolute quantification of Mycobacterium tuberculosis complex by digital PCR. Anal Chem 2015; 87:3706-13 |
[39] | Mojtahedi M., Fouquier d’Herouel A., Huang S. Direct elicitation of template concentration from quantification cycle (Cq) distributions in digital PCR. Nucleic Acids Res 2014; 42:e126 |
[40] | Wilson P.J., Ellison S.L. Extending digital PCR analysis by modelling quantification cycle data. BMC Bioinformatics2016; 17:421 |
[41] | Kline M.C., Duewer D.L. Evaluating Droplet Digital Polymerase Chain Reaction for the Quantification of Human Genomic DNA: Lifting the Traceability Fog. Anal Chem 2017; 89:4648-54 |
[42] | Jones M., Williams J., G rtner K., Phillips R., Hurst J., Frater J. Low copy target detection by Droplet Digital PCR through application of a novel open access bioinformatic pipeline, ’definetherain’. J Virol Methods 2014; 202:46-53 |
[43] | Trypsteen W., Vynck M., De Neve J., Bonczkowski P., Kiselinova M., Malatinkova E. et al. ddpcRquant: threshold determination for single channel droplet digital PCR experiments. Anal Bioanal Chem 2015; 407:5827-34 |
[44] | Whale A.S., Huggett J.F., Tzonev S. Fundamentals of multiplexing with digital PCR. Biomol Detect Quantif 2016; 10:15-23 |
[45] | CLSI, Guideline EP17-A2: Evaluation of Detection Capability for Clinical Laboratory Measurement Procedures, 2nd Edition |
[46] | Hougs L., Gatto F., Goerlich O., Grohmann L., Lieske K., Mazzara M. et al. Verification of analytical methods for GMO testing when implementing interlaboratory validated methods. EUR 29015 EN, Publication Office of the European Union, Luxembourg, 2017, ISBN 978-92-79-77310-5, doi: 10.2760/645114, JRC 109940 |
[47] | Forootan A., Sjoback R., Bjorkman J., Sjogreen B., Linz L., Kubista M. Methods to determine limit of detection and limit of quantification in quantitative real-time PCR (qPCR). Biomol Detect Quantif 2017; 12:1-6 |
[48] | Ellison S.L.R., Barwick V.J., Farrant T.J.D. Practical Statistics for the Analytical Scientist - A Bench Guide. 2nd ed: RSC Publishing (Cambridge), 2009 |
[49] | Whale A.S., Bushell C., Grant P.R., Cowen S., Guttierrez-Aguirre I., O’Sullivan D.M. et al. Detection of rare drug resistance mutations by digital PCR in a human influenza A virus model system and clinical samples. J Clin Microbiol 2016; 54:392-400 |
[50] | Vynck M., Vandesompele J., Thas O. Quality control of digital PCR assays and platforms. Anal Bioanal Chem 2017; 409:5919-31 |
[51] | Ellison S.L.R. In defence of the correlation coefficient. Accred Qual Assur 2006; 11:146-52 |
[52] | Eurachem Guide, The fitness for purpose of analytical methods - A laboratory guide to method validation and related topics (second edition). 2014. ISBN 978-91-87461-59-0. |
[53] | Pinheiro L.B., O’Brien H., Druce J., Do H., Kay P., Daniels M. et al. Interlaboratory Reproducibility of Droplet Digital Polymerase Chain Reaction Using a New DNA Reference Material Format. Anal Chem 2017; 89:11243-51 |
[54] | SI Brochure: The International System of Units (SI). BIPM (Sevres, France). ISBN 978-92-822-2272-0. www.bipm.org/en/publications/si -brochure/ |
[55] | Yoo H.B., Park S.R., Dong L., Wang J., Sui Z., Pavsic J. et al. International Comparison of Enumeration-Based Quantification of DNA Copy-Concentration Using Flow Cytometric Counting and Digital Polymerase Chain Reaction. Anal Chem 2016; 88:12169-76 |
[56] | Whale A.S., Jones G.M., Pavsic J., Dreo T., Redshaw N., AkyurekS. et. al. Assessment of Digital PCR as a Primary Reference Measurement Procedure to Support Advances in Precision Medicine. Clin Chem 2018; 64:1296-1307 |
[57] | Griffiths K.R., Burke D.G., Emslie K.R. Quantitative polymerase chain reaction: a framework for improving the quality of results and estimating uncertainty of measurement. Anal Methods 2011; 3:2201-11 |
[58] | Deprez L., Corbisier P., Kortekaas A.M., Mazoua S., Beaz Hidalgo R., Trapmann S., Emons H. Validation of a digital PCR method for quantification of DNA copy number concentrations by using a certified reference material. Biomol Detect Quantif 2016; 9:29-39 |
[59] | Jacobs B.K., Goetghebeur E., Clement L. Impact of variance components on reliability of absolute quantification using digital PCR. BMC Bioinformatics 2014; 15:283 |
[60] | Pinheiro L.B., Coleman V.A., Hindson C.M., Herrmann J., Hindson B.J., Bhat S., Emslie K.R. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Anal Chem 2012; 84:1003-11 |
[61] | Huggett J.F., Cowen S., Foy C.A. Considerations for Digital PCR as an Accurate Molecular Diagnostic Tool. Clin Chem 2015; 61:79-88 |
[62] | Corbisier P., Pinheiro L., Mazoua S., Kortekaas A.M., Chung P.Y., Gerganova T. et al. DNA copy number concentration measured by digital and droplet digital quantitative PCR using certified reference materials. Anal Bioanal Chem 2015; 407:1831-40 |
[63] | Dong L., Meng Y., Sui Z., Wang J., Wu L., Fu B. Comparison of four digital PCR platforms for accurate quantification of DNA copy number of a certified plasmid DNA reference material. Sci Rep 2015; 5:13174 |
[64] | Dagata J.A., Farkas N., Kramar J.A. Method for Measuring the Volume of Nominally 100 Diameter Spherical Water-in-Oil Emulsion Droplets. NIST Special Publication 260-184 (2016) DOI: 106028/NISTSP260-184 |
[65] | Kosir A.B., Divieto C., Pavsic J., Pavarelli S., Dobnik D., Dreo T. et al. Droplet volume variability as a critical factor for accuracy of absolute quantification using droplet digital PCR. Anal Bioanal Chem 2017; 409:6689-97 |
[66] | Whale A.S., Devonshire A.S., Karlin-Neumann G., Regan J., Javier L., Cowen S. et al. International Interlaboratory Digital PCR Study Demonstrating High Reproducibility for the Measurement of a Rare Sequence Variant. Anal Chem 2017; 89:1724-33 |
[67] | Huggett J.F., Foy C.A., Benes V., Emslie K., Garson J.A., Haynes R. et al. The Digital MIQE Guidelines: Minimum Information for Publication of Quantitative Digital PCR Experiments. Clin Chem 2013; 59:892-902 |
[68] | Wilfinger W.W., Mackey K., Chomczynski P. Effect of pH and ionic strength on the spectrophotometric assessment of nucleic acid purity. BioTechniques 1997; 22:474-6, 8-81 |
[69] | Heitzer E., Ulz P., Geigl J.B. Circulating Tumor DNA as a Liquid Biopsy for Cancer. Clin Chem 2015; 61:112-23 |
[70] | Cheng S., Chen Y., Monforte J.A., Higuchi R., Van Houten B. Template integrity is essential for PCR amplification of 20 to 30-kb sequences from genomic DNA. PCR Methods Appl 1995; 4:294-8 |
[71] | Deagle B.E., Eveson J.P., Jarman S.N. Quantification of damage in DNA recovered from highly degraded samples-a case study on DNA in faeces. Front Zool 2006; 3:11 |
[72] | Colotte M., Couallier V., Tuffet S., Bonnet J. Simultaneous assessment of average fragment size and amount in minute samples of degraded DNA. Anal Biochem 2009; 388:345-7 |
[73] | Didelot A., Kotsopoulos S.K., Lupo A., Pekin D., Li X., Atochin I. et al. Multiplex picoliter-droplet digital PCR for quantitative assessment of DNA integrity in clinical samples. Clin Chem 2013; 59:815-23 |
[74] | Mano J., Nishitsuji Y., Kikuchi Y., Fukudome S.I., Hayashida T., Kawakami H. et al. Quantification of DNA fragmentation in processed foods using real-time PCR. Food Chem 2017; 226:149-55 |
[75] | Schroeder A., Mueller O., Stocker S., Salowsky R., Leiber M., Gassmann M. et al. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol 2006; 7:3 |
[76] | Vermeulen J., De Preter K., Lefever S., Nuytens J., De Vloed R, Derveaux S. et al. Measurable impact of RNA quality on gene expression results from quantitative PCR. Nucleic Acids Res 2011; 39:e63 |
[77] | Bjorkman J., Svec D., Lott E., Kubista M., Sjoback R. Differential amplicons (DeltaAmp)-a new molecular method to assess RNA integrity. Biomol Detect Quantif 2016; 6:4-12 |
[78] | Svec D., Tichopad A., Novosadova V., Pfaffl M.W., Kubista M. How good is a PCR efficiency estimate: Recommendations for precise and robust qPCR efficiency assessments. Biomol Detect Quantif 2015; 3:9-16 |
[79] | Tichopad A., Kitchen R., Riedmaier I., Becker C, Stahlberg A., Kubista M. Design and optimization of reverse-transcription quantitative PCR experiments. Clin Chem 2009; 55:1816-23 |
[80] | Sanders R., Mason D.J., Foy C.A., Huggett J.F. Considerations for accurate gene expression measurement by reverse transcription quantitative PCR when analysing clinical samples. Anal Bioanal Chem 2014; 406:6471-83 |
[81] | ISO 5725-1, Accuracy (trueness and precision) of measurement methods and results - Part 1: General principles and definitions |
[82] | ISO 13495:2013, Foodstuffs - Principles of selection and criteria of validation for varietal identification methods using specific nucleic acid |
[83] | ISO 15193:2009, In vitro diagnostic medical devices - Measurement of quantities in samples of biological origin - Requirements for content and presentation of reference measurement procedures |
[84] | ISO 16269-4, Statistical interpretation of data - Part 4: Detection and treatment of outliers |
[85] | ISO 16577:2016, Molecular biomarker analysis - Terms and definitions |
[86] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories |
[87] | ISO 17511, In vitro diagnostic medical devices - Measurement of quantities in biological samples - Metrological traceability of values assigned to calibrators and control materials |
[88] | ISO 20184-1, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for frozen tissue - Part 1: Isolated RNA |
[89] | ISO 20184-2, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for frozen tissue - Part 2: Isolated proteins |
[90] | ISO 20186-1, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for venous whole blood - Part 1: Isolated cellular RNA |
[91] | ISO 20186-2, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for venous whole blood - Part 2: Isolated genomic DNA |
[92] | ISO 20186-3, Molecular in vitro diagnostic examinations - Specifications for pre-examination processes for venous whole blood - Part 3: Isolated circulating cell free DNA from plasma |
[93] | ISO 21571, Foodstuffs - Methods of analysis for the detection of genetically modified organisms and derived products - Nucleic acid extraction |
[94] | ISO 24276, Foodstuffs - Methods of analysis for the detection of genetically modified organisms and derived products - General requirements and definitions |
[95] | ISO 25720:2009, Health informatics - Genomic Sequence Variation Markup Language (GSVML) |
УДК 615.07:006.354 | ОКС 07.080 |
Ключевые слова: биотехнология, требования к оценке эффективности методов количественного определения последовательностей нуклеиновых кислот-мишеней, количественная ПЦР, цифровая ПЦР | |

