ГОСТ Р ИСО 20688-1-2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Биотехнология
СИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ
Часть 1
Требования к производству и контролю качества синтезированных олигонуклеотидов
Biotechnology. Nucleic acid synthesis. Part 1. Requirements for the production and quality control of synthesized oligonucleotides
ОКС 07.080
Дата введения 2024-03-01
Предисловие
1 ПОДГОТОВЛЕН Федеральным государственным бюджетным учреждением "Российский институт стандартизации" (ФГБУ "Институт стандартизации") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 326 "Биотехнологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 11 августа 2023 г. N 635-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 20688-1:2020* "Биотехнология. Синтез нуклеиновых кислот. Часть 1. Требования к производству и контролю качества синтезированных олигонуклеотидов" (ISO 20688-1:2020 "Biotechnology - Nucleic acid synthesis - Part 1: Requirements for the production and quality control of synthesized oligonucleotides", IDT).
Международный стандарт разработан Техническим комитетом ИСО/ТК 276 "Биотехнология" Международной организации по стандартизации (ИСО)
5 ВВЕДЕН ВПЕРВЫЕ
6 Некоторое элементы настоящего стандарта могут являться объектами патентных прав
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
Введение
Одноцепочечные линейные биополимеры, полученные из нуклеотидов, которые называются "синтетическими олигонуклеотидами" или "олигомерами", - незаменимые компоненты для биотехнологии. Например, они используются как праймеры для амплификации полимеразной цепной реакции (ПЦР = PCR), зонды для микроматриц (ДНК), реакции ПЦР в реальном времени или как зонды захвата секвенционирования нового поколения (NGS), а также как вводимые исходные материалы для создания неповрежденных генов-мишеней.
Производственный контроль качества имеет большое значение в синтезе олигонуклеотидов. Количественное определение диапазона размеров, концентрации и загрязнителей необходимо, чтобы обеспечить соблюдение требований к качеству целевого назначения. Учитывая, что олигонуклеотиды используются в биологически активных приложениях, их качество, особенно последовательность и конформация, будет влиять на приспособленность или функцию, например молекулярное распознавание родственного центра связывания, химических свойств. Конкретные требования для каждого конечного приложения могут отличаться.
Настоящий стандарт определяет общие показатели качества синтетических олигонуклеотидов и рассматривает их количественное определение и оценку конечного использования.
Настоящий стандарт предназначен для улучшения менеджмента качества и демонстрации качества продукции.
Международные, национальные или региональные регламенты или требования можно также применить к конкретным темам, затронутым в настоящем стандарте. Например, если синтезированные олигонуклеотиды используют как экспериментальные лекарственные препараты или фармацевтические агенты, могут применяться региональные регламенты и/или нормы надлежащей производственной практики (GMP).
1 Область применения
Настоящий стандарт устанавливает минимальный объем требований к производству и контролю качества синтезированных олигонуклеотидов (номинально до 250 нуклеотидов).
В настоящем стандарте приведены общие показатели качества для синтезированных олигонуклеотидов, а также общие методы оценки показателей качества.
2 Нормативные ссылки
В настоящем стандарте нормативные ссылки отсутствуют.
3 Термины и определения
В настоящем стандарте использованы следующие термины с соответствующими определениями.
Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам:
- платформа онлайн-просмотра ИСО по адресу: http://www.iso.org/obp;
- Электропедия МЭК по адресу: http://www.electropedia.org/.
3.1 сертифицированный стандартный образец; ССО; аттестованный стандартный образец; АСО (certified reference material; CRM): Стандартный образец (см. 3.4) (СО), одно или несколько определенных свойств которого установлены метрологически обоснованной процедурой, сопровождаемый сертификатом СО, в котором приведены значение этого свойства, связанная с ним неопределенность и утверждение о метрологической прослеживаемости.
[ИСО Руководство 30:2015, 2.1.2, с изменениями - примечания удалены]
3.2 функциональный показатель (синтетических олигонуклеотидов) (performance) <synthetic oligonucleotides>: Способность олигонуклеотидов, синтезированных для конкретного использования, включая биологический анализ, выполнять требования для этого конкретного применения.
Примечание 1 - В случае олигонуклеотидов, синтезированных в качестве праймеров для ПЦР, это способность таких синтетических олигонуклеотидов функционировать в качестве праймеров.
Примечание 2 - В случае олигонуклеотидов, синтезированных в качестве зондов для использования в микроматрицах ДНК, ПЦР в реальном времени или NGS, это способность таких синтетических олигонуклеотидов создавать гибриды в качестве зондов с мишенью-последовательностью олигонуклеотидов.
Примечание 3 - Функциональный показатель подтверждается испытанием, оценивающим полноту функционирования олигонуклеотидов во время их соответствующего использования.
3.3 чистота (синтетических олигонуклеотидов) (purity) <synthetic oligonucleotides>: Отношение между ожидаемой последовательностью и/или длиной синтетических олигонуклеотидов и общим числом олигонуклеотидов.
Примечание 1 - Чистота синтетических олигонуклеотидов представляет собой соотношение площади пика оптической плотности, соответствующего синтетическим олигонуклеотидам ожидаемой последовательности и/или длин, и суммарной площади пиков олигонуклеотидов. Измерение оптической плотности при 260 нм (OD 260) вычисляют методом высокоэффективной жидкостной хроматографии (ВЭЖХ = HPLC) или капиллярного электрофореза (КЭ = CE). Чистоту вычисляют методом нормализации площади по результату ВЭЖХ или КЭ или масс-спектрометрии.
3.4 стандартный образец; СО (reference material; RM): Материал, достаточно однородный и стабильный по отношению к одному или нескольким определенным свойствам, которые были установлены для того, чтобы использовать его по назначению в измерительном процессе.
[ИСО Руководство 30:2015, 2.1.1, с изменениями - примечания удалены]
3.5 синтетические олигонуклеотиды (synthetic oligonucleotides): Химически синтезированная ДНК (дезоксирибонуклеиновая кислота) или РНК (рибонуклеиновая кислота).
Примечание 1 - В синтетические олигонуклеотиды могут быть введены различные соединения, такие как модифицированные нуклеиновые основания (структурные элементы нуклеиновых кислот), аналоги оснований, реактивы концевого мечения, флуоресцентные соединения и т.д.
Примечание 2 - В настоящем стандарте синтетический олигонуклеотид считается одноцепочечным, линейным, длиной приблизительно от 10 до 250 нуклеиновых оснований.
4 Проектирование и выбор подходящих олигонуклеотидов, соответствующих поставленной цели
Требования к качеству и последовательности синтетических олигонуклеотидов зависят от их предполагаемого использования. Например, требования к качеству праймера и зонда в полимеразной цепной реакции (ПЦР), или в микроматрице, или в NGS значительно отличаются друг от друга.
Обычно пользователи несут ответственность за установление требований к качеству олигонуклеотидов в соответствии с их конкретным применением.
Производитель может предоставить перечень показателей качества, по которому пользователь может выбрать показатель, который подходит для предполагаемой цели, например "геномного качества" или "десенсибилизирующего качества" (см. 5.2).
Эффективный менеджмент качества и испытания, наряду с общим пониманием показателей качества, могут предоставить достоверные данные, чтобы позволить:
- пользователям правильно выбрать олигонуклеотиды для предполагаемого использования;
- дать пользователям и производителям лучшие возможности обмена информации и согласования технических требований для традиционных олигонуклеотидов.
5 Общие требования к менеджменту качества
5.1 Общие требования
Производитель синтетических олигонуклеотидов (далее - производитель) должен создать и внедрить систему, в которой описаны и документально подтверждены следующие процессы:
a) получение заказа;
b) производство олигонуклеотидов;
c) контроль качества.
Для процесса получения заказа должны быть определены политика и цели обеспечения качества. Требования к обеспечению качества для пользователей зависят от предполагаемого использования, замысла и плана экспериментального метода и возможности получения результатов, влияющих на повторяемость и воспроизводимость. На основе политики обеспечения качества, целей обеспечения качества и классов синтетических олигонуклеотидов (там, где это применимо), четко установленных в формах процесса заказа, производитель должен отслеживать выполнение заказов в соответствии с процессами с помощью таких средств, как, например, карта проверки процесса (см. пример в приложении А). Кроме того, следует принять необходимые меры в отношении производственных процессов, чтобы получить запланированные результаты путем измерений и анализа качества произведенных синтетических олигонуклеотидов.
5.2 Классификация олигонуклеотидов
Чтобы снизить излишнюю индивидуализацию требований к качеству, можно рассмотреть классификацию олигонуклеотидов по качеству. Когда производитель документально подтверждает классификацию нуклеотидов по качеству, классы следует определять на основе предполагаемого использования. Методы очистки следует выбирать и определять в соответствии с каждым классом (см. 7.3).
5.3 Управление документами
Производитель должен иметь процедуру(ы), обеспечивающую(ие) управление документированной информацией, включая записи, требуемые настоящим стандартом, и предотвращение непреднамеренного использования любого потерявшего силу документа. Если документированная информация, включая записи, остается на электронном носителе, производитель осуществляет контроль этой электронной среды.
5.4 Система менеджмента качества
Производитель должен принять систему менеджмента качества. Она устанавливает необходимые процедуры и обеспечивает исполнение производственного контроля, пользуясь этими процедурами. Система менеджмента качества должна регулярно проверять соответствие производства синтетических олигонуклеотидов требованиям настоящего стандарта.
Примечание - Для меченых олигонуклеотидов могут рассматриваться дополнительные показатели качества согласно характеристикам метки, например прочность и длина волны флуоресценции.
5.5 Персонал и обучение
Производитель обеспечивает компетентность персонала в выполнении процедур, установленных в настоящем стандарте, и осуществляет соответствующий надзор над персоналом. Он обеспечивает соответствующую подготовку и оценку компетентности персонала.
5.6 Контроль безопасности
Производитель должен разработать программу по мерам безопасности с учетом применяемых требований, чтобы обеспечить безопасность персонала, выполняющего синтез олигонуклеотидов и очистку их в соответствии с настоящим стандартом.
6 Управление ресурсами
Производитель обеспечивает соответствующее состояние объекта, а также зоны производства олигонуклеотидов. Он поддерживает оборудование и контрольно-измерительные приборы в надлежащем состоянии для производства синтетических олигонуклеотидов. Производитель надлежащим образом контролирует сырье (включая реактивы, чистую воду и вспомогательные материалы), которое может потенциально влиять на качество синтетических олигонуклеотидов.
Пример оборудования и контрольно-измерительных приборов, подходящих для производства олигонуклеотидов, приведен в приложении В.
7 Требования к производственному процессу
7.1 Общие положения
Производство одной последовательности обычно включает следующие процессы:
a) синтез;
b) очистку;
c) контроль качества;
d) сушку, при необходимости;
e) составление рецептуры.
Эти процессы должны проводиться с использованием поддерживаемых в надлежащем состоянии инструментов, например пипеток или сушилок.
Примечание 1 - Некоторые производственные процессы используют для производства комплексных совокупностей олигонуклеотидов. Например, несколько олигонуклеотидов объединяют в комплексную совокупность. В другом варианте такую совокупность проводят посредством матричного синтеза. Можно выбрать и внедрить соответствующие меры по контролю качества на основе метода производства.
Примечание 2 - Общие методы определения показателей качества необязательно подойдут для матричного синтеза.
Примечание 3 - В некоторых случаях одиночные последовательности олигонуклеотидов синтезируют на неоднозначных основаниях для конкретных применений, требующих локального отжига (ренатурации). В этом случае основания пересекаются или переходят на специфический сайт.
7.2 Синтез олигонуклеотидов
Контроль качества необходимо проводить с использованием калиброванных соответствующим образом и обслуживаемых измерительных приборов.
Синтезаторы олигонуклеотидов должны регулярно проходить техническое обслуживание и контроль. Операторы должны быть аттестованы согласно документально подтвержденным процедурам. Записи, касающиеся операций, сохраняют.
7.3 Очистка
Соответствующее оборудование и методы необходимо выбирать на основе анализа рисков по проектной спецификации синтеза нуклеотидов и использовать по назначению в согласованном с пользователем режиме.
Варианты очистки включают: ВЭЖХ с обращенной фазой (С8-С18), анионообменную ВЭЖХ (SAX, WAX), полиакриламидный гель-электрофорез (PAGE), картридж очистки олигонуклеотидов (ОРС), очистку высокой степени от солей (HPSF) и прямое осаждение (обессоливание). Метод очистки можно выбрать в соответствии с предполагаемым назначением олигонуклеотидов. Запись использованного метода сохраняют.
Операции очистки должен выполнять квалифицированный персонал. Записи операций сохраняют.
7.4 Проверка обеспечения качества
Проверку обеспечения качества выполняют с помощью надлежащим образом калиброванных и обслуживаемых измерительных приборов. Измерения должны выполняться квалифицированным персоналом в соответствии с документально подтвержденными процедурами. Кроме того, запись операций необходимо сохранять. Процесс контроля качества проводят, чтобы установить идентичность, чистоту, количество, примеси и другие важные свойства олигонуклеотида в соответствии с его предполагаемым назначением.
7.5 Сушка
Сушку можно выполнять с помощью оборудования для центробежного испарения, сублимационной сушки или воздушной сушки.
Эти операции выполняет квалифицированный персонал в соответствии с документально подтвержденными процедурами. Кроме того, запись операций необходимо сохранять.
7.6 Составление рецептуры
Эти операции выполняет квалифицированный персонал в соответствии с документально подтвержденными процедурами. Кроме того, запись операций необходимо сохранять.
8 Требования к процессу контроля качества
8.1 Общие положения
Процесс контроля качества проводят, чтобы установить идентичность, чистоту, количество, примеси и другие важные свойства олигонуклеотидов в соответствии с их предполагаемым назначением.
Выбирают соответствующие методы и проводят валидацию для установления идентичности и качества олигонуклеотидов.
Измерения должен выполнять квалифицированный персонал.
8.2 Валидация и верификация аналитических методов
Аналитические методы, используемые для выполнения контроля качества и определения параметров качества, подлежат валидации и верификации. Приборы должны быть калиброваны с использованием сертифицированных стандартных образцов.
Примечание - Пример контроля точности измерительных приборов с использованием сертифицированных стандартных образцов и стандартных образцов приведен в приложении Е.
8.3 Идентичность и чистота
8.3.1 Идентичность базовой последовательности
Базовую последовательность можно определить подходящими методами, например ионизацией методом электрораспыления (ESI) или матрично-активированной лазерной десорбцией/ионизацией (MALDI) в качестве источника ионов, с использованием времени пролета (ToF), ионной ловушкой или квадрупольным масс-спектрометром (МС = MS) в качестве анализатора масс, или методом определения последовательности аминокислотных остатков.
Примечание 1 - Пример подтверждения базовых последовательностей с использованием масс-спектрометрии приведен в приложении D.
Примечание 2 - Масс-спектрометрию можно использовать для определения последовательности коротких олигонуклеотидов, в то же время существуют ограничения на точность анализа для определения последовательности, зависящей от длины синтетических олигонуклеотидов.
Определенная идентичность базовой последовательности должна быть документально подтверждена.
8.3.2 Чистота
Чистоту данного нуклеотида для конкретного предполагаемого использования следует определять и согласовывать между производителем и пользователем.
Пример - Чистоту синтетического олигонуклеотида можно определить как отношение между количеством предполагаемого нуклеотида и общим количеством олигонуклеотидов. Предполагаемый(е) нуклеотид(ы) - это олигонуклеотид(ы) с "ожидаемой длиной цепочки" и/или правильной последовательностью.
Методы определения чистоты могут включать один или несколько из следующих методов:
a) аналитический с обращенной фазой или ионообменную высокоэффективную жидкостную хроматографию;
b) капиллярный или блочный гель-электрофорез с валидацией отклика относительной линейности;
c) МС (например, ESI или MALDI в качестве источника ионов, ToF, ионную ловушку или квадрупольную МС в качестве анализатора масс);
d) определение последовательности аминокислотных остатков.
Примечание - Синтетические олигонуклеотиды являются комплексными молекулами и дают разные результаты на основе проектирования олигонуклеотидов и производственного процесса.
Определенная чистота должна быть задокументирована.
8.3.3 Примеси
В некоторых задачах важно определить примеси.
Приемлемую степень или диапазон примесей данного олигонуклеотида для конкретного предполагаемого применения следует определить и согласовать между производителем и пользователем. В общем, примесь - это количество олигонуклеотида, которое мешает предполагаемому применению. Степень примесей необходимо определять подходящим методом.
Примечание - Примеси включают (но не ограничиваются этим) органический растворитель, мононуклеотиды, нуклеиновые кислоты с короткой цепочкой или с неправильной последовательностью.
Методы определения примесей могут включать один или несколько методов в сочетании:
a) аналитический с обращенной фазой или ионообменную высокоэффективную хроматографию;
b) капиллярный или блочный гель-электрофорез с валидацией отклика относительной линейности;
c) МС (ToF или ESI);
d) определение последовательности аминокислотных остатков.
Выявленные примеси должны быть задокументированы.
8.4 Количество
8.4.1 Общие положения
Для предполагаемого анализа по предварительному согласованию должно быть представлено достаточное количество олигонуклеотидов.
Производитель должен подтвердить, что синтезированное количество соответствует требованиям пользователя.
Согласованное количество синтетических олигонуклеотидов необходимо подтвердить документально.
8.4.2 Концентрация
Измерение концентрации олигонуклеотидов можно использовать как часть процесса контроля качества во время производства или испытаний (проверки) продукции. Оптическую плотность (OD) можно использовать для измерения концентрации олигонуклеотидов, присутствующих в растворе. В общем, используют оптическую плотность при длине волны 260 нм.
Молярную концентрацию вычисляют на основе коэффициента молярной экстинкции и OD. Формула (C.1) и параметры для вычисления коэффициента молярной экстинкции приведены в приложении C.
Поскольку в вычислении коэффициента молярной экстинкции используют различные допущения, данные о коэффициенте молярной экстинкции, включая используемые допущения, необходимо подтвердить документально (см. [7]).
Можно также использовать другие методы, такие как ВЭЖХ, для измерения концентрации после демонстрации корреляции с оптической плотностью, если применимо, путем использования СО или ССО олигонуклеотида.
Измеренную концентрацию необходимо задокументировать.
8.4.3 Масса
Массу указывают в нанограммах или преобразуемых прослеживаемых единицах СИ.
Массу вычисляют по формуле
где m - масса, нг;
C - коэффициент преобразования, нг/мл;
D - коэффициент разбавления.
8.5 Молярная масса и/или длина баз
Молярную массу и/или длину баз синтезированных олигонуклеотидов следует определять и подтверждать документально. Молярную массу можно определить непосредственно, используя масс-спектрометрию (МС) (включая ESI или MALDI в качестве источника ионов, ToF, ионную ловушку или квадрупольную МС в качестве анализатора масс) или косвенно, посредством электрофореза, методами блочного гель-электрофореза или капиллярного электрофореза, управляемыми по приборам.
Операцию подтверждения должен выполнять квалифицированный персонал, а записи операции - сохраняться.
Масс-спектрометрия (МС) - это метод определения общей массы атомов в молекуле. При использовании МС молярную массу синтетических олигонукеотидов вычисляют по формуле
M = [{#dA·313,200) + (#dC·289,17) + (#dG·329,19) + (#dT·304,18) + (#dU·290,16) +
+ (#I·314,18) + (#rA·329,19) + (#rC·305,17) + (#rG·345,19) + (#rU·306,15)} +
+ (#rI·330,20) - 62] + 1, (2)
где M - молярная масса, г/моль;
#dA - число аденина (дезоксирибонуклеиновая кислота);
#dC - число цитозина (дезоксирибонуклеиновая кислота);
#dG - число гуанина (дезоксирибонуклеиновая кислота);
#dT - число тимина (дезоксирибонуклеиновая кислота);
#dU - число урацила (дезоксирибонуклеиновая кислота);
#I - число инозина (дезоксирибонуклеиновая кислота);
#rA - число аденина (рибонуклеиновая кислота);
#rC - число цитозина (рибонуклеиновая кислота);
#rG - число гуанина (рибонуклеиновая кислота);
#rU - число урацила (рибонуклеиновая кислота);
#rI - число инозина (рибонуклеиновая кислота).
Примечание 1 - См. [8]-[12], а также C.1 и таблицу C.1 для дополнительной информации.
Примечание 2 - Формулу (2) можно использовать для вычисления молярной массы на основе 3’-терминальной модификации фосфорной кислоты.
Если используют другую формулу, это необходимо подтвердить документально.
Молярную массу олигонуклеотидов с модификациями можно вычислить с помощью значения молярной массы модифицированных соединений, приведенных в примерах в C.2.
8.7 Протокол
Протокол синтеза олигонуклеотидов должен включать в т.ч. следующую информацию:
a) идентификатор продукции;
b) число лотов продукции:
- процесс производства и контроль качества должен обеспечить прослеживание связи;
c) синтез по заказу пользователя;
d) метод очистки;
e) последовательность олигонуклеотидов:
- описание должно быть в форме кода по IUPAC, примеры приведены в приложении C;
f) молярную массу в граммах на моль и/или число оснований (длину баз).
Примечание 1 - См. формулу (2). В принципе, молярная масса для компонентов олигонуклеотидов не содержит модификаторы, включающие линкеры. Предполагается, что фосфатная группа на 5’-конце не существует;
g) формулу, используемую для вычисления молярной массы;
h) единицы OD.
Примечание 2 - OD - широко используемое выражение количества олигонуклеотидов.
Примечание 3 - См. 8.4.3;
i) данные по коэффициенту молярной экстинкции, включая применяемые допущения.
Примечание 4 - См. формулу (C.1);
j) общее число молей.
Примечание 5 - Это значение можно вычислить на основе показателей оптической плотности, приведенных в таблице C.1, и формулы (C.1), приведенной в приложении C;
I) содержание гуанина-цитозина (GC);
m) рекомендованное состояние (например, конкретный буфер, включая буфер ТЕ) для повторного суспендирования синтетических олигонуклеотидов;
n) дату окончания срока действия:
- дату окончания срока действия следует определять по эмпирическим данным - оценки срока годности можно применять на основе результатов аналогичного исследования стабильности олигонуклеотидов.
Примечание 6 - В качестве примера: обычный срок годности составляет два года для высушенных продуктов, хранящихся при температуре 4°C, и один год - для продуктов в растворе, хранящихся при температуре минус 20°C;
o) условия хранения:
- условия хранения должны определяться по эмпирическим данным - условия хранения могут применяться на основе результатов по аналогичным исследованиям стабильности олигонуклеотидов.
Примечание 7 - Обычно это температура 4°C для высушенных продуктов и минус 20°C для продуктов в растворе, в то же время можно использовать другой температурный диапазон на основе соглашения между пользователем и производителем;
p) условия отгрузки.
8.8 Верификация корректирующих действий и улучшений
Система менеджмента качества должна осуществлять действия по устранению причин для проблем, включая несоответствия и жалобы заказчика на качество продукции. Если подтверждается возможность улучшения продукции, то следует рассмотреть соответствующие действия. Система менеджмента качества должна обеспечить записи о корректирующих действиях или улучшениях и сохранить их. Система менеджмента качества должна регулярно анализировать статус корректирующих действий и улучшений.
9 Дополнительные требования для синтетических олигонуклеотидов (РНК)
Требования к системе менеджмента качества, приведенные в разделах 4-8, должны также применяться к синтетической РНК.
Кроме того, ввиду склонности РНК к разложению катаболическими ферментами, применяют следующие дополнительные требования:
a) необходимо использовать стерилизованную, не содержащую нуклеаз аппаратуру, например контейнеры и наконечники;
b) чистая вода или буферные растворы, используемые для производства, должны изготавливаться на основе воды, полученной из контролируемой системы очистки. Электропроводность воды, полученной из принятой системы очистки, необходимо регулярно проверять. Реактивы должны приготавливаться на соответствующем оборудовании в контролируемых условиях, чтобы избежать загрязнения нуклеазами. Дополнительно для высушенной продукции предупреждающие заявления должны способствовать быстрому использованию реактивов после того, как откроют герметично закупоренный сосуд. Материалы следует транспортировать в сухом виде. Если продукцию транспортируют и хранят в растворе, ее необходимо держать в замороженном состоянии при транспортировании и хранить при температуре минус 80°C.
Приложение A
(справочное)
Карта проверки процесса
В таблице A.1 представлен пример карты проверки процесса, которую можно использовать для оценки соответствия синтетических олигонуклеотидов.
Таблица A.1 - Карта проверки процесса
Процесс | Требование | Соответствие | Замечания | |||
Соот ветст- вует | Не соотве- тствует | Не приме- няется | Доку- менты и раз- делы | |||
Процесс | Номер изделия | |||||
получения заказа | Информация от заказчика | |||||
Сведения о последовательности | ||||||
Модификации и т.д. | ||||||
Метод очистки | ||||||
Дата получения заказов/срок выполнения | ||||||
Лицо, ответственное за получение заказов | ||||||
Выход | ||||||
Процесс производства | Контроль оборудования | |||||
Синтез | ||||||
Лицо, ответственное за синтез | ||||||
Очистка | ||||||
Лицо, ответственное за очистку | ||||||
Измерение выхода | ||||||
Лицо, ответственное за измерение выхода | ||||||
Процесс | Контроль качества | |||||
контроля качества | Контроль оборудования | |||||
Лицо, ответственное за контроль качества | ||||||
Письменный отчет | ||||||
Лицо, ответственное за письменный отчет | ||||||
Процесс отгрузки | Лицо, ответственное за отгрузку | |||||
Общие сведения | Менеджер по качеству | |||||
Обучение/квалификация | ||||||
Законодательное требование | ||||||
Корректирующее действие | ||||||
Контроль документации | ||||||
Контроль записей | ||||||
Приложение B
(справочное)
Перечень оборудования и устройств и стандарты по их контролю
Пример перечня оборудования и устройств с соответствующими стандартами по их контролю приведен в таблице B.1, [13], [14].
Таблица B.1 - Перечень оборудования и устройств с соответствующими стандартами по их контролю
Типы оборудования | Спецификации | Предполагаемое использование | Требования | Частота производства контроля |
Оборудование с температурным контролем (инкубатор, | - | Хранение реактивов | Однородность и стабильность температуры | В момент установки, каждые два года и после ремонта |
холодильник, морозильник и т.д.) | Проверка температуры | Ежедневно | ||
Система производства чистой воды | - | Контроль качества | Проверка электропроводности | Еженедельно |
pH-метр | - | Приготовление реактивов | Регулировка с помощью не менее двух типов прослеживаемых буферных растворов надлежащего качества | Ежедневно в месте использования |
Взвешивающее устройство | - | Приготовление реактивов | Подтверждение нулевой точки и проверка считывания с помощью стандартного груза или проверка работы встроенного устройства проверки исправности | Ежедневно в месте использования |
Автоматическая или ручная пипетка | - | Дозировка реактивов | Калибровка и проверка точности количества, перенесенного с помощью пипетки | Периодически |
Центрифуга | - | Центрифугирование | Нормальное функционирование без аномального шума | В месте использования |
Синтезатор олигонуклеотидов | Устройства, которые могут осуществлять синтез олигонуклеотидов с использованием -цианоэтил- фосфор-амидита, методы 1), 2) | Синтез олигонуклеотидов | Проверка клапанов и объема потока реактивов | Периодически |
Автоматическая система пипеток | Роботы для применения автоматизированных пипеток и т.д. | Дозировка реактивов или синтетических олигонуклеотидов и т.д. | Проверка точности перенесенного пипеткой количества | Периодически |
Система высокоэффективной жидкостной хроматографии | Устройства, к которым можно приладить подходящие колонки и оснастить детектором, который может измерять длину волны оптической плотности от 254 до 260 нм, с записывающим устройством, которое может суммировать площади пиков, при необходимости, и с устройством для отбора фракций | Очистка олигонуклеотидов | Встроенная проверка технических характеристик (исправности) и проверка эффективности колонок | Периодически |
Оборудование для электрофореза | Устройства, которые могут выполнять гель-электрофорез на полиакриламиде или на агарозе в естественных и денатурирующих условиях, или детекторные устройства, такие как УФ-лампы | Подтверждение длин баз | Способность разделения и детектирования соответствующих маркеров молярной массы | Периодически |
Система капиллярного электрофореза | Устройства, которые могут разделять синтетические олигонуклеотиды в естественных или денатурирующих условиях и оснащены детекторами и записывающими устройствами с функцией суммирования площадей пиков | Подтверждение длин баз | Способность разделения и детектирования соответствующих маркеров молярной массы | Периодически |
Сушилка | Устройства, которые используют с целью сушки растворов синтетических олигонуклеотидов | Сушка синтетических олигонуклеотидов | Проверка времени сушки | В месте использования |
Спектрофотометр | Одно- или двухлучевые спектрофотометры | Измерение выхода синтетических олигонуклеотидов | Встроенная проверка технических характеристик | Периодически |
Измерение выхода синтетических олигонуклеотидов | Калибровка путем применения оптического фильтра для калибровки | Периодически | ||
Частоту проверок определяют для обеспечения соответствия назначению при традиционном способе и частоте использования (см., например, ИСО 9001 или стандарты, относящиеся к системе менеджмента качества организации). Например, оптический стеклянный фильтр, который предназначен для калибровки спектрофотометров. | ||||
Приложение C
(справочное)
Вычисление молярной массы и молярных чисел
C.1 Информация, необходимая для вычисления молярной массы и коэффициента молярной экстинкции
Информация, требуемая для вычисления молярной массы (см. 8.5) и коэффициента молярной экстинкции, приведена в таблицах C.1 и C.2. Приведенная информация является неполным перечнем обычных примеров, особенно в отношении меченых форм.
Молярное число синтетических олигонуклеотидов вычисляют по оптической плотности (выраженной через значение OD), деленной на коэффициент молярной экстинкции.
Коэффициент молярной экстинкции при pH, равном 7,0 и 260 нм, вычисляют по формуле
+ (#rA·14,9) + (#rC·7,55) + (#rG·13,6) + (#rU·10) + (#rI·12,1), (C.1)
#dA - число аденина (дезоксирибонуклеиновая кислота);
#dC - число цитозина (дезоксирибонуклеиновая кислота);
#dG - число гуанина (дезоксирибонуклеиновая кислота);
#dT - число тимина (дезоксирибонуклеиновая кислота);
#dU - число урацила (дезоксирибонуклеиновая кислота);
#I - число инозина (дезоксирибонуклеиновая кислота);
#rA - число аденина (рибонуклеиновая кислота);
#rC - число цитозина (рибонуклеиновая кислота);
#rG - число гуанина (рибонуклеиновая кислота);
#rU - число урацила (рибонуклеиновая кислота);
#rl - число инозина (рибонуклеиновая кислота).
Формула (C.1) не применима к модифицированным олигонуклеотидам.
Можно использовать другую формулу, если она задокументирована и внесена в протокол по 8.7.
Таблица C.1 - Молярная масса и коэффициент молярной экстинкции базовых молекул
Код по IUPAC | Молярная масса , г·моль | Коэффициент молярной экстинкции при pH 7,0 и 260 нм, л·моль · см |
dA | 313,20 | 15,2 |
dC | 289,17 | 7,4 |
dG | 329,19 | 11,8 |
dT | 304,18 | 8,8 |
dU | 290,16 | 10,1 |
rA | 329,19 | 14,9 |
rC | 305,17 | 7,55 |
rG | 345,19 | 13,6 |
rU | 306,15 | 10 |
I | 314,18 | 12,1 |
rl | 330,18 | 12,1 |
Молярная масса - это масса в водном растворе. | ||
C.2 Дополнительная ссылка для вычисления молярной массы и коэффициента молярной экстинкции
В таблице C.2 приведен неполный перечень широко используемых примеров технологии мечения.
Таблица C.2 - Мечение
Сайт | Модификация | Молярная масса, г·моль | Коэффициент молярной экстинкции, л·моль · см | Возбуждение , нм | Эмиссия , нм |
5’- | Су5 | 534,6 | 250000 (650 нм) | 643 | 667 |
5’- | Су3 | 507,6 | 150000 (550 нм) | 550 | 570 |
5’- | Су5 (посредством аминомодификации) | 817,0 | 250000 (650 нм) | 643 | 667 |
5’- | Су3 (посредством аминомодификации) | 791,9 | 150000 (550 нм) | 550 | 570 |
5’- | Амино | 179,2 | - | - | - |
5’- | Биотин | 405,5 | - | - | - |
5’- | Тиол | 329,4 | - | - | - |
5’- | 6-FAM | 537,5 | 83000 (496 нм) | 496 | 516 |
3’ | Су5 (посредством аминомодификации) | 848,0 | 250000 (650 нм) | 643 | 667 |
3’ | Су3 (посредством аминомодификации) | 820,9 | 150000 (550 нм) | 550 | 570 |
3’ | Амино | 208,2 | - | - | - |
3 | Биотин (с линкером TEG) | 569,6 | - | - | - |
3’ | Тиол (до восстановления) | 244,3 | - | - | - |
3’ | TAMRA | 626,7 | 95000 (546 нм) | 546 | 576 |
3’ | 7-деазапропагиламино dA | 351,26 | - | - | - |
3’ | 7-деазапропагиламино dG | 368,26 | - | - | - |
3’ | N2-аминогексил dG | 429,39 | - | - | - |
3’ | 5-миногексил dC | 457,43 | - | - | - |
3’ | 5-миногексил dT | 458,41 | - | - | - |
3’ | 5-флуоресцин dC | 874,91 | - | - | - |
3’ | 5-TAMRA dC | 815,73 | - | - | - |
3’ | 5-TAMRA dT | 875,9 | - | - | - |
3’ | 5-флуоресцин dT | 816,72 | - | - | - |
Приложение D
(справочное)
Верификация последовательностей олигонуклеотидов с помощью анализа масс
D.1 Общие положения
В настоящем приложении приведен пример анализа базовой последовательности олигонуклеотидов посредством затухания источника ионов с использованием матрично-активированной лазерной десорбционно-ионизационной время-пролетной масс-спектрометрии (MALDI-ToF MS) и квадрупольной масс-спектрометрии с электрораспылительной ионизацией (ESI-Q-MS).
D.2 Протокол испытания методом MALDI-ToF MS
a) Предварительная обработка пробы:
- каждый аналит растворяют в чистой воде, чтобы получить конечную концентрацию 50 пикомоль/мкл.
1 мкл раствора пробы и 0,5 мкл матричного раствора наносят пятнами на пластинку MALDI. Затем эту пластинку MALDI сушат на воздухе, загружают в прибор и выполняют масс-спектрометрию.
Примечание - Матричный раствор представляет собой 20 мг/мл 2,4-дигидроксиацетофенона (DHAP) и 70 мМ двуосновного аммониумцитрата в 50%-ном растворе ацетонитрила.
b) Условия проведения MALDI-ToF MS:
- условия испытания приведены в таблице D.1.
Таблица D.1 - Условия проведения MALDI-ToF MS
Используемое устройство | Матрично-активированный лазерный десорбционно-ионизационный время-пролетный масс-спектрометр |
Особенности | Источник света: азотный лазер ( 337,1 нм) |
Ускоряющее напряжение | 20 kB |
Замедленная экстракция | Оптимизировано для m/z 3000 |
Режим пролета | Линейный режим (режим обнаружения положительного иона) |
Диапазон измерения | m/z 1-15000 |
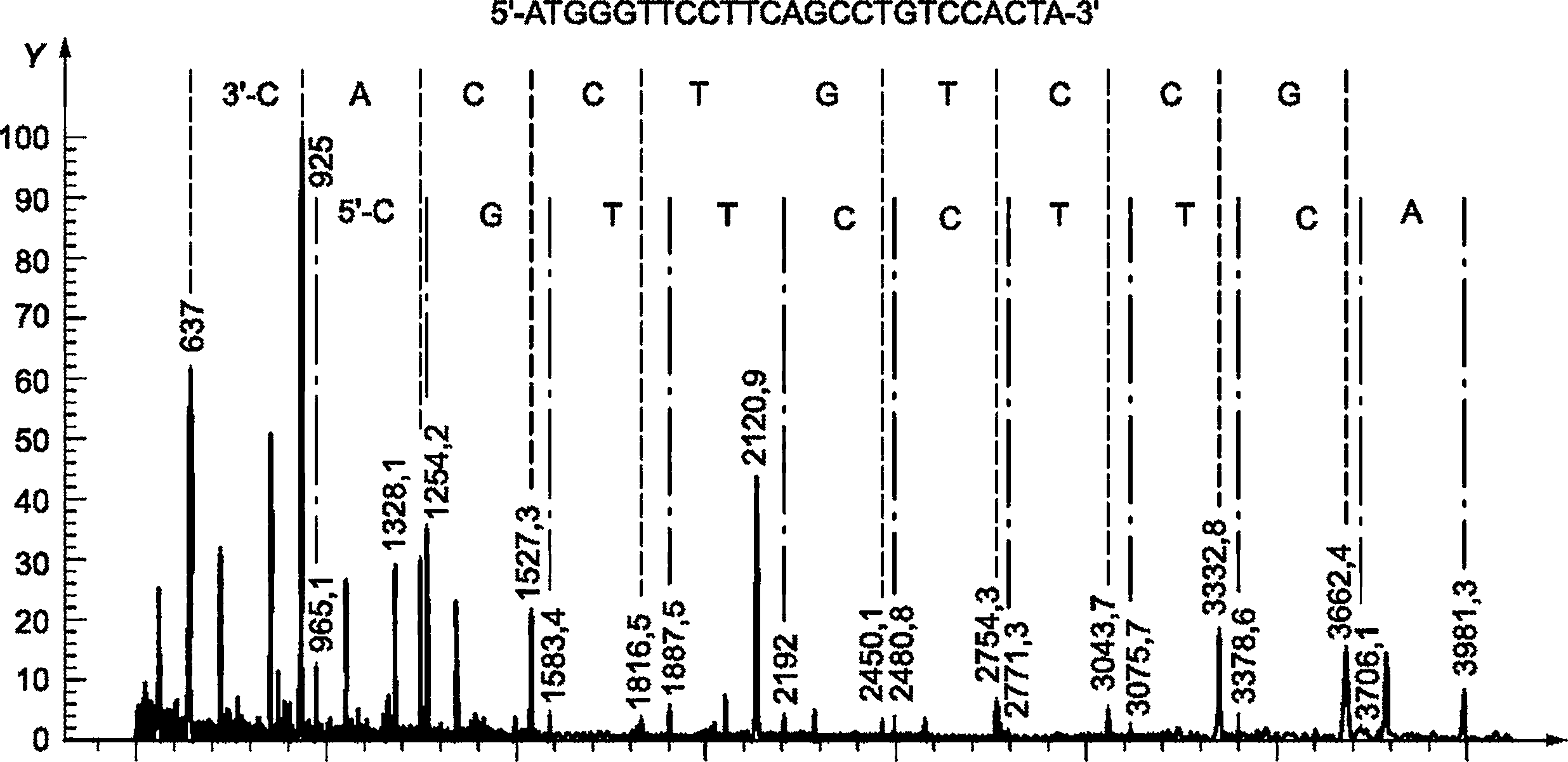
Синтетический олигонуклеотид анализируют методом MALDI-ToF MS, используя условия, приведенные в D.2. Каждый пик, приведенный на рисунке D.1, соотносится с каждым нуклеотидом в обозначенной позиции в олигонуклеотиде путем использования оригинальной аналитической программы.
 |
X - m/z; Y - интенсивность, %
Рисунок D.1 - Примеры результатов масс-спектрометрии для синтетического олигонуклеотида
D.3 Протокол испытания ESI-Q-MS
a) Предварительная обработка пробы:
1) каждый аналит растворяют в чистой воде до конечной концентрации 10 пмоль/мкл. Загрузки масс на колонку выдерживают постоянными на уровне инъекций 50 пмоль или 5 мкл;
3) подвижная фаза B: 15 мМ буфера TAE, 400 мМ HFIP, приготовленного в метаноле (MeOH).
Таблица D.2 - Таблица градиента ВЭЖХ
Время, мин | Скорость потока, мл/мин | % A | % B |
Начало | 0,2 | 81,0 | 19,0 |
15,0 | 0,2 | 73,5 | 26,5 |
16,0 | 0,2 | 50,0 | 50,0 |
17,0 | 0,2 | 81,0 | 19,0 |
21,0 | 0,2 | 81,0 | 19,0 |
b) Условия проведения ESI-Q-MS (см. таблицу D.3):
Таблица D.3 - Условия проведения ESI-Q-MS
Используемое испытательное устройство (ЖХ) | Ультравысокоэффективная жидкостная хроматография |
Используемое испытательное устройство (детектор) | Масс-спектрометр |
Колонка | Колонка технологии разделения олигонуклеотидов, 1,7 мкм, 2,1 мм, 50 мм |
Температура колонки | 60°C |
Температура пробы | 10°C |
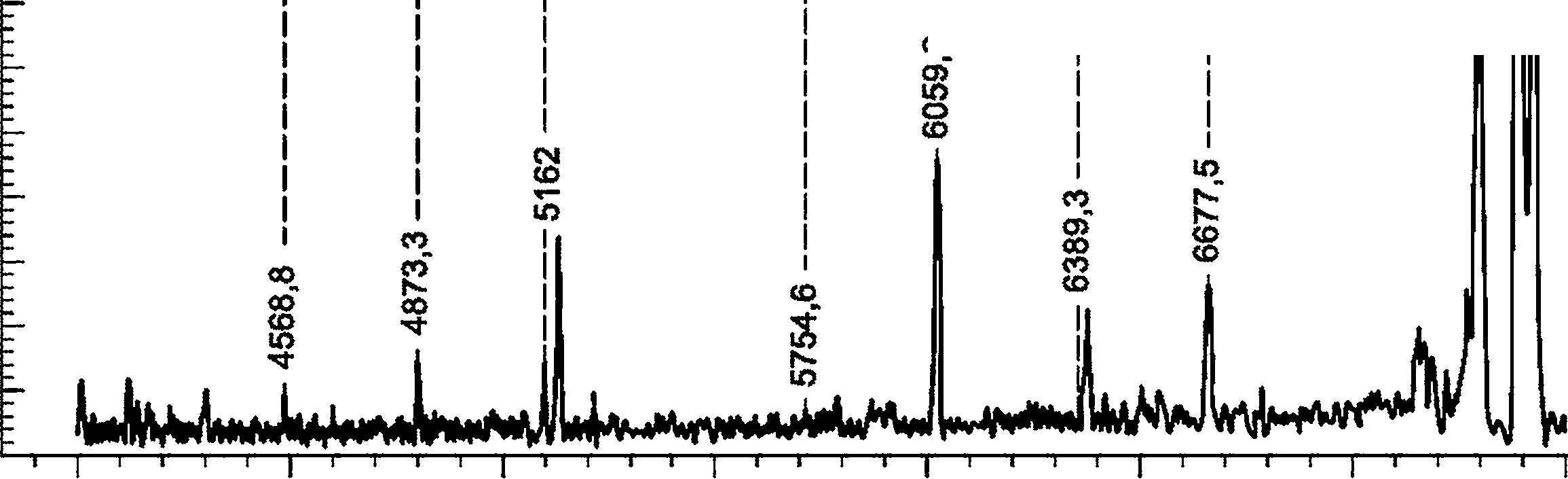
c) Результаты:
 |
a) - хроматограмма; b) - необработанный МС-спектр; c) - спектр после деконволюции; X1 - время удерживания, мин; X2 - m/z; X3 - масса (Da); Y - интенсивность
Рисунок D.2 - Примеры результатов масс-спектроскопии (ESI-Q-MS) для синтетических олигонуклеотидов
Синтетический олигонуклеотид анализируют методом ESI-Q-MS при условиях, приведенных в D.3. Деконволюция необработанного спектра МС стандарта нуклеотида 30 nt, дающая массу основного пика 9064,5 Да (+0,7 Да) и небольшой пик аддуктного иона натрия (Na+) с относительной интенсивностью менее 6%, как показано на рисунке D.2.
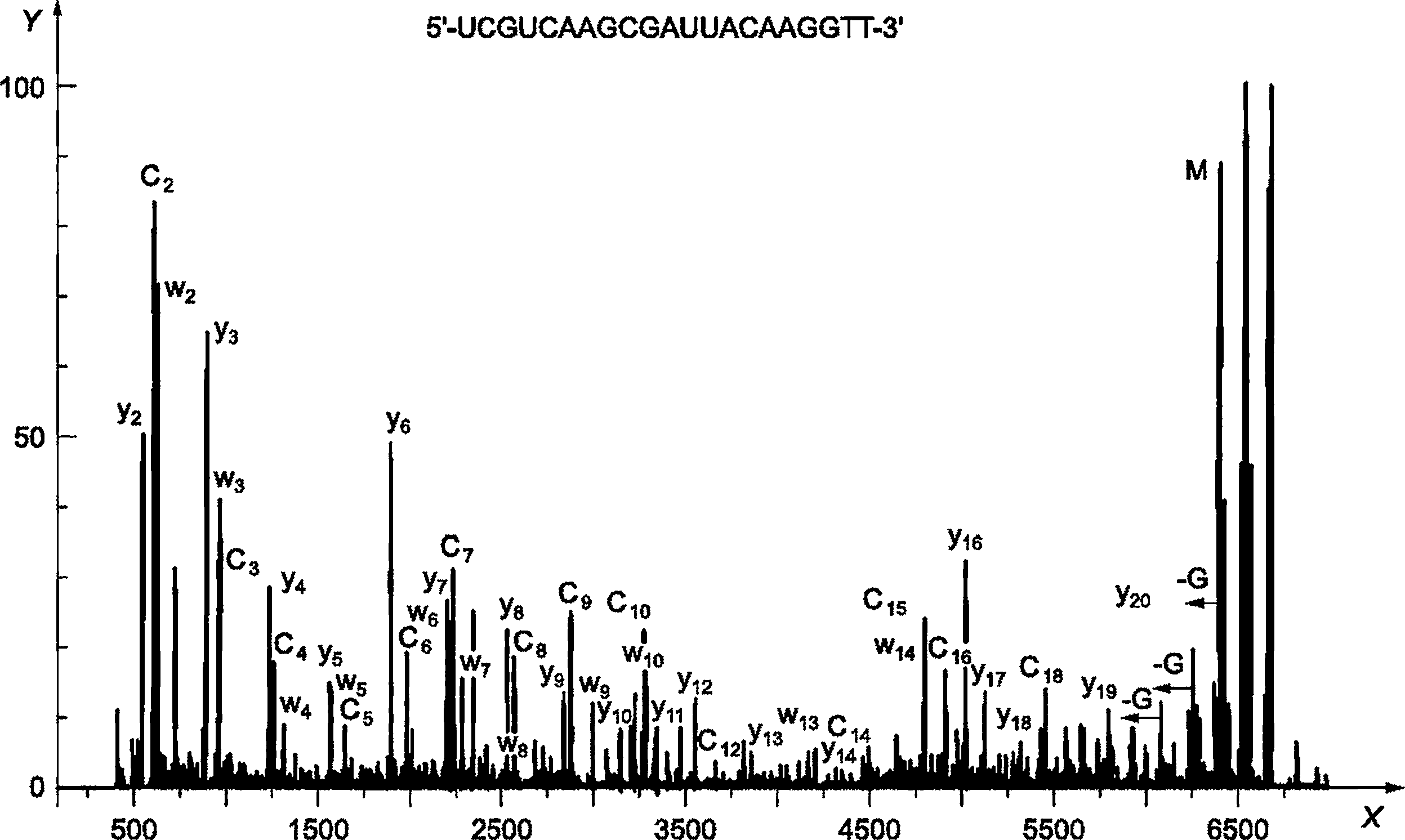
D.4 Протокол проведения испытания ESI-Q-MS/MS
а) Предварительная обработка пробы:
1) в данном испытании была 21-нуклеотидная (nt) олигоРНК (5’-rUrCrGrUrCrArArGrCrGrArUrUrArCrArArGrGrTT-3’) (5 пмоль/мкл в воде);
3) подвижная фаза B: 15 мМ буфера TAE, 400 мМ HFIP, приготовленного в MeOH.
b) Условия испытания ESI-Q-MS/MS:
- условия испытания приведены в таблицах D.4, D.5 и D.6.
Таблица D.4 - Таблица градиента ВЭЖХ
Время, мин | Скорость потока, мл/мин | % A | % B |
Начало | 0,2 | 87,0 | 13,0 |
10,0 | 0,2 | 77,0 | 23,0 |
10,1 | 0,2 | 50,0 | 50,0 |
11,1 | 0,2 | 50,0 | 50,0 |
11,2 | 0,2 | 87,0 | 13,0 |
16,0 | 0,2 | 87,0 | 13,0 |
Таблица D.5 - Условия проведения ESI-Q-MS/MS
Использованное испытательное устройство (ЖХ) | Ультравысокоэффективная жидкостная хроматография |
Использованное испытательное устройство (детектор) | Микромасс-спектрометр квадрупольный время-пролетный |
Колонка | Колонка технологии разделения олигонуклеотидов, 1,7 мкм, 2,1 мм, 50 мм |
Температура колонки | 60°C |
Температура пробы | 6°C |
Таблица D.6 - Условия ESI-Q-MS/MS
МС-система | Микромасс-спектрометр квадрупольный время-пролетный |
Данные диапазона масс | От 400 до 3000 Да |
Режим | Отрицательное разрешение ESI |
Напряжение на конусе | 2,0 kB |
Сдвиг источника | 80 В |
Температура источника | 125°C |
Температура десольвации | 500°C |
Газовый поток при десольвации | 800 л/ч |
Фиксированная масса | Глу-фибринопептид В при 100 фмоль/мкл в 50-50 -CAN, 0,1% FA |
c) Результаты:
 |
X - масса; Y - интенсивность, %
Рисунок D.3 - Примеры результатов масс-спектроскопии (ESI-Q-MS/MS) для синтетических олигонуклеотидов
Приложение E
(справочное)
Контроль точности измерительного прибора с помощью сертифицированных стандартных образцов. Примеры
E.1 Общие положения
Сертифицированные стандартные образцы можно использовать для контроля точности измерительных приборов для измерения синтетических олигонуклеотидов. В настоящем приложении описываются примеры.
E.2 Измерение концентрации ДНК
Сертифицированный стандартный образец концентрации ДНК измеряют согласно следующим условиям, приведенным в a)-c), и получают результаты на спектрофотометре (см. таблицу E.1). Результаты можно использовать для оценки точности спектрофотометра.
a) Использованный сертифицированный стандартный образец:
- Сертифицированный стандартный образец ДНК Национального института передовой промышленной науки и техники (National Institute of Advanced Industrial Science and Technology) (CRM 6203-a).
Примечание - CRM 6203 переходит в CRM 6205 путем улучшения стабильности.
b) Измерительный прибор: спектрофотометр.
c) Порядок выполнения операций:
1) включают прибор в режиме "Начало автокалибровки (Auto calibration starts)";
2) выбирают режим измерения;
3) устанавливают длину волны 260 нм;
4) в кювету наливают воду, не содержащую нуклеаз, в качестве контроля;
5) выполняют калибровку;
6) в другую кювету помещают пробу. Выполняют измерение три раза, оставив пробу в кювете, и записывают значения оптической плотности;
7) вычисляют концентрацию РНК по оптической плотности, коэффициент молярной экстинкции, базовый состав и длину оптического пути (см. приложение C в отношении коэффициента молярной экстинкции).
Таблица E.1 - Пример измерений концентраций ДНК
Сертифицированные стандартные образцы | Значения измерений | Значения, предлагаемые органом по сертификации | ||
OD260 | Концентрация, нг/мкл | Сертифицированное значение, нг/мкл | Расширенная неопределенность, нг/мкл | |
CRM6203-a-A | 0,1241 | 15,513 | 12,4 | 0,8 |
CRM6203-a-G | 0,1398 | 17,475 | 12,4 | 1,1 |
CRM6203-a-T | 0,1146 | 14,325 | 13 | 1,4 |
Образцы серии CRM6203 не предоставляют с июня 2017 г. В то же время стал доступен последующий продукт серии CRM6205. Данные, указанные в таблице, равноценны для серии CRM6205. | ||||
E.3 Измерение концентрации ДНК. Пример 1
Сертифицированный стандартный образец концентрации РНК измеряют согласно условиям, указанным в a)-c), и получают результаты на спектрофотометре (см. таблицу E.2). Результаты можно использовать для оценки точности спектрофотометра.
a) Сертифицированный стандартный образец.
Примечание - Сертифицированный стандартный образец РНК Национального института передовой промышленной науки и техники (National Institute of Advanced Industrial Science and Technology) (CRM 6204-a).
b) Измерительный прибор: спектрофотометр.
c) Порядок выполнения операций:
1) включают прибор (автокалибровка начинается);
2) выбирают режим "Папка конфигурации приложения (Application folder)", а затем "Монохроматический режим (Single wavelength)";
3) устанавливают длину волны 260 нм и режим "Оптическая плотность (Absorbance)";
4) помещают в кювету, выполненную из пропускающих ультрафиолет материалов, воду, не содержащую нуклеаз, в качестве контроля;
5) нажимают клавишу "0А/100%Т" для выполнения калибровки;
6) в другую кювету помещают пробу и нажимают клавишу измерения. Выполняют измерения три раза, оставив пробу в кювете, и записывают значения оптической плотности;
7) вычисляют концентрацию РНК по оптической плотности, коэффициент молярной экстинкции, базовый состав и длину оптического пути (см. приложение C в отношении коэффициента молярной экстинкции).
Таблица E.2 - Пример измерений концентрации РНК
Сертифицированные стандартные образцы | Значения измерений | Значения, предложенные органом по сертификации | ||
А260 | Концентрация, нг/мкл | Сертифицированное значение, нг/мкл | Расширенная неопределенность, нг/мкл | |
CRM6204 500-A | 0,827 | 33,08 | 30,6 | 3,1 |
CRM6204 500-B | 0,736 | 29,44 | 27,3 | 2,4 |
E.4 Измерение концентрации РНК. Пример 2
Другой пример измерения концентрации РНК по сертифицированному стандартному образцу приведен ниже (см. таблицу E.3). Результаты можно также использовать для оценки точности спектрофотометра.
a) Сертифицированный стандартный образец.
Примечание - Сертифицированный стандартный образец РНК Национального института передовой промышленной науки и техники (National Institute of Advanced Industrial Science and Technology) (CRM 6204-a).
b) Измерительный прибор: спектрофотометр.
c) Порядок проведения операций:
1) загружают программу nanodrop и выбирают "Измерение нуклеиновых кислот (Nucleic acid measurement)";
2) выбирают в качестве измерительного объекта "РНК (RNA)", наносят 2 мкл воды и выполняют холостое измерение;
3) протирают наружную поверхность для измерений, наносят 2 мкл пробы и затем выполняют измерение. Измерения выполняют три раза, записывают значения оптической плотности при длине волны 260 нм и определяют концентрацию РНК, а затем вычисляют среднее значение от трех измерений. В другом варианте концентрацию РНК можно рассчитать по оптической плотности при 260 нм, а коэффициент молярной экстинкции - см. приложение D.
Таблица E.3 - Пример измерений концентрации РНК
Сертифицированные стандартные образцы | Значения измерений | Значения, предложенные органом по сертификации | ||
А260 | Концентрация, нг/мкл | Сертифицированное значение, нг/мкл | Расширенная неопределенность, нг/мкл | |
CRM6204 500-C | 0,949 | 37,9 | 32,4 | 3,2 |
CRM6204 1000-A | 1,735 | 69,4 | 58,3 | 4,9 |
CRM6204 1000-B | 1,746 | 69,8 | 59,5 | 5,3 |
Приложение F
(справочное)
F.1 Общие положения
F.2 Пример выбора алгоритма
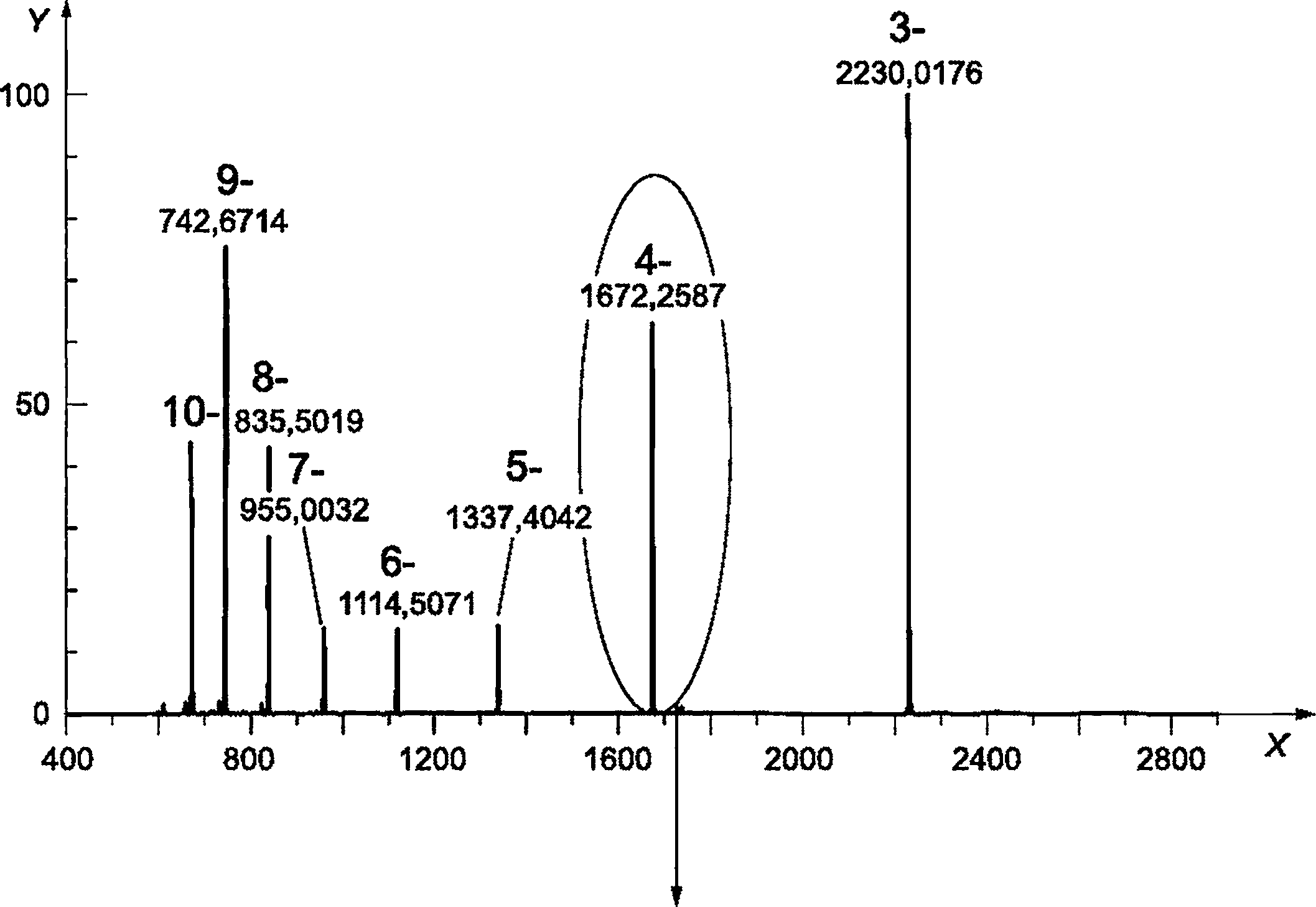 |
Рисунок F.1 - Выбор алгоритма
F.3 Алгоритм ближайшего соседа
Вычисление проводят по формуле
R - газовая константа (1,987 кал/(град·моль));
Таблица F.1 - Пример
Взаимодействие | ||
ккал/моль | кал/(моль·K) | |
AA/TT | -9,1 | -24 |
AT/TA | -8,6 | -23,9 |
TA/AT | -6 | -16,9 |
CA/GT | -5,8 | -12,9 |
GT/CA | -6,5 | -17,3 |
CT/GA | -7,8 | -20,8 |
GA/CT | -5,6 | -13,5 |
CG/GC | -11,9 | -27,8 |
GC/CG | -11,1 | -26,7 |
GG/CC | -11 | -26,6 |
Обозначения 5’ 3’ 3’ 5’ AT/TA Например, для AC (5’ 3’) равно -6,5[ккал/моль], что соответствует значению GT/CA. | ||
F.4 Правило Уоллеса
Вычисление проводят по формуле
где A, Т, G, C - число нуклеотидов каждого типа.
F.5 Метод GC%
Вычисление проводят по формуле
L - число нуклеотидов, вносящих вклад в образование двойной спирали;
F - молярная концентрация формамида (стандартное значение устанавливают на 0).
Библиография
[1] | ISO Guide 30, Reference materials - Selected terms and definitions |
[2] | ISO Guide 35, Reference materials - Guidance for characterization and assessment of homogeneity and stability |
[3] | ISO 9001, Quality management systems - Requirements |
[4] | ISO 16578:2013, Molecular biomarker analysis - General definitions and requirements for microarray detection of specific nucleic acid sequences |
[5] | ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories |
[6] | ISO 24276:2006, Foodstuffs - Methods of analysis for the detection of genetically modified organisms and derived products - General requirements and definitions |
[7] | IDT. "Oligo quantification - getting it right" https://www.idtdna.com/pages/education/decoded/article/oligo-quantification-getting-it-right |
[8] | Howley P.M. et al. A rapid method for detecting and mapping homology between heterologous DNAs. Evaluation of polyomavirus genomes. J. Biol. Chem. 1979 Jun 10, 254 (11) pp.4876-4883 |
[9] | Schildkraut C., Lifson S. Dependence of the melting temperature of DNA on salt concentration. Biopolymers. 1965, 3(2) pp.195-208 |
[10] | Baldino F.Jr. High-Resolution in Situ Hybridization Histochemistry. Methods Enzymol. 1989, (168) pp.761-777 |
[11] | Rychlik W.1 et al. Optimization of the annealing temperature for DNA amplification in vitro. Nucleic Acids Res. 1990 Nov 11, 18 (21) pp.6409-6412 |
[12] | Freier S.M. et al. Improved free-energy parameters for predictions of RNA duplex stability, Proc.Natl.Acad.Sci. USA 1986, 83.9373-9377 |
[13] | Matteucci M.D., Caruthers M.H. J. Am. Chem. Soc, 98, 3655-3661 (1976) |
[14] | Sinha N.D., Biernat J. and H. Nucleic Acids Res 12,b 4539-4557 (1984) |
[15] | Howley P.M. et al. A rapid method for detecting and mapping homology between heterologous DNAs. Evaluation of polyomavirus genomes, J Biol Chem. 1979 Jun 10; 254(11):4876-83 |
[16] | Schildkraut C. and Lifson S. Dependence of the melting temperature of DNA on salt concentration, Biopolymers. 1965; 3(2):195-208 |
[17] | Baldino Jr.F. High-Resolution in Situ Hybridization Histochemistry - METHODS IN ENZYMOLOGY. 1989 (168)761-777 |
[18] | Rychlik W.1 et al. Optimization of the annealing temperature for DNA amplification in vitro, Nucleic Acids Res. 1990 Nov 11; 18(21):6409-12 |
[19] | Naoki Sugimoto. Relationship between Structure and Function of Nucleic Acids: The Study Using Nearest Neighbor Parameters (Japanese), Seibutsubutsuri 1993, 33(2) 61-67 (Published by Yoshioka shoten) |
УДК 615.07:006.354 | ОКС 07.080 |
Ключевые слова: биотехнология, синтез нуклеиновых кислот, требования к производству и контролю качества синтезированных олигонуклеотидов | |

