ГОСТ Р ИСО 11137-2000
Группа Р26
ГОСУДАРСТВЕННЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Стерилизация медицинской продукции
ТРЕБОВАНИЯ К ВАЛИДАЦИИ И ТЕКУЩЕМУ КОНТРОЛЮ
Радиационная стерилизация
Sterilization of health care products. Requirements for
validation and routine control. Radiation sterilization
ОКС 11.080
ОКП 94 5120
Дата введения 2001-07-01
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией инженеров по контролю микрозагрязнений (АСИНКОМ), ВНИИФТРИ Госстандарта России и Московской медицинской академией им. И.М.Сеченова
ВНЕСЕН Техническим комитетом по стандартизации ТК 383 "Стерилизация медицинской продукции" Госстандарта России
2 ПРИНЯТ И ВВЕДЕН В ДЕЙСТВИЕ Постановлением Госстандарта России от 14 августа 2000 г. N 207-ст
3 Настоящий стандарт содержит аутентичный текст международного стандарта ИСО 11137-95 "Стерилизация медицинской продукции. Требования к валидации и текущему контролю. Радиационная стерилизация"
4 ВВЕДЕН ВПЕРВЫЕ
Введение
Настоящий стандарт содержит требования по обеспечению проведения процесса радиационной стерилизации. К ним относятся документированные программы работ, при помощи которых устанавливаются нормы, обеспечивающие проведение радиационного процесса в регламентированных условиях, при которых производимая продукция постоянно обрабатывается в заданном диапазоне поглощенных доз.
Радиационный процесс - это физический процесс, связанный с облучением изделия ионизирующим излучением. Изделие облучают на специальном оборудовании гамма-излучением радионуклидов кобальта-60 (Со), или цезия-137 (Cs
) или пучком электронного или рентгеновского излучения, генерируемого ускорителем электронов. При правильном проведении радиационная стерилизация является безопасным и надежным промышленным процессом.
Стерилизация является примером процесса, эффективность которого не может быть проверена ретроспективным контролем и испытанием продукции. Важно понимать, что для валидированного и точно контролируемого процесса стерилизации облучение не является единственным условием гарантии того, что изделие стерильно и пригодно для использования по назначению. Следует уделять внимание микробиологическому состоянию сырья и/или комплектующих, микробиологическим защитным свойствам упаковки и контролю внешних условий изготовления, сборки, упаковки и хранения продукции.
Стерильный продукт - это продукт, который не содержит жизнеспособных микроорганизмов. Продукция, изготовленная в контролируемых условиях, может быть до стерилизации загрязнена микроорганизмами, хотя обычно в небольшом количестве. Такая продукция, по определению, нестерильна. Цель стерилизации - дезактивировать микробиологическую контаминацию на нестерильной продукции. Дезактивация микроорганизмов физическими и химическими методами подчиняется экспоненциальному закону. Следовательно, можно рассчитать конечную вероятность выживания микроорганизмов независимо от значения стерилизующей дозы или способа обработки. Вероятность выживания является функцией числа и типа (штамма) микроорганизмов, имеющихся на продукции, процесса гибели при стерилизации и, в отдельных случаях, условий окружающей среды, в которой находятся микроорганизмы при обработке. Из этого следует, что стерильность конкретного объекта в общем числе стерилизуемой продукции не может быть гарантирована в абсолютном смысле.
Уровень обеспечения стерильности () вычисляется математически и определяет вероятность наличия жизнеспособного микроорганизма на отдельной единице продукции.
Первичный изготовитель несет полную ответственность за обеспечение правильности и адекватности всех операций при стерилизации и испытаниях на соответствие техническим требованиям на данную продукцию. В то же время ответственный за облучение персонал отвечает за обработку изделий в требуемом диапазоне доз в соответствии с требованиями валидированного процесса.
В связи с введением ГОСТ 30392-95/ГОСТ Р 50325-92 приложение С к ИСО 11137 о дозиметрии в настоящий стандарт не включено.
1 Область применения
1.1 Настоящий стандарт устанавливает требования к валидации, управлению и текущему контролю процесса радиационной стерилизации медицинской продукции. Он распространяется на радиационно-технологические установки непрерывного и циклического типа, использующие ионизирующее излучение радионуклидов Со и Cs
, а также на радиационно-технологические установки с использованием генераторов электронного и тормозного излучения.
Дополнительная информация приведена в приложениях А-С. В настоящем стандарте не рассматривается проектирование, лицензирование, обучение оператора и факторы, связанные с радиационной безопасностью, а также оценка пригодности продукции для использования по назначению после радиационной стерилизации. Использование биологических индикаторов для валидации или контроля процесса и испытания на стерильность выпускаемой продукции не рассматривается, поскольку эти индикаторы для процесса радиационной стерилизации не рекомендуются.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты:
ГОСТ 30392-95/ГОСТ Р 50325-92 Изделия медицинского назначения. Методика дозиметрии при проведении процесса радиационной стерилизации
ГОСТ Р ИСО 9001-96* Системы качества. Модель обеспечения качества при проектировании, разработке, производстве, монтаже и обслуживании
ГОСТ Р ИСО 9002-96* Системы качества. Модель обеспечения качества при производстве, монтаже и обслуживании.
________________
* На территории Российской Федерации действует ГОСТ Р ИСО 9001-2001. Здесь и далее по тексту. - .
ГОСТ Р ИСО 11737-1-2000 Стерилизация медицинской продукции. Микробиологические методы. Оценка популяции микроорганизмов в продукции.
ИСО 11737-2-98 Стерилизация медицинских изделий. Микробиологические методы. Испытания на стерильность, проводимые при валидации процессов стерилизации.
3 Определения
В настоящем стандарте используют следующие термины с соответствующими определениями:
3.1 Медицинская продукция (health care product) и соответствующие термины:
3.1.1 партия, серия (batch): Определенное количество нерасфасованной, промежуточной или готовой продукции, которая изготовлена в течение определенного цикла производства и имеет однородные характеристики и качество.
3.1.2 медицинская продукция (health care product): Медицинские изделия, лекарственные средства (фармацевтические и биологические) и изделия для диагностики in vitro.
3.1.3 первичный изготовитель (primary manufacturer): Компания или организация, ответственная за изготовление, выпуск, качество и безопасность медицинской продукции.
3.1.4 категория продукции (product category):
1) Для стерилизации гамма- или тормозным излучением - Продукция с одинаковой объемной плотностью, обусловливающей одинаковый характер распределения доз.
2) Для стерилизации электронным излучением - Продукция с одинаковой максимальной поверхностной плотностью, обусловливающей одинаковый характер распределения доз.
3.1.5 единица продукции (product unit): Медицинская продукция, комплект изделий или компонентов в первичной упаковке.
3.2 Радиационно-технологическая установка (Irradiator) и соответствующие термины:
3.2.1 радиационно-технологическая установка периодического действия (batch (type) irradiator): Радиационно-технологическая установка, у которой загрузка и выгрузка контейнеров для облучения производится, когда источник ионизирующего излучения находится в положении хранения.
3.2.2 объемная плотность (bulk density): Масса продукции и всей соответствующей упаковки в контейнере для облучения, деленная на объем, определяемый размерами внешней упаковки.
3.2.3 радиационно-технологическая установка непрерывного действия (continuous (type) irradiator): Установка, которая может быть загружена продукцией и разгружена, когда источник находится в рабочем положении.
3.2.4 контейнер для облучения (irradiation container): Подвеска, тележка, поддон или другой контейнер, в котором производится облучение продукции.
3.2.5 радиационно-технологическая установка (РТУ) (irradiator): Комплекс средств, обеспечивающий безопасное и надежное проведение стерилизации, имеющий в своем составе источник излучения, конвейер и механизмы привода источника, а также устройства безопасности и защиту.
3.2.6 ответственный за облучение (irradiator operator): Компания или организация, ответственная за облучение медицинской продукции требуемой дозой.
3.2.7 поверхностная плотность (surface density): Масса элементарного столбика продукции, вырезанного в направлении распространения пучка электронов вдоль всего контейнера для облучения до самой отдаленной его точки, отнесенная к площади поперечного сечения столбика.
Примечание - Единица поверхностной плотности - г/см.
3.2.8 установка таймера (timer setting): Выбранный интервал времени, в течение которого контейнер для облучения должен находиться в каждой позиции при облучении. Она определяет продолжительность облучения.
3.3 Источники излучения (radiation sources) и соответствующие термины:
3.3.1 средний ток пучка (average beam current): Усредненный во времени поток электронов, производимый генератором электронов.
3.3.2 тормозное излучение (bremsstrahlung): Фотонное излучение с непрерывным энергетическим спектром, возникающее при уменьшении кинетической энергии заряженных частиц.
Примечание - На практике тормозное излучение получают при торможении электронов в каком-либо материале (конвертере). Спектр тормозного излучения зависит от энергии электронов, материала и толщины конвертера и содержит фотоны с энергией от нуля до максимальной энергии электронов.
3.3.3 конвертер (converter): Мишень для электронов высокой энергии, обычно из материала, имеющего высокий атомный номер, в котором возникает тормозное излучение в результате потери энергии падающих электронов.
3.3.4 электронный пучок (electron beam): Непрерывный или импульсный поток электронов высокой энергии.
3.3.5 энергия электронов (electron energy): Кинетическая энергия электронов в электронном пучке.
3.3.6 гамма-излучение (gamma ray): Коротковолновое электромагнитное излучение (фотоны), испускаемое радиоактивными веществами в процессе ядерных реакций.
Примечания
1 Имеет широкое применение.
2 Гамма-излучение, используемое для облучения медицинской продукции, - это проникающее фотонное излучение высокой энергии, испускаемое радионуклидными источниками Со или Cs
.
3.3.7 активность источника (source activity): Мера радиоактивности радионуклида Со или Cs
, измеряемая в беккерелях или кюри (1 Кюри (Ки) =3,7х10
беккерелей (Бк), где 1 Бк =1 распаду в секунду).
3.3.8 Тормозное излучение (x-rays): Коротковолновое электромагнитное излучение, возникающее при ускорении, торможении или отражении электронов высокой энергии сильными электрическим или магнитным полями атомов мишени.
Примечания
1 Имеет широкое применение.
2 Термин включает как тормозное излучение, возникающее при торможении электрона около атомного ядра, так и характеристическое моноэнергетическое излучение, возникающее при переходе атомных электронов на более низкие энергетические уровни. В настоящем стандарте определение применяется для тормозного излучения.
3.4 Термины, относящиеся к измерению дозы (dose measurement):
3.4.1 поглощенная доза (absorbed dose): Количество энергии излучения, переданное единице массы облучаемого материала. Единица поглощенной дозы - грей (Гр). 1 Гр эквивалентен поглощению 1 Дж на 1 кг (равняется 100 рад).
3.4.2 доза (dose): (см. "поглощенная доза").
3.4.3 дозиметр (dosimeter): Устройство или система, имеющие воспроизводимый и поддающийся измерению отклик к ионизирующему излучению, которые используются для измерения поглощенной дозы в данном материале.
3.4.4 дозиметрия (dosimetry): Измерение поглощенной дозы с помощью дозиметров.
3.4.5 дозиметрическая система (dosimetry system): Система, используемая для определения поглощенной дозы, состоящая из детекторов, измерительной аппаратуры и методики ее применения.
3.4.6 дозиметр - первичный эталон (primary standard dosimeter): Дозиметр самого высокого метрологического качества, утвержденный и хранящийся как эталон единицы поглощенной дозы национальной или международной организацией по стандартизации.
3.4.7 образцовый дозиметр (reference standard dosimeter): Дозиметр высокого метрологического качества, используемый как эталон для обеспечения единства измерений и передачи размера единицы поглощенной дозы от первичного эталона рабочим дозиметрам.
3.4.8 рабочий дозиметр (routine dosimeter): Дозиметр, калиброванный с помощью первичного, рабочего эталона или эталона сравнения и используемый для технических измерений поглощенной дозы.
3.4.9 дозиметр - эталон сравнения (transfer standard dosimeter): Дозиметр, часто образцовый дозиметр (рабочий эталон), предназначенный для использования в качестве вспомогательного средства измерения для сравнения дозиметрических измерений, проводимых в разных местах.
3.5 Валидация (validation) и соответствующие термины:
3.5.1 калибровка (calibration): Сличение измерительной системы или прибора неизвестной точности с измерительной системой или прибором известной точности (в соответствии с поверочной схемой), с целью обнаружения, установления соотношений, учета или устранения регулированием любых отклонений показаний калибруемой измерительной системы или прибора от заданных допусков.
3.5.2 аттестация установленного оборудования (installation qualification): Получение и документальное подтверждение того, что оборудование поставлено, установлено в соответствии с техническими требованиями и функционирует с заданными параметрами при использовании в соответствии с инструкциями по эксплуатации.
3.5.3 национальный эталон (national standard): Эталон, признанный решением национальных органов в качестве исходного для всех остальных эталонов рассматриваемой величины в стране.
3.5.4 аттестация процесса (process qualification): Получение и документальное подтверждение уверенности в том, что процесс стерилизации обеспечит производство медицинской продукции необходимого качества.
3.5.5 аттестация продукции (product qualification): Получение и документальное подтверждение уверенности о том, что медицинская продукция будет пригодна после облучения для использования по назначению.
3.5.6 валидация (validation): Документально подтвержденное доказательство того, что рассматриваемый процесс с высокой степенью уверенности будет постоянно давать продукцию, соответствующую заданным характеристикам и требованиям к качеству.
3.6 Стерильность (sterile) и соответствующие термины:
3.6.1 стерильность (sterile): Отсутствие жизнеспособных микроорганизмов.
Примечание - На практике утверждение об абсолютном отсутствии любых форм жизнеспособных микроорганизмов не может быть доказано (см. 3.6.3).
3.6.2 уровень обеспечения стерильности (УС) (sterility assurance level (SAL): Вероятность наличия жизнеспособного микроорганизма на единице продукции после стерилизации.
Примечание - УС обычно выражается величиной 10.
3.6.3 стерилизация (sterilization): Валидированный процесс освобождения продукции от жизнеспособных микроорганизмов.
Примечание - Природа отмирания микроорганизмов в процессе стерилизации описывается экспоненциальной функцией. Поэтому можно говорить только о вероятности наличия микроорганизмов на любой отдельно взятой единице продукции. Вероятность может быть очень малой, но она никогда не может быть равна нулю. Вероятность может быть выражена в виде уровня обеспечения стерильности (УС).
3.6.4 стерилизующая доза (sterilization dose): Минимальная поглощенная доза, необходимая для достижения указанного уровня обеспечения стерильности (УС).
3.7 Термины, связанные с определением дозы
3.7.1 бионагрузка (bioburden): Популяция жизнеспособных микроорганизмов на продукции.
Примечание - В контексте радиационной стерилизации бионагрузка определяется непосредственно перед стерилизацией (инициальная контаминация).
3.7.2 положительная доля (fraction positive): Частное от деления количества образцов, давших положительный результат контроля стерильности, на общее количество исследованных образцов.
3.7.3 возрастающая доза (incremental dose): Доза из серии значений доз, при которых облучается определенное количество единиц продукции или их частей, используемая в методе определения стерилизующей дозы для установления или подтверждения ее значения.
3.7.4 радиационная стойкость (radiation stability): Способность медицинской продукции сохранять свои функциональные свойства в течение всего срока годности после облучения максимальной дозой.
3.7.5 проверка стерилизующей дозы (sterilization dose audit): Действия, определяющие необходимость изменения стерилизующей дозы.
3.8 Термины, употребляемые в приложении В
3.8.1 испытание на стерильность (sterility testing): Испытание, выполненное с целью установления наличия жизнеспособных микроорганизмов на единице продукции.
3.8.2 испытание на стерильность с положительным результатом (positive sterility test): Испытания, которые обнаруживают рост микроорганизмов после инкубации.
3.8.3 испытания на стерильность с отрицательным результатом (negative sterility test): Испытания, которые показывают отсутствие роста микроорганизмов после инкубации.
3.8.4 ложноположительный результат (false positive): Результат испытания, при котором помутнение испытательной среды, являющееся следствием вторичного загрязнения микроорганизмами или взаимодействием между образцом и испытательной средой, приписывается испытуемому образцу.
3.8.5 ложноотрицательный результат (false negative): Результат испытания, который интерпретируют как отсутствие роста в то время, когда рост присутствует, но не обнаруживается, или когда жизнеспособные микроорганизмы не смогли вырасти.
3.8.6 аэробный организм (aerobic organism): Микроорганизм, использующий кислород в качестве акцептора электронов при метаболизме.
3.8.7 анаэробный организм (anaerobic organism):
1) Микроорганизмы, которые не используют кислород как акцептор электронов при метаболизме.
2) Микроорганизмы, которые растут только при отсутствии кислорода.
3.8.8 факультативный микроорганизм (facultative organism): Микроорганизм, способный как к аэробному, так и к анаэробному метаболизму.
3.8.9 часть продукции для испытания () (sample item portion (SIP)): Определенная часть единицы медицинской продукции, которую используют при испытаниях.
3.8.10 проверочная доза (verification dose) (**, кГр): Значение дозы, обеспечивающее
10
для единицы продукции или ее части и используемое в методике определение стерилизующей дозы при ее установлении или подтверждении.
_____________
** Обозначение дозы.
3.8.11 , кГр: Доза излучения при определенных условиях обработки, необходимая для уменьшения однородной популяции микроорганизмов в 10 раз в предположении, что инактивация микроорганизмов подчиняется кинетическому уравнению первого порядка.
4 Документация
Чтобы гарантировать воспроизводимость валидации, производственные процессы и все другие элементы, которые будут влиять на процесс стерилизации, должны быть полностью документированы. Оформление и ведение документации следует выполнять в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
5 Персонал
Должен быть назначен квалифицированный персонал, ответственный за валидацию и текущий контроль радиационной стерилизации в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6 Валидация процесса стерилизации
6.1 Общие положения
Валидация процесса стерилизации должна включать следующие элементы:
a) аттестацию продукции, облученной на предварительно аттестованной установке радиационной стерилизации;
b) аттестацию установленного оборудования;
c) аттестацию процесса с использованием конкретной или моделирующей ее продукции на аттестованном оборудовании;
d) процедуру официального рассмотрения и утверждения администрацией документации по перечислениям а), b) и с);
e) действия, направленные на поддержание результатов валидации.
На рисунке 1 показана схема типичной программы валидации.
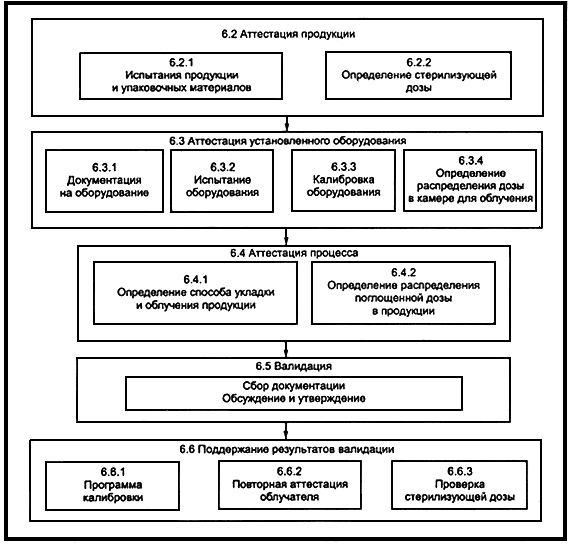
Рисунок 1 - Элементы схемы типичной программы валидации
6.2 Аттестация продукции
6.2.1 Испытания продукции и упаковочных материалов
До использования метода радиационной стерилизации для производства медицинской продукции необходимо оценить влияние ионизирующего излучения на материалы, из которых изготовлена продукция (и/или ее компоненты) и упаковочные материалы. Должно быть показано, что качество, безопасность и функциональные свойства продукции сохраняются в течение всего срока годности.
Эта проверка должна охватывать все характеристики, существенно влияющие на качество, безопасность и функциональные свойства продукции. Обычно при разработке программы испытаний должны быть приняты во внимание: возможные изменения процесса изготовления продукции и его допуски, диапазон доз излучения, вид излучения, сырье и условия хранения. Для каждого вида продукции и упаковочного материала должна быть установлена максимально допустимая доза излучения.
Руководство по испытанию изделий и упаковочных материалов приведено в приложении А.
6.2.2 Выбор стерилизующей дозы
6.2.2.1 Для определения стерилизующей дозы нужно определить количество и радиорезистентность естественной микрофлоры изделия. Доза должна быть достаточной для обеспечения заранее заданного уровня стерильности ().
При выборе стерилизующей дозы используется один из двух подходов:
a) выбор стерилизующей дозы, использующий:
1) информацию о бионагрузке или
2) информацию, полученную при облучении возрастающей дозой.
Примечание - Методы определения дозы для радиационной стерилизации приведены в приложении В;
b) выбор стерилизующей дозы 25 кГр, после соответствующего обоснования.
6.2.2.2 Основными техническими требованиями при получении информации, необходимой для выбора стерилизующей дозы с использованием сведений о бионагрузке или положительной доле, и подтверждения выбора значения 25 кГр должны быть:
a) использование услуг компетентных микробиологических лабораторий;
b) выполнение микробиологических испытаний в соответствии с ГОСТ Р ИСО 11737-1 и/или ИСО 11737-2 (см. также [5]);
c) проведение облучения продукции на установках с использованием:
- источников ионизирующего излучения Co или Cs
или
- пучков электронов и тормозного излучения при значениях энергии излучения и мощности дозы, подобных тем, которые используют в производстве изделий и способных обеспечить облучение с достаточной точностью при значениях дозы, начиная с 1 кГр.
6.2.3 Передача стерилизующей дозы
При передаче продукции с одной установки на другую значение стерилизующей дозы, определенное в соответствии с 6.2.1 и 6.2.2 для первой установки, следует использовать для второй, принимая во внимание следующие данные:
При передаче продукции с установки с электронным пучком или тормозным излучением на любую другую радиационно-технологическую установку (электронный пучокэлектронный пучок; тормозное излучение
тормозное излучение; электронный пучок
тормозное излучение; электронный пучок
гамма-излучение; тормозное излучение
гамма излучение) должны быть получены данные, доказывающие, что различия характеристик двух установок, в частности энергии излучения и мощности дозы, а также распределения поглощенной дозы в продукции, не снижают уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
При передаче стерилизующей дозы между двумя гамма-установками должны быть данные, доказывающие, что отличия в распределении поглощенной дозы в продукции для двух установок не влияют на уровень инактивации микроорганизмов при использовании той же самой стерилизующей дозы.
6.3 Аттестация оборудования
Должна быть составлена, утверждена и выполняться программа аттестации оборудования.
6.3.1 Документация на оборудование
Должна быть документация, описывающая конструкцию и действие радиационно-технологической установки (РТУ). Эта документация должна храниться в течение всего периода эксплуатации установки и включать в себя следующие документы:
а) технические требования на РТУ и его характеристики;
b) описание расположения РТУ в пределах операционного помещения относительно средств, обеспечивающих разделение необлученной и облученной продукции;
c) описание конструкции и действия конвейерной системы;
d) описание конструкции, материалов и размеров контейнеров для облучения;
е) описание правил эксплуатации РТУ и конвейерной системы;
f) паспорта на источники ионизирующего излучения с указанием первоначальной активности и расположения в РТУ; схемы и протоколы зарядки;
g) любые изменения, сделанные в РТУ.
Следует вести и другую документацию, описывающую аппаратуру управления, контроля и записи критических параметров процесса во время облучения. Такая документация должна храниться в соответствии с требованиями ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
Для гамма-установки критическими параметрами процесса являются:
продолжительность облучения, скорость конвейера и измеряемая доза.
Для установок с электронным пучком или тормозным излучением критические параметры процесса должны включать характеристики пучка электронов (средний ток пучка электронов, энергия электронов, ширина развертки пучка электронов), скорость конвейера, а также должны иметь схему обратной связи скорости движения конвейера и/или схему управления обратной связью скорости движения конвейера с измеряемой дозой облучения.
6.3.2 Испытание оборудования
Технологическое оборудование, включающее источник излучения, механизмы конвейера, устройства безопасности и вспомогательные системы, должно испытываться для проверки удовлетворительной работы в соответствии с технической документацией. Методы испытаний и результаты должны быть документированы.
6.3.3 Калибровка оборудования
Для того чтобы гарантировать, что оборудование и дозиметрические системы калиброваны (в соответствии с поверочной схемой) и погрешность находится в заданных границах, должна выполняться программа калибровки в соответствии с ГОСТ Р ИСО 9001.
Для радиационно-технологических гамма-установок программа включает калибровку таймеров цикла облучения или скорости конвейера, взвешивающего оборудования и дозиметрических систем.
Для радиационно-технологических установок с электронным или тормозным излучением программа включает калибровку характеристик электронного пучка, скорости перемещения контейнера для облучения, взвешивающего оборудования и дозиметрических систем.
Для валидации и текущего контроля процесса радиационной стерилизации следует использовать дозиметры с известной точностью. Необходимо иметь надлежащие методики дозиметрии, которые должны включать в себя указания по статистической обработке результатов измерения дозы и ведению документации.
Примечание - Дозиметры, дозиметрия и используемое оборудование - по ГОСТ 30392/Р 50325.
6.3.4 Определение распределения дозы в камере РТУ
Для определения значений дозы и ее воспроизводимости проводят исследование распределения дозы в РТУ.
Для радиационно-технологических гамма-установок и установок с тормозным излучением исследование распределения дозы должно быть выполнено в контейнерах, заполненных до проектных уровней материалом с однородной плотностью, равной или близкой объемной плотности облучаемого продукта, для которых РТУ должна использоваться. Поглощенная доза определяется в различных точках внутри контейнера.
Если прохождение продукции через камеру для облучения происходит по разным маршрутам, исследование распределения дозы должно быть выполнено для каждого из них.
Для радиационно-технологической установки с электронным излучением исследование распределения дозы должно быть выполнено в материале однородной плотности. Полученное распределение дозы характеризует ее распределение по объему транспортируемого через зону облучения материала. Оно должно также установить соотношение между дозой, распределением дозы и рабочими параметрами ускорителя во всем диапазоне значений, используемом для облучения продукции. Если на РТУ имеется более одного маршрута прохождения продукции через РТУ, определение распределения дозы должно быть выполнено для каждого маршрута.
Все отчеты, протоколы, включая протоколы режимов эксплуатации радиационно-технологической установки, результаты и выводы, сделанные на основании измерения распределения дозы в РТУ, необходимо хранить и пересматривать в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.4 Аттестация процесса
6.4.1 Определение способа укладки продукции
Способ укладки продукции должен быть определен для каждого вида продукции. Инструкции по укладке продукции должны включать данные, указанные в 6.4.1.1, 6.4.1.2.
6.4.1.1 Для гамма-установок и установок с тормозным излучением:
a) описание упакованной продукции, включая размеры и плотность, допустимые изменения этих параметров и, если необходимо, ориентацию продукта в упаковке;
b) описание способа размещения продукции в контейнере для облучения;
c) описание контейнера для облучения и его размеров.
6.4.1.2 Для установок с электронным пучком:
a) описание упакованной продукции, включая ориентацию изделия относительно направления движения конвейера и направления электронного пучка, количество единиц продукции в упаковке, размеры и массу упаковки, ориентацию продукции в упаковке и допустимые изменения этих параметров;
b) описание способа укладки продукции внутри контейнера для облучения;
c) описание контейнера для облучения и его размеры.
6.4.2 Определение распределения дозы в продукции
Распределение дозы в продукции определяют для идентификации зон минимальной и максимальной поглощенной дозы в пределах контейнера с изделиями и оценки воспроизводимости процесса. В дальнейшем эта информация должна использоваться при выборе положения контрольной точки для измерения дозы во время проведения рабочего процесса.
Определение распределения дозы должно быть выполнено для объема выборки контейнеров для облучения, достаточного, чтобы определить разброс значений поглощенной дозы между представленными контейнерами, особенно в зонах, где ожидается максимальная и минимальная дозы, и в контрольной точке для текущего дозиметрического контроля.
Определение распределения дозы должно быть выполнено для всего диапазона плотностей данной категории облучаемой продукции независимо от дозы. Схемы загрузки и движения изделий при облучении должны учитываться при исследовании распределения поглощенной дозы в продукции.
Установки, на которых обрабатывается только такая продукция, для которой имеются те же самые характеристики распределения поглощенной дозы, что и характеристики, полученные при аттестации, должны отвечать требованиям распределения дозы в продукции для валидации процесса. Если объемная плотность и размеры образца изделия недостаточно охарактеризованы при текущем исследовании распределения поглощенной дозы, то должно быть проведено дополнительное исследование распределения поглощенной дозы.
Все протоколы, в том числе об условиях облучения, результаты и выводы, сделанные на основании анализа распределения поглощенной дозы, следует хранить в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.5 Валидация
Информация, собранная или полученная при аттестации продукции, установленного оборудования и процесса, должна быть документирована, рассмотрена компетентным экспертом или экспертной группой с целью оценки возможности ее использования и должна храниться в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.6 Поддержание результатов валидации
6.6.1 Программа калибровки
Повторная калибровка оборудования и дозиметрических систем (см. 6.3.3) должна выполняться через установленные интервалы времени, определяемые с учетом стабильности работы и целей в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
6.6.2 Повторная аттестация радиационно-технологической установки
При изменениях в радиационно-технологической установке, которые влияют на распределение дозы в облучаемом объекте, следует повторить всю процедуру аттестации установки или ее часть (см. 6.3).
6.6.3 Проверка стерилизующей дозы
Проверка должна выполняться с определенной, указанной в документации, периодичностью. Чтобы определить возможность продления использования значения стерилизующей дозы, проверка должна выполняться после любого изменения уровня или характера бионагрузки. При отсутствии подобных изменений проверку проводят не реже одного раза в три месяца.
7 Текущий контроль процесса
Текущий контроль процесса включает контроль и наблюдение за технологическим оборудованием, перемещением продукции до, в течение и после облучения, текущее и профилактическое техническое обслуживание, текущий дозиметрический контроль, обеспечение непрерывности процесса и ведение документации.
7.1 Технические требования к процессу
Для каждого вида или категории продукции должны быть разработаны технические требования к процессу, которые должны включать следующие данные:
a) перечень видов продукции, охватываемой данными техническими требованиями;
b) максимально допустимую дозу и стерилизующую дозу (6.2);
c) схему укладки продукции и соотношение между дозой в контрольной точке, и максимальной и минимальной дозами (6.4.1);
d) положение (положения) рабочего дозиметра для текущего контроля (положение контрольной точки);
e) для стерилизации гамма-излучением - соотношение между плотностью продукции, дозой и мощностью дозы в продукции и активностью источника;
f) для стерилизации электронным пучком и тормозным излучением - соотношение между характеристиками пучка электронов, скоростью конвейера, конфигурацией продукции и дозой.
В случаях, когда требуются многократные облучения продукции, некоторые из которых включают переориентацию продукции, эти требования также должны быть включены в документацию на процесс.
7.2 Обращение с продукцией
Следует разработать и вести документацию, описывающую обращение с продукцией до, во время и после радиационной стерилизации. При обращении с продукцией и ее хранении следует принимать меры, предотвращающие дополнительную контаминацию микроорганизмами.
Следует вести систему учета продукции при получении, погрузке, разгрузке последующем облучении и выпуске.
7.2.1 Отгрузка и получение продукции
Для обеспечения учета продукции производственные записи о продукции, подлежащей стерилизации, должны включать количество полученной продукции. Любое несоответствие между количеством полученной продукции и количеством, указанным в транспортных документах по отгрузке или передаче продукции, должно быть выяснено до его обработки.
7.2.2 Хранение продукции до и после облучения
Продукция до и после стерилизации должна храниться в отдельных зонах. Если эти зоны предназначены не только для хранения нестерильной продукции или только для хранения стерильной продукции, соответственно, или если зоны хранения отдалены от мест загрузки и выгрузки, то должны использоваться индивидуальные поддоны или продукт должен иметь четкую маркировку, отражающую его состояние.
7.3 Техническое обслуживание
Работы по техническому обслуживанию оборудования (обычно рекомендуемые поставщиком) должны осуществляться и документально оформляться в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
7.4 Облучение продукции
7.4.1 Контроль процесса
Радиационно-технологическую установку следует эксплуатировать и обслуживать в соответствии с документами, предназначенными для обеспечения полного выполнения установленных и документированных требований к процессу.
7.4.1.1 Радиационно-технологическая гамма-установка
a) Периодический контроль. Для данной продукции или категории продукции необходимо контролировать установку таймера или скорость конвейера и делать поправку на распад источника ионизирующего излучения. Необходимо иметь резервный таймер, чтобы иметь возможность контролировать любые изменения от первоначально установленного времени облучения.
Облучатель должен иметь контрольные устройства для гарантии того, что он находится в правильном рабочем положении.
b) Непрерывный контроль. Необходимо следить за положением источника, установкой таймера и движением контейнеров для облучения.
с) Укладка продукции. Продукция должна размещаться в контейнере для облучения в соответствии со схемой укладки для данного типа продукции.
7.4.1.2 Радиационно-технологические установки с электронным пучком и тормозным излучением
a) Периодический контроль. Параметры электронного пучка и скорость конвейера должны регулироваться автоматически.
b) Непрерывный контроль. Необходимо контролировать параметры электронного пучка и скорость конвейера для обнаружения отклонений процесса.
c) Укладка продукции. Продукция должна размещаться в контейнере для облучения в соответствии со схемой укладки данного типа продукции.
7.4.2 Прерывание процесса
Если происходит остановка процесса во время стерилизации, и при этом продолжение процесса откладывается на неопределенное время, необходимо исследовать влияние остановки процесса на микробиологическое состояние продукции и принять соответствующие действия.
Для изделий, способных поддерживать рост микроорганизмов, в технологическом регламенте должен быть указан максимальный промежуток времени, который может пройти между моментами остановки и завершения стерилизации, условия обращения при хранении и перемещении в период остановки, а также условия завершения облучения.
Примечание - Для изделий, не способных поддерживать рост микроорганизмов, действие дозы излучения носит кумулятивный характер и, таким образом, прерывание процесса облучения не оказывает заметного воздействия.
7.4.3 Дозиметрический контроль
Для текущего контроля процесса облучения должны использоваться рабочие дозиметры. Чувствительные к ионизирующему излучению визуальные индикаторы не должны использоваться как доказательство удовлетворительной радиационной обработки или как единственное средство отличать облученные изделия от необлученных.
7.4.3.1 Положение контрольной точки
Положение контрольной точки должно быть определено из анализа данных, полученных при измерениях распределения поглощенной дозы в продукции. Для обеспечения надлежащего размещения дозиметров описание положений контрольных точек должно быть частью технических требований на данный процесс. Дозиметры следует размещать в месте, для которого известно соотношение минимальной и максимальной доз.
7.4.3.2 Периодичность контроля
Процесс должен контролироваться через установленные интервалы времени количеством дозиметров, достаточным, чтобы показать, что поглощенная доза в продукции находится в интервале, заданном техническими требованиями на процесс.
Для радиационно-технологических гамма-установок в РТУ всегда должен находиться, по крайней мере, один контейнер для облучения с дозиметром. При нескольких маршрутах движения продукции каждый маршрут должен сопровождаться, по крайней мере, одним дозиметром в РТУ.
Для радиационно-технологических установок с электронным пучком и тормозным излучением необходимо использовать достаточное количество дозиметров с определенным интервалом, чтобы гарантировать, что вся продукция во время облучения получила стерилизующую дозу.
7.4.3.3 Анализ
После облучения должны быть измерены и зарегистрированы показания дозиметров. Все текущие дозиметрические данные должны быть проанализированы. Результаты измерения дозы должны сравниваться со значениями доз, предусмотренными документацией на процесс.
Должно быть проанализировано любое отклонение показаний дозиметров (отдельного дозиметра или среднего значения для нескольких дозиметров) за установленные границы. Если для измерений в контрольных точках используются показания нескольких дозиметров, а показание отдельного дозиметра имеет отклонение большее, чем погрешность данной дозиметрической системы, этот случай также должен быть проанализирован. Продукция, для которой получены такие данные, не может быть реализована до получения удовлетворительных результатов исследований и получения документа, удостоверяющего ее пригодность для реализации.
7.5 Документация на процесс
Для каждого вида продукции необходимо иметь утвержденную уполномоченным лицом документацию на процесс, в которой должна быть представлена следующая информация:
a) количество поступившей продукции с указанием кода и номера партии продукции (если имеется);
b) схема укладки продукции;
c) размещение и возврат дозиметров;
d) номер партии стерилизуемой продукции;
e) необходимая стерилизующая доза и максимально допустимая доза;
f) параметры процесса:
- установка таймера цикла и/или скорости конвейера (гамма-установки),
- характеристики пучка и скорость конвейера (ускорителя электронов и генератора тормозного излучения);
g) данные учета продукции, загруженной в контейнер для облучения;
h) дата (даты) стерилизации;
i) данные учета продукции, выгруженной из контейнера для облучения;
j) данные дозиметрии и результаты анализа;
k) данные учета отгруженной продукции;
l) записи параметров процесса:
- о работе конвейера и положении источника (гамма-установки),
- о параметрах пучка и скорости конвейера (ускорителя электронов и генератора тормозного излучения);
m) использованный маршрут следования продукции (для радиационно-технологических установок, которые имеют различные внутренние маршруты);
n) прерывание процесса и принятые действия;
о) отклонения течения процесса и принятые действия.
7.6 Приемка стерилизации
Когда имеются все записи, показывающие, что процесс стерилизации выполняет требования настоящего стандарта, процесс стерилизации считается принятым.
Примечание - Для того, чтобы продукция могла реализовываться и распространяться как стерильная, потребуются дополнительные отчеты о процессе производства и приемочном контроле изделия в соответствии с системой качества/планом контроля качества (ГОСТ Р ИСО 9001 / ГОСТ Р ИСО 9002).
Настоящий стандарт не требует проведения испытания на стерильность конечной продукции.
8 Управление и контроль
Управление и контроль процесса радиационной стерилизации должны быть полностью документированы и приведены в соответствии с ГОСТ Р ИСО 9001 и/или ГОСТ Р ИСО 9002.
Контроль процесса радиационной стерилизации может достичь своей цели только в том случае, если все методики валидации и производства стандартизованы и документированы, а эти документы, в свою очередь, контролируются. Например, большое значение для обеспечения эффективности этих методик имеют внутренние аудиторские проверки, а записи об изменениях и их результатах имеют большое значение для анализа в будущем.
ПРИЛОЖЕНИЕ А
(справочное)
Испытания изделий и упаковочных материалов
Настоящее приложение дает руководство по испытанию медицинских изделий, и относится к медицинским изделиям, изготовленным из полимерных материалов. Для другой медицинской продукции влияние облучения ионизирующим излучением на другие свойства, не упомянутые в этом приложении, необходимо исследовать.
До выбора метода радиационной стерилизации для медицинских изделий важно исследовать влияние ионизирующего излучения на стабильность свойств материалов изделия или его частей. Известно, что некоторые материалы, например, полистирол, меньше подвержены действию ионизирующего излучения, чем другие, например, политетрафторэтилен или полиоксиметилен, поэтому радиационная стойкость любого изделия будет зависеть как от материала, так и от метода его переработки (таблица А.1). Поэтому должна быть выполнена программа исследований, демонстрирующая, что изделия сохраняют свои функциональные свойства в течение всего срока годности.
Таблица А.1 - Общие правила выбора радиационно стойких материалов
При выборе или разработке радиационно стойких материалов применяется несколько правил. Согласно общему правилу все пластмассы можно классифицировать как материалы, молекулы которых: а) преимущественно деструктируют при облучении; b) преимущественно сшиваются при облучении. Материалы, которые сшиваются при облучении, увеличивают свою радиационную стойкость. Разные виды излучения по-разному воздействуют на физические свойства некоторых материалов. Более конкретные правила состоят в следующем: 1 Ароматические материалы более стабильны, чем алифатические. 2 Фенольные антиоксиданты, содержащиеся в большинстве пластмасс, являются причиной изменения цвета. Использование нефенольных присадок может снять эту проблему. 3 Большинство полипропиленов и политетрафторэтиленов нестабильны при облучении. Поливинилхлорид и полиэтилен должны быть специально стабилизированы, чтобы улучшить радиационную совместимость. 4 Условия производства полимеров и материалы, которые приводят к хрупкости медицинских изделий, подвергнутых радиационной стерилизации, должны быть тщательно изучены (например, использование вторичных полимеров или полимеров, способных к кристаллизации; использование высоких температур при литье; создание высоких уровней кристалличности в полукристаллических полимерах при медленном охлаждении и обработке в автоклавах). 5 Большое количество антиоксидантов повышает радиационную стабильность. Как правило, если медицинское изделие будет подвергнуто радиационной стерилизации, уровень антиоксиданта должен быть удвоен. 6 Использование условий изготовления, которые ведут к низкой кристалличности, повышает стабильность полукристаллических полимеров. 7 Модуль упругости полимеров существенно не зависит от значения стерилизующей дозы. 8 Следует тщательно оценивать использование низкомолекулярных полимеров. 9 В пределах одного класса полимеры с более низкой плотностью обладают большей радиационной стойкостью. |
Испытанию должны подвергаться все свойства изделий, определяющие их функциональное назначение, например, прочность, прозрачность, цвет, биологическую совместимость и целостность упаковки. Программа испытаний должна охватить все изменения в производственном процессе, допуски, дозы излучения, источники ионизирующего излучения, сырье и условия хранения. На основании проведенных исследований для каждого изделия устанавливают максимально допустимую дозу излучения.
Действие ионизирующего излучения на материалы может проявляться не сразу после облучения. Поэтому программа испытаний может включать ускоренное старение при экстремальных условиях для первичного анализа материала, а также старение в естественных условиях. Ускоренные испытания могут включать облучение при более высоких дозах, чем необходимо для стерилизации в комбинации с экстремальными условиями хранения. Однако в большинстве случаев частью программы испытаний должно быть испытание в реальном масштабе времени необлученных образцов, хранящихся в нормальных условиях.
При типовых испытаниях может потребоваться облучение изделий или образцов материалов в диапазоне доз от 10 до 100 кГр. Облучение образцов должно проводиться в соответствии с ГОСТ 30392/ГОСТ Р 50325.
Несмотря на то, что изучение старения в естественных условиях нельзя заменить ничем, изучение ускоренного старения может использоваться для подбора материалов. В этом случае используются те же методы испытания, но материалы выдерживают при температуре 60 °С. При отсутствии более точных данных семь дней при 60 °С могут рассматриваться эквивалентными 180 дням старения в естественных условиях окружающей среды. Для ускоренного испытания интервал времени выбирается от одной недели до 30 дней. При естественных условиях окружающей среды интервалы времени выбираются из ряда - 0; 3; 6; 9 и 12 месяцев [1]. Во всех случаях необлученные изделия должны храниться в качестве контрольного образца в течение всего срока годности.
Существует большое количество методов испытаний материалов (таблица А.2). Если материал отбирают на основе этих испытаний, то заключительные испытания, демонстрирующие стабильность функциональных свойств продукции, должны быть выполнены: на полностью обработанных отдельных компонентах или укомплектованных изделиях и упаковочных материалах (готовой продукции). Если выполнялись испытания отдельных компонентов изделия, то на основе испытаний должно быть показано, что они совместимы друг с другом в собранном изделии.
Таблица А.2 - Методы испытания физических и функциональных характеристик для оценки полимерных материалов
Метод испытания | Ссылка |
Испытание на хрупкость | |
1 Испытания на прочность: | ИСО /Р527-66 |
а) предел прочности на разрыв; b) максимальное удлинение; с) модуль упругости; d) работа. | |
2 Испытания на изгиб: | |
а) испытание на двухопорный ударный изгиб; | "STABILITY OF IRRADIATED POLYPROPYLENE. 1. Mechanical Properties. (Стабильность облученного полипропилена 1. Механические испытания)" Williams, Dunn, Sugg, Stannet. Advances in Chemistry Series, No. 169, Stabilization and Degradation of Polymers, Eds, Allara. Hawkins, pp.142-150, 1978 |
b) испытание на статический изгиб бруска. | ИСО 178:1975 |
3 Прочность на удар | 1985 ASTM Standards Vol. 08.01-Plastics, D-1822-84 |
4 Твердость: | |
а) по Шору | ИСО 868:1985 |
b) по Роквеллу | 1985 ASTM Standards, Vol. 08.01-Plastics, D-785-65 |
5 Сопротивление сжатию | ИСО 604:1973 |
6 Прочность на разрыв | 1985 ASTM Standards, Vol. 08.01-Plastics (Tubing), D-1180-57 |
7 Износостойкость | 1985 ASTM Standards, Vol. 08.01-Plastics D-1004-66, и ИСО 6383/1-1983 |
Испытание на изменение цвета | |
1 Индекс желтизны | 1985 ASTM Standards, Vol. 08.02-Plastics, D-1925-70 |
2 Оптическая спектрометрия | 1985 ASTM Standards, Vol. 08.02-Plastics, D-1746-70 |
Примечание - Источник - Международное агентство по атомной энергии МАГАТЭ. Руководящие принципы промышленной радиационной стерилизации медицинских продуктов однократного применения. Гамма-излучение Со | |
В дополнение к квалификационным испытаниям физических и механических характеристик материалов может также потребоваться испытание на биологическую совместимость. Изменения в химической структуре полимера и добавок, а также выделение газообразных побочных продуктов во время облучения могут изменять биологическую совместимость материалов, используемых для медицинских изделий. Это испытание должно также демонстрировать биологическую совместимость в течение всего срока годности изделия. В ИСО 10993-1 [2] приведено руководство по выбору основных биологических испытаний, которые могут использоваться для предварительной оценки безопасности облученных материалов, используемых в медицинских изделиях. В зависимости от назначения изделия могут потребоваться специальные испытания.
Строгое соблюдение руководящих принципов, изложенных в настоящем стандарте, поможет первичному изготовителю устранять проблемы при радиационной стерилизации медицинских изделий. Разработчик и первичный изготовитель несут ответственность за обеспечение пригодности материала, изделий и упаковки для облучения. Ответственный за облучения может при необходимости уведомлять об условиях облучения и выполнять облучение испытуемых образцов. Первичные изготовители медицинских изделий также ответственны за обеспечение того, что они информированы поставщиками материалов и компонентов о любых изменениях в рецептуре и технологическом процессе, которые могут влиять на радиационную стойкость.
В таблице А.3 приведен список некоторых типичных материалов с хорошей радиационной стойкостью. Таблица А.4 дает общее руководство по радиационной стойкости материалов.
Таблица А.3 - Примеры радиационно стойких материалов (в диапазоне используемых доз стерилизации)
Следующие основные материалы, которые доступны на рынке, обладают естественной радиационной стойкостью и могут использоваться в наиболее применяемых стерильных изделиях: Акрилонитрил/Бутадиен-стирольный пластик (АБС-пластик) Полистирол Полистиролакрилонитрил Полиэтилен (всех плотностей и сверхвысокого молекулярного веса) Полиамиды Полисульфоны Полиимиды Полиуретан Полифениленсульфид Полиэфиры Полиэтиленвинилацетат Полиэтиленакрилат Фенольные смолы Эпоксидные смолы Натуральная резина Силикон Большинство синтетических эластомеров (кроме бутиловых или полиакриловых) |
Таблица А.4 - Общее руководство по радиационной стойкости материалов
Материалы | Радиационная стабильность | Примечания |
Термопластичные материалы | ||
Полистирол | Отличная | - |
Полиэтилен | Отличная | - |
Полиамиды | Отличная | - |
Полиимиды | Отличная | - |
Полисульфон | Отличная | Натуральный материал - желтый |
Полифениленсульфид | Отличная | - |
Поливинилхлорид (ПВХ) | Хорошая | Желтизна - антиоксиданты и стабилизаторы предотвращают пожелтение. Высокомолекулярные органические стабилизаторы улучшают радиационную стабильность |
Поливинилхлорид-поливинилацетат | Хорошая | Менее устойчив, чем ПВХ |
Поливинилиденхлорид | Хорошая | Менее устойчив, чем ПВХ |
Поливинилформаль | Хорошая | Менее устойчив, чем ПВХ |
Оливинилбутираль | Хорошая | Менее устойчив, чем ПВХ |
Полистиролакрилонитрил | Хорошая | - |
Полипропилен | Плохая | Должен быть стабилизирован - физические свойства очень ухудшаются при облучении |
Фторопласты: Политетрафторэтилен (ПТФЭ) Полихлортрифторэтилен (ПХТФЭ) Поливинилфторид Поливинилиденфторид Этилентетрафторэтилен Сополимер тетрафторэтилена и гексафторэтилена | Плохая | При облучении ПТФЭ и ПХТФЭ имеет место значительная деструкция. Другие полимеры показывают лучшую стабильность |
Целлюлозные: Эфиры Целлюлоза | Плохая | Эфир деструктирует меньше, чем целлюлоза |
Полиацетали | Плохая | Облучение - причина хрупкости. Были отмечены цветовые изменения (от желтого к зеленому) |
Термореактивные материалы | ||
Фенольные | Хорошая | Очень хорошая при добавлении минеральных наполнителей |
Эпоксидные | Хорошая | Очень хорошая при использовании ароматических отверждающих агентов |
Полиэфирные | Хорошая | Очень хорошая при добавлении минеральных или стеклянных волокон |
Аллилдигликолькарбонат (полиэфир) | Отличная | Сохраняет превосходные оптические свойства после облучения |
Полиуретаны: | ||
алифатические | Отличная | |
ароматические | Хорошая | Могут происходить потемнения. Возможно растрескивание изделий |
Эластомеры | ||
Уретаны | Отличная | - |
EPDM | Отличная | - |
Натуральная резина | Хорошая | - |
Нитрил | Хорошая | Изменение цвета |
Полихлоропрен (неопрен) | Хорошая | Изменение цвета - прибавление ароматических пластификаторов делает материал более стабильным к облучению |
Силикон | Хорошая | Фенилметилсиликон более стабильный, чем метилсиликон |
Бутадиен-стирол | Хорошая | - |
Полиакрил | Плохая | - |
Хлорсульфонат полиэтилена | Плохая | - |
Примечание - Частичный источник: МАГАТЭ, 1990. | ||
ПРИЛОЖЕНИЕ В
(справочное)
Методы определения стерилизующей дозы
Примечание - Наряду с методами определения стерилизующей дозы, приведенными в этом приложении, могут использоваться другие методы, которые отвечают требованиям настоящего стандарта. В связи с этим приложение рассматривается как справочное, а термины "должен" и др. рассматриваются только в пределах контекста этого приложения. Если принято решение использовать один из методов определения стерилизующей дозы по настоящему приложению, то требования этого приложения для выбранного метода должны строго соблюдаться.
B.1 Введение
Методы установления дозы, приведенные в этом приложении, во многом используют идеи, выдвинутые первоначально в [12, 13, 14]. Впоследствии были разработаны и стандартизированы методы "возрастающей дозы" [10, 11], которые заложили основу методов определения стерилизующей дозы [4, 6].
Методы используют данные, полученные при инактивации естественной микрофлоры, имеющейся на изделиях. Эти методы основаны на вероятностной модели инактивации микроорганизмов. Вероятностная модель, применяемая к бионагрузке, состоящей из различных разновидностей микроорганизмов, предполагает, что каждая разновидность имеет собственное значение . В этой модели вероятность того, что специфическое изделие будет стерильно после облучения при данной дозе, определена в терминах начального количества организмов на изделии до облучения и значение
.
Методы используют испытание на стерильность продукта или частей продукта, которые получили более низкие дозы радиации, чем стерилизующая доза. После определения стерилизующей дозы необходимо проводить периодические проверки для подтверждения того, что при данной дозе достигается требуемый уровень обеспечения стерильности ().
В.2 Определения
Определения - по 3.8 настоящего стандарта.
В.3 Отбор и испытание продукции
В.3.1 Отбор продукции
Метод отбора единицы продукции для последующего испытания может влиять на результат. Предпочтительно использовать случайный метод. Единицы продукции могут быть выбраны из серийной продукции, которая изготовлена в характерных для данного производства условиях и в которую должны включаться единицы продукции, произведенные в разное время. Если ряд партий изготовлен одновременно, единицы продукции отбирают от каждой партии. Для испытаний могут использоваться забракованные по тем или иным причинам в процессе изготовления единицы продукции при условии, что они прошли полный цикл производства.
В.3.1.1 Часть продукции, отбираемая для испытания в качестве образца ()
Как правило, для испытаний необходимо использовать всю изготовленную продукцию, однако это не всегда возможно. В таких ситуациях можно использовать часть продукции, отбираемую для испытаний в качестве образца. Часть продукции, отбираемая для испытания в качестве образца, должна быть настолько большой, насколько позволяют условия лаборатории. Если невозможно всю часть продукции поместить в одну колбу, можно разделить ее на две или больше колб, а результаты испытаний считать как одно. Если в одной колбе получен положительный результат, то он распространяется на всю часть продукции, отбираемой для испытаний в качестве образца. может быть рассчитана на основе длины, массы, объема или поверхности единицы продукции, которая подвергается испытаниям (см. примеры в таблице В.23).
должна объективно представлять микроорганизмы, подвергаемые процессу стерилизации, и разнообразные элементы сложных изделий. Микроорганизмы в (или на) единице продукции должны быть представлены соответственно отбираемой
. Равномерность бионагрузки единицы продукции должна исследоваться и, если можно показать, что она равномерна,
может отбираться с любого места. При невозможности показать, что бионагрузка распределена равномерно,
должна отбираться случайным образом.
Подготовка и упаковка должна проводиться при условиях минимальной дополнительной бионагрузки. Подготовка
должна осуществляться в помещении с контролируемой окружающей средой и, если возможно, должны использоваться упаковочные материалы, аналогичные используемым для готовой продукции.
Должна демонстрироваться адекватность отбираемой . Бионагрузка
должна быть такой, чтобы испытание на стерильность 20 необлученных образцов дало минимум 17 положительных результатов (т.е. 85% положительных случаев). Если этот критерий не соблюдается, требуется большая
.
Примечание - Если испытывают все изделие целиком, то минимальное количество положительных результатов для необлученных образцов не устанавливают.
Если единица продукции имеет требование по стерильности только внутренней поверхности, по которой течет жидкость, то испытание на стерильность этой поверхности должно рассматриваться как испытание на стерильность целого изделия.
В.3.1.2 Часть продукции, отбираемая для испытаний комплектов
Комплекты, содержащие больше чем одну единицу продукции, рассматриваются как единая медицинская продукция. В состав комплекта могут входить кратные единицы идентичной медицинской продукции (а) или различная медицинская продукция, необходимая для проведения какой-либо одной процедуры или операции (b):
a) Комплекты, содержащие кратное количество одной и той же медицинской продукции. для таких комплектов должна быть основана на предположении, что это одна медицинская продукция, а не сумма всех продуктов в комплекте. Например, для комплекта, содержащего пять шприцев, один проверенный полностью шприц приравнивают к проверке всего комплекта.
b) Комплекты, содержащие различную медицинскую продукцию.
для таких комплектов должна быть основана на необходимости проверки каждого типа медицинской продукции и установлении отдельной
для каждого вида продукции в комплекте. Например, для комплекта, содержащего два халата, два полотенца, две пары перчаток и простыню, индивидуальная
будет определяться для каждого вида медицинской продукции.
В.3.2 Микробиологические испытания
Исследование бионагрузки и испытание на стерильность проводят как часть экспериментов, которые должны проводиться для определения дозы, используя приемлемые лабораторные условия в соответствии с ГОСТ Р ИСО 11737-1 и ИСО 11737-2.
Примечание - См. примечание к 6.2.2.2.
Приведенные ниже методы используют одну среду для испытания на стерильность. Использование этой среды предполагает, что она будет оптимальна для аэробных и факультативно анаэробных культур микроорганизмов, которые могут сохранять жизнеспособность. В противном случае следует использовать другие среды и условия инкубации.
Примечание - Рекомендуется использовать соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней.
В.3.3 Облучение продукции
Облучение продукции или должно проводиться в соответствии с С.1.5.4.
Предпочтительно, чтобы продукт облучался в обычной упаковке. Однако для того, чтобы минимизировать и упростить манипуляции во время испытания, а также сократить возможность получения ложноположительных результатов, может быть принято решение разукомплектовать и переупаковать продукт перед стерилизацией.
Примечание - Манипуляции перед облучением не всегда приемлемы, поскольку они могут изменять реакцию микроорганизмов на облучение, например, изменять химическую среду около микроорганизмов (обычно - давление кислорода).
Материалы, используемые для переупаковки продукта или перед облучением, должны быть устойчивы к облучению в заданном диапазоне доз и не повреждаться после облучения, чтобы свести до минимума вероятность повторных загрязнений.
В.3.4 Методы установления дозы
В.3.4.1 Метод 1. Использование информации о бионагрузке для установления дозы
В.3.4.1.1 Общие положения
Метод основан на экспериментальной проверке того, что устойчивость к облучению микрофлоры продукта меньше, чем устойчивость популяции микроорганизма, имеющего стандартную резистентность.
Используя рациональный выбор стандартной резистентности () (см. таблицу В.24) и вычислительные методы, были рассчитаны индивидуальные дозы, необходимые для достижения величин
10
; 10
; 10
; 10
; 10
для определенных уровней бионагрузки продукта (средняя бионагрузка). Расчетные дозы для средних значений бионагрузки сведены в таблицу B.1.
Практически оценка делается, исходя из средней бионагрузки. Из таблицы B.1 можно определить дозу, которая дает 10
для единиц продукции с известной средней бионагрузкой. Эту дозу используют как проверочную дозу. Она сокращает популяцию микроорганизмов со стандартной резистентностью в 100 раз. Если при дозе 100 единиц продукции или
не обнаружено больше двух положительных результатов испытания на стерильность, таблица В.1 используется для установления стерилизующей дозы, обеспечивающей любой
для данного уровня бионагрузки.
В.3.4.1.2 Определение дозы по методу 1
В методе 1 используется пять этапов установления дозы.
Примечание - Конкретные примеры описаны в пункте В.4.
В.3.4.1.2.1 Стадия 1 - Выбор и отбор образцов единиц продукции
Регистрируют используемый уровень обеспечения стерильности (). Отбирают, по крайней мере, 10 образцов единиц продукции не менее чем от трех серийных партий до стерилизации. Число единиц продукции должно адекватно отражать бионагрузку.
Примечание - Образцами может быть единица продукции или часть единицы продукции (часть продукции, отбираемая для испытаний в качестве образца - ).
В.3.4.1.2.2 Стадия 2 - Определение средней бионагрузки
Используя методы ГОСТ Р ИСО 11737-1, определяют:
a) среднюю бионагрузку в единице продукции () для всех образцов продукции (полная средняя бионагрузка);
b) среднюю бионагрузку в единице продукции () для каждой из трех серий в отдельности (средняя для серий 1, 2 и 3).
Сравнивают данные средней бионагрузки для каждой из трех партий с полной средней бионагрузкой. Определяют, имеется ли серия со средней бионагрузкой в два или более раз больше полной средней бионагрузки.
В.3.4.1.2.3 Стадия 3 - Определение проверочной дозы
Чтобы определить проверочную дозу, берут следующие значения бионагрузки (в соответствии со стадией 2):
- наибольшее среднее для серии, если при ее определении одно или более средних значений для серии больше, чем удвоенное значение общего среднего бионагрузки; или
- общее среднее бионагрузки, если каждое среднее для серии меньше, чем удвоенное значение общего среднего бионагрузки.
В таблице B.1 проверочная доза указана напротив значения средней бионагрузки (полной средней бионагрузки или самой высокой бионагрузки). Если значение средней бионагрузки отсутствует в таблице B.1, берется следующее большее значение.
Таблица B.1 - Доза (кГр), необходимая для достижения заданного уровня обеспечения стерильности (). Данные используются в стадиях 3, 4 и 5 метода 1 определения стерилизующей дозы
Средняя бионагрузка | Доза, кГр, при | ||||
10 | 10 | 10 | 10 | 10 | |
0,063 | 1,0 | 2,6 | 4,8 | 7,4 | 10,4 |
0,075 | 1,1 | 2,7 | 5,0 | 7,6 | 10,6 |
0,088 | 1,2 | 2,8 | 5,1 | 7,8 | 10,8 |
0,10 | 1,3 | 3,0 | 5,3 | 8,0 | 11,0 |
0,12 | 1,4 | 3,1 | 5,5 | 8,2 | 11,3 |
0,14 | 1,5 | 3,3 | 5,7 | 8,4 | 11,5 |
0,17 | 1,6 | 3,5 | 5,9 | 8,6 | 11,7 |
0,19 | 1,7 | 3,6 | 6,0 | 8,8 | 11,9 |
0,22 | 1,8 | 3,7 | 6,2 | 9,0 | 12,1 |
0,26 | 1,9 | 3,9 | 6,4 | 9,2 | 12,3 |
0,29 | 2,0 | 4,0 | 6,5 | 9,4 | 12,5 |
0,34 | 2,1 | 4,1 | 6,7 | 9,6 | 12,7 |
0,39 | 2,2 | 4,3 | 6,8 | 9,8 | 12,9 |
0,44 | 2,3 | 4,4 | 7,0 | 9,9 | 13,1 |
0,50 | 2,4 | 4,5 | 7,1 | 10,1 | 13,3 |
0,57 | 2,5 | 4,7 | 7,3 | 10,3 | 13,5 |
0,65 | 2,6 | 4,8 | 7,5 | 10,4 | 13,6 |
0,73 | 2,7 | 4,9 | 7,6 | 10,6 | 13,8 |
0,83 | 2,8 | 5,1 | 7,8 | 10,8 | 14,0 |
0,93 | 2,9 | 5,2 | 8,0 | 10,9 | 14,2 |
1,05 | 3,0 | 5,3 | 8,1 | 11,1 | 14,3 |
1,17 | 3,1 | 5,4 | 8,2 | 11,2 | 14,5 |
1,32 | 3,2 | 5,6 | 8,3 | 11,4 | 14,7 |
1,47 | 3,3 | 5,7 | 8,5 | 11,5 | 14,8 |
1,64 | 3,4 | 5,8 | 8,6 | 11,7 | 15,0 |
1,83 | 3,5 | 6,0 | 8,8 | 11,9 | 15,1 |
2,04 | 3,6 | 6,1 | 8,9 | 12,0 | 15,3 |
2,27 | 3,7 | 6,2 | 9,0 | 12,2 | 15,5 |
2,51 | 3,8 | 6,3 | 9,2 | 12,3 | 15,6 |
2,79 | 3,9 | 6,4 | 9,3 | 12,4 | 15,8 |
3,09 | 4,0 | 6,6 | 9,4 | 12,6 | 15,9 |
3,42 | 4,1 | 6,7 | 9,6 | 12,7 | 16,1 |
3,77 | 4,2 | 6,8 | 9,7 | 12,9 | 16,2 |
4,17 | 4,3 | 6,9 | 9,9 | 13,0 | 16,4 |
4,60 | 4,4 | 7,0 | 10,0 | 13,1 | 16,5 |
5,06 | 4,5 | 7,1 | 10,1 | 13,3 | 16,6 |
5,57 | 4,6 | 7,3 | 10,2 | 13,4 | 16,8 |
6,13 | 4,7 | 7,4 | 10,4 | 13,6 | 16,9 |
6,74 | 4,8 | 7,5 | 10,5 | 13,7 | 17,1 |
7,40 | 4,9 | 7,6 | 10,6 | 13,8 | 17,2 |
8,12 | 5,0 | 7,7 | 10,7 | 14,0 | 17,4 |
8,91 | 5,1 | 7,9 | 10,9 | 14,1 | 17,5 |
9,76 | 5,2 | 8,0 | 11,0 | 14,2 | 17,6 |
10,69 | 5,3 | 8,1 | 11,1 | 14,4 | 17,8 |
11,70 | 5,4 | 8,2 | 11,2 | 14,5 | 17,9 |
12,80 | 5,5 | 8,3 | 11,4 | 14,6 | 18,1 |
13,99 | 5,6 | 8,4 | 11,5 | 14,7 | 18,2 |
15,28 | 5,7 | 8,5 | 11,6 | 14,9 | 18,3 |
16,69 | 5,8 | 8,6 | 11,7 | 15,0 | 18,5 |
18,21 | 5,9 | 8,8 | 11,8 | 15,1 | 18,6 |
19,87 | 6,0 | 8,9 | 12,0 | 15,3 | 18,7 |
21,66 | 6,1 | 9,0 | 12,1 | 15,4 | 18,8 |
23,61 | 6,2 | 9,1 | 12,2 | 15,5 | 19,0 |
25,72 | 6,3 | 9,2 | 12,3 | 15,6 | 19,1 |
28,00 | 6,4 | 9,3 | 12,4 | 15,8 | 19,3 |
30,48 | 6,5 | 9,4 | 12,6 | 15,9 | 19,4 |
33,16 | 6,6 | 9,5 | 12,7 | 16,0 | 19,5 |
36,06 | 6,7 | 9,7 | 12,8 | 16,1 | 19,6 |
39,20 | 6,8 | 9,8 | 12,9 | 16,2 | 19,8 |
42,60 | 6,9 | 9,9 | 13,0 | 16,4 | 19,9 |
46,28 | 7,0 | 10,0 | 13,2 | 16,5 | 20,0 |
50,25 | 7,1 | 10,1 | 13,3 | 16,6 | 20,2 |
54,55 | 7,2 | 10,2 | 13,4 | 16,8 | 20,3 |
59,20 | 7,3 | 10,3 | 13,5 | 16,9 | 20,4 |
64,22 | 7,4 | 10,4 | 13,6 | 17,0 | 20,5 |
69,65 | 7,5 | 10,5 | 13,7 | 17,1 | 20,7 |
75,51 | 7,6 | 10,6 | 13,9 | 17,3 | 20,8 |
81,83 | 7,7 | 10,7 | 14,0 | 17,4 | 20,9 |
88,67 | 7,8 | 10,9 | 14,1 | 17,5 | 21,0 |
96,04 | 7,9 | 11,0 | 14,2 | 17,6 | 21,2 |
104,0 | 8,0 | 11,1 | 14,3 | 17,7 | 21,3 |
112,6 | 8,1 | 11,2 | 14,4 | 17,9 | 21,4 |
121,9 | 8,2 | 11,3 | 14,5 | 18,0 | 21,5 |
131,9 | 8,3 | 11,4 | 14,7 | 18,1 | 21,7 |
142,6 | 8,4 | 11,5 | 14,8 | 18,2 | 21,8 |
154,3 | 8,5 | 11,6 | 14,9 | 18,3 | 21,9 |
166,8 | 8,6 | 11,7 | 15,0 | 18,5 | 22,0 |
180,3 | 8,7 | 11,8 | 15,1 | 18,6 | 22,2 |
194,8 | 8,8 | 11,9 | 15,2 | 18,7 | 22,3 |
210,5 | 8,9 | 12,0 | 15,3 | 18,8 | 22,4 |
227,4 | 9,0 | 12,2 | 15,5 | 18,9 | 22,5 |
245,6 | 9,1 | 12,3 | 15,6 | 19,0 | 22,7 |
265,2 | 9,2 | 12,4 | 15,7 | 19,2 | 22,8 |
286,3 | 9,3 | 12,5 | 15,8 | 19,3 | 22,9 |
309,0 | 9,4 | 12,6 | 15,9 | 19,4 | 23,0 |
333,4 | 9,5 | 12,7 | 16,0 | 19,5 | 23,1 |
359,7 | 9,6 | 12,8 | 16,1 | 19,6 | 23,3 |
388,0 | 9,7 | 12,9 | 16,2 | 19,8 | 23,4 |
418,4 | 9,8 | 13,0 | 16,4 | 19,9 | 23,5 |
451,1 | 9,9 | 13,1 | 16,5 | 20,0 | 23,6 |
486,3 | 10,0 | 13.2 | 16,6 | 20,1 | 23,7 |
524,2 | 10,1 | 13,3 | 16,7 | 20,2 | 23,9 |
564,9 | 10,2 | 13,4 | 16,8 | 20,3 | 24,0 |
606,6 | 10,3 | 13,5 | 16,9 | 20,5 | 24,1 |
655,6 | 10,4 | 13,7 | 17,0 | 20,6 | 24,2 |
706,2 | 10,5 | 13,8 | 17,1 | 20,7 | 24,3 |
760,5 | 10,6 | 13,9 | 17,3 | 20,8 | 24,5 |
818,8 | 10,7 | 14,0 | 17,4 | 20,9 | 24,6 |
881,4 | 10,8 | 14,1 | 17,5 | 21,0 | 24,7 |
948,7 | 10,9 | 14,2 | 17,6 | 21,1 | 24,8 |
1021 | 11,0 | 14,3 | 17,7 | 21,3 | 24,9 |
1099 | 11,1 | 14,4 | 17,8 | 21,4 | 25,1 |
1182 | 11,2 | 14,5 | 17,9 | 21,5 | 25,2 |
1271 | 11,3 | 14,6 | 18,0 | 21,6 | 25,3 |
1387 | 11,4 | 14,7 | 18,2 | 21,8 | 25,4 |
1470 | 11,5 | 14,8 | 18,3 | 21,9 | 25,5 |
1581 | 11,6 | 14,9 | 18,4 | 22,0 | 25,7 |
1699 | 11,7 | 15,0 | 18,5 | 22,1 | 25,8 |
1827 | 11,8 | 15,1 | 18,6 | 22,2 | 25,9 |
1963 | 11,9 | 15,2 | 18,7 | 22,3 | 26,0 |
2109 | 12,0 | 15,3 | 18,8 | 22,4 | 26,1 |
2266 | 12,1 | 15,5 | 18,9 | 22,6 | 26,2 |
2435 | 12,2 | 15,6 | 19,0 | 22,7 | 26,4 |
2615 | 12,3 | 15,7 | 19,1 | 22,8 | 26,5 |
2808 | 12,4 | 15,8 | 19,3 | 22,9 | 26,6 |
3016 | 12,5 | 15,9 | 19,4 | 23,0 | 26,7 |
3238 | 12,6 | 16,0 | 19,5 | 23,1 | 26,8 |
3476 | 12,7 | 16,1 | 19,6 | 23,2 | 26,9 |
3731 | 12,8 | 16,2 | 19,7 | 23,3 | 27,1 |
4004 | 12,9 | 16,3 | 19,8 | 23,4 | 27,2 |
4297 | 13,0 | 16,4 | 19,9 | 23,6 | 27,3 |
4611 | 13,1 | 16,5 | 20,0 | 23,7 | 27,4 |
4946 | 13,2 | 16,6 | 20,1 | 23,8 | 27,5 |
5306 | 13,3 | 16,7 | 20,2 | 23,9 | 27,6 |
5691 | 13,4 | 16,8 | 20,4 | 24,0 | 27,7 |
6104 | 13,5 | 16,9 | 20,5 | 24,1 | 27,9 |
6545 | 13,6 | 17,0 | 20,6 | 24,2 | 28,0 |
7018 | 13,7 | 17,1 | 20,7 | 24,3 | 28,1 |
7524 | 13,8 | 17,2 | 20,8 | 24,5 | 28,2 |
8065 | 13,9 | 17,4 | 20,9 | 24,6 | 28,3 |
8645 | 14,0 | 17,5 | 21,0 | 24,7 | 28,4 |
9265 | 14,1 | 17,6 | 21,1 | 24,8 | 28,6 |
9928 | 14,2 | 17,7 | 21,2 | 24,9 | 28,7 |
10638 | 14,3 | 17,8 | 21,3 | 25,1 | 28,8 |
11397 | 14,4 | 17,9 | 21,4 | 25,2 | 28,9 |
12209 | 14,5 | 18,0 | 21,6 | 25,3 | 29,0 |
13078 | 14,6 | 18,1 | 21,7 | 25,4 | 29,1 |
14006 | 14,7 | 18,2 | 21,8 | 25,5 | 29,2 |
15000 | 14,8 | 18,3 | 21,9 | 25,6 | 29,3 |
16062 | 14,9 | 18,4 | 22,0 | 25,7 | 29,5 |
17197 | 15,0 | 18,5 | 22,1 | 25,8 | 29,6 |
18411 | 15,1 | 18,6 | 22,2 | 25,9 | 29,7 |
19709 | 15,2 | 18,7 | 22,3 | 26,0 | 29,8 |
21096 | 15,3 | 18,8 | 22,4 | 26,1 | 29,9 |
22578 | 15,4 | 18,9 | 22,5 | 26,2 | 30,0 |
24162 | 15,5 | 19,0 | 22,6 | 26,3 | 30,1 |
25885 | 15,6 | 19,1 | 22,7 | 26,4 | 30,3 |
27664 | 15,7 | 19,2 | 22,8 | 26,4 | 30,4 |
29596 | 15,8 | 19,3 | 23,0 | 26,7 | 30,5 |
31661 | 15,9 | 19,4 | 23,1 | 26,8 | 30,6 |
33867 | 16,0 | 19,5 | 23,2 | 26,9 | 30,7 |
36222 | 16,1 | 19,7 | 23,3 | 27,0 | 30,8 |
39739 | 16,2 | 19,8 | 23,4 | 27,1 | 31,0 |
41426 | 16,3 | 19,9 | 23,5 | 27,2 | 31,1 |
44296 | 16,4 | 20,0 | 23,6 | 27,3 | 31,2 |
47360 | 16,5 | 20,1 | 23,7 | 27,4 | 31,3 |
50632 | 16,6 | 20,2 | 23,8 | 27,6 | 31,4 |
54126 | 16,7 | 20,3 | 23,9 | 27,7 | 31,5 |
57855 | 16,8 | 20,4 | 24,0 | 27,8 | 31,6 |
61836 | 16,9 | 20,5 | 24,1 | 27,9 | 31,7 |
66086 | 17,0 | 20,6 | 24,2 | 28,0 | 31,8 |
70622 | 17,1 | 20,7 | 24,3 | 28,1 | 31,9 |
75463 | 17,2 | 20,8 | 24,5 | 28,2 | 32,0 |
80629 | 17,3 | 20,9 | 24,6 | 28,3 | 32,1 |
86142 | 17,4 | 21,0 | 24,7 | 28,4 | 32,3 |
92025 | 17,5 | 21,1 | 24,8 | 28,5 | 32,4 |
98302 | 17,6 | 21,2 | 24,9 | 28,6 | 32,5 |
105000 | 17,7 | 21,3 | 25,0 | 28,8 | 32,6 |
112140 | 17,8 | 21,4 | 25,1 | 28,9 | 32,7 |
119760 | 17,9 | 21,5 | 25,2 | 29,0 | 32,8 |
127890 | 18,0 | 21,6 | 25,3 | 29,1 | 32,9 |
136560 | 18,1 | 21,7 | 25,4 | 29,2 | 33,0 |
145810 | 18,2 | 21,8 | 25,5 | 29,3 | 33,1 |
155670 | 18,3 | 21,9 | 25,6 | 29,4 | 33,3 |
166190 | 18,4 | 22,0 | 25,7 | 29,5 | 33,4 |
177410 | 18,5 | 22,1 | 25,8 | 29,6 | 33,5 |
189360 | 18,6 | 22,2 | 25,9 | 29,7 | 33,6 |
202110 | 18,7 | 22,3 | 26,1 | 29,8 | 33,7 |
215710 | 18,8 | 22,5 | 26,2 | 29,9 | 33,8 |
230220 | 18,9 | 22,6 | 26,3 | 30,1 | 33,9 |
245650 | 19,0 | 22,7 | 26,4 | 30,2 | 34,0 |
262110 | 19,1 | 22,8 | 26,5 | 30,3 | 34,1 |
279660 | 19,2 | 22,9 | 26,6 | 30,4 | 34,2 |
298370 | 19,3 | 23,0 | 26,7 | 30,5 | 34,3 |
318310 | 19,4 | 23,1 | 26,8 | 30,6 | 34,5 |
339560 | 19,5 | 23,2 | 26,9 | 30,7 | 34,6 |
362200 | 19,6 | 23,3 | 27,0 | 30,8 | 34,7 |
386320 | 19,7 | 23,4 | 27,1 | 30,9 | 34,8 |
412030 | 19,8 | 23,5 | 27,2 | 31,0 | 34,9 |
439420 | 19,9 | 23,6 | 27,3 | 31,1 | 35,0 |
468660 | 20,0 | 23,7 | 27,4 | 31,2 | 35,1 |
499690 | 20,1 | 23,8 | 27,5 | 31,3 | 35,2 |
532810 | 20,2 | 23,9 | 27,6 | 31,5 | 35,3 |
568-80* | 20,3 | 24,0 | 27,7 | 31,6 | 35,4 |
605660 | 20,4 | 24,1 | 27,8 | 31,7 | 35,5 |
645680 | 20,5 | 24,2 | 28,0 | 31,8 | 35,7 |
688310 | 20,6 | 24,3 | 28,1 | 31,9 | 35,8 |
733710 | 20,7 | 24,4 | 28,2 | 32,0 | 35,9 |
782060 | 20,8 | 24,5 | 28,3 | 32,1 | 36,0 |
833540 | 20,9 | 24,6 | 28,4 | 32,2 | 36,1 |
888370 | 21,0 | 24,7 | 28,5 | 32,3 | 36,2 |
946746 | 21,1 | 24,8 | 28,6 | 32,4 | 36,3 |
1008900 | 21,2 | 24,9 | 28,7 | 32,5 | 36,4 |
Примечание - Присутствие в таблице B.1 высоких уровней бионагрузки не означает, что такие уровни являются нормой. | |||||
________________
* Соответствует оригиналу. - .
Примечание - Таблица B.1 предназначена для проверки на устойчивость к процессу стерилизации при 10
средней бионагрузки образца. Образцами могут быть вся единица продукции или часть единиц продукции (
). Если испытывают часть продукции, то для определения проверочной дозы следует использовать бионагрузку части образца (бионагрузка
).
В.3.4.1.2.4 Стадия 4. Проведение эксперимента по контролю проверочной дозы.
Для проведения эксперимента по контролю проверочной дозы берут 100 образцов продукции из одной партии.
Эти 100 образцов продукции для выполнения стадии 4 могут отбираться от любой из трех партий, для которой была получена оценка бионагрузки на стадии 2, или четвертой партии, изготовленной при нормальных условиях производства. При отборе партии необходимо учитывать способность медицинской продукции поддерживать рост микроорганизмов. Облучение образцов для проверки следует проводить при дозах, полученных на стадии 3 из табл.B.1, или большей.
Фактическая доза может отличаться от дозы проверки на +10%. Если доза меньше 90% расчетной дозы, испытания необходимо повторить.
Примечание - Эксперимент по контролю проверочной дозы без оценки бионагрузки является недействительным.
Следует испытывать на стерильность каждую единицу продукции () отдельно. Рекомендуется использовать соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней (в соответствии с ИСО 11737-2).
Примечание - Могут быть использованы другие соответствующие среды и условия инкубации (В.3.2).
Результат считается статистически удовлетворительным и принимается, если при испытании на стерильность оказываются положительными не более двух случаев из 100.
Примечание - Положение о приемлемости проверки, когда имеются не более двух положительных случаев, основано на статистической вероятности использования средней бионагрузки для определения дозы, при которой один из 100 образцов ожидается нестерильным, с вероятностью 0,92 можно утверждать, что будет наблюдаться ноль, один или два положительных результата (таблица В.25).
Если имеется более двух положительных испытаний на стерильность, и это не может быть приписано неправильному выполнению оценки бионагрузки, контролю стерильности или облучению (например, доза составляла менее 90% расчетной дозы), этот метод определения дозы не может быть использован, и необходимо применять другой метод, использующий изучение резистентности контаминирующих микроорганизмов (например, метод 2).
В.3.4.1.2.5 Стадия 5. Определение стерилизующей дозы
Если результаты контроля проверочной дозы статистически удовлетворительны для определения стерилизующей дозы, то по таблице B.1 находят самое близкое значение бионагрузки, равное или более средней бионагрузки для данной единицы продукции, и устанавливают необходимую дозу для достижения требуемого .
Примечание - При определении средней бионагрузки для целого продукта используют всю единицу продукции (![]() 1). Если на стадии 2 используют часть единицы продукции (
1). Если на стадии 2 используют часть единицы продукции (![]() 1), то определяют бионагрузку
1), то определяют бионагрузку , а для получения средней бионагрузки необходимо бионагрузку
разделить на ее долю
относительно единицы продукции.
В.3.4.1.3 Проверка стерилизующей дозы, определенной по методу 1
Установленная стерилизующая доза должна основываться на самом последнем экспериментальном исследовании или на увеличенной дозе, полученной при последней проверке (В.3.5.3). Для подтверждения того, что результаты определения стерилизующей дозы являются обоснованными, следует один раз в три месяца выполнять проверку в соответствии с В.3.5.
В.3.4.2 Метод 2 - Использование информации о "положительной доле", полученной при облучении образцов возрастающей дозой, для установления коэффициента экстраполяции
Примечания
1 При использовании метода 2 образцы берут из одной и той же партии, а для метода 1 результат получают при исследовании трех партий.
2 Порядок расчетов доз (кГр),
(кГр) и стерилизующей дозы для методов 2А и 2В различен, поэтому следует обращать внимание на правильность применения формул и таблиц.
3 Метод 2В требует использования всей единицы продукции (![]() 1,0), в то время как для метода 2А можно использовать как всю единицу продукции, так и часть (
1,0), в то время как для метода 2А можно использовать как всю единицу продукции, так и часть (![]() 1,0).
1,0).
В.3.4.2.1 Пояснение
В методе 2 определяют резистентность к радиации микроорганизмов, находящихся на изделии. Метод использует результаты испытания на стерильность образцов продукта, которые облучались возрастающей дозой, чтобы оценить значение дозы, при котором в выборке из 100 единиц продукции может находиться один нестерильный образец (т.е. 10
). Микроорганизмы, выжившие при этой дозе, должны иметь значение
, более однородное, чем начальная бионагрузка. По результатам экспериментального облучения при возрастающих дозах оценивают
, и, чтобы определить стерилизующую дозу, используют для экстраполяции значение
10
.
Достоверность расчета стерилизующей дозы зависит от достоверности экстраполяции. В больших экспериментах, использующих компьютерное моделирование инактивации микроорганизмов, достоверность этой экстраполяции была установлена для популяций микроорганизмов с изученной радиорезистентностыо.
Разработка, на основании которой может быть сделано это утверждение, и данные компьютерного моделирования содержатся в [11].
В В.3.4.2.2 - В.3.4.2.5 приведено описание двух методов:
a) 2А - для продуктов с бионагрузкой, которая бывает при "нормальном" процессе производства;
b) 2В - для продуктов со стойкой и очень низкой бионагрузкой.
В.3.4.2.2 Определения дозы по методу 2А
Метод 2А состоит из четырех стадий.
Примечание - Конкретные примеры приведены в В.4.
В.3.4.2.2.1 Стадия 1. Выбор и получение образцов изделия
Выбирают и регистрируют используемую . Отбирают не менее 280 единиц продукции от каждой из трех независимых серий до стерилизации. Должны быть выполнены условия для выбора
, приведенные в В.3.1.1.
Примечание - В качестве образца может быть взята единица продукции или .
В.3.4.2.2.2 Стадия 2. Экспериментальное облучение при возрастающих дозах
Облучают по 20 единиц продукции от трех серий не менее чем при девяти дозах, увеличивающихся на 2 кГр. Облучение должно проводиться независимо, и поглощенная доза для разных образцов может отличаться от номинальной дозы на ±1,0 кГр или ±10%. Если доза меньше номинальной более чем на 1 кГр или 10%, эксперимент надо повторить. Поглощенную дозу для каждой единицы продукции необходимо контролировать дозиметрами индивидуально.
Каждую облученную единицу продукции проверяют на стерильность индивидуально, используя соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней (в соответствии с ИСО 11737-2). Число положительных и отрицательных результатов испытания на стерильность регистрируют.
Примечание - Могут быть использованы другие среды и условия инкубации (В.3.2), которые удовлетворяют необходимым требованиям.
В результате этого эксперимента получают следующие данные.
В.3.4.2.2.2.1 Определение дозы и дозы, при которой появляется первый положительный результат - first fraction positive (
)
Для каждой из трех партий определяют самую низкую дозу из ряда возрастающих доз, при которой не менее чем один из 20 результатов отрицателен. Эти дозы обозначают как дозы и находят их среднее значение. По таблице В.2 определяют дозу
, используя число положительных результатов испытаний на стерильность и среднее значение доз
.
Таблица В.2 - Оценка дозы для различных количеств испытаний на стерильность с положительным результатом, полученных при дозе, равной среднему значению
дозы (метод 2А)
| Количество испытаний на стерильность с положительным результатом при дозе, равной среднему значению |
0,00 | 19 |
0,13 | 18 |
0,22 | 17 |
0,31 | 16 |
0,38 | 15 |
0,45 | 14 |
0,52 | 13 |
0,58 | 12 |
0,65 | 11 |
0,72 | 10 |
0,79 | 9 |
0,87 | 8 |
0,95 | 7 |
1,05 | 6 |
1,15 | 5 |
1,28 | 4 |
1,43 | 3 |
1,65 | 2 |
2,00 | 1 |
2,00 | 0 |
Примечание - (кГр) - величина, на которую уменьшается среднее значение доз
, чтобы определить дозу, при которой ожидается 19 положительных результатов испытания на стерильность.
Формула для вычисления (кГр) (метод 2А)
![]() , (В.1)
, (В.1)
где - число испытаний с отрицательным результатом.
По уравнению В.2 вычисляют дозу:
![]() (В.2)
(В.2)
Примечание - (кГр) - значение дозы, при которой только один образец из 20 облучаемых будет стерилен.
В.3.4.2.2.2.2 Доза *
_____________
* Обозначение дозы.
_____________
Здесь и далее по тексту. - .
Для каждой из трех серий, определяют дозу * как:
a) самую малую обнаруженную дозу из двух последовательных, при которой результаты всех испытаний являются отрицательными, при этом испытания для дальнейшего ряда возрастающих доз сопровождаются не более чем одним положительным результатом; или
b) самую маленькую обнаруженную дозу, при которой из 20 образцов может быть один положительный результат, при этом все следующие испытания отрицательны.
Облучение при дозах выше * может быть не более одного положительного результата.
Дозу * определяют следующим образом:
a) если самая высокая доза * для партии превышает среднее значений доз
* меньше чем на 5 кГр, среднее значение доз
* становится дозой
*;
или
b) если самая высокая доза * для партии превышает среднее значение доз
* на 5 кГр или больше, самая высокая доза
* для партии становится дозой
*.
Примечание - * предварительная оценка значения дозы, необходимой для достижения
10
.
B.3.4.2.2.2.3 * серия
* серией считают серию, для которой доза
* равна дозе
*. Если более одной серии доза
* равна дозе
*,
* серию выбирают случайным образом из этих серий.
В.3.4.2.2.3 Стадия 3. Проведение эксперимента по контролю дозы
Облучают 100 единиц продукции или частей ее от * серии при дозе
*. Поглощенная доза контролируется дозиметрами. Эта поглощенная доза будет дозой
*. Фактическая доза может отличаться от дозы
* на +1,0 кГр или +10% (допускается большее значение из этих величин). Если поглощенная доза меньше 90% дозы
*, испытание может быть повторено.
Каждую облученную единицу продукции или часть ее проверяют на стерильность индивидуально. Рекомендуется использовать соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней (в соответствий с ИСО 11737-2). Регистрируют количество положительных результатов испытания на стерильность, полученных в этом эксперименте.
Примечания
1 Могут быть использованы другие среды и условия инкубации (В.3.2).
2 Этот эксперимент выполняется, чтобы получить дозу, при которой ожидается, что ни одна из 100 единиц продукции не будет нестерильной (First No Positives, доза).
В результате этого эксперимента получают следующие данные:
a) доза * - фактическая поглощенная доза;
b) * - число положительных испытаний на стерильность;
c) доза :
- если * два или меньше, доза
равна дозе
*;
- если * больше двух и меньше десяти, доза
равна дозе (
*+2,0) кГр;
- если * больше девяти и меньше 16, доза
равна (
*+4,0) кГр;
- если * больше 15, доза
* должна быть повторно определена (стадия 2).
В.3.4.2.2.4 Стадия 4. Определение стерилизующей дозы
Дозу определяют, используя уравнения В.3 или В.4 в зависимости от различия доз
и
.
Если ![]() меньше 10 кГр (метод 2А),
меньше 10 кГр (метод 2А),
![]() . (В.3)
. (В.3)
Примечание - При использовании уравнения В.3, если ![]() кГр меньше нуля,
кГр меньше нуля, ![]() приравнивается нулю,
приравнивается нулю, ![]() .
.
Если ![]() равно 10 кГр или больше (метод 2А),
равно 10 кГр или больше (метод 2А),
![]() . (В.4)
. (В.4)
Для определения дозы ** по методу 2А используют уравнение В.5.
![]() . (В.5)
. (В.5)
Примечание - Если * равно нулю, то принимают
![]() .
.
При расчете стерилизующей дозы по методу 2А используют формулу В.6.
Стерилизующая доза (метод 2А):
стерилизующая доза ![]() , (B.6)
, (B.6)
где
доза ** - доза (кГр), которая будет обеспечивать
10
для испытуемых образцов;
- предварительно выбираемый гарантированный уровень стерильности для продукта;
- часть продукции (часть продукции, отбираемая для проведения испытаний), используемая для определения дозы
** и дозы
(кГр);
доза - доза, необходимая для инактивации 90% микроорганизмов, выдерживающих дозу
**.
Примечания
1 Вычисляют дозу с точностью до первого десятичного знака. Доза стерилизации может быть округлена (использование стандартной процедуры округления) с точностью до первого десятичного знака.
2 ![]() в уравнении B.6 означает соответствующий корректирующий коэффициент, если изделие проверяется на стерильность не целиком.
в уравнении B.6 означает соответствующий корректирующий коэффициент, если изделие проверяется на стерильность не целиком.
В.3.4.2.3 Проверка стерилизующей дозы, определенной по методу 2А
Стерилизующую дозу определяют на основе самых последних экспериментов или на увеличенной дозе, полученной при проверке. Чтобы определить, остаются ли действительными результаты обоснованности стерилизующей дозы, проверка дозы должна проводиться в соответствии с В.3.5.
В.3.4.2.4 Методика определения дозы по методу 2В (изделие с устойчивой и очень низкой бионагрузкой)
При использовании метода 2В должны быть соблюдены три требования:
a) используют всю единицу продукции (![]() 1,0);
1,0);
b) число испытаний на стерильность с положительным результатом после облучения с любой из возрастающих доз не превышает 14 из 20 для любой серийной партии;
c) доза не превышает 5,5 кГр.
В методе 2В используют четыре стадии для определения дозы.
Примечание - Конкретные примеры описаны в пункте В.4.
В.3.4.2.4.1 Стадия 1. Выбор и получение образцов изделия
Выбирают и регистрируют используемый . Отбирают не менее 260 образцов продукции от каждой из трех независимых серий до стерилизации.
В методе 2В, для изучения бионагрузки и испытания на стерильность используют всю продукцию (![]() 1). Если всю представительную часть единицы продукции невозможно поместить в одну посуду, можно ее разделить на несколько колб, а результаты испытаний считать как одно.
1). Если всю представительную часть единицы продукции невозможно поместить в одну посуду, можно ее разделить на несколько колб, а результаты испытаний считать как одно.
В.3.4.2.4.2 Стадия 2. Экспериментальное облучение образцов при возрастающих дозах
По 20 образцов изделий от трех партий облучают не меньше чем при восьми дозах, увеличивающихся на 1 кГр. Облучение должно проводиться независимо, и поглощенная доза для разных образцов может отличаться от номинальной дозы на ±0,5 кГр или ±10%, за исключением дозы в 1,0 кГр, которая может отличаться только на ±0,2 кГр. Если поглощенная доза меньше этих значений, эксперимент необходимо повторить. Поглощенную дозу для каждого изделия необходимо контролировать дозиметрами.
Каждое изделие проверяют на стерильность, используя соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней (в соответствии с ИСО 11737-2). Регистрируют число положительных и отрицательных результатов испытания на стерильность.
Примечание - Могут быть использованы другие соответствующие среды и условия инкубации (В.3.2).
При использовании метода 2В число положительных результатов испытаний на стерильность после облучения при любой дозе не должно превышать 14 из 20 для любой серийной партии. Если наблюдается больше 14 положительных результатов, необходимо использовать другой метод определения дозы (например, метод 2А).
В результате этого эксперимента получают следующие данные.
В.3.4.2.4.2.1 Определение дозы и первой положительной дозы (
)
Для каждой из трех партий определяют самую низкую дозу из ряда возрастающих доз, при которой, по крайней мере, одно из 20 испытаний отрицательное. Эти дозы обозначают как дозы и находят их среднее значение. По таблице В.3 определяют дозу
, используя число положительных испытаний на стерильность и среднее значение
доз.
Таблица В.3 - Оценка дозы для различных количеств положительных результатов испытаний на стерильность, полученных при дозах, равных среднему значению
дозы (метод 2В)
Доза | Количество испытаний на стерильность с положительным результатом при дозе, равной среднему значению |
0,22 | 14 |
0,26 | 13 |
0,29 | 12 |
0,32 | 11 |
0,36 | 10 |
0,40 | 9 |
0,44 | 8 |
0,48 | 7 |
0,52 | 6 |
0,58 | 5 |
0,64 | 4 |
0,72 | 3 |
0,82 | 2 |
1,00 | 1 |
1,00 | 0 |
Примечание - Доза - значение, на которое уменьшается среднее значение доз
, чтобы определить дозу, при которой ожидается 19 положительных результатов испытаний на стерильность.
Формула для расчета дозы (кГр) (метод 2В)
![]() , (B.7)
, (B.7)
где - количество отрицательных результатов испытаний.
Расчет дозы (метод 2В) производят по формуле В.8.
![]() (В.8)
(В.8)
Примечание - Доза - доза, при которой только один образец из 20 будет нестерилен.
В.3.4.2.4.2.2 Доза *
Для каждой из трех серий определяют дозу * как:
a) самую малую дозу, при которой все испытания на стерильность отрицательны, при этом для следующей большей дозы все испытания также отрицательны, а для остальных больших доз может быть не более одного положительного результата; или
b) самую малую дозу, при которой из 20 образцов может быть один положительный результат, при этом все следующие испытания отрицательны.
При дозах выше * не должно быть более одного положительного результата.
Дозу * определяют следующим образом:
a) если самая высокая доза * для партии превышает среднее значение доз
* меньше чем на 5 кГр, среднее значение доз
* становится дозой
*
или
b) если самая высокая доза * для партии превышает среднее значение доз
* на 5 кГр или больше, самая высокая доза
* для партии становится дозой
*.
Примечание - * - предварительная оценка дозы, необходимой для достижения
10
.
В.3.4.2.4.2.3 * серия
Устанавливают серию, для которой доза * равна дозе
*, и определяют ее как
* серию. Если больше чем одна серия имеет дозу
*, равную дозе
*, одну из этих серий выбирают случайным способом как
* серию.
В.3.4.2.4.3 Стадия 3. Экспериментальная проверка дозы
Облучают 100 единиц продукции от * серии дозой
*. Поглощенную дозу контролируют дозиметрами. Эту поглощенную дозу определяют как дозу
*. Фактическая доза может отличаться от дозы
* на +1,0 кГр или +10% (допускается большее значение из этих величин). Если поглощенная доза меньше 90% дозы
*, испытание может быть повторено.
Проверяют на стерильность каждое изделие выборки индивидуально.
Рекомендуется использовать соево-казеиновый бульон, температуру инкубации (30±2) °С и инкубационный период 14 дней (в соответствии с ИСО 11737-2).
Примечания
1 Могут быть использованы другие среды и условия инкубации (В.3.2).
2 Этот эксперимент выполняют, чтобы получить дозу, при которой ожидается, что ни одна из 100 единиц продукции не будет нестерильной (First No Positives, доза ).
В результате этого эксперимента получают следующие данные:
a) дозу * фактически поглощенную дозу;
b) * - число положительных испытаний на стерильность;
c) дозу - (для метода 2В
не должна превышать 5,5 кГр; если она превышает это значение, необходимо использовать другой метод, например, метод 2А):
- если * равно двум или меньше, доза
равна дозе
*,
- если * больше двух и меньше десяти, доза
равна дозе
*+2,0 кГр,
- если * больше девяти и меньше 16, доза
равна
*+4,0 кГр,
- если * больше 15, доза
* должна быть повторно определена (стадия 2).
В.3.4.2.4.4 Стадия 4. Определение стерилизующей дозы
Дозу для метода 2В определяют по формуле:
![]() (B.9)
(B.9)
Примечание - Если при использовании уравнения В.9 ![]() меньше нуля, принимают
меньше нуля, принимают ![]() .
.
Используя уравнение В.10, устанавливают дозу **, кГр, для метода 2В.
Формула для ** по методу 2В (аналогична формуле В.5):
![]() (В.10)
(В.10)
Примечание - Если ![]() , то
, то ![]() .
.
Рассчитывают стерилизующую дозу по методу 2В, используя уравнение В.11:
стерилизующая доза ![]() , (В.11)
, (В.11)
где доза ** (кГр) - доза, которая обеспечивает
10
для испытуемых образцов;
- предварительно выбираемый уровень обеспечения стерильности для продукта;
- доза, необходимая для инактивации 90% микроорганизмов, выдерживающих дозу
**.
Примечание - Вычисляют дозу с точностью до первого десятичного знака. Доза стерилизации может быть округлена (использование стандартной процедуры округления) с точностью до первого десятичного знака.
В.3.4.2.5 Проверка стерилизующей дозы, определенной по методу 2В
Стерилизующую дозу определить на основе самых последних экспериментов по определению этой дозы или на увеличенной дозе, полученной при проверке. Чтобы определить, остаются ли действительными результаты установления стерилизующей дозы, проверку дозы проводить в соответствии с В.3.5.
В.3.5 Проверка стерилизующей дозы
В.3.5.1 Цель и периодичность
Для подтверждения ранее определенной стерилизующей дозы необходимо проводить периодическую проверку. Для условий серийного производства проверку проводить не менее чем один раз в три месяца, чтобы обнаружить изменения бионагрузки, которая может потребовать увеличения стерилизующей дозы.
В.3.5.2 Методика проверки
Проверку проводить следующим образом:
a) от случайной серии отобрать 110 случайных образцов изделия до стадии стерилизации;
b) используя те же самые и методы испытания бионагрузки, которые используются при первоначальном определении дозы, определить бионагрузку для каждого из 10 изделий;
c) при использовании той же самой снова облучить оставшиеся 100 единиц продукции контрольной дозой (для метода 2, доза
**), которая определена при первоначальном определении дозы. Если контрольная доза была увеличена в течение предыдущей проверки, использовать увеличенную дозу. Фактическая доза может отличаться от контрольной дозы (для метода 2,
**) на +10%. Если поглощенная доза меньше 90% расчетной проверочной дозы, испытание повторить;
d) провести испытание на стерильность, используя те же методы, что и при первоначальном определении дозы.
В.3.5.3 Интерпретация и выполняемые действия
При интерпретации результатов проверки, кроме данных контроля, необходимо использовать данные оценки бионагрузки, обследования условий и состояния производства. Если обследование указывает на неудовлетворительное состояние условий производства, необходимо принять соответствующие действия:
a) если получено два или меньшее количество положительных результатов испытания на стерильность, то первоначальная стерилизующая доза приемлема и не требуется никаких действий;
b) если получено три или четыре положительных результата, то первоначальная стерилизующая доза неприемлема. Поэтому стерилизующая доза должна быть немедленно увеличена (В.3.5.4.1 или В.3.5.4.2.).
После этого следует провести повторные испытания проверочной дозы, чтобы определить, нужно ли продолжать увеличение стерилизующей дозы:
1) если при повторных испытаниях получено два или меньшее количество положительных результатов испытания на стерильность, а данные оценки бионагрузки и обследования условий и состояния производства не указывают на отклонение от установленных требований, использование первоначальной стерилизующей дозы может быть возобновлено;
2) если при повторных испытаниях получено от трех до четырех положительных результатов испытания на стерильность, следует провести контрольные действия, предписанные для случая, когда получено от пяти до шести положительных результатов (В.3.5.3 с);
3) если при повторных испытаниях получено пять или больше положительных результатов испытания на стерильность, следует провести контрольные действия, предписанные для случая, когда получено семь или больше положительных результатов (В.3.5.3 d).
Если увеличение стерилизующей дозы происходит при каждой ежеквартальной проверке, следующую ревизию необходимо проводить, используя пересмотренную контрольную дозу. Если при каждой ежеквартальной проверке не происходит увеличения стерилизующей дозы, следующую ревизию необходимо проводить, используя первоначальную контрольную дозу.
Повторение проверки стерилизующей дозы не разрешается, если не установлено, что проверка проводилась с нарушением установленной процедуры или облучение проведено низкой дозой (например, доза была меньше 90% проверочной дозы);
c) если получено пять или шесть положительных результатов испытания на стерильность, первоначальная стерилизующая доза не адекватна. Поэтому стерилизующая доза должна быть немедленно увеличена (В.3.5.4.1 или В.3.5.4.2), и повторные испытания не разрешаются. Стерилизующую дозу определить вновь.
Следующую ежеквартальную проверку следует выполнить с использованием пересмотренной или вновь определенной контрольной дозы.
Повторение проверки стерилизующей дозы не разрешается, если не установлено, что проверка проводилась с нарушением установленной процедуры или облучение проведено низкой дозой (например, доза была меньше 90% проверочной дозы);
d) если получено семь или более положительных результатов и не обнаружено существенное увеличение бионагрузки, то, предполагается, что увеличилась резистентность микроорганизмов, контаминирующих изделия. В этом случае стерилизующая доза не может быть просто увеличена, а должна быть заново определена.
Повторение проверки стерилизующей дозы не разрешается, если не установлено, что проверка проводилась с нарушением установленной процедуры или облучение проводилось при низкой дозе (например, доза была меньше 90% проверочной дозы).
В.3.5.4 Увеличение дозы
В.3.5.4.1 Метод 1
Пересмотр контрольный дозы и увеличение стерилизующей дозы следует выполнить следующим образом:
a) если во время контрольной процедуры получено:
1) три или четыре положительных результата испытания на стерильность или
2) пять или шесть положительных результатов испытания на стерильность, а бионагрузка увеличилась, то увеличение контрольной и стерилизующей доз следует провести, исходя из следующих положений:
- используя значение средней бионагрузки, полученной при проверке, определить новую контрольную дозу и стерилизующую дозу из таблицы B.1;
- умножая среднюю бионагрузку, полученную при первоначальном определении стерилизующей дозы на 10, использовать полученное значение для определения новой контрольной и стерилизующей доз из таблицы B.1;
b) если при проверке получено пять или шесть положительных результатов испытания на стерильность и не обнаружено существенное увеличение биологической нагрузки единицы продукции, то в этом случае стерилизующая доза не может быть просто увеличена, а должна быть заново определена.
В.3.5.4.2 Метод 2
Пересмотр контрольной дозы и увеличение стерилизующей дозы выполнить следующим образом:
a) если в течение контрольной процедуры получено:
1) три или четыре положительных результата испытания на стерильность или
2) пять или шесть положительных результатов испытания на стерильность, и бионагрузка увеличилась, то вычисление пересмотренной контрольной дозы и увеличение стерилизующей дозы провести, используя следующее уравнение:
пересмотр контрольной дозы для методов 2А и 2В:
![]() , (B.12)
, (B.12)
где является числом положительных испытаний при стерилизации контрольной дозой, а доза
рассчитана с использованием уравнений В.3, В.4, В.9 соответственно.
Примечание - Доза основана на проверке
, увеличение дозы
установлено экспериментально.
Увеличение стерилизующей дозы (формула для метода 2А)
Стерилизующая доза ![]() . (В.13)
. (В.13)
Увеличение стерилизующей дозы (формула для метода 2В)
Стерилизующая доза![]() ; (В.14)
; (В.14)
b) если в течение проверки получено пять или шесть положительных результатов, и бионагрузка не увеличилась, следует предположить, что изменилась резистентность микроорганизмов. Это лишает возможности использовать принятое значение резистентности для определения стерилизующей дозы. Поэтому пересмотренная контрольная доза или увеличенная стерилизующая доза не может быть рассчитана. Проводить стерилизацию ранее установленной дозой нельзя, и необходимо вновь определить стерилизующую дозу.
В.3.5.5 Биологические индикаторы и испытание на стерильность
Использование биологических индикаторов для валидации и контроля процесса или использование процедуры испытания на стерильность для того, чтобы контролировать выпускаемые изделия, в практике радиационной стерилизации не рекомендовано.
В природе существует большое количество микроорганизмов, которые имеют более высокую резистентность к радиации, чем обычно используемые в качестве биологических индикаторов споры Bacillus pumilus. Кроме того, радиорезистентность может увеличиваться при облучении в определенных условиях (например, в анаэробных условиях, в капсулах). Данные о радиорезистентности большого числа микроорганизмов см. [7]. Кроме того, промышленный опыт показывает, что часто в составе бионагрузки продукта встречаются микроорганизмы, имеющие большую радиорезистентность, чем у спор Bacillus pumilus. Поэтому, если не показано, что радиорезистентность контаминирующих на изделиях микроорганизмов меньше, чем радиорезистентность биологических индикаторов, использование биологических индикаторов не рекомендуется для контроля процесса или валидации.
Невозможно проводить испытание на стерильность продукта при 10
(т.е. 10
, 10
, 10
, 10
) из-за необходимости использовать большое количество испытательных образцов для доказательства того, что требуемый
достигнут. Например, чтобы показать
10
, необходимо проверить на стерильность один миллион изделий. Поэтому использование процедуры испытания на стерильность для контроля выпускаемых продуктов в практической радиационной стерилизации не рекомендовано.
В.4 Примеры
В.4.1 Примеры для метода 1
Для метода 1 дается два примера.
В первом примере для продукта, который является слишком большим, чтобы его можно было легко контролировать, использовалась часть продукта (![]() 1,0). По окончании работы достигнут
1,0). По окончании работы достигнут 10
.
Второй пример относится к продукции, которая может быть использована для контроля (![]() 1) полностью. После окончания работы достигнут
1) полностью. После окончания работы достигнут 10
.
Метод 1, контроль
Контрольная процедура для метода 1 одна и та же, независимо от того, используется все изделие или . В таблице В.6 приводится пример ежеквартальной проверки дозы, определенной в соответствии с примером, приведенным в таблице В.5. В соответствии с этим примером после окончания работ достигается
10
. На стадии 2 получена средняя бионагрузка 382, на стадии 3 определена контрольная доза 9,7 кГр, и на стадии 5 определена доза стерилизации 12,9 кГр.
В.4.2 Примеры для метода 2
Для метода 2А даются два примера: один - для продукта, который может контролироваться целиком (![]() 1,0), и второй - для продукта, у которого для контроля используется лишь часть (
1,0), и второй - для продукта, у которого для контроля используется лишь часть (![]() 1,0). Один пример дан для метода 2В, который требует использования продукции целиком. В таблице В.22 имеется пример проверки и увеличения стерилизующей дозы для метода 2.
1,0). Один пример дан для метода 2В, который требует использования продукции целиком. В таблице В.22 имеется пример проверки и увеличения стерилизующей дозы для метода 2.
Примечание - В следующих примерах приведены случаи использования образцов от одной серии и образцов, полученных от трех серий.
В.4.2.1 Пример для метода 2А (![]() 1,0)
1,0)
В.4.2.1.1 Стадия 1. Выбор и отбор образцов изделия
По окончании испытаний необходимо было получить 10
. Для испытаний на стерильность использовалась продукция полностью (
![]() 1,0) и 280 случайных образцов, отобранных от каждой из трех серий.
1,0) и 280 случайных образцов, отобранных от каждой из трех серий.
Распределение образцов продукта при проведении эксперимента с возрастающей дозой приведено в таблице В.7.
В.4.2.1.2 Стадия 2. Экспериментальное облучение возрастающей дозой
В таблице В.8 приведен пример данных, полученных при облучении образцов возрастающим рядом доз. В таблице В.9 показан пример вычислений.
В.4.2.1.3 Стадия 3. Экспериментальная проверка дозы
В таблице В.10 приведены экспериментальные результаты, полученные на стадии 3.
В.4.2.1.4 Стадия 4. Определение стерилизующей дозы
В таблице В.11 приведены вычисления стерилизующей дозы.
Таблица В.4 - Определение стерилизующей дозы (метод 1, ![]() 1,0)
1,0)
Величина | Значение | Примечание |
Стадия 1 | ||
10 | Для единицы продукции к концу испытаний должен быть достигнут | |
0,05 | Так как единица продукции была также большой и сложной для испытания на стерильность, 1/20 часть была отобрана для испытания группы на резистентность | |
Стадия 2 | ||
Бионагрузка | 59 | Результаты испытаний бионагрузки - 50, 62 и 65; среднее значение - 59, так как ни одно значение бионагрузки не превышает среднее более чем вдвое, в качестве бионагрузки |
Средняя бионагрузка | 1180 | Бионагрузка испытываемой единицы продукции была рассчитана следующим образом: 50/0,05=1000; 62/0,05=1240; 65/0,05=1300. Таким образом, средняя бионагрузка - 1180. Так как ни одно значение не превышает среднее более чем в два раза, для установления дозы принимается средняя бионагрузка - 1180 |
Стадия 3 | ||
Доза проверки | 7,3 кГр | Для бионагрузки |
Стадия 4 | ||
Результаты испытания на стерильность | Два положительных результата при дозе проверки 6,8 кГр | Результаты испытаний принимаются, т.к. контрольная доза была в пределах заданного диапазона, т.е. меньше 8,0 кГр, а результаты испытания на стерильность были приемлемы (т.е. |
Стадия 5 | ||
Стерилизующая доза при | 25,2 кГр | При |
Таблица В.5 - Определение стерилизующей дозы (метод 1, ![]() 1,0)
1,0)
Величина | Значение | Примечание |
Стадия 1 | ||
10 | К концу испытаний должен быть достигнут | |
1,00 | Полная единица продукции была использована для испытания группы на резистентность | |
Стадия 2 | ||
Бионагрузка | 382 | Результаты определения бионагрузки - 360, 420 и 384; среднее значение - 382, так как ни одно значение бионагрузки не превышает среднее более чем вдвое, в качестве бионагрузки |
Средняя бионагрузка | 382 | Так как для исследования использовалась продукция целиком ( |
Стадия 3 | ||
Контрольная доза | 9,7 кГр | Для бионагрузки |
Стадия 4 | ||
Результаты испытания на стерильность | Один положительный результат при дозе 10,1 кГр | Результаты испытаний принимаются, т.к. контрольная доза была в пределах заданного диапазона, т.е. меньше 10,7 кГр, а испытания на стерильность были приемлемы (т.е. |
Стадия 5 | ||
Стерилизующая доза при | 12,9 кГр | При |
Таблица В.6 - Пересмотр дозы проверки и увеличения стерилизующей дозы (метод 1)
Величина | Значение | Примечание |
При проведении ежеквартальной проверки было получено четыре положительных результата, при проверке стерильности изделий после облучения дозой 9,5 кГр (контрольная доза (стадия 3) была в пределах ±1,0 кГр). Поэтому необходимо пересмотреть дозу проверки и увеличить дозу стерилизации. | ||
10 | К концу испытаний | |
Средняя бионагрузка | 652 | Средняя бионагрузка для изделий, проверенных в течение ежеквартальной проверки, была 652 ( |
Первоначальная средняя бионагрузка | 382 | Средняя бионагрузка для изделий, проверенных в течение первоначальной валидации была 382 ( |
Пересмотр дозы проверки | 12,9 кГр | Поскольку средняя бионагрузка, наблюдаемая в течение ежеквартальной проверки, была больше, чем бионагрузка, полученная в течение валидации, бионагрузка, используемая для пересмотра, равна средней бионагрузке, полученной в течение валидации, увеличенной в 10 раз. Поэтому доза пересмотра, основанная на бионагрузке 3820, и из таблицы B.1, является 12,9 кГр. (Поскольку бионагрузка 3820 не внесена в список таблицы, используется следующая большая бионагрузка - 4004) |
Увеличенная стерилизующая доза | 16,3 кГр | Поскольку контрольная средняя бионагрузка была больше, чем средняя бионагрузка, полученная в течение валидации, бионагрузка, используемая для увеличения, равна средней бионагрузке, полученной в течение валидации, увеличенной в 10 раз. Увеличенная доза основана на бионагрузке 3820 и из таблицы B.1 - 16,3 кГр. (Поскольку бионагрузка 3820 не внесена в список в таблице, используется следующая большая бионагрузка - 4004) |
Таблица В.7 - Распределение образцов при проведении эксперимента возрастающей дозой (метод 2А, стадия 1, ![]() 1,0)
1,0)
Серия | Возрастающая доза, кГр | Образцы | Общее количество образцов | ||||||||
2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | |||
1 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 280 |
2 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 280 |
3 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 280 |
Таблица В.8 - Пример данных, полученных от эксперимента возрастающей дозой, число положительных испытаний от 20 изделий (метод 2А, стадия 2, ![]() 1)
1)
Серия | Заданная доза, кГр | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
1 | Поглощенная доза, кГр | 2,2 | 5,0 | 5,3 | 9,0 | 9,2 | 11,6 | 15,0 | 16,2 | 19,3 |
Количество положительных испытаний | 20 | 5 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | |
2 | Поглощенная доза, кГр | 2,6 | 3,2 | 6,6 | 8,0 | 9,7 | 13,0 | 13,8 | 15,8 | 17,9 |
Количество положительных испытаний | 11 | 7 | 0 | 0 | 1 | 0 | 0 | 0 | 0 | |
3 | Поглощенная доза, кГр | 2,3 | 4,2 | 5,9 | 7,5 | 10,7 | 11,4 | 13,7 | 17,5 | 17,1 |
Количество положительных испытаний | 18 | 7 | 2 | 2 | 0 | 0 | 0 | 0 | 0 | |
Примечание - Дозы независимы, допуск менее +1,0 кГр или +10%. | ||||||||||
Таблица В.9 - Вычисления для стадии 2 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
Серия 1 | 5,0 кГр | Серия |
0,65 кГр | Найти минимальное число положительных испытаний на стерильность, для серии со средним значением | |
1,95 кГр |
| |
Серии 1 | 9,0 кГр | Доза а) первая минимальная доза в ряду возрастающих доз, при облучении которой все 20 изделий стерильны, при условии, что для следующей большей дозы также все 20 изделий стерильны. При этом допускается, что облучение более высокими дозами должно дать менее двух нестерильных образцов или b) первая доза в ряду возрастающих доз, при облучении которой одно из 20 изделий будет нестерильным, а при облучении следующей дозой все 20 изделий стерильны. При этом допускается, что облучение остальными, более высокими дозами, должно дать менее двух нестерильных образцов |
| 9,0 кГр | Минимальная доза, необходимая для достижения |
Серия | Серия 1 | Партией |
Таблица В.10 - Вычисления для стадии 3 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
| 9,0 кГр | Из стадии 2 |
| 8,0 кГр | Доза |
| 2 | Количество нестерильных тестов из 100 наблюдений на стадии 3 |
8,0 кГр | Если если если если |
Таблица В.11 - Вычисления для стадии 4 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
| 2 | Из стадии 3 |
| 8,0 кГр | Из стадии 3 |
8,0 кГр | Из стадии 3 | |
1,95 кГр | Из стадии 2 | |
| 6,05 кГр | Например, Примечание - Если |
3,21 кГр | Когда доза Когда Например, | |
Доза проверки | 9,0 кГр |
Примечание - Если Например, Округляя до первого знака после запятой, получаем 9,0 кГр |
10 | Решение со стадии 1 | |
1,0 | Решение со стадии 1 | |
Стерилизующая доза для | 21,8 кГр | Стерилизующая доза (кГр)= Например, стерилизующая доза=9,0+(6-0-2)х(3,21)=9,0+(4)х(3,21)=21,84 кГр Округляя до первого знака после запятой, получаем 21,8 кГр |
В.4.2.2 Пример для метода 2А (![]() 1)
1)
В.4.2.2.1 Стадия 1. Выбор и отбор образцов изделия
По окончании испытаний необходимо было получить 10
. Изделие было слишком большим, чтобы легко подвергаться испытаниям, поэтому использовалась часть изделия (
меньше единицы) от 300 случайных образцов, отобранных от каждой из трех серий.
Распределение образцов изделия при проведении эксперимента возрастающей дозой приведено в таблице В.12.
Таблица В.12 - Распределение образцов при проведении эксперимента возрастающей дозой (метод 2А, стадия 1, ![]() 1)
1)
Серия | Возрастающая доза, кГр | Образцы для стадии 3 | Общее количество образцов | |||||||||
0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | |||
1 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 300 |
2 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 300 |
3 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 300 |
В.4.2.2.2 Стадия 2. Экспериментальное облучение возрастающей дозой
В таблице В.13 дан пример данных, полученных при облучении образцов рядом возрастающих доз. В таблице В.14 показан пример вычислений.
Таблица В.13 - Пример данных, полученных от экспериментального облучения возрастающей дозой, число положительных испытаний от 20 изделий (метод 2А, стадия 2, ![]() 1)
1)
Партия | Заданная доза, кГр | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
1 | Поглощенная доза, кГр | 0,0 | 1,8 | 3,7 | 6,3 | 7,8 | 10,9 | 12,8 | 14,2 | 15,2 | 18,0 |
Количество положительных испытаний | 20 | 17 | 1 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
2 | Поглощенная доза, кГр | 0,0 | 1,5 | 3,9 | 5,7 | 8,5 | 9,9 | 11,3 | 14,5 | 17,3 | 18,4 |
Количество положительных испытаний | 20 | 20 | 3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
3 | Поглощенная доза, кГр | 0,0 | 2,5 | 3,5 | 6,1 | 7,3 | 10,2 | 12,4 | 12,7 | 14,8 | 17,7 |
Количество положительных испытаний | 20 | 9 | 4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
Примечания 1 При испытании на стерильность необлученных образцов 2 Дозы независимы, допуск менее +1,0 кГр или +10%. | |||||||||||
Таблица В.14 - Вычисления для стадии 2 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
Серия 1 | 1,8 кГр | Серия |
0,79 кГр | Найти минимальное число положительных испытаний на стерильность для серии со средним значением | |
1,71 кГр |
Например, | |
Серии 1 | 6,3 кГр | Доза а) первая минимальная доза в ряду возрастающих доз, при облучении которой все 20 образцов стерильны, при условии, что для следующей большей дозы также все 20 изделий стерильны. При этом допускается, что облучение более высокими дозами должно дать менее двух нестерильных образцов или b) первая доза в ряду возрастающих доз, при облучении которой одно из 20 образцов будет нестерильным, а при облучении следующей дозой все 20 образцов стерильны. При этом допускается, что облучение остальными, более высокими дозами, должно дать менее двух нестерильных образцов |
| 6,1 кГр | Минимальная доза, необходимая для достижения |
Серия | Серия 3 | Серией |
В.4.2.2.3 Стадия 3. Экспериментальный контроль дозы
В таблице В.15 показаны экспериментальные результаты, которые были получены на стадии 3.
Таблица В.15 - Вычисления для стадии 3 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
| 6,1 кГр | Из стадии 2 |
| 5,5 кГр | Доза |
| 2 | Количество нестерильных тестов из 100 наблюдений на стадии 3 |
5,5 кГр | Если если если если |
В.4.2.2.4 Стадия 4. Определение стерилизующей дозы
В таблице В.16 приведены вычисления стерилизующей дозы.
Таблица В.16 - Вычисления для стадии 4 (метод 2А, ![]() 1)
1)
Величина | Значение | Примечание |
| 2 | Из стадии 3 |
| 5,5 кГр | Из стадии 3 |
5,5 кГр | Из стадии 3 | |
1,71 кГр | Из стадии 2 | |
| 3,79 кГр | Например, Примечание - Если |
2,76 кГр | Когда Когда Например, | |
Контрольная доза | 6,3 кГр |
Примечание - Если Например, |
10 | Решение со стадии 1. | |
0,05 | Решение со стадии 1. | |
Стерилизующая доза для | 12,7 кГр | Стерилизующая доза (кГр) = Например, стерилизующая доза=6,3+(3+1,301-2)х(2,76)=6,3+(2,301)х(2,76)=12,65 кГр. Округляя до первого знака после запятой, получаем =12,7 кГр |
В.4.2.3 Конкретный пример для метода 2В
В.4.2.3.1 Стадия 1. Выбор и отбор образцов продукции
По окончании испытаний необходимо было получить 10
. Используется изделие целиком, по 260 случайных образцов отобрано от каждой из трех серий.
Распределение образцов изделия при проведении экспериментального облучения возрастающей дозой приведено в таблице В.17.
Таблица В.17 - Распределение образцов при проведении экспериментального облучения возрастающей дозой (метод 2В, стадия 1)
Серия | Возрастающая доза, кГр | Образцы | Общее количество образцов | |||||||
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |||
1 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 260 |
2 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 20 | 100 | 260 |
3 | 20 | 20 | 20 | 20 | 30 | 20 | 20 | 20 | 100 | 260 |
В.4.2.3.2 Стадия 2. Экспериментальное облучение возрастающей дозой
В таблице В.18 даются данные, полученные при облучении образцов рядом возрастающих доз, а в таблице В.19 показывается пример вычислений.
Таблица В.18 - Пример данных, полученных от экспериментального облучения возрастающей дозой, число положительных испытаний от 20 изделий (метод 2В, стадия 2)
Серия | Заданная доза, кГр | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
1 | Поглощенная доза, кГр | 1,1 | 2,4 | 3,3 | 4,4 | 4,6 | 6,4 | 7,3 | 7,8 |
Количество положительных испытаний | 13 | 2 | 0 | 0 | 0 | 0 | 0 | 0 | |
2 | Поглощенная доза, кГр | 1,1 | 1,5 | 2,6 | 3,8 | 5,2 | 5,9 | 7,2 | 8,3 |
Количество положительных испытаний | 8 | 7 | 1 | 0 | 0 | 0 | 0 | 0 | |
3 | Поглощенная доза, кГр | 1,0 | 2,2 | 2,6 | 3,7 | 5,2 | 6,1 | 7,7 | 8,8 |
Количество положительных испытаний | 12 | 4 | 0 | 1 | 0 | 0 | 0 | 0 | |
Примечания 1 Дозы независимы, допуск в пределах ±0,5 кГр или ±10%, первая заданная доза должна быть (1±0,2) кГр. 2 Ни в одном из испытаний не было больше 14 положительных результатов. | |||||||||
Таблица В.19 - Вычисления для стадии 2 (метод 2В)
Величина | Значение | Примечание |
Серия 1 | 1,1 кГр | Серия |
0,44 кГр | Найти минимальное число положительных испытаний на стерильность, для серии со средним значением | |
0,66 кГр |
| |
Серии 1 | 3,3 кГр | Доза а) первая минимальная доза в ряду возрастающих доз, при облучении которой все 20 образцов стерильны, при условии, что для следующей большей дозы также все 20 образцов стерильны. При этом допускается, что облучение более высокими дозами должно дать менее двух нестерильных образцов или b) первая доза в ряду возрастающих доз, при облучении которой один из 20 образцов будет нестерильным, а при облучении следующей дозой все 20 образцов стерильны. При этом допускается, что облучение остальными, более высокими дозами, должно дать менее двух нестерильных образцов |
| 3,7 кГр | Минимальная доза, необходимая для достижения |
Серия | Серия 3 | Серией |
В.4.2.3.3 Стадия 3. Экспериментальный контроль дозы
В таблице В.20 приводятся экспериментальные результаты, которые были получены на стадии 3.
Таблица В.20 - Вычисления для стадии 3 (метод 2В)
Величина | Значение | Примечание |
| 3,7кГр | Из стадии 2 |
| 3,4 кГр | Доза |
| 3 | Количество нестерильных тестов из 100 наблюдений на стадии 3 |
5,4 кГр | Если если если если | |
Примечание - | ||
В.4.2.3.4 Стадия 4. Определение стерилизующей дозы
В таблице В.21 приведены вычисления стерилизующей дозы.
Таблица В.21 - Вычисления для стадии 4 (метод 2В)
Величина | Значение | Примечание |
| 3 | Из стадии 3 |
| 3,4 кГр | Из стадии 3 |
5,4 кГр | Из стадии 3 | |
0,66 кГр | Из стадии 2 | |
| 4,74 кГр | Например, Примечание - Если |
2,55 кГр | Когда требования R2 и R3 удовлетворены, доза Когда требования R2 и R3 не удовлетворены, для дозы Например, | |
Контрольная доза | 4,6 кГр |
Примечание - Если Например, |
10 | Решение со стадии 1 | |
1,0 | Решение со стадии 1 | |
Стерилизующая доза для | 14,8 кГр | Стерилизующая доза (кГр)= Например, стерилизующая доза =4,6+(6-2)х(2,55)=4,6+(4)x(2,55)=14,8 кГр |
Метод 2 (контрольный)
Контрольные процедуры для метода 2А (![]() 1), метод 2А (
1), метод 2А (![]() 1), и метод 2В одинаковые до стадии, где определяется новая контрольная доза и увеличенная стерилизующая доза (см. В.3.5.4.1 и В.3.5.4.2).
1), и метод 2В одинаковые до стадии, где определяется новая контрольная доза и увеличенная стерилизующая доза (см. В.3.5.4.1 и В.3.5.4.2).
Пример дается в таблице В.22. Используя метод 2А, была первоначально получена стерилизующая доза 17,8 кГр. Целые изделия (![]() 1) использовались в течение первоначальной валидации; на стадии 1 выбирался
1) использовались в течение первоначальной валидации; на стадии 1 выбирался 10
, и на стадии 2,
![]() 1,95 кГр; на стадии 3, контрольная доза была установлена 6,2 кГр.
1,95 кГр; на стадии 3, контрольная доза была установлена 6,2 кГр.
Таблица В.22 - Пересмотр контрольной дозы и увеличение стерилизующей дозы (метод 2)
Величина | Значение | Примечание |
При проведении проверки после облучения дозой 6,5 кГр наблюдалось шесть нестерильных единиц. Первоначальные дозы были установлены, используя метод 2А. Пересмотр результатов проверки и расчет увеличения дозы были выполнены по уравнениям в В.3.4.2.2 | ||
10 | Для изделия к концу испытаний должен быть достигнут | |
1,0 | Проверялись целые изделия и поэтому | |
8,5 | Если при проверке получено от трех до шести положительных результатов, то | |
1,95 кГр |
| |
| 6,55 кГр |
|
3,31 кГр | Когда Когда Например, | |
Пересмотренная контрольная доза ( | 9,1 кГр |
Например, Принимаем |
Увеличенная стерилизующая доза для | 22,3 кГр | Используется метод 2А, поэтому увеличенная стерилизующая доза рассчитана следующим образом: стерилизующая доза (кГр) Например, стерилизующая доза =9,1+(6-2)(3,31)=9,1+13,24+22,34 кГр. Принимаем значение =22,3. |
В.5 Иллюстрации
Таблица В.23 - Примеры для расчета ЧПИ
Основа для расчета ЧПИ | Примеры продукции |
Площадь поверхности | Имплантаты (неабсорбируемые) |
Масса | Порошки, халаты, имплантаты (абсорбируемые) |
Длина | Трубки с постоянным диаметром |
Объем | Чашка для воды |
Путь протекания жидкости | Инвазивные катетеры |
Таблица В.24 - Распространенность резистентных микроорганизмов, используемая в методе 1 [15]
| 1,0 | 1,5 | 2,0 | 2,5 | 2,8 | 3,1 | 3,4 | 3,7 | 4,0 | 4,2 |
Частота | 0,65487 | 0,22493 | 0,06302 | 0,03179 | 0,01213 | 0,00786 | 0,00350 | 0,00111 | 0,00072 | 0,00007 |
Таблица В.25 - Ожидаемая частота положительных результатов от 100 испытаний при 10
Число положительных испытаний | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Вероятность | 0,366 | 0,370 | 0,185 | 0,061 | 0,015 | 0,003 | 0,0005 | 0,00006 | 0,000007 |
ПРИЛОЖЕНИЕ С
(справочное)
Библиография
[1] Международное агентство по атомной энергии. Руководство по промышленной радиационной стерилизации одноразовой медицинской продукции однократного применения гамма-облучения Со. Техн. док. 539. Вена, МАГАТЭ, 1990 - INTERNATIONAL ATOMIC ENERGY AGENCY. Guidelines for industrial radiation sterilization of disposable medical products, Co-60 gamma irradiation. TEC DOC-539. Vienna: IAEA, 1990
[2] ИСО 10993-1:1992, Биологическая оценка медицинских изделий - Часть 1: Руководство по выбору тестов - ISO 10993-1: 1992. Biological evaluation of medical devices - Part 1: Guidance on selection of tests
[3] Дунн Т., Вильямс Е и Вильямс Дж. Исследования стабилизирующих добавок. I. Модель системы для изучения остаточной радикальной активности в растворе. Дж. Поли, Sci, Нью Йорк, Джон Вилей, 1982. В издательстве химии полимеров, т.20, 1982 - Dunn, TS, Williams, ЕЕ and Williams, JL. Investigations of stabilizing additives. I. A model system for studying radical scavenging activity in solution. J. Poly, Sci. New York: John Wiley, 1982. In Polymer Chemistry Edition, Vol.20, 1982
[4] АНСИ/ААМИ Ст32: 1991, второе издание ААМИ PC Руководство по стерилизации гамма-излучением. Арлингтон Ва. ААМИ, 1992 - ANSI/AAMI ST32: 1991, second edition of AAMI RS. Guideline for gamma radiation sterilization. Arlington Va. AAMI, 1992
[5] ААМИ ТИР8, Микробиологические методы при стерилизации гамма-излучением медицинских изделий. Арлингтон Ва. ААМИ, 1991 - AAMI TIR8, Microbiological methods for gamma radiation sterilization of medical devices. Arlington Va. AAMI, 1991
[6] ААМИ, 1984. Руководство по контролю процесса стерилизации медицинских изделий гамма-излучением. Арлингтон Ва. ААМИ, 1984 - AAMI 1984. Process control guidelines for gamma radiation sterilization of medical devices. Arlington Va. AAMI, 1984.
[7] Блок С. Дезинфекция, стерилизация и консервирование. Третье изд., 1983 - Block, S. Disinfection, Sterilization and Preservation, 3 ed., 1983
[8] Кристерсен Е. и Кристерсен X. Радиорезистентность микроорганизмов, находящихся в воздухе чистых помещений. - Christensen, EA, and Christensen, H. Radiation resistance of microorganisms from ir in clean premises. Acta pathalogica et microbiologica scandinavica section В 89, 1981; pp.293-301
[9] Чернявский Е., Столярчик Л. Попытка установить дозу ионизирующей радиации для стерилизации узлов медицинского оборудования однократного применения - Cherniawski, and Stolarczyk, L. Attempt to establish the ionizing radiation dose to be used in the sterilization of one-use medical equipment units. Acta microbiologica polonica Series В 6, 1974; pp.177-83
[10] Дэйвис К, Стродерман В, Мазефильд Дж. и Витби Дж. Установление доз гамма-излучения и методы контроля при стерилизации медицинских изделий. Гохран Е.Р.Л., Моррисей Р.Дж. (издатели). Стерилизация медицинской продукции. Т.2, Монреаль: Multiscience Publications Ltd., 1981, стр.34-102 - Davis, K.W, Strawderman, W.E., Masefield, J. and Whitby, JL. DS gamma radiation dose setting and auditing strategies for sterilizing medical devices. In: Gaughran E.R.L; Morrisey, R.J. (eds). Sterilization of medical products, Vol.2. Montreal: Multiscience Publications (Ltd., 1981; pp.34-102)
[11] Дэйвис К., Стродерман В. и Витби Дж. Обсуждение и компьютерная оценка метода определения стерилизующей дозы гамма-излучения для медицинских изделий, которые используют протоколы испытания стерильности субстерилизующих возрастающих доз. - Davis, KW, Strawderman, W.E., Masefield, J. and Whitby, JL. The rationale and computer evaluation of a gamma sterilization dose determination method for medical devices using a substerilization incremental dose sterility tests protocol. J. Appl. Bact. 1985, 57; pp.31-50
[12] Таллентир А. Аспекты микробиологического контроля радиационной стерилизации. Журнал рад. стерил., 1973; 1; стр.85-103 - Tallentire, A. Aspects of microbiological control of radiation sterilization. J. Rad. Ster. 1973, 1, pp.85-103
[13] Таллентир А., Дваер Дж. и Лей Ф. Дж. Микробиологический контроль стерилизованных продуктов. Оценка модели, связывающей частоту контаминации изделий с увеличением радиационной обработки. Журнал прикладной микробиологии. 1971; 34; стр.521-34.-Tallentire, A., Dwyer, J. and Ley FJ. Microbioliogical control of sterilized products. Evaluation of model relating frequency of contaminated items with increasing radiation treatment. J. Appl. Bact. 1971; 34; pp.521-34
[14] Таллентир А. и Кхан А.А. Субдозы при определении степени гарантии стерильности. В Гохран Е.Р.Л., Гоуди А.Дж. Стерилизация ионизирующим излучением. Т.2. Монреаль: Multiscience Ltd. 1978, стр.65-80 - Tallentire, A., Khan A.A. The sub-process dose in defining the degree of sterility assurance. In Gaughran, E.R.L.; Goudie, A.J. (eds). Sterilization by ionizing radiation. Vol.2. Montreal: Multiscience Publications Ltd., 1978; pp.65-80
[15] Уитби Дж.Л. и Гелда А.К. Использование возрастающих доз облучения Со как средство определения радиационной стерилизующей дозы. - Whitby, J1. And Gelda, Ak. Use of incremental doses of cobalt 60 radiation as means to determine radiation sterilization dose. J. Parent. Drug Assoc. 1979, 33; pp.144-55
[16] АСТМ Е1261; 88; Руководство по выбору и применению дозиметрических систем для радиационной обработки продуктов питания. Филадельфия; АСТМ, 1988. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM Е1261; 88; Guide for selection and application of dosimetry systems for radiation processing of food. Philadelphia: ASTM, 1988. In Annual Book of ASTM Standards, Vol. 12.02 (1993)
[17] АСТМ Е 1026:92; Руководство по использованию стандартных эталонных дозиметрических систем Фрике. Филадельфия: АСТМ, 1992. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM E1026:92; Practice for using the Fricke reference standard dosimetry system. Philadelphia: ASTM, 1992. In Annual Book of ASTM Standards, Vol. 12.02 (1993)
[18] АСТМ Е 1205:93; Руководство по использованию церий-церий сульфатных дозиметрических систем. Филадельфия: АСТМ, 1993а. В ежегодном сборнике стандартов АСТМ, т.12.02,1993. - ASTM E1205:93; Practice for use of ceric-cerous sulfate dosimetry system. Philadelphia: ASTM, 1993а. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[19] АСТМ Е 1275:93; Руководство по использованию радиохромных пленочных дозиметрических систем. Филадельфия: АСТМ, 1993b. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM Е1026:92; Practice for use of a radiochromic film dosimetry system. Philadelphia: ASTM, 1993b. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[20] АСТМ Е 1276:93; Руководство по использованию полиметилметакрилатных дозиметрических систем. Филадельфия: АСТМ, 1993с. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM E1276:92; Practice for use of a polymethylmethacrylate dosimetry system. Philadelphia: ASTM, 1993с. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[21] АСТМ Е 1310:89; Руководство по использованию радиохромных оптических дозиметрических систем. Филадельфия: АСТМ, 1989. В ежегодном сборнике стандартов АСТМ, т.12.02, 1989. - ASTM E1310:89; Practice for use of a radiochromic optical waveguide dosimetry system. Philadelphia: ASTM, 1989. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[22] АСТМ Е 1538:93; Руководство по использованию этанол хлорбензольных дозиметрических систем. Филадельфия: АСТМ, 1993d. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM Е1538:93; Practice for use of a efhanol-chlobenzene dosimetry system. Philadelphia: ASTM, 1993d. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[23] АСТМ Е 1540:93; Руководство по использованию радиохромных жидких дозиметрических систем. Филадельфия: АСТМ, 1993е. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM E1540:93; Practice for use of a radiochromic liquid dosimetry system. Philadelphia: ASTM, 1993е. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[24] АСТМ Е 1401:93; Руководство по использованию бихроматных дозиметрических систем. Филадельфия: АСТМ, 1991а. В ежегодном сборнике стандартов АСТМ, т.12.02,1993. - ASTM E1401:93; Practice for use of a dichromate dosimetry system. Philadelphia: ASTM, 1991а. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[25] АСТМ Е 1400:91а; Руководство по определению параметров и снятию характеристик высоких доз гамма-излучения дозиметрической калибровочной лабораторией. Филадельфия: АСТМ, 1991b. В ежегодном сборнике стандартов АСТМ, т.12.02, 1993. - ASTM E1400:91a; Practice for characterization and performance of a high dose gamma radiation dosimetry calibration laboratory. Philadelphia: ASTM, 1991b. In Annual Book of ASTM Standards, Vol.12.02 (1993)
[26] Аттике Ф.X. Введение в радиационную физику и радиационную дозиметрию. Нью-Йорк: Джон Вилей, 1986. Attix, FH. Introduction to Radiological Physics and Radiation Dosimetry. New York: John Wiley, 1986
[27] Баррет Дж. Barrett, Jh. Дозиметрия с окрашенными и неокрашенными акриловыми пластиками. Междун. Журн. Прикл Радиац. Изотопов. 1982; 33; стр.1177-87. - Dosimetry with dyed and undyed acrylic plastic. Int. J.Appl. Ratiat. Isotopes. 1982; 33; pp.1177-87
[28] Бьергбакке Е. Церий сульфатный дозиметр. В Хольм Н.В., Берри Р.Дж. (издатели). Руководство по радиационной дозиметрии. Нью Йорк, Марсель Деккер, 1970а, стр.323-26. - Bjergbakke, Е. The сerie sulfate dosimeter. In Holm, N.W., Berry R.J. (eds.). Manual on Radiation Dosimetry. New York: Marcel Dekker, 1970а; pp.323-36
[29] Бьергбакке Е. Ферросульфатный дозиметр. В Хольм Н.В., Берри Р.Дж. (издатели). Руководство по радиационной дозиметрии. Нью-Йорк, Марсель Деккер, 1970Ь, стр.319-21. - Bjergbakke, Е. The ferrous-cupric dosimeter. In Holm, N.W., Berry R.J. (eds.). Manual on Radiation Dosunetry. New York: Marcel Dekker, 1970b; pp.319-21
[30] Чадвик Кх. Твердотельная дозиметрия высоких доз. В Каснати (изд.) Метрология ионизирующей радиации. Болонья - Chadwick, КН. Solid state dosimetry at high doses In: Casnati., (ed.). Ionizing radiation metrology. Bologna: Editrice Compositori, 1977: pp.195-211
[31] Эллис С. Распространение эталонов поглощенной дозы при химической дозиметрии, механизм и использование дозиметров Фрике. В Каснати (изд.) Метрология ионизирующей радиации. Болонья - Ellis, SC. The dissemination of absorbed dose standards by chemical dosimetry, mechanism and use of the Fricke dosimeter. In: Casnati., (ed.). Ionizing radiation metrology. Bologna: Editrice Compositori, 1977; pp.163-80
[32] Фарахани М., Лианг Дж. и Маклафлин В. Радиохромные растворы для эталонной дозиметрии. Прикл. Радиац. изотопы. 1990; 41; стр. 5-11. - Farahani, М., Liang, JH. and McLaughlin, WL. Radiochromic solutions for reference dosimetry. Appl. Radiat. Isotopes. 1990; 41; pp. 5-11
[33] Гловер К., Кинг М. и Уаттс М. Калибровка и взаимное сравнение красных перспекс-дозиметров 4034. В Дозиметрии высоких доз: Сборник трудов симпозиума Международного агентства по атомной энергии (МАГАТЭ) в Вене. 1984. Вена, МАГАТЭ, 1985 - Glover, KM., King, М. and Watts, MF. Calibration and inter-comparison of red 4034 Perspex dosimeters. In High-Dose Dosimetry: Proceedings of the International Atomic Energy Agency Symposium at Vienna, 1984. Vienna: International Atomic Energy Agency, 1985: IAEA Publ. STI/PUB/671, pp.373-95
[34] Отчет 14 ИКРУ, Радиационная дозиметрия: Рентгеновское излучение гамма-излучение с максимальными энергиями фотонов между 0,6 и 50 мэВ, 1969. - ICRU Report 14, Radiation Dosimetry: X-Rays and gamma rays with maximum photon energies between 0,6 and 50 MeV. Bathesda: ICRU, 1969
[35] Отчет 17 ИКРУ, Радиационная дозиметрия: Рентгеновское излучение гамма-излучение, генерированное при потенциалах от 0,6 и 50 мэВ, 1969. - ICRU Report 17, Radiation Dosimetry: X-Rays and gamma rays generated at potentials of 5 to 150 kV. Bethesda: ICRU, 1970
[36] Отчет 34 ИКРУ, Дозиметрия пульсирующей радиации, 1984. ICRU Report 34, Dosimetry of pulsed radiation. Bethesda: ICRU, 1982
[37] Отчет 35 ИКРУ, Радиационная дозиметрия: Электронные пучки с энергиями между 1 и 50 мэВ, 1984. - ICRU Report 35. Radiation Dosimetry: Electron beams with energies between 1 and 50 MeV. Bethesda: ICRU, 1984
[38] Ковач А., Стенгер В., Фолдиак Г. Оценка облученных этанол-монохромбензольных дозиметров методом проводимости. В дозиметрии высоких доз: Сборник трудов симпозиума Международного агентства по атомной энергии (МАГАТЭ) в Вене, 1984. Вена, МАГАТЭ, 1985 - Kovacs, A., Stenger, V. and Foldiac, G. Et al. Evaluation of irradiated ethanol monochlorobenzene dosimeters by conductivity method. In High-Dose Dosimetry: Proceedings of the International Atomic Energy Agency Symposium at Vienna, 1984. Vienna: International Atomic Energy Agency, 1985: IAEA Publ. STI/PUB/ 671, pp.135-42
[39] Лафлин Дж., Генна Дж. Калориметрия. В: Аттрикс Ф.X. Ройш B.C. (издатели). Радиационная дозиметрия, т.2, 2-е изд., Нью-Йорк - Laughlin JS. and Genna, S. Calorimetry. In: Attrix, F.H.; Roesch, W.C., (eds). Radiation Dosimetry, Vol. 2; 2d ed. New York: Academic Press, 1966; pp.389-442
[40] Лью 3., Радак Б., Маклафлин В. Радиационная дозиметрия пищевых продуктов методом оптохроматографии. Радиац. Физ. Хим. 1985; 25; стр.125-34. - Liu, ZJ., Radak, ВВ. and McLaughlin, WL. Food irradiation dosimetry by Opti-chromic technique. Radiat. Phys. Chem. 1985; 25; pp.125-34
[41] Мэтыоз РВ., Matthews, Rw. Водная химическая дозиметрия. Межд. Журн. Прикл. Радиац. Изотопов. 1982; 33; стр.1159-70. - Aqueous chemical dosimetry. Int. J. Appl. Radiat. Isotopes. 1982; 33; pp.1159-70
[42] Маклафлин В., Джарретт Р., Олейник Т. Дозиметрия. В Джозефсон Е., Петерсон М. (издатели). Консервирование продуктов питания с использованием ионизирующего излучения. Т.1. 1981, стр.189-245. McLaughlin, WL., Jarrett, RD. and Olejnik, ТА. Dosimetry. In Josephson, E.S., Peterson M.S., (eds). Preservation of food by ionizing radiation. Vol.1 Boca Raton; CRC Press, 1981, pp.189-245
[43] Маклафин В., Бойд А., Чадвик К., Макдональд Дж., Миллер А. Дозиметрия радиационных процессов. Лондон: Тэйлор и Фрэнсис, 1989а - McLaughlin WL., Boyd, AW., Chadwick, КН., McDonald, JC. and Miller, A. Dosimetry for Radiation Processing. London: Taylor and Francis, 1989а
[44] Маклафлин В., Кхан X., Варасавас В., Аль-Шейнкли, Радак Б. Оптическая волновая дозиметрия для гамма-излучения в диапазоне, доз 10 - 10
Гр. Радиац. Физ. Хим. 1189b; 33; стр.39-46. - McLaughlin, WL., Khan, HM., Warasawas, W., Al-Sheinkly, H. and Radak, BB. Optical waveguide dosimetry for gamma radiation in the dose range 10
-10
Gy. Radiat. Rhys. Chem 1989b; 33; pp.39-46
[45] Миллер А., Маклафлин В., Оценка радиохромно окрашивающихся пленок и других пластиковых измерителей дозы в условиях радиационной обработки. В техн. отчете серии 205 "Измерения высоких доз в промышленной радиационной обработке. Вена: МАГАТЭ, 1981, стр.119-38. Miller, A., and McLaughlin, WL. Evaluation and radiochromic dye films and other plastic dose meters under radiation processing conditions. In High-Dose measurements in industrial radiation processing. Technical Report Series 205. Vienna: International Atomic Energy Agency, 1981; pp.119-38
[46] Миллер А., Ковас А. Применение калориметров для текущей и эталонной дозиметрии в промышленных ускорителях электронов 4-10 МэВ. Радиац. Физ. Хим. 1990; 35; стр.774-78 - Miller, A. and Kovacs, A. Application of calorimeters for routine and reference dosimetry at 4-10 MeV industrial electron accelerators. Radiat. Phys. Chem. 1990; 35; pp. 774-78
[47] Разем Д., Анделик Л., Дворник И. Razem, D., Andelic, L., and Dvornik, I. Закономерности этанол-хлорбензольной дозиметрии. Сборник трудов симпозиума Международного агентства по атомной энергии (МАГАТЭ) в Вене, 1984. Вена, МАГАТЭ, 1985 - The consistancy of ethanol-chlorobenzene dosimetry. In High-Dose Dosimetry: Proceedings of the International Atomic Energy Agency Symposium at Vienna, 1984. Vienna: International Atomic Energy Agency, 1985: IAEA Publ. STI/PUB/671, pp.143-56
[48] Регулла Д., Деффнер У. Дозиметрия ES спектроскопии аланина. Междун. Журн. Прикл. Радиац. Изотопов. 1982; 33; стр.1101-14 - Regulla, DF. and Deffner, U. Dosimetry by ES spectroscopy of alanine. Int. J. Appl. Radiat. Isotopes. 1982; 33; pp.1101-14
[49] Регулла Д., Деффнер У. Развитие аланин/ESR дозиметрии. Сборник трудов симпозиума Международного агентства по атомной энергии (МАГАТЭ) в Вене, 1984. Вена, МАГАТЭ, 1985 Regulla, Df. and Deffner, U. Progress in alanine/ESR transfer dosimetry. In High-Dose Dosimetry: Proceedings of the International Atomic Energy Agency Symposium at Vienna, 1984. Vienna: International Atomic Energy Agency, 1985: IAEA Publ. STI/PUB/671, pp.221-35
[50] Сехестед К. Дозиметр Фрике. К. В Хольм Н. В., Берри Р.Дж. (издатели). Руководство по радиационной дозиметрии. Нью-Йорк, Марсель Деккер, 1970а, стр. 313-17 - Sehested, The Fricke dosimeter. In Holm, N.W.; Berr R.J. (eds.). Manual oh Radiation Dosimetry. New York; Marcel Dekker, 1970а; pp.313-17
[51] Шарп П., БарретДж., Берклей A. Sharpe, PHG., Barret, JH. and Berckley, А. Бихроматные растворы кислоты в воде как эталонные дозиметры в диапазоне 10-40 кГр. Междун. Журн. Радиац. Изотопов. 1985; 36; 647-52. Acid aqueous dichromate solutions as reference dosimeters in the 10-40 kGy range. Int. J. Appl. Radiat. Isotopes. 1985; 36; 647-52.
[52] Тамура Н., Танака Р., Митомо С., Матцуда К., Нагай С. Свойства измерительной дозы на триацетатцеллюлозе. Радиац. Физ. Хим. 1981; 18 стр.947-556 - Tamura, N., Tanaka, R., Mitomo, S., Matsuda, K. and Nagai, S. Properties of cellulose triacetate dose meter. Radiat. Phys. Chem. 1981; 18; pp.947-56
[53] Танака Р., Митомо С., Тамура Н. Оценка влияния температуры, относительной влажности и дозы на чувствительность триацетатцеллюлозных измерителей дозы к электронам и гамма-лучам. - Tanaka, R., Mitomo, S., Tamura, N. Effects of temperature, relative humidity and dose rate on the sensitivity of cellulose triacetate dose meters to electrons and gamma rays. Int. J. Appl. Radiat. Isotopes. 1984; 35; pp.875-81
[54] Виттакер Б., Уатс М., Меллор С. Некоторые параметры, влияющие на реакцию на облучение и пострадиационную стабильность красных персекс-дозиметров 4034. Сборник трудов симпозиума Международного агентства по атомной энергий (МАГАТЭ) в Вене, 1984, Вена, МАГАТЭ, 1985 - Whittaker, В., Watts, MF, and Mellor, S. et al. Some parameters affecting the radiation response and post-irradiation stability of red 4034 Persex dosimeters. In Hign-Dose Dosimetry: Proceedings of the International Atomic Energy Agency Symposium at Vienna, 1984. Vienna: International Atomic Energy Agency, 1985: IAEA Publ. STI/PUB/671, pp.293-305
Электронный текст документа
и сверен по:
М.: ИПК Издательство стандартов, 2001

