ГОСТ 32373-2020
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
Основные требования к проведению испытаний по оценке острой токсичности при накожном поступлении
Methods of testing the impact of chemical products on the human body. Basic requirements for conducting tests to assess the acute toxicity in dermal intake
МКС 75.080
11.020
11.120.01
Дата введения 2021-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила, рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Российский научно-технический центр информации по стандартизации, метрологии и оценке соответствия" (ФГУП "") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 июня 2020 г. N 131-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | ЗАО "Национальный орган по стандартизации и метрологии" Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 октября 2020 г. N 906-ст межгосударственный стандарт ГОСТ 32373-2020 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2021 г.
5 Настоящий стандарт является модифицированным по отношению к международному документу OECD Test N 402:2017* "Руководство по испытанию химических веществ. Острая кожная токсичность: испытание фиксированной дозы" ("Guideline for testing of chemicals. Acute dermal toxicity: fixed dose procedure", MOD) путем:
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
- включения дополнительного раздела 1, который выделен в тексте курсивом;
- изменения его структуры для приведения в соответствие с правилами, установленными в ГОСТ 1.5 (подразделы 4.2 и 4.3).
Сопоставление структуры настоящего стандарта со структурой указанного международного документа приведено в дополнительном приложении ДА.
Наименование настоящего стандарта изменено относительно наименования указанного международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВЗАМЕН ГОСТ 32373-2013
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Руководства Организации экономического сотрудничества и развития (OECD) периодически пересматриваются с учетом научного прогресса и в целях защиты животных. Первая версия руководства по оценке острой токсичности при воздействии вещества на кожу OECD Test N 402 была принята в 1987 г. В ряде последних публикаций были проанализированы результаты исследований острой пероральной и кожной токсичности сотен активных веществ пестицидов и тысяч промышленных химических веществ и было установлено, что нормативные классификации, основанные на данных об острой токсичности при пероральном поступлении, были аналогичными или более четко выражеными в более чем 98% случаев, чем результаты исследовании кожной токсичности, что ставит под сомнение ценность рутинного исследования этой конечной точки. Критерии для отказа от исследований острой кожной токсичности, которые должны быть рассмотрены до принятия решения о проведении этого исследования в интересах ограничения испытания новых животных для оценки конечных критериев в исключительных случаях с убедительным научным обоснованием определены в [7]. Настоящий документ уделяет особое внимание использованию данных, полученных в исследовании острой токсичности, для оценки здоровья человека. Основное внимание должно быть уделено проведению исследования с целью получения данных для оценки в других областях, таких как экологический риск.
_______________
См. [1]-[6].
На основе рекомендаций экспертов по результатам нескольких совещаний было достигнуто международное соглашение о согласованных пороговых значениях ![]() для классификации химических веществ. Пересмотр настоящего руководства сочли своевременным, поскольку: 1) испытание животных одного пола (обычно самок), как правило, считают достаточным и 2) для того, чтобы балльная оценка была значимой, необходимо оценить доверительные интервалы (CI)
для классификации химических веществ. Пересмотр настоящего руководства сочли своевременным, поскольку: 1) испытание животных одного пола (обычно самок), как правило, считают достаточным и 2) для того, чтобы балльная оценка была значимой, необходимо оценить доверительные интервалы (CI)![]() . Адекватно разделенные дозы позволяют ранжировать исследуемое химическое вещество для целей классификации опасности в соответствии с Согласованной на глобальном уровне системой (СГС) для классификации химических веществ без бальной оценки токсичности
. Адекватно разделенные дозы позволяют ранжировать исследуемое химическое вещество для целей классификации опасности в соответствии с Согласованной на глобальном уровне системой (СГС) для классификации химических веществ без бальной оценки токсичности![]() .
.
_______________
![]() См. [8], [13]
См. [8], [13]
![]() См. [10].
См. [10].
Для оценки и сравнения эффективности нескольких схем испытания на острую кожную токсичность с целью выбора наилучшего плана испытания для пересмотренного руководства был проведен биометрический анализ![]() . Были выполнены биометрические оценки дизайна первой версии OECD Test N 402:1987, четырех модификаций процедуры с фиксированной дозой (FDP)
. Были выполнены биометрические оценки дизайна первой версии OECD Test N 402:1987, четырех модификаций процедуры с фиксированной дозой (FDP)![]() , модифицированной схемы оценки острой токсичности (АТС)
, модифицированной схемы оценки острой токсичности (АТС)![]() и метода "вверх и вниз" (UDP)
и метода "вверх и вниз" (UDP)![]() . Несмотря на то, что по сравнению с UDP OECD Test N 402:1987 обладал лучшими характеристиками для правильной классификации опасности, связанной с воздействием химических веществ, FDP при воздействии на кожу превосходил все другие методы безопасной классификации химических веществ. Кроме того, в схемах исследования при воздействии фиксированной дозы (FDP) на кожу использовали меньше животных, чем в OECD Test N 402:1987 или UDP. В связи с этим пошаговая процедура руководства OECD Test N 402:1987 с использованием до трех животных одного пола на шаг была адаптирована к методу оценки острой токсичности и процедуре с фиксированной дозой, приведенной в [12]. В зависимости от смерти и/или животных в состоянии агонии могут потребоваться дальнейшие шаги для оценки острой токсичности исследуемого химического вещества. Метод обеспечивает воспроизводимость, использует очень мало животных и позволяет ранжировать исследуемые химические вещества
. Несмотря на то, что по сравнению с UDP OECD Test N 402:1987 обладал лучшими характеристиками для правильной классификации опасности, связанной с воздействием химических веществ, FDP при воздействии на кожу превосходил все другие методы безопасной классификации химических веществ. Кроме того, в схемах исследования при воздействии фиксированной дозы (FDP) на кожу использовали меньше животных, чем в OECD Test N 402:1987 или UDP. В связи с этим пошаговая процедура руководства OECD Test N 402:1987 с использованием до трех животных одного пола на шаг была адаптирована к методу оценки острой токсичности и процедуре с фиксированной дозой, приведенной в [12]. В зависимости от смерти и/или животных в состоянии агонии могут потребоваться дальнейшие шаги для оценки острой токсичности исследуемого химического вещества. Метод обеспечивает воспроизводимость, использует очень мало животных и позволяет ранжировать исследуемые химические вещества![]() аналогично другим методам испытаний острой токсичности, например по [13].
аналогично другим методам испытаний острой токсичности, например по [13].
_______________
![]() См. [11].
См. [11].
![]() См. [12].
См. [12].
![]() См. [9].
См. [9].
![]() См. [13].
См. [13].
![]() См. [14].
См. [14].
1 Область применения
Настоящий стандарт устанавливает основные требования к проведению испытаний по оценке острой токсичности при однократном нанесении на кожу химического вещества для оценки и классификации его в соответствии с Согласованной на глобальном уровне системой (СГС) для данного вида воздействия.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 острая кожная токсичность (acute dermal toxicity): Неблагоприятные эффекты, вызванные воздействием на кожу однократной дозы исследуемого вещества в течение короткого периода времени (не более 24 ч).
2.2 доза (dose): Количество нанесенного исследуемого химического вещества.
Примечание - Дозу выражают в единицах массы исследуемого химического вещества на единицу массы подопытного животного (например, мг/кг массы тела).
2.3 СГС (GHS) - [Globally Harmonised classification system for chemical substances and mixtures]: Согласованная на глобальном уровне система классификации химических веществ и смесей.
2.4 отсроченная смерть (гибель) (impending death): Наличие клинических симптомов, указывающих на неизбежность агонального состояния или смерти до следующего запланированного времени наблюдения.
Примечание - Симптомами подобного состояния у грызунов могут быть конвульсии, лежачее положение (в т.ч. на боку) и тремор. Более подробная информация приведена в [14].
2.5 ![]() (средняя смертельная доза) [
(средняя смертельная доза) [![]() (median lethal dose)]: Статистически установленное значение однократной дозы химического вещества, которая может вызвать гибель 50% животных, подвергшихся накожному воздействию.
(median lethal dose)]: Статистически установленное значение однократной дозы химического вещества, которая может вызвать гибель 50% животных, подвергшихся накожному воздействию.
Примечание - Значение ![]() выражают в единицах массы исследуемого химического вещества на единицу массы подопытного животного (мг/кг массы тела).
выражают в единицах массы исследуемого химического вещества на единицу массы подопытного животного (мг/кг массы тела).
2.6 испытуемая предельная доза (limit test): Означает высшую дозу при испытании (2000 мг/кг массы тела).
2.7 агония (moribund status): Обратимое терминальное состояние, предшествующее наступлению клинической смерти.
Примечание - Более подробная информация приведена в [15].
2.8 прогнозируемая смерть (гибель) (predictable death): Наличие клинических признаков, указывающих на то, что смерть может наступить ранее запланированного окончания испытания, например, вследствие невозможности дотянуться до воды или пищи.
Примечание - Более подробная информация приведена в [15].
2.9 исследуемое химическое вещество (test chemical): Объект исследования.
2.10 UVCBs: Вещество неизвестного или переменного состава, продукты сложных реакций или биологические материалы.
3 Основные положения
3.1 Как в интересах науки, так и благополучия животных, возможность испытания острой кожной токсичности in vivo не следует рассматривать до тех пор, пока не будет оценена весомость доказательств всех имеющихся данных о потенциальной кожной токсичности исследуемого химического вещества. До проведения исследования должна быть рассмотрена вся доступная информация об исследуемом химическом веществе. Такая информация включает идентификационные данные и структурную формулу исследуемого химического вещества, его физико-химические свойства, результаты любых испытаний токсичности in vitro или in vivo, доступные данные модели (S)SAR и токсикологические данные о структурно родственных веществах, предполагаемое(ые) использование(я), потенциальную возможность соответствующего воздействия на человека и дальнейшее использование полученных данных. Эта информация поможет в обосновании проведения настоящего исследования и выборе подходящей начальной дозы. Принцип настоящего метода заключается в использовании доз, которые могут быть только умеренно токсичными, и в возможности избегать доз, которые предположительно будут смертельными.
3.2 Потенциальные возможности для отказа от проведения испытаний по настоящему методу приведены в [7] и зависят от предусмотренных требований действующего законодательства.
3.3 Несмотря на то, что основное внимание уделяют оценке диапазонов токсичности, полученная информация может быть использована для классификации химического вещества в соответствии с критериями классификации опасности и маркировки химических веществ. Информация, полученная в ходе испытаний на острую токсичность, имеет особое значение для оценки опасностей, которые могут возникнуть в аварийных ситуациях, однако зачастую фактические данные, необходимые в таких обстоятельствах, выходят за рамки исследования острой токсичности. Если отказ научно не обоснован
![]() , испытание острой кожной токсичности in vivo проводят в каждом конкретном случае при условии четкого обоснования значимости или актуальности полученных данных.
, испытание острой кожной токсичности in vivo проводят в каждом конкретном случае при условии четкого обоснования значимости или актуальности полученных данных.
_______________
См. [10].
![]() См. [7].
См. [7].
3.4 Исследуемые химические вещества не следует наносить в дозах, которые вызывают значительную боль и дистресс, обусловленные возможностью разъедающего или сильно раздражающего действия вещества. Полезную информацию об этом дают значения рН и буферной емкости (кислотно-щелочной резерв) исследуемого химического вещества. Для проверки потенциальной разъедающей способности исследуемого химического вещества можно провести исследование in vitro. Животные в агональном состоянии или животные, явно страдающие от боли или имеющие признаки серьезного и длительного дистресса, должны быть умерщвлены гуманным способом и учтены при интерпретации результатов испытаний как животные, погибшие при проведении испытаний. Критерии для принятия решения об умерщвлении агонирующих или тяжело страдающих животных, а также руководство для выявления предсказуемой или неминуемой смерти приведены в [15].
3.5 При проведении настоящего испытания изучают как местные, так и системные эффекты. Явное доказательство раздражения кожи (например, эритема 3-й или 4-й степени и/или отек 3-й или 4-й степени) при исследовании воздействия на кожу может быть использовано для представления информации о потенциальной способности вещества вызывать раздражение вместо проведения конкретного исследования раздражения.
3.6 Смесь или готовые смесевые продукты
Комплексная оценка смесевых продуктов (включая пестициды, биоциды и другие смесевые продукты) показала, что значение острой кожной токсичности редко превышает значение острой пероральной токсичности этой же смеси. Фактически в большинстве случаев (99%) значение
![]() при нанесении на кожу не менее 2000 мг/кг массы тела. Поэтому для отказа от проведения ненужного испытания рекомендуется использовать критерий острой пероральной токсичности (если значение
при нанесении на кожу не менее 2000 мг/кг массы тела. Поэтому для отказа от проведения ненужного испытания рекомендуется использовать критерий острой пероральной токсичности (если значение ![]() при пероральном введении более 2000 мг/кг массы тела). Кроме того, данные in vivo были сопоставлены с расчетными данными СГС
при пероральном введении более 2000 мг/кг массы тела). Кроме того, данные in vivo были сопоставлены с расчетными данными СГС![]() , полученными вычислением класса опасности смеси на основе оценки острой токсичности (ATE) каждого отдельного компонента. Полученные данные совпадают более чем на 98% (без ложноотрицательных результатов) и могут служить еще одним средством отказа от проведения исследований на коже. Обычно между компонентами смеси не наблюдаются синергетические эффекты, тем не менее следует учитывать возможные взаимодействия, которые могут способствовать токсическому потенциалу всей смеси.
, полученными вычислением класса опасности смеси на основе оценки острой токсичности (ATE) каждого отдельного компонента. Полученные данные совпадают более чем на 98% (без ложноотрицательных результатов) и могут служить еще одним средством отказа от проведения исследований на коже. Обычно между компонентами смеси не наблюдаются синергетические эффекты, тем не менее следует учитывать возможные взаимодействия, которые могут способствовать токсическому потенциалу всей смеси.
_______________
См. [16].
![]() См. [10].
См. [10].
4 Принцип проведения испытаний in vivo
4.1 Группы животных одного пола подвергают воздействию исследуемого химического вещества поэтапно с использованием соответствующих фиксированных доз в соответствии с приложением А. В зависимости от имеющихся данных об исследуемом химическом веществе может потребоваться исследование по определению диапазона доз (например, при недостаточности или отсутствия информации). Начальный уровень дозы выбирают как концентрацию, которая (как предполагают) будет вызывать явные признаки токсичности без серьезных токсических эффектов или смертности. Испытания других групп животных проводят при более высоких или более низких фиксированных уровнях доз в зависимости от наличия или отсутствия признаков токсичности или смертности. Эту процедуру продолжают до тех пор, пока не будет выявлена доза, вызывающая токсичность или не более одной смерти, или пока не будет видно никаких эффектов при самой высокой дозе, или пока не наступит смерть при самой низкой дозе.
4.2 Исследуемое химическое вещество наносят на кожу подопытных животных в ступенчатых дозах, т.е. каждой группе наносят одну и ту же дозу вещества и наблюдают за последствиями и гибелью животных. Животных, погибших во время испытания, подвергают аутопсии. При завершении испытания выживших животных умерщвляют и подвергают аутопсии.
4.3 Затем проводят классификацию исследуемого химического вещества на основе наблюдаемого результата.
5 Описание метода
5.1 Выбор видов животных
5.1.1 Для проведения испытаний предпочтительно использовать взрослых особей крыс. Результаты испытаний острой пероральной![]() и острой ингаляционной токсичности
и острой ингаляционной токсичности![]() показывают, что различия в чувствительности между животными разного пола обычно отсутствуют, но если различия наблюдают, то самки, как правило, немного более чувствительны. Дополнительные доказательства отсутствия зависимости чувствительности от пола животного было получено в последнем обзоре данных по испытанию кожной токсичности, полученных для разных продуктов
показывают, что различия в чувствительности между животными разного пола обычно отсутствуют, но если различия наблюдают, то самки, как правило, немного более чувствительны. Дополнительные доказательства отсутствия зависимости чувствительности от пола животного было получено в последнем обзоре данных по испытанию кожной токсичности, полученных для разных продуктов![]() . В связи с вышеизложенным, для испытаний рекомендуется использовать самок. Однако, если информация о токсикологических или токсикокинетических свойствах структурно родственных химических веществ указывает на вероятность большей чувствительности самцов, то следует использовать животных этого пола. При проведении испытаний на самцах должно быть представлено соответствующее обоснование.
. В связи с вышеизложенным, для испытаний рекомендуется использовать самок. Однако, если информация о токсикологических или токсикокинетических свойствах структурно родственных химических веществ указывает на вероятность большей чувствительности самцов, то следует использовать животных этого пола. При проведении испытаний на самцах должно быть представлено соответствующее обоснование.
_______________
![]() См. [17].
См. [17].
![]() См. [18], [19].
См. [18], [19].
![]() См. [16].
См. [16].
5.1.2 Используют молодых здоровых половозрелых животных обычно используемых лабораторных линий. Самки должны быть нерожавшими и небеременными. Возраст каждого животного в начале нанесения доз должен быть от 8 до 10 недель и размер - облегчающий проведение испытаний (от 200 до 300 г), при этом диапазон колебаний массы тела животных не должен превышать ±20% от средней массы тела всех животных, ранее использованных в исследовании. Кожа животных должна быть здоровой и неповрежденной.
5.2 Условия содержания и кормления
Температура в помещении для подопытных животных должна быть (22±3)°С, относительная влажность - от 30% до 70%, за исключением случаев уборки помещений, оптимальное значение - от 50% до 60%, освещение должно быть искусственным, с чередованием периодов света (12 ч) и темноты (12 ч). При кормлении используют обычную лабораторную пищу с неограниченным количеством питьевой воды.
5.3 Подготовка животных
5.3.1 Проводят акклиматизацию животных в лабораторных условиях не менее пяти дней до начала исследования, размещая группами по соображениям защиты животных. Животных, используемых в исследовании, выбирают случайным образом и маркируют для обеспечения индивидуальной идентификации.
5.3.2 За сутки до введения исследуемого химического вещества вся шерстка должна быть тщательно выстрижена со спинной/боковой части тела подопытных животных (не менее 10% поверхности тела). Можно использовать анестетики для помощи в обращении с животными и минимизации стресса. Необходимо соблюдать осторожность, чтобы не повредить кожу, что может изменить ее проницаемость. При определении площади тела животного, подлежащей удалению шерстки и нанесению исследуемого вещества, следует принимать во внимание массу тела животного.
6 Условия проведения испытаний
6.1 Нанесение доз
6.1.1 Исследуемое химическое вещество наносят по возможности равномерно на подготовленную поверхность кожи в области спины/бока (не менее 10% поверхности тела). В случае высокотоксичных исследуемых химических веществ площадь поверхности, на которую наносят вещество, может быть уменьшена, но большая часть подготовленной поверхности должна быть покрыта по возможности тонким и равномерным слоем. Во время воздействия в течение 24 ч исследуемые химические вещества поддерживают в контакте с кожей с использованием проницаемой марлевой салфетки и нераздражающего пластыря. Аппликационная зона должно быть дополнительно защищена подходящим образом для обеспечения сохранности марлевой повязки и исследуемого химического вещества и предотвращения проглатывания его животными. При необходимости может быть предусмотрено использование удерживающего устройства, которое не должно приводить к иммобилизации животного. В течение 24-часового периода воздействия животных содержат в клетках индивидуально для предотвращения проглатывания исследуемого химического вещества другими животными.
6.1.2 При испытании твердых веществ для обеспечения хорошего контакта с кожей может потребоваться измельчение и увлажнение исследуемого химического вещества, предпочтительно использовать воду или подходящий носитель (растворитель). При использовании растворителя (кроме воды) следует учитывать его влияние на проникновение в кожу исследуемого химического вещества. Регистрируют количество используемого растворителя (обычно достаточно от 0,5 до 1 см). Жидкие исследуемые химические вещества обычно используют неразбавленными.
6.1.3 При завершении воздействия по возможности удаляют остатки исследуемого химического вещества водой или соответствующим растворителем. Животных переводят на групповое содержание при отсутствии причин для индивидуального содержания (таких как опасения, что контакт с другими животными может усилить стресс, связанный с характером и тяжестью признаков токсичности, или привести к обострению локальных кожных реакций). Однако время индивидуального размещения животных должно быть сведено к минимуму.
6.2 Число животных и уровни доз
6.2.1 Исследуемое химическое вещество наносят последовательно двум отобранным животным аналогично способу, используемому при любом выбранном уровне дозы в основном исследовании. Как правило, если критерии отказа не применимы, требуется исследование острой кожной токсичности, и ожидаемая острая кожная токсичность, вероятно, будет неизвестной или высокой (например, значение ![]() менее 200 мг/кг массы тела).
менее 200 мг/кг массы тела).
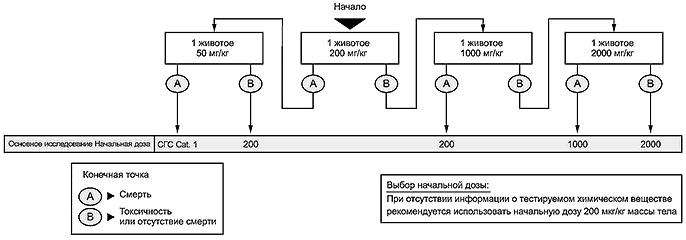
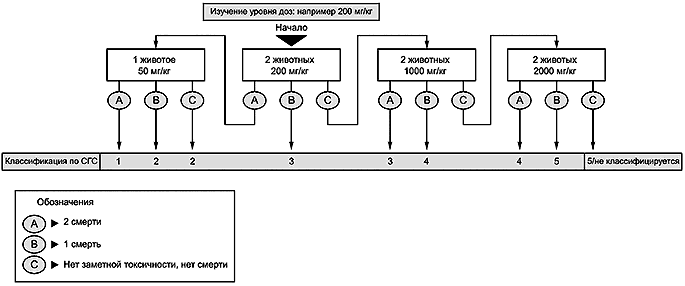
6.2.2 При отсутствии или недостаточном количестве информации об исследуемом химическом веществе рекомендуется провести исследование для определения диапазона доз с использованием одного животного с начальной дозой 200 мг/кг массы тела, чтобы минимизировать использование животных и оптимизировать схему исследования (см. схемы приложения А). На основании результатов исследования по определению диапазона доз основное исследование может быть проведено с использованием двух животных для подтверждения результата классификации по процедуре основного исследования, приведенной в блок-схеме приложения А. Этот подход подтверждают биометрической оценкой, которую проводят для сравнения схем клинических исследований с соответствующими прогнозами по классификации. Это необходимо для обеспечения достоверности рекомендуемой схемы исследования и получения правильной классификации при использовании только двух животных в основном исследовании.
_______________
См. [11].
6.2.3 При наличии информации об исследуемом химическом веществе и невозможности отказа от испытания можно выбрать отличающуюся начальную дозу (близкую к значению предельной дозы), например, 50, 1000 или 2000 мг/кг массы тела животного, в соответствии с процедурой (исследование по определению диапазона доз и последующее основное исследование), на основании классификации СГС для острой кожной токсичности![]() .
.
_______________
![]() См. [10].
См. [10].
6.2.4 Период между испытаниями каждого животного будет составлять не менее 48 ч, и, тем не менее, он будет зависеть от появления, продолжительности и степени выраженности признаков токсичности. Нанесение животным дозы следующего уровня должно быть отложено до появления подтверждения выживания животных, ранее подвергнутых воздействию химического вещества. Обычно всех животных наблюдают не менее 14 дней.
7 Наблюдения
7.1 За животными наблюдают сразу после нанесения вещества и не менее одного раза в первые 30 мин, затем периодически - в течение первых 24 ч. При этом особое внимание уделяют в течение первых 2-6 ч после начала воздействия, и затем ежедневно, в общей сложности 14 дней. Несмотря на это продолжительность наблюдения не фиксирована, а определяется характером и временем появления клинических признаков и продолжительностью периода восстановления. Очень важно время появления и исчезновения признаков токсичности, особенно если есть тенденция к замедленному проявлению признаков токсичности![]() . Все наблюдения регистрируют индивидуально для каждого животного. Животные в агональном состоянии, испытывающие сильную боль и/или стойкие признаки тяжелого дистресса, должны быть умерщвлены гуманным способом. Время умерщвления или гибели животных должно быть зафиксировано максимально точно.
. Все наблюдения регистрируют индивидуально для каждого животного. Животные в агональном состоянии, испытывающие сильную боль и/или стойкие признаки тяжелого дистресса, должны быть умерщвлены гуманным способом. Время умерщвления или гибели животных должно быть зафиксировано максимально точно.
_______________
![]() См. [4].
См. [4].
7.2 Необходимо наблюдать за изменениями состояния кожи и шерсти, глаз, слизистых оболочек, дыхательной, кровеносной, вегетативной и центральной нервных систем, соматомоторной активностью и характером поведения. Следует обращать внимание на тремор, судороги, слюноотделение, диарею, вялость, сонливость и коматозное состояние. Кроме того, обработанное место можно наблюдать через 24, 48 и 72 ч после удаления исследуемого химического вещества с использованием критериев Драйза поскольку эти данные могут быть использованы для исключения исследования раздражения кожи in vivo.
7.3 Масса тела
Индивидуальную массу тела животных определяют в день или непосредственно перед нанесением исследуемого химического вещества и не менее одного раза в неделю после него. В конце испытания выживших животных взвешивают, а затем умерщвляют гуманным способом.
7.4 Патология
Всех подопытных животных (в том числе, погибших во время испытания или исключенных из испытания по гуманным соображениям) подвергают аутопсии. У каждого животного регистрируют все макропатологические изменения. Полезную информацию может дать микроскопическое исследование органов с признаками макропатологии или мест воздействия вещества у животных, выживших через 24 ч или более после нанесения первоначальной дозы.
8 Данные и отчет
8.1 Данные
8.1.1 Должны быть предоставлены индивидуальные данные для животных. Кроме того, все данные должны быть сведены в таблицу, показывающую число использованных животных для каждой подопытной группы, число животных с признаками токсичности, число животных, обнаруженных мертвыми во время испытания или умерщвленных по гуманным соображениям, и время смерти отдельных животных, описание и динамику токсического действия и его обратимость, а также результаты некропсии.
8.1.2 Для исследуемого химического вещества должен быть определен класс опасности (см. приложение А). Последовательность действий после испытания начальной дозы приведена в блок-схемах. При проведении основного испытания на основании результатов определения диапазона доз потребуется одна из трех процедур: 1) испытание с тем же уровнем дозы для подтверждения результатов, 2) испытание с более высоким уровнем дозы или 3) испытание с более низким уровнем дозы. Для защиты животных от ненужных страданий в основном испытании не пересматривают дозу, вызвавшую смерть в исследовании по определению диапазона доз. Результаты основного испытания с двумя дополнительными животными на дозу подтвердят соответствующий класс опасности, и проведение дальнейших испытаний не потребуется.
8.2 Отчет об испытании
Согласно установленному порядку отчет должен содержать следующую информацию:
8.2.1 Обоснование испытания in vivo - анализ весомости доказательств результатов предварительных данных:
- описание соответствующих данных, полученных в ходе предыдущих испытаний;
- данные, полученные на каждом этапе стратегии испытания;
- весомость доказательств анализа для проведения испытания in vivo.
8.2.2 Исследуемое химическое вещество:
- поставщик, номер партии, срок хранения (при наличии);
- стабильность, если известна;
- растворимость и стабильность в растворителе, если известна.
Однокомпонентное химическое вещество:
- физические свойства и дополнительные соответствующие физико-химические свойства (например, кислотно-щелочной резерв);
- химическая идентификация, такая как наименование по IUPAC или CAS, номер CAS, код SMILES или InChl, структурная формула;
- чистота;
- химическая идентификация примесей в зависимости от ситуации и практической осуществимости и т.д.
Многокомпонентное химическое вещество, UVCB и смеси:
- характеризуются, насколько это возможно, химической идентификацией (см. выше), количественным присутствием и соответствующими физико-химическими свойствами компонентов и смеси.
8.2.3 Растворитель (при необходимости):
- обоснование выбора растворителя, если он отличается от воды.
8.2.4 Подопытные животные:
- вид/линия;
- микробиологический статус животных, если известен;
- число, возраст и пол животных (включая обоснование использования самцов вместо самок, при необходимости);
- поставщик, условия содержания, кормления, исторические данные и т.д.
- подробная информация о качестве пищи и воды (включая тип/источник питания, источник воды);
- метод рандомизации при отборе животных.
8.2.5 Условия испытаний:
- подробный состав исследуемого химического вещества, включая информацию о его агрегатном состоянии при нанесении;
- подробная информация о способе нанесения исследуемого вещества и месте нанесения, включая объемы доз, область нанесения и продолжительность воздействия;
- обоснование выбора начальной дозы.
8.2.6 Результаты испытаний:
- занесение в таблицу данных ответа и уровня доз для каждого животного (т.е. животных с признаками токсичности, включая смертность, характер, выраженность и продолжительность эффекта);
- занесение в таблицу данных о массе тела и изменении массы тела;
- индивидуальная масса тела животных перед воздействием, с последующими недельными интервалами и во время смерти или умерщвления;
- дата и время смерти, если смерть произошла до запланированного умерщвления;
- время появления симптомов токсичности и их обратимость для каждого животного;
- результаты некропсии и данные гистопатологических исследований для каждого животного, при наличии;
- оценка критериев Драйза, если использовали;
- метод интерпретации данных.
8.2.7 Обсуждение и интерпретация результатов.
8.2.8 Выводы.
Приложение А
(обязательное)
Блок-схемы процедур испытаний
А.1 Исследование по определению диапазона доз
|
А.2 - Основное исследование
|
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа
Таблица ДА.1
Структура настоящего стандарта | Структура международного документа |
Введение (1-3) | Введение |
1 | |
2 | |
3 | |
1 Область применения | |
2 Термины и определения (приложение ) | |
3 Основные положения (5-10) | Основные положения |
3.1 | 5 |
3.2 | 6 |
3.3 | 7 |
3.4 | 8 |
3.5 | 9 |
3.6 Смесь или готовые смесевые продукты | Смесь или готовые смесевые продукты |
10 | |
4 Принцип проведения испытаний in vivo | Принцип проведения испытаний in vivo |
(11-13) | |
4.1 | 11 |
4.2 | 12 |
4.3 | 13 |
5 Описание метода (14-18) | Описание метода |
5.1 Выбор вида животных | Выбор вида животных |
5.1.1 | 14 |
5.1.2 | 15 |
5.2 Условия содержания и кормления | Условия содержания и кормления |
16 | |
5.3 Подготовка животных | Подготовка животных |
5.3.1 | 17 |
5.3.2 | 18 |
6 Условия проведения испытаний (19-25) | Условия проведения испытаний |
6.1 Нанесение доз | Нанесение доз |
6.1.1 | 19 |
6.1.2 | 20 |
6.1.3 | 21 |
6.2 Число животных и уровни доз | Число животных и уровни доз |
6.2.1 | 22 |
6.2.2 | 23 |
6.2.3 | 24 |
6.2.4 | 25 |
7 Наблюдения (26-29) | Наблюдения |
7.1 | 26 |
7.2 | 27 |
7.3 Масса тела | Масса тела |
28 | |
7.4 Патология | Патология |
29 | |
8 Данные и отчет (30-32) | Данные и отчет |
8.1 Данные | Данные |
8.1.1 | 30 |
8.1.2 | 31 |
8.2 Отчет об испытании | Отчет об испытании |
32 | |
* | Библиография |
** | Приложение 1 Термины и определения |
Приложение А Блок-схемы процедур испытаний | Приложение 2 Блок-схема процедуры испытаний |
Приложение ДА Сопоставление структуры настоящего стандарта со структурой примененного в нем международного документа | |
Библиография | |
* Библиография приведена в конце настоящего стандарта. | |
Библиография
[1] | Thomas, H.D. and Dewhurst, I.C. (2007). What does a dermal acute toxicity study add to the information on a plant protection pesticide? Toxicol. 231, 114-115 |
[2] | Creton, S., Dewhurst, I.C., Earl, L.K. et al. (2010). Acute toxicity testing of chemicals - Opportunities to avoid redundant testing and use alternative approaches. Crit. Rev. Toxicol. 40, 50-83 |
[3] | Seidle, T., Prieto, P. and Bulgheroni, A. (2011). Examining the regulatory value of multi-route mammalian acute systemic toxicity studies. ALTEX 28, 95-102 |
[4] | Indans, I., Fry, T., Parsons, P., et al. (1998). Classification and labelling of new industrial chemicals for acute toxicity, skin and eye irritation. Hum. Exp. Toxicol. 17, 529 |
[5] | Seidle, T., Robinson, S., Holmes, T. et al. (2010). Cross-Sector Review of Drivers and Available 3Rs Approaches for Acute Systemic Toxicity Testing. Tox. Sci. 116, 382-396 |
[6] | Moore, N.P, Andrew, D.J., Bjerke, D. L. et al. (2013). Can acute dermal systemic toxicity tests be replaced with oral tests? A comparison of route-specific systemic toxicity and hazard classifications under the Globally Harmonized System of Classification and Labelling of Chemicals (GHS). Reg. Toxicol. Pharmacol. 66, 30-37 |
[7] | OECD (2016). Guidance Document on Waiving or Bridging of Mammalian Acute Toxicity Tests. Draft dated January 2016. Series on Testing and Assessment No. 237, Environment, Health and Safety Publications, OECD, Paris |
[8] | British Toxicology Society Working Party on Toxicity (1984). Special report: a new approach to the classification of substances and preparations on the basis of their acute toxicity. Human Toxicol. 3, 85-92 |
[9] | OECD (2002). OECD Guideline for Testing of Chemicals: Acute Toxic Class Method (No. 423). OECD, Paris |
_______________
| |
[10] | UN (2015). United Nations Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Fifth Revised Edition, UN New York and Geneva. Available at: [http://www.unece.org/trans/danger/publi/ghs/ghs_rev05/05files_e.html]. |
[11] | Mielke H., Strickland J., Jacobs M.N., Mehta J.M. (2017) Biometrical Evaluation of the Performance of the Revised Test Guideline 402 for Assessing Acute Dermal Toxicity. In press. Regulatory Toxicology and Pharmacology |
[12] | OECD (2002). OECD Guideline for Testing of Chemicals: Acute Oral Toxicity-Fixed Dose Procedure (No. 420). OECD, Paris |
_______________
| |
[13] | OECD (2008). OECD Guideline for Testing of Chemicals: Acute Oral Toxicity - Up-and-Down Procedure (UDP) (No. 425). OECD, Paris |
_______________
| |
[14] | Stallard, N., Whitehead, A. and Indans, I. (2004). Statistical Modelling and Evaluation of an Acute Dermal Toxicity Test Using Dermal Fixed Dose Procedure. Hum. Exp. Toxicol. 23(8), 405-412 |
[15] | OECD (2000). Guidance Document on the Recognition, Assessment and Use of Clinical Signs as Humane Endpoints for Experimental Animals Used in Safety Evaluation. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 19. OECD, Paris |
[16] | Corvaro, M., Gehen, S., Andrews, K. et al., (2016). GHS Additivity Formula: A true replacement method for acute systemic toxicity of agrochemical formulations. Reg. Toxicol. Pharmacol. 82: 99-110 (available online, http://dx.doi.org/10.1016/j.yrtph. 2016.10.07) |
[17] | Lipnick, R. L., Cotruvo, J. A., Hill, R. N. et al. (1995). Comparison of the Up-and-Down, Conventional LD50 and Fixed Dose Acute Toxicity Procedures. Fd. Chem. Toxicol. 33, 223-231 |
[18] | Warbrick, E. V., Indans, I., Blackwell, M. et al. (2002). The reduction and refinement of animal use in acute inhalation toxicity testing. Toxicol. 192, 92 |
[19] | Price, Ch., Stallard, N., Creton, S. et al. (2010). A statistical evaluation of the effects of gender differences in assessment of acute inhalation toxicity. Hum. Exp. Toxicol. 30(3), 217-238 |
[20] | OECD (2015). OECD Guideline for Testing of Chemicals: Acute Dermal Irritation/Corrosion (No. 404). OECD, Paris |
_______________
![]() Действует ГОСТ 34557-2019 "Методы испытаний по воздействию химической продукции на организм человека. Испытания по оценке острой токсичности при внутрижелудочном поступлении. Метод "вверх и вниз".
Действует ГОСТ 34557-2019 "Методы испытаний по воздействию химической продукции на организм человека. Испытания по оценке острой токсичности при внутрижелудочном поступлении. Метод "вверх и вниз".
УДК 615.038/615.012/615.014/615.2:006.354 | МКС 75.080 | MOD |
Ключевые слова: методы испытания, воздействие химической продукции на организм человека, основные требования к проведению испытаний, оценка острой токсичности при накожном поступлении | ||
Электронный текст документа
и сверен по:
, 2020