ГОСТ 32537-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение биоразлагаемости при аэробных методах очистки
Testing of chemicals of environmental hazard. Determination of biodegradability under aerobic treatment methods
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии международного документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Туркмения | TM | Главгосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 785-ст межгосударственный стандарт ГОСТ 32537-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test No. 303:2001* "Испытание методом моделирования. Аэробная очистка сточных вод.303 А. Аэротенки. 303 В. Биопленки" ("Simulation Test - Aerobic Sewage Treatment: 303 A: Activated Sludge Units - 303 B: Biofilms", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Май 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
В 1950 г. сделали вывод, что новые используемые ПАВы явились причиной сильного пенообразования на установках очистки сточных вод, а также в реках. Аэробная очистка не могла в полной мере справиться с их удалением, в ряде случаев удаление остальных органических веществ носило ограниченный характер. Проблема послужила толчком для исследований возможностей удаления ПАВов из сточных вод, а также изучения того, поддаются ли очистке сточные воды с новыми соединениями, производимыми промышленностью. Для этого были использованы установки, моделирующие два основных типа аэробной биологической очистки сточных вод (активный ил и процеживание, или просачивание, фильтрация). Было бы нецелесообразно и затратно изучать каждый новый материал на крупномасштабной очистной установке, даже на местном уровне.
Моделирующие установки с активным илом, исходя из описаний, могут быть различных размеров по объему, начиная с 300 мл до 2000 мл. Некоторые из них очень схожи с полномасштабными установками, будучи оборудованными отстойниками для ила, подаваемого насосом обратно в аэротенк; у других же отстойники вообще отсутствуют, например установка Swisher [1]. Выбор размера оборудования является компромиссным решением, с одной стороны, установка должна быть достаточно большой для успешной механической работы, справляющейся с достаточным объемом образцов, без влияния на режим эксплуатации, но с другой стороны, ее размер не должен быть таким большим, чтобы возникла необходимость в большем пространстве и большем количестве расходуемых материалов.
Два вида оборудования, которые широко и с успехом используются, - это установки Husmann (Гусмана) [2] и установки Porous Pot (пористый цилиндр) [3, 4], впервые использовались для изучения ПАВов; именно их рассматривают в настоящем стандарте. Другие также были найдены удовлетворительными, например установка Eckenfelder [5]. По причине относительно высокой стоимости и сопровождающих применение данного моделирующего теста трудностей параллельно шла разработка более простых и дешевых скрининг-тестов, лежащих в основе метода ОЭСР 301 A-F. Опыты, проводимые со многими ПАВами и другими химическими веществами, показали, что те из них, что прошли скрининг-тест (т.е. являются быстроразлагаемыми), также распадаются и в моделирующем испытании. Некоторые из тех, чей распад не произошел в ходе скрининг-теста, обнаружили эту способность в тестах на внутренне присущую биоразлагаемость (ОЭСР 302 А, В), и только некоторые из этой группы претерпели распад в ходе моделирующего испытания, в то время как распад тех химических веществ, которые не прошли успешно тест на присущую биоразлагаемость, не наблюдался и в тестах с моделированием [6]-[8].
Для некоторых целей достаточными являются испытания с моделированием, проводимые в одинаковых рабочих условиях; результат при этом выражают как процент удаления опытного вещества или растворенного органического углерода (РОУ). Описание такого теста имеется в методике ОЭСР 303 А. Тем не менее, в отличие от предшествующего метода ОЭСР 303 А [9], в котором описан только один тип оборудования для очистки синтетических стоков в связанном режиме, использующем относительно грубый метод иловых отходов (потерь), данный метод предлагает ряд вариаций. Здесь описаны альтернативные виды оборудования, режимы эксплуатации, удаления стоков и иловых отходов (потерь). Метод очень близок к ISO 11733 [10], который тщательно проверялся в ходе его подготовки, несмотря на то что метод не проходил проверки круговым испытанием.
Если требуется более точное определение концентрации опытных веществ в выходящем потоке, необходим более обширный метод. Например, требуется более точное регулирование скорости иловых отходов (потерь) ежедневно и в период всего испытания, установки при этом должны работать при различной скорости потерь. Чтобы метод получился всеобъемлющим, испытания должны проводиться при двух или трех различных показателях температуры, как в методе, описанном Берчем [11], [12] и кратко изложенном в приложении A. Тем не менее имеющиеся знания не позволяют решить, какая из кинетических моделей подходит для определения биоразлагаемости химической продукции при очистке сточных вод и в водной среде вообще. Использование кинетики Моно, представленной в приложении A в качестве примера, ограничено: вещество должно присутствовать в концентрации 1 мг/л и выше, но, по мнению некоторых экспертов, даже это требует обоснования. Тесты для концентраций, которые более правдиво отражают те, что были обнаружены в сточных водах, приведены в приложении B, но эти тесты и те, что включены в приложение A, оформляются в виде приложений, а не как отдельные основополагающие принципы испытаний.
Меньше внимания уделяют моделирующим установкам с капельным фильтром, возможно, по причине их громоздкости и меньшей компактности, чем моделирующие установки с активным илом. Джериком с соавторами [13] были разработаны установки с капельным фильтром, которые работали в связанном режиме [9], [13]. Данные фильтры имели относительно большой размер (высота - 2 м, объем - 60 л), и через каждый требовалось пропускать стоки со скорость 2 л/ч. Боманн с соавторами [14] смоделировали капельные биологические фильтры, вставив ворсистые полоски из сложного полиэфира в трубу длиной 1 м (внутренним диаметром 14 мм), предварительно погрузив полоски в концентрированный активный ил на 30 мин. Опытное вещество в качестве единственного источника углерода () в растворе минеральных солей было направлено вниз по вертикальной трубке, оценку его биоразлагаемости определяли измерением (РОУ) в выходящем потоке и
в выходящем газе.
Иным образом были смоделированы биофильтры, см. [15]; на внутренние поверхности вращающихся трубок, наклоненных горизонтально под небольшим углом, подавались стоки (примерно 250 мл/ч), содержащие и не содержащие опытное вещество, у собранных же потоках определяли РОУ и/или указанное вещество. Данный метод описан в методике ОЭСР 303 В.
Испытания методом моделирования обычно применяют к химическим веществам, не прошедшим предварительные испытания на полную биоразлагаемость, но прошедшим испытания на первичную биоразлагаемость. В особых случаях имитационные испытания также применяются к любым веществам, о которых требуется больше информации, особенно это касается веществ, производимых в больших объемах, при этом обычно используют исследование активного ила.
В некоторых случаях требуется конкретная информация относительно реакции химического вещества на методы очистки сточных вод, включающие биопленку, а именно перколяционные или капельные фильтры, вращающиеся биологические контакторы, псевдоожиженные слои.
1 Область применения
Настоящий стандарт устанавливает испытания биоразлагаемости методом моделирования на модельных установках, представляющих два основных вида аэробной биологической очистки сточных вод: активным илом и фильтрацией.
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 сохранившиеся кинетические параметры: Кинетические значения, отражающие условия среды, из которой были извлечены микроорганизмы, не изменяющиеся в ходе исследования.
2.2 имманентные кинетические параметры: Кинетические параметры, полученные в условиях исследования, дающих возможность полноценного развития системы, синтезирующих белок, позволяя системе максимально вырасти.
3 Аэротенки
3.1 Принцип метода
3.1.1 Метод предназначен для количественного определения удаления загрязнителей и первичной и/или полной биоразлагаемости водорастворимых органических веществ аэробными микроорганизмами в испытательных системах непрерывного действия, моделирующих процесс очистки активным илом.
3.1.2 Испытания проводят на двух установках, работающих одновременно при одинаковых условиях, подобранных в зависимости от целей исследования. Среднее время гидравлического задержания сточных вод равно 6 ч, средний возраст ила (время задержания ила) - от шести до десяти дней. Ил удаляется одним из двух методов. Исследуемое вещество в концентрации от 10 до 20 мг/л растворенного органического углерода (РОУ) добавляется в сточные воды (органическую среду), подаваемые только на одну из установок. Вторая установка является контрольной для определения биоразлагаемости самих сточных вод.
3.1.3 В периодически отбираемых пробах частично очищенных сточных вод определяются значения РОУ (предпочтительно) или химическая потребность в кислороде (ХПК), а также концентрация испытуемого вещества (если необходимо) соответствующим методом в сточной воде, поступающей из опытной установки. Предполагается, что разница в значениях РОУ или ХПК в опытном и контрольном аэротенках обусловливается испытуемым веществом или его метаболитами. Для того чтобы определить удаление испытуемого вещества, эта разница сравнивается со значениями РОУ или ХПК подаваемой на установку органической среды.
3.1.4 Явление биоразложения можно отличить от биоадсорбции при анализе временных зависимостей удаления вещества, что может быть дополнительно подтверждено проведением испытания на полную биоразлагаемость на акклиматизированном инокуляте, полученном из установки, содержащей испытуемое вещество.
3.2 Испытуемое вещество
3.2.1 Для корректной интерпретации результатов необходимо определить чистоту испытуемого вещества, его растворимость в воде, летучесть, способность к адсорбции. Тестировать летучие или нерастворимые вещества нельзя, если только не были предприняты особые меры (приложение С). Должна быть известна химическая структура вещества или хотя бы его эмпирическая формула для того, чтобы определить теоретические значения ТПК, РОУ или ХПК и/или проверить их значения, полученные в ходе исследования.
3.2.2 Информация о токсичности вещества для микроорганизмов может быть полезной при выборе условий проведения тестирования и может быть существенной для правильной интерпретации низких значений биоразлагаемости.
3.3 Проходные значения
3.3.1 Степень удаления ПАВ при определении первичной биоразлагаемости должна быть более 80%. Если значение в 80% не достигается, может проводиться данное исследование, при этом степень удаления ПАВ должна быть не менее 90%.
В целом для химических веществ процент удаления можно получить из приближенных вычислений возможной концентрации в окружающей среде для оценки безопасности вещества. Результаты подчиняются принципу "все или ничего". В ряде испытаний чистых химически веществ процентное удаление РОУ составило свыше 90% более чем у трех четвертых веществ и свыше 80% более чем у 90% веществ, которые показали какую-нибудь значимую степень биоразлагаемости.
3.3.2 Сравнительно немного химических веществ (например, ПАВ) присутствует в сточных водах в концентрациях, используемых в данном исследовании (около 10 мг углерода/л). Некоторые химические вещества при таких концентрациях могут оказывать подавляющее действие, кинетика удаления других может быть различна при низких концентрациях. Более точная оценка разложения может быть выполнена с использованием модифицированных методов при использовании реалистично низких концентраций химических веществ. Полученные данные могут быть использованы для расчета констант скорости процесса. Работоспособность необходимых экспериментальных методов еще не полностью подтверждена, так же как и не были построены кинетические модели, описывающие реакции биоразложения (приложение В).
3.4 Вещества сравнения
Для того чтобы быть уверенными, что эксперимент проводится правильно, рекомендуется время от времени проводить одновременно с исследуемыми веществами испытания веществ, поведение которых известно.
К таким соединениям относятся адипиновая кислота, 2-фенил фенол, 1-нафтол, дифеновая кислота, 1-нафтойная кислота.
3.5 Воспроизводимость результатов испытаний
Отчетов, касающихся исследований испытаний с моделированием, значительно меньше, по сравнению с отчетами по испытаниям на быструю биоразлагаемость.
Воспроизводимость (между одновременными испытаниями) (в пределах от 10% до 15%) для испытуемых веществ, разложившихся на 80% или более, - хорошая, для менее разлагаемых веществ разброс результатов может быть больше.
Результаты, полученные при применении двух типов аппаратов, различаются незначительно. Однако некоторые вещества более активно и стабильно разлагаются в присутствии бытовых сточных вод по сравнению с синтетическими сточными водами. Также с некоторыми пограничными веществами время от времени получают совсем несопоставимые результаты (например, 10%, 90%) в процессе теста длительностью до девяти недель.
3.6 Описание метода
3.6.1 Тест-система
3.6.1.1 Система для проведения тестирования одного испытуемого вещества состоит из испытательной и контрольной установок.
Когда выполняют только определенные испытания (первичная биоразлагаемость), необходима только испытательная установка. Одну контрольную установку можно использовать при проведении исследований на нескольких испытательных установках, на которые подается одно и то же вещество или различные вещества. В случае сопряжения (приложение D) каждая испытательная установка должна быть оборудована своей контрольной установкой.
3.6.1.2 Система для проведения тестирования может представлять собой как модель станции аэрации сточных вод активным илом, так и установку Хасмана (см. рисунок 1) или пористый бак (см. рисунок 2). В обоих случаях резервуары для хранения сточных вод, поступающих на очистку, и выпускаемых сточных вод должны быть достаточного размера для поступления притока и формирования стоков. Также необходимы насосы для дозирования подаваемых сточных вод, смешанных с раствором испытуемого вещества или без него.
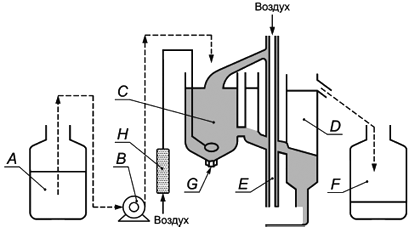
Установка Хасмана (Husmann)
| |
A - Резервуар для хранения | E - Пневматический насос |
B - Дозирующий насос | F - Сосуд для отбора |
C - Камера аэрации | G - Аэратор |
D - Отстойник | H - Расходомер воздуха |
Рисунок 1 - Оборудование, применяемое для оценки биоразложения
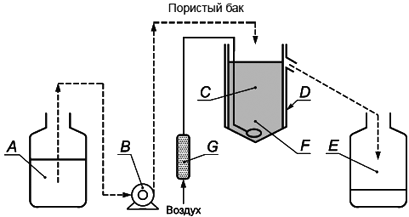
| |
A - Резервуар для хранения | Е - Сосуд для отбора |
B - Дозирующий насос | F - Диффузор |
C - Пористый аэрационный резервуар | G - Расходомер воздуха |
D - Внешний непроницаемый сосуд | |
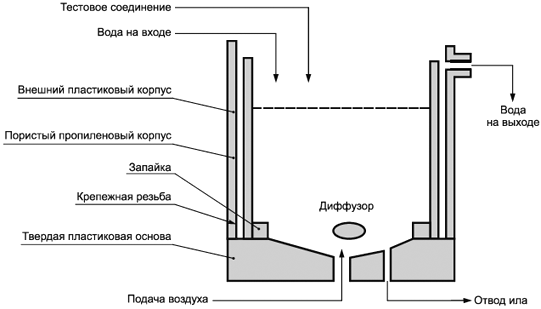
Рисунок 2 - Оборудование, применяемое для оценки биоразложения
3.6.1.3 Каждое устройство станции аэрации сточных вод активным илом состоит из аэрационного резервуара с известным объемом примерно 3 л активированного ила и сепаратора (вторичный отстойник), в котором содержится примерно 1,5 л; объемы можно изменять до некоторой степени путем регулировки высоты сепаратора. Можно использовать резервуары различных размеров, если они функционируют с аналогичными гидравлическими нагрузками.
Если невозможно сохранить температуру в помещении для испытаний в нужном диапазоне, рекомендуется использовать резервуары для воды с водяной рубашкой и регулировкой температуры. Воздушный или дозировочный насос используется для рециркуляции активного ила из сепаратора в аэрационный резервуар, непрерывно или с промежутками через равные промежутки времени.
3.6.1.4 Система пористого бака состоит из внутреннего пористого цилиндра с коническим днищем, удерживаемого в большем резервуаре аналогичной формы, но изготовленном из водоупорного пластмассового материала.
Подходящим материалом для пористого резервуара является пористый полиэтилен с максимальным размером пор 90 мкм и толщиной 2 мм. Выделение ила из обработанной органической среды основано на различном прохождении сквозь пористую стену. Выпускаемые сточные воды собираются в кольцевом пространстве, откуда они втекают в отборный чан. Осадки не образуются и, следовательно, отсутствует рециркуляция активного ила. Вся система может монтироваться в водяной ванне с термостатическим управлением. На начальных этапах пористые баки блокируются и могут переполняться. В таком случае замените внутреннюю пористую обшивку чистой обшивкой, в первую очередь откачав сифоном ил из бака в чистое ведро и удалив засоренную внутреннюю обшивку. После смывания непроницаемого наружного цилиндра вставляют чистую внутреннюю обшивку и закачивают обратно активный ил в бак. Любой ил, оставшийся на стенках засоренной внутренней обшивки, также тщательно счищают и переносят в бак. В первую очередь чистят засорившиеся баки тонкой струей воды для удаления оставшегося ила и погружением в слабый раствор гипохлорита натрия, а затем в воду с последующим полосканием водой.
3.6.1.5 Для аэрации активного ила в аэрационных резервуарах обеих систем требуются подходящие технологические приемы, например синтерированные кубики (диффузионные камни) и сжатый воздух. При необходимости воздух очищают пропусканием через соответствующий фильтр и кондиционируют. Через систему должно проходить достаточное количество воздуха для поддержания аэробных условий и сохранения хлопьев активного ила во взвешенном состоянии в течение всего времени испытания.
3.6.2 Фильтровальные установки или центрифуга
Устройства для фильтрации образцов с мембранными фильтрами с подходящей пористой структурой (номинальный диаметр пор составляет 0,45 мкм), через которые проходят растворимые органические соединения и выделяется органический углерод в минимальной величине. Если используются фильтры, которые выделяют органический углерод, промывайте фильтры осторожно, используя горячую воду для удаления выщелачиваемого органического углерода. В качестве альтернативы можно использовать центрифугу, способную работать при 40000 м/с.
3.6.3 Аналитическая аппаратура
Установка необходима для определения:
- растворенного органического углерода (РОУ), общего содержания органического углерода или химической потребности в кислороде (ХПК);
- веществ, если требуется;
- взвешенных твердых частиц, рН, содержания кислорода в воде;
- температуры, кислотности и щелочности;
- аммония, нитритов и нитратов, если испытание проводится в условиях нитрифицирования.
3.6.4 Вода
3.6.4.1 Водопроводная вода должна содержать РОУ менее 3 мг/л. Необходимо определить щелочность, если она не известна.
3.6.4.2 Деионизованная вода должна содержать РОУ менее 2 мг/л.
3.6.5 Органическая среда
В качестве органической среды допускается использование синтетических сточных вод, бытовых сточных вод или их смеси.
Как было указано в [8], [12], использование только бытовых стоков часто ведет к увеличенному процентному удалению растворенного органического углерода (РОУ), бытовые стоки даже позволяют удалять и биоразлагать некоторые химические вещества, не являющиеся биоразлагаемыми при использовании одних лишь синтетических стоков в ходе теста OECD. Постоянное или прерывающееся добавление бытовых отходов часто стабилизирует активный ил, а также улучшает осаждение, что является значимой способностью. Именно поэтому рекомендуют применение бытовых стоков.
Рекомендуется использовать бытовые сточные воды, так как:
- использование только бытовых сточных вод часто способствует увеличению процента удаления РОУ и даже приводит к удалению и биоразложению некоторых химических веществ, которые не разлагаются под действием микроорганизмов при использовании синтетических сточных вод;
- постоянное или периодическое добавление бытовых сточных вод часто стабилизирует активный ил, включая важное свойство хорошего оседания.
Измеряют концентрацию растворенного органического углерода или химическую потребность в кислороде в каждой новой дозе органической среды.
Необходимо знать кислотность или щелочность органической среды. Если уровень кислотности или щелочности низкий, то во время испытания для поддержания рН на уровне примерно 7,5±0,5 в аэрационном резервуаре может потребоваться добавление в органическую среду подходящего буферного вещества (например, двууглекислого натрия или дигидрофосфата калия).
Количество добавляемого буферного вещества и время добавления необходимо определять в каждом отдельном случае. Если используются смеси (непрерывно или периодически), РОУ (или ХПК) смеси должен сохраняться приблизительно равным постоянному значению, например при помощи разбавления с водой.
3.6.6 Синтетические сточные воды
3.6.6.1 На каждый литр водопроводной воды необходимо растворить:
- пептон - 160 мг;
- мясной экстракт - 110 мг;
- мочевину - 30 мг;
- обезвоженный вторичный кислый фосфорнокислый калий (![]() ) - 28 мг;
) - 28 мг;
- хлористый натрий () - 7 мг;
- дигидрат хлористого кальция (![]() ) - 4 мг;
) - 4 мг;
- гептагидрат сульфат магния (![]() ) - 2 мг.
) - 2 мг.
Данные синтетические сточные воды являются примером и содержат среднюю концентрацию растворенного органического углерода в сточных водах, поступающих на очистку, равную примерно 100 мг/л.
В качестве альтернативы возможно использование других составов с приблизительно аналогичной концентрацией РОУ, которые ближе к реальным сточным водам.
Если потребуются менее концентрированные сточные воды, поступающие на очистку, необходимо смешать синтетические сточные воды, например в соотношении 1:1, с водопроводной водой для получения концентрации, равной примерно 50 мг/л.
Более низкая концентрация сточных вод, поступающих на очистку, будет способствовать лучшему росту нитрифицирующих организмов, и данное изменение должно использоваться, если потребуется изучение моделирования станций для очистки нитрифицирующих сточных вод.
Синтетические сточные воды можно приготовить на основе дистиллированной воды и хранить в концентрированном виде при температуре приблизительно 1°С до одной недели. При необходимости их разбавляют водопроводной водой. (Данная среда является неудовлетворительной, так как концентрация азота очень высокая, содержание углерода относительно низкое, в этом случае следует добавлять большее количество фосфата как буферного вещества и большее количество пептона).
3.6.7 Бытовые сточные воды
Ежедневно используют только что собранные отстоявшиеся сточные воды из водоочистных станций, в которые поступают преимущественно бытовые сточные воды. Они должны собираться до первичного осаждения из промывного канала первичного отстойника или из питающей линии к станции аэрации сточных вод активным илом. Они не должны содержать крупных частиц. Сточные воды могут использоваться после хранения в течение нескольких дней (но в целом данный срок не должен превышать семи дней) при температуре примерно 4°С, если будет подтверждено, что РОУ (или ХПК) не был сильно снижен (т.е. менее 20%) во время хранения. Для ограничения нарушений в системе РОУ (или ХПК) каждой новой партии должен регулироваться перед использованием до соответствующего постоянного значения, например при помощи разбавления водой.
3.6.8 Активный ил
Собирают активный ил для инокуляции из аэрационного резервуара хорошо функционирующей станции по очистке сточных вод или из работающего в лабораторных масштабах аэротенка, обрабатывающего преимущественно бытовые сточные воды.
3.6.9 Концентрированные растворы испытуемого вещества
3.6.9.1 Для веществ с достаточной растворимостью готовят концентрированные растворы при соответствующих концентрациях (например, от 1 до 5 г/л) в деионизованной воде или минеральной части искусственных сточных водах (информацию о нерастворимых и летучих веществах см. приложение С). Определяют РОУ и общее содержание органического углерода концентрированного раствора и повторно выполняют измерения для каждой новой партии. При наличии разницы между растворенным органическим углеродом и общим содержанием органического углерода более 20% проверяют водорастворимость испытуемого вещества. Чтобы определить, достаточно ли хорошо проходит восстановление (обычно можно ожидать более 90%), сравнивают значение РОУ и концентрацию испытуемого вещества, измеряемого специальным методом анализа концентрированного раствора, с номинальным значением. При дисперсии можно использовать растворенный органический углерод в качестве аналитического параметра или возможно использование только определенного аналитического метода для анализа испытуемого вещества. При дисперсии требуется центрифугирование образцов. Для каждой новой партии необходимо измерить РОУ, ХПК или провести анализ содержания испытуемого вещества специальным методом.
3.6.9.2 Определяют рН концентрированного раствора. Его предельные значения указывают на то, что добавление вещества может влиять на рН активного ила в системе для проведения испытаний. В этом случае нейтрализуют концентрированный раствор для получения рН, равного 7±0,5 незначительным количеством неорганической кислоты или неорганического основания, но не допускают выпадения испытуемого вещества в осадок.
3.7 Процедура
Описание процедуры представлено для станций аэрации сточных вод активным илом, которая должна быть немного адаптирована для системы пористого бака.
3.7.1 Подготовка инокулюма
3.7.1.1 В начале испытания вводят в систему для проведения испытаний активный ил или инокулюм, содержащий низкую концентрацию микроорганизмов. Держат инокулюм в аэрированном виде при комнатной температуре до тех пор, пока он используется, и используют его в течение 24 ч. В первом случае берут образец активного ила из резервуара для аэрации эффективно функционирующей станции биологической очистки сточных вод или станции лабораторной обработки, в которую поступают преимущественно бытовые сточные воды. Для моделирования нитрифицирующих условий берут ил из станции очистки нитрифицирующих сточных вод. Определяют концентрацию взвешенных твердых частиц и, при необходимости, собирают ил так, чтобы объем, добавляемый в систему для проведения испытаний, был минимальным. Проверяют, чтобы начальная концентрация сухого вещества составляла примерно 2,5 г/л.
3.7.1.2 Во втором случае используют от 2 до 10 мл/л выпускаемых сточных вод из станции биологической очистки бытовых сточных вод в качестве инокулюма. Для получения максимально разных образцов бактерий может быть полезным добавить инокулюм из других источников, например поверхностных вод. В этом случае активированный ил будет развиваться и расти в системе для проведения испытаний.
3.7.2 Дозировка органической среды
3.7.2.1 Проверяют емкости с поступающими для очистки и выпускаемыми сточными водами и трубопроводы, ведущие от резервуаров с поступающими для очистки сточными водами к резервуарам с выпускаемыми сточными водами, их тщательно чистят с целью удаления микробных колоний в начале и во время проведения испытания. Устанавливают системы для проведения испытаний в помещении, где контролируется температура (обычно в пределах от 20°С до 25°С) или используют испытательные установки с водяной рубашкой. Готовят достаточный объем необходимой органической среды. Изначально заполняют резервуар для аэрации и сепаратор органической средой и добавляют инокулюм. Запускают процесс аэрации так, чтобы ил находился в виде суспензии и в аэробном состоянии, затем начинают дозировку поступающих на очистку сточных вод и рециркуляцию осевшего ила. Дозируют органическую среду из резервуаров для хранения в резервуары для аэрации испытательной и контрольной установок и собирают соответствующие выпускаемые сточные воды в аналогичные резервуары для хранения. Для получения нормального времени гидравлического задержания сточных вод на очистном сооружении, равного 6 ч, органическая среда должна закачиваться со скоростью 0,5 л/ч. Для подтверждения данной скорости измеряют ежедневный объем органической среды, отмечая уменьшение объемов среды в резервуарах для хранения. Другие режимы дозировки будут необходимы для определения результатов периодического выпуска и "ударной" нагрузки химических веществ.
3.7.2.2 Если органическая среда подготовлена для использования на период более одного дня, с целью предотвращения микробного роста и биоразложения вне испытательных установок необходимо охлаждение при температуре примерно 4°С или другие подходящие методы сохранения. Если используют искусственные сточные воды, можно готовить и хранить концентрированный раствор при температуре примерно 4°С (например, десятикратная обычная концентрация). Перед использованием данный сконцентрированный раствор можно хорошо перемешать с соответствующим объемом водопроводной воды; в качестве альтернативы его можно закачивать напрямую, но при этом водопроводная вода закачивается отдельно.
3.7.3 Дозировка испытуемого вещества
3.7.3.1 Добавляют необходимый объем концентрированного раствора испытуемого вещества в резервуар для хранения поступающих на очистку сточных вод или дозируют его непосредственно при помощи специального насоса в резервуар для аэрации.
Обычная средняя концентрация испытуемого вещества в поступающих на очистку сточных водах должна составлять от 10 до 20 мг/л растворенного органического углерода с максимальной концентрацией не более 50 мг/л.
Если водорастворимость испытуемого вещества низкая или если очевидно токсическое воздействие, уменьшают концентрацию до 5 мг/л растворенного органического углерода или даже ниже, но только если имеется и выполняется подходящий специальный аналитический метод (диспергированные испытуемые вещества, плохо растворимые в воде, могут добавляться при помощи специальных способов дозировки, приложение С).
3.7.3.2 Начинают добавление испытуемого вещества через период, при котором система стабилизируется и эффективно осуществляется удаление РОУ из органической среды (примерно 80%). Перед добавлением испытуемого вещества необходимо проверить, что все установки работают одинаково эффективно; в противном случае, для достижения одинаковой эффективности работы установок можно смешать отдельные порции ила и повторно распределить равные объемы на отдельные единицы. При использовании инокулюма (примерно) 2,5 г/л (сухой вес) активного ила испытуемое вещество может добавляться в начале испытания, так как с самого начала при прямом добавлении возрастающего объема есть преимущество в том, что активированный ил может лучше адаптироваться к испытуемому веществу. Каким бы способом ни добавлялось испытуемое вещество, рекомендуется, чтобы соответствующий расход и/или объемы в резервуаре(ах) для хранения измерялись на регулярной основе.
3.7.4 Обработка активного ила
3.7.4.1 Во время проведения испытания концентрация активного ила обычно стабилизируется в пределах, независимо от используемого инокулюма, от 1 до 3 г/л (сухой вес) в зависимости от качества и концентрации органической среды, режимов работы, характера присутствия микроорганизмов и воздействия испытуемого вещества.
3.7.4.2 Проверяют взвешенные твердые частицы в резервуарах для аэрации не менее одного раза в неделю и удаляют избыточный активный ил для поддержания концентрации на уровне от 1 до 3 г/л (сухой вес) либо удерживают средний возраст активного ила при постоянном значении обычно в пределах от шести до десяти дней.
Пример - Если выбирается время удерживания ила, равное восьми дням, ежедневно удаляют 1/8 часть объема активного ила в резервуаре для аэрации и выбрасывают его. Выполняют это ежедневно или, предпочтительно, посредством автоматического насоса периодического действия.
При сохранении постоянной концентрации взвешенных твердых частиц (или в ограниченных пределах) время удерживания ила не сохраняется постоянным и является рабочей переменной, которая определяет значение концентрации испытуемого вещества в выпускаемых сточных водах.
3.7.4.3 В течение проведения испытания удаляют как минимум каждый день любой ил, собравшийся на стенках резервуара для аэрации и в сепараторе для повторного ресуспендирования. Проверяют и чистят регулярно все трубы, чтобы не допустить образование биопленки. Рециркулируют осевший ил из сепаратора в резервуар для аэрации, предпочтительно при помощи периодического откачивания. В системе пористого бака рециркуляция не осуществляется, поэтому следует обеспечить чистку внутренних баков до увеличения объема в резервуаре.
3.7.4.4 Плохое оседание и потеря ила может возникнуть в установках Хасмана. Это можно исправить, выполняя одно или несколько действий параллельно с испытательными и контрольными установками:
- свежий ил или флокулянты (например, 2 мл на резервуар с 50 г/л ![]() ) можно добавлять на регулярной основе, например еженедельно, но не допускать реакции испытуемого вещества с
) можно добавлять на регулярной основе, например еженедельно, но не допускать реакции испытуемого вещества с ![]() и образования осадка;
и образования осадка;
- пневмонасос можно заменить перистальтическим насосом, с помощью которого осуществляется поток рецикруляции ила, приблизительно равный потоку поступающих на очистку сточных вод, который будет использоваться. При этом развивается анаэробная зона в осевшем иле (геометрия пневмонасоса ограничивает минимальный расход возвращаемого ила, который будет составлять приблизительно 12-кратный объем поступающих на очистку сточных вод);
- ил может закачиваться периодически из сепаратора в резервуар для аэрации (например, 5 мин через каждые 2,5 ч для рециркуляции от 1 до 1,5 л/ч);
- нетоксичная противовспенивающая добавка в минимальной концентрации может использоваться для предотвращения потерь при пенообразовании (например, кремнийорганическое масло);
- воздух может проходить через активный ил в сепаратор короткими толчкообразными впрысками (например, 10 с каждый час);
- органическая среда может дозироваться с интервалами в резервуар для аэрации (например, от 3 до 10 мин каждый час).
3.7.5 Отбор образцов и анализ
3.7.5.1 Через определенные промежутки времени измеряют концентрацию растворенного кислорода, температуру и рН активного ила в резервуарах для аэрации. Проверяют, что имеется достаточное количество кислорода (более 2 мг/г) и температура поддерживается в необходимом диапазоне (обычно от 20°С до 25°С). Поддерживают значение рН на уровне 7,5±0,5 путем дозирования небольшого количества неорганического основания или кислоты в резервуар для аэрации или в сточные воды, поступающие на очистку, или посредством увеличения буферной емкости органической среды. При возникновении нитрификации образуется кислота, при окислении 1 мг образуется эквивалентное количество, равное примерно 7 мг
. Частота измерений зависит от измеряемого параметра и стабильности системы и может варьироваться между ежедневными и еженедельными измерениями.
3.7.5.2 Измеряют значения РОУ и ХПК в сточных водах, поступающих на очистку в контрольную и испытательную установки. При помощи специального метода анализа определяют концентрацию испытуемого вещества или определяют его концентрацию в концентрированном растворе, принимая во внимание использованный объем и количество сточных вод, поданных на испытательную установку. Рекомендуется рассчитывать концентрацию испытуемого вещества с целью устранения разброса значений концентрации.
3.7.5.3 Берут подходящие образцы из собранных выпускаемых сточных вод (например, 24-часовые) и фильтруют их через мембрану с размером пор 0,45 мкм или центрифугируют со скоростью примерно 40000 м/с в течение примерно 15 мин. Центрифугирование необходимо использовать, если процесс фильтрования затруднен. Для измерения полной биоразлагаемости дважды определяют значения РОУ или ХПК. При необходимости измерения первичной биоразлагаемости используют специальный метод анализа для определения концентрации испытуемого вещества.
3.7.5.4 Использование ХПК может стать причиной возникновения аналитических проблем при низких концентрациях испытуемого вещества и, следовательно, рекомендуется только при использовании в испытании достаточно высокой концентрации (примерно 30 мг/л). Также для сильно адсорбирующихся веществ рекомендуется, чтобы их количество в иле измерялось при помощи аналитических приемов, применимых для анализа данного испытуемого вещества.
3.7.5.5 Частота отбора образцов зависит от предполагаемой продолжительности испытания. Рекомендуемая частота отбора образцов - три раза в неделю. После того как работа установок стала эффективной, для стабилизации их работы после ввода испытуемого вещества необходимо максимум от одной до шести недель. Для оценки результатов испытания желательно получить как минимум 15 допустимых значений на горизонтальном участке кривой (фаза плато), обычно на это необходимо три недели. Испытание может быть завершено при достижении достаточной степени очищения (например, более 90%) и при условии, что эти 15 значений, которые представляют собой анализы, проводимые каждый будний день в течение трех недель, будут в наличии. Продолжительность испытания не должна длиться более 12 недель после добавления испытуемого вещества.
3.7.5.6 При нитрификации ила и необходимости изучения влияния испытуемого вещества на нитрификацию проводят анализ образцов из выпускаемых сточных вод испытательных и контрольной установок как минимум один раз в неделю на наличие аммония и/или нитрита плюс нитрата.
3.7.5.7 Все анализы должны проводиться как можно раньше, особенно расчеты азота. При необходимости переноса проведения анализа на поздний срок образцы хранят при температуре приблизительно 4°С в полностью темных, плотно закрытых сосудах. Если образцы должны храниться более 48 ч, хранят их с помощью низкотемпературного замораживания, подкисления [например, 10 мл/л на 400 г/л раствора серной кислоты) или с добавлением подходящего токсичного вещества (например, 20 мл/л на 10 г/л раствора ртутного (II) хлорида]. Проверяют, что способ хранения не влияет на результаты анализа.
3.7.6 Сопряжение испытательных установок
3.7.6.1 При использовании сопряжения (приложение D) ежедневно меняют определенное количество активного ила (от 150 до 1500 мл для резервуаров аэрации, содержащих 3 л раствора) между резервуарами испытательной и контрольной установок. Если испытуемое вещество сильно адсорбируется на иле, меняют только супернатант сепараторов. В обоих случаях используют поправочный коэффициент для расчета результатов испытания.
3.8 Данные и отчетность
3.8.1 Обработка результатов
3.8.1.1 Процентное удаление РОУ или ХПК испытуемого вещества для каждого времени испытания вычисляют по формуле
![]() , (1)
, (1)
где - РОУ или ХПК испытуемого вещества в сточных водах, поступающих на очистку. Желательно, чтобы эти значения определялись на основе анализа стокового раствора, мг/л;
- РОУ или ХПК очищенной сточной воды, поступающей с испытательной установки, мг/л;
- РОУ или ХПК очищенной сточной воды, поступающей с контрольной установки, мг/л.
3.8.1.2 Показатель удаления РОУ или ХПК из органической среды контрольной установки является полезным показателем для изучения биоразлагающей активности ила во время исследования. Процент удаления РОУ или ХПК из органической среды контрольной установки во время -
рассчитывают по формуле
![]() , (2)
, (2)
где - РОУ или ХПК органической среды в очищенных сточных водах, поступающих с контрольной установки, мг/л.
3.8.1.3 - процент удаления РОУ или ХПК, обусловленных как органической средой, так и испытуемым веществом сточных вод, подаваемых на очистку в испытательную установку, вычисляют по формуле
![]() , (3)
, (3)
где - РОУ или ХПК сточных вод подаваемых на очистку в испытательную установку, мг/л.
3.8.1.4 - процент первичного удаления испытуемого вещества в момент времени
, при условии анализа его концентрации с помощью специального аналитического метода, в каждый выбранный момент анализа вычисляют по формуле
![]() , (4)
, (4)
где - измеренная или вычисленная концентрация испытуемого вещества в сточных водах, подаваемых на очистку в испытательную установку, мг/л;
- измеренная концентрация испытуемого вещества в очищенных сточных водах, поступающих с испытательной установки, мг/л.
3.8.1.5 При использовании режима сопряжения компенсируйте разбавление испытуемого вещества в аэрационном резервуаре из-за обмена части ила, используя поправочный коэффициент (приложение D). Если среднее время гидравлического удержания сточных вод равно 6 ч, проводят обмен половины объема активированного ила в аэрационном резервуаре, полученные значения удаления за день должны быть скорректированы для получения истинного значения степени удаления
испытуемого вещества по формуле
![]() . (5)
. (5)
3.8.2 Представление результатов исследования
Строят зависимость процента удаления (или
), а также
(если возможно) от времени (приложение E). Исходя из формы кривой удаления испытуемого вещества (как такового или в виде РОУ), можно сделать некоторые заключения о процессе удаления.
3.8.3 Адсорбция
Если высокий уровень удаления РОУ испытуемого вещества наблюдается с начала испытания, то возможно, что испытуемое вещество удаляется посредством адсорбции на твердых частицах активного ила.
Это предположение можно подтвердить, проведя анализ адсорбированного испытуемого вещества, с помощью специальных методов. Сохранение постоянно высокого уровня удаления РОУ адсорбируемого вещества на протяжении всего исследования является нехарактерным; обычно наблюдается высокий уровень удаления в начале исследования, который постепенно падает до постоянного значения. Если испытуемое вещество тем или иным способом смогло вызвать акклиматизацию популяции микроорганизмов, то удаление РОУ испытуемого вещества впоследствии увеличится и достигнет постоянного значения.
3.8.4 Индукционный период
При испытании при статической нагрузке, в скрининг-тестах, для многих испытуемых веществ до полного биоразложения характерно наличие индукционного периода. В этот период происходит акклиматизация или адаптация разлагающих вещество бактерий и практически не наблюдается удаление испытуемого вещества, затем происходит бактериальный рост. По окончании этой фазы начинается фаза разложения, когда удаляется приблизительно около 10% испытуемого вещества (с учетом адсорбции, если она имеет место). Индукционный период часто сильно варьируется и плохо поддается воспроизведению.
3.8.5 Фаза плато
Область плато кривой удаления в испытании в непрерывном режиме характеризует фазу, в которой происходит максимальное биоразложение вещества. Фаза плато должна длиться не менее трех недель, и должно быть получено не менее 15 допустимых значений.
3.8.6 Средний уровень удаления испытуемого вещества
Вычисляют среднее значение из значений удаления () испытуемого вещества на плато. Уровень удаления испытуемого вещества получают округлением полученного значения до целого числа (1%). Также рекомендуется рассчитать 95%-ный доверительный интервал среднего значения.
3.8.7 Удаление органической среды
Строят график зависимости процента удаления РОУ или ХПК органической среды из контрольной установки () от времени. Указывают среднее значение удаления таким же образом, как это было проделано для испытуемого вещества.
3.8.8 Признаки биоразложения
Если испытуемое вещество не адсорбируется значительно на активированном иле и кривая удаления имеет типичную форму кривой биоразложения с характерными индукционным периодом, фазой разложения и плато, то можно утверждать, что наблюдаемое удаление явилось результатом биоразложения.
Если изначально наблюдается высокий уровень удаления вещества, то тестирование методом моделирования не дает ответа на вопрос о природе удаления, было ли оно биологическим или абиотическим. В таком или подобном случае, когда возникают сомнения о протекании процесса биоразложения (например, если имеет место десорбция), анализируют адсорбируемое испытуемое вещество или проводят дополнительное испытание биоразлагаемости при статической нагрузке и параметрах, однозначно указывающих на протекание биологических процессов. Примерами таких исследований является, например, метод усвоения кислорода или метод, предполагающий измерение выделяемого углекислого газа, парофазный метод, в котором используется подвергавшийся предварительному воздействию инокулюм, взятый из испытания методом моделирования [см. 16].
Если были измерены значения удаления РОУ и значения концентрации удаленного испытуемого вещества, то значительная разница между процентными показателями удаления указывает на наличие в частично очищенных сточных водах промежуточных органических соединений, которые по сравнению с исходным соединением могут хуже поддаваться биоразложению.
3.8.9 Оценка достоверности результатов исследования
3.8.9.1 Информацию о нормальной биоразлагающей активности инокулюма можно получить, если известна степень удаления органической среды из контрольной установки. Можно полагать, что результаты теста являются достоверными, если удаление из контрольной установки РОУ или ХПК составляет более 80% после двух недель, при условии, что не было сделано необычных наблюдений.
3.8.9.2 Если используют вещества, легко поддающиеся биологическому разложению (вещества сравнения), то уровень разложения () должен превышать 90%.
3.8.9.3 Если испытания проводятся при нитрифицирующих условиях, в частично очищенных сточных водах должно содержаться менее 1 мг/л аммиака и менее 2 мг/л
нитритов.
3.8.9.4 Если данные требования не выполняются, повторяют исследования, используя инокулюм из другого источника. Проводят испытания вещества сравнения и анализируют все использованные экспериментальные методики.
3.8.10 Отчет об испытаниях
Отчет об испытаниях должен содержать следующие разделы:
3.8.10.1 Испытуемое вещество:
- идентификационные данные;
- физическая природа и, если применимо, физико-химические свойства.
3.8.10.2 Условия испытания:
- тип тест-системы; модификации для исследования нерастворимых и летучих соединений;
- тип органической среды;
- количественное соотношение и происхождение различных сточных вод в применяемых сточных водах;
- инокулюм, природа и зоны отбора проб, концентрация и предварительная обработка;
- стоковый раствор испытуемого вещества: значения РОУ и ХПК; способ приготовления, если в суспензии; концентрация, использованная в испытании, и обоснование, если она не находится в диапазоне от 10 до 20 мг РОУ/л; метод добавления; дата первого добавления; любые изменения;
- средний возраст ила или среднее время гидравлического задержания сточных вод; метод сброса ила; методы контроля увеличения объема ила, потери ила и т.д.;
- применяемые аналитические методы;
- температура, при которой проводится испытание;
- объемы вспухания ила, индекс объема ила (SVI), взвешенные частицы в смеси сточных вод с активным илом (MLSS);
- любые отклонения от стандартных методов и любые обстоятельства, которые могли повлиять на результаты испытания.
3.8.10.3 Результаты испытания:
- все результаты измерений (РОУ, ХПК, специальный анализ, рН, температура, концентрация кислорода, содержание взвешенных частиц, соединений , если применимо);
- все рассчитанные значения (или
),
,
, представленные в форме таблицы и рассчитанные из анализа кривой удаления;
- информация об индукционном периоде и фазе плато, времени проведения испытания, степени удаления испытуемого вещества и органической среды из испытательной установки, а также статистическая информация и заключение о степени биоразложения и достоверности результатов испытания;
- обсуждение результатов.
4 Биопленки
Испытания методом моделирования в норме используются с химическими веществами, которые дали отрицательный результат в ходе скрининг-теста на биоразлагаемость [см. 17], но прошли тест на присущую биоразлагаемость. В виде исключения, моделирующие испытания также могут применяться с любым веществом, для которого требуется больше информации, это особенно касается продукции высокотоннажной химии, в таких случаях обычно используют тесты с активным илом [см. 18]. В некоторых случаях требуется получение особой информации, касающейся поведения химического продукта относительно методов очистки сточных вод, где задействованы анаэробные фильтры, такие как капельные или капельные биологические фильтры, вращающиеся биологические осветлители, псевдоожиженные слои. Для этого были разработаны различные устройства.
Джерик с соавторами [см. 19] использовали большие пилотные капельные биологические фильтры, эксплуатируя их в связанном режиме. Данные фильтры занимали большое пространство и требовали относительно больших объемов стоков или синтетических стоков. Фильтры меньших размеров (1,83 м0,15 м) были описаны Трусдейлом и его соавторами [20], в данные фильтры подавались естественные бытовые стоки, не содержащие ПАВов, но для фильтров такого типа также требовались достаточно большие объемы стоков. На создание "выдержанного" анаэробного фильтра требовалось не менее 14 недель, плюс дополнительные 4-8 недель после первого введения опытного ПАВа, необходимые для акклиматизации.
Боманном (Baumann) с соавторами [см. 21] были разработаны фильтры, меньшие по размерам, в которых использовался полиэфирный ворсистый материал, предварительно вымоченный в активном иле, используемом в качестве инертной среды, поддерживающей анаэробный фильтр. Опытное вещество использовали как единственный источник углерода, биоразлагаемость определяли измерениями растворенного органического углерода во входящем и выходящем потоках, а также по количеству в выходном газе.
Совершенно иной подход был разработан исследователем Глойна и его соавторами [см. 22], являющимися изобретателями вращающегося трубчатого реактора. На внутренней поверхности вращающейся трубки ими была выращена биопленка (или анаэробный фильтр): через выбранный участок поверхности проходил поток, подаваемый с верхнего конца трубки, расположенной горизонтально под небольшим углом. Для изучения биоразлагаемости ПАВов [см. 23] и для исследования оптимальной толщины биопленки и ее диффузионной способности [см. 24] был использован реактор. Кроме того, данными авторами был разработан реактор и его модификация, которая позволила определять содержание в выходном газе.
Метод с вращающимся трубчатым реактором был признан комитетом аналитиков Великобритании (Standing Committee of Analysts) в качестве стандартного метода для оценки как биоразлагаемости химической продукции [см. 25], так и способности поддаваться очистке, а также токсичности сточных вод [см. 26]. Преимущества описанного метода заключаются в простоте, компактности, воспроизводимости результатов, а также в небольших объемах органической среды.
4.1 Принципы исследования
4.1.1 Синтетические или бытовые сточные воды и исследуемое вещество (в виде примеси или само по себе) распространяются по внутренней поверхности медленно вращающейся наклонной трубы. На внутренней поверхности образуется слой микроорганизмов, таких же, что и в среде биофильтра. Условия работы реактора выбраны таким образом, чтобы вызвать достаточное удаление органического вещества и, при необходимости, окисление аммония.
4.1.2 Сток из трубы собирают и отстаивают и/или фильтруют перед специальным исследованием на растворенный органический углерод (РОУ) и/или исследуемое вещество. Для сравнения параллельно в тех же условиях действуют контрольные установки, на которые не поступает исследуемое вещество. Разница между уровнями концентрации РОУ в стоке из испытательных и контрольных установок относится на счет испытуемого вещества и его органических метаболитов. Эта разница сравнивается с концентрацией добавленного испытуемого вещества (такого как РОУ) для вычисления удаления исследуемого вещества.
4.1.3 Биоразложение обычно можно отличить от биопоглощения, внимательно изучив кривую удаление - время. Подтвердить результат можно с помощью исследования на полное биоразложение (поглощение кислорода или образование углекислого газа), используя адаптированный прививочный материал, взятый в конце исследования из реакторов, в которые поступает испытуемое вещество.
4.2 Информация об исследуемом веществе
4.2.1 Должны быть известны следующие факторы: отсутствие примесей, растворимость в воде, степень летучести и адсорбционные характеристики исследуемого вещества.
4.2.2 Обычно летучие и труднорастворимые вещества нельзя изучать, не приняв особых мер предосторожности (приложение С). Также необходимо знать химическое строение или эмпирическую формулу, чтобы вычислить теоретические значения и/или проверить измерения параметров, например теоретической потребности в кислороде (ТПК), РОУ.
4.2.3 Данные о токсичности исследуемого вещества для микроорганизмов (приложение F) могут быть полезны для выбора подходящей концентрации и могут быть очень важны для правильного истолкования низких значений биоразложения.
4.3 Проходные уровни
4.3.1 Степень биоразлагаемости ПАВ должна быть не менее 80%. Если 80% не достигнуто, можно провести имитационное (контрольное) испытание, при этом степень биоразлагаемости ПАВ должна быть не менее 90% специфического вещества.
Значение полученного процента удаления может быть использовано в приблизительных вычислениях возможной концентрации в окружающей среде для их последующего применения при оценке опасности химических веществ.
В ряде испытаний чистых химически веществ процентное удаление РОУ составило свыше 90% более чем у трех четвертых веществ и свыше 80% более чем у 90% веществ, которые показали сколь-нибудь значимую степень биоразлагаемости.
4.4 Сравнительные вещества
Для гарантии того, что эксперимент проходит правильно, рекомендуется иногда исследовать сравнительные вещества, чья реакция известна. Такие реагенты включают в себя адипиновую кислоту, 2-фенил фенол, 1-нафтол, дифеновую кислоту и 1-нафтойную кислоту.
4.5 Воспроизводимость результатов исследования
Относительное стандартное отклонение - 3,5%, а между исследованиями - 5% [см. 17].
4.6 Описание метода
4.6.1 Аппаратура
4.6.1.1 Вращающиеся трубчатые реакторы
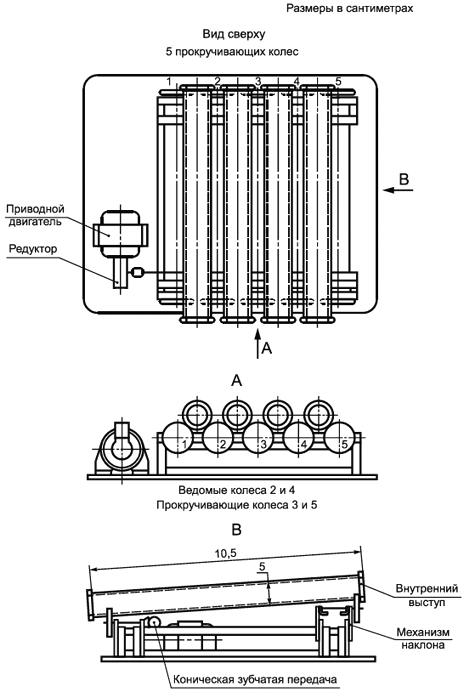
Аппаратура (см. рисунки 3, 4) состоит из набора акриловых труб, каждая длиной 30,5 см и с внутренним диаметром 5 см, поддерживаемых колесиками с резиновым ободом, помещенных внутрь металлической опорной рамы. Каждая труба имеет внешний выступ примерно 0,5 см глубиной для закрепления на колесиках, внутренней поверхности придана шероховатость с помощью грубой проволочной губки, также имеется внутренний выступ в 0,5 см глубиной на верхнем (загрузочном) конце для задержки жидкости. Трубы располагаются под углом примерно один градус к горизонту для необходимой продолжительности контакта при воздействии исследуемого вещества на чистую трубу. Колесики с резиновым ободом вращаются с помощью медленного мотора с регулируемой скоростью. Температура труб регулируется путем их установки в помещение с постоянной температурой.
|
Рисунок 3 - Вращающиеся трубы
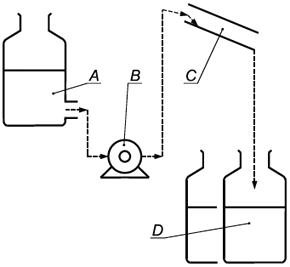
| |
A - Питающий резервуар | C - Вращающаяся труба |
B - Шланговый насос | D - Емкость для отбора стока |
Рисунок 4 - Технологическая схема
Заключив каждый трубчатый реактор внутрь немного ![]() трубы с крышкой и убедившись, что соединения не пропускают газы, можно собрать отходящий газ
трубы с крышкой и убедившись, что соединения не пропускают газы, можно собрать отходящий газ в щелочном растворе для последующих измерений.
Запас для круглосуточного снабжения каждой трубы органической средой с добавлением, при необходимости, исследуемого вещества содержится в 20-литровом резервуаре для хранения (см. рисунок 4, А). При необходимости раствор испытуемого вещества может быть дозирован отдельно. У основания каждого накопительного контейнера есть выпускное отверстие, соединенное соответствующими трубами, например из силиконового каучука, через шланговый насос (см. рисунок 4, B) со стеклянной или акриловой подающей трубкой, которая входит на расстояние от 2 до 4 см в верхний (загрузочный) конец наклонной трубы (см. рисунок 4, С). Сток стекает с нижнего конца наклонной трубы и собирается в другой резервуар для хранения (см. рисунок 4, D). Сток отстаивается или фильтруется перед анализом.
4.6.1.2 Фильтровальная аппаратура - центрифуга
Фильтровальный аппарат - это устройство для фильтрации образцов с мембранным фильтром с достаточной пористостью (номинальный диаметр отверстия 0,45 мкм), который адсорбирует органические соединения или снижает уровень органического углерода до минимального. При использовании фильтров, высвобождающих органический углерод, необходимо тщательно промыть их горячей водой, чтобы удалить вымываемый органический углерод. Можно использовать центрифугу, способную работать при 40000 м/с.
Аналитическое оборудование для измерения:
- РОУ/общего органического углерода (ООУ) или химического потребления кислорода (ХПК);
- специфического вещества (ВЭЖХ, ГХ и т.п.) при необходимости;
- рН, температуры, кислотности, щелочности;
- аммония, нитрита, нитрата, если исследования проводятся в нитрифицирующих условиях.
4.6.2 Вода
Водопроводная вода, содержащая не более 3 мг/л РОУ.
Дистиллированная или деионизированная вода, содержащая не более 2 мг/л РОУ.
4.6.3 Органическая среда
4.6.3.1 В качестве органической среды можно использовать синтетические сточные воды, бытовые сточные воды или смесь тех и других. Следует измерять концентрацию РОУ (или ООУ) в каждой новой пробе органической среды. Кислотность или щелочность органической среды должна быть известна. Среда может требовать добавления соответствующего буфера (гидрокарбонат натрия или дикалийфосфат), если она обладает пониженной кислотностью или щелочностью, для поддержания рН на уровне 7,5±0,5 в реакторе во время исследования. Количество буфера и время его добавления определяются отдельно для каждого случая.
4.6.4 Синтетические сточные воды
Растворяют в 1 л водопроводной воды:
- пептон - 160 мг;
- мясной экстракт - 110 мг;
- мочевина - 30 мг;
- безводный вторичный кислый фосфат калия, (![]() ) - 28 мг;
) - 28 мг;
- хлорид натрия () - 7 мг;
- дигидрат хлорида кальция (![]() ) - 4 мг;
) - 4 мг;
- магний сернокислый семиводный (![]() ) - 2 мг.
) - 2 мг.
Эти синтетические сточные воды являются примером и дают среднюю концентрацию РОУ в приточной жидкости примерно в 100 мг/л.
В качестве альтернативы можно использовать другие составы с такой же концентрацией РОУ, которые ближе к настоящим сточным водам. Эти синтетические сточные воды могут быть приготовлены в дистиллированной воде в концентрированном виде и храниться при температуре приблизительно в 1°С до одной недели. При необходимости их следует разбавить водопроводной водой. (Эта среда является неудовлетворительной, т.к., концентрация азота очень высока, относительно низкое содержание углерода. Для устранения этих недостатков рекомендуется добавить больше фосфата в качестве буфера и большее количество пептона).
4.6.5 Бытовые сточные воды
Следует использовать свежие отстоявшиеся сточные воды, собираемые ежедневно из очистных сооружений, принимающих преимущественно бытовые сточные воды. Их следует собирать из сливного канала первичного отстойника или из системы подачи на станцию аэрации сточных вод, и они не должны содержать крупных частиц. Сточные воды можно использовать после хранения в течение нескольких дней при температуре 4°С, если доказано, что не произошло значительного (то есть более 20%) снижения РОУ (или ООУ) во время хранения. Чтобы ограничить вмешательство в систему, РОУ (или ООУ) из каждой новой пробы необходимо перед использованием привести к соответствующему постоянному значению путем, например, разбавления водопроводной водой.
4.6.6 Смазочный материал
Для смазки роликов шлангового насоса можно использовать глицерин или оливковое масло: оба материала подходят для использования на трубах из силиконового каучука.
4.6.7 Основные растворы исследуемого вещества
4.6.7.1 Для веществ с достаточной растворимостью готовят основные растворы соответствующей концентрации (например, от 1 до 5 г/л) в деионизированной воде или в минеральной части синтетических сливных вод.
4.6.7.2 Для нерастворимых веществ (см. приложение С).
Этот метод не подходит для летучих веществ без внесения изменений в трубчатые реакторы. Следует определить РОУ и ООУ основного раствора и повторять измерения для каждой новой пробы. Если разница между РОУ и ООУ больше 20%, следует проверить водорастворимость исследуемого вещества. Сравнивают РОУ или концентрацию исследуемого вещества, измеренную специальным анализом основного раствора с номинальным значением, чтобы убедиться в достаточном уровне восстановления (обычно можно ожидать >90%). Проверяют, может ли РОУ использоваться в качестве аналитического параметра, или же можно использовать только специальную технологию для данного исследуемого вещества. Для дисперсий необходимо центрифугирование образцов. Для каждой новой пробы следует измерять РОУ, ХПК или проводить специальный анализ исследуемого вещества.
4.6.7.3 Следует определить рН основного раствора. Повышенные значения сигнализируют о том, что добавление вещества могло оказать влияние на рН активного ила в системе исследования. В этом случае следует нейтрализовать основной раствор до уровня рН 7±0,5 с помощью небольшого количества неорганической кислоты или основания, при этом избегая выпадения исследуемого вещества в осадок.
4.7 Процедура
4.7.1 Подготовка органической среды для дозирования
4.7.1.1 Проверяют, что все впускные и выпускные контейнеры и трубы из впускных и к выпускным емкостям тщательно промыты для остановки роста бактерий; проверяют это перед исследованием и во время него.
4.7.1.2 Каждый день готовят свежие синтетические сточные воды из сухого вещества или из концентрированного основного раствора путем разбавления водопроводной водой. Измеряют необходимое количество в цилиндре и помещают в чистую впускную емкость. Также, в случае необходимости, добавляют нужное количество основного раствора исследуемого вещества или сравнительного вещества к синтетическим сточным водам перед разбавлением. Если требуется избегать потери испытуемого вещества, готовят отдельно его разбавленный раствор в отдельном контейнере и помещают его в наклонную трубу с помощью дозирующего насоса.
4.7.1.3 В качестве предпочтительной альтернативы можно использовать отстоянные бытовые сточные воды, свежесобранные каждый день, если это возможно.
4.7.2 Эксплуатация вращающихся трубчатых реакторов
4.7.2.1 Для анализа одного исследуемого вещества нужно два одинаковых трубчатых реактора; они собираются при постоянной комнатной температуре обычно в (22±2)°С.
4.7.2.2 Регулируют шланговые насосы для подачи органической среды со скоростью (250±25) мл/ч (без исследуемого вещества) в наклонные трубы, вращающиеся со скоростью (18±2) об/мин. Применяют смазывающий материал к насосным трубам перед началом исследования и повторяют эту процедуру время от времени при исследовании, чтобы обеспечить правильное функционирование и продлить срок службы труб.
4.7.2.3 Регулируют угол наклона труб относительно горизонта до достижения продолжительности пребывания (125±12,5) с для смеси в чистой трубе. Устанавливают время задержки путем добавления небиологического маркера (например, , инертный краситель) в раствор, время достижения максимальной концентрации в стоке считается средним временем задержки (при максимальной пленке время задержки может возрастать примерно до 30 мин).
4.7.2.4 Данные значения скорости и времени дают максимальное удаление (более 80%) РОУ (или ХПК) и получение нитрифицированных сточных вод. Следует изменить скорость потока, если удаление неэффективно или требуется воспроизвести действие определенной установки. Во втором случае следует отрегулировать интенсивность дозирования органической среды, чтобы действие реактора соответствовало действию установки.
4.7.3 Инокуляция
Для начала роста микроорганизмов при использовании синтетических сточных вод может быть эффективна воздушно-капельная инокуляция, в ином случае следует добавить 1 мл/л отстоянных сточных вод к раствору на три дня.
4.7.4 Измерения
Во время регулярных интервалов проверяют, укладываются ли дозировка и скорость вращения в установленные пределы. Также следует измерять рН стока, особенно, если ожидается нитрификация.
4.7.5 Отбор проб и анализ
4.7.5.1 Метод, схема и частота отбора проб выбирают с учетом цели исследования.
Пример - Взять точечные (или выборочные) пробы входящего и исходящего потоков или собрать образцы за более долгий период, например от 3 до 6 ч.
В первый период, без исследуемого вещества, образцы следует брать дважды в неделю. Затем их нужно отфильтровать через мембраны или центрифугу при 40000 м/с в течение примерно 15 мин. Может возникнуть необходимость отстоять образцы и/или пропустить их через первичный фильтр перед мембранной фильтрацией. Определяют РОУ (или ХПК), как минимум в двух экземплярах и, при необходимости, БПК, аммоний и нитрит/нитрат.
4.7.5.2 Все анализы следует проводить как можно скорее после отбора и приготовления проб. Если анализ приходится отложить, образцы следует хранить при температуре около 4°С в темном месте, в полных, плотно закупоренных сосудах. Если требуется хранить образцы более 48 ч, следует подвергнуть их глубокой заморозке, ацидификации или добавить подходящее токсичное вещество [например, 20 мл/л раствора хлорида ртути (II) 10 г/л]. Проверяют, что технология хранения не влияет на результаты анализа.
4.7.6 Период приработки
В этот период поверхностная биопленка вырастает до оптимальной толщины, это обычно занимает около двух недель и не должно превышать шести недель. Уровень удаления РОУ (или ХПК) возрастает и достигает стабильного значения. После достижения одинакового стабильного значения в обеих трубах одну из них делают контрольной на оставшийся период исследования, во время которого их работа должна оставаться согласованной.
4.7.7 Введение испытуемого вещества
На этой стадии следует добавить испытуемое вещество в другой реактор, соблюдая нужную концентрацию, обычно от 10 до 20 мг углерода/л. В контрольную установку продолжает поступать только органическая среда.
4.7.8 Период адаптации
Продолжают анализ на РОУ (или ХПК) дважды в неделю, и, если необходимо оценить первичную биоразлагаемость, также измеряйте концентрацию испытуемого вещества с помощью специального анализа. Для адаптации должно пройти от одной до шести недель (при некоторых условиях дольше) после того, как испытуемое вещество было впервые введено. Когда процент удаления достигнет максимального значения, собирают от 12 до 15 удовлетворительных показателей в фазе плато примерно за три недели для оценки среднего процента удаления. Исследование считается завершенным, если достигнут достаточно высокий показатель удаления. Обычно длительность исследования не превышает 12 недель после добавления испытуемого вещества.
4.7.9 Смыв биопленки
Внезапное исчезновение большого количества избыточной пленки из труб, или смыв, случается относительно регулярно. Чтобы убедиться, что на результаты исследования это не повлияет, во время исследования должно пройти не менее двух полных циклов вырастания и смыва.
4.8 Данные и отчет
4.8.1 Обработка результатов
- процентное удаление РОУ (или ХПК) испытуемого вещества в период времени
вычисляют по формуле
![]() %, (6)
%, (6)
где - концентрация РОУ (или ХПК) в стоке в связи с испытуемым веществом, предпочтительно вычисляемая из концентрации в основном растворе и добавленного объема, мг/л;
- измеренный РОУ (или ХПК) исследуемого стока в период времени
, мг/л;
- измеренный РОУ (или ХПК) в контрольном стоке в период времени
, мг/л.
Повторяют вычисления для вещества сравнения, если оно исследуется.
4.8.2 Работа контрольного реактора
4.8.2.1 Степень удаления РОУ (или ХПК) () органической среды в контрольных реакторах является полезной информацией для определения активности биоразложения биопленки во время исследования. Следует вычислять
по формуле
![]() %, (7)
%, (7)
где - РОУ (или ХПК) органической среды в контрольном стоке (мг/л).
4.8.2.2 Удаление испытуемого вещества, если этот параметр измеряется с помощью специального метода расчета в каждый период анализа, вычисляют по формуле
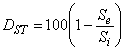 %, (8)
%, (8)
где - измерение или, предпочтительно, установленная концентрация вещества в исследуемом стоке, мг/л;
- измеренная концентрация вещества в исследуемом стоке за период времени
, мг/л.
Если данный метод расчета дает положительное значение в неадаптированных сточных водах, равное мг/л, следует вычислять процент удаления
по формуле
![]() %. (9)
%. (9)
4.8.3 Выражение результатов исследования
Следует представлять процент удаления и
(или
), при наличии, как функцию времени (приложение Е). Берут среднее (выраженное ближайшим целым числом) и стандартное отклонение от 12 до 15 значений
(и
при наличии), полученное в устойчивой фазе, как процент удаления исследуемого вещества. Некоторые заключения относительно процессов удаления можно вывести из кривой удаления.
4.8.4 Адсорбция
Если в начале исследования наблюдается высокий уровень удаления РОУ в исследуемом веществе, исследуемое вещество удаляют путем адсорбции в биопленку. Доказать это возможно, определив адсорбированное исследуемое вещество в сухом остатке из пленки. Обычно удаление РОУ адсорбируемых веществ не остается высоким в течение исследования; наблюдается первоначально высокий уровень удаления, который затем постепенно падает до устойчивого значения. Если адсорбированное исследуемое вещество смогло вызвать адаптацию микробной популяции, это означает, что удаление РОУ исследуемого вещества впоследствии вырастет и достигнет высокого стабильного уровня.
4.8.5 Латентная фаза
Как и в статичных испытаниях методом моделирования, многие исследуемые вещества нуждаются в латентной фазе, прежде чем проявится полное биоразложение. Во время латентной фазы происходит адаптация соответствующих бактерий при почти полном отсутствии удаления исследуемого вещества; затем происходит первоначальный рост этих бактерий. Данная фаза оканчивается, и фаза разложения условно считается начавшейся, когда около 10% первоначального количества исследуемого вещества удалено (после адсорбции, если она имеет место). Латентная фаза часто крайне изменчива и с трудом поддается воспроизведению.
4.8.6 Стабильная фаза
Стабильная фаза кривой удаления в продолжительном исследовании определяется как фаза, в которой происходит максимальное разложение. Эта фаза должна длиться не менее трех недель и иметь от 12 до 15 действительных измерений.
4.8.7 Средний уровень удаления исследуемого вещества
Следует вычислять среднее значение из значений удаления (и
при наличии) исследуемого вещества во время стабильной фазы. Округленное до целого числа (1%), это значение является уровнем удаления исследуемого вещества. Также рекомендуется вычислять 95%-ный доверительный интервал среднего значения. Таким же образом следует производить вычисления среднего уровня (
) удаления органической среды в контрольной установке.
4.8.8 Признаки биоразложения
Если исследуемое вещество не адсорбируется значительно в биопленку и кривая удаления имеет типичную форму кривой биоразложения с латентной фазой, фазой разложения и стабильной фазой, то измеряемое удаление можно отнести на счет биоразложения.
При высоком уровне первоначального удаления имитационное исследование не может провести различие между процессами биологического и абиотического удаления. В случаях, когда возникают сомнения относительно биоразложения (например, если имеет место отслаивание), следует анализировать адсорбированное исследуемое вещество на образцах пленки или производить дополнительные статичные (скрининг) испытания на биоразлагаемость на основе параметров, ясно указывающих на биологические процессы.
Если измерялись и РОУ, и удаление специфического вещества, значительная разница (первое ниже, чем второе) между процентными показателями удаления указывает на наличие в стоках промежуточных органических продуктов, которые труднее поддаются разложению; эти факторы следует изучить.
4.8.9 Действительность результатов исследования
4.8.9.1 Исследования считаются действительными, если уровень удаления РОУ (или ХПК) в контрольных установках более 80% через две недели работы и не наблюдалось никаких отклонений от нормы.
4.8.9.2 Если исследовалось вещество, легко поддающееся биоразложению (сравнительное), уровень биоразложения должен быть более 90%, а разница между дублирующими значениями не должна превышать 5%. Если эти два критерия не соблюдены, следует пересмотреть экспериментальные процедуры и/или взять бытовые сточные воды из другого источника.
4.8.9.3 Различия между значениями биоразложения дублирующих установок (если таковые используются) относительно исследуемого вещества не должны превышать 5%. Если этот критерий не соблюден, но уровни удаления высокие, следует продолжать анализ в течение еще трех недель. При низком уровне удаления следует обратить внимание на ингибирующее действие исследуемого вещества, если оно неизвестно, и повторить исследование при более низкой концентрации исследуемого вещества, если это осуществимо.
4.9 Отчет об исследовании
Отчет об исследовании должен содержать следующее:
4.9.1 Испытуемое вещество:
- идентифицирующие данные;
- физическая природа и физико-химические свойства.
4.9.2 Условия исследования:
- любые изменения, внесенные в систему исследования, особенно при изучении нерастворимых или летучих веществ;
- вид органической среды;
- пропорции и происхождение промышленных отходов в сточных водах;
- способ прививки;
- основной раствор исследуемого вещества: содержание РОУ (растворенного органического углерода) и ООУ (общего органического углерода); как приготовлен, если это суспензия; использованная концентрация (концентрации), если вне пределов от 10 до 20 мг/л РОУ - причины, способ добавления; дата первого добавления; любые изменения в концентрации;
- среднее время гидравлического задержания (при отсутствии роста); скорость вращения трубы; приблизительный угол наклона;
- подробности относительно смыва, время и интенсивность;
- температура и диапазон условий исследования;
- задействованные методы анализа.
4.9.3 Результаты исследования:
- данные по измерениям РОУ, ХПК, специфические анализы, рН, температура, соединения в соответствующих случаях;
- вычисленные данные (или
),
,
, полученные в форме таблицы и кривых удаления;
- информация относительно латентной и стабильной фаз, длительности исследования, уровня удаления исследуемого вещества, сравнительного вещества (если таковое исследуется) и органической среды (в контрольной установке), а также статистические данные и заявления относительно биоразлагаемости и действительности исследования;
- обсуждение результатов.
Приложение А
(рекомендуемое)
Корреляция между периодом удержания химических веществ в иле и возможностью их очистки
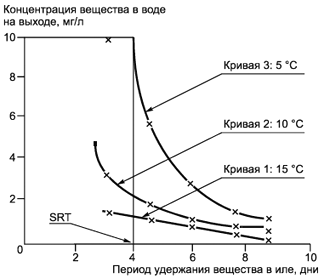
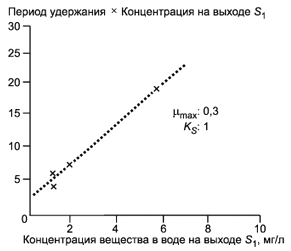
А.1 Введение
Способ, изложенный в основном описании, создан для того, чтобы выяснить, могут ли испытываемые химические вещества (обычно те, о которых известно, что по существу они поддаются биоразложению, но не быстро) биоразлагаться в установленных для узлов очистки сточных вод пределах. Результаты записывают как процент удаления и процент биоразлагаемости.
А.1.1 В зависимости от параметров аэротенков и состава вещества на входе концентрация тестового материала в воде на выходе может существенно разниться. В ходе исследований необходимо выдерживать определенную номинальную концентрацию твердого ила (см. [27], [28]) или определенное время удержания вещества в иле (SRT). Это время может варьироваться в течение суток или нескольких дней в зависимости от интенсивности расходования ила.
А.1.2 Период удержания контролируется в ограниченных пределах на протяжении каждых суток (так же, как и в промышленной установке), результатом чего является получение более стабильных значений концентрации веществ в воде на выходе. Для исследования рекомендуется выбирать бытовые сточные воды, поскольку их использование обеспечивает более стабильный результат и более высокую степень очистки. Также изучается влияние ряда сопутствующих параметров. При проведении углубленного исследования можно установить влияние различных температур на концентрацию веществ в воде на выходе.
А.1.3 К полученным данным было решено применять модель Моно (рост бактерий и утилизация субстрата), поскольку данный метод предполагалось использовать только в отношении веществ, производимых в больших объемах, при концентрации в стоках выше 1 мг/л [28, 29].
Обоснованность использования упрощенной модели и последующих выводов была установлена с помощью этоксилатов спирта, у которых варьируется степень первичной биологической разлагаемости.
Описание данного метода во многом схоже с описанием, приведенным в тексте; ниже говорится только об отличиях.
А.2 Суть метода
А.2.1 Установки в виде пористых цилиндров с активным илом, обеспечивающие (практически) непрерывный процесс расходования иловой смеси и высокую точность измерения периода удержания вещества в иле, работают в несовмещенном режиме в условиях различных периодов удержания и, при возможности, различных температур. Период удержания составляет от двух до десяти дней; температура варьируется от плюс 5°С до плюс 20°С. Стоки (лучше бытовые) и раствор тестового вещества подают в установки по отдельности в объемах, требуемых для достижения желаемой концентрации тестового материала в воде на входе и достижения желаемого результата за определенный период удержания (от 3 до 6 ч). Для сравнения параллельно работают контрольные установки без испытуемого вещества.
А.2.2 Могут использоваться и другие типы аппаратов, следует максимально тщательно контролировать период удержания в них вещества.
Например, при использовании резервуаров отстаивания необходимо будет принять в расчет потерю твердого вещества через воду на выходе.
Следует позаботиться об особых мерах по недопущению ошибок вследствие разницы в количестве ила в резервуарах отстаивания.
А.2.3 Каждая установка работает в определенном режиме. После достижения равновесия системы в течение трех недель получают средние стабильные значения концентрации тестового материала в воде на выходе и при необходимости растворенного органического углерода. Кроме вычисления процента удаленного тестового материала и, при необходимости, растворенного органического углерода, в графической форме должна быть показана связь между условиями работы установок и концентрацией веществ на выходе. Исходя из этих данных, могут быть вычислены ориентировочные кинетические константы, а также спрогнозированы условия, при которых тестовое вещество может быть очищено.
А.3 Описание метода
А.3.1 Аппарат
А.3.1.1 Лучшей установкой послужит модифицированная система, основанная на принципе пористого цилиндра (см. рисунок А.1). Она состоит из внутреннего корпуса (трубы), изготовленного из пористого полипропилена толщиной 3,2 мм с размером пор 90 мкм. Соединение должно быть сварено встык.
Труба находится внутри герметичного полиэтиленового корпуса, состоящего из двух частей: кругового основания, в котором просверливают отверстия для двух воздуховодов и отвода ила, а также верхнего цилиндра, привинченного к основанию и имеющего отвод, обеспечивающий необходимый объем в корпусе пористого цилиндра. На одном из воздуховодов имеется диффузор; другой (сквозной) расположен под прямым углом к камню в цилиндре. Данная система создает вихревой поток, необходимый для полного смешивания внутри аппарата, а также поддерживает концентрацию растворенного кислорода на уровне выше 2 мг/л.
|
Рисунок А.1 - Установка пористого цилиндра с системой контроля периода удержания вещества в иле
А.3.1.2 Температура необходимого количества установок поддерживается в диапазоне от плюс 5°С до плюс 20°С (±1°С) за счет использования водяных бань или комнат постоянной температуры. Два насоса подают раствор испытуемого вещества и отстоявшуюся сточную воду в аэрационные резервуары в объеме от 0 до 1,0 мл/мин и от 0 до 5 мл/мин соответственно. Для удаления отработанного ила из аэрационных резервуаров используют третий насос. Необходимая низкая скорость отвода отработанного ила обеспечивается за счет установки насоса на более высокие обороты и его работы с заданным интервалом (для этого используют переключатель таймера). Насос работает 10 с в минуту. Скорость подачи составляет 3 мл/мин, а скорость отвода - 0,5 мл/мин.
А.4 Описание процесса исследования
А.4.1 Подготовка инокулятов
Используется активный ил, около 2,5 г/л.
А.4.2 Количество тестовых установок
При проведении простого исследования (т.е. измерения объемов удаленного вещества) вычисления можно проводить только для одного периода удержания вещества в иле. Для расчета ориентировочных констант скорости требуется провести исследования для четырех-пяти периодов удержания вещества. Обычно периоды составляют от двух до десяти дней. В практическом плане имеет смысл провести исследования для четырех-пяти периодов удержания вещества одновременно и в одинаковых температурных условиях. При углубленных исследованиях соответствующие параметры изменяются, температура варьируется в диапазоне от плюс 5°С до плюс 20°С. Для исследования на первичное биологическое разложение в рамках заданных условий обычно требуется только одна установка. Для исследования на полное биологическое разложение необходима контрольная установка в рамках каждого набора заданных условий. В нее подают сточные воды (но не испытуемое вещество). Если предполагается, что тестовый материал присутствует в используемой воде, при определении степени первичного разложения необходимо использовать контрольные установки и делать необходимые поправки в расчетах.
А.4.3 Подача органического вещества и тестового материала
Раствор испытуемого вещества подается отдельно, уровень расхода ила может различаться.
Нужно контролировать и при необходимости изменять объемы потока на входе и на выходе, а также уровень расхода ила на ±10%, например, два раза в день. Если возникают трудности с анализом при использовании бытовых сточных вод, исследование можно проводить на сточных водах синтетического происхождения. Однако следует удостовериться, что в различных средах будут получены сравнимые кинетические данные.
А.4.4 Эксплуатация аэротенков
Контроль периода удержания вещества в иле должен проводиться при постоянном уровне расхода ила.
А.4.5 Отбор образцов и их анализ
Необходимо определить концентрацию испытуемого вещества, а также, при необходимости, растворенного органического углерода; значения химической потребности в кислороде не требуются.
А.5 Данные и отчетность
А.5.1 Вычисление констант скорости
Концентрация испытуемого вещества в воде на выходе и изменение в зависимости от конкретных условий в очистных сооружениях определяют по формуле
![]() . (А.1)
. (А.1)
Данное уравнение поможет найти значения ,
и
, критического времени удержания вещества в иле.
Или же средние значения и
могут быть определены простой компьютерной программой для подтверждения показателей расчетной кривой по формуле
![]() . (А.2)
. (А.2)
А.5.2 Вариативность результатов
Как показывает опыт, получение различных значений кинетических параметров по отдельным химическим веществам является очень распространенным явлением. Считается, что условия, при которых выращивают ил, а также условия, преобладающие в используемом испытании, оказывают большое влияние на получаемые значения. Один из аспектов такого непостоянства обсуждается исследователем Грейди и его соавторами [см. 30], которые предложили использовать термины "сохранившийся" (extant) и "присущий" (intrinsic) для описания двух противоположных условий, представляющих те пределы физиологического состояния, которые культуры могут обрести в ходе кинетических экспериментов. Если не допускается изменение состояния в ходе теста, то кинетические значения параметров отражают условия той среды, из которой микроорганизмы были изъяты; такие значения называют "сохранившимися" (extant) или существующими на данный момент. В противоположном случае, если условия испытания таковы, что допускается полное развитие синтезирующей протеин системы при максимально возможной скорости роста, то получаемые при этом кинетические параметры называются "присущими" (intrinsic) и зависят только от природы субстрата и от типов бактерий в культуре.
Таким образом, большое влияние на результаты оказывают условия, в которых формировался ил, а также условия исследования.
Сохранившиеся значения могут быть получены путем поддержания на низком уровне концентрации микроорганизмов в субстрате ![]() , например на уровне 0,025.
, например на уровне 0,025.
Если же концентрация высока (равна и больше 20), четко проявляются имманентные характеристики.
В обоих случаях значения должны либо равняться соответствующим значениям
(константа полунасыщения), либо превышать их.
Непостоянство и другие аспекты кинетики биоразложения обсуждались на последнем заседании SETAC [31]. Благодаря исследованиям данного вида, как проведенным, так и на стадии проекта, становится очевидной необходимость дальнейших исследований кинетики при работе установок по очистке сточных вод, что позволит улучшить интерпретацию существующих данных, а также предлагать более подходящие проекты для будущих основополагающих принципов испытаний.
Приложение В
(справочное)
Исследование при низком интервале концентрации (мкг/л)
Обычно в водной среде присутствует большое количество химических веществ, даже в сточных водах, хотя в очень низких концентрациях (мкг/л). Такие концентрации, вероятнее всего, не могут служить в качестве первичных субстратов, приводя к разрастанию, но более вероятно произойдет их распад как не разросшихся вторичных субстратов, сопутствующих множеству естественно встречаемых соединений углерода. Следовательно, распады таких химических веществ не будут соответствовать модели, описанной в приложении А. Существует множество моделей, которые могут применяться с ними в условиях, которые превалируют в системах очистки сточных вод, подходить могут сразу несколько.
Между тем может использоваться процедура, представленная в главном описании, но только для определения первичной биоразлагаемости, прибегая к подходящим низким концентрациям (менее 100 мкг/л) и сертифицированной аналитической процедуре. Процент биоразложения может быть рассчитан, только если абиотические процессы (адсорбция, летучесть и т.п.) приняты во внимание. В качестве примера может выступать исследование Найолма и его соавторов [32], [33] с использованием 4-часового цикла в системе наполнения и слива. Были обнаружены константы псевдопервого порядка для пяти химических веществ, добавленных в синтетический сток в концентрации от 5 до 10 мкг/л. (Для определения полной биоразлагаемости могут использоваться опытные вещества с меткой . Их описание выходит за рамки настоящего стандарта, поскольку пока здесь не представлены согласованные процедуры, несмотря на то что предлагаемый метод для стандарта ISO 14592 [34] содержит руководство по использованию веществ с меткой
).
В.1 Исследование SCAS
Был предложен простой двухступенчатый тест [35]-[37].
За полунепрерывным методом активного ила (SCAS) следуют краткосрочные кинетические исследования на образцах, взятых из установок SCAS.
Система SCAS работает при заданных параметрах расходования ила.
В нее подаются модифицированные сточные воды синтетического происхождения и бытовые стоки. Первые были модифицированы вследствие изменяющегося уровня рН и слабого оседания ила путем добавления фосфата в качестве амортизатора, дрожжевого экстракта, хлорида железа (III) и микропримеси солей; при этом химическая потребность в кислороде была повышена до 750 мг/л посредством увеличения концентрации пептона и мясного экстракта. Установки работают в режиме 24-часового цикла. Аэрацию проводят 23 ч. Также производится отвод отработанного ила, отстаивание, удаление веществ с поверхности. Затем следует подача стоков синтетического происхождения вместе с испытуемым веществом (до 100 мкг/л, примерно та же концентрация используется в краткосрочных исследованиях). Раз в неделю 10% ила заменяют новым илом в целях поддержания баланса микрофлоры.
До и после аэрации измеряют концентрацию тестового материала; исследование продолжается до тех пор, пока тестовый материал не будет окончательно удален. Этот процесс занимает от одной недели до нескольких месяцев.
В.2 Краткосрочное исследование
При определении (псевдо)константы скорости первого порядка для разложения тестового материала в активном иле известного, но иного происхождения, нежели исходный образец, используют краткосрочное исследование (его продолжительность может составлять, например, 8 ч).
Отборы ила производят из установок SCAS (в конце периода аэрации, когда концентрация органического субстрата находится на низком уровне) в ходе эксперимента по акклиматизации.
Для сравнения пробы ила можно взять из установки SCAS, в которую тестовый материал не подается. Смесь ила и тестового материала, добавляемого в двойной концентрации в диапазоне от 1 до 50 мкг/л, проходит аэрацию, при этом не добавляются ни сточные воды синтетического происхождения, ни иной органический субстрат. В течение максимум 24 ч через регулярные промежутки времени (например, каждый час) проводят измерения концентрации тестового материала, остающегося в растворе. Частота замеров зависит от разложимости вещества. Перед проведением анализа образцы центрифугируют.
В.3 Расчеты
Данные, полученные в ходе исследований на установках SCAS, используются для вычисления процента выведенного тестового материала. Среднюю константу (приведенная к общей норме для значений концентрации взвешенных частиц) вычисляют по формуле
![]() , (В.1)
, (В.1)
где - период аэрации (23 ч);
- концентрация вещества в конце периода аэрации (мкг/л);
- концентрация вещества перед аэрацией (мкг/л);
- концентрация твердых веществ в активном иле (г/л).
По результатам краткосрочного исследования на графике отображают зависимость концентрации вещества от времени. Наклон начальной части (10%-50% разложения) графика эквивалентен , (псевдо)константе первого порядка.
Константу приводят в соответствие с уровнем концентрации твердых веществ в иле: наклон делится на значение концентрации твердых веществ в иле.
Результаты исследования должны также включать в себя данные о начальной концентрации испытуемого вещества и взвешенных частиц, времени удержания вещества в иле, нагрузке на ил, происхождении ила, а также информацию о том, подвергался ли тестовый материал взаимодействию с другими веществами.
Непостоянство и другие аспекты кинетики биоразложения обсуждались на последнем заседании SETAC [38]. Благодаря исследованиям данного вида, как проводимым, так и на стадии проекта, становится очевидной необходимость дальнейших исследований кинетики при работе установок по очистке сточных вод, что позволит улучшить интерпретацию существующих данных, а также предлагать более подходящие проекты для будущих основополагающих принципов испытаний.
Приложение С
(справочное)
Слаборастворимые вещества, используемые в исследовании (летучие вещества)
Было опубликовано лишь малое количество отчетов, касающихся тому воздействию, что испытывают плохо растворимые и нерастворимые химические вещества в ходе тестов, моделирующих очистку сточных вод [39]-[41].*
________________
* Текст документа соответствует оригиналу. - .
С.1 Вещества, слаборастворимые в воде
Единого способа диспергирования опытного материала, подходящего для всех нерастворимых химических веществ, не существует.
Для дисперсии веществ, используемых в исследованиях, подходят два метода из четырех, описанных в [42]: использование эмульгаторов и/или ультразвука. Необходимо, чтобы эффект дисперсии сохранялся по меньшей мере в течение 24 ч. В ходе исследования рассеянные и стабилизированные вещества, находящиеся в резервуаре и постоянно перемешиваемые в нем, подают в аэротенк отдельно от сточных вод бытового (или синтетического) происхождения.
После того как дисперсии обнаружили стабильность, исследуют, как можно определить опытное вещество в диспергированной форме. Маловероятно, что метод РОУ окажется подходящим, для этого требуется установить специальный аналитический метод, который подходит для выходящих потоков, твердых веществ выходящих потоков и активного ила. Тогда поведение опытного вещества при моделировании процесса с активным илом следует изучать в жидкой и твердой фазах.
Чтобы установить, разложился ли тестовый материал, необходимо высчитать "баланс массы". Таким способом можно узнать, произошло ли начальное биологическое разложение.
Полное биологическое разложение определяют в ходе спирометрического теста на полную биологическую разложимость с использованием инокулируемого ила, подвергаемого в ходе исследования взаимодействию с тестовым материалом.
С.2 Летучие вещества
Возможность использования методов моделирования очистки сточных вод с летучими веществами является сомнительной и проблематичной. Как и в случае с плохо растворимыми опытными веществами, имеются публикации лишь только нескольких отчетов, описывающих моделирующие испытания с летучими веществами.
Принцип работы наиболее распространенного типа аппаратов полного смешивания основан на герметизации резервуаров для аэрации и отстаивания, измерении и контролировании потока воздуха при помощи расходомеров и пропускании отработанного газа через специальные уловители с целью отбора летучего органического материала.
В некоторых случаях в газохроматографических исследованиях используется вакуумный насос для подачи отработанного газа через охлаждаемую ловушку или очистной фильтр Тенакс или с силикатным гелем. Присутствие в уловителе тестового материала может быть установлено путем проведения соответствующего анализа.
Исследование проходит в два этапа. Сначала в аэротенк закачиваются стоки, содержащие синтетические отходы, вместе с тестовым материалом (но без ила). В течение нескольких дней проводят отбор и анализ воды на входе и выходе, а также отработанного газа. Полученные данные позволяют определить процент высвобожденного тестового материала ().
Затем проводят обычное биологическое исследование (с использованием ила) в условиях, идентичных тем, в которых проходила прочистка. Чтобы удостовериться в эффективности аппаратов, измеряют уровень растворенного органического углерода и химической потребности в кислороде. На первом этапе время от времени измеряют содержание тестового материала в воде на входе и выходе, а также в отработанном газе. После акклиматизации периодичность замеров возрастает. Исходя из характеристик системы на момент ее стабильного состояния, можно определить процент тестового материала, удаленного из жидкой фазы в ходе как физических, так и биологических процессов (), а также процент отфильтрованных веществ (
).
С.3 Расчеты
В ходе небиологического исследования процент тестового материала, высвобожденного из системы (), вычисляют по формуле
![]() , (С.1)
, (С.1)
где - процент испытуемого вещества, удаленного в результате улетучивания (%);
- количество испытуемого вещества, задержанного уловителями; выражается как эквивалентная концентрация в жидкой фазе (мг/л);
- концентрация испытуемого вещества в воде на входе (мг/л).
При проведении биологического исследования процент тестового материала, удаленного из системы (), вычисляют по формуле
![]() , (С.2)
, (С.2)
где - процент испытуемого вещества, удаленного в ходе биологического исследования в результате улетучивания (%);
- количество испытуемого вещества, задержанного уловителями в ходе биологического исследования; выражается как эквивалентная концентрация в сточных водах на входе (мг/л);
- концентрация испытуемого вещества в стоках на входе (мг/л).
В ходе биологического исследования процент тестового материала, удаленного в результате всех процессов (), рассчитывают по формуле
![]() , (С.3)
, (С.3)
где - концентрация тестового материала в (жидком) веществе на выходе (мг/л).
Процент вещества, удаленного в ходе биологического разложения и адсорбции (), вычисляют по формуле
![]() . (С.4)
. (С.4)
Для того чтобы определить, адсорбировалось ли испытуемое вещество, необходимо провести дополнительные исследования. Если оно адсорбировалось, можно провести уточнение/корректировку расчетов.
Сравнение пропорций тестового материала, удаленного в ходе биологического и небиологического исследования ( и
соответственно), в общих чертах характеризует эффект биологической очистки на высвобождение тестового материала в атмосферу.
Пример - Бензол
Период удержания в активном иле - 4 дня
Синтетические отходы; период удержания - 8 ч
![]() 150 мг/л
150 мг/л
=150 мг/л (
=0)
=22,5 мг/л
=22,5 мкг/л
Таким образом, =100%,
=15%,
=100%,
=85%.
(Бензол условно не адсорбировался илом)
Приложение D
(справочное)
Сопряжение испытательной установки
Для того чтобы уравнять микробные популяции в иле испытательной установки, на которую подаются сточные воды с испытуемым веществом, и в иле контрольной установки, проводят ежедневный обмен ила (методика сопряжения) [см. 43].
Сопряжение проводят с использованием установок Хасмана с активированным илом и с установками типа пористого бака [см. 44], [45].
Существенного различия в результатах при использовании сопряженных и несопряженных установок не наблюдается как в случае установок Хасмана, так и по типу пористого бака, поэтому нет необходимости в сопряжении установок.
Обмен илом может привести к видимости значительного удаления вещества. При обмене часть испытуемого вещества переносится в контрольную установку. Как следствие, его концентрации в частично очищенных сточных водах, поступающих с испытательной и контрольной установок, выравниваются. Соответственно, должны использоваться корректирующие коэффициенты, значение которых зависит от обмененной фракции и среднего времени гидравлического задержания сточных вод.
Скорректированные значения степени удаления РОУ и ХПК вычисляют по формуле
 %, (D.1)
%, (D.1)
где - скорректированное значение степени удаления РОУ или ХПК, %;
- определенное значение степени удаления РОУ или ХПК, %;
- часть объема аэротенка, подлежащего обмену;
- среднее время гидравлического задержания сточных вод, ч.
Пример - Проводят обмен половины объема аэротенка (=0,5), и среднее время гидравлического задержания сточных вод равно 6 ч, поправочная формула принимает вид
![]() . (D.2)
. (D.2)
Приложение Е
(рекомендуемое)
Расчет кинетических констант
Предположив, что кинетические закономерности Моно применимы, и приняв в расчет баланс массы активных твердых веществ и субстрата в системе активного ила, получаем формулу
![]() (Е.1)
(Е.1)
или
![]() , (E.2)
, (E.2)
где - концентрация вещества в воде на выходе (мг/л);
- константа полунасыщения, или концентрация, при которой
![]() (мг/л);
(мг/л);
- специфический уровень роста (
);
- максимальное значение
![]() ;
;
- специфическая степень разложения активных твердых веществ (
);
- среднее время удержания вещества в иле (
).
По результатам анализа данной формулы получены следующие выводы:
- концентрация вещества в воде на выходе не зависит от концентрации вещества в воде на входе (). Следовательно, степень биологического разложения изменяется вместе с концентрацией вещества в исходном материале (
);
- единственным параметром, контролируемым на станциях очистки воды и влияющим на , является время удержания вещества в иле
;
- для заданной концентрации вещества в воде на входе () существует критическое время удержания в иле, вычисляемое по формуле
![]() , (Е.3)
, (Е.3)
где - критическое время удержания в иле (если оно меньше, есть вероятность, что микроорганизмы будут вымыты).
- поскольку остальные параметры в формуле (Е.2) связаны с кинетикой роста, можно предположить, что на уровень субстрата в полученной воде и на критический период удержания оказывает влияние температура: время удержания, необходимое для достижения определенного уровня очистки, увеличивается с понижением температуры.
Исходя из баланса массы твердых веществ в системе пористого цилиндра и предполагая, что концентрация твердых веществ в воде на выходе () низкая по сравнению с концентрацией в аэрационном резервуаре (
), период удержания вещества в иле вычисляют по формулам
![]() и (Е 4)
и (Е 4)
![]() , (Е.5)
, (Е.5)
где - объем резервуара для аэрации (л);
- концентрация твердых веществ в резервуаре (мг/л);
- концентрация твердых веществ в воде на выходе (мг/л);
- скорость подачи воды на входе (л/д);
- скорость отвода отработанного ила (л/д).
Таким образом, можно контролировать период удержания вещества в иле при любой заданной величине путем контроля скорости отвода отработанного ила ().
Выводы
Главной целью исследования является прогнозирование концентрации вещества (в частности, тестового материала) в получаемой на выходе воде.
Графическое изображение и
иногда помогает легко определить критическое время удержания
(кривая 3 на рисунке Е.1).
|
Рисунок Е.1 - Три значения температуры, пять периодов удержания вещества в воде
Если это не представляется возможным, определяют * вместе с приблизительными значениями
и
путем нанесения на график значений
и
![]() .
.
________________
* Текст документа соответствует оригиналу. - .
Пересмотр формулы (Е.1) дает следующее
![]() . (Е.6)
. (Е.6)
Если значение относительно небольшое, то
![]() 1, формула (E.6) преобразуется в (E.7):
1, формула (E.6) преобразуется в (E.7):
![]() . (Е.7)
. (Е.7)
Таким образом, должна получиться прямая линия (рисунок Е.2) с наклоном и отсечением
![]() ;
; ![]() .
.
|
Рисунок E.2 - Линия регрессии, период удержания от
,
5°С
Приложение F
(рекомендуемое)
Оценка ингибирования активного ила испытуемым веществом
Химическое соединение (или сточные воды) могут не подвергаться разложению или удалению в испытании методом моделирования и даже могут оказывать ингибирующее воздействие на микроорганизмы активированного ила.
Некоторые химические соединения подвергаются биоразложению при низких концентрациях, но становятся ингибиторами при более высоких концентрациях (гормезис). Ингибирующее действие может быть обнаружено на более ранних стадиях исследования или определено в исследовании на токсичность с использованием похожего или идентичного инокулюма, что был использован в испытании моделированием [см. 46], следующими методами: подавление поглощения кислорода [см. 47] или торможение роста микроорганизмов ила [см. 48].
В испытании методом моделирования ингибирование может быть обнаружено, если разница в значениях РОУ или ХПК в частично очищенных сточных водах с испытательной и контрольной установок составляет более значения РОУ, привнесенного в качестве испытуемого вещества. Или процент удаления РОУ (БПК, ХПК и/или ![]() ) органической среды станет меньше в присутствии испытуемого вещества. В этом случае необходимо повторить испытание при уменьшении концентрации испытуемого вещества до тех пор, пока ингибирование будет отсутствоват? и, возможно, далее понижать концентрацию вещества, пока оно не будет биодеградировано. Однако, если испытуемое вещество (или сточные воды) оказывает нежелательное воздействие при всех концентрациях, это указывает на то, что вещество очень сложно или даже невозможно подвергнуть биологическому разложению. Может быть полезным повторить испытание при использовании активного ила из другого источника и/или подвергнуть ил постепенной акклиматизации.
) органической среды станет меньше в присутствии испытуемого вещества. В этом случае необходимо повторить испытание при уменьшении концентрации испытуемого вещества до тех пор, пока ингибирование будет отсутствоват? и, возможно, далее понижать концентрацию вещества, пока оно не будет биодеградировано. Однако, если испытуемое вещество (или сточные воды) оказывает нежелательное воздействие при всех концентрациях, это указывает на то, что вещество очень сложно или даже невозможно подвергнуть биологическому разложению. Может быть полезным повторить испытание при использовании активного ила из другого источника и/или подвергнуть ил постепенной акклиматизации.
Если испытуемое вещество подвергается биологическому удалению в испытании моделированием с первой попытки для того, чтобы проверить, проявляет ли оно ингибирующее воздействие, его концентрация должна быть увеличена.
При оценке ингибирования необходимо учитывать, что популяция микроорганизмов активного ила может изменяться, и со временем они могут выработать устойчивость к ингибирующему веществу.
Расчет степени ингибирования.
Процент полного удаления БПК, РОУ, ХПК и др. из испытательной и контрольной установок может быть вычислен по формуле
![]() %, (F.1)
%, (F.1)
где - концентрации БПК, РОУ, ХПК сточных вод, поступающих на очистку на контрольную и испытательную установки, мг/л;
- соответствующие концентрации частично очищенных сточных вод, мг/л.
Параметры и
для РОУ должны быть скорректированы из-за присутствия испытуемого вещества в испытательной установке, в противном случае расчеты процента ингибирования будут неверными.
Уровень ингибирования, обусловленный присутствием испытуемого материала, может быть вычислен по формуле
![]() , (F.2)
, (F.2)
где - процент удаления из контрольной установки;
- процент удаления из испытательной установки.
Библиография
[1] | Swisher R.D. Surfactant Biodegradation, 2nd Edn. Marcel Dekker Inc. New York, 1085 pp (1987) |
[2] | German Government (1962). Ordinance of the degradability of detergents in washing and cleaning agents. Bundesgesetzblatt, Pt. 1 No. 49:698-706 |
[3] | Painter H.A. and King E.F. (1978, a). WRc porous-pot method for assessing biodegradability. Technical Report No. 70, Water Research Centre, Medmenham, UK |
[4] | Painter H.A. and King E.F. (1978, b) The effect of phosphate and temperature on growth of activated sludge and on biodegradation of surfactants. Wat. Res., 12, 909-915 |
[5] | Eckenfelder W.W. (19) [to come from USEPA] |
[6] | Gerike P. and Fischer W.K. (1979). A correlation study of biodegradability determinations with various chemicals in various tests. Ecotox. Env. Saf., 3, 157-173 |
[7] | Gerike P. and Fischer W.K. (1981), as (6), II Additional results and conclusions. Ecotox. Env. Saf., 5, 45-55 |
[8] | Painter H.A. and Bealing D. (1989). Experience and data from the OECD activated sludge simulation test. pp. 113-138, In: Laboratory tests for simulation of water treatment processes. CEC Water Pollution Report 18. Eds. Jacobsen BN, Muntau, H, Angeletti,G |
[9] | OECD Test Guideline 303A, Paris (1981) |
[10] | International Organization for Standardization, ISO Standard 11,733. Evaluation of the elimination and biodegradability of organic compounds in an aqueous medium - activated sludge simulation test (1995) |
[11] | Gerike P. and Fischer W.K. (1981), as (6), II Additional result and conclusions. Ecotox. Env. Saf., 5, 45-55 |
[12] | Birch R.R. (1984). Biodegradation of noniomic surfactants. J.A.O.C.S., 61 (2) 340-343 |
[13] | Gerike P., Fischer W.K. and Holtmann W. (1980). Biodegradability determinations in trickling filter units compared with the OECD confirmatory test. Wat. Res., 14, 753-758 |
[14] | Baumann U., Kuhn G. and Benz M. (1998). Einfache Versuchsanordnung zur Gewinnung |
[15] | Her Majesty's Stationery Office (1982). Assessment of biodegradability. Methods for the examination of waters and associated materials. pp.91-98 ISBN 011 751661 9 |
[16] | ИСО 14593:1999 (ISO 14593:1999) Качество воды. Оценка способности органических соединений к полному аэробному биологическому разложению в водной среде. Метод с применением анализа неорганического углерода в герметичных сосудах |
[17] | OECD Guidelines for the Testing of Chemicals (1993). Ready Biodegradability 301 A-F |
[18] | OECD Test Guideline 303A, Paris (1981). OECD/OCDE 303 15/50 |
[19] | Gerike P. and Fischer W.K. (1981), as (6), II Additional results and conclusions. Ecotox. Env. Saf., 5, 45-55 |
[20] | Truesdale G.A., Jones K., Vandyke K.G. (1959). Removal of synthetic detergents in sewage treatment processes: Trials of a new biologically attackable material. Wat. Waste Tr. J., 7, 441-444 |
[21] | Baumann U., Kuhn G. and Benz M. (1998). Einfache Versuchsanordnung zur Gewinnung |
________________ | |
[22] | Gloyna E.F., Comstock R.F., Renn C.E. (1952). Rotary tubes as experimental trickling filters. Sewage ind. Waste, 24, 1355-1357 |
[23] | Kumke G.W., Renn C.E. (1966). LAS removal across an institutional trickling filter. JAOCS, 43, 92-94 |
[24] | Tomlinson T.G., Snaddon D.H.M., (1966). Biological oxidation of sewage by films of micro-organisms. Int.J. Air Wat. Pollut., 10, 865-881 |
[25] | Her Majesty's Stationery Office (1982). Methods for the examination of waters and associated materials. Assessment of biodegradability, 1981, London |
[26] | Her Majesty's Stationery Office (1984). Methods for the examination of waters and associated materials. Methods for assessing the treatability of chemicals and industrial waste waters and their toxicity to sewage treatment processes, 1982, London |
[27] | Birch R.R .(1982). The biodegradability of alcohol ethoxylates. XIII Jornado Com. Espanol Deterg., 33-48 |
[28] | Birch R.R. (1984). Biodegradation of nonionic surfactants. J.A.O.C.S., 61(2) 340-343 |
[29] | Birch R.R. (1991). Prediction of the fate of detergent chemicals during sewage treatment. J. Chem. Tech. Biotechnol., 50, 411-422 |
[30] | Grady C.P.L., Smets B.F. and Barbeau D.S. (1996). Variability in kinetic parameter estimates: A review of possible causes and a proposed terminology. Wat. Res., 30 (3) 742-748 |
[31] | Biodegradation kinetics: Generation and use of data for regulatory decision making (1997). Workshop at Port Sunlight, UK. Eds. Hales, SG. Feitjel T., King H., Fox K. and Verstraete W. 4-6th Sept. 1996. SETAC-Europe, Brussels |
[32] | Nyholm N., Jacobsen B.N., Pedersen B.M., Poulsen O., Dambourg A. and Schultz B. (1992). Removal of micropollutants in laboratory activated sludge reactors. Biodegradability. Wat. Res., 26, 339-353 |
[33] | Jacobsen B.N., Nyholm N., Pedersen B.M., Poulsen O., and Ostfeldt P. (1993). Removal of organic micropollutants in laboratory activated sludge reactors under various operating conditions: Sorption. Wat. Res., 27, 1505-1510 |
[34] | ISO 14592 (ISO/TC 147/ SC5/WG4, N264) (1998). Water Quality - Evaluation of the aerobic biodegradability of organic compounds at low concentrations in water |
[35] | Nyholm N., Ingerslev F., Berg U.T., Pedersen J.P. and Frimer-Larsen H. (1996). Estimation of kinetic rate constants for biodegradation of chemicals in activated sludge waste water treatment plants using short-term batch experiments and |
[36] | Berg U.T. and Nyholm N. (1996). Biodegradability simulation Studies in semi-continuous activated sludge reactors with low ( |
[37] | Danish Environmental Protection Agency. (1996). Activated sludge biodegradability simulation test. Environmental Project, No. 337. Nyholm N., Berg U.T., Ingerslev F., Min. of Env. and Energy, Copenhagen |
[38] | Biodegradation kinetics: Generation and use of data for regulatory decision making (1997). Workshop at Port Sunlight, UK. Eds. Hales, SG. Feitjel T., King H., Fox K. and Verstraete, W. 4-6th Sept. 1996. SETAC-Europe, Brussels |
[39] | Horn J.A., Moyer J.E., Hale J.H. (1970). Biological degradation of tertiary butyl alcohol. Proc. 25 |
[40] | Pitter P., Chudoba J. (1990). Biodegradability of organic substances in the aquatic environment. CRC Press. Boston, USA |
[41] | Stover E.L, Kincannon D.F. (1983). Biological treatability of specific organic compounds found in chemical industry waste waters. J. Wat. Pollut. Control Fed., 55, 97 |
[42] | ISO 10634 (1995) Water Quality - Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium |
[43] | Fischer W., Gerike P., Holtmann W. (1975). Biodegradability Determinations via Unspecifi c Analyses (Chemical Oxygen Demand, DOC) in Coupled Units of the OECD Confirmatory Test. I The test. Wat. Res., 9, 1131-1135 |
[44] | Painter H.A., Bealing D.J. (1989). Experience and Data from the OECD Activated Sludge Simulation Test. pp. 113-138. In: Laboratory Tests for Simulation of Water Treatment Processes CEC Water Pollution Report 18. Eds. Jacobsen B.N., Muntau H., Angeletti G. |
[45] | Painter H.A, King E.F. (1978). Water Research Centre Porous Pot Method for Assessing Biodegradability. Technical Report TR70, Water Research Centre, Stevenage, UK |
[46] | Reynolds L. et al. (1987). Evaluation of the toxicity of substances to be assessed for biodegradability. Chemosphere, 16, 2259 |
[47] | ИСО 8192:2007 (ISO 8192:2007) Качество воды. Испытание на ингибирование поглощения кислорода активным илом для окисления углеродистыми и аммиачными соединениями (Water quality - Test for inhibition of oxygen consumption by acivated sludge for carbonaceous and ammonium oxidation) |
[48] | ИСО 15522:1999 (ISO 15522:1999) Качество воды. Определение антикорроионного действия водных компонентов на рост микроорганизмов активированного ила (Water quality - Determination of the inhibitory effect of water constituents on the growth of acivated sludge microorganisms) |
УДК 658.382.3:006.354 | МКС 71.040.50 |
Ключевые слова: химическая продукция, воздействие на окружающую среду, окружающая среда, острая токсичность | |
Электронный текст документа
и сверен по:
, 2019