ГОСТ 32372-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЯ ПО ВОЗДЕЙСТВИЮ ХИМИЧЕСКОЙ ПРОДУКЦИИ НА ОРГАНИЗМ ЧЕЛОВЕКА
In vitro 3Т3 NRU тест на фототоксичность
Methods of testing of chemicals of health hazard. In vitro 3T3 NRU phototoxicity test
МКС 71.040.10
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным бюджетным учреждением здравоохранения "Российский регистр потенциально опасных химических и биологических веществ" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУЗ "Российский регистр потенциально опасных химических и биологических веществ" Роспотребнадзора), Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 22 ноября 2013 г. N 773-ст межгосударственный стандарт ГОСТ 32372-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 432:2004* "In vitro 3T3 NRU тест на фототоксичность" ("In vitro 3Т3 NRU phototoxicity test", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Установлено, что многие типы веществ могут индуцировать фототоксический эффект. Их общее свойство - это способность поглощать световую энергию в диапазоне солнечного излучения. В соответствии с первым законом фотохимии (закону Гротгуса-Дрейпера), фотореакции требуют достаточного поглощения световых квантов. Предполагается, что если молярная оптическая плотность/коэффициент поглощения менее чем 10 лмоль
см
, то вещество не является фотореакционным. Подобное вещество, возможно, не нужно исследовать на фототоксичность с использованием in vitro 3Т3 NRU теста или любого другого биологического теста [1].
Исследование фототоксичности in vitro 3Т3 NRU тестом позволяет прогнозировать острый фототоксический эффект в тестах in vivo на животных и человеке. Тест не позволяет прогнозировать другие неблагоприятные эффекты, которые могут возникнуть при комбинированном воздействии вещества и света, например: он не определяет фотогенотоксичность, фотоаллергическую реакцию, фотоканцерогенность и не позволяет оценивать фототоксический потенциал. Тест также не позволяет определять непрямые механизмы фототоксичности, эффекты метаболитов исследуемого вещества или эффекты смесей.
Так как до настоящего времени использование метаболизирующих систем является основным требованием всех тестов in vitro для прогноза генотоксичности и канцерогенного потенциала, применительно к фототоксикологии только в редких случаях требуются продукты метаболизма веществ для оценки фототоксического действия в опытах in vivo и in vitro. Таким образом, данный метод тестирования не является обязательным для метаболически активных систем.
1 Область применения
Настоящий стандарт устанавливает процедуру испытания химической продукции на фототоксичность методом In vitro 3Т3 NRU.
Тест на фототоксичность используется для определения фототоксического потенциала исследуемого вещества, индуцированного тестируемым веществом после экспозиции светом. Тест оценивает фотоцитотоксичность по снижению жизнеспособности клеток, подвергавшихся воздействию химического вещества в присутствии или при отсутствии света. Вещества, выявленные в данном тесте, являются фототоксичными in vivo после системного нанесения и распределения на коже или после местного нанесения.
2 Термины и определения
В настоящем стандарте применены следующие термины и обозначения с соответствующими определениями:
2.1 диапазон волн УФ излучения (UV light wavebands): Обозначения, рекомендуемые Международной комиссией по освещению (МКО), следующие: УФ А (от 315 до 400 нм), УФ В (от 280 до 315 нм) и УФ С (от 100 до 280 нм).
Примечание - Другие обозначения также используются; разделение между УФ В и УФ А часто помещается на 320 нм, и УФ А может разделяться на УФ-А1 и УФ-А2 с разделением на отметке 340 нм.
2.2 жизнеспособность клетки (cell viability): Параметр, измеряющий общую активность популяций клеток (например, поглощение витального красителя нейтрального красного (Neutral red) клеточными лизосомами), которая в зависимости от конечной точки измерения и используемой схемы эксперимента коррелирует с общим числом и/или выживаемостью клеток.
2.3 нейтральный красный: Слабый катионный краситель, который легко проникает сквозь клеточные мембраны путем недиффузионного, межклеточного накопления в лизосомах.
2.4 облучение (irradiance): Интенсивность падения на поверхность ультрафиолетового излучения или излучения видимого спектра, измеренная в Вт/м или мВт/см
.
2.5 относительная жизнеспособность клетки (relative cell viability): Жизнеспособность клетки, выраженная в отношении контроля за растворителем (отрицательного), который использовался в течение всей процедуры испытания (+Irr, -Irr), но не обрабатывался исследуемым веществом.
2.6 световая доза (dose of light): Количество (интенсивностьвремя) ультрафиолетового (УФ) или видимого излучения, падающего на поверхность и выраженного в Дж (Вт
с) на площадь поверхности, например: Дж/м
и Дж/см
.
2.7 фототоксичность (phototoxicity): Острая токсическая реакция, которая появляется после первого воздействия на кожу конкретных химических веществ и при последующей экспозиции светом, или которая вызывается также облучением кожи после системного воздействия химического вещества.
2.8 Balb/c 3Т3 клетки: Фибробласты мышей альбиносов лабораторной линии Американской коллекции типовых культур (АТСС) или Европейской коллекции клеточных культур (ЕСАСС).
2.9 : Концентрация исследуемого вещества, при которой жизнеспособность клетки снижается до 50%.
2.10 ![]() (средний фотоэффект): Значение измерения, полученное математическим анализом кривых реакций концентраций, полученных при отсутствии
(средний фотоэффект): Значение измерения, полученное математическим анализом кривых реакций концентраций, полученных при отсутствии и в присутствии
![]() нецитотоксического облучения УФ А/видимым светом.
нецитотоксического облучения УФ А/видимым светом.
2.11 (photo-Irritation-Factor): Фактор, образованный путем сравнения двух одинаково эффективных цитотоксических концентраций (
) исследуемого вещества, полученный при отсутствии
и в присутствии
![]() нецитотоксического облучения УФ А/видимого света.
нецитотоксического облучения УФ А/видимого света.
3 Принцип метода испытания
In vitro 3Т3 NRU тест по изучению фототоксичности основан на сравнении цитотоксичности химического вещества при его воздействии в условиях присутствия и отсутствия нецитотоксичной дозы имитируемого солнечного света. Цитотоксичность в данном тесте выражается как зависимое от концентрации снижение поглощения витального красителя нейтрального красного и измеряемое через 24 часа после воздействия исследуемым химическим веществом и облучением. Изменение чувствительности поверхности лизосомной мембраны ведет к лизосомной хрупкости и другим изменениям, которые постепенно становятся необратимыми. Подобные изменения вызваны воздействием ксенобиотиков, в результате которого снижается поглощение и связывание нейтрального красного. Таким образом, становится возможным отличить жизнеспособные, поврежденные или мертвые клетки, что является основой данного метода исследования.
Balb/c 3Т3 клетки выдерживают в питательной среде в течение 24 часов для формирования монослоев.
Два планшета с 96 ячейками для каждого исследуемого вещества выдерживают предварительно с восемью различными концентрациями вещества в течение часа.
Один из планшетов подвергают воздействию наивысшей нецитотоксичной дозой облучения, другой планшет оставляют в темноте. В обоих планшетах в тестируемую среду вносят культуру клеток и после следующих 24 часов инкубации по поглощению нейтрального красного определяют жизнеспособность клеток.
Жизнеспособность клеток выражается в процентах как по отношению к необработанному тестируемым веществом контролю и вычисляется для каждой тестовой концентрации.
Для определения фототоксического воздействия полученные реакции на концентрации исследуемых веществ в присутствии и при отсутствии облучения сравниваются с уровнем, полученным в эксперименте с необработанным контролем.
4 Подготовка
4.1 Клетки
Для проведения исследования рекомендуют группу клеток мышиного фибробласта, Balb/c 3Т3, клон 31 или другие клетки и клеточные линии, если условия культивирования клеток адаптированы для их специфических потребностей.
Клетки регулярно проверяют на отсутствие загрязнения микоплазмой и используют, только если загрязнение не выявлено.
Регулярно проверяют УФ чувствительность клеток.
Используют Balb/c 3Т3 клетки самого низкого пересева, предпочтительно менее 100, так как УФ А чувствительность клеток возрастает с числом пересевов.
4.2 Среда и питательные условия
При обычном пересеве и во время процедуры эксперимента используют соответствующие условия питательной среды и условия инкубации.
Пример - для Balb/c 3Т3 клеток используют среду DMЕМ (питательная среда для клеток млекопитающих) с добавлением 10% сыворотки крови новорожденных телят, 4 ммоль глутамина, пенициллин (100 ME), стрептомицин (100 мг/мл) и влажную инкубацию при 37°С, от 5,0% до 7,5% СО в зависимости от буферного раствора.
Питательная среда должна обеспечивать нормальную продолжительность клеточного цикла или используемой клеточной линии.
4.3 Культура
Клетки из замороженных чистых культур высевают на питательную среду с определенной плотностью и пересевают как минимум один раз перед использованием.
Культуры не должны сливаться до конца исследования (на момент определения клеточной жизнеспособности, определяемой через 48 часов после посева).
Пример - для Balb/c 3Т3 клеток, растущих в планшете с 96 ячейками, рекомендуемая плотность посева составляет 110
клеток на ячейку.
Для каждого исследуемого вещества клетки высевают в два отдельных планшета с 96 ячейками, которые затем используют параллельно в течение всего эксперимента при одинаковых условиях культивирования, исключая период времени, когда один из планшетов облучают ![]() , а другой держат в темноте
, а другой держат в темноте .
4.4 Исследуемое вещество
Тестируемый раствор должен быть приготовлен непосредственно перед использованием.
Рекомендуется использовать химические вещества и проводить первоначальную обработку клеток при световых условиях, которые позволят избежать фотоактивации или деградации исследуемого вещества до облучения.
Исследуемые вещества должны быть растворены в соленом буферном растворе, например, в сбалансированном солевом растворе Эрла (EBSS) или в других физиологически сбалансированных солевых растворах, которые не должны содержать протеиновых компонентов, компонентов, поглощающих свет (например, красителей - индикаторов рН и витаминов) во избежание помех во время облучения.
Во время облучения необходимо избегать защелачивания, так как клетки выдерживают в течение примерно 50 минут вне инкубатора. При использовании слабых буферов, таких как EBSS, это может достигаться путем инкубации клеток при 7,5%
. Если клетки инкубируют в 5%
, то должен быть использован более сильный буфер.
Для тестирования веществ, имеющих плохую растворимость в воде, необходимо их растворить в соответствующем растворителе. Если используют растворитель, то он должен присутствовать в постоянном объеме во всех культурах, в том числе в отрицательном контрольном эксперименте (с растворителем), так же как и во всех концентрациях исследуемого вещества, и не должен быть цитотоксичным в данной концентрации. Исследуемые концентрации веществ должны быть подобраны так, чтобы избежать образования осадка или помутнения раствора.
Рекомендуется использовать в качестве растворителей диметилсульфоксид (DMSO), этанол (ЕtOН) и другие растворители с низкой цитотоксичностью. Перед использованием необходимо провести оценку специфических свойств растворителей.
Пример - реакции с исследуемым веществом, гашение цитотоксического эффекта, радикальное вымывание и/или химическая устойчивость в растворителе.
Для увеличения растворимости можно использовать вихревое перемешивание, и/или обработку ультразвуком, и/или нагревание до необходимых температур, при условии, что это не повлияет на стабильность химического вещества.
5 Процедура испытания
5.1 Условия облучения
5.1.1 Источник света
Для фототоксических реакций in vivo используют свет УФ А или свет видимого спектра.
Свет УФ В не используют из-за высокой цитотоксичности, увеличивающейся в 1000 раз, при изменении длины волны от 313 до 280 нм.
Источник света должен излучать длины волн, поглощаемые исследуемым веществом (абсорбционный спектр).
Доза света (достижимая в необходимое время экспозиции) должна быть достаточной для определения известных фотоцитотоксичных веществ. Длины волн и задействованные дозы не должны быть чрезмерно разрушительными для тест-системы.
Оптимальным искусственным источником света является модель солнечного света. Мощность распределения излучения должна быть близка дневному свету в соответствии с [2].
В качестве модели солнечного света используют ксеноновую дугу и активированную ртутногалогенную лампу, которая выделяет меньше тепла и является более дешевой, но имеет менее полное соответствие солнечному свету по сравнению с ксеноновой дугой.
Для всех источников должны быть подобраны подходящие фильтры для ослабления сильного цитотоксичного УФ В излучения.
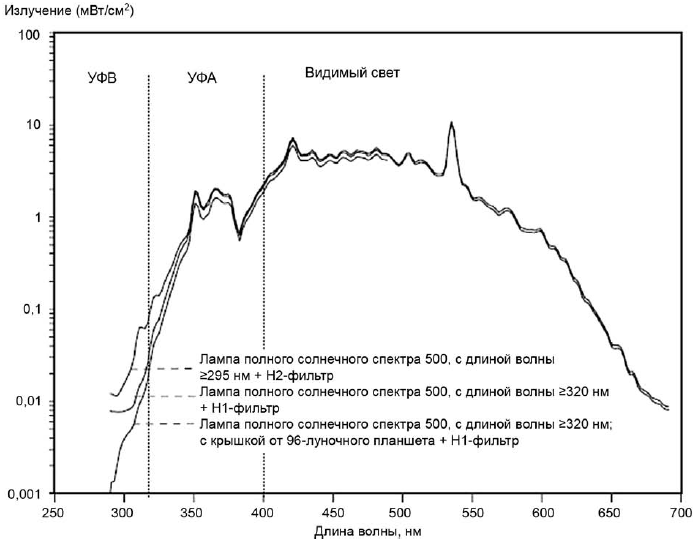
Спектр измеряют через крышку для пластины того же типа, что используют в эксперименте.
Спектр, зарегистрированный с фильтрами или фильтрующими эффектами оборудования, не должен сильно отличаться от стандартного дневного света в соответствии с [2].
Пример спектрального распределения излучения солнечного имитатора, используемого на подтверждающей стадии in vitro 3Т3 NRU теста на фототоксичность, приведен на рисунке 1.
|
Рисунок 1 - Спектральное распределение излучения солнечного имитатора
5.1.2 Дозиметрия
Интенсивность света (облучения) проверяют перед каждым экспериментом на фототоксичность с использованием соответствующего широкодиапазонного УФ-измерителя. Интенсивность должна измеряться через тот же тип крышки 96-луночного планшета, который будет использоваться в эксперименте. УФ-измеритель должен быть откалиброван для источника. Характеристики УФ-измерителя должны быть проверены, для этой цели рекомендуется использовать второй, стандартный УФ-измеритель того же типа с идентичной калибровкой (например, спектрорадиометр).
Дозу облучения выбирают таким образом, чтобы выбранная доза не была опасной для клеток, но в то же время была достаточна для инициирования стандартных фототоксинов. Время экспозиции вычисляют по формуле (1).
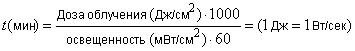 . (1)
. (1)
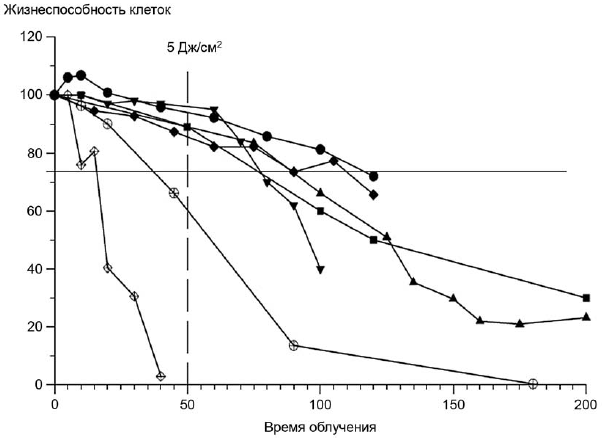
Пример - Для клеток Balb/c 3Т3 доза в 5 Дж/см (измеренная в УФ А спектре) была определена, как нетоксичная и достаточная для стимуляции фототоксической реакции, для достижения 5 Дж/см
в течение 50 мин, излучение должно составлять 1,7 мВт/см
, рисунок 2.
|
Рисунок 2 - Чувствительность клеток Balb/c 3Т3 к облучению (в диапазоне УФА)
5.2 Условия проведения эксперимента
5.2.1 Концентрации исследуемых веществ
Должен быть определен диапазон концентраций исследуемого вещества в присутствии ![]() и при отсутствии
и при отсутствии света.
Рекомендуется определить растворимость в начале эксперимента и на 60-й минуте (или на то время обработки, которое будет использоваться), так как растворимость может изменяться во времени и в течение экспозиции.
Чтобы избежать токсичности, вызываемой экстремальными значениями рН, рН клеточных культур с добавленным исследуемым веществом должен находиться в диапазоне от 6,5 до 7,8.
Наибольшая концентрация исследуемого вещества должна соответствовать физиологическим условиям эксперимента, то есть необходимо избегать осмотического и рН стресса.
В зависимости от исследуемого вещества может потребоваться оценка других физико-химических свойств как факторов, лимитирующих высокие концентрации.
Малорастворимые вещества, которые не являются токсичными в концентрациях в точке насыщения, должны быть исследованы при максимально достижимых концентрациях.
Следует избегать выпадения в осадок химического вещества при любой концентрации. Максимальная концентрация исследуемого вещества не должна превышать 1000 мкг/мл; осмотическая концентрация не должна превышать 10 ммоль. Используют геометрическую серию разведений из восьми концентраций исследуемого вещества с постоянным фактором разбавления.
Если существуют данные (из эксперимента по определению диапазона), что исследуемое вещество не является цитотоксичным вплоть до пороговой концентрации в темноте , но высокоцитотоксично при облучении
![]() , диапазоны концентраций, выбранные для
, диапазоны концентраций, выбранные для ![]() исследования, могут отличаться от выбранных в
исследования, могут отличаться от выбранных в исследовании для выполнения требования об адекватном качестве данных.
5.2.2 Контрольные эксперименты
5.2.2.1 Чувствительность клеток к облучению, установленная на основе литературных данных
Клетки необходимо регулярно проверять (во время каждого пятого пересева) на их чувствительность к источнику света путем оценки их жизнеспособности после экспозиции возрастающих доз облучения. Должны быть использованы дозы облучения, включая уровни, значительно превышающие те, которые применялись в ходе эксперимента. Данные дозы легко определяются измерениями УФ части источника света.
Клетки высевают с плотностью, как в in vitro 3Т3 NRU тесте на фототоксичность, и облучают на следующий день. Клеточная жизнеспособность затем определяется спустя один день с использованием теста по поглощению нейтрального красного. Должно быть показано, что наибольшей результирующей нецитотоксичной дозы (например, в подтверждающей стадии: 5 Дж/см УФ А) достаточно для корректной классификации стандартного вещества.
5.2.2.2 Чувствительность к облучению, проверка текущего теста
Необходимо провести качественную оценку, если отношение необлученных клеток к растворителю в контроле показывает жизнеспособность более 80% по сравнению с необлученной культурой.
5.2.2.3 Жизнеспособность контроля с растворителем
Абсолютная оптическая плотность (![]() ) нейтрального красного, экстрагированного из контрольного раствора, показывает, выросли ли 1
) нейтрального красного, экстрагированного из контрольного раствора, показывает, выросли ли 110
клетки на ячейку с нормальным временем удвоения во время двухдневного эксперимента. Тест необходимо оценить по критериям входного контроля, если средняя
![]() необлученного контроля составляет
необлученного контроля составляет 0,4.
5.2.2.4 Положительный контроль
Вещество с известными фототоксическими свойствами должно быть исследовано параллельно в каждом in vitro 3Т3 NRU тесте на фототоксичность. Рекомендуется использовать хлорпромазин ().
исследовали в стандартном протоколе в in vitro 3Т3 NRU тесте на фототоксичность. Был определен следующий критерий входного контроля: облученный
![]() :
: = от 0,1 до 2,0 мкг/мл, необлученный
![]() :
: = от 7,0 до 90,0 мкг/мл. Фактор облучения (
) должен быть больше шести.
Другие фототоксичные вещества, относящиеся к тому же химическому классу или показателям растворимости, что и вещество, подлежащее оценке, могут использоваться для параллельного положительного контроля вместо хлорпромазина.
5.3 Выполнение эксперимента
5.3.1 Первый день
Поместить по 100 мкл питательной среды в периферийные ячейки 96-луночного планшета микротитратора. В оставшиеся лунки поместить по 100 мкл клеточной суспензии по 110
клеток/мл в питательной среде (равно 1
10
клеток/лунка). Для каждой серии концентраций исследуемого вещества следует подготовить по два планшета, а также для контрольного теста с растворителем и положительного контроля.
Инкубацию культуры продолжают в течение 24 часов до тех пор, пока они не образуют полунепрерывный монослой. Данный инкубационный период позволяет использовать восстановление клеток, адгезию и экспоненциальный рост.
5.3.2 Второй день
После инкубации следует отделить клетки от питательной среды и тщательно промыть 150 мкл буферного раствора, используемого для инкубации. Добавьте 100 мкл буфера, содержащего необходимую концентрацию исследуемого вещества или растворителя. Используйте восемь различных концентраций исследуемого вещества. Инкубируйте клетки с исследуемым веществом в темноте в течение 60 минут.
Из двух планшетов, приготовленных для каждой серии концентраций исследуемого вещества и контрольного теста, выбирается случайным образом один для определения цитотоксичности ![]() (например, контрольный планшет) и один (планшет исследования) для определения фотоцитотоксичности
(например, контрольный планшет) и один (планшет исследования) для определения фотоцитотоксичности ![]() .
.
Для проведения экспозиции, клетки облучают при комнатной температуре в течение 50 минут через крышку 96-луночного планшета наибольшей дозой облучения, которая не является цитотоксичной. Следует выдержать необлученные планшеты
![]() при комнатной температуре в темноте в течение 50 мин (время экспозиции света).
при комнатной температуре в темноте в течение 50 мин (время экспозиции света).
Необходимо отделить тестовый раствор и дважды тщательно промыть 150 мкл буферного раствора, используемого при инкубации, но не содержащего исследуемое вещество. Следует отделить буфер с питательной средой и инкубировать в течение от 18 до 22 часов.
5.3.3 Третий день
5.3.3.1 Микроскопическая оценка
В клетках необходимо исследовать развитие, морфологию и целостность монослоя с использованием фазово-контрастной микроскопии. Изменения в клеточной морфологии и явления клеточного роста должны быть зафиксированы.
5.3.3.2 Тест на захват нейтрального красного
Следует промыть клетки 150 мкл теплого буферного раствора, аккуратно слить промывочный раствор, добавить 100 мкл в концентрации 50 мкг/мл нейтрального красного (NR) (3-амино-7-диметиламино-2-метилфеназин гидрохлорид, номер ЕС 209-035-8, номер CAS 553-24-2, CI 50040) в среду без сыворотки и выдерживать в течение трех часов. После инкубации необходимо удалить среду NR и промыть клетки 150 мкл буферного раствора, затем отфильтровать и удалить избыточный буферный раствор промоканием или центрифугированием.
Следует добавить точно 150 мкл десорбирующего NR свежеприготовленного раствора (49 частей воды + 50 частей этанола + одну часть уксусной кислоты).
Необходимо аккуратно встряхивать планшет в качалке в течение 10 минут до тех пор, пока NR не экстрагируется из клеток и не образует гомогенный раствор.
Затем проводят измерение оптической плотности экстракта NR при 540 нм в спектрофотометре, используя пустые ячейки, как контроль.
6 Данные
6.1 Качество и количество данных
Экспериментальные данные должны позволять проводить значимый анализ доза - ответ, полученный в присутствии и при отсутствии облучения, и, если возможно, концентрации исследуемого вещества, при которой клеточная жизнеспособность снижается до 50% (). Если обнаружена цитотоксичность, то и диапазон концентраций, и шаг индивидуальных концентраций должны устанавливаться таким образом, чтобы кривая соответствовала экспериментальным данным.
Как для явно положительных, так и для явно отрицательных результатов основной эксперимент, поддерживаемый одним или несколькими экспериментами по подбору диапазона доз, может быть достаточным.
Сомнительные, пограничные или нечеткие результаты должны быть разъяснены в дальнейшем исследовании. В подобных случаях должно быть рассмотрено изменение экспериментальных условий. Экспериментальные условия, которые могут быть изменены, включают диапазон концентраций, прединкубационное время, время экспозиции облучения. Меньшее время экспозиции может быть необходимо для нестабильных в воде веществ.
6.2 Оценка результатов
Для возможности оценки результатов могут быть вычислены фотосенсибилизирующий фактор облучения () или средний эффект облучения (
).
Для расчета меры фототоксичности набор дискретных величин зависимости доза - ответ должен быть аппроксимирован соответствующей непрерывной кривой доза - ответ. Подбор кривой для данных часто выполняется нелинейным регрессионным анализом. Для оценки влияния разнообразия данных на подобранную кривую рекомендуется проводить процедуру ступенчатого перехода.
Фотосенсибилизирующий фактор облучения () рассчитывается по формуле (2).
![]() . (2)
. (2)
Если показатель в присутствии или при отсутствии света не может быть вычислен, то для исследуемого вещества не может быть определен
. Средний эффект облучения (
) основан на сравнении полный кривых доза - ответ. Он определяется как средневзвешенное значение из представительной выборки значений фотоэффекта (3).
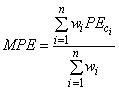 . (3)
. (3)
Фотоэффект для любой концентрации
определяется как произведение эффекта ответа
и эффекта дозы
, например
![]() . Эффект ответа определяется, как разница между эффектами, наблюдаемыми в присутствии и при отсутствии света, например
. Эффект ответа определяется, как разница между эффектами, наблюдаемыми в присутствии и при отсутствии света, например ![]() . Эффект дозы рассчитывается по формуле (4).
. Эффект дозы рассчитывается по формуле (4).
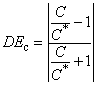 , (4)
, (4)
где представляет эквивалентную концентрацию, например, концентрацию, при которой ответ
равен ответу
при концентрации
.
Если не может быть определена, поскольку величины ответов на кривой
систематически выше или ниже, чем
![]() , эффект дозы принимается за единицу. Весовой коэффициент
, эффект дозы принимается за единицу. Весовой коэффициент дается по максимальной величине ответа, например
![]() . Сетка концентраций
. Сетка концентраций выбрана таким образом, что одинаковое количество точек попадало в каждый интервал концентраций, определенных величинами концентраций в эксперименте. Вычисление
ограничено максимальными величинами концентраций, при которых как минимум, одна из двух кривых представляет величину ответа как минимум 10%. Если данная максимальная концентрация выше, чем наибольшая концентрация, используемая в
эксперименте, остаточная часть
кривой устанавливается на величине ответа "0". В зависимости от того, больше ли фактор
, чем выбранная пороговая величина (
![]() =0,15) или нет, вещество классифицируется, как фототоксичное.
=0,15) или нет, вещество классифицируется, как фототоксичное.
6.3 Интерпретация результатов
На основании контрольного теста исследуемое вещество с <2 или
<0,1 определяют как "нефототоксичное".
>2 или <5 или
>0,1 или <0,15 считают как: "возможно фототоксичное"; и
>5 или
>0,15 считают "фототоксичным".
Для любой лаборатории, впервые проводящей данное исследование, до исследования тестовых веществ на фототоксичность должны быть протестированы стандартные вещества, приведенные в таблице 1. Величины и
должны быть близки к величинам, указанным в таблице 1.
Таблица 1 - Стандартные вещества
Химическое наименование | Номер | Номер CAS |
| Абсорб- | Растворитель | |
Амиодарон | 243-293-2 | 19774-82-4 | >3,25 | 0,2-0,54 | 242 нм | Этанол |
Хлопромазин | 200-701-3 | 69-09-0 | >14,4 | 0,33-0,63 | 309 нм | Этанол |
Норфлоксацин | 274-614-4 | 70458-96-7 | >71,6 | 0,34-0,90 | 316 нм | Ацетонитрил |
Антрацен | 204-371-1 | 120-12-7 | >18,5 | 0,19-0,81 | 356 нм | Ацетонитрил |
Протопорфирин, двунатриевый | 256-815-9 | 50865-01-5 | >45,3 | 0,54-0,74 | 402 нм | Этанол |
Гистидин | 7006-35-1 | нет | 0,05-0,10 | 211 нм | Вода | |
2,2 цис-метиленбис (3,4,6-трихлорфенол) | 200-733-8 | 70-30-4 | 1,1-1,7 | 0,00-0,05 | 299 нм | Этанол |
Лаурилсульфат натрия | 205-788-1 | 151-21-3 | 1,0-1,9 | 0,00-0,05 | нет абсорбции | вода |
| ||||||
6.4 Интерпретация данных
Если фототоксический эффект наблюдается только при высоких исследуемых концентрациях (особенно для веществ, растворимых в воде), для оценки воздействия могут понадобиться дополнительные исследования. Они могут включать в себя данные о кожной абсорбции и аккумуляции вещества в коже и/или данные других исследований, например, in vitro тестирование вещества на коже животных или человека или кожных моделях.
Если токсичность не проявляется ( и
) и если плохая растворимость ограничивает концентрации, которые могут быть исследованы, тогда данный эксперимент не подходит для данного вещества и должны быть проведены подтверждающие исследования с использованием другой модели.
7 Подготовка отчета
7.1 Отчет о проведении исследования
Отчет о проведении исследования должен содержать следующую информацию:
Исследуемое вещество:
- идентификационные данные, наименование класса веществ, наименование по IUPAC, номер CAS (если известно);
- физические свойства, чистота;
- физико-химические свойства, имеющие значение при проведении эксперимента;
- УФ/видимый абсорбционный спектр;
- устойчивость и фотоустойчивость (если известно).
Растворитель:
- обоснование выбора растворителя;
- растворимость исследуемого вещества в данном растворителе;
- содержание растворителя в тестовой среде.
Клетки:
- тип и источник клеток;
- отсутствие микоплазмы;
- количество клеточных пассажей, если известно;
- клеточная чувствительность к облучению, определенная с помощью оборудования, используемого в in vitro 3Т3 NRU тесте на фототоксичность.
Условия проведения эксперимента, инкубация до и после обработки:
- тип и состав среды культуры;
- условия инкубации (концентрация , температура, влажность);
- продолжительность инкубации (до и после обработки).
Условия проведения эксперимента, обработка химическим веществом:
- логическое обоснование выбора концентраций исследуемого химического вещества, используемого в присутствии и при отсутствии облучения;
- в случае ограниченной растворимости исследуемого вещества и при отсутствии цитотоксичности: логическое обоснование для использования более высоких концентраций;
- тип и состав среды (соляной буферный раствор);
- продолжительность химической обработки.
Условия проведения эксперимента, облучение:
- логическое обоснование выбора источника света;
- производитель и тип источника света и радиометра;
- спектральные характеристики излучения источника света;
- пропускная и поглощательная способность используемых фильтров;
- характеристики радиометра, описание процедуры калибровки;
- расстояние между источником света и тестовой системой;
- УФ А излучение на данном расстоянии, мВт/см;
- продолжительность экспозиции УФ/видимого света;
- доза УФ А (облучениевремя), Дж/см
;
- температура клеточной культуры во время облучения и клеточной культуры, параллельно содержащейся в темноте.
Условия проведения эксперимента, тест на жизнеспособность с нейтральным красным:
- состав среды нейтрального красного;
- продолжительность инкубации нейтрального красного;
- инкубационные условия (концентрация , температура, влажность);
- условия экстракции нейтрального красного (экстрагент, продолжительность);
- длина волны для спектрофотометрического измерения оптической плотности нейтрального красного;
- вторая длина волны (стандартная), при необходимости;
- содержание результатов спектрофотометрии, при необходимости.
Результаты:
- клеточная жизнеспособность при каждой концентрации исследуемого вещества, выраженная в процентах от среднего значения жизнеспособности в параллельных контрольных тестах с растворителем;
- кривые концентрация - ответ (концентрация вещества в зависимости от соответствующей клеточной жизнеспособности), полученные в параллельных и
экспериментах;
- анализ кривых концентрация - ответ: если возможно, расчет значений ![]() и
и ![]() ;
;
- сравнение двух кривых концентрация - ответ, полученных в присутствии и при отсутствии облучения путем вычисления ингибирующего фактора облучения () или среднего эффекта облучения (
);
- критерий приемлемости результатов; параллельный контрольный тест с растворителем;
- абсолютная жизнеспособность (оптическая плотность экстракта нейтрального красного) облученных и необлученных клеток;
- литературные отрицательные данные и данные контрольного теста с растворителем, средние значения и стандартные отклонения;
- критерий приемлемости результатов, параллельный положительный контрольный тест;
- ![]() и
и ![]() и
и ![]() положительного контрольного вещества;
положительного контрольного вещества;
- литературные положительные данные для контрольного вещества: ![]() и
и ![]() и
и ![]() , средние значения и стандартные отклонения.
, средние значения и стандартные отклонения.
Обсуждение результатов.
Выводы.
Библиография
[1] Руководящий документ ОЭСР Test N 432 "In vitro 3Т3 NRU phototoxicity test"
[2] ISO 18909:2006/Cor 1:2006 Фотография. Обработанные цветные фотопленки и фотоснимки. Методы измерения устойчивости изображения. Техническая поправка 1
[3] Lovell W.W. (1993). A scheme for in vitro screening of substances for photoallergenic potential. Toxic. In Vitro 7: 95-102.
[4] Santamaria, L. and Prino, G. (1972). List of the photodynamic substances. In "Research Progress in Organic, Biological and Medicinal Chemistry" Vol. 3 part 1. North Holland Publishing Co. Amsterdam, p.XI-XXXV.
[5] Spielmann, H., Lovell, W.W., , E., Johnson, B.E., Maurer, Т., Miranda, M.A., Pape, W.J.W., Sapora, O., and Sladowski, D. (1994). In vitro phototoxicity testing: The report and recommendations of ECVAM Workshop 2. ATLA, 22, 314-348.
[6] Spikes, J.D. (1989). Photosensitization. In "The science of Photobiology" Edited by K.C. Smith. Plenum Press, New York. 2nd edition, p.79-110.
[7] OECD (1997) Environmental Health and Safety Publications, Series on Testing and Assessment No. 7 "Guidance Document On Direct Phototransformation Of Chemicals In Water" Environment Directorate, OECD, Paris.
[8] Spielmann, H., Balls, M., , В.,
![]() , H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, Т., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793-796.
, H.G., Kalweit, S., Klecak, G., L'Eplattenier, H., Liebsch, M., Lovell, W.W., Maurer, Т., Moldenhauer. F. Moore. L., Pape, W., Pfannbecker, U., Potthast, J., De Silva, O., Steiling, W., and Willshaw, A. (1994). EEC/COLIPA project on in vitro phototoxicity testing: First results obtained with a Balb/c 3T3 cell phototoxicity assay. Toxic. In Vitro 8, 793-796.
[9] Anon (1998). Statement on the scientific validity of the 3T3 NRU PT test (an in vitro test for phototoxicity), European Commission, Joint Research Centre: ECVAM and DGXI/E/2, 3 November 1997, ATLA, 26, 7-8.
[10] Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., Pechovitch, G. De Silva, O., ![]() , H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, Т., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305-327.
, H.G., Clothier, R., Desolle, P., Gerberick, F., Liebsch, M., Lovell, W.W., Maurer, Т., Pfannenbecker, U., Potthast, J. M., Csato, M., Sladowski, D., Steiling, W., and Brantom, P. (1998). The international EU/COLIPA In vitro phototoxicity validation study: results of phase II (blind trial), part 1: the 3T3 NRU phototoxicity test. Toxic. In Vitro 12, 305-327.
[11] OECD (2002) Extended Expert Consultation Meeting on The In Vitro 3T3 NRU Phototoxicity Test Guideline Proposal, Berlin, 30th-31st October 2001, Secretariat's Final Summary Report, 15th March 2002, OECD ENV/EHS, available upon request from the Secretariat.
[12] Borenfreund, E., and Puerner, J.A. (1985). Toxicity determination in vitro by morphological alterations and neutral red absorption. Toxicology Lett., 24, 119-124.
[13] Hay, R.J. (1988) The seed stock concept and quality control for cell lines. Analytical Biochemistry 171, 225-237.
[14] Lambert L.A., Wamer W.G., and Kornhauser A. (1996) Animal models for phototoxicity testing. In "Dermatotoxicology", edited by F.N. Marzulli and H.I. Maibach. Taylor & Francis, Washington DC. 5th Edition, p.515-530.
[15] Tyrrell R.M., Pidoux M (1987) Action spectra for human skin cells: estimates of the relative cytotoxicity of the middle ultraviolet, near ultraviolet and violet regions of sunlight on epidermal keratinocytes. Cancer Res., 47, 1825-1829.
[16] ISO 10977. (1993). Photography - Processed photographic colour films and paper prints - Methods for measuring image stability.
[17] Sunscreen Testing (UV.B) TECHNICALREPORT, CIE, International Commission on lllumnation, Publication No. 90, Vienna, 1993, ISBN 3 900 734 275.
[18] ZEBET/ECVAM/COLIPA - Standard Operating Procedure: In Vitro 3T3 NRU Phototoxicity Test. Final Version, 7 September, 1998. 18 pgs.
[19] Spielmann, H., Balls, M., Dupuis, J., Pape, W.J.W., De Silva, O., ![]() , H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 7617681 EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679-708.
, H.G., Gerberick, F., Liebsch, M., Lovell, W.W., and Pfannenbecker, U. (1998) A study on UV filter chemicals from Annex VII of the European Union Directive 7617681 EEC, in the in vitro 3T3 NRU phototoxicity test. ATLA 26, 679-708.
[20] ![]() , H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127-138.
, H.G., and Quedenau, J. (1995) Mathematical modeling of cellular responses to external signals. J. Biol. Systems 3, 127-138.
[21] ![]() , H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445462
, H.G. (1997). A general measure of in vitro phototoxicity derived from pairs of dose-response curves and its use for predicting the in vivo phototoxicity of chemicals. ATLA, 25, 445462
УДК 658.382.3:006.354 | МКС 71.040.10 |
Ключевые слова: химическая продукция, воздействие на организм человека, метод испытаний, фототоксичность | |
Электронный текст документа
и сверен по:
, 2019