ГОСТ 32290-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение биоразлагаемости по угнетению потребления кислорода активным илом
Methods of testing the chemicals of environmental hazard. Determination of biodegradability on inhibition of oxygen consumption by actirated sludge
МКС 71.040.50
Дата введения 2014-08-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский центр стандартизации, информации и сертификации сырья, материалов и веществ" (ФГУП "ВНИЦСМВ") на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 28 августа 2013 г. N 58-П)
За принятие проголосовали:
Краткое наименование страны | Код страны | Сокращенное наименование национального органа по стандартизации |
Азербайджан | AZ | Азстандарт |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
Украина | UA | Минэкономразвития Украины |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 28 августа 2013 г. N 782-ст межгосударственный стандарт ГОСТ 32290-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 августа 2014 г.
5 Настоящий стандарт идентичен международному документу OECD, Test N 209* "Активированный ил, тест на угнетение поглощения (окисление углерода и аммония)" ["Activated Sludge, Respiration Inhibition Test (Carbon and Ammonium Oxidation)"], IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Цель теста - предложить вниманию быстрый скрининговый метод оценки действия веществ на микроорганизмы активного ила станций биологической (аэробной) очистки сточных вод. Результаты теста могут также служить индикатором соответствующих неингибирующих концентраций тестируемого вещества, которые будут использоваться в тестах определения биоразлагаемости. В этом случае тест может использоваться в качестве скринингового метода, подобно методам определения средних или предельных концентраций, имея в виду только полное дыхание. Эта информация должна использоваться с осторожностью в тестах по оценке биоразложения микроорганизмами, для которых концентрация посевного материала значительно ниже чем та, которая применяется в настоящем стандарте. Отсутствие ингибирования дыхания в данном стандарте не приводит автоматически к неингибирующим условиям в тесте на биоразлагаемость микроорганизмами серии TG 301 или TG 310.
Тест на ингибирование дыхания в большинстве случаев может быть успешно применен, но иногда он дает ошибочные результаты [1]. Отношение концентрации к кривой дыхания может быть двухфазным, в этом случае график доза - ответ искажается и величина получается неожиданно низкой. Исследования показали, что такие результаты получаются тогда, когда активный ил, используемый в тестах на нитрификацию, имеет большее значение окисления аммонийного иона, чем при общем гетеротрофном окислении. Эти ошибочные результаты могут быть исправлены с помощью дополнительного тестирования с использованием ингибиторов нитрификации. Измеряя потребление кислорода в присутствии или в отсутствии такого ингибитора, как, например, аллилтиомочевина (ATU) (CAS 109-57-9), при измерении общего, гетеротрофного и нитратного кислорода могут быть получены корректные данные [1]. Таким образом, ингибирующие эффекты тестируемого вещества в двух процессах и
для окисления органического углерода (гетеротрофный процесс) и аммонийного азота (нитрификация) могут быть определены обычным способом. Нужно отметить, что в редких случаях ингибирующий эффект аллилтиомочевины может быть частично или полностью аннулирован в результате образования комплексных соединений с тестируемыми веществами или компонентами среды, например ионами меди. Ионы меди необходимы для Nitrosomonas, но являются токсичными в высокой степени концентрации.
Потребность в нитрификации при аэробной очистке сточных вод как необходимый этап в удалении азота путем денитрификации до газообразных продуктов ощущается в настоящее время особенно в европейских странах. В Европейском союзе установлен нижний предел концентрации азота в очищенных сточных водах, сбрасываемых в водоем.
В большинстве случаев достаточно применения одного лишь метода оценки эффекта окисления органического углерода. Однако иногда исследование эффекта нитрификации или нитрификации и окисления органического углерода необходимо для интерпретации результатов эксперимента.
1 Область применения
Настоящий стандарт применяет метод определения эффекта воздействия химического вещества на микроорганизмы активного ила (в основном бактерии) измерением величины дыхания (окисление углерода и (или) иона аммония) при определенных условиях в присутствии различных концентраций тестируемого вещества.
2 Термины и определения
В настоящем стандарте применены термины с соответствующими определениями.
2.1 NOEC (неэффективная наблюдаемая концентрация): Самая высокая известная концентрация тестируемого вещества в тесте, при которой не наблюдается статистически значимого смертельного или другого эффекта. В этом стандарте концентрация, соответствующая NOEC, не имеет никакого статистически значимого эффекта (0,05) в пределах данного периода экспозиции по сравнению с контролем.
2.2 (эффективная концентрация для
%): Концентрация, которая вызывает эффект на
% тестируемых организмов в пределах данного периода экспозиции по сравнению с контролем. Например,
- концентрация, которая вызвала эффект на 50% популяции в определенный период экспозиции.
3 Принцип теста
3.1 Основные положения
3.1.1 Скорость дыхания образцов активного ила, питаемого синтетическими сточными водами, измеряется в закрытой емкости с кислородным электродом после 3-часовой экспозиции. При рассмотрении более реалистичного сценария воздействия исследуемого вещества время инкубации может быть увеличено. Если тестируемое вещество быстро разлагается абиотически, например посредством гидролиза, или оно летуче и невозможно поддерживать необходимую концентрацию, то дополнительно может использоваться более короткий период экспозиции, например 30 мин. Чувствительность каждой партии активного ила должна быть проверена с помощью соответствующих референтных веществ в день проведения теста. Тест обычно используется для того, чтобы определить (например,
) тестируемого вещества и (или) неэффективную наблюдаемую концентрацию (NOEC).
3.1.2 Возможно раздельно определить ингибирование потребления кислорода микроорганизмами, окисляющими органический углерод и тот же параметр для микроорганизмов, окисляющих аммонийный ион, выражая его как степень потребления кислорода в присутствии или в отсутствии аллилтиомочевины, избирательного ингибитора первого этапа окисления аммония в нитриты бактериями-нитрификаторами. В этом случае процент ингибирования потребления кислорода рассчитывают путем сравнения скорости потребления кислорода в присутствии тестируемого вещества с уровнем потребления кислорода в контроле, не содержащем тестируемое вещество в присутствии или в отсутствии ингибитора аллилтиомочевины.
3.1.3 Скорость потребления кислорода в водном растворе тестируемого вещества, связанная с абиотическими процессами, определяется измерением кислорода в смеси тестируемого вещества, синтетической сточной воды, исключая присутствие активного ила.
3.2 Информация о тестируемом веществе
Идентификация (предпочтительно номер CAS), название (IUPAC), чистота, растворимость в воде, давление пара, летучесть и адсорбционные характеристики тестируемого вещества должны быть известны, что позволит правильно скорректировать полученные результаты. Обычно летучие вещества без использования специальных приемов не могут быть адекватно протестированы.
3.3 Применимость метода
Метод может быть применен к растворимым в воде, плохо растворимым и летучим веществам.
Не всегда возможно получить для плохо растворимых веществ. Достоверные результаты для летучих веществ можно получить, если большая часть тестируемого вещества (более 80%) остается в реакционной смеси в конце периода экспозиции. Если вызывают подозрения относительно стабильности тестируемого вещества или его летучести, то дополнительно должны быть представлены аналитические данные для уточнения концентрации
.
3.4 Референтные вещества
Референтные вещества должны периодически поверяться, с тем чтобы удостовериться в том, что применяемый метод и условия эксперимента надежны, а также для проверки чувствительности каждой партии активного ила, используемого в качестве посевного материала в день проведения теста. 3,5-дихлорфенол (3,5-DCP) (CAS 591-35-5) может использоваться как референтное ингибирующее вещество, так как это - известный ингибитор дыхания, используемый во многих тестах на ингибирование (токсичность) [1]. Пентагидрат сульфата меди (II) может использоваться как референтный ингибитор полного дыхания. N-метиланилин используется как специфичный ингибитор нитрификации [1].
3.5 Критерии достоверности и воспроизводимости
3.5.1 В контрольной пробе (без тестируемого или референтного вещества) потребление кислорода не должно быть меньше 20 мг/г в час активного ила (в пересчете на сухой вес). Если уровень потребления кислорода ниже, то тест должен быть повторен с промытым активным илом или с илом, взятым из другого источника. Коэффициент вариации уровня потребления кислорода в контроле не должен превышать 30% в конце тестовых проб.
Пример - При использовании активного ила, полученного из хозяйственно-бытовых (фекальных) вод, 3,5-DCP, находится в диапазоне от 2 до 25 мг/л для полного дыхания, от 5 до 40 мг/л для гетеротрофного дыхания и от 0,1 до 10 мг/л для процессов нитрификации. Если
3,5-DCP не находится в этом диапазоне, то тест должен быть повторен с активным илом из другого источника.
пентагидрата сульфата меди (II) должен находиться в диапазоне от 53 до 155 мг/л для полного дыхания.
4 Описание метода
4.1 Посуда и оборудование
Пример - Химические стаканы на 1000 мл, чтобы вместить 500 мл реакционной смеси
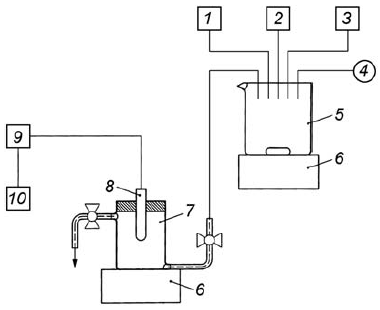
4.1.1 Используют следующее лабораторное оборудование (рисунок 1):
- емкость и оборудование, необходимые для измерения концентрации растворенного кислорода;
- соответствующий кислородный электрод;
- закрытая емкость для содержания образца в отсутствии воздушного пространства над ним и устройства для регистрации.
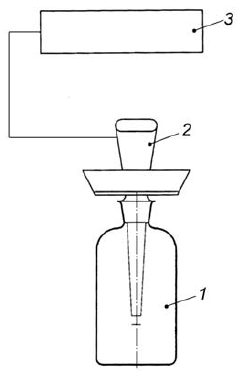
Также может быть использована бутылка для БПК с подходящим адаптером для того, чтобы герметично закрепить кислородный электрод в горлышке бутылки (рисунок 2).
|
1 - активный ил; 2 - синтетическая сточная вода (питательная среда); 3 - тестируемое вещество; 4 - воздух; 5 - емкость смешения; 6 - магнитная мешалка; 7 - кислородная ячейка; 8 - кислородный электрод; 9 - прибор, измеряющий кислород; 10 - регистратор
Рисунок 1 - Прибор для измерения кислорода
|
1 - экспериментальная емкость; 2 - кислородный электрод; 3 - прибор для измерения кислорода
Рисунок 2 - Пример измерительной установки с использованием бутылки для БПК
Для того чтобы избежать потерь при переливании жидкости в кислородную ячейку, необходимо сначала вставить стеклянную или иную трубку через муфту или использовать емкость с расширенным горлышком.
В любом случае должны использоваться магнитная мешалка или аналогичный метод перемешивания:
- магнитная мешалка, покрытая инертным материалом, для использования с мерными и (или) тестируемыми емкостями;
- аэратор, если необходимо, то для удаления пыли и масел сжатый воздух нужно подавать через соответствующий фильтр или бутылки с водой для увлажнения воздуха.
Содержимое емкостей должно аэрироваться пипетками Пастера или другими устройствами аэрации, которые не адсорбируют химикаты.
Орбитальная мешалка со скоростью вращения 150 и 250 об/мин, с флаконами объемом, например 2000 мл, может использоваться для того, чтобы удовлетворить потребность ила в кислороде и решить проблемы с летучими веществами, образующими сильную пену и поэтому выдуваемыми или разбрызгиваемыми потоком воздуха при аэрации.
Экспериментальная установка аэрируется непрерывно или последовательно (например, с 10-15-минутными интервалами), затем также последовательно анализируется. Соответствующее оборудование, которое позволяет одновременно аэрировать и измерять потребление кислорода в смесях, также может использоваться:
- рН метр;
- центрифуга для ила с ускорением 10000 м/с.
4.2 Реактивы
Все реактивы должны быть чистотой не ниже х.ч.
4.3 Вода
Дистиллированная или деионизированная вода, содержащая РОУ (растворенный органический углерод) менее 1 мг/л, за исключением водопроводной воды, содержащей свободный хлор.
4.4 Синтетическая питательная смесь (синтетическая сточная вода)
4.4.1 Питательная среда должна содержать следующие элементы:
- пептон 16 г;
- мясной экстракт (или сопоставимый растительный экстракт) 11 г;
- мочевина 3 г;
- поваренная соль () 0,7 г;
- дигидрат хлорида кальция (![]() ,
, ![]() ) 0,4 г;
) 0,4 г;
- гептагидрат сульфат магния (![]() ,
, ![]() ) 0,2 г;
) 0,2 г;
- безводный гидрофосфат калия (![]() ) 2,8 г;
) 2,8 г;
- дистиллированная или деионизированная вода до 1 л.
4.4.2 рН раствора должен быть 7,5±0,5. Если готовая среда не используется немедленно, то она должна храниться в темноте при температуре от 0 до 4°С не дольше одной недели или при условиях, которые не изменяют ее состав.
4.4.3 Компоненты среды могут индивидуально стерилизоваться для хранения, а пептон и мясной экстракт могут быть добавлены незадолго до эксперимента. Перед использованием среда должна быть полностью смешана и рН приведен к необходимой величине 7,5±0,5.
4.5 Тестируемое вещество
4.5.1 Должен быть приготовлен водный раствор тестируемого вещества, содержащий его максимально возможное количество (осадок не допустим). Плохо растворимые в воде вещества, смеси с компонентами различной водной растворимости и адсорбирующие вещества должны быть взвешены в экспериментальном сосуде. Альтернативой этим случаям может быть проведение аналитических измерений количества тестируемого вещества в экспериментальных сосудах (до добавления активного ила). Использования органических растворителей и эмульгаторов (диспергаторов) для улучшения растворимости следует избегать. Ультразвуковые мешалки можно использовать в случае, если есть информация о стабильности тестируемого вещества в этих условиях.
4.5.2 Тестируемое вещество может изменить рН питательной среды. рН тестируемого вещества (смеси) должен быть определен до эксперимента, также заранее необходимо установить, будет ли тестируемое вещество изменять кислотность питательной среды. В случае необходимости изменения рН должны быть нейтрализованы до внесения активного ила.
Так как нейтрализация может изменить химические свойства вещества в зависимости от поставленных целей, тест может быть выполнен без регулирования рН.
4.5.3 Токсическое действие летучих веществ, особенно при барботировании, может быть искажено вследствие потерь вещества во время продувки. В этом случае необходимо контролировать содержание вещества или компонентов смеси и их изменения в процессе аэрации.
4.6 Референтное вещество
4.6.1 Если в качестве референтного вещества используется 3,5-дихлорфенол, то готовят раствор 1,00 г 3,5-дихлорфенола в 1000 мл воды. Рекомендуется использовать теплую воду и (или) ультразвуковую мешалку для ускорения растворения. После растворения вещества и охлаждения воды раствор доводят до нужного объема. Необходимо убедиться в том, что референтное вещество структурно не изменилось, проверить рН раствора и в случае необходимости привести его к рН 7-8 с помощью раствора ![]() или
или ![]() .
.
4.6.2 Если в качестве референтного вещества используется пентогидрат сульфата меди (II), то применяются концентрации растворенного кислорода 58, 100 и 180 мг/л (фактор разбавления 1.8). Вещество взвешивают непосредственно перед растворением в сосуде, в котором будут растворять (29-50-90 мг для объема 500 мл). Далее разводят 234 мл автоклавированной водопроводной воды. Сульфат меди (II) 5-водный легко растворим. Для теста добавляют 16 мл питательной среды и 250 мл активного ила.
4.7 Специальный ингибитор нитрификации
Готовят раствор 2,32 г/л N-аллилтиомочевины (ATU). Добавляют в 2,5 мл раствора инкубационную смесь, доводят объем до 500 мл, получая концентрацию ATU, равную 11,6 мг (10 моль/л), которой достаточно для 100%-ного ингибирования нитрификации в нитрифицированном активном иле, содержащем 1,5 г/л сухого вещества.
4.8 Абиотический контроль
В редких случаях тестируемое вещество может вызвать абиотическое потребление кислорода. Необходимо различать абиотическое потребление кислорода и микробное дыхание. Абиотический контроль готовится так же, как и биотический, но без внесения инокулюма (активного ила). Точно так же абиотический контроль без активного ила может использоваться для выполнения сопутствующих аналитических измерений по определению концентрации исследуемого вещества во время теста, например для раствора плохо растворимых веществ или смесей с компонентами с различной растворимостью. В некоторых случаях может возникнуть необходимость в подготовке абиотического контроля со стерилизованной культурой (например, автоклавированный ил или ил с добавками стерилизующих ядов). Некоторые вещества могут выделять или потреблять кислород, только если поверхность раствора является достаточной для реакции, даже если веществам нужны более высокая температура или давление для начала реакции. В этом смысле особое внимание следует уделять пероксидам. Стерилизованный инокулюм обеспечивает большую площадь поверхности раствора.
4.9 Инокулюм (активный ил)
4.9.1 Активный ил берется на выходе из аэротенков или поблизости от выхода стабильно работающих очистных сооружений, перерабатывающих хозяйственно-бытовые (фекальные) сточные воды. В зависимости от цели теста также могут использоваться другие адекватные типы или источники активного ила, например ил, выращенный в лаборатории, с концентрацией сухого вещества от 2 до 4 г/л. Ил разных очистных сооружений будет иметь различные особенности и чувствительность.
4.9.2 Активный ил может использоваться в том виде, в каком он собран, но его крупные частицы должны быть удалены сразу же после отбора (примерно 5-15 мин) путем фильтрования (размер ячейки составляет 1 мм). Также активный ил может быть гомогенизирован в блендере в течение приблизительно 15 сек или дольше, но необходимо избегать воздействия центробежных сил и изменения температуры ила, которые могут произойти при его длительном измельчении.
4.9.3 Промывка активного ила часто необходима при низкой величине эндогенного дыхания. Активный ил нужно вначале отцентрифугировать в течение периода, достаточного для появления прозрачного супернатанта и шарика твердых частиц сточных вод (обычно 10 мин) с ускорением 10000 м/с. Супернатант сливают, а ил повторно заливают отстоянной (без хлора) водопроводной водой, взбалтывают и удаляют промывочную воду повторным центрифугированием. Промывка и центрифугирование в случае необходимости должны быть повторены. Сухое вещество в промытом иле определяют заново, сконцентрированный ил разводят в отстоянной (или освобожденной от хлора другим способом) водопроводной воде до концентрации сухого вещества 3 г/л. Активный ил должен непрерывно аэрироваться (примерно 2 л/мин) при температуре эксперимента и, если возможно, использоваться в день проведения эксперимента. Если это невозможно, то ил должен ежедневно подкармливаться синтетической сточной водой (50 мл синтетической сточной воды/л активного ила) в течение двух дополнительных дней. Результаты теста с илом, используемым для тестирования, принимаются как валидные при условии, что с илом не произошло никаких существенных изменений, оцениваемых как эндогенные гетеротрофное и нитрифицирующее дыхание.
4.9.4 Трудности могут возникнуть в случае, если во время инкубации произойдет вспенивание (вспухание) ила до такой степени, что пена и твердые частицы ила выходят за пределы аэрируемых емкостей. Иногда вспухание может быть следствием присутствия питательных веществ, но оно неизбежно, если тестируемое вещество содержит ПАВ. Потеря твердых частиц ила в тестируемой смеси приводит к искусственно сниженным величинам дыхания, которые могут по ошибке интерпретироваться как результат ингибирования. Кроме того, в растворе ПАВ концентрируются в слое пены. Потеря пены из тестовой системы снижает концентрацию воздействия. Вспениванием можно управлять простыми механическими способами (например, периодическим ручным взбалтыванием с использованием стеклянной палочки) или добавляя вещества-антивспениватели, такие, как силаны. Также можно использовать такой метод аэрации, как встряхивание флаконов. Если проблема связана с присутствием питательных веществ, то состав сточных вод должен быть изменен включением антивспенивающего агента в количестве примерно 50 мкл/л. Если вспенивание вызвано исследуемым веществом, то его максимальное количество, не образующее пену, должно быть установлено, и далее нужно тождественно рассматривать все индивидуальные аэрируемые сосуды, включая те, в которых пена отсутствует. Антивспениватели не должны вступать во взаимодействия с тестируемым веществом и (или) инокулюмом.
5 Процедура тестирования
Может быть определено ингибирование трех различных типов потребления кислорода: общее, гетеротрофное и нитрификация. Обычно достаточно только лишь измерения ингибирования полного потребления кислорода. Тем не менее определение гетеротрофного потребления кислорода, связанное с окислением органического углерода, с одной стороны, и окислением аммония - с другой, необходимо тогда, когда нужно объяснить необычные кривые доза-ответ при построении графика общего потребления кислорода для некоторых веществ.
5.1 Условия тестирования
Тестирование должно быть выполнено при температуре 20±2°С.
5.2 Тестовые смеси
Тестовые смеси ( в таблице 1), содержащие воду, синтетические сточные воды и тестируемое вещество должны быть подготовлены для получения различных номинальных концентраций тестируемого вещества (таблица 1). рН должен быть в пределах 7,5±0,5. В случае необходимости смеси можно развести водой и активным илом, добавленным для получения равных объемов во флаконах в начале аэрации.
Таблица 1 - Примеры смесей для предварительного тестирования
Реактивы | Оригинальные концентрации | ||||
Стартовая концентрация тестируемого вещества | 10 г/л | ||||
Синтетическая питательная среда | см. п.4.4.1 | ||||
Маточная культура активного ила | 3 г/л по сухому веществу | ||||
Компоненты смесей | Дозировка в тестовых емкостях* | ||||
Стартовый раствор, мл | 0,5 | 5 | 50 | 0 | 50 |
Синтетическая питательная среда (синтетические сточные воды), мл | 16 | 16 | 16 | 16 | 16 |
Суспензия активного ила, мл | 250 | 250 | 250 | 250 | 0 |
Вода | 233,5 | 229 | 184 | 234 | 434 |
Общий объем смеси, мл | 500 | 500 | 500 | 500 | 500 |
Концентрация в смеси | |||||
Тестируемая суспензия, мг/л | 10 | 100 | 1000 | 0 | 1000 |
Активный ил (сухое вещество), мг/л | 1500 | 1500 | 1500 | 1500 | 0 |
* Та же процедура должна проводиться для референтного вещества во флаконах | |||||
5.3 Референтная смесь
Должна быть подготовлена смесь с референтным веществом, например 3,5-дихлорфенолом, вместо испытательного вещества так же, как и тестовые смеси.
5.4 Холостая проба
Холостая проба берется в начале и в конце проведения анализа с одинаковыми интервалами. В тестах, выполненных с использованием оборудования, позволяющего проводить непрерывное измерение потребления кислорода, должны быть по крайней мере две холостые пробы, включенные в каждую серию анализов. Холостая проба содержит равный объем активного ила и питательной среды, но без референтного и тестируемого веществ. Проба должна быть разведена водой до того же объема, что и референтная и тестовая смеси.
5.5 Абиотический контроль
В случае необходимости, если у тестируемого вещества известна или предполагается способность к поглощению кислорода, готовят смесь для измерения абиотического потребления кислорода. В смеси должно быть то же самое количество тестируемого вещества, что и синтетических сточных вод, и она должна иметь такой же объем, что и тестовые смеси, но без активного ила.
5.6 Проведение эксперимента и измерения
5.6.1 Тестовые, референтные смеси, холостая проба и абиотический контроль инкубируются при температуре эксперимента в условиях постоянной аэрации (0,5-1 л/мин) для поддержания концентрации растворенного кислорода не менее 60-70% от насыщающей и поддержания активного ила во взвешенном состоянии.
Необходимо время от времени вручную встряхивать флаконы, взбалтывая хлопья ила.
Инкубация начинается с момента контакта активного ила с другими элементами смеси. В конце инкубации, после периода экспозиции, равного обычно 3 ч, отбирают образцы для измерения уменьшения концентрации растворенного кислорода.
Измерения проводят в кислородной ячейке (рисунок 2) или в полностью заполненной бутылке для БПК. Определение времени начала инкубации также зависит от способности используемого оборудования измерить скорость потребления кислорода.
Пример - Если оборудование имеет только один кислородный электрод, то измерения проводят индивидуально. В этом случае готовят различные смеси, необходимые для теста с синтетическими сточными водами, но инокулюм сразу не добавляют, внося его отдельно в каждый флакон серии. Каждая инкубация должна быть начата в удобно рассчитанные интервалы, например в 10-15 мин. Если же имеется достаточное количество кислородных электродов, которые делают возможным одновременные измерения в нескольких флаконах, то инокулюм может быть добавлен одновременно в несколько флаконов.
5.6.2 Концентрация активного ила во всех тестовых, референтных и холостых смесях (кроме абиотического контроля) должна составлять 1,5 г/л сухого вещества. Потребление кислорода должно быть измерено через 3 ч после воздействия. В некоторых случаях измерения можно проводить через дополнительные 30 мин после основной экспозиции.
5.7 Нитрификационный потенциал ила
Для того чтобы определить начало процесса нитрификации в иле, и, если это так, определить его величину, должны быть подготовлены смеси как в варианте холостой пробы, так и в дополнительных "контрольных" смесях
с N-аллилтиомочевиной, содержащейся в концентрации 11,6 мг/л. Смеси должны быть проаэрированы и инкубированы при температуре (20±2)°С в течение 3 ч. Количество потребленного кислорода позволит рассчитать величину нитрификации.
5.8 Ход эксперимента
5.8.1 Определение концентрации тестируемого вещества
5.8.1.1 Предварительный тест проводится, с одной стороны, тогда, когда необходимо установить диапазон концентраций исследуемого вещества, необходимых для эксперимента по определению ингибирования потребления кислорода. С другой стороны, отсутствие подавления потребления кислорода тестируемым веществом в предварительном эксперименте может свидетельствовать о том, что окончательный тест является ненужным. В этом случае приводят утроенную концентрацию от самого высокого значения, полученного в предварительном эксперименте (обычно 1000 мг/л, но все зависит от требований к результатам эксперимента).
5.8.1.2 Тест должен быть выполнен как минимум для трех концентраций тестируемого вещества, например 10, 100 и 1000 мг/л, с холостым контролем и как минимум тремя абиотическими контролями с самыми высокими концентрациями тестируемого вещества (таблица 1). Самая низкая концентрация не должна оказывать никакого эффекта на потребление кислорода. Если возможно, то рассчитывают величину потребления кислорода и величину нитрификации, а также процент ингибирования. В зависимости от целей теста можно определить предельную токсичную концентрацию, например 1000 мг/л. Если статистически значимого токсического эффекта не выявлено при этой концентрации, то проводят дополнительные тесты при более высоких или более низких концентрациях. Следует отметить, что плохо растворимые вещества, смеси с компонентами, имеющими различную растворимость в воде, и вещества с адсорбтивными свойствами должны быть взвешены непосредственно в тестовых емкостях. В этом случае объем, сохраненный для исходного раствора, должен быть дополнен разбавляющей водой.
5.8.2 Окончательный тест
5.8.2.1 Ингибирование полного потребления кислорода
Тест должен выполняться, основываясь на диапазоне концентраций, полученных в предварительном эксперименте. Для получения NOEC и (например,
) рекомендуется провести шесть контрольных проб и пять разных концентраций тестируемого вещества, взятых в геометрической прогрессии. Абиотический контроль можно не повторять в случае, если в предварительном тесте не было эффекта, но если обнаружено воздействие, то абиотический контроль осуществляют для каждой концентрации тестируемого вещества. Чувствительность ила должна быть проверена с помощью 3,5-дихлорфенола в качестве референтного вещества, а также осуществлена для каждой серии концентраций, так как чувствительность подвержена сильным колебаниям. Во всех случаях образцы должны быть отобраны из экспериментальных емкостей после 3-3,5 ч или в случае необходимости для измерения величины потребления кислорода в ячейке кислородного электрода. Величина дыхания, измеренная как разница между величиной дыхания в холостом эксперименте и тестируемым веществом, рассчитывается по формуле (7).
5.8.2.2 Дифференцирование ингибирования гетеротрофного дыхания и нитрификации
Использование специфического ингибитора нитрификации, ATU, позволяет оценивать ингибиторный эффект тестируемого вещества при гетеротрофном окислении. Кроме того, вычитая скорость потребления кислорода в присутствии ATU из общего объема потребления кислорода (без ATU), можно сделать вывод о его влиянии на скорость нитрификации. Для этого готовят в двух повторах реакционные смеси согласно прописи по определению или NOEC, но дополнительно добавляют к каждой пробе ATU в концентрации 11,6 мг/л, которая полностью подавляет процессы нитрификации в иле при его концентрации по сухому остатку до 3000 мг/л. Величина потребления кислорода измеряется после экспозиции. Эти прямые измерения показывают только гетеротрофное дыхание, а разность между дыханием и соответствующей величиной полного дыхания и составляет нитрификацию. Высчитывают различные степени ингибирования.
5.9 Измерения
После периода экспозиции образец из первой аэрируемой емкости переливают в ячейку с кислородным электродом (рисунок 1) и немедленно измеряют концентрацию растворенного кислорода.
Если доступна многоканальная электродная система, то измерения могут быть проведены одновременно в нескольких ячейках. Важно перемешивать пробы с помощью магнитной мешалки с той же скоростью, что и при калибровке электрода для получения от него более быстрого отклика и обеспечения единообразия и воспроизводимости результатов. Обычно система, состоящая из кислородного электрода и автомешалки, работает хорошо. Ячейку необходимо ополаскивать водой между измерениями.
Другим способом предполагается использовать бутылку для БПК (рисунок 2), снабженную магнитной мешалкой. Кислородный электрод оснащается адаптером, вставляется через горлышко бутылки, затем начинают перемешивание. В обоих случаях концентрация растворенного кислорода должна измеряться и регистрироваться непрерывно в течение 5-10 мин или до падения концентрации кислорода ниже 2 мг/л. После этого кислородный электрод удаляют, смесь возвращают в аэрируемую емкость и продолжают аэрацию и перемешивание, если необходимо измерить концентрацию кислорода при более длительной экспозиции.
5.10 Проверка концентрации тестируемого вещества
5.10.1 В некоторых случаях необходимо измерить концентрацию тестируемого вещества в испытательных сосудах. Если в исходном растворе присутствуют плохо растворимые в воде вещества, смеси с компонентами с различной растворимостью в воде или вещества с хорошей водной растворимостью, концентрация которых находится вблизи максимальной растворимости в воде, то величина растворенной фракции становится неизвестной, а реальная концентрация тестируемого вещества остается неопределенной.
Необходимо определить концентрацию тестируемого вещества в пробе для характеристики воздействия. Для этого необходимо проводить аналитические исследования концентрации тестируемого вещества в испытательных сосудах. Для упрощения анализа аналитическая оценка может быть получена перед внесением инокулюма. Поскольку для анализа передается только растворенная фракция, то концентрация тестируемого вещества может быть очень низкой.
5.10.2 Для того чтобы избежать дорогостоящих и трудоемких аналитических исследований, рекомендуется взвешивать тестируемое вещество в экспериментальных емкостях и соотнести начальную величину номинальной концентрации с последующими вычислениями. Дифференцирование растворенного, нерастворенного или адсорбированного фракциями тестируемого вещества не является обязательным потому, что обе фракции имеют место быть в реальных условиях на очистных сооружениях и могут меняться в зависимости от состава сточных вод. Цель настоящего стандарта состоит в том, чтобы оценить неингибирующую концентрацию. Стандарт также подходит для подробного изучения вклада каждой фракции в ингибирование организмов активного ила. Наконец, адсорбтивные вещества должны быть также взвешены в тестовых сосудах. Для минимизации потерь через адсорбцию к адсорбтивным необходимо добавить силаны.
6 Данные и отчет о проведении испытаний
6.1 Вычисление величины потребления кислорода
6.1.1 Скорость потребления кислорода вычисляют из средневзвешенных значений, например, используя линейные части графика концентрации кислорода во времени. Следует ограничивать вычисления концентраций кислорода в диапазоне от 2,0 до 7,0 мг/л, так как более высокие и более низкие концентрации могут сами по себе влиять на потребление кислорода.
Иногда возникает необходимость в использовании концентрации ниже или выше этих значений, например в случаях сильного подавления и, как следствие, очень медленного дыхания или, наоборот, если дыхание активного ила слишком быстрое. Это допустимо при условии, что расширенные части кривой потребления кислорода рассматриваются как линейные и их градиенты не изменяются вне диапазона от 2,0 до 7,0 мг/л кислорода. Любые нелинейные функции графика указывают на то, что система стабилизирована или величина потребления кислорода изменилась и не может использоваться для вычисления. Скорость потребления кислорода выражается в миллиграммах на литр в час (мг/л ч) или в миллиграммах на грамм сухого вещества в час (мг/г ч). Скорость потребления кислорода, , в мг/л ч, может быть вычислена или интерполирована из линейной части кривой уменьшения количества кислорода в соответствии с уравнением:
![]() , (1)
, (1)
где - концентрация кислорода в начале линейной части кривой (мг/л);
- концентрация кислорода в конце линейной части кривой (мг/л);
- временной интервал между двумя измерениями (мин).
6.1.2 Удельная скорость дыхания выражается как количество кислорода, потребляемого на грамм ила в сухом весе в час (мг/г ч) в соответствии с уравнением:
![]() , (2)
, (2)
где - концентрация взвешенных веществ в тестируемой смеси (г/л).
6.1.3 Различные индексы могут иметь следующие значения:
- удельная скорость;
- общее дыхание;
- дыхание, связанное с нитрификацией;
- гетеротрофное дыхание;
- величина, связанная с абиотическими процессами;
- величина, полученная в холостом эксперименте.
6.2 Вычисление потребления кислорода на нитрификацию
6.2.1 Отношения между полным дыханием , дыханием нитрификации
и гетеротрофным дыханием
приведены в уравнении:
![]() , (3)
, (3)
где - величина потребления кислорода на нитрификацию (мг/л ч);
- количество потребленного кислорода в холостом контроле (без ATU;
) (мг/л ч);
- количество потребленного кислорода в холостом контроле с ATU;
(мг/л ч).
6.2.2 Эти отношения действительны для холостых проб (,
,
), абиотических контролей (
,
,
) и анализов с тестируемым веществом (
,
,
) (мг/г ч). Удельную скорость дыхания рассчитывают следующим образом:
![]() , (4)
, (4)
![]() , (5)
, (5)
![]() . (6)
. (6)
6.2.3 Если величина в предварительном тесте является незначительной (
5%
в холостой пробе), то можно предположить, что гетеротрофное потребление кислорода равно полному, а нитрификации не происходит. Если необходимо установить действие на гетеротрофные и нитрифицирующие микроорганизмы, то необходим другой источник активного ила. Окончательный тест выполняется, если имеются данные об ингибировании потребления кислорода в зависимости от концентрации вещества.
6.3 Вычисление процента ингибирования
6.3.1 Общее ингибирование потребления кислорода в процентах определяют для каждой концентрации вещества в пробах и рассчитывают по формуле:
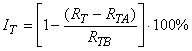 . (7)
. (7)
6.3.2 Точно так же рассчитывают процент гетеротрофного ингибирования потребления кислорода для каждой концентрации тестируемого вещества по уравнению:
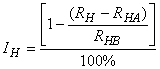 . (8)
. (8)
6.3.3 Ингибирование дыхания, связанного с нитрификацией , вычисляют по уравнению:
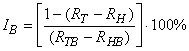 . (9)
. (9)
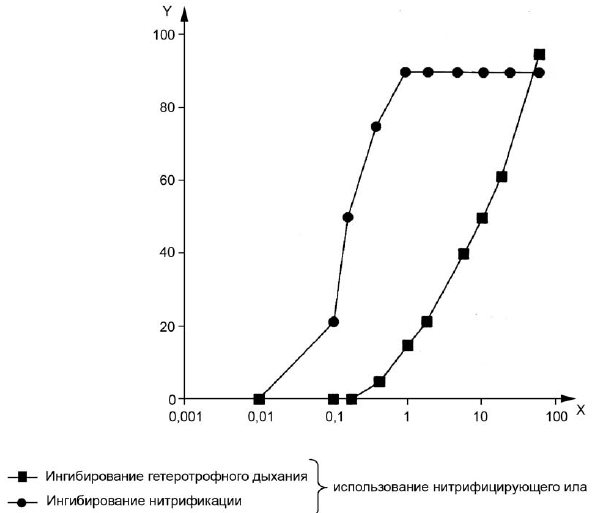
6.3.4 Проводят кривую ингибирования процесса потребления кислорода в зависимости от логарифма концентрации тестируемого вещества (рисунок 3).
Кривые ингибирования строят для каждой 3-часовой фазы аэрации или после 30 дополнительных минут. Концентрация вещества в пробах, соответствующая 50%-ному ингибированию, рассчитывается или интерполируется из этой кривой. Если имеются соответствующие данные, то также вычисляется 95%-ный доверительный интервал , наклон кривой и соответствующие значения начала ингибирования (например,
или
) и его завершения (
или
).
6.3.5 Следует отметить, что в связи с большой изменчивостью, наблюдаемой в результатах, во многих случаях достаточно определить порядок величины, например:
![]() 1 мг/л;
1 мг/л;
от 1 до 10 мг/л;
от 10 до 100 мг/л;
![]() 100 мг/л.
100 мг/л.
|
Рисунок 3 - Пример кривых ингибирования
6.4 Интерпретация результатов
6.4.1
Значение и 95%-ный доверительный интервал рассчитывают с помощью соответствующих статистических методов (пробит анализ, логистическая функция или функция Вейбулла, сокращенный метод Спирмена - Карбера или метод интерполяций).
получают интегрированным значением соответствующих
, %, от контроля, найденного в уравнении. Для того чтобы вычислить
или любой другой
, необходимо проводить регрессионный анализ.
6.4.2 Оценка NOEC
Статистический анализ также применим для определения NOEC. Необходимо проводить статистический анализ для каждой емкости (каждую емкость рассматривают как отдельный эксперимент). В целом негативные воздействия тестируемого вещества по сравнению с контролем сопряжены с проверкой гипотезы односторонних (наименьших) критериев при 0,05.
6.5 Оформление результатов
6.5.1 Тестируемое вещество:
- название, химическое наименование, номер CAS, чистота;
- физико-химические свойства тестируемого вещества (![]() , водная растворимость, давление пара, константа Генри (Н) и другая возможная информация, описывающая свойства тестируемого вещества, например адсорбция к активному илу);
, водная растворимость, давление пара, константа Генри (Н) и другая возможная информация, описывающая свойства тестируемого вещества, например адсорбция к активному илу);
6.5.2 Тестовая система:
- источник активного ила, условия работы очистных сооружений и вид сточных вод, концентрация, предобработка и поддержание активного ила.
6.5.3 Условия теста:
- температура, рН во время теста и продолжительность экспозиции.
6.5.4 Результаты:
- потребление кислорода в холостом опыте (мг / г ила ч);
- все собранные данные, кривая ингибирования и метод вычисления ;
- и 95%-ный доверительный интервал,
,
; NOEC и используемые статистические методы, если
не может быть определен;
- общее ингибирование и ингибирование, связанное с нитрификацией;
- абиотическое потребление кислорода в физико-химическом контроле;
- название референтного вещества и результаты теста, проводимого с этим веществом;
- все проведенные наблюдения и отклонения от стандартной процедуры, которые могут повлиять на результат.
Библиография
1. Brown, D., Hitz, H.R., ![]() , L. (1981), The assessment of the possible inhibitory effect of dyestuffs on aerobic waste-water bacteria, Experience with a screening test, Chemosphere 10 (3): p.245-261.
, L. (1981), The assessment of the possible inhibitory effect of dyestuffs on aerobic waste-water bacteria, Experience with a screening test, Chemosphere 10 (3): p.245-261.
2 King, E.F. and Painter H.A. (1986), Inhibition of respiration of activated sludge; variability and reproducibility of results, Toxicity Assessment 1(1): 27-39.
3 OECD (1984), Activated sludge. Respiration inhibition test, Test Guideline No. 209, Guidelines for the testing of chemicals, OECD, Paris.
4 ISO (2007), ISO 8192 Water Quality - Test for inhibition of oxygen consumption by activated sludge for carbonaceous and ammonium oxidation, International Organization for Standardization.
5 Bealing, D.J. (2003), Document ISO/TC147/WGI/N.183, International Organization for Standardization.
6 Painter, H.A., Jones K. (1963), The use of the wide-bore dropping-mercury electrode for the determination of the rates of oxygen uptake and oxidation of ammonia by micro-organisms, Journal of Applied Bacteriology 26 (3) 471-483.
7 Painter, H.A. (1986), Testing the toxicity of chemicals by the inhibition of respiration of activated sludge. Toxicity Assessment 1:515-524.
8 Robra, B. (1976), Wasser/Abwasser 117, 80.
9 Fiebig S. and Noack, U. (2004), The use of copper(ll)sulphate pentahydrate as reference substance in the activated sludge respiration inhibition test - acc. to the OECD guideline 209. Fresenius Environmental Bulletin 13 No. 12b: 1556-1557.
10 ISO (1995), ISO 10634 Water Quality - Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in aqueous medium, International Organization for Standardization.
11 OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application, Series on testing and assessment No. 54, ENV/JM/MONO(2006)18, OECD, Paris.
УДК 658.382.3:006.354 | МКС 71.040.50 | ||
Ключевые слова: химическая продукция, воздействие на окружающую среду, окружающая среда, биоразлагаемость, потребление кислорода, активный ил | |||
Электронный текст документа
и сверен по:
, 2019