ГОСТ Р 57004-2016
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Диагностика в онкологии
АЛГОРИТМ ДИАГНОСТИКИ
Шейка матки
Лабораторный этап
Diagnostics in oncology. Diagnostic algorithm. Cervix. Laboratory stage
ОКС 03.040, 11.040.01, 11.100.01
Дата введения 2017-02-01
Предисловие
1 РАЗРАБОТАН Автономной некоммерческой организацией "Центр инновационных технологий в онкологии" (АНО "ЦИТО")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 216 "Диагностика в онкологии"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 1 июля 2016 г. N 795-ст
4 ВВЕДЕН ВПЕРВЫЕ
5 ПЕРЕИЗДАНИЕ. Февраль 2020 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
В настоящем стандарте реализованы основные нормативные положения документов [1]-[4].
Настоящий стандарт разработан для внедрения в практику здравоохранения унифицированных алгоритмов проведения пробоподготовки, в том числе:
- для метода жидкостной цитологии с целью оптимизации и систематизации деятельности лечебно-профилактических учреждений и специалистов в области раннего выявления и диагностики рака;
- эффективной и своевременной (ранней) диагностики и лечения опухолей, масштабной борьбы против рака на региональном, национальном и глобальном уровнях в целях увеличения выживаемости, снижения смертности от онкологических заболеваний;
- обеспечения доступности лечения для пациентов, страдающих онкологическими заболеваниями.
Настоящий стандарт может быть использован специалистами как методическое руководство при осуществлении профессиональной деятельности, а также учреждениями здравоохранения и органами государственной власти при создании нормативных правовых актов.
1 Область применения
Настоящий стандарт разработан как руководство по организации и проведению диагностических мероприятий, в том числе с использованием метода жидкостной цитологии, для руководителей лечебно-профилактических учреждений, гинекологических отделений, женских консультаций, лабораторий, врачей-гинекологов, сотрудников женских консультаций, смотровых кабинетов, цитологических лабораторий.
Настоящий стандарт разработан в соответствии с настоятельными рекомендациями ВОЗ о мероприятиях по борьбе с онкологическими заболеваниями шейки матки.
ВОЗ также настоятельно рекомендует обратить особое внимание:
- на организацию материально-технического обеспечения и укомплектованность кадрами;
- обеспечение соответствующего профессионального уровня сотрудников путем организации регулярного повышения квалификации для них и контроля качества диагностических мероприятий.
Настоящий стандарт распространяется на процедуры:
- получения материала для исследования;
- подготовки и доставки материала в лабораторию;
- пробоподготовки;
- документального оформления этих действий на каждом этапе.
2 Термины, определения и сокращения
2.1 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1.1 аспиратор: Прибор, предназначенный для аспирации - вакуумного забора надосадочной жидкости.
2.1.2 виала: Контейнер с герметичной крышкой, содержащий транспортную жидкость, предназначенный для хранения и транспортирования клеточного материала.
2.1.3 мазок: Препарат, приготавливаемый путем нанесения и равномерного распределения (размазывания) биологического материала.
2.1.4 ПАП-тест: Данный тест является методом цервикального скрининга и используется для обнаружения потенциально предраковых и раковых процессов в шейке матки или цервикальном канале. Тест был изобретен Георгиосом Папаниколау и назван в честь этого греческого врача. Подразумевает оценку полученного материала по системе Bethesda.
_______________
Система Bethesda (TBS) представляет собой систему для оценки цитологической картины материала, полученного при биопсии шейки матки, и для формирования цитологического диагноза. Она была введена в 1988 г., и пересмотрена в 1991 и 2001 гг. Название происходит от места (Бетесда, Мэриленд) проведения конференции, на которой была утверждена к применению эта система.
2.1.5 транспортная жидкость: Специальная жидкость, использующаяся в жидкостной цитологии для сохранения и/или транспортирования материала. Как правило, представляет собой изотонический раствор с консервантами, фиксирующий и предохраняющий клетки от быстрого распада.
2.1.6 цитощетка: Щеточка для получения эндоцервикальных образцов.
2.1.7 сervex-brush: Щеточка для получения биоматериала из Т-зоны (зоны трансформации шейки матки) и влагалищной части шейки матки.
2.1.8 ID (identification): Уникальный идентификатор, который присваивается системой каждой отдельной записи или каждому пациенту.
2.2 Сокращения
В настоящем стандарте использованы следующие сокращения:
аденокарцинома - АК;
Всемирная организация здравоохранения - ВОЗ;
жидкостная цитология - ЖЦ;
иммуноцитохимия - ИЦХ;
информационная система - ИС;
лабораторная информационная менеджмент-система - ЛИМС;
лабораторная информационная система - ЛИС;
лечебно-профилактическое учреждение - ЛПУ;
Международная классификация болезней 10-го пересмотра - МКБ-10;
полимеразная цепная реакция - ПЦР;
рак шейки матки - РШМ;
шейка матки - ШМ.
3 Получение цитологического материала
3.1 Сотрудники гинекологических и смотровых кабинетов ЛПУ, направляющие цитологический материал для исследования, должны быть информированы о том, каким методом осуществляют пробоподготовку [ЖЦ или традиционная (классическая) цитология] гинекологического материала в лаборатории, так как это влияет на выбор способа забора, хранения и транспортирования материала.
Материал для исследования следует забирать, готовить и транспортировать в лабораторию с учетом требований метода, используемого лабораторией.
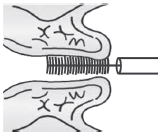
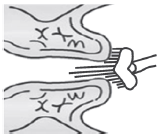
Материал с шейки матки забирают с помощью одноразовых щеток различного типа (см. рисунки 1-2). Для получения более информативного материала рекомендуется использовать два вида щеток сervex-brush и цитощетки различных типов.
|
Рисунок 1 - Цитощетка или щеточка цервикальная
Цитощетка должна быть со щетинками, расположенными под углом 90°. При заборе материала ее следует поворачивать на 90° не менее двух раз.
|
Рисунок 2 - Комбинированная щеточка, cervex-brush
Комбинированная щеточка используется для одномоментного получения материала из цервикального канала и влагалищной части ШМ. При заборе материала следует сделать пять оборотов по часовой стрелке.
При невозможности использования щеток или при использовании методов классической цитологии допустимо использование традиционных способов получения материала.
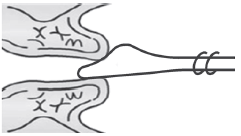
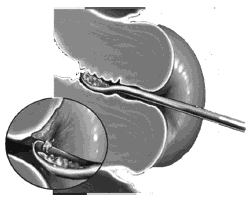
Материал с влагалищной части шейки матки допустимо забирать с помощью шпателя Эйра (см. рисунок 3), а из цервикального канала - с помощью кюретки (см. рисунок 4).
|
Рисунок 3 - Шпатель Эйра
При заборе делается полный оборот шпателя с легким надавливанием.
|
Рисунок 4 - Кюретка для получения материала цервикального канала
Использовать для забора материала ватный тампон и другие приспособления недопустимо.
3.2 Материал нужно получить со всей зоны трансформации (зоны стыка или переходной зоны). Непосредственно само получение материала для исследования с шейки матки (без учета времени на осмотр) занимает около 5 мин, процедура безболезненна и может проводиться амбулаторно.
_______________
Зона трансформации - гистологический термин, обозначающий участок слизистой оболочки шейки матки в том месте, где многослойный плоский эпителий, характерный для влагалищной части шейки матки, переходит в цилиндрический эпителий канала шейки матки (цервикального канала).
3.3 Получение материала для исследования может быть отложено, если у женщины:
- менструация;
- острое воспалительное заболевание половых путей;
- беременность.
4 Подготовка и оформление материала
4.1 Метод получения материала и приготовления препаратов, который будет использован в каждом конкретном случае, должен быть заранее четко согласован между лабораторией и отделением ЛПУ, что должно быть отражено в соответствующем документе.
4.2 При использовании метода классической цитологии материал после получения помещают на предметное стекло путем нанесения и равномерного распределения (размазывания) биологического материала вдоль стекла, избегая чрезмерного механического воздействия (чтобы не раздавить клетки). Одновременно с этим необходимо стремиться к получению тонкого монослоя.
Материал с шейки матки и материал из цервикального канала помещают на разные стекла, маркируемые соответственно нанесенному материалу.
Препараты подсушивают в течение нескольких минут на открытом воздухе (при использовании методов окраски по Паппенгейму, по Лейшману и др.) и могут транспортировать в лабораторию.
При использовании метода окраски по Папаниколау препараты требуют немедленной фиксации.
4.3 При использовании метода ЖЦ полученный материал необходимо немедленно перенести в транспортную жидкость в емкость - виалу, отделив саму щетку от рукоятки (если производителем щетки не предусмотрено иное), и герметично закрыть виалу с целью исключения возможности проливания и испарения содержимого.
4.3.1 Следует сразу же маркировать (подписать) виалу, используя простой карандаш, ручку (при наличии этикетки) или перманентный маркер.
4.4 При маркировке указывают фамилию, имя, отчество пациентки и/или еe ID (в том случае, если сотрудник, получающий материал для исследования у пациентки, и лаборатория используют единую информационную систему). Возможно применение штрих-кодов и номеров, присваиваемых исследованию информационной системой, если используется штрихкодирование. В любом случае маркировка должна быть четкой, читаемой, надежно закрепленной на виале, не смываемой водой.
4.5 Абсолютно недопустимым является:
- использование для маркировки препаратов стеклографов, карандашей старого образца, водных маркеров;
- отправка для исследования немаркированного материала;
- отправка материала без сопровождающих документов;
- отсутствие в ЛПУ документально оформленного "прикрепления" к конкретной лаборатории, с указанием согласованных взаимных правил и требований, касающихся получения материала, приготовления препаратов, оформления, доставки материала для исследования, сроков доставки, повторных исследований, сроков проведения исследования и предоставления заключений и отчетов, порядка направления пациенток с выявленной патологией для обследования и лечения в другие ЛПУ и т.п.
5 Отправка и транспортирование материала в лабораторию
Сотрудник, отвечающий за этот этап работ, должен проверить соответствие представленного материала записи о нем в сопровождающем документе.
5.1 Материал, направляемый в лабораторию, сопровождается заполненным направлением на исследование (см. приложение А).
5.2 В направлении, прилагаемом к материалу, должна быть как минимум следующая информация:
- фамилия, имя, отчество пациентки;
- дата рождения;
- номер истории болезни/амбулаторной карты/другой номер, идентифицирующий пациентку;
- наименование запрашиваемого исследования (например, "направляется на цитологическое диагностическое исследование");
- причина обследования (указать диагноз или, например, "профилактический осмотр", "онкопоиск");
- дата последней менструации, продолжительность менопаузы;
- количество виал с материалом и данные, какой материал в них содержится (например, соскоб с эндоцервикса, эктоцервикса), в случае штрихкодирования виал эту информацию указывают в направлении напротив каждого штрих-кода;
- дата и время сбора материала;
- фамилия лица, направившего материал на исследование.
При отсутствии информации для заполнения поля необходимо поставить прочерк.
Наличие пустых полей в бланке направления недопустимо.
5.3 Направление может быть оформлено в электронном виде при наличии ЛИС и должно давать доступ к указанной информации в рамках прав доступа каждого конкретного медицинского работника.
5.4 Порядок сбора материала из ЛПУ для отправки в цитологическую лабораторию должен быть четко согласован между отделением ЛПУ и лабораторией и прописан в соответствующем документе.
6 Доставка и прием материала цитологической лабораторией
6.1 Прием материала должен осуществлять ответственный сотрудник лаборатории, назначенный заведующим лабораторией или лицом, его замещающим, под подпись с указанием даты и времени доставки.
Порядок доставки и приема также должен быть согласован между отделением ЛПУ и лабораторией, что должно быть оформлено документально. Прием материала в лаборатории осуществляют непосредственно после его доставки. Сотрудник, отвечающий за этот этап работ, должен проверить соответствие представленного материала записи о нем в сопровождающем документе.
6.1.1 Лаборатория может отказаться от приема материала в том случае, если:
- отсутствует или не оформлена надлежащим образом сопровождающая документация;
- не маркирован материал;
- констатируется нарушение сохранности (целостности, герметичности) упаковки;
- очевидно нарушение условий сбора, хранения и/или транспортирования.
6.1.2 Отказ в приеме материала с указанием причины фиксируют в отдельном журнале и заверяют подписями представителей обеих сторон.
_______________
Приказ Министерства здравоохранения СССР от 4 октября 1980 г. N 1030 "Об утверждении форм первичной медицинской документации учреждений здравоохранения" (с изменениями на 31 декабря 2002 г.). Приказом Минздрава СССР от 5 октября 1988 г. N 750 настоящий приказ был признан утратившим силу, но до утверждения новых форм продолжают применяться формы, утвержденные данным приказом - письмо Минздравсоцразвития России от 30 ноября 2009 г. N 14-6/242888.
6.1.3 Регистрацию осуществляют в ЛИМС или при отсутствии информационной системы в бумажном журнале регистрации материала (см. приложение Б).
6.1.4 Форма журнала может быть свободной, но с указанием всех параметров исследования и с наличием всех граф, имеющихся в направлении.
7 Лабораторный этап
7.1 Общие положения
На все оборудование, принадлежности, реагенты и расходные материалы для пробоподготовки цитологических препаратов должны быть представлены регистрационные удостоверения Федеральной службы по надзору в сфере здравоохранения и социального развития.
7.1.1 Все компоненты оборудования/систем должны быть приобретены у одного производителя, либо производитель/поставщик должен предоставить официальные сведения о совместимости с оборудованием других фирм.
7.1.2 К оборудованию в обязательном порядке следует прилагать инструкцию на русском языке и подробное руководство пользователя.
7.1.3 Все используемые реактивы для обработки и окраски биологического материала должны соответствовать срокам годности.
7.1.4 Сотрудник лаборатории (из числа среднего медицинского персонала) допускается к осуществлению пробоподготовки по методу ЖЦ после соответствующего распоряжения заведующего лабораторией.
7.1.5 Сотрудник, допускаемый к работе по методу ЖЦ, должен быть предварительно подготовлен и обучен работе с приборами у производителя (или его уполномоченного представителя).
7.1.6 Сотрудник, допускаемый руководителем лаборатории к работе, в том числе по методу ЖЦ, должен быть обучен методам контроля информативности материала путем микроскопии окрашенных препаратов.
7.1.7 Следует обратить внимание на перечень характеристик рекомендованного к использованию оборудования для ЖЦ (см. приложения В и Г).
7.1.8 Для пробоподготовки материала с ШМ, производящегося с целью выявления и ранней диагностики рака методом ЖЦ, использование цитоцентрифуг нецелесообразно.
7.1.9 Каждая лаборатория составляет внутренний документ - "Инструкцию по подготовке материала для исследования методом ЖЦ".
7.1.10 В данном документе подробно, по пунктам, расписывают весь процесс приготовления препаратов на основе ЖЦ для данной лаборатории с указанием конкретного оборудования, в соответствии с рекомендациями производителя оборудования, используемого в лаборатории.
7.1.11 В инструкции указывают, в том числе фирменные названия приборов, материалов, реагентов (названия растворов, включая фирменные, позволяющие их однозначно идентифицировать), номеров и/или названий программ, запускаемых на автоматических приборах, описание конкретных методик окраски, применяемых в данной лаборатории, названия форм и бланков, заполняемых в процессе выполнения методики.
Инструкция должна содержать следующие пункты:
- назначение процедуры;
- описание процедур;
- сбор материала;
- приготовление окрашенных цитологических препаратов методом ЖЦ.
Приложением к данной инструкции должны служить:
- перечень сотрудников, допущенных к работе по этому направлению (с указанием должностей сотрудников, принимающих участие в пробоподготовке и диагностике);
- ответственные за осуществление этих работ;
- оборудование;
- материалы;
- реагенты;
- процедуры;
- литература (при необходимости);
- перечень заполняемых форм.
7.1.12 Документ подписывает заведующий лабораторией; копии хранятся на рабочих местах непосредственных исполнителей методик.
7.2 Пробоподготовка
7.2.1 Материал для проведения исследования должен быть доставлен в лабораторию на маркированных предметных стеклах, а в случае использования метода ЖЦ - в маркированной емкости (виале) с транспортной жидкостью, количество которой варьирует в зависимости от объема и производителя виалы.
7.2.2 Пробоподготовку в рамках ЖЦ из доставленного в лабораторию материала в виалах необходимо произвести не позднее срока, указанного производителем. Например, не позднее четырех недель после получения материала, находящегося при комнатной температуре от 15 до 30°С; при температуре холодильной камеры от 2 до 10°С можно обрабатывать материал в течение полугода.
7.2.3 Этапы пробоподготовки (если производителем оборудования не предусмотрено иное):
_______________
Аналогично ГОСТ Р 57005 (см. подраздел 7.3).
7.2.3.1 содержимое виал перемешать;
7.2.3.2 консервирующую жидкость налить с помощью пипетки в пробирки для центрифугирования (~ 1/3 части пробирки);
7.2.3.3 для приготовления клеточной суспензии материал (~1/3 часть пробирки) перенести из виалы в пробирку в консервирующую жидкость (использовать аппарат для приготовления клеточной суспензии типа BD PrepMate™);
7.2.3.4 пробирки поместить в центрифугу и центрифугировать в щадящем режиме (при 200 rcf, 2 мин);
_______________
Relative centrifugal force - относительная центробежная сила, выражается в единицах g (гравитационная постоянная).
7.2.3.5 с помощью аспиратора убрать надосадочную жидкость и центрифугировать (при 800 rcf, 10 мин);
7.2.3.6 слить надосадочную жидкость полностью, резким движением перевернув штатив с пробирками на 180°;
_______________
В дальнейшем слитую жидкость утилизировать в соответствии с правилами обращения с отходами категории В.
7.2.3.7 с помощью "вортекс" перемешать образовавшийся клеточный осадок (~15 с);
7.2.3.8 перенос полученного клеточного осадка на предметные стекла проводить в соответствии с процедурой, установленной производителем оборудования;
7.2.3.9 аппарат для приготовления и окрашивания препаратов использовать в соответствии с руководством производителя оборудования;
7.2.3.10 приготовить препараты;
7.2.3.11 предметные стекла с нанесенным биоматериалом после окрашивания (если использовалось окрашивание по Папаниколау) промыть спиртом [опустив в емкость со спиртом или сливая спирт из пипетки (выше монослоя)]. Можно использовать специальный спрей для фиксации;
7.2.3.12 подсушить препарат;
7.2.3.13 подготовить покровные стекла необходимого размера;
7.2.3.14 на препарат в центр монослоя нанести монтирующую среду;
_______________
Главное требование к монтирующей среде - соответствие ее коэффициента преломления света к аналогичному показателю стекла. Виды монтирующих сред: канадский бальзам, глицерин-желатин, синтетическая, на основе полистирола и др.
7.2.3.15 заключить препарат под покровное стекло/пленку;
7.2.3.16 монтировать вручную покровное стекло следующим образом:
- приложить покровное стекло ребром под углом к препарату и опустить, избегая образования воздушных пузырей,
- при необходимости слегка нажать на покровное стекло, удалить излишки монтирующей среды (с помощью ваты/марли со спиртом/ксилолом),
- дать препарату подсушиться (время зависит от монтирующей среды);
7.2.3.17 использовать автоматизированные приборы для заключения препаратов под покровное стекло или пленку в соответствии с руководством производителя оборудования;
7.2.3.18 препараты, приготовленные традиционным способом, окрашивают теми же методами, что и препараты, приготовленные в рамках метода ЖЦ.
7.3 Хранение биоматериала
7.3.1 Нативный жидкостной биоматериал без добавления консервантов или транспортной жидкости, доставленный в лабораторию или оставшийся после взятия для исследования, можно хранить в холодильной камере при температуре от 2 до 10°С не более 4 ч.
7.3.2 Биоматериал в транспортной среде в комнатных условиях при температуре от 15 до 30°С можно хранить не более 4 недель, если иное не предусмотрено производителем транспортной среды или консерванта.
7.3.3 Биоматериал в транспортной среде можно хранить в холодильной камере при температуре от 2 до 10°С не более 6 мес, если иное не предусмотрено производителем транспортной среды или консерванта.
7.3.4 Окрашенные препараты, по которым выявлена онкопатология или предопухолевые изменения, необходимо хранить в комнатных условиях (при температуре от 15 до 30°С) в течение срока, установленного данным лечебным учреждением, но не менее 10 лет.
7.3.5 Окрашенные неинформативные препараты при температуре от 15 до 30°С необходимо хранить 2 недели (для контроля качества).
7.3.6 Транспортную среду при температуре от 15 до 30°С хранить не более 36 мес (если производителем реагентов не предусмотрено иное).
7.3.7 Нативный биоматериал, поступивший в лабораторию на предметных стеклах, можно хранить в сухом помещении без ограничений до момента использования.
7.3.8 Утилизацию отходов осуществляют в соответствии с требованиями действующих нормативных документов [5], а также инструкциями к приборам, реагентам и расходным материалам, использующимся для приготовления препаратов методом ЖЦ в данной лаборатории.
7.4 Диагностический этап
7.4.1 Подготовленные к просмотру препараты в сопровождении направления в установленном порядке отправляют на диагностику.
7.4.1.1 К диагностике материала, приготовленного любым методом, допускается только персонал, прошедший обучение и допущенный на этом основании к работе руководителем лаборатории с оформлением соответствующего распоряжения (приказа) по лаборатории.
7.4.2 Для адекватной оценки препарата необходимо системно произвести просмотр всего клеточного материала (см. рисунок 5), а затем дать оценку качества препарата и его информативности.

Рисунок 5 - Наиболее эффективная схема направления просмотра препарата
7.4.3 Необходимо сформулировать заключение, содержащее информацию:
7.4.3.1 о качестве препарата, его информативности;
7.4.3.2 о том, какое количество препаратов оценивают (описывают);
7.4.3.3 о причине, по которой препарат оценен исследователем как неинформативный или малоинформативный (при неинформативном или малоинформативном материале);
7.4.3.4 на предмет диагноза с указанием кода по МКБ-10 или описания препарата при невозможности выставления однозначного диагноза;
7.4.3.5 о причине, по которой исследователь счел невозможным указать точный диагноз;
7.4.3.6 в отношении рекомендаций по проведению дополнительных исследований или по повторному получению материала, если это необходимо для установления диагноза;
7.4.3.7 о дате исследования и ФИО выдавшего заключение.
7.5 Формулирование заключения
При оценке результатов цитологического исследования возможно использование классификации Папаниколау, Бетесда или традиционной, классической морфологической классификации (см. приложение Д).
Приложение А
(рекомендуемое)
Направление на цитологическое диагностическое исследование и результат исследования
Министерство здравоохранения Российской Федерации | Медицинская документация | ||||||||||||||||
Наименование учреждения | |||||||||||||||||
НАПРАВЛЕНИЕ | |||||||||||||||||
ПЕРВИЧНО | |||||||||||||||||
1. Отделение | |||||||||||||||||
История болезни N | |||||||||||||||||
2. Лечащий врач (ФИО, тел.) | |||||||||||||||||
3. ФИО больного (полностью) | |||||||||||||||||
4. Дата рождения | Пол: м ( ), ж ( ) | ||||||||||||||||
5. Страховая компания | N страхового полиса | Серия | |||||||||||||||
6. Диагноз (при направлении на цитологическое исследование) | |||||||||||||||||
Код по МКБ-10 | |||||||||||||||||
7. Краткий анамнез и важнейшие клинические симптомы: | |||||||||||||||||
8. Данные инструментального обследования (рентгенологического, УЗИ, КТ, эндоскопического и др.) | |||||||||||||||||
9. Проведенное лечение (оперативное, лучевое, химиотерапия; доза, дата начала и окончания лечения) | |||||||||||||||||
10. Локализация процесса и способ получения материала | |||||||||||||||||
11. Объем и макроскопическое описание биологического материала, маркировка препаратов | |||||||||||||||||
12. Дата взятия биологического материала | |||||||||||||||||
ФИО врача, направившего материал | |||||||||||||||||
Подпись врача | |||||||||||||||||
13. Объем и макроскопическое описание доставленного биологического материала (заполняют в лаборатории): | |||||||||||||||||
(Оборотная сторона) | |||||||||||||||||
Наименование цитологической лаборатории, телефон | |||||||||||||||||
Результат цитологического исследования N | |||||||||||||||||
Дата поступления материала | |||||||||||||||||
Дата проведения исследования | |||||||||||||||||
ФИО врача, проводившего исследование | |||||||||||||||||
Подпись | |||||||||||||||||
Приложение Б
(рекомендуемое)
Журнал регистрации материала, поступающего в цитологическую лабораторию, и проведенных исследований
Б.1 Обязательные поля:
- дата поступления материала;
- номер исследования;
Примечание - Указывают в диапазоне в зависимости от количества препаратов. Далее ставится знак "/" (например, для пяти препаратов, поступивших 1 января 2002 г. первыми, номер будет 1-5/02, следующие два препарата - (6-7/02).
- первично/повторно;
- отделение (учреждение), приславшее материал;
- N истории болезни или ID;
- лечащий врач (ФИО, тел.);
- ФИО больного (полностью);
- пол;
- дата рождения;
- диагноз (при направлении на цитологическое исследование), код по МКБ-10;
- важнейшие клинические данные;
- метод получения материала;
- откуда получен материал;
- характер материала;
- объем и макроскопическое описание биологического материала, маркировка препаратов;
- дата взятия биологического материала;
- ФИО врача, направившего материал;
- дата проведения исследования;
- результат цитологического исследования N;
- ФИО врача, проводившего исследование.
Б.2 Журнал должен быть прошнурован, пронумерован и скреплен печатью.
Приложение В
(рекомендуемое)
Требования к оборудованию и реактивам, используемым для проведения жидкостной цитологии гинекологического материала (эпителий шейки матки)
В.1 Общие требования
В.1.1 На все аппаратные средства, принадлежности, реагенты и расходные материалы комплекса для приготовления и окраски цитологических препаратов должны быть регистрационные удостоверения Федеральной службы по надзору в сфере здравоохранения и социального развития.
В.1.2 К оборудованию в обязательном порядке следует прилагать инструкцию на русском языке и подробное руководство пользователя.
В.1.3 Все компоненты оборудования (системы) должны быть приобретены у одного производителя либо производитель/поставщик должен предоставить официальные сведения о совместимости с оборудованием других фирм.
В.2 Приготовление и окрашивание препаратов при проведении цитологических исследований
В.2.1 Технология взятия и доставки биологического материала должна предоставлять возможность переноса на предметное стекло без потерь всего биологического материала, взятого у пациентки.
В.2.2 Срок годности консервирующей жидкости для гинекологического материала при хранении при комнатной температуре (от 15 до 30°C) должен составлять не менее 32 мес со дня изготовления.
В.2.3 Срок хранения флакона с клеточным материалом при комнатной температуре должен составлять не менее 2 недель.
В.2.4 Оборудование должно предоставлять возможность получить готовый препарат как без содержания эритроцитов и слизи, так и при сохранении исходного их количества в препарате.
В.2.5 Транспортная жидкость, используемая для сохранения материала при транспортировании, не должна препятствовать проведению других видов исследования (ИЦХ, ПЦР и пр.).
В.2.6 При наличии в составе консерванта (транспортной жидкости) веществ, влияющих на выбор тактики при проведении дополнительных исследований, производитель или поставщик должны в письменном виде предоставить информацию, касающуюся этого вопроса, самостоятельно или по запросу пользователя.
В.2.7 Технология приготовления и окраски клеточного материала должна быть управляемой и допускать изменения в случае необходимости для подготовки препаратов из различного материала, в том числе негинекологического, жидкостей и пр.
В.2.8 Оборудование должно обеспечивать возможность:
- управления объемом клеточной суспензии;
- управления объемом переносимого на предметное стекло клеточного материала;
- одновременного приготовления серии идентичных препаратов из одного материала в количестве не менее чем 12 шт. (от 1 до 12);
- вносить изменения в ход работы и протоколы;
- обработки материала, не исключающей дальнейшего использования препарата как для традиционного цитологического исследования, так и для автоматизированного;
- использования оставшегося после приготовления препаратов клеточного материала в других видах исследований;
- приготовления нативных (неокрашенных) монослойных препаратов, не менее 90 в 1 ч;
- приготовления окрашенных монослойных препаратов, не менее 40 в 1 ч.
Приложение Г
(рекомендуемое)
Перечень и краткая характеристика необходимого оборудования и расходных материалов, применяемых при использовании метода жидкостной цитологии
Г.1 Техническое оснащение лаборатории для проведения метода ЖЦ:
- центрифуга лабораторная с качающимся ротором, приспособленным для центрифугирования пробирок диаметром 17 мм, объемом 15 мл, способная обеспечить центрифугирование 600 g;
- "вортекс" для пробирок с плавной регулировкой скорости встряхивания от 100 до 3000 rpm;
- прибор для автоматического приготовления клеточной суспензии, выполняющий начальный процесс обогащения клеточной суспензии (состоящий в очистке суспензии от эритроцитов, детрита и элементов воспаления): перемешивание образца и его извлечение из пробирки с консервантом, затем нанесение образца на плотный реагент в пробирку для центрифугирования;
- аппарат для автоматической окраски препаратов - прибор для окрашивания образцов или эквивалент, который предназначается для обработки микропрепаратов, автоматического переноса клеточных образцов из пробирок для центрифугирования в осадочную камеру, помещаемую на предметное стекло для микроскопа, автоматически окрашивает и промывает каждый микропрепарат;
- рабочая станция для управления прибором или эквивалент: системный блок с предустановленным программным обеспечением, монитор, клавиатура, мышь;
- аспиратор - система создания вакуума для удаления продуктов окрашивания: емкость, компрессор, комплект трубок не менее одного комплекта;
- считыватель штрих-кода.
Г.2 Расходные материалы:
- одноразовые пробирки из пластика диаметром 17 мм, вместимостью до 15 мл, с закручивающейся крышкой, выдерживающие центрифугирование при скорости 600 g;
- одноразовые стерильные виалы с транспортной средой;
- одноразовые стерильные цитологические щетки для забора материала с влагалищной части шейки матки;
- одноразовые стерильные цитологические щетки для забора материала из цервикального канала;
- предметные стекла для микроскопии с адгезивным покрытием (например, D-полилизиновым) или без оного - в зависимости от конкретной методики;
- набор одноразовых пастеровских пипеток для работы с жидкостью и клеточным осадком;
- при необходимости - пленка или покровные стекла для покрытия препаратов;
- консервирующая (транспортная) жидкость;
- красители, буферы, забуференная или дистиллированная вода, фиксаторы и спецрастворы в зависимости от способа окраски;
- одноразовые наконечники для переноса и дозирования материала;
- средство для промывания аппарата для автоматической окраски препаратов;
- контейнер для сбора и утилизации отходов класса B.
Приложение Д
(справочное)
Системы оценки цитологических препаратов
Таблица Д.1 - Системы оценки цитологических препаратов
Морфология | Система CIN | Папаниколау | Бетесда (1991) |
Возрастная норма. Патологические изменения эпителия слизистой отсутствуют. Клеточный состав также в пределах нормы | Норма | Класс I | Негатив |
Незначительные клеточные изменения | Незначительные клеточные изменения | Класс II | Доброкачественные клеточные изменения, воспаление, признаки различных инфекций, радиационные изменения, реактивные, репаративные |
Плоскоклеточная атипия + полиморфные изменения (воспаления, инфекции и т.п.) | Плоскоклеточная атипия + полиморфные изменения (воспаления, инфекции и т.п.) | Класс II | ASCUS (АПНЗ) + полиморфные изменения |
Папилломавирусные изменения (койлоцитоз) | Папилломавирусные изменения (койлоцитоз) | Класс II | LSIL (Н-ПИП) |
Слабая дисплазия | CIN I | Класс III | LSIL (Н-ПИП) |
Дисплазия средней степени | CIN II | Класс III | HSIL (Н-ПИП) |
Дисплазия высокой степени | CIN III | Класс III | HSIL (Н-ПИП) |
Карцинома in situ (CIS) | CIN III | Класс IV | HSIL (Н-ПИП) |
Инвазивный РШМ | Инвазивный РШМ | Класс V | |
Атипия клеток железистого эндоцервикального эпителия | Атипия клеток железистого эпителия, эндоцервикального эпителия | - | Атипия клеток железистого эпителия, эндоцервикального эпителия |
Аденокарцинома | Аденокарцинома | Аденокарцинома | Аденокарцинома |
Примечание - CIN (cervical intraepithelial neoplasia) - цервикальная интраэпителиальная неоплазия; ASCUS (atypical squamous cell of undetermined significance) - АПНЗ (атипия плоскоклеточная неопределенной значимости); LSIL (low-grade squamous intraepithelial lesions) - Н-ПИП (плоскоклеточное интраэпителиальное поражение низкой степени выраженности); HSIL (high-grade squamous intraepithelial lesions) - В-ПИП (плоскоклеточное интраэпителиальное поражение высокой степени выраженности). | |||
Библиография
[1] | Руководство ВОЗ "Комплексная борьба с раком шейки матки: руководство по основам практики - 2 издание" (WHO, Comprehensive cervical cancer control: a guide to essential practice - 2nd ed) |
[2] | Международная статистическая классификация болезней и проблем, связанных со здоровьем - 10-й пересмотр (International Statistical Classification of Diseases and Related Health Problems - Teath Revision - Volume 3. Alphabetical Index) |
[3] | ВОЗ, Классификация опухолей женских репродуктивных органов [WHO Classification of Tumours of the Female Reproductive Organs (IARC WHO Classification of Tumours) Fourth Edition] |
[4] | Цитологическая классификация Бетесда (Cytology classification. The Bethesda System 2014) |
[5] | СанПиН 2.1.7.2790-10 "Санитарно-эпидемиологические требования к обращению с медицинскими отходами" |
УДК 616-006-072/-079:618.146(083.74) | ОКС 03.040, 11.040.01, 11.100.01 | |
Ключевые слова: диагностика в онкологии, алгоритм диагностики, шейка матки, лабораторный этап | ||
Электронный текст документа
и сверен по:
, 2020