ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТ Р
ИСО 20166-3—
2023
Молекулярные диагностические исследования in vitro
ТРЕБОВАНИЯ К ПРОЦЕССАМ ПРЕАНАЛИТИЧЕСКОГО ЭТАПА ИССЛЕДОВАНИЯ ЗАФИКСИРОВАННЫХ ФОРМАЛИНОМ ТКАНЕЙ В ПАРАФИНОВЫХ БЛОКАХ (FFPE)
Часть 3 Выделенные ДНК (ISO 20166-3:2018, IDT)
Издание официальное
Москва Российский институт стандартизации 2023
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») (Комитетом по молекулярной диагностике инфекционных и неинфекционных заболеваний «ФЛМ») на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2023 г. № 559-ст
4 Настоящий стандарт идентичен международному стандарту ИСО 20166-3:2018 «Молекулярные диагностические исследования in vitro. Требования к процессам преаналитического этапа исследования зафиксированных формалином тканей в парафиновых блоках (FFPE). Часть 3. Выделенные ДНК» (ISO 20166-3:2018 «Molecular in vitro diagnostic examinations — Specifications for pre-examination processes for formalin-fixed and paraffin-embedded (FFPE) tissue — Part 3: Isolated DNA», IDT).
Международный стандарт разработан Техническим комитетом ИСО/ТК 212 «Клинические лабораторные исследования и диагностические тест-системы in vitro».
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты, сведения о которых приведены в приложении ДА.
Дополнительные сноски в тексте стандарта, выделенные курсивом, приведены для пояснения текста оригинала
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2018 © Оформление. ФГБУ «Институт стандартизации», 2023
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Общие положения
5 Деятельность вне лаборатории
6 Деятельность внутри лаборатории
Приложение А (справочное) Влияние температуры хранения на целостность ДНК в блоках ткани FFPE
Приложение ДА (справочное) Сведения о соответствии ссылочных международных стандартов национальным стандартам
Библиография
Введение
Молекулярная диагностика in vitro, включая молекулярную патологию, позволила добиться значительного прогресса в медицине. Ожидается дальнейший прогресс в области новых технологий исследования нуклеиновых кислот, белков и метаболитов в тканях и жидкостях человеческого организма. Однако в процессе сбора, транспортирования, хранения и обработки образцов профиль и/или целостность молекул может претерпеть радикальные изменения, что приведет к ненадежности или даже невозможности диагностики в связи с тем, что результаты исследования будут соответствовать не реальному состоянию пациента, а отражать искаженный профиль, возникший в результате процессов, произошедших с образцом до проведения исследования. Были проведены исследования для определения факторов, влияющих на исследование ДНК ткани, зафиксированной формалином в парафиновом блоке (FFPE). Исследования показали, что необходима стандартизация всего процесса преана-литического этапа от взятия образцов до исследования ДНК. Результаты работы по систематизации и стандартизации процесса преаналитического этапа для тканей FFPE в отношении исследования ДНК являются предметом настоящего стандарта.
Целостность ДНК может изменяться до, во время и после фиксации ткани формалином, ее обработки и хранения. Химические модификации, внесенные в ДНК во время фиксации ткани, могут привести к фрагментации и сдвигу последовательности цепочки, смене состояния метилирования или даже к структурным изменениям молекулы, например к изменению числа ложных копий в профиле массива CGH (сравнительная геномная гибридизация). Такие модификации молекул ДНК могут влиять на достоверность и надежность результатов исследования, поэтому следует принять меры по минимизации описанных изменений и модификаций ДНК для проведения последующего исследования.
В настоящем стандарте использованы следующие формулировки:
- «должен/должна/должно» указывает на требование;
- «следует» — на рекомендацию;
- «мог/могла/могло бы» — на разрешение;
- «может/способен» — на способность или возможность.
ГОСТ Р ИСО 20166-3—2023
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
Молекулярные диагностические исследования in vitro
ТРЕБОВАНИЯ К ПРОЦЕССАМ ПРЕАНАЛИТИЧЕСКОГО ЭТАПА ИССЛЕДОВАНИЯ ЗАФИКСИРОВАННЫХ ФОРМАЛИНОМ ТКАНЕЙ В ПАРАФИНОВЫХ БЛОКАХ (FFPE)
Часть 3 Выделенные ДНК
Molecular in vitro diagnostic examinations. Specifications for pre-examination processes for formalin-fixed and paraffin-embedded (FFPE) tissue. Part 3. Isolated DNA
Дата введения — 2024—05—01
1 Область применения
В настоящем стандарте содержатся руководящие принципы обращения, документирования, хранения и обработки образцов тканей, зафиксированных формалином в парафиновых блоках (FFPE), предназначенных для исследования ДНК на преаналитическом этапе молекулярного исследования.
Настоящий стандарт применим к молекулярным диагностическим исследованиям in vitro, включая лабораторно разработанные тесты*, выполняемые медицинскими лабораториями и лабораториями молекулярной патологии. Настоящий стандарт предназначен для использования поставщиками, разработчиками и производителями медицинских изделий для диагностики in vitro, биобанками, учреждениями и коммерческими организациями, осуществляющими биомедицинские исследования, а также регулирующими органами**.
Примечание — Международные, национальные или региональные правила или требования могут также применяться к конкретным темам, рассматриваемым в настоящем стандарте.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты [для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных — последнее издание (включая все изменения)]:
ISO 15189:2012, Medical laboratories — Requirements for quality and competence (Медицинские лаборатории. Требования к качеству и компетентности)***
* В Российской Федерации к термину «лабораторно разработанные тесты» (медицинские изделия или методики их применения, разработанные в лаборатории для собственного применения) применяют определение «незарегистрированные медицинские изделия для диагностики in vitro» в соответствии с Федеральным законом от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
Государственный контроль за обращением медицинских изделий осуществляется уполномоченным
Правительством Российской Федерации федеральным органом исполнительной власти, в настоящее время Федеральной службой по надзору в сфере здравоохранения.
Заменен на ISO 15189:2022. Однако для однозначного соблюдения требования настоящего стандарта, приведенного в датированной ссылке, рекомендуется использовать только указанное в этой ссылке издание.
Издание официальное
ISO 15190, Medical laboratories — Requirements for safety (Медицинские лаборатории. Требования к безопасности)
3 Термины и определения
В настоящем стандарте применены термины по ИСО 15189, а также следующие термины с соответствующими определениями.
Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам:
- платформа онлайн-просмотра ИСО по адресу: http://www.iso.org/obp;
- Электропедия МЭК по адресу: http://www.electropedia.org/.
3.1 аликвота (aliquot): Часть от большего количества гомогенного материала, при взятии которого допустима незначительная погрешность выборки.
Примечание 1 — Данный термин обычно применяют к жидкостям. Ткани гетерогенны и, как следствие, аликвота тканей не может быть взята.
Примечание 2 — Определение заимствовано из [25]—[27].
3.2 температура окружающей среды (ambient temperature): Нерегулируемая температура окружающего воздуха.
3.3 аналит (analyte): Компонент, представленный в наименовании измеряемой величины.
[ИСО 17511:2003, 3.2, измененный — примечание удалено]
3.4 аналитические характеристики теста [методики] (analytical test performance): Точность, погрешность и чувствительность теста для измерения искомого аналита (см. 3.3).
Примечание 1 — Также могут быть применены другие характеристики продуктивности метода исследования, такие как надежность, повторяемость.
3.5 экстракорпоральное хранение, холодовая ишемия (cold ischemia): Условия хранения образца от момента извлечения из организма до стабилизации и фиксации.
3.6 диагноз (diagnosis): Заключение о состоянии здоровья или наличии заболевания по его признакам и/или симптомам; процесс постановки диагноза может включать обследование и исследование (см. 3.8) для отнесения состояния индивидуума к принятым классификациям и номенклатуре болезней, что позволяет принимать медицинские решения по прогнозу и лечению.
3.7 дезоксирибонуклеиновая кислота; ДНК (DNA, deoxyribonucleic acid): Полимер дезоксирибонуклеотидов, существующий в двухцепочечной (дцДНК) или одноцепочечной (оцДНК) форме.
[ИСО 22174:2005, 3.1.2]
3.8 исследование, аналитический тест, анализ (examination, analytical test): Ряд операций, имеющий объектом определения значения или характеристики свойства.
Примечание — Процессы, которые начинаются с изолированного аналита и включают в себя все виды тестирования параметров или химические манипуляции для количественного или качественного исследования.
3.9 формалин (formalin): Насыщенный водный раствор формальдегида, который на 100 % содержит 37 % формальдегида по массе (что соответствует 40 % по объему).
3.10 фиксация формалином (formalin fixation): Обработка образца (исходного образца, первичной пробы) стандартным забуференным раствором формалина (см. 3.20) для стабилизации.
3.11 макроскопическое исследование (grossing, gross examination): Осмотр патологических образцов невооруженным глазом для получения диагностической информации и обработка для дальнейшего микроскопического исследования.
3.12 интерферирующие вещества (interfering substances): Эндогенные вещества образца (см. 3.15)/лробь/ (см. 3.18) или экзогенные вещества (например, стабилизирующий раствор), которые могут изменить результат исследования.
3.13 заливка парафином (paraffin embedding): Процесс заливки образца ткани в парафиновый блок для создания твердой внешней матрицы для получения тонких срезов, пригодных для микроскопирования.
3.14 процесс подготовки, преаналитический этап, преаналитический рабочий процесс (preexamination process, preanalytical phase, preanalytical workflow): Процесс, который в хронологическом порядке начинается с клинического запроса, включающий оценку направления, подготовку и идентификацию пациента, сбор первичных образцов (см. 3.15), транспортирование в клинико-диагностическую 2
лабораторию или в лабораторию патолого-анатомического отделения, выделение аналита (см. 3.3) и завершается началом аналитического исследования.
Примечание 1 — Преаналитический этап включает подготовительные процессы, влияющие на планируемое исследование.
[ИСО 15189:2012, 3.15, измененный — «преаналитический этап» добавлен в качестве термина, добавлено примечание 1 и расширено определение]
3.15 первичный образец, проба (primary sample, specimen): Дискретная порция биологической жидкости, выдыхаемого воздуха, волос или тканей, взятая для исследования (см. 3.8), изучения или анализа одной или нескольких величин или свойств, которые предполагается приписать целому.
[ISO 15189:2012, 3.16, измененный — примечания 1—3 удалены]
3.16 проверка квалификации (proficiency test): Оценивание характеристики функционирования участника по заранее установленным критериям посредством межлабораторных сличений.
[ИСО 17043:2010, 3.7, изменено — примечания 1 и 2 удалены]
3.17 комнатная температура (room temperature): Для целей настоящего стандарта температура в пределах от 18 °C до 25 °C.
Примечание 1 — Национальные правила или требования могут иметь различные определения.
3.18 проба (sample)*: Одна или несколько частей, которые взяты из первичного образца (см. 3.15). [ИСО 15189:2012, 3.24, измененный — пример удален]
3.19 стабильность (stability): Характеристика материала образца, описывающая ее способность сохранять значения свойства в определенных пределах в течение определенного периода времени при хранении в установленных условиях.
Примечание 1 — Для процессов, описанных в настоящем стандарте, аналитом является выделенная ДНК.
[Руководство ИСО 30:2015, 2.1.15, измененный — «стандартный образец» заменен на «материал пробы», «способность» заменена на «характеристика, описывающая возможность», также изменено примечание 1]
3.20 стандартный забуференный раствор формалина, нейтральный буферный формалин; НБФ (standard buffered formalin solution, neutral buffered formalin, NBF): 10 %-ный раствор формалина (см. 3.9) в воде с массовой долей 3,7 % (соответствующий объемной доле 4 %) формальдегида, буферизированный до pH 6,8—7,2.
Примечание 1 — Стандартные буферные растворы формалина часто содержат небольшое количество метанола для замедления окисления и полимеризации формальдегида.
3.21 хранение (storage): Длительный период прерывания преаналитического этапа исследования (см. 3.14) образца (см. 3.18), или аналита (см. 3.3), или его производных, таких как окрашенные препараты на стекле или образцы ткани в парафиновых блоках, в соответствующих условиях при условии сохранения свойств образца.
Примечание 1 — Долгосрочное хранение обычно осуществляют в лабораторных хранилищах или в биобанках.
3.22 гистологический процессор (tissue processor): Аппарат для автоматизированной проводки тканей, в которой происходит их фиксация, дегидратация и пропитывание парафином.
3.23 валидация (validation): Подтверждение посредством представления объективных свидетельств того, что требования, предназначенные для конкретного использования или применения, выполнены.
Примечание 1 — Термин «валидирован» используют для обозначения соответствующего статуса.
[ИСО 9000:2015, 3.8.13, измененный — примечания 1 и 3 удалены]
3.24 интракорпоральная ишемия (warm ischemia): Состояние ткани или органа во время хирургических или диагностических манипуляций, уже лишенных нормального кровоснабжения до момента извлечения из организма.
В настоящем стандарте понятие «фрагмент» использовано как часть первичного образца (пробы).
3.25 рабочий процесс (workflow): Последовательные действия, необходимые для выполнения задачи.
3.26 гомогенный (homogeneous): Однородный по структуре и составу.
4 Общие положения
Общие положения о системе менеджмента качества медицинских лабораторий и, в частности, о взятии образцов и обращении с ними (включая предотвращение перекрестного загрязнения) приведены в ИСО 15189:2012 (4.2, 5.4.4, 5.4.6) или в ИСО/МЭК 17020:2012 (раздел 8 и 7.2). Необходимо соблюдать требования к лабораторному оборудованию, реагентам и расходным материалам в соответствии с ИСО 15189:2012 (5.3), ИСО 15189:2012 (5.5.1.2 и 5.5.1.3), а также ИСО/МЭК 17020:2012 (6.2).
Все этапы диагностического рабочего процесса могут повлиять на конечный результат аналитического исследования. Таким образом, весь рабочий процесс, включая стабильность биомолекул и условия хранения образцов, должен быть проверен и валидирован. Этапы рабочего процесса, которые не всегда поддаются контролю (например, тепловая ишемия), должны быть задокументированы. Должна быть проведена оценка рисков неконтролируемых этапов рабочего процесса, включая их потенциальное влияние на этап проведения аналитических исследований, и должны быть приняты меры по предотвращению последствий для обеспечения требуемых результатов аналитических тестов.
В отличие от РНК или белков, ДНК в тканях относительно стабильна при тепловой и холодовой ишемиях. Изменения последовательности ДНК или числа копий, например сравнительные профили геномной гибридизации (CGH), из-за более длительной тепловой и холодовой ишемий неизвестны [7]. Однако паттерны метилирования ДНК могут варьироваться в ответ на ишемию [6]. Помещение образца в стандартный забуференный раствор формалина должно быть выполнено в максимально короткий интервал времени, чтобы избежать ферментативной деградации ДНК. Продолжительность и температура хранения образца до его фиксации должны быть задокументированы [5].
Во время фиксации, обработки и хранения целостность ДНК может изменяться в зависимости от вида фиксации, продолжительности и температуры хранения или архивирования ткани, зафиксированной в парафиновом блоке, а также метода, используемого для выделения и очистки ДНК. При использовании фиксатора на основе формальдегида продолжительность и температура фиксации образца оказывают существенное влияние на целостность ДНК. Чем выше температура фиксации и длиннее интервал продолжительности времени, тем больше образуется химических модификаций и перекрестных связей, что может привести к деградации или изменению последовательности ДНК (см. [9]—[14]). Такие последствия могут ограничивать размер амплифицируемой целевой ДНК и/или влиять на целевую последовательность праймеров, используемых для амплификации.
Инструкции по технике безопасности при транспортировании и обработке образцов должны быть рассмотрены и соблюдены в соответствии с ИСО 15189:2012 (5.2.3 и 5.4.5) и ИСО 15190.
В течение всего процесса макроскопического исследования должны приниматься меры предосторожности во избежание перекрестного загрязнения между различными образцами/фрагментами, например при применении одноразовых материалов, когда это возможно, или при проведении соответствующих процедур очистки между обработкой различных образцов/фрагментов.
Если промышленные наборы для выделения ДНК использованы не в соответствии с инструкциями производителя, то ответственность за эффективность их применения лежит на пользователе.
5 Деятельность вне лаборатории
5.1 Взятие образцов
5.1.1 Общие положенияДля взятия образца следует учитывать требования (например, стадию заболевания донора/паци-ента, размер образца) предполагаемого молекулярного исследования (см. также раздел 6).
См. также ИСО 15189:2012 (5.4.4).
5.1.2 Информация о доноре/пациенте образца
Документация должна включать идентификацию донора/пациента, у которого взят образец; идентификация может быть представлена в виде кода. Документация должна включать, но не ограничиваться следующими данными:
а) данные о состоянии здоровья донора/пациента [например, здоровый, тип заболевания, сопутствующие болезни, демографические данные (например, возраст и пол)];
Ь) информация о плановом медицинском лечении и специальном лечении перед взятием образцов тканей (например, прием анестетиков, лекарств, проведенные хирургические или диагностические процедуры);
с) информированное согласие донора/пациента.
5.1.3 Информация об образце
Документация должна включать, но не ограничиваться, следующими данными:
а) начало ишемии в организме (тепловая ишемия) путем документирования точки перевязки/пе-режатия сосудов, имеющей отношение к ишемии (обычно время артериального пережатия);
Ь) время и дату удаления ткани из организма и метод удаления (например, пункционная биопсия, резекция, устройство для биопсии, используемое для сбора);
с) описание типа и происхождения ткани, состояние ткани (например, патологическая, не пораженная болезнью), включая ссылки на любую маркировку, нанесенную в операционной или за ее пределами, сделанную хирургом, рентгенологом или патологоанатомом;
d) этапы документирования, описанные в 6.2, если фиксация формалином начинается вне помещения лаборатории, а также этапы документирования, описанные в 6.3, если исследование патологии образца и взятие образца(ов) также выполняют за пределами помещения лаборатории.
Документация также должна включать идентификацию лица, ответственного за взятие образца.
5.1.4 Обработка образцов
Необходимо выполнить следующие действия:
а) документирование любых дополнений или модификаций образца после извлечения из тела [например, маркировка ориентирования образца (маркировка чернилами, швы, надрезы)];
Ь) выбор и использование контейнеров (например, холодильник, контейнер для хранения и транспортирования, вакуумная упаковка) в соответствии с правилами транспортирования образцов;
с) выбор и использование процедур стабилизации (например, методов охлаждения) при транспортировании.
Примечание 1 — Случайное замораживание ткани (например, при неправильном использовании охлаждающих элементов) может привести к повреждению ДНК. Деградация при последующем оттаивании ткани также может повлиять на морфологическую характеристику.
Примечание 2 — Этот этап можно пропустить, если образец переносят непосредственно в стандартный забуференный раствор формалина (см. 6.2) и обращают внимание на важность объема фиксатора и срезов ткани для обеспечения достаточного проникновения фиксатора;
d) маркировку контейнера для взятия и транспортирования образцов [например, регистрационный номер, штрих-код (1D или 2D), тип образца, количество и ткань происхождения органа] и дополнительную документацию [информация, указанная в перечислениях а)—с) 5.1.2—5.1.4].
Несколько образцов от одного и того же донора/пациента со сходными характеристиками (макроскопический вид, тип ткани, статус заболевания и анатомическая локализация) могут быть помещены в один контейнер/контейнерный отсек.
Образцы следует без промедления переносить в транспортный контейнер после извлечения из тела. Затем контейнер следует хранить на влажном льду или при температуре от 2 °C до 8 °C, чтобы свести к минимуму деградацию ДНК.
Температура окружающей среды транспортного контейнера во время холодовой ишемии (например, температура в разных помещениях, транспорте) должна быть задокументирована. Если температуру не представляется возможным измерить, диапазон температур следует оценивать по классификации: температура окружающей среды, комнатная температура или температура от 2 °C до 8 °C.
5.2 Требования к транспортированию
Лаборатория в сотрудничестве с клиническим или хирургическим отделением должна установить требования к процедуре транспортирования образцов.
Мониторинг температуры должен быть осуществлен надлежащим образом.
Если образец еще не помещен в стандартный забуференный раствор формалина, его следует без промедления транспортировать на влажном льду или при температуре от 2 °C до 8 °C, чтобы свести к минимуму изменения в ДНК.
Если образец уже помещен в стандартный забуференный раствор формалина за пределами помещения лаборатории, то температура во время транспортирования не должна превышать комнатной.
Соблюдение требований процедуры транспортирования образцов, а также любые отклонения от данной процедуры должны быть задокументированы.
6 Деятельность внутри лаборатории
6.1 Информация о приеме образца
Идентификация лица, принимающего образец, должна быть документально подтверждена. Дата, время и условия доставки полученных образцов (например, маркировка, условия транспортирования, включая температуру, тип ткани и количество образца, утечка/разрыв контейнера), а также любые отклонения от процедуры транспортирования образцов (см. 5.2) должны быть задокументированы.
Должна быть проверена правильность идентификации образца. Идентификация включает клиническую информацию (см. 5.1.2 и 5.1.3) образца, номер госпитализации и/или идентификационный номер донора/пациента, имя пациента, дату и год рождения пациента.
6.2 Формалиновая фиксация образца или фрагмента(ов)
Процедура фиксации образца применима как к образцу в целом, так и в том случае, если одна или несколько частей (фрагментов) взяты из образца в результирующую(ие) пробу(ы).
Используемый фиксатор должен представлять собой стандартный забуференный раствор формалина.
Примечание — В некоторых странах стандартный забуференный раствор формалина называется нейтральным буферизованным формалином (NBF).
Значение pH стандартного буферизованного раствора формалина следует проверять не реже одного раза в неделю и перед использованием или с каждой новой партией формалина, поскольку раствор не стабилен (например, формальдегид имеет тенденцию к окислению до муравьиной кислоты) [13].
Должно быть выполнено следующее:
а) ознакомление с паспортом безопасности (SDS) производителя перед началом работы со стандартным забуференным раствором формалина.
Примечание — Формальдегид является канцерогенным и опасным соединением, которое проникает в ткани и вызывает химическую модификацию биомолекулы. Тем не менее на территориальном уровне могут быть разработаны классификации потенциальной канцерогенности формальдегида;
Ь) документирование процедуры помещения образца ткани в стандартный забуференный формалин.
Примечание — Общая продолжительность фиксации в формалине может повлиять на результаты дальнейшего исследования, например иммуногистохимические методы, молекулярные исследования на основе нуклеиновых кислот [16] (см. также А.2). Оптимальная продолжительность фиксации формалином может варьироваться в зависимости от типа и размера ткани. Для больших хирургических образцов, например резецированный желудок, неоднородное уплотнение может произойти до процесса фиксации из-за медленного проникновения формальдегида с поверхности тканей внутрь.
Пример—Для кусочков ткани толщиной 5 мм продолжительность фиксации от 12 до 24 ч в большинстве случаев является приемлемой для надлежащего проникновения и фиксации. См. также 6.8.2;
с) выбор контейнера(ов):
1) вместимость контейнеров для взятия образцов должна быть такой, чтобы образец можно было полностью погрузить в стандартный забуференный раствор формалина. Минимальное соотношение объема стандартного забуференного раствора формалина и объема ткани зависит от конкретной ткани, но должно составлять не менее 10:1 (объем к объему) [7]. Чтобы обеспечить полную фиксацию формалином больших образцов, следует проводить специальную обработку тканей, такую как разрез(ы) цельных органов или вскрытие полых органов.
Образцы большего размера, возможно, придется разделить пополам и выбрать соответствующие части для обеспечения надлежащего проникновения фиксатора. В этом случае стандартный забуференный раствор формалина необходимо периодически менять,
2) при использовании контейнеров, предварительно заполненных стандартным забуферен-ным раствором формалина, необходимо соблюдать инструкции производителя,
3) контейнер должен надежно закрываться;
d) маркировка контейнера [например, с помощью самоклеящихся этикеток, рукописного ввода данных, устройств радиочастотной идентификации (RFID), предварительно маркированных контейнеров, штрих-кодов], которая должна обеспечивать надлежащую прослеживаемость образцов. Таким образом, маркировка сборных контейнеров должна содержать следующую минимальную информацию:
1) об идентификаторе пациента/донора, уникальном идентификаторе образца и дате взятия образца, которые могут быть представлены в виде кода (уникального для каждого образца),
2) основную информацию об образце, такую как тип и состояние ткани, и соответствующую дополнительную информацию, например пораженная ткань (например, опухоль) или неизмененная ткань, при условии, что система отслеживания образцов не может предоставить такую информацию в сочетании с идентификацией образца согласно перечислению 1) d) 6.2,
3) об уникальном номере каждого контейнера, который может быть включен в идентификатор образца согласно перечислению 1) d) 6.2;
е) документация о типах ткани образца, а также его описание и количество.
Следует учитывать, что при некоторых заболеваниях, например при опухолях тканей, молекулярные признаки могут неоднородно присутствовать в образце ткани. Следовательно, важно, чтобы часть фактического образца ткани, предназначенная для молекулярного исследования, оценивалась патологоанатомом с медицинской квалификацией (например, наличие сертификата специалиста) (см. 6.3). В этом контексте следует задокументировать, какие признаки заболевания действительно отражены в образце ткани или фрагменте, используемом для молекулярного исследования (например, в центре и на фронте инвазии опухоли могут активироваться различные молекулярные механизмы, опухоли также могут состоять из участков с разной степенью дифференциации).
6.3 Исследование патологии образца и взятие образца(ов)
Исследование и документирование патологии образца, а также взятие образца для дальнейшей обработки должны быть выполнены патологоанатомом с медицинской квалификацией (например, наличие сертификата специалиста) или под его наблюдением. Могут быть применены территориальные, национальные или региональные правила.
Ниже приведены варианты выбора образца(ов) для исследования ДНК.
а) Взятие соответствующих частей (фрагментов) образца ткани для молекулярного и гистопатологического исследований, а также в случае проведения исследований для иных целей должно быть осуществлено патологоанатомом с медицинской квалификацией (например, наличие сертификата специалиста) или под его наблюдением для того, чтобы гарантировать, что исследования ДНК не ставят под угрозу проведение гистопатологического исследования. Для молекулярного исследования следует выбирать подходящие части ткани образца, так как кровоточащие и некротические части могут привести к недостоверному результату молекулярного исследования, и их применения, по возможности, необходимо избегать. Микродиссекцию ткани следует рассматривать для взятия или дополнения определенных клеточных признаков заболевания.
Примечание 1 — Взятие соответствующих частей образца может быть также осуществлено за пределами лаборатории, например в операционной (см. 5.1.4) в соответствии с процедурами, утвержденными локальными актами организации.
При проведении макроскопического исследования образца хирургического профиля до и/или после фиксации формалином следует проверить клиническую информацию (см. 5.1.2 и 5.1.3) об образце (например, номер, тип ткани, размер), номер госпитализации, и/или номер патологического случая, и/или идентификатор донора/пациента, имя пациента, дату и год его рождения. Информация об образце и результаты исследования должны быть надлежащим образом задокументированы в соответствии с рекомендациями медицинских сообществ и в соответствии с клинической информацией, например историей болезни пациента или направлением врача. Должна быть описана анатомическая локализация, представленная в образце, края резекции и другие значимые участки могут быть отмечены, если это необходимо для проведения последующего микроскопического исследования; допускается применять фотографии образца. Репрезентативные образцы для проведения микроскопического исследования должны быть взяты (собраны) в соответствии с рекомендациями по конкретным органам/ заболеваниям соответствующих медицинских сообществ.
Примечание 2 — Вышеописанное исследование и документирование патологии образца также могут быть выполнены за пределами лаборатории, например в операционной.
Ь) Если образец ткани взят из организма без соблюдения требований для проведения гистопатологической диагностики, то документирование информации об образце, его взятии и исследовании может быть выполнено другими квалифицированными лицами, кроме патологоанатомов.
Документация может включать фотографии. Размер образцов должен соответствовать размеру кассеты с тканями образцов (максимальный размер — 3 х 2 х 0,5 см). Если образец еще не зафиксирован должным образом, то можно выполнить постфиксацию внутри кассеты с тканями. Каждая кассета с тканями должна быть маркирована уникальным идентификатором (например, штрих-код, номер, аббревиатура ткани). Если одна кассета с тканями содержит несколько фрагментов одного и того же образца с разными характеристиками (например, тип ткани, статус заболевания, местонахождение), то такая информация должна быть задокументирована.
Момент времени переноса фрагмента ткани, взятого из образца, в кассету с тканями должен быть задокументирован.
Без промедления, т. е. предпочтительно в течение 60 мин, образец ткани следует поместить либо в стандартный забуференный раствор формалина, либо, если он уже зафиксирован, в спиртосодержащий раствор (например, 70 %-ный раствор этанола) на гистологическом процессоре.
Температура и общая продолжительность фиксации формалином должны быть задокументированы.
6.4 Постфиксация замороженных образцов
Замороженные образцы или фрагменты (например, после диагностики замороженных участков) могут быть помещены в стандартный буферный раствор формалина для дальнейшего встраивания парафина.
Общая продолжительность фиксации формалина должна быть задокументирована.
Информация о фрагменте или образце ткани FFPE, полученного из замороженного фрагмента или образца, должна быть задокументирована.
6.5 Декальцинация
Декальцинация корректирует твердый состав костей до мягкости парафина. Образцы должны быть декальцинированы, например с помощью ЭДТА (этилендиаминтетрауксусной кислоты). Процедура декальцинации должна быть задокументирована.
6.6 Обработка и заливка парафином
Момент времени помещения в спиртосодержащий раствор гистологического процессора после того, как образец или фрагмент зафиксирован в стандартном буферном растворе формалина, должен быть задокументирован. Дальнейшую обработку образца или фрагмента проводят в гистологическом процессоре в соответствии с инструкциями производителя.
Примечание 1 — Во время обработки ткань обезвоживается, и воду заменяют парафиновым воском. Остаточная вода может влиять на качество и стабильность тканей при их хранении, в том числе и на ДНК [7].
Замена реагентов должна проводиться на регулярной основе в соответствии с инструкциями производителей.
Продолжительность и температура процесса пропитывания парафином могут влиять на целостность биомолекул в фиксированной ткани. Для пропитывания тканей следует использовать парафин со стандартизованным составом и с низкой температурой плавления. Продолжительность и температура каждого этапа процесса пропитывания парафином должны соблюдаться в соответствии с инструкциями производителей или процедурами, применяемыми в лаборатории. Данные процедуры должны быть задокументированы.
Примечание 2 — Типичные низкие температуры плавления парафина находятся в диапазоне от 50 °C до 56 °C.
6.7 Требования к хранению
Продолжительность и температура хранения, такие как температура окружающей среды архива, влияют на стабильность ДНК в ткани FFPE [29] (см. А.2).
Тканевый блок FFPE следует хранить в сухом месте при комнатной температуре или, что предпочтительнее, при более низкой температуре.
Примечание 1 — Более низкие температуры хранения (например, от 2 °C до 8 °C, минус 20 °C) замедляют процесс деградации ДНК в течение длительного времени (см. также приложение А).
Примечание 2 — Если тканевый блок FFPE не хранят в сухом месте, то деградация ДНК может возрасти, а рост грибков и бактерий может усилиться.
Примечание 3 — Имеются данные о том, что тканевые блоки FFPE можно оценивать через пять лет или позже, если их обрабатывают и хранят надлежащим образом.
Для выделения ДНК срезы тканей FFPE должны быть свежеприготовленными. Если хранения таких срезов не удается избежать, то их следует хранить в течение как можно более короткого периода времени в сухом и прохладном месте, в холодильнике (от 2 °C до 8 °C) или при более низких температурах.
Должен быть определен способ для длительного хранения тканей FFPE. Место хранения, температура хранения, факт извлечения любого фрагмента или образца из места хранения, его использование и возврат в место хранения должны быть задокументированы.
6.8 Выделение ДНК
6.8.1 Общие положенияНеобходимо провести гистопатологическую характеристику клеточного состава и состояния образца или фрагмента [например, на срезах с гематоксилином/эозином (Н&Е)] в соответствии с международной гистопатологической классификацией (например, Классификацией опухолей ВОЗ/МАИР [24]). Когда образец или фрагмент используют для молекулярной диагностики, перед выделением ДНК необходимо оценить фракцию клеток-мишеней. Количество клеток-мишеней должно быть достаточным для проведения исследования. Если образец или фрагмент не используют для диагностики, а только для проведения исследований, рекомендуется аналогичный подход.
6.8.2 Общая информация о процедурах выделения ДНК
Фиксация формалином вводит ковалентную модификацию ДНК путем добавления монометилоль-ных групп. На второй стадии электрофильное присоединение N-метилола к аминооснованию приводит к образованию метиленовых мостиков между двумя аминогруппами.
Формальдегид вносит химические модификации, препятствующие ферментативным реакциям при проведении последующих молекулярных исследований, например ДНК-полимераза.
Далее приведены требования и рекомендации.
а) Оптимальная продолжительность фиксации зависит от типа и размера ткани. Длительная фиксация тканей приводит к необратимым модификациям ДНК, и ее следует избегать. При толщине ткани не более 5 мм продолжительность фиксации должна составлять от 12 до 24 ч в стандартном забуфе-ренном растворе формалина.
Ь) Исходным материалом для очистки ДНК должны быть свежесрезанные срезы толщиной до 10 мкм, полученные из блоков ткани FFPE образцов, рассеченных вручную [17], или путем микродиссекции [18] с помощью лазера, или из сердцевины тканей [например, тканевый микрочип (ТМА)]. Медицинский персонал должен использовать перчатки. Соответствующие части микротома, включая многоразовое лезвие, очищают после разрезания каждого парафинового блока. Следует рассмотреть возможность использования новых одноразовых лезвий для микротома, чтобы избежать перекрестного загрязнения.
с) Параллельные срезы, окрашенные гематоксилином/эозином (Н&Е), следует использовать для идентификации, отбора и контроля вскрытия неокрашенных образцов для последующей очистки ДНК.
Примечание — Окрашивание может ухудшить качество и эффективность ДНК при проведении последующих исследований.
d) Для всех процедур выделения ДНК должны быть предусмотрены меры для устранения наибольшего числа модификаций формальдегида без дальнейшей деградации ДНК:
- расщепление, например протеиназой К, и нагревание частично устраняют модификации нуклеиновых кислот, внесенные формальдегидом, и перекрестные связи белок-ДНК.
Примечание 1 — Изменения ДНК в тканях FFPE включают модификации оснований и дезаминирование, которые при ПЦР или удлинении праймера могут привести к ошибочному считыванию результата.
Примечание 2 — Наиболее частым является переходное изменение C:G в Т:А, которое до некоторой степени обратимо путем обработки ДНК ткани FFPE урацил-ДНК-гликозилазой [19] после или во время очистки ДНК.
е) Выделение ДНК не следует проводить в том помещении, в котором выполняют амплификацию во избежание перекрестной контаминации, за исключением тех случаев, когда используют закрытую систему.
Если ДНК извлекают из архивных блоков ткани, блоки следует обрезать, утилизируя первые срезы, прежде чем брать срезы для выделения ДНК, поскольку внешние срезы могут содержать деградировавшую ДНК. Может потребоваться дальнейшая обрезка блоков для того, чтобы обогатить их тканевыми компонентами, значимыми при проведении исследования.
При наличии сомнений в правильности идентификации образца или фрагмента должна быть проведена проверка идентификации.
Выделение ДНК является ключевым этапом диагностического рабочего процесса, которому следует уделять особое внимание при проверке всего рабочего процесса.
Правильность выполнения процедуры выделения ДНК следует проверять в рамках выполнения программы проверки квалификации выделения ДНК.
6.8.3 Применение наборов для выделения ДНК, изготовленных производителем
В случае применения наборов, предназначенных для выделения ДНК из тканей FFPE, изготовленных производителем, необходимо следовать инструкциям по использованию наборов.
6.8.4 Применение наборов, изготовленных лабораторией
6.8.4.1 Если в лаборатории применяют процедуру выделения ДНК, отличную от инструкции производителя, то должны быть проведены верификация и валидация такой процедуры с подтверждением соответствия по назначению применяемого набора, в том числе должна быть разработана и соблюдена инструкция по его применению.
6.8.4.2 Если применяют процедуру выделения ДНК, разработанную лабораторией, то должны быть проведены верификация и валидация такой процедуры, подтверждающие соответствие по назначению применяемого набора, в том числе должна быть разработана и соблюдена инструкция по его применению.
Использование наборов для выделения ДНК от разных производителей может повлиять на достоверность результатов исследования, поскольку наборы могут быть несовместимы для применения. Такие изделия следует использовать в комбинации для диагностического исследования только в том случае, если их компоненты исследованы совместно и валидированы с подтверждением соответствия по назначению.
Процедуры выделения ДНК для срезов тканей FFPE должны включать нижеприведенные действия.
а) Удаление парафина из свеженарезанных срезов ткани FFPE.
Примечание 1 — Удаление парафина можно сделать с помощью растворителей, таких как ксилол. В качестве альтернативы можно использовать высокотемпературные методы, которые освобождают ткань от парафина, но не требуют растворителей.
Примечание 2 — Можно использовать имеющиеся в продаже растворы для депарафинизации, что избавляет от необходимости гранулировать ткани FFPE.
b) За ресуспензией срезов в буфере для лизиса следует расщепление, например протеиназой К для удаления перекрестносшитых белков и высвобождения ДНК из срезов.
Рекомендуется оптимизировать лизирующий буфер для этапа расщепления протеиназой и последующего этапа нагревания.
Примечание — Стандартный период расщепления протеиназой К составляет от 1 до 18 ч при температуре от 37 °C до 60 °C.
с) Тепловая инкубация в течение 1 ч при температуре не выше 90 °C для удаления большей части метилольных добавок и устранения перекрестных связей.
Примечание — Более длительная инкубация или более высокая температура инкубации могут привести к большей фрагментации ДНК.
d) Дополнительная функция: если требуется геномная ДНК, не содержащая РНК, необходимо провести инкубацию с РНКазой А.
Примечание 1 — Для методов, разработанных в лаборатории, может потребоваться включение стадии расщепления РНКазой, если чрезмерно большое количество РНК, мешающее исследованию, очищается вместе с ДНК.
Примечание 2 — Совместно очищенная РНК, даже после расщепления, может привести к превышению значения количественного результата ДНК спектрофотометрическими методами. Превышение значения количественного результата и фактическое присутствие РНК влияют на результаты исследования.
е) Экстракция ДНК из лизата, например методами на основе фенола/хлороформа или с использованием наборов производителей для очистки ДНК из ткани FFPE.
6.9 Исследование количества и качества выделенной ДНК
Количество и качество ДНК следует проверять в соответствии с инструкциями производителя изделий для молекулярной диагностики или в соответствии с проверенными и валидированными процедурами лаборатории с помощью общепринятых физических, химических и биохимических методов. Такие методы могут включать одно или несколько исследований:
а) количественную оценку путем измерения поглощения (А260), спектрофлуориметрии или специфического для генома количественного ПЦР [20];
Ь) испытание на чистоту путем измерения поглощения (например, сканирование по длине волны, отношение А260/А280);
с) тест на целостность и амплифицируемость ДНК (например, с помощью электрофореза, хроматографических или молекулярных методов, таких как дифференциальное отношение длины ампликона [21], [22]);
d) тест на наличие интерферирующих веществ, используя экзогенные контроли (добавленные в контроли ДНК) или анализируя кривые отклика количественной ПЦР на предмет наличия аномалий.
Для качественных исследований, например наличие/отсутствие, секвенирование, изменение числа копий, часто применяют исследования, приведенные в перечислениях а), Ь) 6.9; для количественных исследований могут потребоваться исследования, приведенные в перечислениях а)—d) 6.9.
Примечание — Фиксация формалином отрицательно влияет на целостность ДНК и достоверность результата измерений ДНК. Химические модификации, вызванные формальдегидом, не могут быть обнаружены в стандартных исследованиях контроля качества, таких как электрофоретическое измерение длины фрагмента ДНК, но тем не менее могут помешать ферментативному исследованию.
6.10 Хранение выделенной ДНК
Условия хранения выделенной ДНК должны соответствовать требованиям инструкции, предоставленной производителем набора для выделения ДНК. Необходимо соблюдать требования инструкции по проведению обследования донора/пациента, если она содержит более строгие требования, например к более низкой температуре хранения выделенной ДНК, чем требования инструкции производителя.
Медицинская лаборатория должна применять валидированные процедуры хранения выделенной ДНК в случае отсутствия инструкций производителя набора для выделения ДНК или применения разработанных лабораторией инструкций для выделения ДНК.
Для длительного хранения ДНК следует элюировать в слабощелочном элюирующем буфере, например буфер ТЕ, представляющий собой 10 мМ Трис-раствор, включающий 1 мМ ЭДТА и доведенный до pH 8,0 с помощью HCI для исследования ДНК.
Примечание — В зависимости от процедуры выделения ДНК и качества получаемого элюата в определенных обстоятельствах может быть целесообразным хранение ДНК при комнатной температуре в течение короткого периода времени или при температуре от 2 °C до 8 °C.
Хранить выделенную ДНК для долгосрочных целей следует при температуре от минус 20 °C и ниже. Также можно использовать другие проверенные методы хранения [23].
Следует использовать предназначенные для хранения емкости, такие как криогенные флаконы.
Для длительного хранения следует получить аликвоту выделенной ДНК, чтобы избежать повторного замораживания и оттаивания.
Процесс длительного хранения выделенной ДНК должен быть валидирован, а емкость для хранения выделенной ДНК или полученной из нее аликвоты должна иметь уникальную маркировку.
Должна быть обеспечена прослеживаемость процесса хранения, например за счет применения считываемых RFID, 1D- или 20-штрих-кодов или емкостей для хранения с предварительно напечатанными уникальными кодами, предоставленными производителями изделий, предназначенными для низких температур хранения.
Приложение А (справочное)
Влияние температуры хранения на целостность ДНК в блоках ткани FFPE
А.1 Введение
Хранение блоков ткани FFPE при разных температурах в течение более длительного периода времени влияет на целостность выделенной ДНК. Хранение при низких температурах от минус 20 °C до минус 80 °C позволяет выделить более высокую среднюю молекулярную массу ДНК, чем хранение при температурах от 4 °C и выше.
А.2 Результаты
Целостность ДНК в тканях FFPE зависит от продолжительности времени и температуры хранения.
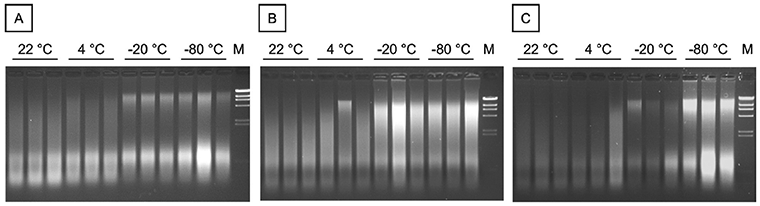
ДНК выделяли из фиксированных формалином и залитых парафином (FFPE) тканей крысы из разных источников: 4 образца почек, 4 образца селезенки и 4 образца кишечника. 4 тканевых блока FFPE из каждого источника хранили до экстракции ДНК в течение 72 мес при различных температурах (22 °C, 4 °C, минус 20 °C и минус 80 °C). 500 нг геномной ДНК были разделены в 1 % ТАЕ (Трис, уксусная кислота, ЭДТА) агарозных гелей. Результаты приведены на рисунке А.1.

М - М=маркер ламбда Hind III; А— почка; В — селезенка; С — кишечник
Рисунок А.1 — Влияние температуры хранения на целостность ДНК в блоках ткани FFPE
На рисунке А.1 показаны результаты исследования целостности ДНК методом электрофореза агарозного геля ДНК из фиксированных формалином и залитых парафином (FFPE) тканей крысы: почки (А), селезенки (В) и кишечника (С), после шести лет хранения при температурах 22 °C, 4 °C, минус 20 °C и минус 80 °C. Экстракция из каждого блока ткани выполнялась в трех повторностях.
Эффективность выделения ДНК методом ПЦР в тканях FFPE зависит от продолжительности и температуры хранения.
ДНК выделена из фиксированных формалином и залитых парафином (FFPE) тканей крысы из разных источников: 4 образца почек, 4 образца селезенки, 4 образца кишечника, 4 образца легких и 4 образца печени. 4 тканевых блока FFPE из каждого источника хранили до извлечения ДНК в течение 72 мес при разных температурах (22 °C, 4 °C, минус 20 °C и минус 80 °C). 2 мкл разведения 1:10 экстрагированных элюатов ДНК амплифицировали с использованием четырех различных методов ПЦР в реальном времени SYBR-Green гена бета-актина крыс в диапазоне от 271 до 747 нуклеотидов (nt). Результаты приведены на рисунке А.2.
На рисунке А.2 показаны результаты анализа эффективности выделения ДНК методом ПЦР в реальном времени SYBR-Green из ткани FFPE после шести лет хранения при температурах 22 °C, 4 °C, минус 20 °C и минус 80 °C. Экстракции из каждого блока тканей, выполненные в трех повторностях, амплифицированы. Значения ACT (ACT = СТ [FFPE] - СТ) показаны как среднее значение +SD (стандартное отклонение) для пяти различных типов тканей (почки, селезенка, кишечник, легкие и печень), амплифицированных для каждой температуры хранения. Данные приведены к среднему значению Ct, полученному с помощью 10 нг ДНК из экстракций соответствующих свежезамороженных тканей, выполненных в трех повторностях.

Y — значение дельта СТ; X — длина ампликона в парах оснований (Ьр)
Рисунок А.2 — Влияние температуры хранения на эффективность выделения ДНК методом ПЦР в блоках ткани FFPE
А.З Выводы
При хранении при температуре минус 20 °C или минус 80 °C можно увидеть более четкие высокомолекулярные полосы, чем при хранении при более высоких температурах, при применении метода электрофореза в агарозном геле. Таким образом, можно сделать вывод, что ДНК подвергается меньшей деградации при более низких температурах хранения.
Приложение ДА (справочное)
Сведения о соответствии ссылочных международных стандартов национальным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего национального стандарта |
ISO 15189:2012 | IDT | ГОСТ Р 15189—2015 «Лаборатории медицинские. Частные требования к качеству и компетентности» |
ISO 15190 | MOD | ГОСТ Р 52905—2007 (ИСО 15190:2003) «Лаборатории медицинские. Требования безопасности» |
Примечание — В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов:
| ||
Библиография
[1 ] ISO Guide 30:2015, Reference materials — Selected terms and definitions
[2] ISO 9000:2015, Quality management systems — Fundamentals and vocabulary
[3] ISO/IEC 17043:2010, Conformity assessment — General requirements for proficiency testing
[4] ISO/IEC 17020:2012, Conformity assessment — Requirements for the operation of various types of bodies performing inspection
[5] ISO 17511:2003, In vitro diagnostic medical devices — Measurement of quantities in biological samples — Metrological traceability of values assigned to calibrators and control materials
[6] ISO 22174:2005, Microbiology of food and animal feeding stuffs — Polymerase chain reaction (PCR) for the detection of food-borne pathogens — General requirements and definitions
[7] Hewitt S.M., Lewis F.A., Cao Y. et al. Tissue handling and specimen preparation in surgical pathology: issues concerning the recovery of nucleic acids from formalin-fixed, paraffin embedded tissue. Arch. Pathol. Lab. Med. 2008 Dec, 132 (12) pp. 1929—1935
[8] Heylen L., Thienpont B., Naesens M. et al. The Emerging Role of DNA Methylation in Kidney Transplantation: A Perspective. Am. J. Transplant. 2016 Jan 18
[9] Williams C., Ponten F., Moberg C. A high frequency of sequence alterations is due to formalin fixation of archival specimens. Am J Pathol. 1999 Nov; 155(5):1467—71
[10] McSherry G., Kay H., Gallagher D. Formalin-fixed paraffin-embedded clinical tissues show spurious copy number changes in array-CGH profiles. Clin. Genet. 2007 Nov, 72 (5) pp. 441—447
[11] Tokuda Y, Nakamura T, Satonaka K. et al. Fundamental study on the mechanism of DNA degradation in tissues fixed in formaldehyde. J. Clin. Pathol. 1990 Sep, 43 (9) pp. 748—751
[12] Quach N., Goodman M.F., Shibata D. In vitro mutation artifacts after formalin fixation and error prone translesion synthesis during PCR. BMC Clin. Pathol. 2004 Feb 12, 4 (1) p. 1
[13] Do H., & Dobrovic A. Sequence artifacts in DNA from formalin fixed tissues: causes and strategies for minimization. Clin. Chern. 2015 Jan, 61 (1) pp. 64—71
[14] Viertler C., Groelz D., Giindisch S. et al. A new technology for stabilization of biomolecules in tissues for combined histological and molecular analyses. J. Mol. Diagn. 2012 Sep, 14 (5) pp. 458—466
[15] Fox C.H., Johnson F.B., Whiting J. et al. Formaldehyde Fixation. J. Histochem. Cytochem. 1985 Aug, 33 (8) pp. 845—853
[16] Engel K.B., & Moore H.M. Effects of preanalytical variables on the detection of proteins by immunohistochemistry in formalin-fixed, paraffin-embedded tissue. Arch. Pathol. Lab. Med. 2011 May, 135 (5) pp. 537—543
[17] Specht K., Richter T, Muller U. et al. Quantitative gene expression analysis in microdissected archival formalin-fixed and paraffin-embedded tumor tissue. Am. J. Pathol. 2001 Feb, 158 (2) pp. 419—429
[18] Burgemeister R. Nucleic acids extraction from laser microdissected FFPE tissue sections. Methods Mol Biol. 2011; 724:117—129
[19] Do H., & Dobrovic A. Dramatic reduction of sequence artifacts from DNA isolated from formalin-fixed cancer biopsies by treatment with uracil- DNAglycosylase. Oncotarget. 2012 May, 3 (5) pp. 546—558
[20] Laurell H., lacovoni J.S., Abot A. et al. Correction of RT—qPCR data for genomic DNA derived signals with ValidPrime. Nucleic Acids Res. 2012 Apr, 40 (7) pp. 1—10
[21] Colotte M., & Couallier V. et al. ( 2009). Simultaneous assessment of average fragment size and amount in minute samples of degraded DNA. Anal Biochem 2009 May 388 (2) pp. 345—347
[22] Pavsic J., 2el J., Milavec M. Assessment of the real-time PCR and different digital PCR platforms for DNA quantification. Anal Bioanal Chern 2016 Oct 408 (1) pp. 107—121
[23] Colotte M., & Coudy D. et al. (2011). Adverse Effect of Air Exposure on the Stability of DNA Stored at Room Temperature. Biopreservation and biobanking 9 (1): 47—50
[24] WHO/IARC Classification of Tumours http: //whobluebooks.iarc .fr/
[25] IUPAC. (2014) Compendium of Chemical Terminology, Gold Book Version 2.3.3. International Union of Pure and Applied Chemistry
[26] Horwitz W. (2009). Nomenclature for sampling in analytical chemistry (Recommendations 1990). Pure and Applied Chemistry, 62 (6), pp. 1193—1208
[27] Calvert J. (2009). Glossary of atmospheric chemistry terms (Recommendations 1990). Pure and Applied Chemistry, 62 (11), pp. 2167—2219
[28] ISO/IEC 17025, General requirements for the competence of testing and calibration laboratories
[29] Groelz D., Viertler C., Pabst D., Dettmann N., Zatloukal K. PLoS One. 2018 Sep 7; 13 (9):e0203608. doi: 10.1371/ journal.pone.0203608. eCollection
УДК 57.085.2:006.354 OKC 11.100.10
Ключевые слова: молекулярные диагностические исследования in vitro, требования к процессам пре-аналитического этапа исследования зафиксированных формалином тканей в парафиновых блоках, FFPE, выделенные ДНК
Редактор Л С. Зимилова Технический редактор И.Е. Черепкова Корректор О.В. Лазарева Компьютерная верстка А.Н. Золотаревой
Сдано в набор 21.07.2023. Подписано в печать 31.07.2023. Формат 60*84%. Гарнитура Ариал. Усл. печ. л. 2,32. Уч.-изд. л. 2,10.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.

