ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ГОСТР
70826—
2023/ ISO/TS 22583:2019
ПРАВИЛА ДЛЯ РУКОВОДИТЕЛЕЙ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЙ ПО МЕСТУ НАХОЖДЕНИЯ ПАЦИЕНТА (ИМНП) И ПОЛЬЗОВАТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ЭТИХ ЦЕЛЕЙ
(ISO/TS 22583:2019, IDT)
Издание официальное
Москва Российский институт стандартизации 2023
Предисловие
1 ПОДГОТОВЛЕН Ассоциацией специалистов и организаций лабораторной службы «Федерация лабораторной медицины» (Ассоциация «ФЛМ») (Комитетом по молекулярной диагностике инфекционных и неинфекционных заболеваний «ФЛМ») на основе собственного перевода на русский язык англоязычной версии документа, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 380 «Клинические лабораторные исследования и диагностические тест-системы ин витро»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 19 июля 2023 г. № 561-ст
4 Настоящий стандарт идентичен международному документу ISO/TS 22583:2019 «Правила для руководителей проведения исследований по месту нахождения пациента (ИМНП) и пользователей медицинских изделий, предназначенных для этих целей» (ISO/TS 22583:2019 «Guidance for supervisors and operators of point-of-care testing (РОСТ) devices», IDT).
Международный документ разработан Техническим комитетом ИСО/ТК 212 «Клинические лабораторные исследования и диагностические тест-системы in vitro».
Дополнительные сноски в тексте стандарта, выделенные курсивом, приведены для пояснения текста оригинала
5 ВВЕДЕН ВПЕРВЫЕ
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. № 162-ФЗ «О стандартизации в Российской Федерации». Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе «Национальные стандарты», а официальный текст изменений и поправок — в ежемесячном информационном указателе «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования — на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.rst.gov.ru)
© ISO, 2019 © Оформление. ФГБУ «Институт стандартизации», 2023
Настоящий стандарт не может быть полностью или частично воспроизведен, тиражирован и распространен в качестве официального издания без разрешения Федерального агентства по техническому регулированию и метрологии
Содержание
1 Область применения
2 Нормативные ссылки
3 Термины и определения
4 Персонал
5 Выбор изделия для ИМНП
6 Управление процессами ИМНП
7 Управление информацией
8 Документирование деятельности и управление записями
9 Охрана труда и техника безопасности
Приложение А (обязательное) Обучение и компетентность пользователей
Приложение В (обязательное) Изделие для ИМНП и выбор наиболее подходящего исследования . . 17
Приложение С (справочное) Документы и записи
Приложение D (обязательное) Внутренний контроль качества и внешняя оценка качества
Приложение Е (справочное) Предотвращение внутрибольничных заражений (биобезопасность)... .27
Библиография
Введение
Благодаря доступности и быстроте получения результата исследований по месту нахождения пациента (ИМНП) медицинские изделия для ИМНП (далее — изделие для ИМНП, изделие) широко используют в качестве инструмента для принятия решений в отношении состояния здоровья, лечения и ухода за пациентами. Такие решения могут включать госпитализацию, направление пациента в другие лечебно-профилактические учреждения и целенаправленное ведение пациента. Меры, предпринятые по результатам ИМНП, могут иметь гражданско-правовые и/или иные юридические последствия, такие как отстранение от трудовой деятельности, принятие решения суда по семейным делам, отмена освобождения под залог, условно-досрочное освобождение.
Наличие простых в использовании изделий привело к расширению возможности проведения ИМНП при оказании медицинской помощи, например: исследование глюкозы, анализ факторов свертывания крови, оценка маркеров инфекционных, сердечно-сосудистых заболеваний, определение гемоглобина, определение количества лейкоцитов, проведение теста на беременность, обнаружение фактов использования запрещенных наркотических препаратов и тестирование на допинг.
Наряду со стандартными правилами проведения исследования жидкостей организма, выделений и тканей пациента в контролируемых и регулируемых условиях медицинской лаборатории, ИМНП во всем мире все чаще проводят пользователи изделий для ИМНП (далее — пользователи, пользователи изделий) вне стандартных лабораторных условий без поддержки медицинской лаборатории.
ИМНП могут быть проведены при оказании медицинской помощи в условиях, включающих, но не ограничивающих: стационарные и амбулаторные медицинские учреждения, аптеки, фельдшерские, акушерские пункты, учреждения долгосрочного ухода, медицинские кабинеты в отдаленных и сельских районах, общественные организации, такие как правоохранительные органы, производственные предприятия, спортивные сооружения, научные учреждения, военные части, торговые центры, а также при чрезвычайных ситуациях, стихийных бедствиях.
Поскольку результаты ИМНП могут быть использованы для принятия значимых решений о здоровье пациентов, жизненно важно, чтобы изделие функционировало должным образом для получения достоверных результатов, а пользователи изделий были компетентными в части проведения ИМНП. Для этой цели необходимо, чтобы система контроля качества была предоставлена руководителем по контролю качества ИМНП (далее — руководитель ИМНП, руководитель) и доступна пользователям.
Вероятность получения недостоверных результатов ИМНП возрастает при осуществлении лабораторной деятельности, не соответствующей требованиям системы контроля качества, что может оказать негативное влияние на пациента с точки зрения принятия решений, касающихся состояния его здоровья или предоставления ему мер социальной поддержки.
Настоящий стандарт изложен доступным для понимания языком. Его цель состоит в том, чтобы предоставить руководителю и пользователям рекомендации по оценке целесообразности предлагаемого ИМНП, выбору методов и изделий для ИМНП, в том числе по техническим характеристикам изделий и квалификации их пользователей, которые обеспечат надежность, качество и правильную интерпретацию полученных результатов, соответствующие предполагаемому использованию.
Рекомендуется, чтобы производители и поставщики изделий обратили внимание покупателя на настоящий стандарт с целью применения его требований при эксплуатации изделий по назначению.
Примечание 1 — Приложения содержат подробную информацию и добавляют контекст, который не включен в основную часть настоящего стандарта. Поэтому, чтобы полностью оценить его, пользователю рекомендуется убедиться в том, что соответствующие приложения применяют вместе с основной частью стандарта.
Примечание 2 — Предполагается, что процедуры разработаны в соответствии с законодательными и нормативными требованиями.
Примечание 3 — В некоторых разделах настоящего стандарта установлены требования к персоналу медицинских лабораторий, который должен обладать необходимой компетенцией для предоставления консультаций и работать в лабораториях, соответствующих международным стандартам, включая ИСО 15189 «Медицинские лаборатории. Требования к качеству и компетентности» и ИСО 22870 «Исследования по месту лечения (РОСТ). Требования к качеству и компетентности».
ГОСТ Р 70826—2023/ISO/TS 22583:2019
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРАВИЛА ДЛЯ РУКОВОДИТЕЛЕЙ ПРОВЕДЕНИЯ ИССЛЕДОВАНИЙ ПО МЕСТУ НАХОЖДЕНИЯ ПАЦИЕНТА (ИМНП) И ПОЛЬЗОВАТЕЛЕЙ МЕДИЦИНСКИХ ИЗДЕЛИЙ, ПРЕДНАЗНАЧЕННЫХ ДЛЯ ЭТИХ ЦЕЛЕЙ
Guidance for supervisors and operators of point-of-care testing (РОСТ) devices
Дата введения — 2024—05—01
1 Область применения
Настоящий стандарт содержит правила и рекомендации для руководителей контроля качества проведения исследований по месту нахождения пациента (ИМНП) и пользователей изделий, где ИМНП выполняет не персонал медицинской лаборатории. Настоящий стандарт включает в себя ключевые компоненты, которые следует учитывать для обеспечения безопасных и надежных результатов ИМНП.
Самотестирование исключено из настоящего стандарта.
2 Нормативные ссылки
Настоящий стандарт не содержит нормативных ссылок.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями. Терминологические базы данных ИСО и МЭК доступны по следующим интернет-адресам: - платформа онлайн-просмотра ИСО по адресу: http://www.iso.org/obp;
- Электропедия МЭК по адресу: http://www.electropedia.org/.
3.1 аналит (analyte): Компонент, который измеряют, исследуют или рассчитывают.
Пример — Гпюкоза, тропонин, кокаин, антитела к ВИЧ.
3.2 биологический референтный интервал, референтный диапазон, нормальный диапазон, нормальное значение (biological reference interval reference range, normal range, normal value): Специфицированный интервал распределения значений, полученных в биологической референтной популяции.
Примечание 1 — Референтный интервал состоит из значений или диапазона значений аналита (см. 3.1), предполагаемого для «здорового человека». Их иногда называют «нормальными» значениями. В то время как «нормальные» значения диапазонов могут указывать на благополучие пациента (см. 3.10), следует учитывать, что результат в пределах «нормальных» значений диапазона не обязательно означает, что пациент (см. 3.10) здоров, или результат за пределами «нормальных» значений диапазона не обязательно означает, что пациент (см. 3.10) не здоров. Также важно отметить, что значения «нормальных» диапазонов могут отличаться от изделия (см. 3.6) с одной аналитической системой к изделию (см. 3.6) с другой аналитической системой и от одной популяции человека к другой.
Примечание 2 — В некоторых случаях, таких как исследования на злоупотребление наркотиками, нормальное значение должно быть отрицательным или не обнаруживаться.
[ИСО 15189:2012, 3.4, изменено — примечания 1—4 удалены и добавлено примечание 1]
Издание официальное
3.3 передача ответственности, передача пациента, передача (clinical handover, patient handover, handover): Передача ответственности полностью или частично за ведение пациента (см. 3.10) другому лицу или группе лиц на временной или постоянной основе.
Примечание 1 — Передача ответственности в части ведения пациента (см. 3.10) между медицинскими организациями или подразделениями является ситуацией высокого риска, а ошибки, связанные с передачей ответственности — это основные источники предотвратимого вреда пациенту (см. 3.10).
Примечание 2 — Структурированная и стандартизованная процедура передачи ответственности за ведение пациента является эффективной, снижает количество ошибок и повышает безопасность пациентов (см. 3.10).
Примечание 3 — Примером передачи ответственности является обеспечение своевременного уведомления уполномоченному лицу о критических результатах, чтобы свести к минимуму вред для пациента (см. 3.10).
3.4 компетентность (competence): Продемонстрированная способность применять знания и умения для получения точного результата ИМНП.
[ИСО 15189:2012, 3.5, изменено — добавлено «для получения точного результата ИМНП» и удалено примечание]
3.5 критические результаты (critical results): Результаты за пределами установленных диапазонов, которые могут указывать на опасную для жизни ситуацию и требуют немедленного уведомления лечащего врача.
3.6 изделие1 (equipment): Любое оборудование, устройство или инструмент, которые могут быть использованы для выполнения ИМНП (см. 3.11).
Примечание 1 — Примерами изделий для выполнения ИМНП являются простые, меняющие цвет тест-полоски для определения глюкозы в моче и более сложные электронные ручные или настольные анализаторы, такие как глюкометры, анализаторы липидов и алкотестеров.
Примечание 2 — Для целей настоящего стандарта к изделиям для выполнения ИМНП относят любые реагенты или расходные материалы, необходимые для проведения исследования.
3.7 внешняя оценка качества; ВОК, проверка квалификации; ПК (external quality assessment, EQA, proficiency testing, PT): Периодический процесс исследования образцов (см. 3.13) с установленными значениями, которые неизвестны участникам ВОК.
Примечание 1 — Полученные результаты сравнивают с другими результатами исследования того же образца (см. 3.13) того же вида изделия для (см. 3.6) ИМНП (см. 3.11), что дает участнику ВОК возможность оценить свои результаты по сравнению с другими.
Примечание 2 — Рекомендуются коммерчески доступные программы ВОК. В случае отсутствия возможности их применения производители изделий для ИМНП и/или лаборатории могут предложить программы сличительных испытаний (исследований) образцов (см. 3.13).
3.8 интерферирующие факторы (interference factors): Вещество или процесс, которые ложно изменяют результат теста.
Примечание 1 — Влияние может быть значительным.
Примечание 2 — Вещества, которые ложно изменяют результаты исследования могут быть эндогенными [вещества в образце (см. 3.13) пациента (см. 3.10), образованные в результате естественной жизнедеятельности организма, такие как липиды, белки, антитела] или экзогенными (вещества в образце пациента, проникшие в организм из внешней среды, такие как наркотики, яды или лекарства).
Примечание 3 — Наиболее распространенными интерферирующими факторами являются гемолиз [разрыв эритроцитов и выделение их содержимого в окружающую жидкость (например, плазму/сыворотку крови)], гипербилирубинемия (желтая или зеленая пигментация плазмы/сыворотки крови из-за высокого уровня билирубина) и липемия (аномально высокая концентрация липидов в крови, характерно, что плазма крови может иметь белый или молочный цвет из-за присутствия жира).
Примечание 4 — Тип контейнера для взятия образца также может влиять на исследование, поскольку контейнеры часто содержат дополнительные компоненты.
3.9 внутренний контроль качества; ВКК, контроль качества; КК (internal quality control, IQC, quality control, QC): Внутренняя процедура, которая отслеживает процесс исследования с целью подтверждения правильности выполнения системных требований и с высокой степенью достоверности подтверждает надежность результатов для их включения в протокол.
Примечание — Образцы (см. 3.13) ВКК содержат известные количества исследуемого вещества (см. 3.1). Предполагается, что полученный результат будет близок к известному значению и находится в приемлемом диапазоне. Если результаты выходят за пределы допустимого диапазона, необходимо предпринять действия по устранению проблемы до того, как пациенты (см. 3.10) пройдут исследование.
3.10 пациент (patient): Человек, которому проводят исследование по месту его нахождения (см. 3.11).
Примечание 1 — В настоящем стандарте термин «пациент» использован концептуально.
Примечание 2 — Следует отметить, что человек, который проходит ИМНП (см. 3.11), может не иметь текущего заболевания и, следовательно, не может быть пациентом как таковым. Это могут быть заказчики или персонал лаборатории, проходящие исследование по причинам, отличным от получения медицинской помощи, таким как скрининг, медицинское обследование перед приемом на работу или оценка использования препаратов или химических веществ, повышающих работоспособность (допинг).
3.11 исследование по месту нахождения пациента; ИМНП (point-of-care testing, РОСТ, nearpatienttesting): Исследование, которое выполняют в непосредственной близости от пациента или по месту его нахождения и результат которого влияет на возможное изменение лечения пациента (см. 3.10).
3.12 организация, предоставляющая услуги по проведению ИМНП, поставщик услуг ИМНП (point of care, testing service provider, РОСТ service provider): Физическое лицо или организация, ответственные за предоставление ИМНП (см. 3.11).
3.13 первичная проба, образец (sample, primary sample, specimen): Дискретная порция биологической жидкости (например, крови, мочи, слюны), выдыхаемого воздуха, волос или тканей, взятая для ИМНП (см. 3.11), которая представляет организм человека в целом.
Примечание 1 — В некоторых странах вместо термина «проба» используют термины «образец» или «первичный образец». Для целей настоящего стандарта термины «образец», «первичный образец» и «проба» следует считать синонимичными.
Примечание 2 — Источник образцов крови (артериальная, венозная или капиллярная) является еще одним важным фактором, поскольку результаты ИМНП для образцов капиллярной крови могут отличаться от результатов образцов артериальной, венозной крови для определенных исследований и при определенных обстоятельствах.
3.14 срочные результаты (urgent results): Результаты, необходимые для оказания медицинской помощи пациенту в течение минимального периода времени.
3.15 валидация (validation): Подтверждение заявленных производителем эксплуатационных характеристик и ограничений использования изделия (см. 3.6) для ИМНП (см. 3.11) и определение факторов, которые могут изменить эти характеристики в той или иной степени.
Примечание 1 — Существенными показателями для достоверности результата являются аналит (см. 3.1), тип образца (см. 3.13) (артериальная, венозная или капиллярная кровь; плазма; моча) и наличие интерферирующих факторов (см. 3.8).
Примечание 2 — Подтверждение того, что метод соответствует назначению (подходит для предполагаемого использования).
3.16 верификация (verification): Подтверждение посредством представления объективных свидетельств того, что установленные требования к изделиям выполнены поставщиком услуг ИМНП (см. 3.12).
4 Персонал
4.1 Требования к руководителю
Должно(ы) быть назначено(ы) лицо(а), руководитель, которое(ые) имеет(ют) полномочия и несет(ут) ответственность за качество обслуживания пациентов и обладает(ют) компетенциями, позволяющими контролировать проводимые исследования.
Руководитель несет ответственность за качество, своевременность, точность и безопасность проведения ИМНП, включая анализ рисков (см. 9.2.5).
Руководитель должен определить функции и обязанности пользователей изделий для ИМНП, а также:
- выбрать соответствующие исследования после консультации с медицинским специалистом, при необходимости;
- обеспечить конфиденциальность персональной информации и результатов исследования пациентов, проходящих обследование;
- предоставить возможность интерпретации результатов;
- предоставить возможность проведения консультаций;
- предоставить результаты исследования и/или направление на соответствующее или необходимое дополнительное исследование;
- выбрать подходящее изделие для ИМНП;
- обеспечить выполнение применяемых инструкций;
- обеспечить проведение процедур контроля качества с последующим его анализом и принятием корректирующих мер;
- разработать и актуализировать внутренние инструкции или процессы;
- обучить пользователей и оценить их компетентность;
- обеспечить соответствующие условия для проведения исследований;
- обеспечить управление материальными ресурсами;
- обеспечить надлежащую и эффективную передачу данных клинического исследования;
- обеспечить соответствующие процедуры биобезопасности и инфекционного контроля.
Руководитель должен обеспечить наличие процедур, соответствующих услуге по проведению ИМНП, а также их выполнение пользователями.
В случае необходимости руководитель должен обеспечить возможность предоставления консультаций с медицинским специалистом и специалистом медицинской лаборатории.
4.2 Требования к пользователям
4.2.1 Общие положенияДолжно(ы) быть назначено(ы) лицо(а) (пользователь изделия для ИМНП), прошедшее(ие) обучение и продемонстрировавшее(ие) компетентность, необходимую для проведения исследований. Руководитель также может быть пользователем.
4.2.2 Обучение
Должна быть внедрена программа обучения пользователей, которая:
- описывает ключевые аспекты процесса исследования, включая:
- цель процесса исследования,
- его основные этапы,
- значимость каждого этапа;
- гарантирует, что пользователи могут получать достоверные результаты;
- описывает требования к программам внутреннего контроля качества и внешней оценки качества и обеспечивает их применение (при наличии);
- заявляет о важности соблюдения правил, процедур и инструкций по применению изделий.
Все пользователи должны успешно пройти программу обучения.
Программа обучения должна обновляться, когда происходят изменения процедуры проведения исследования (например, введены новое изделие или инструкция), пользователи в этом случае должны быть обучены по актуальной программе.
Программа обучения должна периодически оцениваться на предмет эффективности.
Примечание — Аспекты процесса исследования, которые следует учитывать в учебных программах, описаны в приложении А.
4.2.3 Компетентность пользователя
Пользователи должны быть оценены на предмет компетентности после обучения и до того, как им будет разрешено проводить исследования.
Пользователи, признанные некомпетентными, не должны проводить исследований до тех пор, пока они не пройдут переподготовку и не будут признаны компетентными.
Оценка компетентности пользователей должна проводиться с запланированной периодичностью. Интервал оценки компетентности устанавливают в зависимости:
- от количества исследований и частоты их проведения;
- количества исследований, проводимых каждым пользователем;
- сложности исследования (степени сложности);
- результатов оценки качества (например, в случае выявления большого количества ошибок необходимо провести анализ, установить причины их появления и сократить интервал проведение обучения).
Если пользователь с подтвержденной компетентностью не проводит исследования, поставщику услуг ИМНП следует рассмотреть приемлемый срок, в течение которого пользователя считают компетентным для проведения исследований, и повторная оценка компетентности не требуется. По истечении установленного приемлемого срока пользователь должен повторно подтвердить свою компетентность.
Как правило, редко проводимые исследования требуют более частой оценки компетентности пользователей.
Количество и частота проведенных исследований, в том числе частота участия пользователя в ИМНП могут применяться для определения интервала оценки компетентности. Сложность ИМНП также может повлиять на интервал оценки компетентности пользователей, поскольку выполнение более сложных исследований часто затруднительно, особенно когда исследования проводят редко. Следовательно, запланированные интервалы повторной оценки компетентности должны учитывать количество ИМНП, проводимых одним пользователем, т. е. 1 исследование, 10 исследований, 100 исследований, выполняемых ежедневно, еженедельно, ежемесячно или ежегодно в зависимости от степени сложности ИМНП. Результаты оценки компетентности должны быть зафиксированы в соответствии с заранее определенным набором достижимых и измеримых целей, установленных руководителем.
Если по результатам обучения пользователи признаны некомпетентными, то программа обучения должна быть пересмотрена и, при необходимости, усовершенствована.
Примечание — Аспекты исследования, которые следует учитывать в программах обучения оценки компетентности, описаны в приложении А.
5 Выбор изделия для ИМНП
Выбор изделия для ИМНП должен учитывать:
- объем и цель ИМНП;
- эксплуатационные характеристики изделия;
- надежность изделия при использовании;
- потребности тех, кто должен пройти исследование;
- другие потребности третьей стороны, например запрос работодателя;
- национальные и региональные нормативные требования.
Несмотря на то что изделие для ИМНП может не соответствовать всем предпочтительным характеристикам, которые определены, изделие, наиболее подходящее для конкретного исследования, следует считать пригодным для применения по назначению.
Недостаточное понимание области применения изделия для ИМНП может привести к выбору изделия, которое не подходит для использования по назначению. Выбор изделия, не соответствующего применению по назначению, может повлиять на безопасность пациента.
Перед покупкой изделия и проведением исследований изделие для ИМНП должно быть одобрено руководителем как пригодное для использования.
Примечание — В приложении В приведены рекомендации по выбору изделия ИМНП.
6 Управление процессами ИМНП
6.1 Общие положения
Процесс исследования состоит из трех этапов: преаналитический, аналитический и постаналитический.
Преаналитический этап исследования включает в себя все действия, выполняемые до момента проведения исследования.
Аналитический этап включает в себя использование образца пациента и изделия для ИМНП с целью получения результата исследования.
Постаналитический этап, хронологически начинающийся после проведения исследования, включает рассмотрение результатов, хранение биологического материала, утилизацию образцов и отходов, а также форматирование, интерпретацию, оформление и выдачу результатов исследований, их хранение.
Все три этапа способствуют повышению качества результатов исследования.
6.2 Преаналитический этап
6.2.1 Общие положенияБольшинство ошибок, в том числе и наиболее существенных (например, неверно идентифицированный пациент, недостаточный объем образца, неподходящий образец, неправильное обращение с образцом), происходят на преаналитическом этапе. Совершение ошибок на преаналитическом этапе влияет на достоверность результатов исследования независимо от того, насколько правильно будут проведены процессы аналитического или постаналитического этапа.
Исследование образцов другого пациента (в случае ошибки идентификации образцов) всегда будет означать получение недостоверного результата. В результате такой ошибки пациенту может быть назначено неправильное лечение или пациент может пропустить необходимое лечение, причинив вред своему организму.
6.2.2 Планирование и развитие деятельности по предоставлению услуг ИМНП
При планировании и развитии деятельности по предоставлению услуг ИМНП следует учитывать:
- показания к исследованию, включая потенциальные результаты для тех, кто проходит медицинское обследование;
- на какую группу пациентов направлена услуга по проведению ИМНП;
- кто имеет право пройти исследование;
- критерии выбора соответствующих методов исследования, изделий для ИМНП, которые должны быть предоставлены;
- кто может заказать проведение исследования;
- кто может получить результаты исследования;
- трудовые ресурсы;
- процедуры подтверждения того, что деятельность поставщика услуг ИМНП осуществляется в соответствии с установленными требованиями;
- оценку ошибок и их последствия для пациентов и поставщика услуг ИМНП;
- требования к качеству, включая внутренний контроль качества и внешнюю оценку качества;
- хранение изделий, реагентов и расходных материалов;
- нормативные требования.
Возможность предоставления консультаций и рекомендаций со стороны медицинского специалиста и/или специалиста медицинской лаборатории должна быть доступна для пользователей.
6.2.3 Окружающая среда для проведения исследования
Среда для проведения ИМНП должна соответствовать установленным требованиям. Кроме того, должна быть гарантирована безопасность в рамках проведения исследований для пациентов и пользователей, в том числе путем использования достаточно просторных лабораторных помещений, а также обеспечена конфиденциальность данных пациентов в соответствии с этическими и культурными соображениями.
6.2.4 Наличие и качество материалов для проведения исследования
6.2.4.1 Общие положения
Расходные материалы должны быть доступны в достаточном количестве для проведения исследования. Расходные материалы включают устройства для взятия образцов, контейнеры, тест-полоски или тест-карты, а также реагенты, этикетки и письменные принадлежности для маркировки образцов.
Наличие дополнительных расходных материалов может оказаться целесообразным в случае их загрязнения или потери при проведении ИМНП.
Со всеми расходными материалами следует обращаться в соответствии с рекомендациями производителя.
6.2.4.2 Устройства для взятия образцов
Надлежащее применение устройств для взятия образцов в соответствии с инструкциями производителя имеет решающее значение для получения достоверного результата.
При взятии образца крови пациента должны применяться одноразовые устройства, такие как иглы или ланцеты, при этом иглы должны быть надлежащим образом защищены (экранированы) от укола и удалены после одноразового использования.
При повторном использовании дополнительного изделия для взятия крови, такого как держатели трубок и жгуты, должны быть применены тщательные процедуры дезинфекции для снижения вероятности перекрестного заражения.
6.2.5 Готовность изделия для ИМНП к использованию
6.2.5.1 Общие положения
Перед исследованием образца пациента должно быть подтверждено надлежащее функционирование изделия.
Изделие должно пройти контроль качества ИМНП в соответствии с утвержденными процедурами и иметь достаточную электрическую или аккумуляторную мощность для проведения полного цикла исследования (если применимо).
Температура окружающей среды не должна выходить за пределы температурного диапазона, рекомендованного изготовителем изделия для ИМНП.
Дополнительные параметры условий окружающей среды, предписанные изготовителем, также должны соответствовать установленным требованиям.
6.2.5.2 Валидация изделия для ИМНП
Валидация изделия для ИМНП должна быть выполнена до введения в эксплуатацию для подтверждения соответствия функциональных характеристик. Если производитель выполнил валидацию, то пользователи могут полагаться на ее результаты и должны провести верификацию изделия.
Валидация должна быть проведена в случае применения модифицированного или самостоятельно разработанного пользователем изделия или в случае его использования в условиях, которые не были подтверждены производителем.
Примечание 1 — В некоторых странах запрещают проводить модификацию изделия пользователем ИМНП. Предполагается, что порядок применения изделия соответствует законодательным и нормативным требованиям.
Примечание 2 — В приложении В содержится дополнительная информация о валидации.
6.2.5.3 Верификация изделия для ИМНП
Верификация изделия для ИМНП должна быть выполнена до введения в эксплуатацию для подтверждения того, что пользователи смогут достичь в реальных условиях таких же результатов исследований, как и производитель в рамках проведения валидации изделия.
Примечание — В приложении В содержится дополнительная информация о верификации.
6.2.5.4 Калибровка изделия для ИМНП
При необходимости изделие для ИМНП должно быть откалибровано в соответствии с инструкциями производителя с использованием калибратора, рекомендованного изготовителем.
Примечание — В приложении В содержится дополнительная информация о калибровке.
6.2.5.5 Техническое обслуживание изделия для ИМНП
Программа технического обслуживания изделия для ИМНП должна быть разработана с учетом сложности изделия и требований инструкции производителя. Для технического обслуживания могут потребоваться услуги со стороны производителя.
6.2.6 Согласие пациента и консультирование
6.2.6.1 Общие положения
Пациенты должны быть проинформированы о возможных рисках, преимуществах и результатах проводимого ИМНП на понятном пациентам языке, не содержащем специальных профессиональных терминов.
6.2.6.2 Получение согласия пациента
Пациент (или, при необходимости, его законный представитель) должен дать согласие на проведение исследования до того, как будет взят образец. Для большинства обычных ИМНП согласие может быть получено/подразумеваться, когда пациент приходит на обследование и добровольно соглашается на взятие и исследование образца.
Примечание — Подразумеваемое согласие — это согласие, которое предоставляется действиями физического лица, фактами и обусловлено обстоятельствами конкретной ситуации (или, в некоторых случаях, молчанием или бездействием лица).
Пациентам должна быть предоставлена возможность отказаться от ИМНП до взятия образца.
В чрезвычайных ситуациях, например пациент без сознания, выражение согласия может быть невозможно, при этих обстоятельствах приемлемо провести необходимые ИМНП при условии, что они наиболее соответствуют интересам пациента.
Может потребоваться более высокий уровень согласия, известный как информированное согласие. Предполагается, что процедуры получения информированного согласия пациентов соответствуют законодательным и нормативным требованиям.
При необходимости пользователь должен получить информированное согласие для того, чтобы убедиться в том, что пациент понимает факты и последствия проведения ИМНП.
ИМНП, результаты которого могут оказать значительное влияние на пациента (например, исследование на наркотики или исследование на инфекционные заболевания), должно быть проведено при наличии информированного согласия.
Для того чтобы получить информированное согласие, пациенту должна быть предоставлена информация, включающая объяснение проводимого ИМНП на понятном пациенту языке.
Факт получения информированного согласия должен быть задокументирован.
6.2.6.3 Консультирование пациента
Пациент должен быть проинформирован о предполагаемом исследовании, включая вероятность ложноположительных и ложноотрицательных результатов и процедуру их подтверждения, при наличии.
Пользователь ИМНП не всегда обладает достаточной компетентностью для предоставления профессиональной информации об исследовании. В таких случаях специалист медицинской лаборатории и/или медицинский специалист должны надлежащим образом проконсультировать пациента. Кроме того, для поддержки устного общения следует предоставлять документированные инструкции и учебные материалы, предназначенные для пациентов.
6.2.7 Идентификация личности пациента
Перед началом ИМНП личность пациента должна быть однозначно идентифицирована пользователем ИМНП. Процедуры идентификации личности пациента должны быть установлены и доступны пользователю.
Неспособность правильно идентифицировать пациента может причинить значительный вред пациенту и/или вызвать неблагоприятные последствия.
6.2.8 Требования к взятию образцов
Пользователи должны убедиться в том, что требования производителя к взятию образцов выполнены. Отклонения от выполнения требований могут привести к недостоверному результату, поскольку конкретные требования для взятия образцов подтверждены валидацией производителя.
Интервал времени между взятием образцов и проведением исследования не должен превышать значений, установленных производителем изделия для ИМНП, поскольку это может привести к недостоверными результатам исследования.
6.2.9 Интерферирующие факторы
Пользователи должны понимать, что присутствие определенных веществ или процессов (интерферирующих факторов), таких как прием лекарственных препаратов или соблюдение диеты, могут повлиять на результаты исследований.
Информация о важности интерферирующих факторов должна быть доведена до пациентов, чтобы они понимали, что о приеме лекарственных препаратов или о соблюдении диеты необходимо сообщить пользователю изделия для ИМНП.
Примечание — Консультацию по интерферирующим факторам и их влиянию на результаты исследования можно получить у специалистов медицинской лаборатории.
6.3 Аналитический этап
6.3.1 Общие положенияВсе изделия для ИМНП требуют регулярного контроля качества, который проводят для обеспечения правильного функционирования изделия для ИМНП и получения точных и достоверных результатов.
6.3.2 Внутренний контроль качества (ВКК)
Программа ВКК должна быть разработана на основе инструкций производителя. Материалы ВКК с ожидаемыми значениями на клинически важных уровнях, т. е. близкими к контрольным диапазонам или пороговым значениям, должны быть по возможности исследованы.
ВКК должен проводиться с частотой, которая основана на стабильности ИМНП и отсутствии риска причинения вреда пациенту, связанного с последствиями принятых решений по недостоверным результатам исследования.
Документированные критерии для положительной или отрицательной оценки результатов ВКК должны быть доступны пользователям изделия для ИМНП.
ВКК должен проводиться одновременно с исследованием с целью подтверждения его надлежащего выполнения и возможности принятия решений на основе результатов ИМНП.
В случае получения отрицательной оценки результатов ВКК необходимо предпринять соответствующие корректирующие действия до начала проведения исследования образцов пациента.
Примечание — В приложении D приведена дополнительная информация о ВКК.
6.3.3 Внешняя оценка качества (ВОК)
Следует периодически проводить ВОК. Там, где проведение ВОК невозможно, необходимо искать альтернативный подход.
Примечание — В приложении D приведена дополнительная информация о ВОК.
6.3.4 Проведение исследования
6.3.4.1 Общие положения
Исследование должно проводиться только в том случае, если оно соответствует предназначенной услуге.
Изделие для ИМНП должно быть применено только по показаниям и в соответствии с инструкцией производителя.
Инструкции по проведению исследования должны быть доступны пользователям в месте нахождения пациента.
В инструкциях должны быть указаны критические аспекты всех этапов исследования для того, чтобы гарантировать последовательность выполнения ИМНП. Документами, описывающими порядок выполнения исследования, являются стандартные операционные процедуры (СОП), инструкции производителя по эксплуатации изделия, инструкции по выполнению конкретной деятельности в рамках ИМНП или краткие справочные руководства.
Должна быть обеспечена прослеживаемость каждого проведенного исследования, включая идентификацию пациента, записи результатов контроля качества, идентификацию пользователя и, где применимо, сведения о расходных материалах.
Процедуры исследования должны быть направлены на обеспечение безопасности пользователей и пациентов.
ИМНП, выполняемое вне установленных инструкций, может привести к противоречивым и недостоверным результатам и тем самым представлять риск для пациентов. Последствия получения недостоверных результатов включают риски принятия неправильных решений в отношении здоровья, ведения или ухода за пациентами.
Возможны и юридические последствия для поставщика услуг ИМНП в случае применения недостоверных результатов ИМНП.
6.3.4.2 Исследование в присутствии пациента
Исследования в присутствии пациента предпочтительнее и могут служить дополнительной гарантией того, что результаты исследования будут сопоставимы с обследуемым пациентом.
6.3.4.3 Обработка одного образца для одного исследования
Одновременно следует обрабатывать и исследовать только один образец пациента, чтобы не допустить ошибку в прослеживаемости образцов к результату исследования.
6.3.4.4 Идентификация образца
Образцы должны быть промаркированы, если исследования проводят через некоторое время после взятия образца, а также в случае взятия более одного образца у разных пациентов. Маркировка образца должна быть проведена в присутствии пациента.
Для маркировки должна использоваться уникальная идентификация, обеспечивающая прослеживаемость образца до того пациента, у которого он был взят.
6.3.4.5 Считывание результатов
В тех случаях, когда интервал времени имеет критическое значение для результата исследования, пользователи в месте проведения исследования должны иметь в своем распоряжении таймер и применять его. Установленные производителем временные интервалы перед считыванием результатов исследования имеют решающее значение и должны быть соблюдены.
Считывание результатов исследования до истечения рекомендованного производителем интервала времени может привести к получению недостоверных или ложноотрицательных результатов из-за неполной химической реакции образца пациента и реагентов.
Считывание результата исследования по истечении рекомендованного производителем интервала времени может привести к ложноположительным результатам из-за чрезмерного проявления цвета, к ложноотрицательным результатам из-за угасания химической реакции или выцветания, к недействительным результатам, когда химическая реакция выходит за пределы видимой области.
6.3.5 Выявление ошибок
Выявление повторяющихся ошибок или тенденций на этапе исследования может быть использовано для улучшения деятельности поставщика услуг ИМНП. Ошибки, которые следует регистрировать и анализировать, включают:
- отказы изделия для ИМНП;
- отрицательную оценку ВКК и ВОК;
- неисправные устройства для взятия образцов.
Следует консультироваться со специалистами медицинских лабораторий для получения практических рекомендаций, включающих ответы на такие вопросы, как:
- функционирует ли изделие для ИМНП?
- работоспособный ли реагент?
- правильно ли пользователь выполняет исследование?
- как понять, что изделие для ИМНП не функционирует, и как это исправить?
В качестве альтернативы производитель изделия для ИМНП может рекомендовать способы устранения неполадок изделия или услуги уполномоченных организаций для предоставления консультаций.
6.4 Постаналитический этап
6.4.1 Предоставление результатов исследованияВсе результаты исследования должны быть сообщены лицу, указанному в качестве уполномоченного для получения результатов. Лицом, уполномоченным для получения результатов исследования, может быть:
- лицо, назначившее исследование;
- пациент, прошедший исследование;
- другое лицо, в зависимости от обстоятельств.
Во многих странах результаты сообщают непосредственно пациенту, который прошел исследование. Необходимо применять национальные правила и/или требования, которые регламентируют порядок сообщения результата исследования. Инструкции поставщика услуг ИМНП разрабатывают в соответствии с законодательными и нормативными требованиями.
Последствия, связанные с результатом исследования медицинского и/или социального характера, влияют на способ передачи результатов пациенту, включая запрет на их предоставление непосредственно пациенту, прошедшему обследование.
Например, получение результата при таком инфекционном заболевании, как ВИЧ, может иметь как медицинские, так и социальные последствия. Поставщик услуг ИМНП должен учитывать возможные последствия влияния результатов исследования на пациента. Если результат сообщают непосредственно пациенту, пользователь должен иметь возможность предоставлять консультации до и после проведения исследования или направить пациента на соответствующую клиническую консультацию.
6.4.2 Интерпретация результата исследования
Протокол исследования может содержать интерпретацию результатов исследования при условии, что пользователь ИМНП обладает достаточной компетентностью для интерпретации результатов. Интерпретация результатов исследований должна быть проведена в соответствии с инструкциями производителя.
При необходимости следует проконсультироваться со специалистами медицинской лаборатории, чтобы получить рекомендации относительно интерпретации результатов.
Следует также проконсультироваться с медицинскими специалистами, которые могут дать рекомендации по лечению, ведению и профилактике пациента.
6.4.3 Протокол результатов исследования
6.4.3.1 Общие положения
Результаты исследования должны сообщаться оперативно без неоправданной задержки и с детализацией для обеспечения надлежащего лечения и включать следующее (при необходимости):
- уникальную комбинацию идентификаторов для прослеживаемости результата исследования к пациенту;
- дату и время взятия образцов и проведения исследования;
- результат исследования с единицами измерения и референтным интервалом или правилом принятия решения;
- интерпретацию результатов исследования, при наличии;
- рекомендации о получении доступа к последующему лечению.
Пользователи должны убедиться в том, что результаты сообщены уполномоченному лицу и правильно им поняты.
В случае сообщения результатов в устной форме, лицо, получающее результат, должно повторить то, что сообщено ему пользователем, включая полученные советы или инструкции. При наличии возможности результаты, представленные в устной форме, должны сопровождаться протоколом.
6.4.3.2 Результаты, представляющие значительный риск для пациентов и требующие принятия немедленных действий
В некоторых случаях результаты ИМНП могут указывать на значительный риск или опасную ситуацию для жизни пациента. В таких случаях требуется немедленное уведомление медицинского специалиста или срочное обращение пациента за медицинской помощью.
Поставщик услуг ИМНП должен четко определять результаты, которые представляют значительный риск для пациентов, по возможности это должно быть сделано после консультации со специалистами медицинской лаборатории.
Инструкции о действиях, предпринимаемых при получении результатов, представляющих значительный риск для пациента, должны быть доступны пользователям изделия для ИМНП.
Своевременная передача результатов, представляющих значительный риск для пациента, имеет решающее значение для состояния здоровья.
Некоторые исследования требуют немедленного сообщения результата независимо от того, находится ли он в пределах биологического референтного интервала или за его пределами. Одним из таких примеров является исследование на сердечный тропонин.
6.4.4 Обработка и утилизация образцов и расходных материалов
Все образцы, устройства для взятия образцов (например, иглы), реагенты должны быть обработаны и утилизированы с соблюдением требований безопасности.
Инструкции по обработке, удалению и утилизации образцов и расходных материалов разрабатывают в соответствии с законодательными и нормативными требованиями.
6.4.5 Очистка изделия для ИМНП
Изделие для ИМНП, загрязненное биологическими жидкостями, должно быть очищено и обеззаражено в соответствии с инструкцией производителя.
6.5 Внешние аудиты поставщика услуг ИМНП
Следует рассмотреть возможность проведения внешних аудитов коллегами, консультантами, специалистами медицинских лабораторий или внешним органом по оценке соответствия, например национальным или международным органом по аккредитации для оценки процесса проведения исследований и выявления возможностей для улучшения деятельности поставщика услуг ИМНП.
7 Управление информацией
7.1 Общие положения
Сложность управления информацией (УИ), необходимой для поддержки функционирования поставщика услуг ИМНП, должна быть соответствующей назначению, а не чрезмерно сложной или дорогостоящей.
Выбранный уровень поддержки обмена сообщениями должен соответствовать потребностям поставщика услуг ИМНП.
Конфиденциальность информации о пациенте и результатах исследования должна быть обеспечена при применении системы УИ.
Поставщику услуг ИМНП следует рассмотреть возможность использования программных систем обмена сообщениями, которые предлагают интегрированные возможности ведения записей и управления исследованиями.
Программные системы УИ должны быть способны интегрировать различные изделия для ИМНП, идентифицировать пользователей, отслеживать ошибки, выявленные в процессе функционирования изделия, контролировать его работоспособность и проведение технического обслуживания, а также предоставлять руководителям возможность в режиме реального времени наблюдать за деятельностью поставщика услуг ИМНП.
Производители изделия для ИМНП и специалисты медицинских лабораторий могут предложить консультации по программным системам УИ.
7.2 Конфиденциальность и безопасность
Изделия часто обеспечены встроенными системами безопасности для предотвращения несанкционированного доступа. Обеспечение безопасности пользователя «вход в систему» является наиболее распространенной мерой безопасности. В том случае, если встроенные системы безопасности недоступны, необходимо рассмотреть другие способы обеспечения безопасности.
Должны быть приняты меры безопасности, обеспечивающие использование изделия только уполномоченными пользователями. Правила хранения информации об исследовании должны обеспечивать ее конфиденциальность и безопасность.
При необходимости должна быть обеспечена кибербезопасность (защита систем, подключенных к Интернету).
Безопасность конфиденциальной информации имеет существенное значение. Изделие для ИМНП, имеющее компьютерное обеспечение, должно быть защищено от компьютерных вирусов, повреждения данных и несанкционированного доступа.
8 Документирование деятельности и управление записями
8.1 Документирование деятельности
Поставщик услуг ИМНП должен документировать деятельность в объеме, необходимом для обеспечения последовательного выполнения процедур и подтверждения достоверности результатов ИМНП.
Любая деятельность, требующая последовательного выполнения процедур, должна быть задокументирована. Осуществление контроля за обращением документов в соответствии с установленными требованиями обеспечивает применение актуальных версий документированных процедур (инструкций).
8.2 Управление записями
8.2.1 Общие положенияЗапись не содержит описания выполнения деятельности.
Записи могут создаваться и храниться в любой форме или на любом носителе, например на бумажном носителе или в электронном виде.
8.2.2 Требования к управлению записями
Если установлен срок хранения записи, то должна существовать система восстановления информации и сохранения данных.
Требования к ведению записей обязательны как для данных, зафиксированных рукописным способом, так и для данных, внесенных в электронные системы. Если данные передают в электронном виде, необходимо проводить регулярные проверки целостности данных.
8.2.3 Исправление записей
Исходные записи (например, протоколы) не должны быть изменены, скрыты или удалены и должны быть сохранены по мере необходимости.
Исходные записи могут быть изменены путем создания новой записи, наименование которой содержит информацию об исправлении, например исправленный протокол. Срок хранения исправленной записи соответствует исходной записи.
Процедура исправления ошибки, например неправильного результата ИМНП, должна быть задокументирована. Исправленная запись должна быть четко идентифицирована как ошибочная с указанием времени и даты внесения изменений. Следует сообщать как об исходном, так и об исправленном результате, если результаты существенно отличаются, для подтверждения того, что изменение идентифицировано и принято соответствующее решение. Лицо, вносящее изменение, должно быть идентифицировано.
Если изменение исходной записи может оказать существенное влияние на лечение пациента, информация о результате исследования должна быть передана поставщиком услуг ИМНП в максимально сжатые сроки.
8.2.4 Хранение записей
Поставщики услуг ИМНП работают по-разному. Многие поставщики услуг ИМНП ведут учет и хранят записи о проведенных исследованиях, включая результаты исследований, данные о пациенте и образцах, что позволяет предоставить доказательства проведения исследования.
Некоторые поставщики услуг ИМНП не хранят записи о проведенных исследованиях, касающихся пациента, образцов и результатов исследования, таких как история болезни пациента и/или результат исследования. В этих случаях результат исследования выдают непосредственно пациенту, информацию о проведенном исследовании не сохраняют в месте проведения исследования.
Поставщик услуг ИМНП должен определить, какие записи подлежат хранению с указанием срока их хранения.
Законодательные и нормативные требования могут устанавливать срок хранения определенных записей в течение определенного периода времени, что должно соответствовать требованиям документированных процедур, разработанных поставщиком услуг ИМНП.
Примечание — Примеры документов и записей перечислены в приложении С.
9 Охрана труда и техника безопасности
9.1 Общие положения
Требования в области охраны труда и техники безопасности распространены на все рабочие процессы, включая проведение ИМНП. Поставщик услуг ИМНП должен назначить ответственное лицо, которое будет отвечать за все аспекты деятельности, касающиеся охраны труда и техники безопасности.
Меры, применяемые для охраны труда и соблюдения техники безопасности, должны быть включены в программу обучения пользователей.
Консультации по вопросам охраны труда и соблюдения техники безопасности можно получить у производителей изделий и поставщиков медицинских услуг, также можно обратиться в национальные и региональные органы власти.
Примечание — Особое внимание следует уделять обследованию младенцев и детей для обеспечения их безопасности.
9.2 Предотвращение внутрибольничных заражений (биобезопасность)
9.2.1 Общие положенияИМНП проводят путем исследования биологических жидкостей, применяя для взятия образцов инструменты с острыми кромками, которые представляют опасность передачи патогенов, передаваемых через кровь.
9.2.2 Использование острых инструментов
Острые инструменты необходимо использовать только один раз и утилизировать в специально предназначенный для этих целей контейнер. Следует использовать острые инструменты со встроенными защитными элементами.
Несоблюдение правил применения ланцетных устройств (острых инструментов) может увеличить риск заражения, поэтому их следует выбирать после консультации с производителями изделия.
Поставщик услуг ИМНП должен внедрить правила безопасного применения острых инструментов и определить меры, предпринимаемые в случае получения травмы при их использовании.
9.2.3 Средства защиты
Для проведения ИМНП должны быть предоставлены перчатки, средства защиты глаз, например очки, средства для промывания глаз и другие средства защиты, а также соответствующие дезинфицирующие средства для очистки изделий, рабочей зоны и устранения разливов.
Следует использовать перчатки без латекса, учитывая возможную аллергическую реакцию на латекс.
Использование устройств для дезинфекции рук, например раковины, соответствующий дезинфицирующий гель для рук, должно обеспечить снижение к минимуму риска инфекционного заражения.
9.2.4 Утилизация отходов
Требования к безопасному обращению с медицинскими отходами и их утилизации должны быть рассмотрены в соответствии с национальными и региональными правилами. Кроме того, воздействие медицинских отходов на окружающую среду должно быть сведено к минимуму.
9.2.5 Анализ опасности
При использовании устройства ИМНП следует проводить идентификацию и минимизацию возможных опасностей. Они могут включать в себя вздутие батареек, вызывающее опасность возникновения пожара, и утечку медицинских отходов, что может привести к повреждению электрических кабелей.
9.3 Другие меры по охране труда и технике безопасности
Оценка риска для здоровья и безопасности пациентов, пользователей и руководителей должна быть осуществлена до начала проведения ИМНП. Любой выявленный риск должен быть сведен к минимуму, насколько это возможно.
Оценка риска должна включать риски, связанные с применением расходных материалов, изделий для ИМНП и устройств для взятия образцов. Кроме того, следует учитывать требования к инфраструктуре, необходимой для обеспечения исследований, в том числе к электроснабжению и водоснабжению.
Инструкции по охране труда и техники безопасности, не охватывающие все аспекты безопасности и/или применяемые с нарушениями, могут иметь существенные медицинские и/или юридические последствия.
Требования документированных процедур, разработанных поставщиком услуг ИМНП, должны соответствовать установленным законодательным и нормативным требованиям и/или правилам в области охраны труда и техники безопасности.
Примечание — В приложении Е приведена дополнительная информация по предотвращению внутрибольничных заражений (биобезопасность).
Приложение А (обязательное)
Обучение и компетентность пользователей
А.1 Общие положения
Для получения допуска к проведению исследований пользователи должны пройти соответствующее обучение в области теоретических основ проведения исследования и технических характеристик изделия для ИМНП, результатом которого являются подтвержденная компетентность пользователя.
Пользователям, проводящим исследования, должно быть предоставлено учебное пособие. В учебном пособии должны быть указаны темы, подлежащие рассмотрению в рамках учебной программы и описаны конкретные изучаемые объекты; оценку полученных знаний и технических навыков проводят по каждой теме обучения.
Должен быть указан метод обучения каждого изучаемого объекта, а также способ оценки знаний и критерии подтверждения компетентности обучаемого персонала.
Должен быть установлен проходной балл для оценки компетентности. Пользователи изделий для ИМНП должны периодически проходить оценку компетентности.
Ниже приведен список тем, которые должны быть включены в программу обучения и повышения квалификации.
А.2 Программа обучения
Программа обучения включает:
а) принцип исследования(й), которое(ые) должно(ы) быть выполнено(ы);
Ь) цель исследования;
с) контролируемые факторы исследования (например, продолжительность интервала времени нахождения картриджа или полоски вне первичной и вторичной упаковок, в течение которого можно получить достоверный результат исследования);
d) тип образца, который может быть исследован (включая образцы пациентов, ВОК и ВКК);
е) единицы измерения, в которых представлен результат исследования;
f) эксплуатационные характеристики изделия для ИМНП, такие как:
- точность результата исследования,
- погрешность измерения для исследования количественных характеристик,
- чувствительность или истинно положительный результат,
- специфичность или истинно отрицательный результат для качественных результатов;
д) интерферирующие факторы, касающиеся проведения исследования;
h) требования к проведению преаналитического этапа:
- обоснованность назначения изделия,
- частота выполнения исследования,
- готовность пациента к проведению исследования, включая его безопасность и подготовку к исследованию,
- взятие образцов, подходящие контейнеры для образцов,
- надлежащая идентификация пациентов, проходящих обследование,
- уникальная идентификация каждого образца,
- надлежащая подготовка пациентов, например натощак для исследования на содержание глюкозы;
i) проведение исследования:
- правила хранения реагента,
- подробная информация об интерферирующих факторах, влияющих на результаты исследования,
- порядок проведения исследования,
- что означает сообщение об ошибке и соответствующие действия, которые необходимо предпринять в этом случае,
- распознавание сомнительных результатов и соответствующие действия, которые необходимо предпринять,
- запись результатов исследования;
j) обеспечение достоверности результатов исследований (внутренний и внешний контроль качества):
- хранение и подготовка материалов для контроля качества,
- периодичность проведения контроля качества и порядок регистрации результатов,
- критерии оценки результатов контроля качества, принятия/отклонения результатов;
к) протокол о результатах проведения исследования:
- контрольные интервалы значений, требующие принятие решений для оказания медицинской помощи,
- единицы измерения,
- стандартные комментарии для интерпретации результатов,
- печатные и электронные протоколы (если применимо),
- критические результаты исследований, требующие принятия неотложных мер;
I) техническое обслуживание изделия для ИМНП:
- плановое техническое обслуживание,
- устранение неполадок в работе изделия,
- проведение калибровки, при необходимости,
- инструкции производителя;
гл) охрану труда и технику безопасности:
- инфекционный контроль и биобезопасность,
- обработка разливов крови и обращение с острыми инструментами,
- удаление и утилизация биологических отходов;
п) конфиденциальность информации;
о) понимание этических стандартов при проведении исследований;
р) обеззараживание изделия для ИМНП.
А.З Оценка компетентности
Пользователь, в рамках оценки компетентности должен:
а) продемонстрировать знание и понимание процедуры исследования;
Ь) провести исследование в соответствии с инструкциями производителя, включая проведение контроля качества, хранения реагентов и соблюдения условий эксплуатации изделия;
с) предоставить в защищенном формате результаты исследований и их интерпретацию;
d) продемонстрировать знание проведения процедур по обеспечению качества, таких как ВОК, ВКК, и порядка выполнения действий в случае выявления несоответствий при проведении исследований;
е) выполнить техническое обслуживание и устранить выявленные неисправности изделия;
f) сформулировать требования к отчетности;
д) обнаружить ошибочные результаты исследования и продемонстрировать выполнение действий, необходимых в таких случаях.
Приложение В (обязательное)
Изделие для ИМНП и выбор наиболее подходящего исследования
В.1 Оценка соответствия изделия для ИМНП применению по назначению
В.1.1 Общие положения
Следует проконсультироваться со специалистами медицинских лабораторий для получения рекомендаций по выбору наиболее подходящего исследования.
Перед покупкой изделия и началом проведения исследования должны быть установлены ключевые критерии, касающиеся требований к изделию и его пригодности для применения.
Используемое изделие должно соответствовать цели исследования ИМНП.
В некоторых случаях для достижения цели исследования может потребоваться точное высокотехнологичное изделие. В других случаях более подходящим может быть несложное изделие для проведения скринингового исследования, которое проще в использовании, рентабельнее и более компактно. Такой подход называют «соответствие применения по назначению».
В следующем разделе изложены правила и советы, которые помогут с выбором изделия для ИМНП, соответствующего применению по назначению.
Чтобы определить, является ли изделие соответствующим применению по назначению, должны быть установлены ключевые характеристики изделия. В зависимости от цели исследования некоторые характеристики изделия являются более значимыми, чем другие, этот факт следует учитывать руководителям поставщика услуг ИМНП при выборе изделия для ИМНП. При оценке характеристик изделия стоимость не должна являться более значимым фактором, чем благополучие пациента, проходящего обследование.
При покупке изделия рекомендуется учитывать следующее:
- оценку необходимости проведения исследования и результаты, ожидаемые от проведения исследования;
- эксплуатационные характеристики изделия, такие как:
- точность (см. В.1.2.2) и погрешность результатов количественных характеристик исследования,
- чувствительность (истинно положительный показатель) и специфичность (истинно отрицательный показатель) для качественных результатов;
- возможность устранения неисправностей, включая поддержку со стороны уполномоченных организаций, если требуется;
- прогнозируемую рабочую нагрузку и эксплуатационные ресурсы выбранного изделия;
- наличие необходимых расходных материалов с учетом требований к температурному режиму хранения и достаточности ресурсов для их размещения в холодильных установках, при необходимости;
- поддержку эксплуатации (например, наличие технической поддержки, предоставляемой производителем или дистрибьютором, а также проведение специального обучения пользователей по эксплуатации изделия);
- требования к техническому обслуживанию, включая очистку и дезинфекцию изделия;
- требования к образцам (например, требования к подготовке тех образцов, которые необходимо обработать перед исследованием, таким как центрифугирование, разбавление или экстракция, что может усложнить процесс исследования или сделать его невыполнимым);
- объем образца (например, требования к образцу для исследования);
- срок годности расходных материалов (например, гарантия достаточного количества расходных материалов, которые будут использованы до истечения установленного срока годности);
- сопоставление результатов ИМНП с результатами, полученными в медицинской лаборатории, если это применимо и важно для оценки состояния одного и того же пациента в случае применения комбинации результатов лабораторных исследований и ИМНП;
- возможность передачи результатов в электронном виде;
- возможность нанесения штрих-кода для пациентов, пользователей и расходных материалов;
- мобильность (т. е. возможность перемещения изделия и его компактность, необходимые для ИМНП). Недостаточно компактное изделие может не подойти для использования, если его применение по назначению предусматривает перемещение для проведения исследования;
- долговечность изделия, включая сохранение/восстановление работоспособности в случае повреждения, вызванного падением и загрязнением биологическими жидкостями;
- наличие необходимых материалов для контроля качества;
- наличие соответствующих программ внешней оценки качества;
- гарантийный срок эксплуатации изделия;
- наличие договора на обслуживание (например, обеспечение текущего обслуживания и техническая поддержка эксплуатации);
- наличие финансовых ресурсов для закупки и периодического обслуживания (включая затраты на проведение технического обслуживания, контроля качества, инсталляцию изделия, закупку расходных и контрольных материалов);
- предоставление поставщиком изделия обучающих материалов;
- надежность поставок;
- условия окружающей среды, необходимые для проведения исследований, такие как показатели температуры, влажности, освещения, электрические характеристики. Изделие может не подойти для проведения исследования, если оно чувствительно к экстремальным условиям окружающей среды или требует постоянного сетевого питания, при наличии таких требований для его соответствия применения по назначению;
- продолжительность интервала времени для получения результата;
- продолжительность интервала времени, в течение которого образцы остаются стабильными;
- способы безопасной утилизации биологических отходов после проведения исследования;
- совместимость управления информацией, например совместимость передачи данных об изделии, промежуточного программного обеспечения и информационной системы;
- наличие доступа к последующему или дополнительному исследованию по мере необходимости.
Для выбора наиболее подходящего изделия для ИМНП следует сравнить методы исследования, применяемые в различных изделиях, если это возможно.
В.1.2 Аналитические характеристики
В.1.2.1 Общие положения
Аналитические характеристики — это ряд рассматриваемых ключевых критериев, оценка которых дает поставщику услуг ИМНП представление о том, в какой степени предлагаемое изделие подходит для нужд пользователей и соответствует применению по назначению.
Аналитические характеристики должны включать:
- предельно высокие или низкие значения результатов;
- надежность результатов исследования;
- нелинейность исследования (получение недостоверных результатов при отклонении на высоких или низких значениях).
С технической точки зрения эти критерии включают:
- точность/смещение;
- прецизионность;
- линейность;
- общую аналитическую ошибку;
- предел обнаружения;
- предел количественного определения;
- правильность;
- интерферирующие факторы;
- прослеживаемость.
В. 1.2.2 Характеристики изделия
Характеристики изделия, которые следует учитывать, включают нижеприведенное.
а) Точность
Степень близости результата измерений к принятому опорному значению. Точность определяется как смещением, так и погрешностью.
Ь) Смещение
Разность между средним значением измерений одного и того же объекта исследований и его истинным значением.
Смещение определяют как положительную или отрицательную величину. При положительном смещении результаты оказываются выше истинного значения; при отрицательном смещении — ниже истинного значения.
с) Непрецизионность
Показатель вариабельности при измерении одного и того же образца более одного раза.
d) Предел обнаружения (LoD)
Наименьшее количество определяемого вещества, которое можно обнаружить по сравнению с отсутствием вещества (пустая проба) в пределах установленного доверительного интервала.
е) Предел количественного определения (LoQ)
Наименьшая концентрация, при которой аналит может быть достоверно обнаружен и при которой достигаются заранее заданные значения смещения и погрешности. LoQ может быть эквивалентен LoD или может соответствовать более высокой концентрации.
f) Линейность
Свойство калиброванного изделия, которое может быть графически представлено в виде линейной зависимости между значениями, полученными в результате исследования, и действительными концентрациями аналита. Анализ линейности проводят для обеспечения предела обнаружения вещества; если полученное значение выходит за границы предела обнаружения, то выбирают наибольшее или наименьшее значение предела обнаружения. Например: исследуемое значение составляет 10 ммоль/л, а нижний предел линейности/обнаружения — 12 ммоль/л. Сообщаемый результат испытания должен составлять менее 12 ммоль/л.
д) Прецизионность
Степень близости друг к другу независимых результатов измерений, полученных на одном и том же образце — это «получение каждый раз одного и того же результата измерения».
h) Прогностическая ценность для качественных исследований
Положительные и отрицательные прогностические значения обычно используют для исследований, результаты которых обычно являются бинарными (положительные/отрицательные, присутствуют/отсутствуют). Это доли положительных и отрицательных результатов, которые являются истинно положительными и истинно отрицательными результатами. Следовательно, положительное прогностическое значение (истинно положительное) — это получение положительного результата и действительное присутствие аналита. Отрицательное прогностическое значение (истинно отрицательное) — это получение отрицательного результата при отсутствии аналита. Такими примерами являются исследование на ВИЧ и другие инфекционные заболевания или тестирование на беременность, где результат либо отрицательный, либо положительный, либо неопределенный (серая зона, где результат не является однозначным и должен быть повторен позже или с помощью более чувствительного исследования).
i) Качественное исследование
Присутствие конкретного аналита в образце обычно трактуется как положительный/отрицательный, присут-ствует/отсутствует. Качественные исследования могут быть использованы для скрининга (исследование на наркотики) и диагностики (инфекционные заболевания, беременность).
j) Количественное исследование
Присутствие определенного аналита в образце устанавливают в ходе количественных исследований, определяющих то значение, которое обычно сравнивают с пороговым значением (подтверждения исследования на наркотики, тропонин), с целевым значением (холестерин, НЬА1с) или контрольным интервалом (глюкоза).
к) Представление результатов
Результаты, полученные с применением изделия для ИМНП, являются качественными, полуколичественны-ми или количественными. Необходимо определить, какой тип результата наиболее подходит для предполагаемого исследования.
I) Полуколичественное исследование
Исследования, которые дают такой результат, как «менее 5», «от 5 до 20» или «более 20».
гл) Чувствительность
Способность исследования правильно идентифицировать пациентов с заболеванием (истинно положительный результат).
п) Специфичность
Способность исследования правильно идентифицировать пациентов без заболевания (истинно отрицательный результат).
о) Общая аналитическая ошибка
Сочетание непрецизионности и среднего смещения, которое может быть использовано для расчета и оценки качества исследования и постановки целей.
р) Прослеживаемость
Прослеживаемость — свойство результата измерения, в соответствии с которым результат может быть соотнесен с эталоном для сравнения посредством документированной непрерывной цепочки калибровок.
Преимущество прослеживаемости в ИМНП заключается в обеспечении измерения одного и того же аналита, что должно обеспечить сопоставимые/эквивалентные результаты измерений на различных изделиях для ИМНП.
q) Правильность
Степень близости среднего значения, полученного на основании репрезентативной серии результатов измерений (или результатов исследований), к действительному (целевому или референтному) значению.
Совершенная правильность — это отсутствие смещения.
В.1.3 Оценка характеристик изделия
Изделие и метод проведения исследования должны быть полностью оценены в соответствии с установленными нижеприведенными характеристиками изделия.
Характеристики изделия должны быть расставлены по приоритетам от наиболее значимых до наименее значимых, чтобы определить, какое изделие наилучшим образом соответствует потребностям поставщика услуг ИМНП. В некоторых случаях ни одно из имеющихся в наличии изделий не будет соответствовать всем или каким-либо из установленных существенных характеристик. В таком случае следует оценить целесообразность проведения исследования. Однако, если проведение исследования считают существенным, определение приоритетов характеристик изделия будет по-прежнему полезным.
Некоторые производители проводят тщательную проверку характеристик изделия в различных условиях эксплуатации, но есть и такие, которые проверяют изделие только в нормальных условиях эксплуатации, не выполняя проверку в экстремальных условиях. Поэтому оценку производителей следует рассматривать как часть процесса закупок.
В.2 Валидация и/или верификация методов и изделия
В.2.1 Общие положенияВалидация и/или верификация метода исследования и изделия должны быть проведены до их внедрения в практическую деятельность.
В.2.2 Валидация изделия и методов для ИМНП
Валидацию изделия и методов для ИМНП обычно проводит производитель и определяет наилучшие возможные характеристики работоспособности изделия, которые позволяют получить достоверные результаты исследования. Процедура валидации часто является сложной и может быть дорогостоящей.
Необходимо, чтобы результаты валидации демонстрировали надежное получение достоверных результатов при использовании изделия, соответствующего применению по назначению.
Следует отметить, что объем работ по валидации различается у производителей. Достаточность проведенного объема работ по валидации (степень валидации) должна быть понятна руководителю ИМНП. Некоторые производители проводят проверку изделия с учетом различных условий и факторов окружающей среды. Однако некоторые производители проводят валидацию в строго контролируемых лабораторных условиях опытными и обученными специалистами. Хотя это и дает представление о наилучшей производительности изделия, но, скорее всего, не будет отражать то, как изделие используют при проведении ИМНП в реальных условиях.
Разные пользователи выполняют ИМНП в различных, а иногда и экстремальных условиях окружающей среды. В идеале изделие для ИМНП должно быть проверено с учетом различных условий и факторов окружающей среды, которые могут возникнуть в процессе осуществления деятельности поставщика услуг ИМНП. Экстремальные жара или холод, влажность, пыль, частые перемещения и «удары» изделия могут оказать негативное влияние на надежность и точность результатов ИМНП, а также на производительность изделия. Поставщик услуг ИМНП должен обсудить с производителем последствия проведения исследования в различных возможных условиях и факторах окружающей среды с целью определения их влияния на достоверность результатов ИМНП.
Если валидация изделия проведена производителем, то повторять ее не требуется. В этом случае функциональные характеристики устройства будут предоставлены производителем. Тем не менее пользователь изделия для ИМНП должен выполнить верификацию (см. В.2.2).
Если валидация изделия не проведена производителем, то пользователю необходимо провести валидацию изделия для ИМНП перед его использованием. Эта процедура может быть трудной и дорогостоящей. В таких случаях следует рассмотреть другой вариант изделия для проведения исследования.
При применении изделия за пределами требований, установленных в инструкции по эксплуатации производителя или спецификации, а также в случае отсутствия валидации изделия могут быть получены недостоверные результаты исследования. Изделие, применяемое за пределами требований, установленных в инструкции по эксплуатации, потребует от пользователя проведение валидации даже при незначительных изменениях. Эта процедура может быть трудной и дорогостоящей. Такого варианта использования изделия следует избегать.
Как минимум, результаты валидации, проводимые на новых изделиях для ИМНП, должны включать показатели точности, линейности и результаты сличительных испытаний с другими изделиями.
В.2.3 Верификация изделия и методов для ИМНП
Верификация — это менее объемный процесс, чем валидация, направленный на подтверждение того, что пользователи изделия для ИМНП должны получить достоверные результаты, подтвержденные при проведении валидации, или, по крайней мере, достичь точных и надежных результатов исследования, соответствующих применению по назначению изделия.
Верификация изделия направлена на подтверждение соответствия того, что заявленные характеристики производительности изделия, задокументированные производителем, соответствуют установленным при проведении ИМНП пользователем в конкретных условиях. Верификация должна быть настолько полной, насколько это необходимо, в зависимости от сложности применяемого изделия и потенциально различных условий окружающей среды, в которых возможно проведение ИМНП, например при сильной жаре, большом количестве пыли.
При проведении верификации следует использовать статистически значимое количество образцов, способных предоставить информацию для принятия важных клинических решений при соответствующем применении по назначению.
Примечание — Общепринятое статистически значимое число выборок составляет 20 (N = 20).
Точность должна быть определена для тех методов, которые обеспечивают количественный результат.
Для качественных и полуколичественных методов должны быть проведены сличительные испытания с существующими валидированными методами.
Исследование образцов ВКК с известными значениями в диапазоне концентраций обеспечивает оценку точности результатов для количественных методов.
Многократное повторение одного и того же образца ВКК позволяет оценить точность результата при заданной концентрации.
Объединенные образцы пациентов и обмен образцами также являются потенциальным источником образцов, которые могут быть использованы при проведении сличительных испытаний. В некоторых случаях производитель изделия для ИМНП или медицинская лаборатория могут предоставить доступ к соответствующим образцам.
В.З Калибровка изделия для ИМНП
Калибровка изделия является важным шагом в проверке изделия и помогает обеспечить получение достоверного результата. Калибровка позволяет отрегулировать изделие для получения заданного значения. После калибровки следует выполнять ВКК, чтобы выявить любые изменения в измерительной системе изделия. Изделие для ИМНП должно быть откалибровано в соответствии с инструкциями производителя там, где это применимо. Как правило, производитель поставляет соответствующие калибраторы для калибровки изделия. Если производитель не поставляет калибраторы, необходимо применить другие соответствующие калибраторы, однако следует избегать использования такого изделия.
Примечание — Не все изделия нуждаются в калибровке, что может упростить их использование. И наоборот, для некоторых изделий может потребоваться калибровка, которая относится к дорогостоящей процедуре и усложняет деятельность поставщика услуг ИМНП. Это важные факторы, которые следует учитывать.
В.4 Изделия для ИМНП и регулирование диагностики in vitro (ИВД)
Во многих странах качество, эффективность и безопасность изделия для ИМНП должно быть подтверждено регулирующим органом по диагностике in vitro (ИВД)2, прежде чем оно сможет поступить в обращение. Наличие подтверждения соответствия изделия требованиям эффективности и безопасности дает основание считать, что изделие имеет надлежащее качество.
Приложение С (справочное)
Документы и записи
С.1 Документы
Документ — это часть письменного, печатного или электронного материалов, которые предоставляют информацию или описывают, как именно должен быть выполнен процесс. Обычно это правила, ООП и инструкции по использованию.
Документы подлежат периодическому пересмотру и актуализации, надлежащий контроль документооборота имеет существенное значение.
Примечание — Контроль документооборота означает, что все документы утверждаются руководителем и гарантируют, что все пользователи обеспечены идентичными инструкциями для выполнения деятельности.
Процедуры и действия, которые должны быть задокументированы в инструкциях, следующие:
- как происходит выбор и закупка изделий, расходных материалов, реагентов, ВОК и ВКК;
- как проведены обучение и оценка компетентности персонала;
- как выполнены плановые и внеплановые процедуры технического обслуживания изделия;
- перечень процедур и инструкций по эксплуатации изделия;
- как и кому сообщаются результаты ИМНП;
- перечень неотложных и важных результатов и каким образом и кому о них следует сообщать;
- как утилизировать отходы;
- как проведена маркировка образцов;
- как осуществлен контроль обеспечения актуальными версиями документов.
С.2 Записи
Запись — результат процесса или свидетельства осуществленной деятельности (например, результат ИМНП). Записи, которыми следует управлять, включают:
- обучение персонала и оценку его компетентности;
- результаты внутреннего контроля качества и внешней оценки качества;
- результаты ИМНП;
- время и дату ИМНП;
- сообщение о неблагоприятных событиях;
- данные об инвентаризации расходных и контрольных материалов;
- результаты верификация и/или валидация используемого метода;
- результаты оценки рисков и аудита;
- данные о выявленных ошибках;
- сведения о жалобах и предложениях;
- сведения о техническом обслуживании изделия;
- сведения о ремонте изделия;
- параметры температуры проведения исследования, где это необходимо;
- место проведения исследования;
- персонал, который провел исследование;
- наименование изделия, применяемого для проведения исследования;
- номер партии изделия и реагентов для ИМНП;
- срок годности реагентов для ИМНП.
Приложение D (обязательное)
Внутренний контроль качества и внешняя оценка качества
D.1 Общие положения
Следует проконсультироваться со специалистами медицинских лабораторий для получения рекомендаций по процессу взятия образцов.
D.2 Внутренний контроль качества
D.2.1 Общие положения
Внутренний контроль качества (ВКК) — это процесс, используемый поставщиком услуг ИМНП для мониторинга и оценки качества процесса исследования и функционирования изделия для ИМНП, результаты которого предоставляют пациенту. Результаты ВКК используют для подтверждения того, что изделие функционирует должным образом и, следовательно, результаты исследования образцов пациента соответствуют цели.
Насколько всеобъемлющей будет программа ВКК, зависит от надежности изделия и потенциального риска причинения вреда пациенту в случае сообщения об ошибочном результате и от принятия необходимых мер.
ВКК должен проверять не только стабильность функционирования изделия, но и соблюдение инструкций по выполнению исследований пользователем, а также состояние расходных материалов, применяемых для проведения исследования. На стабильность функционирования могут влиять различные пользователи, использующие изделие, а также разные номера партий расходных материалов и их состояние.
D.2.2 Процесс контроля качества
Процесс контроля качества включает в себя:
- регулярное исследование образцов ВКК вместе с образцами пациентов;
- сравнение результатов ВКК с конкретными статистическими пределами (диапазонами) (количественный метод исследования);
- сравнение результатов ВКК с ожидаемым результатом (качественный метод исследования).
Проведение ВКК позволяет контролировать аналитические характеристики изделия, необходимые для принятия решений по результатам ИМНП (часто медицинских), и предупреждает пользователей о неудовлетворительных аналитических характеристиках. Как правило, образцы ВКК подтверждают точность или повторяемость метода ИМНП.
Цель ВКК состоит в том, чтобы оценить стабильность характеристик изделия при проведении исследования, а также по истечении определенного времени предоставить информацию о достоверном результате исследования по сравнению с ожидаемым результатом.
Как минимум, ВКК проводят в соответствии с инструкциями производителя.
Частота ВКК должна быть установлена до начала применения изделия.
Использование материала ВКК, который имеет ожидаемые значения в важных точках принятия решений, позволяет удостовериться в том, что исследование «под контролем» там, где это представляется важным.
Результаты ВКК следует проверять перед выполнением каждого этапа исследования, чтобы можно было устранить нарушения до того, как потенциально будут получены недостоверные результаты у пациентов.
Должны быть задокументированы критерии результатов приемлемости ВКК, включая допустимые диапазоны или предельные значения. Важно, чтобы критерии приемлемости ВКК («прошел» контроль или «не прошел») были установлены на соответствующем уровне, чтобы определить, когда исследование вышло из-под контроля.
Если критерии приемлемости ВКК установлены в широком диапазоне значений (+ целевое значение), нарушения могут быть обнаружены только тогда, когда станет слишком поздно. Если критерии приемлемости ВКК определены в узком диапазоне значений, результаты исследования могут быть отклонены, когда в этом отсутствует необходимость.
Если полученный результат является количественным, простейшие критерии приемлемости ВКК основаны на количестве результатов ВКК, выходящих за пределы допустимого диапазона значений и известных как выбросы значений ВКК. Критерии приемлемости ВКК могут быть статистически рассчитаны на основе ожидаемых результатов исследования. Некоторые изделия могут предлагать такие функции. При возможности, следует обратиться за консультацией к специалистам медицинских лабораторий по установлению соответствующих критериев приемлемости ВКК.
Анализ результатов ВКК включает проверку данных на предмет сдвига значений и выявление тенденций в пределах заранее определенного процента отклонения.
D.2.3 ВКК количественного метода исследований
Если результаты представлены в количественном выражении, программа ВКК также должна быть количественной.
Количественные образцы ВКК содержат установленные значения количества аналита. Ожидается, что полученный результат будет близок к установленному значению и находится в приемлемом диапазоне. В тех случаях, когда результаты выходят за пределы допустимого диапазона, необходимо принять меры по устранению ошибок до того, как пациенты пройдут обследование.
D.2.4 Диапазоны значений результатов ВКК количественного метода исследования
Допустимые диапазоны значений ВКК обычно предоставляет производитель, но они также могут быть статистически рассчитаны пользователем. Допустимый диапазон значений — это ожидаемый результат плюс и минус диапазон значений по обе стороны от ожидаемого результата.
Например, ожидаемый результат ВКК для уровня глюкозы в крови может быть 4,5 ммоль/л. Допустимые пределы значений могут составлять+0,3 ммоль/л. Таким образом, допустимый диапазон значений для результата ВКК будет от 4,2 до 4,8 ммоль/л. Любой результат ниже 4,2 ммоль/л или выше 4,8 ммоль/л находится за пределами допустимого диапазона значений и требует пересмотра и принятия соответствующих мер. Обследование пациентов не следует начинать до тех пор, пока результат ВКК не попадет в допустимый диапазон значений.
D.2.5 ВКК качественного метода исследований
Качественные образцы ВКК содержат установленные значения качественного результата исследуемого аналита. Ожидается, что полученный результат ВКК будет таким же, как и установленное значение качественного результата. Примеры качественных результатов могут быть положительными/отрицательными, или присутствовать/ отсутствовать, или выше/ниже предельного значения.
Когда качественные результаты ВКК выходят за рамки ожидаемого значения результата, необходимо принять меры по устранению ошибок до того, как пациенты пройдут обследование.
D.2.6 Результаты ВКК качественного метода исследования
Диапазоны значений результатов ВКК для качественного метода исследований неприменимы. Результат ВКК по сравнению с ожидаемым результатом либо верен, либо не верен. Например, если ожидаемый положительный результат ВКК дает положительный результат, то это правильно, и обследование пациента может начинаться.
Однако если ожидаемый положительный результат ВКК дает отрицательный результат, то это будет неверно и требует пересмотра и принятия соответствующих мер до начала обследования пациента.
В идеале как положительный, так и отрицательный контроль должен быть выполнен одновременно.
D.2.7 Другие проверки качества
D.2.7.1 Общие положения
Изделие для ИМНП может иметь некоторые функциональные возможности для проведения контроля качества. Целью контроля качества может быть проверка целостности изделия, целостности образца, потока образца или объема образца. Такие функциональные возможности обычно не обеспечивают проверку контроля качества всего процесса исследования, и, следовательно, может потребоваться применение других методов контроля качества.
D.2.7.2 Иммунохроматографический метод ИМНП
Изделия для ИМНП, основанные на иммунохроматографическом методе, представляют собой простое изделие, предназначенное для обнаружения присутствия (или отсутствия) целевого аналита в образце без необходимости применения другого специального изделия. Наиболее известным изделием является тест на беременность для проведения ИМНП.
Большинство изделий для проведения ИМНП, основанных на иммунохроматографическом методе, включают две контрольные метки или более.
Для двухлинейного изделия первая метка обычно является тестовой линией, которая показывает фактический результат.
Вторая метка известна как контрольная линия. Большинство изделий для проведения ИМНП, основанных на иммунохроматографическом методе, имеют контрольную линию, подтверждающую, что образец достаточно переместился вдоль применяемого изделия, чтобы иметь возможность получить результат. Контрольная линия указывает на то, что количество образца достаточно для получения результата, однако это не означает, что изделие функционирует должным образом. В таких случаях следует рассмотреть дополнительные материалы для проведения ВКК, которые проверяют весь процесс исследования (имитируют способ взятия образцов у пациентов).
Некоторые изделия для ИМНП имеют несколько тестовых линий, например конкретные тестовые линии для определяемых наркотиков.
D.2.8 Электронный контроль качества
Электронный контроль качества — это проверка сигнала измерительной системы изделия для ИМНП. Данный контроль не проверяет аналитическую (исследуемую) составляющую исследования. Таким образом, электронный контроль качества дополняет, а не заменяет минимальные требования к контролю качества изделия.
D.2.9 Корректирующие действия
Если результаты ВКК выходят за рамки ожидаемого значения, известного как выброс, то процедуру ВКК считают неприемлемой (что-то пошло не так).
Прежде чем проводить дальнейшее исследование пациента, необходимо предпринять соответствующие меры, касающиеся выбросов, в соответствии с заранее установленными инструкциями. Выбросы, выявленные при проведении ВКК, и предпринятые меры должны быть зафиксированы.
Необходимо незамедлительно исследовать причины выявления выбросов при проведении ВКК, поскольку они также могут быть отражены в результатах исследования образцов пациента.
Анализ причин выявления выбросов на ежедневной основе гарантирует, что проведение исследования находятся под контролем в день его проведения. Однако причины выявления выбросов также должны быть проанализированы на долгосрочной основе для анализа тенденций. Результаты анализа тенденций позволяют определить первопричины проблем проведения исследования и разработать эффективный план усовершенствования процессов.
Производитель изделия для ИМНП обычно помогает устранить нарушения, обнаруженные при проведении ВКК, и дает рекомендации в части разработки корректирующих действий, которые необходимо реализовать.
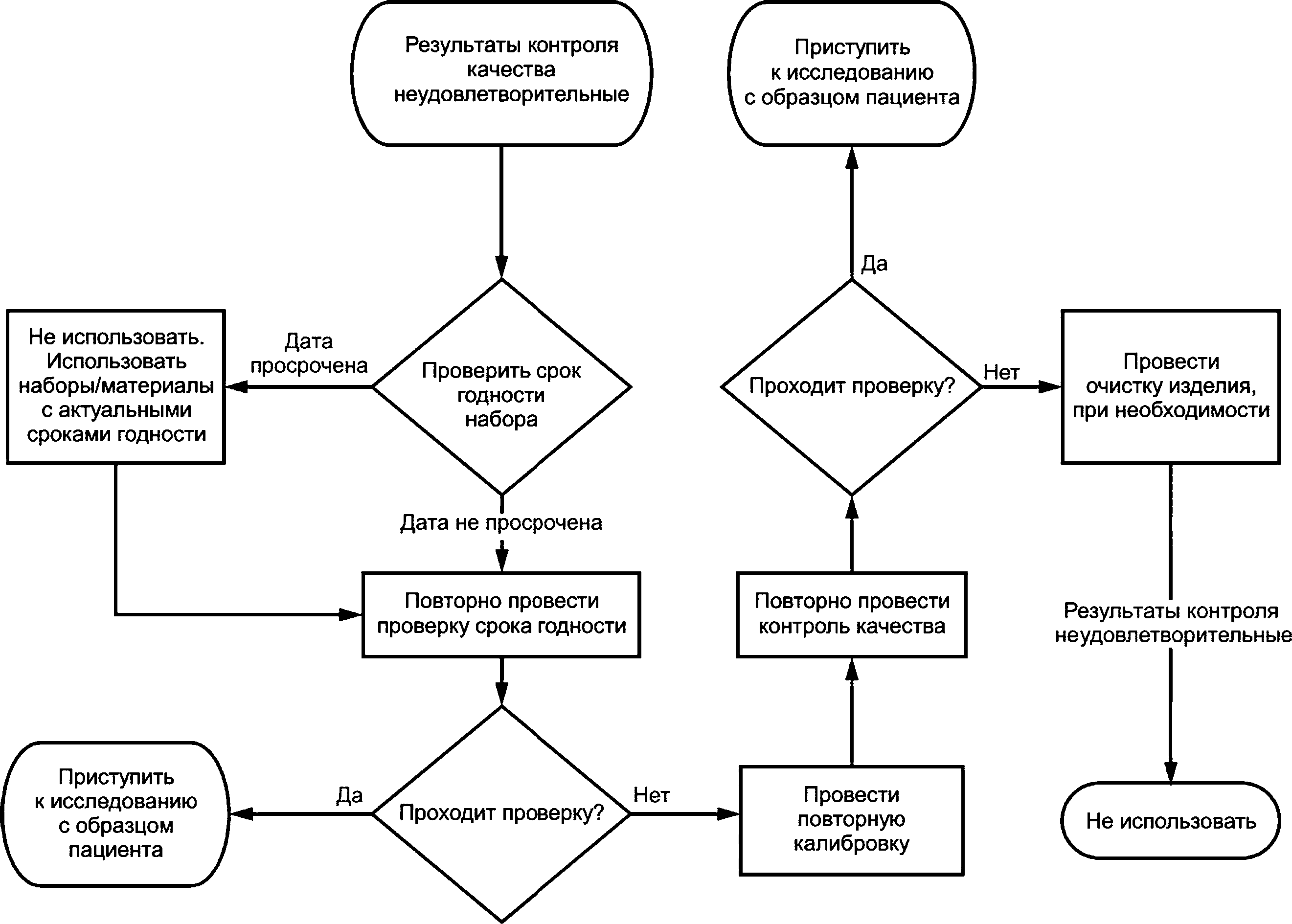
Рисунок D.1 — Блок-схема устранения нарушений при проведении ВКК
На рисунке D.1 приведена блок-схема, которая может помочь в устранении нарушений при проведении ВКК.
D.3 Внешняя оценка качества
Внешняя оценка качества (ВОК) (или обмен образцами) отличается от ВКК тем, что поставщик услуг ИМНП анализирует образцы с неизвестными значениями, предоставленные из внешних источников. Как правило, процедура ВОК подтверждает правильность выполнения исследований поставщиком услуг ИМНП путем проверки способности пользователя получить достоверный результат на образце с неизвестными значениями.
ВОК следует применять там, где это возможно и практично. Услуга по проведению ВОК обычно предоставляется третьей стороной, что позволяет проводить независимую оценку и предлагает возможности для обучения и совершенствования. Советы специалистов медицинской лаборатории, полученные в рамках ВОК, являются ценными и полезными. Во многих странах процедура ВОК широко распространена и легкодоступна, и, следовательно, участие в программах ВОК целесообразно. В некоторых странах процедура ВОК может быть недоступна для исследований или изделий, применяемых поставщиком услуг ИМНП, или участие в ВОК может оказаться невозможным.
Руководители могут подать заявку на участие в программах ВОК, заявленных как программы оценки качества (ПОК), которые периодически предоставляют задачи (образцы с неизвестными значениями) для исследования как образцы пациентов. Программа ВОК является программой проверки квалификации. Провайдер информирует участников ВОК о результатах проверки квалификации. Многие программы ВОК предлагают модули ИМНП. Это предпочтительный вариант, но в некоторых случаях он может быть недоступен или нерентабелен.
Если поставщик услуг ИМНП не может участвовать в ВОК через внешнего поставщика (провайдера), обмен образцами с другими участниками исследования, использующими аналогичные методы исследования для сравнения полученных результатов, также может дать представление о том, насколько четко выполняется исследование. Обмен образцами включает обращение образцов на различных этапах ИМНП. Образцы могут быть объединенными образцами и, как правило, не предоставляются провайдером ВОК. Стабильность объединенных образцов должна быть подтверждена, поскольку такие образцы могут реагировать не так, как стабильные образцы.
Если результаты исследования, проведенные с применением конкретного изделия, являются воспроизводимыми, то результат ВОК является приемлемым.
Приложение Е (справочное)
Предотвращение внутрибольничных заражений (биобезопасность)
Е.1 Средства индивидуальной защиты
Средства индивидуальной защиты (СИЗ) должны быть доступны для лиц, собирающих и обрабатывающих образцы. СИЗ должны соответствовать уровню риска; к основным СИЗ относят лабораторные халаты и перчатки. При необходимости должны быть доступны гипоаллергенные СИЗ, например нелатексные перчатки.
Защитную одежду следует менять через соответствующие промежутки времени, чтобы обеспечить чистоту, и немедленно поменять, если она загрязнена опасными материалами.
Примечание — Опасные материалы могут включать химическое загрязнение, однако для ИМНП опасными материалами, скорее всего, являются биологические жидкости, такие как жидкости организма пациента, представляющие риск заражения.
Специальные защитные очки, лицевые щитки или другие средства защиты глаз и лица должны быть доступны и надеваться, если существует вероятность разбрызгивания образцов, а также при обращении с опасными материалами. Дополнительную защиту глаз следует обеспечивать и при наличии контактных линз, так как они не обеспечивают защиту от брызг.
Е.2 Гигиена рук
Гигиена рук, как минимум, должна быть выполнена до и после контакта с пациентом, между пациентами, а также после снятия перчаток. В тех случаях, когда руки выглядят или ощущаются грязными, их необходимо вымыть водой с мылом. В другое время должно быть приемлемым использование дезинфицирующих средств для рук на спиртовой основе.
Пункты гигиены рук (включая дезинфицирующие средства для рук на спиртовой основе) должны быть легко доступны.
Примечание — Дезинфицирующие средства на спиртовой основе неэффективны против некоторых вирусов гастроэнтерита, таких как норовирус, а также бактерий Clostridium difficile, являющейся основной причиной инфекций, приобретенных в медицинских учреждениях. Пациентам с подозрением на наличие этих заболеваний необходимы другие соответствующие средства дезинфекции, такие как мыло и вода.
Если у пациента или персонала есть аллергия на дезинфицирующие средства на спиртовой основе, следует рассмотреть альтернативу, такую как средства на основе хлоргексидина.
Раковины для мытья рук не должны использоваться для утилизации образцов.
Е.З Требования к персоналу
Персоналу следует избегать ношения искусственных ногтей, колец и незакрепленных украшений. Натуральные ногти должны быть короткими, чтобы предотвратить разрыв перчаток. Длинные волосы должны быть закреплены сзади.
Следует носить СИЗ, соответствующие поставленной задаче; такие изделия, как перчатки, халаты и маски, должны надлежащим образом подходить персоналу.
Перчатки следует менять между каждым взятием образцов у пациента.
Е.4 Безопасная утилизация
Одноразовое устройство для взятия образцов следует использовать один раз и утилизировать после применения.
Предполагается, что процедуры утилизации отходов разрабатывают в соответствии с законодательными и нормативными требованиями.
Следует использовать безопасные одноразовые устройства, такие как иглы со встроенными предохранительными устройствами. Острые предметы необходимо утилизировать непосредственно после использования в контейнерах, устойчивых к проколам.
Общепринятым подходом к разделению медицинских отходов является система из трех контейнеров, в которой предусмотрены отдельные контейнеры для инфекционных отходов, использованных острых предметов и обычных отходов.
Биологически опасные отходы следует утилизировать в специально предназначенных контейнерах с соответствующими символами биологической опасности. Предполагается, что процедуры утилизации отходов разрабатывают в соответствии с нормативными требованиями.
Е.5 Защита пациентов
При взятии образцов следует использовать стерильные одноразовые расходные материалы.
Жгуты должны быть без латекса или накладываться поверх одежды.
Жгуты следует очищать между использованиями, когда одноразовое применение устройства невозможно.
Одноразовые хирургические маски могут быть предоставлены пациентам, когда респираторные микроорганизмы распространены в общественной среде, чтобы уменьшить потенциальное заражение инфекциями через дыхательные пути, включая сезонные вспышки гриппа или подъем заболеваемости другими инфекциями, передаваемыми воздушно-капельным путем.
Е.6 Очистка и дезинфекция
Изделия ИМНП следует очищать с помощью рекомендованных производителем чистящих средств.
Примечание — Производители часто рекомендуют или требуют использование определенных средств для очистки своего изделия. Лотки или тележки, используемые для хранения запасов, должны быть изготовлены из тех материалов, которые можно чистить и дезинфицировать.
Для того чтобы свести к минимуму риск загрязнения в помещениях, предназначенных для взятия образцов, необходимо проводить очистку следующим образом:
а) стулья, кровати и горизонтальные поверхности в зонах взятия образцов (столы, прилавки, полы и т. д.) следует очищать не реже одного раза в день, а также в случае загрязнения поверхностей;
Ь) зоны ожидания пациентов очищают не реже одного раза в день и чаще в зависимости от использования;
с) поверхности, которые соприкасаются с пациентами (поручни или поверхности кровати, подлокотники), очищают не реже одного раза в день и между пациентами при загрязнении;
d) туалеты и дверные ручки чистят ежедневно или чаще, в зависимости от использования и непосредственно после использования пациентом с подозрением на инфекционный энтерит;
е) игрушки и любые другие предметы, предназначенные для детей, очищают не реже одного раза в день.
Следует убедиться в том, что дезинфицирующее средство обладает бактерицидным, вирулицидным и тубер-кулоцидным действием.
Наиболее часто используемыми дезинфицирующими средствами являются этиловый или изопропиловый спирт (70 % — 85 %), соединения хлора (0,01 % — 5 %) или соединения четвертичного аммония (0,1 % — 2 %). Во всех случаях следует руководствоваться инструкциями производителя.
Е.7 Особые меры предосторожности
Должны быть доступны процедуры для взятия образцов у пациентов, нуждающихся в особых мерах предосторожности, таких как пациенты с ослабленным иммунитетом (ВИЧ-инфекция, лечение рака) или пациенты, иным образом нуждающиеся в изоляции (например, вирус Эбола).
Библиография
[1] Eurachem, 1998
[2] ISO 15189:2012
[3] ISO 22870:2016
[4] ISO/TS 20658:2017
[5] ISO 27799:2016
[6] ISO 27799
[7] ISO 35001
Medical laboratories — Requirements for quality and competence
Point-of-care testing (РОСТ) — Requirements for quality and competence
Medical laboratories — Requirements for collection, transport, receipt, and handling of samples
Health informatics — Information security management in health using ISO/IEC 27002
Health informatics — Information security management in health using ISO/IEC 27002
Biorisk management for laboratories and other related organisations
УДК 57.085.2:006.354
ОКС 11.100.01
03.100.30
Ключевые слова: правила для руководителей, пользователи, медицинские изделия, исследования по месту нахождения пациента, ИМНП
Редактор Л. С. Зимилова Технический редактор И.Е. Черепкова Корректор С.В. Смирнова Компьютерная верстка М.В. Малеевой
Сдано в набор 21.07.2023. Подписано в печать 31.07.2023. Формат 60x84%. Гарнитура Ариал. Усл. печ. л. 4,18. Уч.-изд. л. 3,76.
Подготовлено на основе электронной версии, предоставленной разработчиком стандарта
Создано в единичном исполнении в ФГБУ «Институт стандартизации» , 117418 Москва, Нахимовский пр-т, д. 31, к. 2.
1
Для целей настоящего стандарта термин «изделие» соответствует термину «медицинское изделие» в соответствии с Федеральным законом от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
2
В Российской Федерации регулирующим органом по регистрации медицинских изделий является Федеральная служба по надзору в сфере здравоохранения.

