ГОСТ Р 54518-2011
Группа Н09
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ПРОДУКТЫ ПИЩЕВЫЕ, КОРМА, ПРОДОВОЛЬСТВЕННОЕ СЫРЬЕ
Метод определения содержания кокцидиостатиков с помощью высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектором
Food products, feeds, food raw materials. Method for determination of the coccidiastats content by high performance liquid chromatography-mass spectrometry (HPLC-MS)
ОКС 67.040
65.120
ОКСТУ 9109,
9209,
9709
Дата введения 2013-01-01
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. N 184-ФЗ "О техническом регулировании", а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 "Стандартизация в Российской Федерации. Основные положения"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ"), Федеральным государственным бюджетным учреждением "Центральная научно-методическая ветеринарная лаборатория" (ФГБУ "ЦНМВЛ")
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 335 "Методы испытаний агропромышленной продукции на безопасность"
3 УТВЕРЖДЕН Приказом Федерального агентства по техническому регулированию и метрологии от 23 ноября 2011 г. N 588-ст
4 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНЫ: поправка, опубликованная в ИУС N 6, 2017 год; поправка, опубликованная в ИУС N 10, 2018 год; поправка, опубликованная в ИУС N 12, 2019 год
Поправки внесены изготовителем базы данных
1 Область применения
1 Область применения
Настоящий стандарт распространяется на пищевые продукты в части молока, яиц, яичного порошка, яичного меланжа, мяса и мясных продуктов, мяса и субпродуктов птицы, рыбы, а также комбикорма и продовольственное сырье и устанавливает метод высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием (далее по тексту - ВЭЖХ-МС/МС) для определения содержания кокцидиостатиков.
Диапазон измерений от 1,0 до 1000,0 мкг/кг.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р 12.1.019-2009 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты
ГОСТ Р ИСО 5725-6-2002 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике
ГОСТ Р 51447-99 (ИСО 3100-1-91) Мясо и мясные продукты. Методы отбора проб
ГОСТ Р 51652-2000 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ Р 52121-2003 Яйца куриные пищевые. Технические условия
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 53597-2009 Мясо птицы, субпродукты и полуфабрикаты из мяса птицы. Методы отбора проб и подготовка их к испытаниям
ГОСТ Р 53669-2009 Пищевые продукты переработки яиц сельскохозяйственной птицы. Методы отбора проб и органолептического анализа
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности
ГОСТ 12.1.018-93 Система стандартов безопасности труда. Пожаровзрывобезопасность статического электричества. Общие требования
ГОСТ 12.2.085-2002 Сосуды, работающие под давлением. Клапаны предохранительные. Требования безопасности
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 5848-73 Реактивы. Кислота муравьиная. Технические условия
ГОСТ 13496.0-80* Комбикорма, сырье. Методы отбора проб
________________
* На территории Российской Федерации документ не действует. Действует ГОСТ Р ИСО 6497-2011, здесь и далее по тексту. - .
ГОСТ 13867-68 Продукты химические. Обозначение чистоты
ГОСТ 22300-76 Реактивы. Эфиры этиловый и бутиловый уксусной кислоты. Технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 26809-86 Молоко и молочные продукты. Правила приемки, методы отбора и подготовка проб к анализу
ГОСТ 29227-91 (ИСО 835-1-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 29245-91 Консервы молочные. Методы определения физических и органолептических показателей
ГОСТ 31339-2006 Рыба, нерыбные объекты и продукция из них. Правила приемки и методы отбора проб
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
(Поправка. ИУС N 10-2018).
3 Сущность метода
3.1 Определение содержания кокцидиостатиков в анализируемой пробе проводят методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием.
3.2 Количественное определение кокцидиостатиков проводят методом внутреннего стандарта по площади пика идентифицированных соединений с помощью градуировочной характеристики, полученной при анализе градуировочных растворов известных соединений в аналогичных условиях.
3.3 Детектирование анализируемых проб проводят в режиме регистрации выбранных реакций.
4 Условия выполнения измерений и требования безопасности
4.1 При определении содержания кокцидиостатиков должны быть соблюдены следующие условия:
- температура окружающего воздуха | от 15 °С до 30 °С; |
- атмосферное давление | от 84 до 106 кПа; |
- относительная влажность воздуха | от 20% до 80%. |
(Поправка. ИУС N 6-2017).
4.2 Применяемые в работе реактивы относятся к веществам 1-го и 2-го класса опасности по ГОСТ 12.1.007, при работе с ними необходимо соблюдать требования безопасности, установленные для работ с токсичными, едкими и легковоспламеняющимися веществами по ГОСТ 12.1.005.
4.3 Помещения, в которых проводится анализ и подготовка проб, должны быть оборудованы приточно-вытяжной вентиляцией.
4.4 Приготовление градуировочных растворов проводят под тягой в вытяжном шкафу.
4.5 При проведении испытаний соблюдают требования ГОСТ 12.2.085 и [1].
4.6 При выполнении измерений на хромато-масс-спектрометре следует соблюдать правила электробезопасности в соответствии с ГОСТ Р 12.1.019, пожаровзрывобезопасности по ГОСТ 12.1.018 и инструкции по эксплуатации прибора.
4.7 К выполнению измерений методом высокоэффективной жидкостной хроматографии с масс-спектрометрическим детектированием допускаются лица, владеющие техникой ВЭЖХ-МС/МС и изучившие инструкции по эксплуатации применяемой аппаратуры.
5 Средства измерений, вспомогательное оборудование, посуда, материалы и реактивы
5.1 Для определения содержания кокцидиостатиков применяют следующие средства измерений, вспомогательное оборудование и материалы:
- масс-спектрометр с диапазоном измерений от 50 до 1000 атомных единиц массы (а.е.м.), массовым разрешением не менее 1000, точностью измерения массы не ниже 0,2 а.е.м., с режимом получения и анализа фрагментных ионов (режим МС/МС);
- систему высокоэффективную жидкостную хроматографическую, состоящую из бинарного насоса со смесителем, термостата хроматографической колонки, обеспечивающего температуру нагрева до 50 °С;
- колонку хроматографическую обращенно-фазную длиной не менее 150 мм с диаметром частиц сорбента не более 3,5 мкм;
- компьютер с установленным программным обеспечением для управления масс-спектрометром и обработки результатов измерений;
- весы I класса точности по ГОСТ Р 53228 с действительной ценой деления шкалы не более 0,1 мг;
- модуль термостатируемый нагревательный с системой отдувки растворителей инертным газом и максимальной температурой термостатирования 40 °С;
- измельчитель-гомогенизатор лабораторный;
- встряхиватель (шейкер) вибрационный для пробирок орбитального типа движения с амплитудой встряхивания 3 мм и диапазоном скоростей от 150 до 2500 об/мин;
- центрифугу лабораторную рефрижераторную со скоростью вращения ротора не менее 10000 об/с и диапазоном температур охлаждения от 4 °С до 20 °С, с адаптерами для пробирок вместимостью 15 см и микроцентрифужных пробирок вместимостью 1,5 см
;
- баню ультразвуковую с рабочей частотой не менее 20 Гц и объемом не менее 1 дм;
- устройство вакуумное для твердофазной экстракции;
- картридж для твердофазной экстракции объемом не менее 12 см, заполненный обращенно-фазным сорбентом диаметром частиц не более 50 мкм;
- пипетки одноканальные переменной вместимости 2,5-10,0 мм, 5-25 мм
, 20-100 мм
, 200-1000 мм
с допустимой относительной погрешностью дозирования по метанолу и ацетонитрилу не более 1%;
- виалы (флаконы) полипропиленовые вместимостью 15 см с герметично закрывающимися пластмассовыми крышками;
- виалы (флаконы) стеклянные вместимостью 2 см с завинчивающимися крышками и тефлоновыми прокладками 9 мм;
- пробирки полипропиленовые микроцентрифужные вместимостью 1,5 см;
- фильтры мембранные диаметром пор не более 0,2 мкм;
- пробирки мерные стеклянные П-2-10-14/23 по ГОСТ 1770;
- колбы конические Кн-1-250-14/23 ТС по ГОСТ 25336;
- пипетки стеклянные градуированные по ГОСТ 29227;
- колбы мерные стеклянные 1-100-2 по ГОСТ 1770;
- цилиндры мерные стеклянные 1-25(100, 500)-1 по ГОСТ 1770;
- холодильник бытовой с цифровым контроллером температуры и рабочим диапазоном температур от 0 °С до 5 °С;
- камеру лабораторную морозильную с цифровым контроллером температуры и рабочим диапазоном температур от минус 30 °С до минус 40 °С.
(Поправка. ИУС N 12-2019).
5.2 При определении содержания кокцидиостатиков применяют следующие реактивы:
- этилацетат по ГОСТ 22300, х.ч.;
- ацетон по ГОСТ 2603;
- кислоту муравьиную по ГОСТ 5848, ч.д.а.;
- воду деионизованную;
- метанол, х.ч.;
- спирт этиловый ректификованный пищевой 96%-ный по ГОСТ Р 51652;
- ацетонитрил, ч.д.а.;
- формиат аммония с содержанием основного вещества не менее 99,0%.
Все реактивы должны относиться к подгруппе чистоты 2 (х.ч.) или 3 (ч.д.а.) по ГОСТ 13867.
5.3 При определении содержания кокцидиостатиков применяют:
5.3.1 Стандартные образцы кокцидиостатиков:
- монензина натриевая соль с содержанием основного вещества не менее 90,0%;
- наразин с содержанием основного вещества не менее 93,5%;
- лаидломицина пропионата калиевая соль с содержанием основного вещества не менее 96,6%;
- семдурамицина натриевая соль с содержанием основного вещества не менее 96,8%;
- декоквинат с содержанием основного вещества не менее 99,6%;
- толтразурил с содержанием основного вещества не менее 99,5%;
- тинидазол с содержанием основного вещества не менее 99,0%;
- динитрокарбанилид с содержанием основного вещества не менее 97,0%;
- диклазурил с содержанием основного вещества не менее 99,6%;
- толтразурила сульфон с содержанием основного вещества не менее 99,7%;
- галофугинона бромгидрат с содержанием основного вещества не менее 99,6%;
- этопабат с содержанием основного вещества не менее 99,5%;
- арприноцид с содержанием основного вещества не менее 99,0%;
- тернидазол с содержанием основного вещества не менее 99,0%;
- ронидазол с содержанием основного вещества не менее 100,0%;
- клопидол с содержанием основного вещества не менее 98,6%;
- никарбазин с содержанием основного вещества не менее 98,2%;
- ампролиума гидрохлорид с содержанием основного вещества не менее 99,0%;
- ласалоцида натриевая соль с содержанием основного вещества не менее 98,0%;
- мадурамицина аммоний с содержанием основного вещества не менее 90,0%;
- робенидина гидрохлорид с содержанием основного вещества не менее 96,0%;
- салиномицина натриевая соль с содержанием основного вещества не менее 98,0%.
5.3.2 Внутренние стандарты кокцидиостатиков:
- ронидазол-D3 с содержанием основного вещества не менее 99,2%;
- динитрокарбанилид-08 с содержанием основного вещества не менее 99,0%;
- иономицина СА-соль с содержанием основного вещества не менее 99,0%.
5.4 Допускается применение других средств измерений, вспомогательного оборудования, не уступающих вышеуказанным по метрологическим и техническим характеристикам и обеспечивающим необходимую точность измерения, а также реактивов и материалов, по качеству не хуже вышеуказанных.
6 Подготовка к проведению измерений
6.1 Подготовка лабораторной посуды и реактивов
6.1.1 Мойку и сушку посуды проводят в отдельном помещении, оборудованном приточно-вытяжной вентиляцией. Не допускается проведение подготовки посуды в данном помещении для других видов анализов. Для сушки лабораторной посуды и подготовки реактивов необходимо использовать отдельные сушильные шкафы.
6.1.2 Стеклянную посуду подвергают стандартной процедуре очистки лабораторной посуды с последующей последовательной промывкой органическими растворителями: этилацетатом (однократно), ацетоном (дважды).
6.1.3 Процедуру промывки органическими растворителями следует проводить в вытяжном шкафу. Рекомендуется на стадиях промывки использовать ультразвуковую баню. Окончательную сушку посуды проводят в сушильном шкафу, установленном в вытяжном шкафу, при температуре от 105 °С до 110°С.
6.1.4 Каждую новую партию реактивов проверяют на отсутствие контаминации анализируемыми соединениями путем проведения холостого опыта в соответствии с процедурой анализа.
6.2 Приготовление растворов
6.2.1 Приготовление растворов элюентов мобильной фазы А и Б
6.2.1.1 Для приготовления раствора элюента мобильной фазы А в мерную колбу вместимостью 1000 см приливают 475 см
деионизованной воды, 250 см
метанола и 275 см
ацетонитрила, добавляют 0,5 г формиата аммония и 5,0 см
муравьиной кислоты. Полученный раствор дегазируют на ультразвуковой бане в течение 5 мин.
Срок хранения при комнатной температуре - не более 1 мес.
6.2.1.2 Для приготовления раствора элюента мобильной фазы Б в мерную колбу вместимостью 1000 см приливают 475 см
метанола и 525 см
ацетонитрила, добавляют 0,5 г формиата аммония и 0,5 см
муравьиной кислоты. Полученный раствор дегазируют на ультразвуковой бане в течение 5 мин.
Срок хранения при комнатной температуре - не более 1 мес.
6.2.2 Приготовление раствора метанола в деионизированной воде в объемном соотношении 20:80
В мерную пробирку вместимостью 10 см вносят 2 см
метанола, доводят объем до 10 см
деионизированной водой, перемешивают.
Раствор используют свежеприготовленным.
6.2.3 Приготовление раствора метанола в деионизированной воде в соотношении 50:50
В коническую колбу вместимостью 250 см мерным цилиндром отмеривают 50 см
метанола и 50 см
деионизированной воды, перемешивают.
Раствор используют свежеприготовленным.
6.3 Приготовление градуировочных растворов
6.3.1 Приготовление исходных градуировочных растворов стандартов кокцидиостатиков
Для приготовления исходных градуировочных растворов стандартов кокцидиостатиков () рассчитывают массу стандартных образцов по таблице 1 для каждого аналита исходя из содержания кокцидиостатика в стандартном образце в пересчете на действующее вещество.
Таблица 1 - Массы стандартных образцов для приготовления градуировочных растворов
Наименование кокцидиостатика | Действующее вещество | Масса стандартных образцов, мг* |
Ампролиума гидрохлорид | Ампролиум | 12,96 |
Клопидол | Клопидол | 10,00 |
Ронидазол-D3 | Ронидазол-D3 | 10,00 |
Ронидазол | Ронидазол | 10,00 |
Тернидазол | Тернидазол | 10,00 |
Тинидазол | Тинидазол | 10,00 |
Арприноцид | Арприноцид | 10,00 |
Этопабат | Этопабат | 10,00 |
Галофугинона бромгидрат | Галофугинон | 11,95 |
Динитрокарбанилид-08 | Динитрокарбанилид-D8 | 10,00 |
Динитрокарбанилид | Динитрокарбанилид | 10,00 |
Толтразурила сульфон | Толтразурил | 10,75 |
Диклазурил | Диклазурил | 10,00 |
Толтразурил | Толтразурил | 10,00 |
Робенидина гидрохлорид | Робенидин | 11,09 |
Декоквинат | Декоквинат | 10,00 |
Ласалоцида натриевая соль | Ласалоцид | 10,39 |
Семдурамицина натриевая соль | Семдурамицин | 10,25 |
Монензина натриевая соль | Монензин | 10,33 |
Лаидломицина пропионата калиевая соль | Лаидломицин | 11,35 |
Мадурамицина аммоний | Мадурамицин | 10,19 |
Салиномицина натриевая соль | Салиномицин | 10,31 |
Наразин | Наразин | 10,00 |
Иономицина кальциевая соль | Иономицин | 10,54 |
* Масса эквивалентна 10,0 мг действующего вещества с содержанием кокцидиостатика в 100%-ном стандартном образце. |
Для приготовления исходных градуировочных растворов () на микроаналитических весах берут стандартные образцы по таблице 1 для каждого кокцидиостатика и переносят по отдельности в мерные колбы вместимостью 100 см
. Добавляют 80 см
этилового спирта, перемешивают, помещают в ультразвуковую баню на 1 мин и доводят полученный раствор до метки этиловым спиртом.
Массовая концентрация каждого стандарта кокцидиостатика в растворе составляет 100 мкг/см
.
Срок хранения растворов при температуре от минус 30 °С до минус 40 °С - не более двух лет.
Перед применением растворы выдерживают при комнатной температуре втемном месте не менее 30 мин.
6.3.2 Приготовление рабочего градуировочного раствора
Для приготовления рабочего градуировочного раствора переносят 0,2 см
раствора
каждого стандарта кокцидиостатика в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.2) и перемешивают.
Массовая концентрация каждого кокцидиостатика в растворе составляет 2 мкг/см
.
(Поправка. ИУС N 12-2019).
6.3.3 Приготовление рабочего градуировочного раствора
Для приготовления рабочего градуировочного раствора переносят 5,0 см
раствора
в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.3) и перемешивают.
Массовая концентрация каждого кокцидиостатика в растворе составляет 1 мкг/см
.
6.3.4 Приготовление рабочего градуировочного раствора
Для приготовления рабочего градуировочного раствора переносят 2,0 см
раствора
в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.3) и перемешивают.
Массовая концентрация каждого кокцидиостатика в растворе составляет 0,2 мкг/см
.
6.3.5 Приготовление рабочего градуировочного раствора
Для приготовления рабочего градуировочного раствора переносят 1,0 см
раствора
в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.3) и перемешивают.
Массовая концентрация каждого кокцидиостатика в растворе составляет 0,1 мкг/см
.
6.3.6 Приготовление рабочего градуировочного раствора
Для приготовления рабочего градуировочного раствора переносят 1,0 см
раствора
в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.3) и перемешивают.
Массовая концентрация каждого кокцидиостатика в растворе составляет 0,02 мкг/см
.
Приготовленные градуировочные растворы (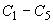 ) хранят в холодильнике при температуре от 2 °С до 4 °С - не более 4 мес.
) хранят в холодильнике при температуре от 2 °С до 4 °С - не более 4 мес.
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 20 мин.
6.3.7 Приготовление исходных градуировочных растворов внутренних стандартов кокцидиостатиков
Для приготовления исходных градуировочных растворов внутренних стандартов () рассчитывают массу стандартного образца, эквивалентную 4,0 мг действующего вещества, для каждого аналита исходя из массовой доли кокцидиостатика в стандартном образце в пересчете на действующее вещество согласно таблице 1.
На микроаналитических весах взвешивают рассчитанную массу каждого внутреннего стандарта кокцидиостатиков и переносят по отдельности в мерные колбы вместимостью 100 см. Добавляют 80 см
этилового спирта, перемешивают, помещают в ультразвуковую баню на 1 мин и доводят полученный раствор до метки этиловым спиртом.
Массовая концентрация каждого внутреннего стандарта кокцидиостатика в растворе составляет 40 мкг/см
.
Срок хранения растворов при температуре от минус 30 °С до минус 40 °С - не более двух лет.
Перед применением растворы выдерживают при комнатной температуре в темном месте не менее 30 мин.
6.3.8 Приготовление рабочего градуировочного раствора внутренних стандартов кокцидиостатиков
Для приготовления рабочего градуировочного раствора переносят по 0,1 см
растворов
(ронидазол-D3 и динитрокарбанилид-D8) и 0,5 см
раствора
(иономицин) в мерную пробирку вместимостью 10 см
, доводят до метки раствором метанол/деионизированная вода (6.2.3) и перемешивают.
Массовая концентрация ронидазола-D3 и динитрокарбанилида-D8 в растворе составляет 400 нг/см
, иономицина - 2,0 мкг/см
.
Срок хранения градуировочного раствора в холодильнике при температуре от 2 °С до 4 °С - не более 4 мес.
(Поправка. ИУС N 12-2019).
6.3.9 Приготовление градуировочных растворов 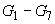 кокцидиостатиков
кокцидиостатиков
6.3.9.1 Приготовление градуировочных растворов
Для приготовления градуировочных растворов приливают по 0,2 см
раствора
(6.3.2) каждого стандарта кокцидиостатиков и по 0,02 см
раствора
(6.3.8) каждого внутреннего стандарта кокцидиостатиков к остатку после упаривания чистой пробы, полученной и проанализированной ранее в соответствии с требованиями раздела 7 (для каждого типа матриц готовят индивидуальные градуировочные растворы). Затем приливают 0,18 см
мобильной фазы А (6.2.1.1), тщательно перемешивают на шейкере, помещают на центрифугу и центрифугируют при 15000 об/мин в течение 10 мин при температуре 10 °С.
Массовая концентрация каждого кокцидиостатика в растворе составляет 1000 нг/см
.
(Поправка. ИУС N 12-2019).
6.3.9.2 Приготовление градуировочных растворов
Для приготовления градуировочных растворов приливают по 0,1 см
раствора
(6.3.2) каждого стандарта кокцидиостатиков и по 0,02 см
раствора
(6.3.8) каждого внутреннего стандарта кокцидиостатиков к остатку после упаривания чистой пробы. Затем приливают 0,28 см
мобильной фазы А (6.2.1.1), тщательно перемешивают на шейкере, помещают на центрифугу и центрифугируют при 15000 об/мин в течение 10 мин при температуре 10 °С.
Массовая концентрация каждого кокцидиостатика в растворе составляет 500 нг/см
.
6.3.9.3 Приготовление градуировочных растворов
Для приготовления градуировочных растворов приливают по 0,05 см
раствора
(6.3.2) каждого стандарта кокцидиостатиков и по 0,05 см
раствора
(6.3.8) каждого внутреннего стандарта кокцидиостатиков к остатку после упаривания чистой пробы. Затем приливают 0,9 см
мобильной фазы А (6.2.1.1), тщательно перемешивают на шейкере, помещают на центрифугу и центрифугируют при 15000 об/мин в течение 10 мин при температуре 10 °С.
Массовая концентрация каждого кокцидиостатика в растворе составляет 100 нг/см
.
6.3.9.4 Приготовление градуировочных растворов 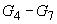
Растворы 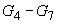 готовят как раствор
готовят как раствор по 6.3.9.3:
для приготовления раствора приливают 0,05 см
раствора
(6.3.3) и 0,05 см
раствора
(6.3.8);
для приготовления раствора приливают 0,05 см
раствора
(6.3.4) и 0,05 см
раствора
(6.3.8);
для приготовления раствора приливают 0,05 см
раствора
(6.3.5) и 0,05 см
раствора
(6.3.8);
для приготовления раствора приливают 0,05 см
раствора
(6.3.6) и 0,05 см
раствора
(6.3.8).
Массовая концентрация каждого кокцидиостатика в растворе составляет 50 нг/см
, в растворе
- 10 нг/см
, в растворе
- 5 нг/см
, в растворе
- 1 нг/см
.
Градуировочные растворы 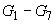 хранят в холодильнике при температуре от 10 °С до 12 °С - не более семи дней.
хранят в холодильнике при температуре от 10 °С до 12 °С - не более семи дней.
6.4 Построение градуировочной характеристики
6.4.1 Градуировочную характеристику строят при помощи матричной градуировки. Для этого проводят обработку заведомо "чистых" проб, приготовленных и проанализированных ранее, не содержащих кокцидиостатиков, в соответствии с требованиями раздела 7, в зависимости от типа исследуемой матрицы.
6.4.2 Для получения градуировочных данных используют не менее трех уровней концентраций матричных градуировочных растворов. Определяемые в анализируемом образце массовые концентрации кокцидиостатиков должны находиться в диапазоне концентраций градуировочной характеристики.
6.4.3 При установлении градуировочной характеристики в инжектор хроматографа вводят по 10 мм и не менее двух раз матричные градуировочные растворы
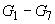 (6.3.9) различных уровней концентраций в условиях, указанных в 6.5.
(6.3.9) различных уровней концентраций в условиях, указанных в 6.5.
6.4.4 Для проверки приемлемости результатов измерений рассчитывают значение относительной повторяемости , %, параллельных определений для каждого градуировочного образца - разности между результатами параллельных определений, отнесенные к их среднему значению, по формуле
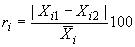 , (1)
, (1)
где и
- параллельные определения при получении
-го результата количественного химического анализа;
- среднеарифметическое значение
и
(
-й результат анализа).
Значения (
1, 2, ..) не должны превышать пределов повторяемости
, установленных для
0,95 и приведенных в таблице 2.
Таблица 2 - Пределы относительной повторяемости для выбранных диапазонов измерений
Диапазон измерений содержания кокцидиостатиков | Предел повторяемости | |||||
От | 1,0 | до | 10,0 | включ. | 25 | |
" | 10,0 | " | 100,0 | " | 15 | |
Св. | 100,0 | " | 1000,0 | " | 20 |
(Поправка. ИУС N 12-2019).
6.4.5 При помощи компьютерной системы обработки данных строят градуировочную характеристику концентрации от площади пика аналита методом внутреннего стандарта. При построении градуировочной зависимости используют квадратическую функцию.
6.4.6 Вычисление площади пика проводят для каждого дочернего иона анализируемых соединений. Допускается проведение количественных измерений по одному, наиболее интенсивному, дочернему иону. Для подтверждения наличия кокцидиостатиков рассчитывают отношения площади пика двух дочерних ионов для каждого соединения в градуировочном растворе.
6.4.7 При построении градуировочной характеристики в качестве внутреннего стандарта для кокцидиостатиков ампролиум, арприноцид, клопидол, лаидломицин, мадурамицин, монензин, ронидазол, салиномицин, семдурамицин, тернидазол, тинидазол, этопабат, толтразурил, толтразурила сульфон и диклазурил в качестве внутреннего стандарта используют ронидазол-D3, для кокцидиостатиков галофугинон, декоквинат, ласалоцид, наразин и робенедин в качестве внутреннего стандарта используют иономицин, для динитрокарбанилида (никарбазина) используют динитрокарбанилид-D8. Расчеты коэффициентов градуировочной характеристики выполняются системой обработки данных в автоматическом режиме.
6.4.8 Время удерживания аналитов определяют при анализе градуировочных растворов. Значения абсолютного времени удерживания анализируемых соединений в предложенных хроматографических условиях приведены в таблице 3.
Таблица 3 - Параметры воздействия на ионы в режиме MRM и условиях электрораспыления с регистрацией положительных или отрицательных (-) ионов
Наименование аналита | Время удерживания, мин | Ион предшест- венник, Q1, m/z | Дочерние ионы, Q3, m/z | Потенциал декласте- | Энергия соударений, (СЕ), эВ | Ускоряющее напряжение, (СХР), В |
Ампролиум | 0,9 | 243,2 | 150,1/94 | 44 | 18/17 | 14/8 |
Клопидол | 1,0 | 192,0 | 101,0/86 | 85 | 41/45 | 9/7 |
Ронидазол-D3* | 1,0 | 204,1 | 143,1 | 38 | 16 | 10 |
Ронидазол | 1,0 | 201,1 | 140,1/55 | 50 | 17/40 | 10/5 |
Тернидазол | 1,0 | 186,2 | 128,1/82 | 52 | 22/40 | 10/10 |
Тинидазол | 1,0 | 248,2 | 121,1/93 | 70 | 24/28 | 20/13 |
Арприноцид | 1,2 | 278,1 | 143,0/10 | 86 | 40/76 | 13/18 |
Этопабат | 1,2 | 238,2 | 206,1/13 | 44 | 17/39 | 12/12 |
Галофугинон | 1,2 | 414,1 | 100,1/13 | 65 | 45/27 | 17/12 |
Динитрокарбанилид-D8* | 3,0 | 309,0 (-) | 140,9 | -64 | -20 | -10 |
Динитрокарбанилид | 3,0 | 300,9 (-) | 136,9/10 | -61 | -18/-50 | -9/-15 |
Толтразурила сульфон | 3,5 | 456,0 (-) | 456,0/42 | -80 | -11/-60 | -5/-5 |
Диклазурил | 5,5 | 405/407 | 333,8/33 | -80 | -25/-25 | -15 |
Толтразурил | 8,0 | 424,0 (-) | 424,0/41 | -75 | -10/-55 | -9/-6 |
Робенидин | 2,9 | 334,1 | 155,1/13 | 78 | 30/38 | 15/12 |
Декоквинат | 10,6 | 418,3 | 372,3/20 | 50 | 35/58 | 25/19 |
Ласалоцид | 11,5 | 613,4 | 377,2/35 | 20 | 51/50 | 25/24 |
Семдурамицин | 11,3 | 890,6 | 629,5/39 | 20 | 36/41 | 18/27 |
Монензин | 11,8 | 693,3 | 675,5/46 | 20 | 52/71 | 18/29 |
Лаидломицин | 12,4 | 777,4 | 503,3/52 | 20 | 75/79 | 33/34 |
Мадурамицин | 12,5 | 934,5 | 629,5/64 | 20 | 36/29 | 18/18 |
Салиномицин | 12,4 | 773,5 | 431,3/53 | 20 | 70/60 | 28/35 |
Наразин | 12,9 | 787,5 | 431,3/53 | 24 | 72/64 | 28/35 |
Иономицин* | 11,7 | 732,5 | 279,1 | 10 | 77 | 21 |
* Внутренний стандарт. |
Относительное отклонение времени удерживания кокцидиостатиков в анализируемых пробах от градуировочных данных не должно превышать 2,5%.
6.4.9 Контроль составляющей расширенной неопределенности, обусловленной стабильностью градуировочных характеристик, выполняется в ходе определения относительных коэффициентов отклика на соединения в градуировочной смеси (построения градуировочных характеристик) при помощи программы обработки данных. Градуировочную характеристику считают приемлемой, если рассчитанное программным обеспечением значение коэффициента корреляции (коэффициент регрессии) каждого аналита 0,98, а значения отклонения градуировки для каждой точки градуировочной характеристики находятся в диапазоне 80%-120%.
6.4.10 Контроль стабильности градуировочной характеристики проводят после анализа каждых 20 исследуемых образцов однократным измерением двух градуировочных растворов и
. Градуировочная характеристика считается стабильной, если рассчитанные значения отклонения градуировки для аналитов градуировочных растворов
и
находятся в диапазоне 75%-125%. В противном случае проводят повторный анализ градуировочных растворов, построение градуировочной характеристики и анализ испытуемых проб.
6.5 Условия хроматографических измерений
6.5.1 Хромато-масс-спектрометр включают в соответствии с руководством (инструкцией) по эксплуатации и устанавливают параметры, рекомендуемые изготовителем капиллярных колонок. Например, для колонки применяют следующие хроматографические условия:
- температура колонки - 50 °С;
- скорость потока подвижной фазы - 0,15 см/мин;
- объем вводимой пробы - 10 мм.
Разделение проводят в режиме градиентного элюирования (приготовление растворов элюентов - в соответствии с 6.2.1): в начальный момент и до 2,0 мин элюирование в 100%-ной мобильной фазе А, с 2,0 по 4,0 мин градиентное элюирование к 100%-ной мобильной фазе Б, с 4,0 по 18,0 мин элюирование в 100%-ной мобильной фазе Б, с 18,0 по 18,10 мин переход к элюированию в 100%-ной мобильной фазе А, с 18,10 по 28,0 мин уравновешивание колонки в 100%-ной мобильной фазе А.
Параметры метода воздействия на ионы в режиме мониторинга нескольких реакций (MRM) приведены в таблице 3.
7 Отбор и подготовка проб
7.1 Отбор проб
7.1.1 Отбор проб мяса и мясных продуктов - по ГОСТ Р 51447.
7.1.2 Отбор проб мяса птицы, пищевых субпродуктов и полуфабрикатов из мяса птицы - по ГОСТ Р 53597.
7.1.3 Отбор проб молока - по ГОСТ 26809.
7.1.4 Отбор проб яиц, яичного меланжа и яичного порошка - по ГОСТ Р 52121 и ГОСТ Р 53669.
7.1.5 Отбор проб рыбы - по ГОСТ 31339.
7.1.6 Отбор проб комбикормов - по ГОСТ 13496.0.
7.2 Подготовка проб
7.2.1 Подготовка проб мяса, мясных продуктов, мяса и субпродуктов птицы, рыбы
Мышечную ткань предварительно очищают от грубой соединительной ткани. 100 г пробы измельчают на гомогенизаторе и взвешивают в полипропиленовой пробирке по 1,0 г гомогенизированной ткани. Пипеточным дозатором в пробирку вносят 0,05 см раствора внутренних стандартов
(6.3.8). Осторожно приливают 3 см
ацетонитрила и помещают пробирку на 15 мин в шейкер для экстракции. Затем центрифугируют при 4000 об/мин в течение 15 мин при температуре 10 °С. Сливают органический слой в новую полипропиленовую пробирку, помещают ее на нагревательный модуль и упаривают в токе воздуха при температуре 60 °С до 0,1-0,2 см
. К остатку приливают 2 см
деионизованной воды, перемешивают в шейкере 5 с и центрифугируют при 4000 об/мин в течение 10 мин при температуре 20 °С. Полученный экстракт очищают методом твердофазной экстракции (ТФЭ). Перед нанесением экстракта на картридж последовательно кондиционируют сорбент 2 см
метанола и 2 см
деионизированной воды. Затем пропускают через картридж полученный экстракт (при процедуре очищения вакуум или избыточное давление не применяют). Промывают картридж 2 см
деионизованной воды, сушат в вакууме водоструйного насоса в течение 10 мин и элюируют аналиты 2 см
метанола в новую полипропиленовую пробирку. Элюат помещают на нагревательный модуль и упаривают в токе воздуха при температуре 60 °С до 0,05-0,1 см
. К полученному остатку приливают 0,9 см
раствора мобильной фазы А (6.2.1.1) и тщательно перемешивают, переливают экстракт в центрифужную полипропиленовую пробирку вместимостью 1,5 см
и центрифугируют при 15000 об/мин в течение 10 мин при температуре 20 °С. Пипеточным дозатором переносят центрифугат в виалу для автосамплера жидкостного хроматографа. Полученный раствор используют для ВЭЖХ-МС/МС анализа.
7.2.2 Подготовка проб яичного порошка
Отобранную пробу яичного порошка перед анализом тщательно перемешивают и взвешивают 1,0 г в полипропиленовой пробирке. Пипеточным дозатором в пробирку вносят 0,05 см раствора внутренних стандартов
(6.3.8). Далее обработку пробы и подготовку к хроматографированию проводят по 7.2.1.
7.2.3 Обработка проб яиц и меланжа
Яйца отделяют от скорлупы и перемешивают на гомогенизаторе, меланж тщательно перемешивают. Взвешивают 1,0 г гомогенизированной пробы в полипропиленовой пробирке. Пипеточным дозатором в пробирку вносят 0,05 см раствора внутренних стандартов
(6.3.8). Далее обработку проб и подготовку к хроматографированию проводят по 7.2.1.
7.2.4 Подготовка проб молока
Отобранную пробу перед анализом тщательно перемешивают.
Взвешивают 1,0 г гомогенизированной пробы в полипропиленовой пробирке. Пипеточным дозатором в пробирку вносят 0,05 см раствора внутренних стандартов
(6.3.8). Далее обработку проб и подготовку к хроматографированию проводят по 7.2.1. Сухие молочные продукты восстанавливают по ГОСТ 29245 (пункт 3.4).
(Поправка. ИУС N 10-2018).
7.2.5 Подготовка проб комбикормов
Отобранную пробу комбикорма измельчают на гомогенизаторе. Взвешивают 1,0 г гомогенизированной пробы в полипропиленовой пробирке. Пипеточным дозатором в пробирку вносят 0,05 см раствора внутренних стандартов
(6.3.8). Осторожно приливают 10 см
ацетонитрила, 1 см
деионизованной воды и помещают пробирку на 15 мин в шейкер для экстракции. Далее обработку пробы и подготовку к хроматографированию проводят по 7.2.1.
При концентрации кокцидиостатиков в комбикорме свыше 1000 мкг/кг, ацетонитрильные экстракты (без этапа ТФЭ) непосредственно разводят мобильной фазой А (6.2.1.1) в 100 и более раз, фильтруют через мембранный фильтр в виалу и используют для ВЭЖХ-МС/МС анализа.
8 Порядок выполнения измерений
8.1 Для определения содержания кокцидиостатиков проводят ВЭЖХ-МС/МС анализ в условиях, указанных в 6.5.
8.2 ВЭЖХ-МС/МС анализ должен выполняться в виде серии измерений, включающей следующие образцы:
- образец мобильной фазы А;
- образец, полученный в условиях подготовки проб, где вместо матрицы использовалось 0,5 г деионизованной воды;
- образец, не содержащий кокцидиостатиков, приготовленный и проанализированный ранее в соответствии с требованиями раздела 7, в зависимости от типа исследуемой матрицы;
- образец с аттестованным содержанием кокцидиостатика;
- градуировочные растворы;
- анализируемые пробы;
- образцы контроля стабильности градуировки.
Результаты измерений округляют до целого значения и выражают в микрограммах на килограмм (мкг/кг).
Если массовая доля кокцидиостатика в анализируемой пробе превышает значение максимального градуировочного уровня, то анализируемую пробу разводят в 10 или более раз подвижной фазой А и проводят повторные измерения
8.3 Время удерживания кокцидиостатиков определяют при анализе градуировочных растворов.
8.4 При анализе каждой партии проб проводят обработку чистой пробы в соответствии с 7.2 в зависимости от типа исследуемой матрицы. Наличие пиков, значения времени удерживания которых совпадают со значениями времени удерживания пиков определяемых компонентов, указывает на наличие контаминации анализируемых проб при их подготовке.
9 Обработка результатов ВЭЖХ-МС/МС анализа
9.1 В соответствии с данными, полученными при анализе градуировочных растворов, проводят количественную обработку хроматограмм с использованием программного обеспечения. Метод обработки хроматограмм - внутренний стандарт.
9.2 Расчеты содержания кокцидиостатика и площади пика выполняются системой обработки данных в автоматическом режиме.
9.3 Вычисление площади пика проводят на двух дочерних ионах (согласно таблице 3) для каждого кокцидиостатика. Отклонения относительных ионных интенсивностей ионов в анализируемой пробе от относительных ионных интенсивностей ионов, полученных при анализе градуировочных растворов, не должны превышать значений, указанных в таблице 4.
Таблица 4 - Допустимые отклонения относительных ионных интенсивностей
Относительная ионная интенсивность (% от основного пика) | Максимально допустимые отклонения для ВЭЖХ-МС/МС детектирования, % | |||||
Св. | 50 | ±20 | ||||
" | 20 | до | 50 | включ. | ±25 | |
" | 10 | " | 20 | " | ±30 | |
менее | 10 | " | ±50 |
9.4 За окончательный результат измерений содержания кокцидиостатиков принимают среднеарифметическое значение результатов двух параллельных определений, выполненных в условиях повторяемости, округленное до целого числа и выраженное в микрограммах на килограмм (мкг/кг).
10 Метрологические характеристики
Установленный в настоящем стандарте метод обеспечивает выполнение измерений содержания кокцидиостатиков с расширенной неопределенностью результатов аналитических измерений при коэффициенте охвата 2, указанной в таблице 5.
Таблица 5 - Значения относительной расширенной неопределенности , %, при коэффициенте охвата
2 в диапазонах измерений содержания кокцидиостатиков, мкг/кг
Наименование кокцидиостатика | Диапазон измерений содержания кокцидиостатиков, мкг/кг | ||
От 1,0 до 10 включ. | Св. 10 до 100 включ. | Св. 100 до 1000 включ. | |
Ампролиум | 126 | 43 | 30 |
Клопидол | 54 | 27 | 47 |
Ронидазол | 43 | 25 | 25 |
Тернидазол | 42 | 25 | 25 |
Тинидазол | 35 | 25 | 25 |
Арприноцид | 38 | 25 | 25 |
Этопабат | 92 | 50 | 80 |
Галофугинон | 31 | 55 | 66 |
Динитрокарбанилид | 51 | 30 | 25 |
Толтразурила сульфон | 80 | 40 | 40 |
Диклазурил | 55 | 66 | 66 |
Толтразурил | 55 | 46 | 28 |
Робенидин | 80 | 95 | 115 |
Декоквинат | 157 | 92 | 92 |
Ласалоцид | 49 | 48 | 45 |
Семдурамицин | 50 | 33 | 32 |
Монензин | 88 | 50 | 40 |
Лаидломицин | 85 | 50 | 50 |
Мадурамицин | 60 | 51 | 30 |
Салиномицин | 82 | 62 | 46 |
Наразин | 52 | 37 | 34 |
Примечание - Значения относительной расширенной неопределенности, указанные в таблице 2, соответствуют границам относительной погрешности результатов измерений при |
11 Оформление результатов измерений
11.1 Содержание -го кокцидиостатика
, мкг/кг, рассчитывают по формуле
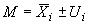 , (2)
, (2)
где - среднеарифметическое значение двух параллельных измерений содержания
-го кокцидиостатика в анализируемой пробе, мкг/кг;
- расширенная неопределенность при коэффициенте охвата
2 определения содержания
-го кокцидиостатика, определяемая по формуле 3, мкг/кг.
11.2 Значения расширенной неопределенности измерения рассчитывают с использованием значений относительной расширенной неопределенности при 2 по формуле
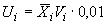 , (3)
, (3)
где - среднеарифметическое значение двух параллельных измерений содержания
-го аналита в анализируемой пробе, мкг/кг;
- значение относительной расширенной неопределенности содержания
-го аналита кокцидиостатиков для соответствующего диапазона измерений, % (в соответствии с таблицей 5).
12 Контроль качества результатов измерений
12.1 Контроль полноты извлечения внутренних стандартов кокцидиостатиков
12.1.1 Контроль извлечения внутренних стандартов кокцидиостатиков выполняют в ходе каждого измерения (получения результата количественного химического анализа при соблюдении требований настоящего стандарта).
12.1.2 Рассчитанные программным обеспечением значения извлечения внутренних стандартов должны находиться в диапазоне от 40% до 130%. Если рассчитанное значение извлечения ниже или выше указанного диапазона, то результаты измерения содержания кокцидиостатика не принимают за окончательный результат. Проводят повторные исследования анализируемых проб.
12.2 Контроль неопределенности результатов измерений
При соблюдении требований настоящего стандарта рекомендуется в ходе анализа каждой серии проб проводить их анализ для контроля с установленным значением содержания -го кокцидиостатика с использованием стандартной процедуры подготовки проб (7.1).
Результаты измерений признают удовлетворительными при выполнении следующего неравенства
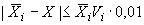 , (4)
, (4)
где - результат анализа содержания
-го кокцидиостатика в образце для контроля, мкг/кг;
- установленное значение содержания
-го кокцидиостатика в образце для контроля, мкг/кг;
- значение относительной расширенной неопределенности содержания
-го кокцидиостатика для соответствующего диапазона измерений (таблица 5), %.
Приложение А (обязательное). Контроль стабильности результатов измерений
Приложение А
(обязательное)
А.1 Периодичность контроля стабильности результатов измерений регламентируют в руководстве по качеству лаборатории.
Контроль стабильности результатов измерений в лаборатории при реализации методики осуществляют по ГОСТ Р ИСО 5725-6, используя контроль стабильности среднеквадратического (стандартного) отклонения промежуточной прецизионности рутинного анализа с изменяющимися факторами "время" и "оператор".
Применяя метод контрольных карт Шухарта, проверяют стабильность этих результатов измерений и оценивают стандартное отклонение промежуточной прецизионности с изменяющимися факторами "время" и "оператор". После отбора испытуемую пробу от каждой партии подготавливают в лаборатории для анализа. Одну пробу, подвергавшуюся анализу во время смены (), анализирует повторно другой оператор в другую смену (
), и результаты сравнивают. Значение стандартного отклонения промежуточной прецизионности (
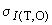 ) устанавливают в лаборатории по результатам измерений за предыдущий период. Параметры контрольной карты пределов для каждого диапазона рассчитывают следующим образом:
) устанавливают в лаборатории по результатам измерений за предыдущий период. Параметры контрольной карты пределов для каждого диапазона рассчитывают следующим образом:
- среднюю линию по формуле
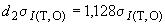 , (А.1)
, (А.1)
где 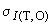 - среднеквадратическое отклонение промежуточной прецизионности, %;
- среднеквадратическое отклонение промежуточной прецизионности, %;
- верхний предел действия по формуле
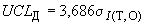 , (А.2)
, (А.2)
- верхний предел предупреждения по формуле
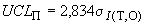 . (А.3)
. (А.3)
Расхождение рассчитывают по формуле
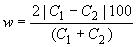 . (А.4)
. (А.4)
Расхождение наносят на карту в течение контролируемого периода.
Рекомендуется устанавливать контролируемый период так, чтобы количество результатов контрольных измерений было от 20 до 30. После этого проводят оценку стандартного отклонения промежуточной прецизионности 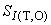 результатов по формуле
результатов по формуле
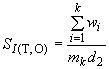 , (А.5)
, (А.5)
где - число измерений.
Полученное значение 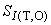 используют для последующего контроля стабильности результатов измерений.
используют для последующего контроля стабильности результатов измерений.
Библиография
[1] | ПБ 03-576-2003 | Правила устройства и безопасной эксплуатации сосудов, работающих под давлением (Утверждены Постановлением Госгортехнадзора России от 11.06.2003 N 91) |
Редакция документа с учетом
изменений и дополнений подготовлена

