ГОСТ ISO 16198-2017
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
КАЧЕСТВО ПОЧВ
Метод определения биодоступности микроэлементов почвы для растений
Soil quality. Plant-based test to assess the environmental bioavailability of trace elements to plants
МКС 13.080.30
Дата введения 2019-01-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Акционерным обществом "Всероссийский научно-исследовательский институт сертификации" (АО "ВНИИС") на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 30 августа 2017 г. N 102-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 10 октября 2017 г. N 1377-ст межгосударственный стандарт ГОСТ ISO 16198-2017 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2019 г.
5 Настоящий стандарт идентичен международному стандарту ISO 16198:2015* "Качество почв. Метод определения биодоступности микроэлементов почвы для растений" ("Soil quality - Plant-based test to assess the environmental bioavailability of trace elements to plants", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан Техническим комитетом ISO/ТС 190 "Качество почв" Международной организации по стандартизации (ISO).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Май 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
Одной из главных целей стандарта [10] является установление схемы биодоступности загрязняющих веществ в почве и почвенных массах, а также рекомендации по выбору методик измерений степени биодоступности, которые возможно стандартизировать. Таким образом, термин "биодоступность" был определен по-разному, в зависимости от условий реализации данного процесса:
a) "биодоступность из окружающей среды";
b) "биодоступность из почвы";
c) "токсикологическая биодоступность".
Биодоступность из окружающей среды - это необходимое условие для оценки токсикологической биодоступности, которое непосредственно связано с влиянием загрязняющих веществ на основные свойства почв в экосистеме, особенно на насыщенность почвы живыми существами и сохранность почвы.
Биодоступность из окружающей среды можно оценивать физическими, химическими или биологическими методами. Что касается микроэлементов, то применение в данном случае химических методов, как правило, является наиболее малозатратным и простым. Более того, некоторые химические методы уже стандартизированы на национальном и международном уровне (см. [11]). Однако необходимо учитывать, что результаты применения химических методов, которыми определяют доступность из почв, должны коррелировать с результатами измерений биологическими методами до того, как химические методы будут использовать в качестве подтверждения биодоступности из окружающей среды. Какие бы химические методы ни применяли, ни один из них не адаптирован таким образом, чтобы учитывать разнообразие реакций, наблюдаемых у различных видов и сортов растений, для которых характерны:
a) определенные особенности процесса доступности различных веществ (например, чувствительность, толерантность, интенсивность доступности микроэлементов, которая в некоторых случаях бывает весьма выраженной)
и (или)
b) способность растений влиять на биологические, физические и физико-химические свойства ризосферы.
Была высказана идея применения химических методов в отношении самой ризосферы, однако отбор проб из зоны ризосферы является весьма трудоемким, чтобы такую процедуру могли проводить регулярно.
В рамках биологических методов исследования процессов в ризосфере проводили четырьмя стандартизированными биотестами, поскольку их допускается применять к растениям, растущим на почве ([5], [8], [12] и ISO 11269-2). Однако данные методы были адаптированы только для теоретической оценки токсичности микроэлементов, т.е. токсикологической биодоступности. В ходе данных биотестов корни растений разрастались непосредственно в почве, в результате чего было необходимо проводить трудоемкую процедуру промывки корней, чтобы с достаточной степенью достоверности определить содержание микроэлементов, накопленных в корневой системе. Следует учесть, что содержание микроэлементов в ростках растений, которые не накапливали микроэлементы, является не достаточно высоким, чтобы его можно было использовать для оценки биодоступности из почвы для микроэлементов по сравнению с их содержанием во всем растении, в том числе в корнях. Таким образом, на данный момент существует необходимость разработки биологических методов, которые будут применять в отношении процессов в ризосфере, и которые дадут возможность полного отделения корня растения от почвы для адекватной оценки биодоступности микроэлементов растениями из почвы.
В соответствии с вышеизложенным настоящий стандарт устанавливает биотест, в основе которого лежит разрастание корня растения при контакте с почвой, но при этом корни не должны прорастать сквозь всю толщину слоя почвы. Несмотря на то, что данная экспериментальная схема не полностью отражает реальные условия рассматриваемых процессов, происходящих в природе, тем не менее, она позволяет проводить достаточно правомерное сравнение биодоступности микроэлементов из анализируемых видов почв. Более того, измерения, проводимые на последней стадии биотеста, могут в большей степени отражать степень биодоступности, чем любые измерения степени токсичности на последней стадии.
1 Область применения
Настоящий стандарт устанавливает метод определения интенсивности биодоступности микроэлементов для растений или концентраций микроэлементов в побегах и корневой системе растений (далее по тексту - биотест).
Биотест состоит из двух последовательных стадий:
1) предварительное выращивание растений на питательных растворах;
2) выращивание растений на пробах почв.
Концентрацию микроэлементов в побегах и корневой системе растений и интенсивность биодоступности для растений микроэлементов определяют при завершении второй стадии биотеста.
Биотест используют преимущественно в отношении сельскохозяйственных растений, растущих на почвах и почвенных массах в аэробных условиях. При этом три вида растений (капуста Brassica oleracea; овсяница тростниковая Festuca arundinacea, томат Lycopersicon esculentum, см. 7.1) были предложены в качестве объектов при проведении биотеста. Исследовали также и другие виды и сорта растений (см. 7.1, приложение А).
Метод биотеста валидирован для ряда микроэлементов, таких как мышьяк, кадмий, хром, кобальт, медь, свинец, никель и цинк, однако допускается также проводить определение и некоторых других микроэлементов (см. приложение А).
При проведении биотеста используют почвы и почвенные массы, в том числе почвы, видоизмененные до или после отбора проб в естественных условиях, содержащие компосты, грязь, сточные воды или иные материалы, отходы или отбросы.
Примечания
1 Данный биотест не предназначен для определения биодоступности для растений микроэлементов, имеющих свойство испаряться, а также в случае впитывания листьями растения влаги (например, из атмосферных осадков).
2 Данный биотест не предназначен для определения биодоступности для растений микроэлементов растениями органических загрязнителей. Допускается использовать аналогичную экспериментальную методику, однако при этом следует обеспечить физическое отделение корней растения от почвы при помощи полиамидной ткани, не впитывающей органические загрязнители.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения).
ISO 3696, Water for analytical laboratory use - Specification and test methods (Вода для лабораторного анализа. Технические требования и методы испытаний)
ISO 10390, Soil quality - Determination of pH (Качество почвы. Определение pH)
ISO 10694, Soil quality - Determination of organic and total carbon after dry combustion (elementary analysis) [Качество почвы. Определение содержания органического и общего углерода после сухого сжигания (элементарный анализ)]
ISO 11269-2, Soil quality - Determination of the effects of pollutants on soil flora - Part 2: Effects of contaminated soil on the emergence and early growth of higher plants (Качество почвы. Определение воздействия загрязняющих веществ на флору почвы. Часть 2. Воздействие загрязненной почвы на всхожесть и ранний рост высших растений)
ISO 11277, Soil quality - Determination of particle size distribution in mineral soil material - Method by sieving and sedimentation (Качество почвы. Определение гранулометрического состава минеральных почв. Метод просеивания и осаждения)
ISO 11465, Soil quality - Determination of dry matter and water content on a mass basis - Gravimetric method (Качество почвы. Определение содержания сухих веществ и воды по массе. Гравиметрический метод)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 загрязнитель (contaminant): Вещество, присутствующее в почве в результате человеческой деятельности (см. [3]).
Примечание - Данное определение не включает тот аспект, что нанесенный ущерб является результатом наличия загрязнителя.
3.2 биодоступность из окружающей среды (environmental availability): Количество загрязнителя, которое путем десорбции, имеющей физико-химический механизм, может потенциально накапливаться в растении (см. [10]).
3.3 биодоступность из почвы (environmental bioavailability): Количество соединения, присутствующего в почве, которое поступает в организм растения в результате физиологических процессов (см. [10]).
3.4 функциональная способность почвы поддерживать естественную среду (habitat function): Способность почвы или почвенной массы поглощать загрязнители так, что они не могут быть удалены путем вымывания водой или путем вовлечения в биоценоз через включения в пищевые цепи с участием организмов, обитающих в почве (см. [3]).
3.5 микроэлемент (trace element): Химический элемент, содержащийся в почве в концентрации менее 100 мг/кг.
Примечание - Данное определение приведено в [16].
3.6 функциональная способность почвы удерживать загрязнители (retention function): Способность почвы или почвенной массы поглощать загрязнители таким образом, чтобы они не могли быть удалены путем смывания водой или путем их вовлечения в процессы биоценоза путем их включения в пищевые цепи с участием организмов, обитающих в почве (см. [3]).
3.7 ризосфера (rhizosphere): Количество почвы, окружающей живые корни растения, с которой они взаимодействуют посредством своей физиологической (или любой другой) активности (см. [17]).
3.8 почва (soil): Самостоятельное естественно-историческое органоминеральное природное тело, возникшее на поверхности земли в результате длительного воздействия биотических, абиотических и антропогенных факторов, состоящее из твердых минеральных и органических частиц, воды и воздуха и имеющее специфические генетико-морфологические признаки, свойства, создающие для роста и развития растений соответствующие условия (см. [3]).
3.9 почвенная масса (soil material): Субстанция, отобранная из какой-либо почвы и модифицированная в результате человеческой деятельности (к ней относятся следующие варианты: отбор вынутого грунта, отбор вычерпываемого грунта, получение тепличных грунтов, обработанных почв, сыпучих почв и т.п. (см. [10]).
3.10 токсикологическая биодоступность (toxicological bioavailability): Процесс накопления в организме растений загрязнителя в концентрациях, которые оказывают токсическое действие (см. [10]).
4 Сущность метода
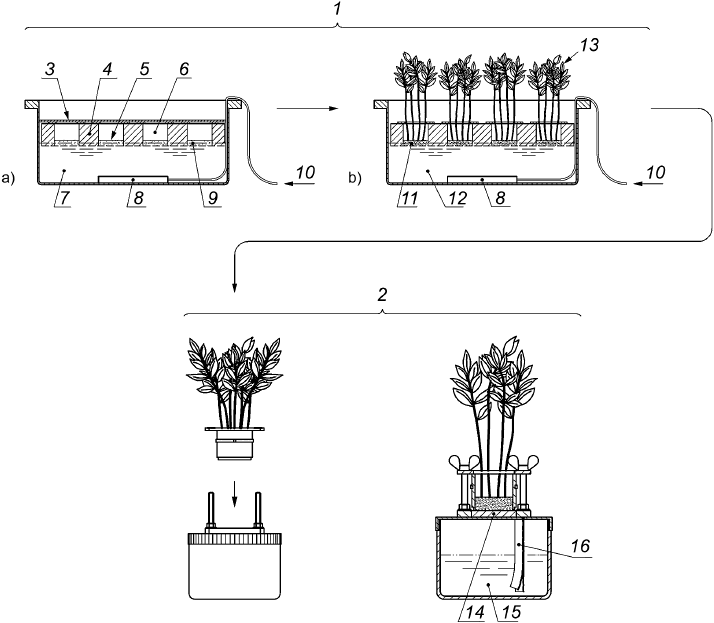
Настоящий стандарт содержит описание экспериментальной методики проведения биотеста, первоначально разработанной в [18]-[20]. Два последовательных этапа биотеста приведены на рисунке 1.
|
Обозначения:
a) прорастание семян (период 7 дней)
b) предварительное образование проростков (период 7 дней)
1 - предварительное выращивание растения на питательных растворах (период 14 дней); 2 - выращивание растения на пробах почв (период 8 дней); 3 - алюминиевая фольга; 4 - плавающая платформа; 5 - семена; 6 - горшок для растения; 7 - питательный раствор 1; 8 - воздуходувка нагнетания воздуха; 9 - сито с диаметром пор 30 мкм; 10 - воздух; 11 - корневая система; 12 - питательный раствор 2; 13 - проростки; 14 - слой почвы толщиной 6 мм; 15 - питательный раствор 3; 16 - набор полосок фильтровальной бумаги
Рисунок 1 - Двухстадийная методика проведения биотеста
В течение первого этапа продолжительностью 14 дней происходит образование проростков из семян на питательном растворе для достижения необходимой биомассы растения и образования плотной корневой системы. В течение второго этапа сформировавшуюся корневую систему приводят в контакт со слоем пробы почвы толщиной 6 мм, просеянной через сито с размером частиц 2 мм. Выращивают растения на пробах почв в течение 8 дней.
После завершения предварительного выращивания растения на питательных растворах отбирают серию контрольных растений для определения общего содержания микроэлементов в побегах и корневой системе растений до того, как растения будут высажены на почву. Затем целые растения (побеги с корневой системой) отбирают после завершения их выращивания на пробах почв. Определяют биомассу растений и концентрацию микроэлементов в побегах и корневой системе. Биотест считают законченным, если:
- достигнута определенная концентрация микроэлементов в побегах и корневой системе при завершении выращивания растений на пробах почв
или
- достигнута определенная интенсивность накопления микроэлементов растениями при завершении выращивания растений на пробах почв.
Если данные двух значений коррелируют между собой (см. [21]), интенсивность накопления, рассматривают как репрезентативный показатель биодоступности микроэлементов растениями в течение периода выращивания растений на пробах почв, поскольку, в отличие от значений концентраций микроэлементов, значения интенсивности биодоступности характеризуют накопление растениями микроэлементов только в период выращивания растений на пробах почв.
Если в ходе предварительного выращивания растения на питательных растворах не проявляются токсические признаки, обусловленные неблагоприятными химическими свойствами почвы, а также чрезмерная биодоступность микроэлементов растениями, то в целях адекватного сравнения допускается проводить биотест для определения степени биодоступности, используя широкий спектр различных почв, в том числе почв, которые сильно загрязнены.
5 Оборудование и вспомогательные материалы
Оборудование и вспомогательные материалы приведены ниже. Все оборудование, которое контактирует с пробами почв, растениями или реактивами, не должно в значительной степени впитывать следовые элементы. Оно также не должно загрязнять пробы.
5.1 Сита с номинальным размером отверстий 2 мм.
5.2 Весы с погрешностью взвешивания ±100 мг.
5.3 Весы с погрешностью взвешивания ±1 мг.
5.4 Камера для искусственного климата, в которой могут быть созданы и поддерживаться требуемые климатические условия (см. 7.4).
5.5 Сушильный шкаф вентилируемый, для высушивания почв или почвенных масс при температуре 25°С, а также побегов и корневой системы при температуре 50°С.
5.6 Ножницы с рабочим полотном, изготовленным из оксида циркония.
5.7 Оборудование для измельчения, изготовленное из оксида циркония.
6 Реактивы
6.1 Общие положения
Используют реактивы квалификации ч.д.а. концентрацией не более 5 мг/кг. Используют воду степени очистки 3 (см. ISO 3696) или воду эквивалентной чистоты, например, дистиллированную или деионизированную, с электропроводностью не более 5 мкСм/см при температуре 25°С и с диапазоном значений рН от 5,0 до 7,5 ед. рН.
6.2 Водорода перекись, ![]() молярной концентрацией 34,01 г/моль.
молярной концентрацией 34,01 г/моль.
6.3 Кальций хлористый двухводный, ![]() молярной концентрацией 147,07 г/моль.
молярной концентрацией 147,07 г/моль.
6.4 Борная кислота, ![]() , молярной концентрацией 61,83 г/моль.
, молярной концентрацией 61,83 г/моль.
6.5 Кальций азотнокислый четырехводный, ![]() молярной концентрацией 236,15 г/моль.
молярной концентрацией 236,15 г/моль.
6.6 Калий азотнокислый, ![]() молярной концентрацией 101,1 г/моль.
молярной концентрацией 101,1 г/моль.
6.7 Магний сернокислый семиводный, ![]() молярной концентрацией 246,48 г/моль.
молярной концентрацией 246,48 г/моль.
6.8 Калий фосфорнокислый, ![]() молярной концентрацией 136,09 г/моль.
молярной концентрацией 136,09 г/моль.
6.9 Этилендиаминтетрауксусной кислоты натрия и железа (III) соль, NaFe(lll)EDTA молярной концентрацией 367,05 г/моль.
6.10 Медь хлористая двухводная, ![]() молярной концентрацией 170,48 г/моль.
молярной концентрацией 170,48 г/моль.
6.11 Марганец хлористый четырехводный, ![]() молярной концентрацией 197,91 г/моль.
молярной концентрацией 197,91 г/моль.
6.12 Цинк сернокислый семиводный, ![]() молярной концентрацией 287,54 г/моль.
молярной концентрацией 287,54 г/моль.
6.13 Натрия молибдата дигидрат, ![]() молярной концентрацией 241,95 г/моль.
молярной концентрацией 241,95 г/моль.
7 Оборудование для проведения биотеста
7.1 Виды растений
При проведении биотеста испытывали три вида растений (В. oleracea, F. arundinacea и L. esculentum), которые были отобраны среди видов растений по причине их достаточно выраженной способности к биодоступности, а также были отобраны некоторые типичные сельскохозяйственные культуры, совместно обладающие максимально выраженной биодоступностью микроэлементов (особенно мышьяка, кадмия, меди, свинца и цинка) из почв, имеющих самые различные физико-химические свойства и первоисточник содержащихся в них микроэлементов (см. [21]). Для каждого выбранного вида были рекомендованы следующие сорта: для В. oleracea - castelard, для F. arundinacea - calina, для L. esculentum - fline.
При отсутствии указанных сортов растений в продаже допускается использование других сортов при условии, что они демонстрируют требуемый рост и формируют гомогенную корневую систему в ходе биотеста при испытании различных видов почв. Причину, по которой были выбраны сорта растений, отличные от рекомендуемых, отмечают в протоколе испытания. Для конкретного сорта растения семена, используемые в единичной серии экспериментов, должны быть отобраны из одной и той же партии.
Допускается отбор дополнительных видов растений, например видов с особыми физиологическими характеристиками или имеющих экологическое, сельскохозяйственное или экономическое значение в конкретных регионах мира, либо для оценки растений, произрастающих в определенных зонах при условии, что данные виды растений демонстрируют требуемый рост и формируют гомогенную корневую систему в ходе биотеста при испытании различных видов почв. Перечень видов растений, отвечающих требованиям биотеста в плане способности к росту, некоторые из которых валидированы в результате проведения стандартизированной процедуры, приведен в приложении А. Причину, по которой были выбраны дополнительные виды растений, отмечают в протоколе испытания.
Примечания
1 Биотест следует проводить, используя семена, не обработанные пестицидами, насколько это возможно. При отсутствии такой возможности, данный факт отмечают в протоколе испытания.
2 Использование в биотесте сортов растений, отличных от рекомендуемых, может привести к результатам, которые будут отклоняться от типичных результатов в той же степени, как и при использовании различных видов растений.
7.2 Оборудование для проведения биотеста
Данное оборудование, контактирующее с пробами почв, растений и с реактивами, не должно адсорбировать вещества и материалы, оценку которых проводят, а также не должно вносить загрязнение в пробы.
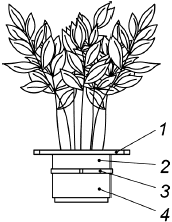
В состав оборудования входят горшки для растений, которые способны вмещать растение с момента начала предварительного выращивания растений на питательных растворах до завершения их выращивания на пробах почв. Горшки для растений должны обеспечивать формирование растением плоской и плотной корневой системы, а также легкое отделение растения от пробы почвы. Горшок представляет собой цилиндр, к верней части которого прикреплена верхняя крепежная накладка, а снизу к цилиндру с помощью регулируемого зажима прочно прикреплена полиамидная ткань с размером пор 30 мкм. Данная схема приведена на рисунке 2.
|
1 - верхняя крепежная накладка; 2 - цилиндр; 3 - регулируемый зажим; 4 - полиамидная ткань с размером пор 30 мкм
Рисунок 2 - Схема сборной конструкции горшка для растения
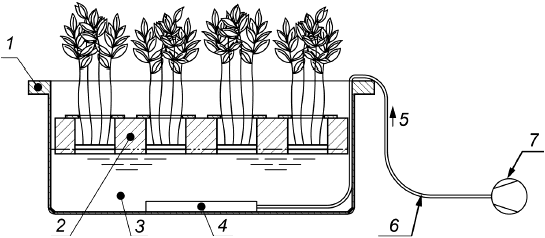
Схема сборной конструкции горшка для растения, используемой при предварительном выращивании растений на питательных растворах, обеспечивает прорастание семян и формирование плотной корневой системы у растений. Она обеспечивает плотный контакт семян или образовавшейся корневой системы с питательным раствором. Данная схема включает платформу с 12 круглыми отверстиями, плавающую на поверхности питательного раствора в баке. В отверстия платформы помещают горшки для растений. Питательный раствор непрерывно насыщают воздухом при помощи системы барботирования, состоящей из воздушного насоса и капиллярных трубок, соединенных с диффузором, расположенным на дне бака. Плавучесть платформы является весьма важным фактором гарантирования однородности контактирования всех горшков с питательным раствором. Рассматриваемая схема также позволяет ограничить воздействие солнечного или искусственного света на питательный раствор и тем самым предотвратить разрастание в нем водорослей. Данная схема приведена на рисунке 3.
|
1 - бак; 2 - плавающая платформа с отверстиями; 3 - питательные растворы (1 или 2); 4 - диффузор воздуха; 5 - воздух; 6 - трубка; 7 - воздушный насос
Рисунок 3 - Схема конструкции, используемой при предварительном выращивании растений на питательных растворах
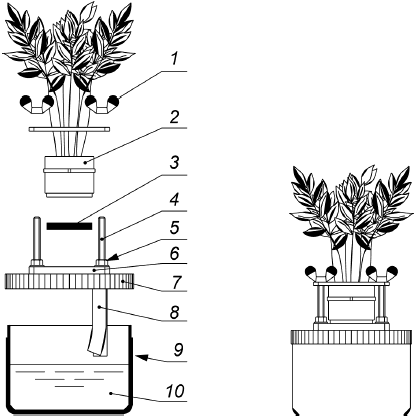
Схема конструкции, используемой при выращивании растений на пробах почв, должна обеспечивать плотный контакт корневой системы растения и слоя почвы. Конструкция состоит из двух компонентов, а также в ней используют три полоски фильтровальной бумаги, один конец которых контактирует со слоем почвы, а другой - опущен в питательный раствор в сосуде вместимостью 0,5 дм, расположенном в нижней части сборки. Данная конструкция гарантирует надежный контакт корневой системы растения со всей поверхностью слоя почвы. Полоски фильтровальной бумаги должны быть полностью смоченными в течение всего периода выращивания растений на пробах почв. Данная схема приведена на рисунке 4.
|
1 - крыльчатая гайка; 2 - горшок; 3 - слой почвы (толщиной 6 мм); 4 - винт; 5 - винтовая гайка; 6 - подложка для почвы; 7 - навинчивающаяся крышка; 8 - полоски фильтровальной бумаги; 9 - сосуд; 10 - питательный раствор 3
Рисунок 4 - Схема конструкции, используемой при выращивании растений на пробах почв
Все части конструкций, приведенных выше, допускается использовать многократно (за исключением регулируемого зажима, полосок фильтровальной бумаги и полиамидной ткани) при условии их промывания горячей водой (для удаления с их поверхности растительной слизи и биопленок, образованных в результате деятельности микроорганизмов), 10%-ной азотной кислотой и достаточно большим количеством дистиллированной или деионизированной воды.
Допускается изготовление самодельных конструкций при условии, что размеры их частей пропорциональны и их характеристики аналогичны установленным.
Подробный перечень частей и их характеристик приведен в таблице 1.
Таблица 1 - Перечень частей конструкций, применяемых при проведении биотеста
Стадия биотеста | Компонент | N | Кол-во | Характеристики |
- | Горшок для растения: | |||
Цилиндр | 1 | 1 | ПВХ высокой плотности, выдерживающий высокую температуру, пищевой | |
Верхняя крепежная накладка | 2 | 1 | Из полиэтилена высокой плотности низкого давления, пищевой | |
Полиамидная ткань | - | 1 | Размеры 100 мм | |
Регулируемый зажим | - | 1 | Размеры 180 мм | |
Предварительное выращивание растения на питательных растворах | Бак | 3 | 1 | Вместимость 12 дм |
Плавающая платформа с отверстиями | 4 | 1 | Из экструзионного полистирола | |
Воздушный насос с двумя выходами | - | 1 | Скорость потока воздуха 100-200 дм | |
Капиллярная трубка | - | 2 | Из ПВХ, внутренний диаметр приблизительно 4 мм | |
Устройство отведения | - | 1 | При необходимости | |
Диффузор воздуха | - | 2 | Керамический, размеры 100 мм | |
Выращивание растения на пробах почв | Сосуд с завинчивающейся крышкой | 5 | 1 | Светонепроницаемый, из белого полипропилена, пищевой |
Полоска фильтровальной бумаги | - | 3 | Уплотненная, беззольная фильтровальная бумага | |
Подложка для почвы | 6 | 1 | Из полиэтилена высокой плотности низкого давления, пищевой, толщина 6 мм | |
Винт | - | 4 | Из полиэтилена высокой плотности низкого давления | |
Винтовая гайка | - | 8 | Из полиэтилена высокой плотности низкого давления | |
| ||||
7.3 Состав питательных растворов
При проведении биотеста готовят три питательных раствора: для прорастания семян (раствор 1), развития проростков (раствор 2) и выращивания растения на почве (раствор 3).
Раствор 1 готовят путем смешивания раствора ![]() молярной концентрацией 600 мкмоль/дм
молярной концентрацией 600 мкмоль/дм (см. 6.4) и раствора
![]() молярной концентрацией 2 мкмоль/дм
молярной концентрацией 2 мкмоль/дм (см. 6.5).
Раствор 2 готовят путем добавления в сосуд растворов реактивов в следующей последовательности:
калия фосфорнокислого молярной концентрацией 136,09 г/моль,
калия азотнокислого молярной концентрацией 101,1 г/моль,
кальция азотнокислого четырехводного молярной концентрацией 236,15 г/моль,
магния сернокислого семиводного молярной концентрацией 246,48 г/моль,
меди хлористой двухводной, молярной концентрацией 170,48 г/моль,
борной кислоты молярной концентрацией 61,83 г/моль,
марганца хлористого четырехводного молярной концентрацией 197,91 г/моль,
цинка сернокислого семиводного молярной концентрацией 287,54 г/моль,
натрия молибдата дигидрата молярной концентрацией 241,95 г/моль,
этилендиаминтетрауксусной кислоты натрия и железа (III) соли, молярной концентрацией 367,05 г/моль.
Раствор 3 готовят путем добавления в сосуд растворов реактивов в следующей последовательности:
калия фосфорнокислого молярной концентрацией 136,09 г/моль,
калия азотнокислого молярной концентрацией 101,1 г/моль,
кальция азотнокислого четырехводного молярной концентрацией 236,15 г/моль,
магния сернокислого семиводного молярной концентрацией 246,48 г/моль.
7.4 Климатические условия в камере искусственного климата
Допускается выращивание растений в камере искусственного климата, фитотроне или теплице при условии, что в них могут быть созданы климатические условия, аналогичные приведенным в таблице 2.
Таблица 2 - Климатические условия, требуемые для проведения биотеста
Климатические условия | Кол-во дней | Кол-во ночей |
Фотопериод, ч | 16 | 8 |
Фотосинтетически активная радиация (свет) (диапазон длин волн 400-700 нм), инициирующая фотосинтез, мкмоль фотонов на кв. метр в секунду | 200-400 | - |
Температура, °С | 25±3 | 20±2 |
Относительная влажность, % | 75±5 | 70±5 |
| ||
8 Предварительная подготовка и анализ проб почв и почвенных масс
8.1 Сокращение проб почвы и получение проб, состоящих из частиц требуемого размера
Пробы почвы и почвенных масс готовят таким образом, чтобы они состояли из частиц с размером не более 2 мм. Не допускается тонкий помол материала проб, поскольку это может привести к изменению характеристик процесса биоаккумуляции. Частицы в пробе с размером более 2 мм, имеющие натуральное происхождение (например, камешки, гравий, веточки и т.п.) отделяют от пробы. Если нет возможности провести дробление или просеивание лабораторной пробы по причине высокого содержания в ней влаги, допускается уменьшить количество влаги в пробе до уровня, когда пробу станет возможным просеять. В таком случае пробу сушат при температуре не более 25°С.
Примечание - Необходимо избегать сушки проб вулканических почв, содержащих аллофаны, при любой температуре, даже при температуре ниже 25°С. Данные виды почв следует хранить увлажненными при температуре 4°С.
8.2 Анализ почв и почвенных масс
Определяют физико-химические характеристики почв и почвенных масс:
- исходное содержание влаги (по ISO 11465);
- влагоемкость (по ISO 11269-2);
- структуру (по ISO 11277);
- рН воды и раствора хлористого кальция (по ISO 10390);
- концентрацию органического углерода (по ISO 10694).
Примечание - Определение структуры, рН и концентрации органического углерода необходимо для интерпретации результатов.
9 Методика проведения биотеста и дополнительных вспомогательных процедур
9.1 Общая блок-схема методики
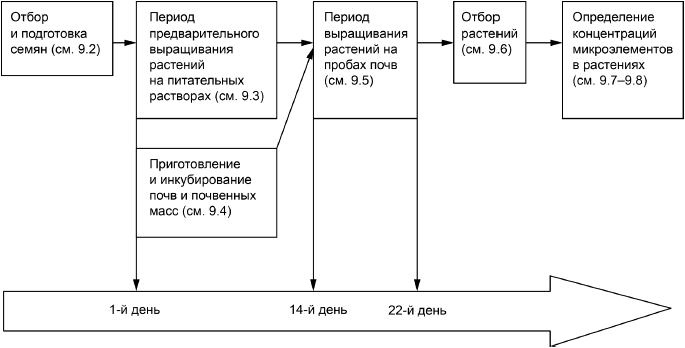
Общая блок-схема методики приведена на рисунке 5.
|
- 1-й день - день начала биотеста и предварительного ПВРПР;
- 14-й день - день завершения предварительного ПВРПР и начала периода ВРНПП;
- 22-й день - день завершения периода ВРНПП и завершения биотеста.
Рисунок 5 - Блок-схема, отражающая последовательность стадий методики, включающей проведение биотеста
9.2 Отбор и подготовка семян
Семена для биотеста отбирают в соответствии с приложением С. Не используют семена, которые повреждены, имеют неправильную форму или размер.
Во избежание прорастания отобранные семена хранят в темном и сухом месте при оптимальной температуре 4°С.
9.3 Процессы прорастания семян и развития проростков
Поверхность семян стерилизуют путем погружения в 6%-ный раствор перекиси водорода на 10 мин и трехкратного промывания дистиллированной или деионизированной водой.
Требуемое количество семян помещают на поверхность полиамидной ткани, находящейся в горшке. Для В. oleracea, F. arundinacea и L. esculentum количество семян на один горшок составляет 50, 80 и 40 соответственно. Информация о количестве помещаемых в горшок семян других видов растений, используемых в рамках стандартизированной экспериментальной методики, приведена в приложении С.
Для каждого вида почвы или почвенной массы готовят не менее пяти проб (т.е. горшков) для данного вида растения. Кроме того, готовят не менее пяти горшков, растения в которых используют в качестве контрольных, с определенными концентрациями в них микроэлементов (особенно это касается меди и цинка). Данные процедуры должны быть выполнены до начала второй стадии биотеста - выращивания растений на пробах почв.
Общее число горшков, которое необходимо подготовить для анализа конкретного вида растения, вычисляют по формуле
![]() , (1)
, (1)
где - число проб почв или почвенных масс;
- число проб (не менее 5);
- число горшков, растения в которых используют в качестве контрольных (не менее 5);
- поправочный коэффициент, обеспечивающий запас надежности анализа (не менее 1,2).
Горшки с семенами вставляют в отверстия платформы (на одной платформе можно разместить 12 горшков), плавающей на поверхности питательного раствора 1 объемом 6 дм в баке. Семенам дают прорасти в течение двух-четырех суток в темноте (бак закрывают алюминиевой фольгой). При появлении у проростков функционирующих фотосинтетических органов (зеленой пигментации семядоль или листьев), алюминиевую фольгу снимают. Проростки продолжают расти до конца первой недели на том же самом питательном растворе.
Затем проросткам дают развиваться в течение еще одной недели, но на питательном растворе 2, который необходимо менять каждый третий день. При каждой очередной замене питательного раствора бак и плавающую платформу отделяют от сборки и тщательно промывают горячей водой, 10%-ной азотной кислотой и дистиллированной или деионизированной водой. При этом горшки на плавающей платформе переставляют произвольным образом.
9.4 Приготовление и инкубирование почв и почвенных масс
Параллельно с проведением предварительного выращивания растений на питательных растворах, пробы почв и почвенных масс инкубируют в течение двух недель в темноте в климатических условиях, аналогичных тем, которые были созданы для растений (см. 7.4). Инкубирование необходимо для достижения физико-химического равновесия в пробах, микрофлора которых интенсивно развивалась из-за увлажнения проб. После помещения требуемого количества проб (в пересчете на сухое вещество) в подходящий контейнер, пробы прессуют, чтобы достичь плотности приблизительно 1,2 г/см, затем смачивают их до такой степени, чтобы они впитали количество влаги, составляющее 70% их влагопоглощающей способности, из питательного раствора 3. Определяют влагопоглощающую способность почв и почвенных масс, спрессованных до той же плотности, что и пробы на подложке. Отверстие каждого контейнера должно обеспечить достижение равновесия с внешней атмосферой. Регулярно проверяют содержание влаги и при необходимости корректируют его путем добавления питательного раствора 3.
За один день до начала выращивания растений на пробах почв на каждую подложку для почв помещают свежую пробу почвы (или почвенной массы) массой 9 г (в пересчете на сухое вещество), чтобы образовался слой толщиной приблизительно 6 мм (плотность почвы - 1,2 г/см). Если нет возможности спрессовать почву до указанной выше плотности, массу пробы почвы корректируют таким образом, чтобы в любом случае получить слой толщиной 6 мм. Данный факт отмечают в протоколе испытания (см. раздел 13). К подложкам для почв снизу прикрепляют сосуды вместимостью 0,5 дм
, содержащие питательный раствор 3, в который опущены полоски фильтровальной бумаги. В данных условиях пробы почв полностью насыщаются влагой. Подложки для проб почв плотно закрывают до начала выращивания на них растений, чтобы ограничить испарение влаги и не допустить воздействия света.
9.5 Период выращивания растений на пробах почв
После завершения предварительного выращивания растений на питательных растворах, отбирают горшки с растениями, которые имеют однородную биомассу (что можно видеть невооруженным глазом). Остальные растения в дальнейшем не используют. Тщательно промывают отобранные горшки большим количеством дистиллированной или деионизированной воды, после чего прикрепляют их к нижней сборке таким образом, чтобы корневая система растения плотно контактировала со слоем почвы на подложке. Растения в данных условиях выращивают в течение 8 сут. Питательный раствор 3 заменяют каждый второй день, за исключением последнего дня проведения данной стадии биотеста. При каждой замене питательного раствора нижний сосуд отделяют, тщательно промывают горячей водой, 10%-ным раствором азотной кислоты и дистиллированной или деионизированной водой. При замене раствора необходимо соблюдать осторожность при обращении с указанными сборками и не допускать повреждения или изменения положения полосок фильтровальной бумаги, поскольку они обеспечивают отрегулированный приток питательного раствора к корневой системе растений. Если какая-либо полоска фильтровальной бумаги оказалась повреждена или ее положение было изменено, полоску незамедлительно заменяют другой либо корректируют положение уже вставленной.
9.6 Отбор растений
После завершения предварительного выращивания растений отбирают горшки с растениями, являющиеся дублями и контрольными растениями. По завершении периода выращивания растений на пробах почв горшки отделяют от нижней сборки, содержащей слой почвы и также отбирают растения.
Из горшков вынимают полиамидную ткань и тщательно промывают растения, состоящие из побегов и корневой системы, дистиллированной или деионизированной водой. Корневую систему промывают особо тщательно, так как она находилась в длительном контакте с почвой и необходимо не допустить существенного загрязнения ее частицами почвы размером менее 30 мкм, проникновение которых в корневую систему полиамидная ткань не предотвратила. Вынимают растения из горшков.
При определении концентраций микроэлементов в побегах и корневой системе побеги отрезают от корневой системы, а при определении интенсивности накапливания микроэлементов растениями, что предположительно дает более точные результаты, растения сохраняют целыми. Для удобства аналитика лузгу непроросших семян удаляют либо смешивают с корневой системой при условии, что это существенно не повлияет на биомассу или на содержание микроэлементов в корневой системе.
Пробы растений (представляющие из себя только побеги, только корневые системы или растения целиком) помещают в подходящие контейнеры и высушивают в сушильном шкафу при температуре не более 50°С. Когда масса проб станет постоянной (что обычно происходит после 3 сут высушивания), их вынимают из шкафа, взвешивают с погрешностью ±1 мг и помещают в сухие контейнеры в целях исключения набора влаги.
Во избежание загрязнения с пробами работают в лабораторных перчатках, и побеги от корневой системы отрезают специальными ножницами (см. 5.6).
9.7 Измельчение и минерализация побегов и корневой системы
Измельчение пробы проводят только тогда, когда необходима ее минерализация. В этом случае пробы растений (побеги и корневую систему, вместе или по отдельности) измельчают при помощи соответствующего устройства (см. 5.7). Если необходимо провести минерализацию пробы целиком, ее нарезают на мелкие кусочки специальными ножницами (см. 5.6).
Процедура минерализации должна обеспечивать полное разрушение тканей растения и образование диоксида кремния и других малорастворимых минеральных веществ. При определении летучих микроэлементов (например, мышьяка или селена) методика минерализации должна быть модифицирована с целью недопущения потери данных элементов. Пример методики минерализации приведен в приложении D (см. D.1).
При минерализации и определении концентраций микроэлементов (см. 9.8) используют определенное количество контрольных проб с целью проверки потенциального загрязнения проб, а также учета фоновой концентрации исследуемых элементов в пробах. Используют не менее одной контрольной пробы. Данные контрольные пробы используют, принимая во внимание исследуемые микроэлементы и предполагаемые диапазоны их концентраций.
9.8 Определение концентраций микроэлементов
Минерализаты проб растений анализируют высокоточными методами, которые позволяют определять концентрации на уровне нанограммов, микрограммов или миллиграммов на грамм сухой биомассы. К данным методам относятся атомно-абсорбционные методы (см. [4] и [13]), атомно-эмиссионная спектрометрия с индуктивно-связанной плазмой (см. [14]) и масс-спектрометрия с индуктивно-связанной плазмой (см. [9]) либо любой другой приемлемый метод.
Пример типичных диапазонов концентраций микроэлементов в минерализатах растений приведен в приложении D (см. D.2).
10 Критерии достоверности результатов биотеста
Использование в ходе биотеста горшков с растениями является приемлемым только при выполнении следующих критериев:
- прорастание семян имеет гомогенный характер, при этом в течение первой недели предварительного выращивания растений на питательных растворах не образуется плесень;
- проростки имеют здоровую корневую систему, которая покрывает все дно горшка при завершении периода предварительного выращивания растений;
- проростки в ходе своего развития образуют гомогенную биомассу при завершении периода предварительного выращивания растений;
- побеги не содержат вредителей, здоровые, с отсутствием нарушений процессов питания и фитотоксических признаков (например, пятнистости листьев, хлороза, выгорания, омертвения тканей, усыхания, увядания и т.п.) в течение всего периода проведения биотеста;
- биомасса побегов и корневой системы значительно увеличивается с момента завершения периода предварительного выращивания до момента завершения выращивания на пробах почв (см. 12.2);
- полоски фильтровальной бумаги должны быть всегда погружены в питательный раствор, поставлять в растения питательные вещества и не должны быть повреждены или перемещены в конце выращивания на пробах почв;
- слои почв должны быть насыщены влагой в конце выращивания на них растений;
- должно быть обеспечено плотное контактирование корневой системы растений со слоем почвы в течение всего периода их выращивания на почвах.
11 Выражение результатов
11.1 Определение концентрации микроэлементов в пробах растений и интенсивности их накопления
На основе концентраций микроэлементов, определенных в минерализатах растений, проводят их пересчет для проб растений (т.е. для побегов и корневой системы по отдельности либо объединенных вместе) в каждом горшке при завершении предварительного выращивания растений на питательных растворах (это касается горшков с контрольными растениями) и при завершении выращивания на пробах почв.
Концентрацию следового элемента в пробе растения, , мкг/г сухой биомассы растения вычисляют по формуле
![]() , (2)
, (2)
где - концентрация микроэлемента в минерализате растения, мкг/дм
;
- объем минерализата растения, дм
;
- масса измельченной пробы растения (в пересчете на сухое вещество), подвергнутой минерализации, г.
Интенсивность накопления микроэлементов при выращивании растений на пробах почв , нг/м
·с, при условии, что побеги и корневую систему анализировали по отдельности, вычисляют по формулам (3) и (4), а при условии, что побеги и корневая система были объединены, вычисляют по формуле (5):
![]() ; (3)
; (3)
![]() (4)
(4)
или
![]() , (5)
, (5)
где - масса микроэлемента, накопленного растением при выращивании на пробах почв, нг;
- площадь поверхности корневой системы, контактировавшая с почвой, м
(равна 12,6 см
);
- продолжительность выращивания растений на пробах почв, с (равна 8 сут);
- концентрация следового элемента в побегах растений при завершении их выращивания на пробах почв, мкг/г сухой биомассы;
- сухая биомасса побегов при завершении выращивания растений на пробах почв, г;
- усредненная концентрация микроэлемента в побегах контрольных растений при завершении их предварительного выращивания на питательных растворах, мкг/г сухой биомассы;
- усредненная сухая биомасса побегов контрольных растений при завершении их предварительного выращивания на питательных растворах, г;
- концентрация микроэлемента в корневой системе растений при завершении их выращивания на пробах почв, мкг/г сухой биомассы;
- усредненная концентрация микроэлемента в корневой системе контрольных растений при завершении их предварительного выращивания на питательных растворах, мкг/г сухой биомассы;
- усредненная сухая биомасса корневой системы растений при завершении их предварительного выращивания на питательных растворах, г;
- концентрация микроэлемента в растениях (побегах и корневой системе) при завершении их выращивания на пробах почв, мкг/г сухой биомассы;
- сухая биомасса растений (побегов и корневой системы) при завершении их выращивания на пробах почв, г;
- усредненная концентрация микроэлемента в контрольных растениях (побегах и корневой системе) при завершении их предварительного выращивания на питательных растворах, мкг/г сухой биомассы;
- усредненная сухая биомасса контрольных растений (побегов и корневой системы) при завершении их предварительного выращивания на питательных растворах, г.
11.2 Представление результатов
11.2.1 Табличное представление результатов
Полученные результаты представляют в виде таблиц, в которые вносят значения биомасс и концентраций следовых элементов (для побегов, для корневой системы или для целых растений), интенсивности биоаккумуляции следовых элементов контрольными растениями при завершении их предварительного выращивания на питательных растворах, а также при завершении выращивания растений на пробах почв. В каждую таблицу также вносят результаты статистической обработки полученных значений (см. раздел 12).
11.2.2 Графическое представление результатов
Результаты также представляют в графическом виде (например, среднеарифметические значения биомасс побегов, корневой системы или целых растений представляют в виде гистограмм) с учетом среднеквадратического отклонения. Значения, полученные для исследованных видов растений (в том числе для контрольных), которые выращивались на различных видах почв, представляют параллельно. Значения биомасс побегов или корневой системы по отдельности представляют в виде графика, отмечая значения биомассы побегов над осью х, а значения биомассы корневой системы - под осью х.
Среднеарифметические значения концентраций микроэлементов в побегах и корневой системе по отдельности со значениями среднеквадратических отклонений также представляют в виде гистограмм. Значения, полученные для исследованных видов растений (в том числе для контрольных), которые выращивались на различных видах почв, представляют параллельно. Значения концентраций каждого микроэлемента в побегах или корневой системе по отдельности представляют в виде графиков (для каждого следового элемента строят индивидуальный график), отмечая значения концентраций в побегах над осью х, а корневой системы - под осью х.
Среднеарифметические значения интенсивности биодоступности микроэлементов растениями со значениями среднеквадратических отклонений также представляют в виде гистограмм. Значения, полученные для исследованных видов растений (в том числе для контрольных), которые выращивались на различных видах почв, представляют параллельно. Для каждого следового элемента строят индивидуальный график.
В каждую графическую схему вносят результаты статистической обработки значений полученных результатов (см. раздел 12).
12 Статистическая обработка результатов
12.1 Общие положения
Значительный разброс значений биодоступности для различных микроэлементов, различных видов почв, обработанных почв (например, путем добавления в них органических отходов), различных видов растений подвергают обработке, используя соответствующий статистический критерий (например, анализ вариаций ANOVA множественного сравнения значений, 0,05). Если статистический подход базируется на параметрическом анализе, то допускается гипотеза, что полученные результаты имеют нормальное распределение, их обработка независима и разброс значений является однородным при различных методах их обработки. Сначала проверяют истинность данных гипотез. Если результаты биотеста соответствуют данным гипотезам, статистическую обработку продолжают дальше. В противном случае результаты корректируют и к ним снова применяют соответствующий статистический критерий. Если применение данного критерия приводит к получению адекватных результатов и разброс результатов приемлем, параметрическую обработку продолжают дальше, даже если после коррекции результатов имеет место их незначительное несоответствие условиям применяемого критерия. В противном случае, когда после коррекции результатов несоответствие условиям критерия недопустимо большое, проводят статистическую обработку, используя непараметрические методы.
12.2 Определение статистически значимых особенностей значений биомассы растений
Достоверность результатов биотеста в значительной степени зависит от степени увеличения биомассы побегов и корневой системы в период с момента завершения предварительного выращивания растений на питательных растворах до момента завершения их выращивания на пробах почв. Для каждого вида растений определяют степень увеличения биомассы.
Биотест разработан таким образом, чтобы не допустить проявления токсичности, что позволяет проводить обоснованное сравнение влияния различных видов обработки на биодоступность микроэлементов растениями. Для каждого вида растений определяют наличие существенного различия в количестве биомассы побегов и корневой системы при применении различных видов почв, а также по-разному обработанных почв при завершении периода выращивания на них растений.
12.3 Определение статистически значимых особенностей результатов, полученных при завершении определения биодоступности
В случае, когда побеги и корневую систему обрабатывают по отдельности, для каждого вида растений и микроэлемента определяют наличие существенного различия в концентрациях микроэлементов в каждой пробе частей растения при применении различных видов почв, а также по-разному обработанных почв при завершении периода выращивания на них растений.
Независимо от того, обрабатывали ли побеги и корневую систему растений по отдельности или вместе, рассчитывают интенсивность накопления растениями микроэлементов (см. 11.1). Качество данного процесса сильно зависит от однородности биомасс частей растений и концентраций микроэлементов в контрольных растениях, собранных при завершении периода их предварительного выращивания на питательных растворах. Если результаты определения биомассы достаточно приемлемы, то определение концентраций микроэлементов более подвержено воздействию мешающих влияний при проведении биотеста и особенно подвержено влиянию загрязнений в пробах. Если, несмотря на предпринятые особые меры предосторожности, в течение данной стадии биотеста контрольные растения предположительно оказались загрязненными, для выявления непригодных растений при определении концентрации микроэлементов, накопленных в пяти пробах растений, применяют тест Граббса (см. [22]). В протоколе испытания регистрируют все случаи исключения непригодных растений с соответствующим обоснованием (см. раздел 13).
Если расчет интенсивности накопления привел к получению приемлемых результатов, для каждого вида растения и микроэлемента определяют наличие существенного различия в интенсивности биодоступности микроэлементов растениями при применении различных видов почв, а также по-разному обработанных почв при завершении периода выращивания на них растений.
13 Протокол испытания
Протокол испытания должен содержать следующую информацию:
a) ссылку на настоящий стандарт;
b) описание видов растений, используемых в биотесте, в соответствии с классификацией Линнея; описание сортов растений и указание источников растений;
c) описание оборудования, применяемого при проведении биотеста, особенно в тех случаях, когда оно отличается от оборудования, приведенного в таблице 1;
d) описание климатических условий в камере искусственного климата, мониторинг которых проводили (см. 7.4);
e) описание обработанных и необработанных почв и почвенных масс, использованных при проведении биотеста, а именно:
1) акт отбора проб и место отбора проб;
2) протокол, в котором регистрируют внесение в пробы почв и почвенных масс определенных веществ и материалов (например, органических отходов) перед началом соответствующей стадии биотеста;
3) физико-химические характеристики почв и почвенных масс (см. 8.2);
f) описание всех подробностей проведения биотеста, не установленных в настоящем стандарте и всех факторов, которые потенциально могли повлиять на результаты биотеста, в том числе:
1) повреждение каких-либо компонентов, используемых при проведении биотеста, видимых невооруженным глазом (с приложением соответствующих фотографий);
2) формирование биомассы растений или создание концентрации микроэлементов в растениях при завершении периода их предварительного выращивания на питательных растворах (т.е. это касается контрольных растений), значения которых выходят за пределы диапазонов, приведенных в приложении Е (при этом необходимо представить соответствующие данные и поясняющий комментарий);
g) данные, полученные в результате проведения биотеста, вместе с результатами их статистической обработки с указанием ее методов и описанием видов представления этих данных, таких как составление соответствующих таблиц (см. 11.2.1) или графиков, схем, диаграмм и гистограмм (см. 11.2.1);
h) выводы, сделанные в ходе обсуждения полученных результатов биотеста.
Приложение А
(справочное)
Виды и сорта растений, приемлемые для использования в биотесте
В таблице А.1 приведен перечень видов и сортов растений, которые выращивали при проведении биотеста, следуя экспериментальной методике, которая была в некоторой степени модифицирована по сравнению с методикой, описанной в настоящем стандарте.
Таблица А.1 - Виды и сорта растений, приемлемые для использования в биотесте
Вид растения | Сорт растения | Микро- | Эксперимен- | Результат наблюдений | Примени- | Номер, ссылка |
Brassica napus | Duo | Побеги легко повреждаются при манипуляциях | + | [21] | ||
As, Cd, Cu, Pb, Zn | 2 | [23] | ||||
Cu | 3 | [24] | ||||
137Cs, 63Ni | 4 | [28] | ||||
Brassica oleracea | Castelard | As, Cd, Cu, Pb, Zn | 1 | - | ++ | [21] |
Bromus mollis | Samson | 137Cs | 4 | - | ++ | [25] |
Festuca arundinacea | Calina | As, Cd, Cu, Pb, Zn | 1 | - | ++ | [21] |
Festuca ovina | Spartan | 137Cs, 63Ni | 4 | - | ++ | [24] |
Festuca rubra | Bastide | 63Ni | 4 | - | ++ | [24] |
Hordeum vulgare | Campanile | As, Cd, Cu, Pb, Zn | 2 | Корневая система имеет слишком большую толщину | + | [21] |
Vertige | 137Cs | 4 | [25] | |||
Lactuca sativa capitata | Carmen | As, Cd, Cu, Pb, Zn | 2 | Побеги легко повреждаются при манипуляциях | + | [21] |
Sucrine | 137Cs | 4 | [25] | |||
Lolium perene | Oustal | As, Cd, Cu, Pb, Zn | 2 | - | ++ | [21] |
Aubisque | 137Cs, 63Ni | 4 | [25] | |||
Lycopersicon esculentumc | Fline | As, Cd, Cu, Pb, Zn | 1 | - | ++ | [21] |
Saint Pierre | Cu | 3 | [26] | |||
Saint Pierre | 137Cs | 4 | [25] | |||
Medicago sativa | Prunelle | As, Cd, Cu, Pb, Zn | 2 | Проблемы с прорастанием и развитием корневой системы | +/- | [21] |
Maya | 137Cs | 4 | [25] | |||
Nicotiana tabacum | SR1 | Zn | 5 | - | ++ | [27] |
Raphanus sativus | Flamboyant | 63Ni | 4 | Проблемы с развитием побегов и корневой системы | - | [24] |
Sorghum bicolour | Arkanciel | As, Cd, Cu, Pb, Zn | 2 | Проблемы, связанные с ломкостью, корневая система имеет слишком большую толщину | + | [21] |
Trifolium pratense | Miskawi | 137Cs, 63Ni | 4 | - | ++ | [24] |
Triticum aestivum | Premio | As, Cd, Cu, Pb, Zn | 2 | Корневая система имеет слишком большую толщину | + | [21] |
Triticum turgidum durum | Acalou | Cu | 3 | Корневая система имеет слишком большую толщину | + | [20] |
| ||||||
ЭМ 4: продолжительность периода предварительного выращивания растений на питательных растворах - 16 сут, продолжительность периода выращивания на пробах почв - 7 сут, толщина слоя почвы 3 мм, оборудование для проведения биотеста немного отличается от используемого в стандартизированной ЭМ; | ||||||
Приложение В
(справочное)
Чертежи различных частей оборудования для биотеста
В.1 Горшок для растения
|
Рисунок В.1 - Часть 1: цилиндр
|
Рисунок В.2 - Часть 2: крепежный обруч
В.2 Оборудование, используемое в течение периода предварительного выращивания растений на питательных растворах
|
Рисунок В.3 - Часть 3: бак
|
Рисунок В.4 - Часть 4: плавающая платформа с отверстиями
В.3 Оборудование, используемое в течение периода выращивания растений на пробах почв
|
Рисунок В.5 - Часть 5: сосуд с завинчивающейся крышкой (на чертеже приведена только крышка)
|
Рисунок В.6 - Часть 6: подложка для пробы почвы (или пробы почвенной массы)
Приложение С
(справочное)
Инструкции по отбору семян и определению требуемого их количества для помещения семян в горшки для различных видов растений, используемых в биотесте в рамках данного метода
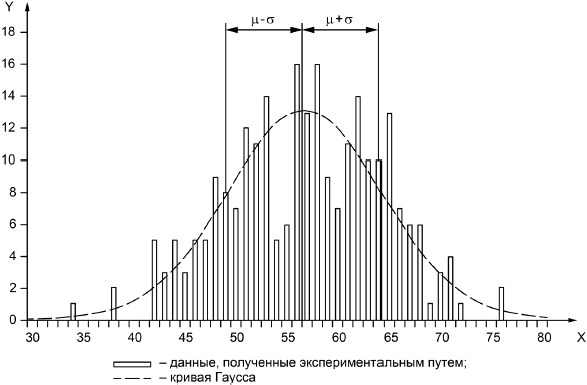
При определении массы семян конкретного растения при помощи точного взвешивания на весах (см. 5.4), т.е. имеющих массу не менее 10 мг, взвешивают приблизительно 100 семян, одно за другим, и составляют частотную гистограмму, после чего устанавливают диапазон масс семян, в пределах которого семена являются приемлемыми для проведения биотеста (см. рисунок С.1). Таким образом, требуемое количество семян можно отобрать исходя из их массы.
|
Обозначения:
=57 мг;
=8 мг;
=250;
по оси х - количество семян;
по оси у - масса отдельных семян, мг.
Рисунок С.1 - Частотная гистограмма распределения масс семян твердой пшеницы (сорт Acalou)
Семена, приемлемые для использования в биотесте, расположены в диапазоне от ![]() до
до ![]() .
.
В случае, когда масса семян менее 10 мг и когда нет возможности проводить точное взвешивание каждого семени, масса количества семян, которое необходимо поместить в один горшок, будет иметь существенный разброс значений (см. таблицу С.1). Для удобства допускается использовать устройство для подсчета семян. В качестве альтернативы, для каждого вида растения сначала определяют массу семян, которая соответствует количеству семян, необходимому для помещения в один горшок. Затем соответствующую массу семян взвешивают и помещают семена в горшок.
Таблица С.1 - Количество семян, помещаемое в один горшок
Наименование вида растения | Наименование сорта растения | Количество семян на один горшок |
Brassica napus | Duo | 25 |
Brassica oleracea | Castelard | 50 |
Festuca arundinacea | Calina | 80 |
Hordeum vulgare | Campanile | 5 |
Lactuca sativa capitata | Carmen | 50 |
Lolium perenne | Oustal | 40 |
Lycopersicon esculentum | Fline | 40 |
Medicago sativa | Prunelle | 60 |
Sorghum bicolour | Arkanciel | 5 |
Triticum aestivum | Premio | 2 |
| ||
При изменении размеров дна горшка количество или массу помещаемых в горшок семян изменяют пропорционально.
Приложение D
(справочное)
Минерализация и анализ проб растений
D.1 Пример методики минерализации проб растений
Ниже приведена методика, которую использовали в процессе различных этапов валидации стандартизированного биотеста и которая приемлема для минерализации широкого спектра проб растений, а также для определения концентраций кадмия, кобальта, хрома, меди, никеля, свинца и цинка. При ее применении происходит испарение некоторого количества мышьяка и других летучих микроэлементов из проб, в результате чего можно лишь приблизительно оценить их концентрации в пробах. Для точного определения концентраций данных микроэлементов используют другие методы минерализации.
Ниже перечислены этапы методики минерализации.
Этап 1: Взвешивают 500 мг пробы растения, предварительно высушенной в сушильном шкафу и измельченной (или разрезанной на мелкие кусочки) и помещают в платиновый тигель. Пробу прокаливают в печи при температуре 500°С в течение 2 ч.
Этап 2: Тигель охлаждают, образовавшуюся золу смачивают несколькими каплями воды ультравысокой степени очистки (с электропроводностью 1820 мкСм/м), добавляют 2 см соляной кислоты молярной концентрацией 6 моль/дм
, кипятят на электроплитке до полного испарения жидкости. Добавляют 2 см
того же раствора соляной кислоты и через 10 мин фильтруют через беззольную фильтровальную бумагу в мерную колбу вместимостью 50 см
. Осадок минерализата на фильтре смывают в мерную колбу теплой водой ультравысокой степени очистки объемом приблизительно 25 см
.
Этап 3: Фильтр с осадком минерализата помещают в платиновый тигель и прокаливают в печи при температуре 500°С в течение 30 мин для удаления остатков органических веществ и самого фильтра. После охлаждения добавляют несколько капель воды ультравысокой степени очистки и 2 см концентрированной плавиковой кислоты и кипятят раствор на электроплитке до полного испарения жидкости (в ходе данного этапа происходит удаление диоксида кремния путем его растворения в плавиковой кислоте и испарения образовавшегося гексафторида кремния).
Этап 4: К осадку добавляют 1 см указанного выше раствора соляной кислоты, фильтруют раствор через беззольную фильтровальную бумагу и промывают фильтр определенным количеством воды ультравысокой степени очистки, смывая осадок с фильтра в ту же мерную колбу, которую использовали при проведении этапа 2. Объем в мерной колбе доводят до метки водой ультравысокой степени очистки.
После завершения этапа 4 минерализат пробы растения готов для определения концентраций микроэлементов в минерализатах.
D.2 Установленные диапазоны концентраций микроэлементов в минерализатах проб растений
Диапазоны концентраций микроэлементов в минерализатах проб растений определяли в рамках межлабораторного сравнительного испытания проб растений, отобранных при завершении периода предварительного выращивания растений на питательных растворах (контрольных растений), а также при завершении периода выращивания растений на пробах почв. Данные диапазоны приведены в таблице D.1.
Таблица D.1 - Установленные диапазоны концентраций микроэлементов в минерализатах проб растений
Наименование вида растения | Диапазоны концентраций различных микроэлементов, в микрограммах на грамм сухой биомассы | ||||||||
As | Cd | Со | Cr | Cu | Ni | Pb | Zn | ||
В. oleracea | побеги | 0,007- | 0,020- | 0,02- | 0,2- | 2,2- | 0,4-11 | 0 | 18-348 |
корневая система | 0,09- | 0,01- | 0,14- | 1,6- | 37-512 | 2-57 | 0 | 43-1336 | |
F. arundinacea | побеги | 0,003- | 0,01-30 | 0,01- | 0,19- | 2,8-22 | 0,45- | 0 | 11,5-247 |
корневая система | 0,04- | 0,015- | 0,1-9 | 1,5- | 7-345 | 2,1-96 | 0 | 32-2060 | |
L. esculentum | побеги | 0,001- | 0,004- | 0,009- | 0,15- | 0,65- | 0,17-22 | 0 | 2,5-280 |
корневая система | 0,15- | 0,05- | 0,13-20 | 1,4- | 9,2- | 2,4-105 | 0 | 5-2270 | |
| |||||||||
Подробная информация об экспериментальной методике данного испытания приведена в приложении F (см. F.1).
Приложение Е
(справочное)
Установленные диапазоны биомасс контрольных растений и масс микроэлементов в контрольных растениях
При проведении межлабораторного сравнительного испытания проб растений, отобранных при завершении периода предварительного выращивания растений на питательных растворах (контрольных растений), были установлены диапазоны биомасс и масс микроэлементов, приведенные в таблицах Е.1 и Е.2. Подробная информация, касающаяся экспериментальной методики данного испытания, приведена в приложении F (см. F.1). Данные результаты были получены при использовании оборудования, описанного в настоящем стандарте (см. 7.2 и приложение В).
Необходимо учитывать, что изменение размеров определенных компонентов используемого оборудования может повлиять на результаты измерений.
Таблица Е.1 - Установленные диапазоны биомасс контрольных растений
Наименование вида растения и количество его проб, | Диапазоны биомасс контрольных растений (биомасса выражена в миллиграммах) | ||
Побеги | Корневая система | Целое растение | |
В. oleracea, | 69-441 | 16-112 | 120-553 |
F. arundinacea, | 56-214 | 32-207 | 137-403 |
L. esculentum, | 79-558 | 14-106 | 120-639 |
Таблица Е.2 - Установленные диапазоны масс следовых элементов, аккумулированных контрольными растениями (в скобках приведено количество соответствующих измерений в каждом случае)
Наименова- | Диапазоны масс микроэлементов; значения выражены в микрограммах | |||||||
As | Cd | Со | Cr | Cu | Ni | Pb | Zn | |
В. oleracea | 0,01-0,09 | 0,007-0,229 | 0,03-0,15 | 0,5-1,0 | 3,5-22,8 | 0,5-1,8 | 0,02-3,56 | 9,8-33,4 |
F. arundinacea | 0,006-0,069 | 0,004-0,371 | 0,02-0,13 | 0,48-0,95 | 2,0-8,3 | 0,5-1,7 | 0,02-12,12 | 6,0-24,7 |
L. esculentum | 0,01-0,11 | 0,0-0,43 | 0,02-0,12 | 0,5-1,1 | 2,5-7,5 | 0,4-1,5 | 0,02-9,03 | 9,2-35,8 |
Приложение F
(справочное)
Межлабораторное сравнительное испытание
F.1 Материалы и методология, используемые при проведении межлабораторного сравнительного испытания
Межлабораторное сравнительное испытание проводили с февраля по май 2012 г. В нем принимали участие восемь лабораторий, шесть из которых ранее никогда не проводили биотест:
1 - UPR Recyclage et risque, Франция;
2 - INERIS, Франция;
3 - INRA, UMR Eco&Sols, Франция;
4 - Institute for ecological chemistry, plant analysis and stored product protection, Германия;
5 - Eurofins IPL Est, Laboratoires Etudes et Expertises, Ecotoxicologie, Франция;
6 - Free university of Bolzano, University of Udine, Италия;
7 - University of ![]() Agro-Bio Tech,
Agro-Bio Tech, de Science du sol, Бельгия;
8 - University of natural resources and life sciences, Rhizosphere Ecology and Biogeochemistry Group, Австрия.
Перед проведением данного испытания каждая лаборатория проходила трехдневную подготовку, включающую как теоретические, так и практические аспекты, касающиеся оборудования для проведения биотеста и соответствующей экспериментальной методики. После этого каждая лаборатория получала данное оборудование, а также семена и пробы почв для их использования в испытании.
Каждая лаборатория, независимо и параллельно с другими, проводила выращивание трех рекомендованных видов растений (B. oleracea, F. arundinacea и L. esculentum) на четырех видах почв в соответствии с методикой настоящего стандарта. Пробы почв обладали значительным разнообразием физико-химических характеристик и были значительно загрязнены различными следовыми элементами (см. таблицу F.1).
Таблица F.1 - Основные физико-химические характеристики почв, используемых при проведении межлабораторного сравнительного испытания
N поч- | Концентрации различных компонентов почв | ||||||||||||
Песок | Ил | Гли- | рН |
|
| As | Cd | Cr | Cu | Ni | Pb | Zn | |
1 | 740 | 102 | 158 | 7,7 | 66 | 13 | 14 | 1,7 | 90 | 98 | 32 | 163 | 432 |
2 | 561 | 322 | 117 | 6,2 | не определена | 13 | 24 | 0,5 | 33 | 453 | 14 | 215 | 74 |
3 | 550 | 337 | 113 | 5,9 | не определена | 25 | 10 | 4,2 | 38 | 24 | 12 | 590 | 429 |
4 | 527 | 311 | 162 | 6,7 | 6 | 41 | 203 | 100 | 109 | 388 | 131 | 131340 | 1172 |
| |||||||||||||
Проба 1 была отобрана с верхнего слоя сельскохозяйственной почвы, содержащей большое количество извести и загрязненной кадмием, медью, свинцом и цинком из-за неоднократного пропитывания почвы сточными водами Парижа в течение нескольких десятилетий. Проба 2 была отобрана с верхнего слоя достаточно кислой почвы в винограднике, загрязненной медью в результате неоднократной обработки медьсодержащими фунгицидами. Проба 3 была отобрана с верхнего слоя кислой сельскохозяйственной почвы, загрязненной медью, свинцом и цинком в результате впитывания оседающих атмосферных выбросов плавильного завода. Проба 4 была отобрана с верхнего слоя почвы, сильно загрязненной мышьяком, кадмием, хромом, медью, никелем, свинцом и цинком главным образом в результате впитывания оседающих атмосферных выбросов завода по переработке аккумуляторов.
При проведении испытания в одной лаборатории процесс выращивания В. oleracea был нарушен, в результате чего не удалось получить приемлемые пробы данного растения. По этой причине только семь лабораторий представили свои результаты для данного вида растения, и все восемь лабораторий представили свои результаты для видов F. arundinacea и L. esculentum.
В каждой лаборатории проводили высушивание проб растений (побегов и корневых систем по отдельности) в сушильном шкафу, после чего пробы доставляли в CIRAD at Montpellier (Франция) для определения их биомассы и для проведения их минерализации (см. приложение D). Концентрации следовых элементов в минерализатах проб определяли методом массовой спектрометрии с индуктивно связанной плазмой.
F.2 Результаты межлабораторного сравнительного испытания и их интерпретация
При отборе побегов и корневой системы растений по отдельности проводилась статистическая обработка полученных в каждой лаборатории значений концентраций микроэлементов в побегах и в корнях, а также значений интенсивности биодоступности растениями микроэлементов, которые были вычислены по формулам (2) и (3) (см. 11.1). Все полученные данные для трех используемых видов растений, четырех видов почв и восьми определяемых микроэлементов сведены в таблицы F.2-F.10.
Для порядка 3680 значений, полученных для каждой конечной точки биологической доступности, количество выбросов в процентном выражении составляло 5%, 10% и 10% для значения интенсивности биодоступности, значений концентраций микроэлементов в корнях и побегах соответственно. Для значения интенсивности биодоступности процент выброса был вдвое ниже, чем для значений концентраций в корнях и побегах. Кроме того, значения выбросов не зависят от конкретной лаборатории, почвы или микроэлемента. Эти результаты одновременно указывают на то, что периодические выбросы не имеют особого влияния на значения повторяемости и воспроизводимости.
Среднеарифметическое значение коэффициентов вариаций для значений концентраций микроэлементов в корнях и побегах, а также для значений интенсивности биодоступности располагаются в диапазоне между 22-32% для повторяемости и 47-61% для воспроизводимости. Самые высокие значения коэффициентов вариации наблюдались только для одного микроэлемента, а именно, свинца (Pb). Более высокая вариабельность значений для Pb связана с аналитической проблемой, поскольку самые низкие концентрации Pb в минерализатах растений были ниже, чем те же концентрации в холостых пробах (см. приложение D.2).
В конечном итоге классификация четырех почв была установлена для каждой лаборатории в условиях объединения значений интенсивности биодоступности восьми микроэлементов в трех разновидностях растений. Данный результат служит примером способности биотеста различать биологическую доступность микроэлементов почвы для растений в разных образцах анализируемой почвы.
Таблица F.2 - Данные статистической обработки значений концентраций микроэлементов в побегах растения В. oleracea
Элемент | |||||||||
Почва 1 | |||||||||
As | 7 | 35 | 0 | 0,12 | 0,04 | 37 | 0,06 | 50 | |
Cd | 6 | 35 | 5 | 14 | 0,5 | 0,1 | 19 | 0,3 | 63 |
Со | 5 | 35 | 10 | 29 | 0,06 | 0,02 | 32 | 0,02 | 40 |
Cr | 6 | 35 | 5 | 14 | 0,5 | 0,1 | 21 | 0,2 | 36 |
Cu | 7 | 35 | 0 | 8,0 | 2,6 | 33 | 3,6 | 45 | |
Ni | 7 | 35 | 0 | 1,3 | 0,5 | 34 | 0,8 | 61 | |
Pb | 6 | 35 | 5 | 14 | 1,9 | 0,9 | 44 | 2,1 | 109 |
Zn | 6 | 35 | 5 | 14 | 36 | 4 | 11 | 8 | 22 |
Почва 2 | |||||||||
As | 7 | 35 | 0,04 | 0,01 | 28 | 0,03 | 61 | ||
Cd | 6 | 35 | 5 | 14 | 0,14 | 0,03 | 23 | 0,05 | 35 |
Со | 6 | 35 | 5 | 14 | 0,4 | 0,2 | 52 | 0,2 | 62 |
Cr | 6 | 35 | 5 | 14 | 0,47 | 0,09 | 20 | 0,13 | 27 |
Cu | 7 | 35 | 23 | 3 | 14 | 8 | 33 | ||
Ni | 5 | 35 | 10 | 29 | 1,0 | 0,2 | 19 | 0,2 | 22 |
Pb | 6 | 35 | 5 | 14 | 1,0 | 0,7 | 71 | 1,0 | 97 |
Zn | 7 | 35 | 44 | 7 | 17 | 18 | 42 | ||
Почва 3 | |||||||||
As | 6 | 35 | 5 | 14 | 0,04 | 0,01 | 25 | 0,02 | 49 |
Cd | 7 | 35 | 2,1 | 0,3 | 15 | 0,7 | 34 | ||
Co | 6 | 35 | 5 | 14 | 0,8 | 0,1 | 16 | 0,4 | 49 |
Cr | 6 | 35 | 5 | 14 | 0,7 | 0,2 | 22 | 0,6 | 81 |
Cu | 7 | 35 | 5,1 | 1,1 | 22 | 2,3 | 45 | ||
Ni | 6 | 35 | 5 | 14 | 1,0 | 0,2 | 23 | 0,6 | 58 |
Pb | 7 | 35 | 1,1 | 1,3 | 114 | 1,4 | 129 | ||
Zn | 7 | 35 | 243 | 28 | 11 | 72 | 30 | ||
Почва 4 | |||||||||
As | 7 | 35 | 0,06 | 0,04 | 66 | 0,05 | 88 | ||
Cd | 6 | 35 | 5 | 14 | 40 | 6 | 14 | 10 | 24 |
Co | 6 | 35 | 5 | 14 | 0,28 | 0,05 | 18 | 0,07 | 24 |
Cr | 7 | 35 | 0,7 | 0,2 | 23 | 0,5 | 71 | ||
Cu | 6 | 35 | 5 | 14 | 8 | 2 | 19 | 2 | 21 |
Ni | 7 | 35 | 7 | 1 | 20 | 2 | 25 | ||
Pb | 7 | 35 | 111 | 40 | 36 | 56 | 50 | ||
Zn | 7 | 35 | 100 | 17 | 18 | 25 | 25 | ||
| |||||||||
Таблица F.3 - Данные статистической обработки значений концентраций микроэлементов в корневой системе растения В. oleracea
Элемент | |||||||||
Почва 1 | |||||||||
As | 7 | 35 | * | 5 | 1 | 23 | 1 | 27 | |
Cd | 6 | 35 | 5 | 14 | 1,4 | 0,3 | 19 | 0,7 | 51 |
Со | 6 | 35 | 5 | 14 | 0,8 | 0,2 | 22 | 0,2 | 22 |
Cr | 7 | 35 | 9 | 3 | 39 | 3 | 40 | ||
Cu | 7 | 35 | 117 | 38 | 32 | 58 | 49 | ||
Ni | 7 | 35 | 7 | 2 | 29 | 2 | 32 | ||
Pb | 7 | 35 | 31 | 11 | 36 | 20 | 65 | ||
Zn | 7 | 35 | 112 | 26 | 24 | 32 | 29 | ||
Почва 2 | |||||||||
As | 5 | 35 | 10 | 29 | 2,7 | 0,5 | 17 | 0,5 | 18 |
Cd | 6 | 35 | 5 | 14 | 0,56 | 0,08 | 15 | 0,18 | 32 |
Со | 7 | 35 | 4 | 2 | 40 | 3 | 59 | ||
Cr | 6 | 35 | 5 | 14 | 4,2 | 0,8 | 19 | 1,8 | 43 |
Cu | 6 | 35 | 5 | 14 | 237 | 32 | 13 | 81 | 34 |
Ni | 7 | 35 | 6 | 1 | 19 | 2 | 32 | ||
Pb | 7 | 35 | 14 | 7 | 46 | 7 | 48 | ||
Zn | 7 | 35 | 83 | 21 | 26 | 26 | 32 | ||
Почва 3 | |||||||||
As | 7 | 35 | 3,0 | 0,5 | 15 | 1,5 | 49 | ||
Cd | 7 | 35 | 12 | 2 | 19 | 5 | 40 | ||
Co | 7 | 35 | 9 | 2 | 17 | 5 | 53 | ||
Cr | 7 | 35 | 8 | 1 | 18 | 2 | 23 | ||
Cu | 5 | 35 | 10 | 29 | 255 | 61 | 24 | 383 | 150 |
Ni | 7 | 35 | 5,7 | 0,8 | 14 | 3,1 | 54 | ||
Pb | 7 | 35 | 27 | 9 | 32 | 11 | 40 | ||
Zn | 7 | 35 | 746 | 110 | 15 | 256 | 34 | ||
Почва 4 | |||||||||
As | 7 | 35 | 11 | 4 | 39 | 6 | 55 | ||
Cd | 6 | 35 | 5 | 14 | 156 | 32 | 21 | 52 | 33 |
Co | 6 | 35 | 5 | 14 | 3,4 | 0,5 | 14 | 0,9 | 26 |
Cr | 7 | 35 | 6 | 2 | 41 | 3 | 59 | ||
Cu | 6 | 35 | 5 | 14 | 101 | 15 | 15 | 22 | 22 |
Ni | 6 | 35 | 5 | 14 | 41 | 6 | 15 | 9 | 21 |
Pb | 7 | 35 | 6805 | 1538 | 23 | 2150 | 32 | ||
Zn | 6 | 35 | 5 | 14 | 386 | 48 | 12 | 72 | 19 |
| |||||||||
Таблица F.4 - Данные статистической обработки значений интенсивности биодоступности микроэлементов растением В. oleracea
Элемент | |||||||||
Почва 1 | |||||||||
As | 6 | 35 | 5 | 14 | 0,9 | 0,2 | 27 | 0,4 | 41 |
Cd | 7 | 35 | * | 0,6 | 0,1 | 21 | 0,2 | 39 | |
Со | 5 | 35 | 10 | 29 | 0,16 | 0,06 | 35 | 0,08 | 49 |
Cr | 7 | 35 | 1,5 | 0,9 | 61 | 1,2 | 75 | ||
Cu | 7 | 35 | 14 | 5 | 36 | 8 | 57 | ||
Ni | 7 | 35 | 1,5 | 0,6 | 43 | 0,8 | 57 | ||
Pb | 5 | 35 | 5 | 2 | 39 | 5 | 95 | ||
Zn | 7 | 35 | 32 | 12 | 37 | 17 | 52 | ||
Почва 2 | |||||||||
As | 7 | 35 | 0,6 | 0,2 | 36 | 0,2 | 42 | ||
Cd | 6 | 35 | 5 | 14 | 0,14 | 0,04 | 26 | 0,06 | 39 |
Со | 7 | 35 | 1,1 | 0,5 | 43 | 0,8 | 70 | ||
Cr | 7 | 35 | 0,5 | 0,3 | 52 | 0,3 | 64 | ||
Cu | 6 | 35 | 5 | 14 | 41 | 6 | 16 | 11 | 27 |
Ni | 6 | 35 | 5 | 14 | 1,1 | 0,4 | 31 | 0,5 | 47 |
Pb | 5 | 35 | 2 | 1 | 71 | 2 | 104 | ||
Zn | 7 | 35 | 26 | 8 | 32 | 11 | 43 | ||
Почва 3 | |||||||||
As | 5 | 35 | 5 | 14 | 0,59 | 0,08 | 14 | 0,10 | 17 |
Cd | 7 | 35 | 3,6 | 0,4 | 11 | 0,9 | 26 | ||
Co | 7 | 35 | 2,1 | 0,5 | 23 | 1,0 | 47 | ||
Cr | 7 | 35 | 1,1 | 0,4 | 32 | 0,6 | 52 | ||
Cu | 6 | 35 | 5 | 14 | 7 | 2 | 26 | 4 | 59 |
Ni | 7 | 35 | 1,1 | 0,3 | 25 | 0,4 | 36 | ||
Pb | 5 | 35 | 4 | 2 | 48 | 4 | 114 | ||
Zn | 7 | 35 | 305 | 43 | 14 | 99 | 32 | ||
Почва 4 | |||||||||
As | 7 | 35 | 2 | 1 | 43 | 2 | 64 | ||
Cd | 6 | 35 | 5 | 14 | 60 | 9 | 15 | 20 | 32 |
Co | 7 | 35 | 0,9 | 0,2 | 17 | 0,3 | 30 | ||
Cr | 7 | 35 | 0,8 | 0,4 | 55 | 0,5 | 68 | ||
Cu | 7 | 35 | 16 | 3 | 21 | 6 | 40 | ||
Ni | 6 | 35 | 5 | 14 | 13 | 2 | 15 | 5 | 35 |
Pb | 5 | 35 | 1178 | 331 | 28 | 1040 | 88 | ||
Zn | 6 | 35 | 5 | 14 | 127 | 18 | 14 | 45 | 35 |
мкг/г | |||||||||
Таблица F.5 - Данные статистической обработки значений концентраций микроэлементов в побегах растения F. arundinacea
Элемент | |||||||||
Почва 1 | |||||||||
As | 8 | 40 | * | 0,13 | 0,03 | 22 | 0,03 | 26 | |
Cd | 8 | 40 | 0,3 | 0,1 | 30 | 0,2 | 53 | ||
Со | 7 | 40 | 5 | 13 | 0,05 | 0,02 | 33 | 0,02 | 49 |
Cr | 8 | 40 | 0,9 | 0,2 | 20 | 0,5 | 59 | ||
Cu | 7 | 40 | 5 | 13 | 10,2 | 0,6 | 6 | 3,4 | 33 |
Ni | 6 | 40 | 10 | 25 | 1,6 | 0,2 | 12 | 0,9 | 57 |
Pb | 7 | 40 | 5 | 13 | 1,2 | 1,1 | 95 | 1,4 | 118 |
Zn | 8 | 40 | 60 | 6 | 9 | 22 | 37 | ||
Почва 2 | |||||||||
As | 6 | 40 | 10 | 25 | 0,07 | 0,01 | 18 | 0,03 | 42 |
Cd | 6 | 40 | 10 | 25 | 0,2 | 0,1 | 41 | 0,1 | 62 |
Со | 6 | 40 | 10 | 25 | 0,4 | 0,1 | 35 | 0,2 | 51 |
Cr | 6 | 40 | 10 | 25 | 1,0 | 0,2 | 21 | 0,7 | 64 |
Cu | 7 | 40 | 5 | 13 | 13 | 1 | 10 | 5 | 35 |
Ni | 8 | 40 | 1,9 | 0,6 | 30 | 1,3 | 65 | ||
Pb | 5 | 40 | 15 | 38 | 0,8 | 0,4 | 52 | 0,5 | 61 |
Zn | 8 | 40 | 49 | 12 | 25 | 25 | 51 | ||
Почва 3 | |||||||||
As | 6 | 40 | 10 | 25 | 0,07 | 0,01 | 17 | 0,02 | 33 |
Cd | 8 | 40 | 1,2 | 0,2 | 15 | 0,7 | 57 | ||
Co | 8 | 40 | 0,7 | 0,2 | 27 | 0,4 | 58 | ||
Cr | 8 | 40 | 0,9 | 0,2 | 17 | 0,5 | 57 | ||
Cu | 7 | 40 | 5 | 13 | 9 | 1 | 12 | 3 | 40 |
Ni | 8 | 40 | 1,5 | 0,3 | 18 | 0,8 | 53 | ||
Pb | 6 | 40 | 5 | 13 | 1,4 | 2,1 | 153 | 2,3 | 169 |
Zn | 8 | 40 | 161 | 19 | 12 | 57 | 35 | ||
Почва 4 | |||||||||
As | 7 | 40 | 5 | 13 | 0,07 | 0,03 | 35 | 0,03 | 44 |
Cd | 7 | 40 | 5 | 13 | 14 | 1 | 9 | 5 | 34 |
Co | 6 | 40 | 10 | 25 | 0,23 | 0,03 | 14 | 0,11 | 46 |
Cr | 7 | 40 | 5 | 13 | 1,0 | 0,2 | 16 | 0,5 | 51 |
Cu | 8 | 40 | 11,2 | 0,8 | 7 | 2,4 | 21 | ||
Ni | 6 | 40 | 10 | 25 | 5,8 | 0,6 | 10 | 2,6 | 45 |
Pb | 7 | 40 | 5 | 13 | 60 | 10 | 17 | 13 | 22 |
Zn | 8 | 40 | 108 | 10 | 9 | 26 | 24 | ||
| |||||||||
Таблица F.6 - Данные статистической обработки значений концентраций микроэлементов в корневой системе растения F. arundinacea
Элемент | |||||||||
Почва 1 | |||||||||
As | 8 | 40 | * | 2,5 | 0,6 | 22 | 0,7 | 26 | |
Cd | 7 | 40 | 5 | 13 | 2,2 | 0,4 | 20 | 0,6 | 28 |
Со | 8 | 40 | 0,5 | 0,2 | 29 | 0,2 | 34 | ||
Cr | 8 | 40 | 8 | 2 | 26 | 2 | 32 | ||
Cu | 7 | 40 | 5 | 13 | 53 | 8 | 15 | 23 | 44 |
Ni | 7 | 40 | 5 | 13 | 6,1 | 0,9 | 14 | 1,4 | 23 |
Pb | 8 | 40 | 22 | 6 | 28 | 7 | 32 | ||
Zn | 8 | 40 | 111 | 22 | 20 | 26 | 24 | ||
Почва 2 | |||||||||
As | 8 | 40 | 1,6 | 0,4 | 23 | 0,4 | 26 | ||
Cd | 7 | 40 | 5 | 13 | 0,6 | 0,1 | 16 | 0,2 | 35 |
Со | 6 | 40 | 10 | 25 | 2,6 | 1,0 | 38 | 1,3 | 48 |
Cr | 7 | 40 | 5 | 13 | 3 | 1 | 32 | 1 | 38 |
Cu | 8 | 40 | 228 | 63 | 28 | 111 | 49 | ||
Ni | 7 | 40 | 5 | 13 | 4,9 | 0,9 | 18 | 2,4 | 49 |
Pb | 6 | 40 | 10 | 25 | 9 | 2 | 25 | 3 | 35 |
Zn | 8 | 40 | 69 | 22 | 32 | 42 | 60 | ||
Почва 3 | |||||||||
As | 7 | 40 | 5 | 13 | 1,5 | 0,2 | 13 | 0,3 | 23 |
Cd | 8 | 40 | 8,6 | 0,9 | 11 | 4,0 | 47 | ||
Co | 8 | 40 | 5,9 | 0,9 | 15 | 1,8 | 30 | ||
Cr | 8 | 40 | 5 | 1 | 27 | 2 | 38 | ||
Cu | 8 | 40 | 16 | 4 | 23 | 8 | 50 | ||
Ni | 7 | 40 | 5 | 13 | 4,2 | 0,6 | 13 | 1,5 | 35 |
Pb | 8 | 40 | 18 | 5 | 30 | 11 | 61 | ||
Zn | 6 | 40 | 10 | 25 | 434 | 57 | 13 | 116 | 27 |
Почва 4 | |||||||||
As | 8 | 40 | 12 | 3 | 27 | 5 | 45 | ||
Cd | 6 | 40 | 10 | 25 | 155 | 13 | 8 | 46 | 29 |
Co | 7 | 40 | 5 | 13 | 3,0 | 0,5 | 16 | 0,8 | 25 |
Cr | 8 | 40 | 5 | 1 | 21 | 2 | 40 | ||
Cu | 6 | 40 | 10 | 25 | 98 | 17 | 17 | 35 | 36 |
Ni | 8 | 40 | 48 | 10 | 21 | 18 | 38 | ||
Pb | 8 | 40 | 5575 | 1083 | 19 | 2010 | 36 | ||
Zn | 5 | 40 | 15 | 38 | 265 | 17 | 6 | 42 | 16 |
| |||||||||
Таблица F.7 - Данные статистической обработки значений интенсивности накопления микроэлементов растением F. arundinacea
Элемент | |||||||||
Почва 1 | |||||||||
As | 8 | 40 | * | 0,8 | 0,2 | 25 | 0,4 | 50 | |
Cd | 8 | 40 | 0,7 | 0,2 | 27 | 0,3 | 36 | ||
Со | 7 | 40 | 5 | 13 | 0,13 | 0,03 | 24 | 0,07 | 51 |
Cr | 7 | 40 | 5 | 13 | 1,7 | 0,5 | 27 | 0,9 | 53 |
Cu | 7 | 40 | 5 | 13 | 15 | 3 | 18 | 4 | 25 |
Ni | 6 | 40 | 10 | 25 | 1,7 | 0,2 | 14 | 0,6 | 33 |
Pb | 6 | 40 | 4 | 2 | 44 | 5 | 136 | ||
Zn | 8 | 40 | 44 | 8 | 19 | 14 | 31 | ||
Почва 2 | |||||||||
As | 8 | 40 | 0,5 | 0,1 | 25 | 0,3 | 51 | ||
Cd | 5 | 40 | 15 | 38 | 0,18 | 0,03 | 15 | 0,09 | 50 |
Со | 8 | 40 | 1,1 | 0,5 | 40 | 0,7 | 57 | ||
Cr | 8 | 40 | 0,7 | 0,3 | 51 | 0,5 | 69 | ||
Cu | 8 | 40 | 61 | 14 | 23 | 21 | 35 | ||
Ni | 8 | 40 | 1,2 | 0,3 | 26 | 0,4 | 36 | ||
Pb | 6 | 40 | 0,5 | 1,0 | 207 | 3,0 | 618 | ||
Zn | 8 | 40 | 21 | 6 | 27 | 8 | 41 | ||
Почва 3 | |||||||||
As | 8 | 40 | 0,5 | 0,1 | 24 | 0,2 | 43 | ||
Cd | 8 | 40 | 2,7 | 0,3 | 11 | 0,6 | 23 | ||
Co | 8 | 40 | 1,8 | 0,3 | 15 | 0,4 | 21 | ||
Cr | 8 | 40 | 1,0 | 0,4 | 45 | 0,6 | 63 | ||
Cu | 7 | 40 | 5 | 13 | 3 | 1 | 38 | 2,0 | 65 |
Ni | 8 | 40 | 1,0 | 0,3 | 26 | 0,4 | 40 | ||
Pb | 6 | 40 | 3 | 2 | 67 | 5 | 184 | ||
Zn | 8 | 40 | 223 | 33 | 15 | 66 | 29 | ||
Почва 4 | |||||||||
As | 8 | 40 | 3,3 | 1,0 | 29 | 1,8 | 54 | ||
Cd | 8 | 40 | 51 | 5 | 10 | 9 | 17 | ||
Co | 7 | 40 | 5 | 13 | 0,9 | 0,1 | 11 | 0,3 | 27 |
Cr | 8 | 40 | 1,2 | 0,4 | 34 | 0,6 | 52 | ||
Cu | 8 | 40 | 31 | 7 | 23 | 13 | 43 | ||
Ni | 8 | 40 | 15 | 2 | 16 | 4 | 28 | ||
Pb | 6 | 40 | 1143 | 274 | 24 | 938 | 82 | ||
Zn | 7 | 40 | 5 | 13 | 120 | 12 | 10 | 34 | 28 |
| |||||||||
Таблица F.8 - Данные статистической обработки значений концентраций микроэлементов в побегах растения L. esculentum
Элемент | |||||||||
Почва 1 | |||||||||
As | 7 | 40 | 5 | 13 | 0,05 | 0,02 | 30 | 0,02 | 48 |
Cd | 7 | 40 | 5 | 13 | 0,36 | 0,07 | 18 | 0,25 | 70 |
Со | 6 | 40 | 10 | 25 | 0,05 | 0,01 | 21 | 0,04 | 75 |
Cr | 7 | 40 | 5 | 13 | 0,6 | 0,2 | 25 | 0,5 | 77 |
Cu | 7 | 40 | 5 | 13 | 8,2 | 0,7 | 8 | 3,1 | 38 |
Ni | 8 | 40 | * | 1,2 | 0,3 | 26 | 0,7 | 62 | |
Pb | 6 | 40 | 10 | 25 | 1,7 | 0,6 | 36 | 1,4 | 84 |
Zn | 8 | 40 | 38 | 4 | 9 | 15 | 40 | ||
Почва 2 | |||||||||
As | 8 | 40 | 0,04 | 0,01 | 38 | 0,02 | 54 | ||
Cd | 7 | 40 | 5 | 13 | 0,15 | 0,03 | 18 | 0,06 | 42 |
Со | 8 | 40 | 0,5 | 0,1 | 26 | 0,4 | 71 | ||
Cr | 7 | 40 | 5 | 13 | 0,7 | 0,1 | 15 | 0,5 | 70 |
Cu | 8 | 40 | 14,1 | 1,0 | 7 | 3,7 | 26 | ||
Ni | 8 | 40 | 1,4 | 0,2 | 15 | 0,6 | 46 | ||
Pb | 6 | 40 | 5 | 13 | 0,6 | 0,3 | 54 | 0,6 | 96 |
Zn | 8 | 40 | 41 | 5 | 11 | 15 | 37 | ||
Почва 3 | |||||||||
As | 8 | 40 | 0,04 | 0,01 | 35 | 0,02 | 60 | ||
Cd | 8 | 40 | 2,6 | 0,4 | 14 | 1,0 | 38 | ||
Co | 8 | 40 | 0,7 | 0,1 | 16 | 0,3 | 37 | ||
Cr | 5 | 40 | 15 | 38 | 0,39 | 0,06 | 16 | 0,20 | 50 |
Cu | 8 | 40 | 8 | 1 | 16 | 4 | 55 | ||
Ni | 5 | 40 | 15 | 38 | 0,67 | 0,08 | 13 | 0,23 | 34 |
Pb | 6 | 40 | 10 | 25 | 0,9 | 1,2 | 131 | 1,5 | 154 |
Zn | 8 | 40 | 187 | 25 | 13 | 73 | 39 | ||
Почва 4 | |||||||||
As | 5 | 40 | 15 | 38 | 0,03 | 0,02 | 47 | 0,02 | 62 |
Cd | 7 | 40 | 5 | 13 | 26 | 3 | 13 | 8 | 30 |
Co | 7 | 40 | 5 | 13 | 0,29 | 0,04 | 13 | 0,10 | 36 |
Cr | 6 | 40 | 10 | 25 | 0,43 | 0,07 | 16 | 0,30 | 70 |
Cu | 7 | 40 | 5 | 13 | 8,4 | 0,6 | 7 | 3,2 | 39 |
Ni | 8 | 40 | 6,4 | 0,7 | 11 | 2,2 | 34 | ||
Pb | 7 | 40 | 5 | 13 | 244 | 39 | 16 | 88 | 36 |
Zn | 8 | 40 | 83 | 7 | 9 | 26 | 32 | ||
| |||||||||
Таблица F.9 - Данные статистической обработки значений концентраций микроэлементов в корневой системе растения L. esculentum
Элемент | |||||||||
Почва 1 | |||||||||
As | 7 | 40 | 5 | 13 | 0,05 | 0,02 | 30 | 0,02 | 48 |
Cd | 7 | 40 | 5 | 13 | 0,36 | 0,07 | 18 | 0,25 | 70 |
Со | 6 | 40 | 10 | 25 | 0,05 | 0,01 | 21 | 0,04 | 75 |
Cr | 7 | 40 | 5 | 13 | 0,6 | 0,2 | 25 | 0,5 | 77 |
Cu | 7 | 40 | 5 | 13 | 8,2 | 0,7 | 8 | 3,1 | 38 |
Ni | 7 | 40 | 5 | 13 | 1,1 | 0,3 | 30 | 0,7 | 67 |
Pb | 4 | 40 | 20 | 50 | 1,1 | 0,3 | 25 | 0,9 | 79 |
Zn | 8 | 40 | * | 38 | 4 | 9 | 15 | 40 | |
Почва 2 | |||||||||
As | 8 | 40 | 0,03 | 0,01 | 40 | 0,02 | 65 | ||
Cd | 7 | 40 | 5 | 13 | 0,14 | 0,03 | 18 | 0,08 | 57 |
Со | 8 | 40 | 0,5 | 0,1 | 27 | 0,4 | 83 | ||
Cr | 7 | 40 | 0,6 | 0,1 | 15 | 0,5 | 85 | ||
Cu | 7 | 40 | 5 | 13 | 14,4 | 1,0 | 7 | 3,8 | 26 |
Ni | 7 | 40 | 5 | 13 | 1,2 | 0,2 | 13 | 0,6 | 51 |
Pb | 6 | 40 | 10 | 25 | 0,5 | 0,4 | 68 | 0,7 | 137 |
Zn | 8 | 40 | 38 | 4 | 12 | 19 | 51 | ||
Почва 3 | |||||||||
As | 8 | 40 | 0,03 | 0,01 | 37 | 0,02 | 67 | ||
Cd | 8 | 40 | 2,4 | 0,3 | 15 | 1,3 | 56 | ||
Co | 8 | 40 | 0,7 | 0,1 | 16 | 0,4 | 52 | ||
Cr | 5 | 40 | 15 | 38 | 0,39 | 0,06 | 15 | 0,20 | 52 |
Cu | 7 | 40 | 5 | 13 | 8 | 1 | 17 | 4 | 55 |
Ni | 5 | 40 | 15 | 38 | 0,60 | 0,09 | 14 | 0,30 | 51 |
Pb | 6 | 40 | 10 | 25 | 0,6 | 0,6 | 90 | 0,8 | 121 |
Zn | 8 | 40 | 172 | 24 | 14 | 97 | 56 | ||
Почва 4 | |||||||||
As | 5 | 40 | 15 | 38 | 0,03 | 0,01 | 45 | 0,02 | 80 |
Cd | 7 | 40 | 5 | 13 | 23 | 3 | 14 | 12 | 55 |
Co | 7 | 40 | 5 | 13 | 0,26 | 0,04 | 14 | 0,15 | 56 |
Cr | 6 | 40 | 10 | 25 | 0,43 | 0,07 | 16 | 0,30 | 70 |
Cu | 7 | 40 | 5 | 13 | 7,5 | 0,6 | 8 | 4,2 | 56 |
Ni | 8 | 40 | 5,8 | 0,7 | 12 | 3,0 | 52 | ||
Pb | 7 | 40 | 5 | 13 | 214 | 37 | 17 | 127 | 59 |
Zn | 8 | 40 | 76 | 7 | 9 | 38 | 50 | ||
| |||||||||
Таблица F.10 - Данные статистической обработки значений интенсивности накопления микроэлементов растением L. esculentum
Элемент | |||||||||
Почва 1 | |||||||||
As | 8 | 40 | * | 1,4 | 0,3 | 22 | 0,6 | 40 | |
Cd | 8 | 40 | 0,7 | 0,1 | 17 | 0,3 | 45 | ||
Со | 8 | 40 | 0,14 | 0,07 | 48 | 0,09 | 65 | ||
Cr | 8 | 40 | 2 | 1 | 48 | 1 | 66 | ||
Cu | 8 | 40 | 12 | 3 | 22 | 4 | 32 | ||
Ni | 7 | 40 | 5 | 13 | 1,6 | 0,4 | 21 | 0,7 | 43 |
Pb | 6 | 40 | 5 | 2 | 49 | 6 | 122 | ||
Zn | 7 | 40 | 5 | 13 | 38 | 7 | 19 | 15 | 39 |
Почва 2 | |||||||||
As | 7 | 40 | 5 | 13 | 0,49 | 0,09 | 19 | 0,17 | 35 |
Cd | 6 | 40 | 10 | 25 | 0,19 | 0,04 | 20 | 0,08 | 40 |
Со | 8 | 40 | 1,2 | 0,4 | 38 | 0,6 | 55 | ||
Cr | 7 | 40 | 5 | 13 | 0,4 | 0,1 | 32 | 0,2 | 60 |
Cu | 8 | 40 | 39 | 5 | 13 | 10 | 26 | ||
Ni | 7 | 40 | 5 | 13 | 1,5 | 0,3 | 17 | 0,5 | 34 |
Pb | 6 | 40 | 0,4 | 1,2 | 283 | 2,1 | 482 | ||
Zn | 8 | 40 | 32 | 6 | 19 | 10 | 30 | ||
Почва 3 | |||||||||
As | 8 | 40 | 0,7 | 0,1 | 17 | 0,3 | 45 | ||
Cd | 8 | 40 | 4,1 | 0,4 | 10 | 0,9 | 22 | ||
Co | 8 | 40 | 2,6 | 0,3 | 10 | 1,2 | 45 | ||
Cr | 8 | 40 | 1,0 | 0,5 | 46 | 0,7 | 65 | ||
Cu | 8 | 40 | 4,3 | 1,0 | 22 | 2,0 | 47 | ||
Ni | 8 | 40 | 1,4 | 0,4 | 29 | 0,7 | 50 | ||
Pb | 5 | 40 | 5 | 13 | 2,5 | 1,2 | 46 | 3,4 | 136 |
Zn | 8 | 40 | 374 | 39 | 10 | 126 | 34 | ||
Почва 4 | |||||||||
As | 7 | 40 | 5 | 13 | 2,4 | 0,7 | 28 | 0,8 | 32 |
Cd | 8 | 40 | 80 | 11 | 14 | 24 | 31 | ||
Co | 7 | 40 | 5 | 13 | 1,1 | 0,2 | 14 | 0,5 | 42 |
Cr | 7 | 40 | 5 | 13 | 0,7 | 0,3 | 36 | 0,3 | 44 |
Cu | 8 | 40 | 16 | 3 | 17 | 6 | 34 | ||
Ni | 7 | 40 | 5 | 13 | 20 | 2 | 12 | 9 | 47 |
Pb | 5 | 40 | 5 | 13 | 1243 | 209 | 17 | 989 | 80 |
Zn | 7 | 40 | 5 | 13 | 179 | 21 | 12 | 70 | 39 |
| |||||||||
Среднеарифметическое значение, , а также значения дисперсии повторяемости и воспроизводимости,
и
, вычисляют в соответствии с [1].
При завершении каждого периода биотеста было получено более 3680 результатов, при этом количество выбросов (значений, резко отклоняющихся от среднеарифметического значения и не учитываемых, поскольку при статистической обработке результатов эти значения оказались вне приемлемого диапазона) для интенсивности биодоступности растениями микроэлементов, концентраций микроэлементов в побегах и в корневой системе составило 5%, 10% и 10% соответственно, т.е. количество выбросов в первом случае в два раза меньше, чем в двух остальных. Более того, данные выбросы в незначительной степени зависели от конкретной лаборатории, конкретных видов почв или микроэлементов. Данные результаты также свидетельствуют от том, что показатели прецизионности (повторяемость и воспрозводимость) характеризуются значительно меньшими значениями, когда количество выбросов незначительно и одни и те же из них не наблюдаются в разных лабораториях. Средние значения коэффициента вариации для интенсивности биодоступности растениями микроэлементов, концентраций микроэлементов в побегах и в корневой системе находятся в диапазоне 22%-32% для повторяемости и в диапазоне 47%-61% для воспроизводимости. Максимальные значения коэффициента вариации были отмечены главным образом только для свинца. Значительная дисперсия измеренных концентраций свинца связана с тем, что в некоторых случаях его концентрация в минерализатах проб растений ниже, чем среднеарифметическое значение концентрации свинца в холостых пробах (см. приложение D.2).
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 3696 | IDT | ГОСТ ISO 3696-2013 |
ISO 10390 | - | * |
ISO 10694 | - | * |
ISO 11269-2 | - | * |
ISO 11277 | - | * |
ISO 11465 | - | *, |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде стандартов. Примечание - В настоящей таблице использовано следующее условное обозначение степени соответствия стандарта: IDT - идентичный стандарт. | ||
_______________
| ||
Библиография
[1] | ISO 5725-2, Accuracy (trueness and precision) of measurement methods and results - Part 2: Basic method for the determination of repeatability and reproducibility of a standard measurement method |
[2] | ISO 10693, Soil quality - Determination of carbonate content - Volumetric method |
[3] | ISO 11074, Soil quality - Vocabulary |
[4] | ISO 11047, Soil quality - Determination of cadmium, chromium, cobalt, copper, lead, manganese, nickel and zinc - Flame and electrothermal atomic absorption spectrometric methods |
[5] | ISO 11269-1, Soil quality - Determination of the effects of pollutants on soil flora - Part 1: Method for the measurement of inhibition of root growth |
[6] | ISO 13528, Statistical methods for use in proficiency testing by interlaboratory comparisons |
[7] | ISO 14869-1, Soil quality - Dissolution for the determination of total element content - Part 1: Dissolution with hydrofluoric and perchloric acids |
[8] | ISO 17126, Soil quality - Determination of the effects of pollutants on soil flora - Screening test for emergence of lettuce seedlings (Lactuca sativa L.) |
[9] | ISO 17294-2, Water quality - Application of inductively coupled plasma mass spectrometry (ICP - MS) - Part 2: Determination of 62 elements |
[10] | ISO 17402, Soil quality - Requirements and guidance for the selection and application of methods for the assessment of bioavailability of contaminants in soil and soil materials |
[11] | ISO 19730, Soil quality - Extraction of trace elements from soil using ammonium nitrate solution |
[12] | ISO 22030, Soil quality - Biological methods - Chronic toxicity in higher plants |
[13] | ISO 20280, Soil quality - Determination of arsenic, antimony and selenium in aqua regia soil extracts with electrothermal or hydride-generation atomic absorption spectrometry |
[14] | ISO 22036, Soil quality - Determination of trace elements in extracts of soil by inductively coupled plasma - atomic emission spectrometry (ICP - AES) |
[15] | NF X31-107, |
[16] | Hooda P.S. ed. Trace elements in soils. Wiley, 2010 |
[17] | Hinsinger P., Bengough A.G., Vetterlein D., Youngl. M Rhizosphere: biophysics, biogeochemistry and ecological relevance. Plant Soil. 2009, 321 pp.117-152 |
[18] | Guivarch A., Hinsinger P., Staunton S. Root uptake and distribution of radiocaesium from contaminated soils and the enhancement of Cs adsorption in the rhizosphere. Plant Soil. 1999, 211 pp.131-138 |
[19] | Chaignon V., & Hinsinger P. A biotest for evaluating copper bioavailability to plants in a contaminated soil. J. Environ. Qual. 2003, 32 pp.824-833 |
[20] | Bravin M.N., Michaud A.M., Larabi В., Hinsinger P. RHIZOtest: A plant-based biotest to account for rhizosphere processes when assessing copper bioavailability. Environ. Pollut. 2010, 158 pp.3330-3337 |
[21] | Lemal L., Bravin M.N., Letourmy P., Hinsinger P., Doelsch E. 2011 Development of a new plant-based biotest to assess trace element phytoavailability in contaminated soils: Selection of target-plant species for standardisation. 21st SETAC Europe, 15-19 May, Milan, Italy |
[22] | NIST/SEMATECH e-Handbook of Statistical Methods, 1.3.5.17.1. Grubbs' Test for Outliers, http://www.itl.nist.gov/div898/handbook/eda/section3/eda35h1, 2012 |
[23] | Chaignon V., Quesnoit M., Hinsinger P. Copper availability and bioavailability are controlled by rhizosphere pH in rape grown in an acidic-Cu contaminated soil. Environ. Pollut. 2009, 157 pp.3363-3369 |
[24] | Pinel F., Leclerc-Cessac E., Staunton S. Relative contributions of soil chemistry, plant physiology and rhizosphere induced changes in speciation on Ni accumulation in plant shoots. Plant Soil. 2003, 255 pp.619-629 |
[25] | Staunton S., Hinsinger P., Guivarch A., Brechignac F. Root uptake and translocation of radiocaesium from agricultural soils by various plant species. Plant Soil. 2003, 254 pp.443-455 |
[26] | Chaignon V., Sanchez-Neira I., Herrmann P., Jaillard В., Hinsinger P. Copper bioavailability and extractability as related to chemical properties of contaminated soils from a vine-growing area. Environ. Pollut. 2003, 123 pp.229-238 |
[27] | Loosemore N., Straczek A., Hinsinger P., Jaillard B. Zinc mobilisation from a contaminated soil by three genotypes of tobacco as affected by soil and rhizosphere pH. Plant Soil. 2004, 260 pp.19-32 |
[28] | Chaignon V., Di Malta D., Hinsinger P. Fe-deficiency increases Cu acquisition by wheat cropped in a Cu-contaminated vineyard soil. New Phytol. 2002, 154 pp.121-130 |
УДК 630*114.53:630*114.268:006.35 | МКС 13.080.30 | |
Ключевые слова: почва, почвенная масса, качество почвы, биодоступность из почв, метод определения биодоступности микроэлементов растениями, токсикологическая биодоступность, микроэлементы, биотест, определение концентрации микроэлементов в побегах, в корневой системе, измерение интенсивности биодоступности микроэлементов растениями, предварительное выращивание растений на питательных растворах, выращивание растений на пробах почв и почвенных масс | ||
Электронный текст документа
и сверен по:
, 2019