ГОСТ ISO 15197-2011
Группа Р24
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СИСТЕМЫ ДИАГНОСТИЧЕСКИЕ ![]()
Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета
![]() diagnostic test systems. Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus
diagnostic test systems. Requirements for blood-glucose monitoring systems for self-testing in managing diabetes mellitus
МКС 11.100.10
Дата введения 2013-01-01
Предисловие
Цели, основные принципы и порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт стандартизации и сертификации в машиностроении" (ВНИИНМАШ)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол N 40-2011 от 29 ноября 2011 г.)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Кыргызстан | KG | Кыргызстандарт |
Российская Федерация | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Украина | UA | Минэкономразвития Украины |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 13 декабря 2011 г. N 1365-ст межгосударственный стандарт ГОСТ ISO 15197-2011 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2013 г.
5 Настоящий стандарт идентичен международному стандарту ISO 15197:2003* In vitro diagnostic test systems - Requirements for blood-glucose monitoring systems for selftesting in managing diabetes mellitus (Системы диагностические in vitro. Требования к системам мониторного наблюдения за концентрацией глюкозы в крови для самоконтроля при лечении сахарного диабета).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Степень соответствия - идентичная (IDT).
Стандарт подготовлен на основе применения ГОСТ Р ИСО 15197-2009.
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
6 ВВЕДЕН ВПЕРВЫЕ
Информация о введении в действие (прекращении действия) настоящего стандарта публикуется в ежемесячно издаваемом информационном указателе "Национальные стандарты".
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений - в ежемесячно издаваемых информационных указателях "Национальные стандарты". В случае пересмотра или отмены настоящего стандарта соответствующая информация будет опубликована в ежемесячно издаваемом информационном указателе "Национальные стандарты".
Введение
Системы мониторинга концентрации глюкозы в крови являются медицинскими диагностическими изделиями in vitro (IVD-изделия), применяемыми преимущественно пациентами, страдающими сахарным диабетом. Сахарный диабет вызывается относительным или абсолютным дефицитом секреции инсулина, что ведет к аномальной концентрации глюкозы в крови и хроническим осложнениям. При правильном использовании система мониторинга концентрации глюкозы в крови позволяет пользователю следить за концентрацией глюкозы в крови и принимать меры для контроля ее изменений.
Настоящий стандарт предназначен для систем мониторинга глюкозы в крови, используемых непрофессионалами. Первоочередной задачей является установление требований для получения приемлемых рабочих характеристик и методов для демонстрации соответствия требованиям этого стандарта.
Критерии эффективности функционирования систем мониторинга глюкозы в крови были установлены исходя из точности (прецизионности и правильности), требуемой для индивидуальных результатов содержания глюкозы в крови. Критерии точности системы также известны в диагностике in vitro (IVD) как критерии суммарной погрешности и используются в данном стандарте, поскольку некоторые метрологические термины, обычно используемые в международных стандартах (например, неопределенность), незнакомы простому пользователю. Точность системы, на которую влияет систематическая погрешность и неопределенность измерения, описывает степень близости отдельных результатов, выдаваемых системой мониторинга глюкозы в крови, к истинным значениям содержания глюкозы, если данная система используется по назначению непрофессионалами.
Критерии точности системы основаны на трех суждениях:
a) эффективность современной технологии для наблюдения пациентов, страдающих сахарным диабетом, продемонстрированная в клинических исследованиях с помощью современных мониторинговых устройств;
b) рекомендации исследователей диабета, а также существующие стандарты на продукцию и руководства технического регулирования;
c) современные технологии, подтвержденные эффективностью имеющихся в продаже изделий.
При выполнении критериев эффективности желательные критерии точности должны быть сопоставлены с возможностями существующих средств измерения (современного уровня) и их эффективностью в отношении клинических исходов. Было принято решение, что более строгие требования к точности приведут к тому, что изготовители при модернизации конструкции будут концентрироваться на аналитических характеристиках за счет других важных свойств приборов. Например, частота выполнения анализа для диабетиков может оказаться такой же важной, как точность отдельного результата, а чем больше удобство самоконтроля глюкозы в крови, тем больше удовлетворен пациент.
Критерии точности системы определяют минимальные приемлемые рабочие характеристики прибора, предназначенного для самоконтроля содержания глюкозы в крови.
Ожидается дальнейшее развитие технологии, которое должно привести к усовершенствованию эффективности приборов для мониторинга содержания глюкозы. Эти усовершенствования будут иметь конкурентные преимущества, в частности, за счет уменьшения зависимости от навыков пользователя.
Настоящий стандарт устанавливает требования непосредственно к приборам самоконтроля концентрации глюкозы в крови, включая сведения, предоставляемые изготовителем. Общие требования, которые применимы ко всем медицинским диагностическим изделиям in vitro (IVD-изделиям) и описаны в других стандартах (например, ISO 13485 и ISO 14971), включены путем ссылки, там где необходимо.
Хотя настоящий стандарт не применяется к методикам измерения, дающим результаты в порядковой шкале (например, визуальные или полуколичественные методики измерения), он может оказаться полезным в качестве руководства для разработки методов оценки эффективности таких систем.
1 Область применения
Настоящий стандарт устанавливает требования к системам мониторинга глюкозы in vitro, с помощью которых измеряют концентрацию глюкозы в пробах капиллярной крови, а также методы проверки и подтверждения эффективности этих систем пользователями. Такие системы предназначены для самоконтроля пользователей (непрофессионалов), страдающих сахарным диабетом.
Настоящий стандарт применяется изготовителями таких систем и другими организациями (например, организациями по техническому регулированию и оценке соответствия), несущими ответственность за оценку эффективности работы таких систем.
Настоящий стандарт
- не обеспечивает всесторонней оценки всех возможных факторов, которые могут повлиять на рабочие характеристики таких систем,
- не относится к измерению концентрации глюкозы для диагностирования сахарного диабета,
- не касается медицинских аспектов лечения сахарного диабета и
- не применяется к методам измерения, дающим результаты в порядковой шкале (например, визуальные, полуколичественные методы).
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие стандарты*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 13485:2003 Medical devices - Quality management systems - Requirements for regulatory purposes (Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования)
ISO 14971:2000 Medical devices - Application of risk management to medical devices (Изделия медицинские. Применение менеджмента риска к медицинским изделиям)
ISO 17511:2003 In vitro diagnostic medical devices - Measurement of quantities in biological samples - Metrological traceability of values assigned to calibrators and control materials (Изделия медицинские для диагностики in vitro. Измерения величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам)
IEC 60068-2-64:1993 Environmental testing - Part 2: Test methods - Test Fh: Vibration, broad-band random (digital control) and guidance (Испытания на воздействие внешних факторов. Часть 2. Испытания. Испытание Fh: Широкополосная случайная вибрация (цифровое управление) и руководство)
IEC 61000-4-2:1995 Electromagnetic compatibility (EMC) - Part 4: Testing and measurement techniques - Section 2: Electrostatic discharge immunity test (Электромагнитная совместимость. Часть 4. Методики испытаний и измерений. Раздел 2. Испытание на невосприимчивость к электростатическому разряду)
IEC 61000-4-3:1995 Electromagnetic compatibility (EMC) - Part 4: Testing and measurement techniques - Section 3: Radiated, radio-frequency, electromagnetic field immunity test (Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на устойчивость к воздействию электромагнитного поля с излучением на радиочастотах)
IEC 61010-1:2001 Safety requirements for electrical equipment for measurement, control, and laboratory use - Part 1: General requirements (Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 1. Общие требования)
IEC 61010-2-101:2002 Safety requirements for electrical equipment for measurement, control and laboratory use - Part 2-101: Particular requirements for in vitro diagnostic (IVD) medical equipment (Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 2-101. Частные требования к медицинской аппаратуре для диагностики in vitro (IVD))
IEC 61326:1997 Electrical equipment for measurement, control and laboratory use - EMC requirements (Электрооборудование для измерения, управления и лабораторного использования. Требования к электромагнитной совместимости)
EN 376:2002 Information supplied by the manufacturer with in vitro diagnostic reagents for self-testing (Реактивы диагностические in vitro для самоконтроля. Информация, поставляемая изготовителем)
EN 13612:2002 Performance evaluation of in vitro diagnostic medical devices (Оценка технических характеристик медицинских диагностических устройств in vitro)
EN 13640:2002 Stability testing of in vitro diagnostic reagent (Оценка стабильности реактивов для диагностики in vitro)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 точность (accuracy): Степень близости результата измерений и принятого опорного значения [1].
Примечание 1 - Термин "точность" применительно к серии результатов измерений включает комбинацию компонентов случайной погрешности и компонента общей систематической погрешности (или bias) [2].
Примечание 2 - В отношении критерия точности результатов системы мониторинга глюкозы в крови см. 3.24.
3.2 систематическая погрешность (bias): Разность между математическим ожиданием результатов измерений и принятым опорным значением [3].
3.3 система мониторинга глюкозы в крови (blood-glucose monitoring system): Система измерения, состоящая из портативного прибора и реактивов, используемая для наблюдения in vitro концентрации глюкозы в крови.
Примечание - Системы мониторинга глюкозы в крови измеряют содержание глюкозы в пробах капиллярной крови и могут выразить результаты либо как концентрацию глюкозы в крови, либо как равноценную концентрацию глюкозы в сыворотке (плазме). В настоящем стандарте концентрация относится к типу результатов, сообщаемых системой.
3.4 прибор для измерения концентрации глюкозы в крови (blood-glucose meter): Компонент системы мониторинга глюкозы в крови, который преобразует результат химической реакции в концентрацию глюкозы в пробе.
3.5 коммутабельность материала (commutability of a material): Способность материала давать одинаковые численные соотношения между результатами измерения, выполненными с помощью данного набора методик измерения при измерении одного и то же количества, аналогичные соотношениям между математическими ожиданиями зависимостей, полученных, если те же самые процедуры применены к другим материалам соответствующего типа [4].
Примечание - В отношении стандартных образцов, используемых для калибровки методик измерения, применяемых к биологическим образцам, "другие материалы соответствующего типа" включают большое число образцов от здоровых пользователей и пациентов, страдающих соответствующим заболеванием.
3.6 контрольный материал (control material): Вещество, материал или изделие (препарат), предназначенное изготовителем для применения при проверке рабочих характеристик медицинского диагностического изделия in vitro [5].
3.7 информация, прилагаемая изготовителем к медицинскому устройству (information supplied by the manufacture with the medical device): Любая написанная, отпечатанная или графическая информация на медицинском оборудовании или вмещающем его контейнере или упаковке, а также сопроводительная информация, касающаяся идентификации, технического описания и применения медицинского изделия, за исключением товаросопроводительной документации и рекламных материалов.
Примечание 1 - Взято из [6].
Примечание 2 - В некоторых странах информацию, предоставляемую изготовителем, называют "этикетирование".
3.8 инструкции по применению (instructions for use): Информация, поставляемая изготовителем и прилагаемая к медицинскому диагностическому изделию in vitro (IVD-изделию), относящаяся к безопасности и правильному использованию реактива или безопасному и правильному техническому обслуживанию, эксплуатации и выявлению основных неисправностей прибора.
Примечание 1 - Взято из [5] и [7].
Примечание 2 - Инструкции по применению реактивов для диагностики in vitro для самоконтроля описаны в EN 376.
Примечание 3 - Инструкции по применению приборов для диагностики in vitro для самоконтроля описаны в [8].
Примечание 4 - Инструкции по применению можно получить в форме пакета документов (на отдельных листах) и/или справочника пользователя.
3.9 промежуточная прецизионность (intermediate precision): Прецизионность в промежуточных условиях между условиями воспроизводимости и условиями повторяемости.
Примечание - Концепция промежуточных уровней прецизионности описана в [9].
3.10 условия промежуточной прецизионности (intermediate precision conditions): Условия, при которых независимые результаты испытания получают одним и тем же методом, на идентичных объектах испытания, в одном и том же месте, но когда другие переменные параметры испытания, такие как операторы, оборудование, калибровка, окружающие условия и/или промежутки времени, различаются.
Примечание - Измеряемая рецизионность в условиях, ведущих к изменчивости, представляет фактическую пользу. Количественные критерии промежуточной прецизионности зависят от оговоренных условий.
3.11 этикетка (label): Отпечатанная, написанная или графическая информация, нанесенная на изделие или содержащий его контейнер.
Примечание - Взято из [5].
3.12 непрофессионал (layperson): Лицо, не прошедшее специальную подготовку в конкретной области или по конкретной дисциплине.
Примечание 1 - Взято из определения "lay user" (простой пользователь) в EN 376.
Примечание 2 - Применительно к настоящему стандарту пользователь устройства для мониторинга глюкозы в крови, который не имеет специальных медицинских, научно-технических знаний, касающихся наблюдения содержания глюкозы в крови.
3.13 партия (lot, batch): Один или несколько компонентов или готовых приборов, которые представляют собой один тип, модель, класс, размер, состав или версию программного обеспечения и произведены преимущественно в одинаковых условиях, и обладают одинаковыми характеристиками и качеством в установленных пределах.
Примечание - В Директиве 98/79/ЕС [10] и в европейских стандартах предпочтительным термином является термин "batch".
3.14 методика измерения, выбранная изготовителем (manufacturer's selected measurement procedure): Методика измерения, калиброванная с помощью одного или нескольких первичных или вторичных котировочных инструментов и утвержденная для применения по назначению.
Примечание - В ISO 17511, пункт 4.2.2, перечисление f), показана выбранная изготовителем методика измерения в цепочке прослеживаемости.
3.15 постоянно действующая методика измерения изготовителя (manufacturer's standing measurement procedure): Методика измерения, калиброванная с помощью одного или нескольких рабочих юстировочных инструментов или юстировочных инструментов более высокого класса и утвержденная для применения по назначению.
Примечание - В ISO 17511, пункт 4.2.2, перечисление h), показана постоянно действующая методика измерения изготовителя в цепочке прослеживаемости.
3.16 вкладыш в упаковку (package insert): Инструкции по применению и другая информация для системы реактивов или контрольного материала, которая поставляется вложенной в упаковку, но не наносится на какую-либо ее часть.
3.17 объемная доля кровяных телец в крови (гематокрит) (packed cell volume): Объемная доля эритроцитов в крови.
Примечание 1 - Выражается либо в десятичных долях (система СИ), либо в процентах (условные единицы). Единицы СИ (л/л) подразумеваются.
Примечание 2 - Иногда называют "гематокритом", по наименованию прибора для определения объема кровяных телец в крови.
3.18 прецизионность измерения (precision of measurement): Степень близости друг к другу результатов измерения, полученных в оговоренных условиях [1].
Примечание 1 - Степень прецизионности выражают численно с помощью статистических критериев погрешности измерения, таких как стандартное (среднеквадратическое) отклонение и коэффициент вариации, которые обратно пропорциональны прецизионности. Количественные критерии прецизионности зависят от оговоренных условий.
Примечание 2 - Прецизионность данной методики измерения подразделяется согласно установленным условиям прецизионности. Конкретный ряд предельных условий называют "повторяемость" (3.20) и "воспроизводимость" (3.22).
3.19 система реактивов (reagent system): Часть медицинского диагностического изделия in vitro (IVD-изделия), которая порождает сигнал в результате химической или электрохимической реакции, что позволяет обнаружить анализируемое вещество (например, глюкозу) в пробе и измерить его концентрацию.
3.20 повторяемость (сходимость) (repeatability): Прецизионность в условиях повторяемости [1].
3.21 условия повторяемости (repeatability conditions): Условия, при которых независимые результаты испытания (измерения) получают одним и тем же методом, на идентичных объектах испытания, в одной и той же лаборатории, одним и тем же оператором, с использованием одного и того же оборудования в пределах короткого промежутка времени [1].
Примечание 1 - В основном, неизменные условия для представления условий, дающих минимальную изменчивость результатов испытания.
Примечание 2 - Применительно к настоящему стандарту термин "лаборатория" следует интерпретировать как "определенное место".
3.22 воспроизводимость (reproducibility): Прецизионность в условиях воспроизводимости [1].
3.23 условия воспроизводимости (reproducibility conditions): Условия, в которых результаты испытания получают одним и тем же методом, на идентичных объектах испытания, в разных лабораториях, разными операторами с использованием разного оборудования [1].
Примечание 1 - Полностью измененные условия для представления условий, дающих максимальную изменчивость результатов испытания.
Примечание 2 - Применительно к настоящему стандарту термин "лаборатория" следует интерпретировать как "определенное место".
3.24 точность системы (system accuracy): Степень близости репрезентативных результатов измерения (испытания), выполненных с помощью системы измерения, к соответствующим им опорным значениям.
Примечание 1 - Термин "точность" применительно к серии результатов измерения (испытания) включает сочетание составляющих случайной погрешности и составляющей общей систематической погрешности [2].
Примечание 2 - Опорные значения присваиваются с помощью методики измерения, прослеживаемой по референтной методике измерения более высокого порядка.
Примечание 3 - Точность системы можно выразить как интервал, который включает 95% расхождений, наблюдаемых между результатами, полученными оцениваемой системой, и их опорными значениями. Этот интервал также включает неопределенность измерения методики измерения, используемой для присвоения опорных значений.
3.25 прослеживаемость (traceability): Свойство результата измерения или значение стандартного образца, посредством которого он может быть отнесен к официальным, обычно национальным или международным эталонам, через неразрывную цепь сличений, каждое из которых имеет установленную неопределенность [2, определение 6.10].
3.26 правильность (trueness): Степень близости среднего значения, полученного на основании большой серии результатов измерений (испытаний), к принятому опорному значению [1].
Примечание - Показателем правильности обычно является значение систематической погрешности (3.2).
3.27 стандартное испытание (type test): Испытание одного или нескольких образцов оборудования (или компонентов оборудования), изготовленных по конкретному проекту, чтобы показать, что проект и конструкция удовлетворяют одному или более требованиям применяемого стандарта.
Примечание 1 - Для приборов, контролирующих содержание глюкозы в крови, статистической выборки не требуется.
Примечание 2 - Взято из IEC 61326.
3.28 настройка системы мониторинга глюкозы в крови пользователем (user adjustment of blood-glucose monitoring system): Процедура, описанная в инструкциях по применению, посредством которой пользователь вводит номер, вставляет кодовую полоску (стрип) или элемент кода и т.д. для достижения системой приемлемых рабочих характеристик.
4 Проектирование и разработка
4.1 Общие требования
Применяют требования, установленные в ISO 13485.
Примечание - В разделах 6, 7.2 и 7.3 описаны процедуры проверки на стадии проектирования, направленные на обеспечение гарантий того, что система может выполнить требования к прецизионности, правильности, безопасности и надежности. В разделе 8 описаны процедуры валидации на стадии проекта, нацеленные на обеспечение гарантий того, что точность системы соответствует требованиям пользователя.
4.2 Безопасность
Применяют требования, установленные в IEC 61010-1 и IEC 61010-2-101.
4.3 Прослеживаемость
Применяют требования к процессу калибровки, выполняемой изготовителем, установленные в ISO 17511.
Примечание 1 - С помощью выбранной изготовителем или постоянно действующей методики измерения можно измерить концентрацию глюкозы в пробе либо крови, либо плазмы. Если используют пробы плазмы, система мониторинга глюкозы в крови может выдать результаты как эквивалент содержания глюкозы в плазме, даже если система мониторинга глюкозы в крови измеряла пробы крови.
Примечание 2 - Цепочка прослеживаемости должна включать разумное число этапов, чтобы свести к минимуму суммарную неопределенность.
Примечание 3 - Цепочка прослеживаемости для типичной системы мониторинга, калиброванной в заводских условиях, приведена в приложении В. Этот пример не подразумевает демонстрацию единственно возможной подходящей цепочки прослеживаемости.
4.4 Аспекты эргономического/человеческого фактора
При проектировании системы мониторинга глюкозы в крови необходимо учесть эргономический и соответствующий человеческий факторы в отношении следующего:
a) легкость эксплуатации;
b) простота технического обслуживания;
c) защита от износа, обычно происходящего в условиях использования;
d) считываемость измеренных результатов;
е) понятность (недвусмысленность) сообщений пользователю, например "low battery" ("подсадка батареи") или "low result" ("низкий результат") вместо сообщения "low" ("низкий").
Примечание 1 - Системы мониторинга глюкозы в крови, предназначенные для самоконтроля, могут использоваться непрофессионалами с различными физическими и ментальными возможностями.
Примечание 2 - Эти системы часто применяются отдельными пользователями, которые могут выполнять измерения при различных установочных параметрах.
Примечание 3 - Не предполагается, что одна система мониторинга глюкозы в крови удовлетворит всех возможных пользователей или все возможные установочные параметры.
4.5 Анализ рисков
Применяют требования, установленные в ISO 14971.
Изготовитель должен установить приемлемость потенциальных рисков, исходя из знания следующих факторов, но не ограничиваясь этим:
a) назначение продукта;
b) умение пользователя и ограничения;
c) защита от несанкционированного изменения основных параметров (например, сообщаемых единиц) или
d) влияние попадания мешающих веществ.
Примечание - Руководство по оценке потенциально мешающих веществ см. [11].
При выполнении анализа рисков изготовитель должен оценить:
e) вероятность возникновения неисправности [например, недостаточен объем пробы или неправильное расположение испытуемой полоски (стрипа)],
f) вероятность того, что система не обнаруживает неисправность и
g) последствия необнаруженной неисправности.
Примечание - Настоящий стандарт не задает уровни риска и приемлемость рисков.
4.6 Проверка, выполняемая пользователем
Конструкция системы мониторинга глюкозы в крови должна позволять пользователю осуществить проверку:
a) правильного функционирования системы мониторинга (то есть контроль системы) и
b) правильного выполнения измерения, включая последовательность этапов процедуры.
Примечание - Пользователю рекомендуется выполнять проверку во время использования системы. "Во время использования" означает до, в процессе или сразу после выполнения измерения. Рекомендуется внедрить проверку, осуществляемую пользователем, в измерение, если такое возможно.
Проверка, выполняемая пользователем, должна давать однозначную информацию.
5 Информация, предоставляемая изготовителем
5.1 Этикетки для прибора, измеряющего концентрацию глюкозы в крови
Прибор, измеряющий концентрацию глюкозы в крови (измеритель), должен быть идентифицирован с помощью этикеток, содержащих, как минимум, следующую информацию:
a) наименование или торговую марку изготовителя и его адрес;
b) наименование или обозначение изделия (эта информация должна находиться непосредственно на этикетке, прикрепленной к изделию);
c) назначение [должна иметься информация, что данное изделие является медицинским изделием для in vitro диагностики (IVD-изделием) для самоконтроля, а также информация, касающаяся системы реактивов, которые используются с этим изделием];
d) номер партии или серийный номер на этикетке, прикрепленной к изделию;
е) условия хранения и обращения, если необходимо;
f) ссылку на справочник пользователя или инструкции по применению.
Там, где необходимо, информацию на этикетке следует приводить в форме символов. Символы должны соответствовать применяемому регламенту и международным стандартам. Все символы должны быть описаны в информации, прилагаемой к измерителю содержания глюкозы в крови.
5.2 Инструкции по применению системы мониторинга глюкозы в крови
Инструкции по применению должны быть представлены в четкой и лаконичной форме с использованием терминов, понятных для непрофессионала. Информация должна быть четко представлена и легко читаема. Печать (шрифт) должна быть крупной (например, шрифт Courier 12 пунктов), а содержание легкодоступно для понимания лицами без научной или специальной технической подготовки. Там, где необходимо, должны использоваться символы и иллюстрации.
Инструкции по применению должны четко устанавливать, какие действия необходимо предпринимать, если проверка показывает недостоверный результат.
Необходимо использовать язык(и) той страны, в которой реализуют системы мониторинга глюкозы в крови. Дополнительные языки необязательны.
Инструкции по применению должны содержать следующую информацию:
a) наименование или торговую марку изготовителя и его адрес; наименование и адрес дистрибьютера (если имеется) (в Европейском Союзе, Директива 98/79/ЕС [10] требует включения наименования и адреса "полномочного представителя", если изготовитель находится вне Евросоюза), и разъяснение, как обратиться за помощью;
b) наименование или обозначение изделия;
c) назначение изделия;
d) принцип метода;
e) методики измерения и/или калибровочные материалы [следует указать, если имеется, прослеживаемость в соответствии с методикой получения исходного измерения (для контроля последующих) и/или по стандартному образцу более высокого порядка], использованные изготовителем для установления и оценки эксплуатационных характеристик;
f) тип проб, использованных изготовителем для калибровки, например, кровь или сыворотка (плазма);
g) соответствующую систему реактивов;
h) методику измерения, в соответствии с которой выполняют измерения на данном приборе, включая:
- последовательность регулировки (например, использование номера, кодовой полоски или элемента и т.д.) измерений и проверки, а также распределение промежутков времени между ними;
- последовательность процедур по подготовке прибора к выполнению измерения, чтобы выполнить это измерение (включая число и рекомендованный внешний вид образцов), и обслуживанию прибора после выполнения измерения;
- единицы измерения, сообщаемые прибором, например ммоль/л или мг/дл;
- эквивалентны или нет результаты, сообщаемые по крови и по плазме;
- советы, как поступать в том случае, если прибор выдал ошибочное сообщение;
i) окружающие условия (например, диапазон температур и влажность), в которых система должна использоваться;
j) подробное описание процедуры, которую должен выполнять пользователь при настройке прибора, если применяется;
k) подробное описание процедур для контроля, выполняемого пользователем, включая идентификацию соответствующего контрольного материала, который необходимо использовать, чтобы убедиться, что система мониторинга глюкозы в крови работает нормально, и совет, как поступить в том случае, если результаты контроля неприемлемы;
I) тип используемой пробы, а также специальные условия ее взятия и предварительной обработки;
m) меры предосторожности, которые необходимо предпринять в отношении риска инфицирования перед применением прибора;
n) меры предосторожности, которые необходимо предпринять в отношении электростатического заряда, магнитных полей и других электрических условий, а также воздействие температуры, влажности и других окружающих условий, по обстановке (см. IEC 61010-2-101, раздел 5);
о) описание и пояснение всех символов, используемых на этикетках и в инструкциях по применению;
р) руководство к действию, которое должен предпринять пользователь как следствие полученного результата, включая:
- ссылку на рекомендации врача и/или квалифицированного патронажного работника и предупреждение о точном соблюдении инструкций на основе результата без консультации с врачом или другим квалифицированным работником здравоохранения;
- совет, как действовать, если результат не ясен пользователю;
- индикацию, с помощью которой система мониторинга предупреждает пользователя, что результат выходит за рамки "интервала измерения" (например, ошибочные сообщения, ложные уведомления);
q) информацию о безопасной утилизации системы и ее компонентов, если необходимо;
r) год и месяц издания инструкции по применению и/или номер пересмотра.
5.3 Этикетки для системы реактивов и контрольного материала
Система реактивов и контрольный материал должны быть идентифицированы с помощью одной или нескольких этикеток.
Применяют требования, установленные в EN 376.
В дополнение, на этикетке(ах) должна быть размещена следующая информация:
a) указание промежутка времени, в течение которого следует использовать реактивы после первого вскрытия контейнера с реактивом, выраженного в месяцах и/или днях;
b) ссылка на инструкции по применению;
c) измеритель глюкозы в крови, который применяют с данными реактивами.
Предупреждения в отношении применения системы реактивов с конкретным измерителем и информацию об утилизации системы реактивов после использования следует включить в сведения на этикетке для получения надежных результатов измерений и безопасной утилизации отходов.
Необходимо использовать язык(и) той страны, где реализуются эти реактивы и контрольные материалы, дополнительные языки необязательны.
5.4 Инструкции по применению реактивов и контрольного материала
Применяют требования, установленные в EN 376.
Кроме того, должна быть включена следующая информация:
a) указание, как получить помощь от изготовителя и/или дистрибьютора;
b) конкретный измеритель глюкозы в крови для применения с этой системой реактивов и контрольным материалом;
c) условия хранения (например, температура, влажность, воздействие света и других факторов окружающей среды), необходимо также включить в инструкцию по применению реактивов предупреждения, касающиеся необходимости плотно закрывать пробку контейнера, чтобы защитить полоски, пропитанные реактивом, или датчики от воздействия воздуха;
d) интервал измерения, указывающий верхнюю и нижнюю границы концентрации, в пределах которых результаты точны и сообщаются пользователю;
e) рабочие характеристики (связанные с точностью системы характеристики, основанные на результатах испытания, выполненного в соответствии с разделом 7), заявленные на языке, понятном для пользователя, и показатели точности системы (см. 7.4.2), изготовитель должен сообщить:
- для концентрации глюкозы менее 4,2 ммоль/л (меньше 75 мг/дл) - процент результатов в пределах ±0,28, ±0,056* и ±0,83 ммоль/л (±5, ±10 и ±15 мг/дл) от опорных значений;
_____________
* Вероятно ошибка оригинала. Следует читать: ±0,56. - .
- для концентраций глюкозы, равной или более 4,2 ммоль/л (равной или более 75 мг/дл), - процент результатов в пределах ±5%, ±10%, ±15% и ±20% от опорных значений;
f) все мешающие вещества, состояние проб (например, гемолиз, билирубин, липемия) или физиологические условия (например, изменения периферийной циркуляции), которые неблагоприятно влияют на точность результатов;
g) методика измерения, используемая для оценки рабочих характеристик системы, а также заявление о прослеживаемости в соответствии с методикой выполнения исходного измерения концентрации глюкозы или стандартного образца более высокого порядка;
h) контрольный диапазон значений концентраций глюкозы в капиллярной крови для недиабетических интервалов и тип проб, используемых для калибровки (проба крови или плазмы);
i) методика измерения, которую необходимо использовать, включая:
- последовательность действий по подготовке системы реактивов и выполнению измерений;
- интервал времени между отдельными действиями, если имеется;
j) подробное описание процедур контроля и контрольных материалов, применяемых для проверки работы системы мониторинга глюкозы в крови в допускаемых пределах.
Необходимо использовать язык(и) той страны, в которой реактивы и контрольные материалы реализуются; представление информации на дополнительных языках необязательно.
Требуемая информация в отношении реактивов и/или контрольных материалов может быть включена в инструкции по применению прибора или системы, если изготовитель прибора или системы тот же самый, что и изготовитель реактивов. Если в этой информации происходит изменение, необходимо использовать этикетки на реактивах, чтобы уведомить пользователя, а также поместить измененную информацию в инструкции по применению системы реактивов.
6 Испытания надежности и безопасности
6.1 Общие требования
6.1.1 Программа
Экспериментальные проекты, методики анализа данных и критерии приемки должны быть описаны в программе.
Программа должна устанавливать число измерителей, единиц реактивов и число параллельных измерений на измеритель.
Для эксплуатационных испытаний программа должна содержать статистическое обоснование.
Установленные требования к испытаниям являются минимальными требованиями.
Примечание 1 - Испытания, описанные в 6.9-6.12, являются испытаниями для определения рабочих характеристик.
Примечание 2 - Испытания, описанные в 6.2-6.8, являются стандартными испытаниями.
6.1.2 Измерители и системы реактивов
Измерители и системы реактивов должны быть репрезентативными для единиц продукции планового производства.
Для определения рабочих характеристик необходимо использовать в каждом испытании не менее 10 измерителей.
Для стандартных испытаний в каждом испытании рекомендуется использовать три измерителя.
6.1.3 Критерии приемки
Критерии приемки для систематической погрешности и повторяемости в определении рабочих характеристик, описанном в 6.10-6.13, следует выводить по критерию точности системы в 7.4. Обоснование необходимо внести в протокол.
Система мониторинга глюкозы в крови должна выполнять критерии приемки в каждом протоколе испытания. В противном случае эта система должна считаться нефункциональной, не показывающей численный результат концентрации глюкозы.
Несоответствие критериям приемки должно быть проанализировано.
6.2 Защита от электрического удара
Применяют требования, установленные в IEC 61010-1, раздел 6.
6.3 Защита от механических повреждений
Применяют требования, установленные в IEC 61010-1, раздел 7.
6.4 Электромагнитная совместимость
Применяют требования, установленные в IEC 61326.
Кроме того, применяют требования, установленные в приложении А.
6.5 Термостойкость
Применяют требования, установленные в IEC 61010-1, раздел 10.
6.6 Стойкость к воздействию влаги и жидкостей
Применяют требования, установленные в IEC 61010-1, 11.1, 11.2 и 11.3.
6.7 Защита от десорбированных газов, взрыва и имплозии
Применяют требования, установленные в IEC 61010-1, 13.1 и 13.2.2.
6.8 Компоненты измерительного устройства
Применяют требования, установленные в IEC 61010-1, 14.1, 14.4, 14.5 и 14.6.
6.9 Определение рабочих характеристик
Определение рабочих характеристик должно выполняться до и после каждого определения механического сопротивления удару, вибрации и сотрясению (см. 6.10) и защиты от воздействия температуры и влажности (см. 6.11 и 6.12). Соответствие/несоответствие критериям должно быть основано на влиянии воздействий на систематическую погрешность системы и повторяемость.
Перед каждым определением рабочих характеристик измеритель глюкозы в крови должен быть приведен к равновесной температуре (23±2) °С.
Для определения рабочих характеристик следует использовать рекомендуемый изготовителем контрольный материал или подходящую альтернативу.
Может оказаться затруднительным отличить изменчивость, возникающую по вине образца и системы реактивов, от изменчивости, вызываемой компонентами измерителя. Это необходимо учесть при планировании испытания и разработке критериев приемки.
Образцы должны испытываться в соответствии с порядком, указанным в протоколе.
Средняя концентрация глюкозы и повторяемость должны быть рассчитаны до и после каждого запроса, и расхождение должно быть сопоставлено с критерием приемки.
a) Средняя концентрация глюкозы: расхождение между средней концентрацией глюкозы после запроса и средней концентрацией глюкозы до запроса должно быть рассчитано и сопоставлено с критерием приемки в отношении систематической погрешности.
b) Повторяемость, квадратный корень из расхождения между дисперсией повторяемости после запроса и дисперсией повторяемости до запроса, должны быть рассчитаны и сопоставлены с критерием приемки в отношении повторяемости.
6.10 Механическое сопротивление удару, вибрации и сотрясению
6.10.1 Протокол испытания на вибрацию
Выполняют определение рабочих характеристик в соответствии с 6.9.
Выполняют испытание на воздействие вибраций в соответствии с IEC 60068-2-64, 8.3.
После завершения вибрационных испытаний повторяют определение рабочих характеристик.
Применяются требования, установленные в IEC 60068-2-64, 8.3.
6.10.2 Протокол испытания на падение
Чтобы оценить ударопрочность при падении, выполняют определение рабочих характеристик в соответствии с 6.9.
Выполняют испытание на падение, определенное в IEC 61010-1, 8.2. После завершения испытаний на падение повторяют определение рабочих характеристик.
Применяются требования, установленные в IEC 60010-1, 8.2.
6.11 Пределы воздействия температуры на прибор
6.11.1 Протокол испытания на воздействие повышенной температуры
Выполняют определение рабочих характеристик в соответствии с 6.9.
Помещают каждый измеритель в герметически закрытую климатическую камеру, температуру внутри которой можно отслеживать.
Увеличивают температуру внутри камеры до (50±2) °С и оставляют при этой температуре на 8 ч в герметичной камере.
Извлекают измеритель из климатической камеры и дают охладиться до температуры (23±2) °С, затем повторяют определение рабочих характеристик.
Для таких систем, в которых система реактивов является неотъемлемым компонентом измерительного прибора и не может быть отделена от него, условия воздействия повышенной температуры должны быть ограничены до условий эксплуатации, установленных изготовителем.
6.11.2 Протокол испытания при пониженной температуре
Выполняют определение рабочих характеристик в соответствии с 6.9.
Помещают каждый измеритель в герметически закрытую климатическую камеру, температуру внутри которой можно отслеживать.
Увеличивают температуру внутри камеры до минус (20±2) °С и оставляют при этой температуре на 8 ч в герметичной камере.
Извлекают измеритель из климатической камеры и дают нагреться до температуры (23±2) °С, затем повторяют определение рабочих характеристик.
Для таких систем, в которых система реактивов является неотъемлемым компонентом измерительного прибора и не может быть отделена от него, условия воздействия пониженной температуры должны быть ограничены до условий эксплуатации, установленных изготовителем.
6.12 Протокол испытания на воздействие влажности на оборудование
Выполняют определение рабочих характеристик в соответствии с 6.9.
Помещают измеритель в камеру влажности.
Стабилизируют относительную влажность, без конденсации до значения (93±3)% и температуры (23±2) °С.
Оставляют измеритель в камере влажности на 48 ч.
Извлекают измеритель из камеры влажности и дают прийти в равновесие до достижения температуры (23±2) °С и относительной влажности 60% в течение 15 мин, затем повторяют определение рабочих характеристик.
6.13 Определение условий хранения и применения реактивов
Условия хранения и применения системы реактивов и контрольного материала должны быть определены и подтверждены.
Применяют требования, установленные в стандарте EN 13640.
7 Оценка аналитических характеристик
7.1 Общие требования
Оценка аналитических характеристик должна быть выполнена в части системы контроля на этапе проектирования изготовителя.
Применяются требования, установленные в ISO 13485.
Оценка характеристик должна выполняться согласно письменному протоколу. Протокол должен задавать детали эксперимента, процедуры анализа данных и критерии приемки.
В протоколе также необходимо обосновать статистические расчеты, включая число измерителей, единиц реактивов и реплицированных образцов, а также критерии приемки.
Все компоненты системы, включая измерительные устройства, системы реактивов и аксессуары, должны быть репрезентативными в отношении продукта, предназначенного для продажи.
Система мониторинга глюкозы в крови должна быть отрегулирована перед применением согласно инструкциям изготовителя (например, с помощью кодирования, кодовых импульсов). Между параллельными измерениями нельзя проводить подстройку, если в инструкциях изготовителя не оговорена настройка перед каждым измерением.
Процедуры контроля, рекомендованные изготовителем, должны выполняться перед каждой оценкой.
Примечание 1 - В 7.2 и 7.3 оценки планируют выполнение верификации, которая предназначена для того, чтобы убедиться, что продукт способен соответствовать требованиям к прецизионности и правильности. В разделе 8 оценки представляют собой валидацию на этапе проектирования, целью которой является уверенность, что рабочие характеристики системы соответствуют установленным требованиям.
Примечание 2 - Устанавливают тип образцов, требуемых для каждой оценки.
7.2 Оценка прецизионности
7.2.1 Общие положения
Повторяемость (сходимость) и промежуточная прецизионность должны быть оценены по критериям эффективности, выведенным из критериев точности системы в 7.3. Критерии приемки должны быть задокументированы в протоколе.
Анализ дисперсии является предпочтительным статистическим методом, который используют, когда необходимо оценить многочисленные факторы.
Примечание 1 - В отношении общих принципов оценки прецизионности метода измерения см. [3].
Примечание 2 - Можно планировать проведение экспериментов и для оценки воздействия таких факторов, как разные партии, разные материалы для образцов, разные пользователи или другие переменные (например, воздействие температуры, влажности).
7.2.2 Оценка повторяемости
7.2.2.1 Общие положения
Повторяемость должна быть оценена в виде пяти значений концентрации глюкозы, распределенных по интервалу измерения.
Повторяемость должна быть измерена в течение короткого промежутка времени, не превышающего один день/на измеритель, одним и тем же оператором, с использованием одного измерителя и реактивов одной партии. Эксперимент должен быть спланирован таким образом, чтобы свести к минимуму влияние нестабильности глюкозы в пробе.
Оценку можно выполнять на одной партии и/или одном пользователе, если данные демонстрируют, что повторяемость системы не зависит от конкретных партий реактивов и/или пользователей. В ином случае эксперимент должен планироваться таким образом, чтобы оценить такую зависимость повторяемости от указанных факторов.
Примечание - В отношении руководства по определению повторяемости метода измерения см. [3].
7.2.2.2 Пробы
Оценку повторяемости необходимо выполнять на пробах крови. Предпочтительной пробой для оценки повторяемости является венозная кровь.
Пробы должны быть приготовлены из венозной крови человека, собранной в пробирки, содержащие антикоагулянт, указанный в инструкциях по применению. Объемная доля кровяных телец в крови (гематокрит) должна быть в пределах 0,35-0,50 л/л (от 35% до 50%).
Необходимо использовать пять проб с концентрацией глюкозы в интервалах, установленных в таблице 1. Концентрацию глюкозы в каждой пробе следует определять, используя систему мониторинга глюкозы в крови.
Таблица 1 - Интервалы концентраций глюкозы для оценки повторяемости
Интервал | Концентрация глюкозы, ммоль/л (мг/дл) |
1 | От 1,7 до 2,8 (от 30 до 50) |
2 | От 2,9 до 6,1 (от 51 до 110) |
3 | От 6,2 до 8,3 (от 111 до 150) |
4 | От 8,4 до 13,9 (от 151 до 250) |
5 | От 14,0 до 22,2 (от 251 до 400) |
Концентрацию глюкозы в пробах венозной крови можно регулировать путем разведения пробы водным раствором глюкозы, приготовленным на 0,9%-ном растворе соли.
Разбавление не должно значительно изменять матрицу пробы.
Полученные пробы следует выдержать в течение не менее 15 мин до использования, чтобы произошла полная мутаротация и было достигнуто равновесие оптических - и
-изомеров.
Можно добавить в пробу консервант, который не мешает измерениям концентрации глюкозы (например, фторид или монойодацетат), в соответствии с рекомендациями изготовителя, в достаточном объеме, чтобы свести к минимуму гликолиз.
Чтобы получить более низкие концентрации глюкозы, допускается состаривание проб крови с антикоагулянтом, пока содержание глюкозы не уменьшится до желаемого уровня.
7.2.2.3 Система реактивов
Требуется 500 единиц системы реактивов из не менее 10 ампул (пробирок) или контейнеров.
7.2.2.4 Измерительные устройства
Для оценки повторяемости системы мониторинга глюкозы в крови необходимо выбрать не менее 10 измерителей.
7.2.2.5 Процедура оценки
Следующая процедура является минимальным экспериментальным планом оценки повторяемости. Она требует выполнения каждым измерителем по 10 измерений проб в каждом интервале концентрации глюкозы, приведенном в таблице 1.
Примечание - Процедуру можно модифицировать, чтобы охватить несколько партий реактивов и/или несколько пользователей.
Пробы должны быть приведены в состояние равновесия при температуре (23±5) °С и поддерживаться во время эксперимента в пределах ±2 °С от стартовой температуры.
Прежде чем взять каждую порцию для измерения, пробу необходимо осторожно и тщательно перемешать переворачиванием пробирки.
Единицы системы реактивов следует брать из одной и той же пробирки/упаковки для каждого измерителя.
a) Нумеруют единицы системы реактивов (пробирки/контейнеры) для каждого измерителя.
b) Берут единицу системы реактивов из пробирки/контейнера и наносят на пробу.
Результат записывают.
Можно использовать пипетку для переноса (то есть разные мерные пипетки), обеспечивающую перенос объемов пробы в пределах рекомендуемого изготовителем интервала, чтобы имитировать стандартное нанесение пробы.
c) Повторяют этап b) еще 9 раз, используя один и тот же измеритель.
d) Используя одну и ту же пробу, повторяют этапы b) и с) с каждым из 9 оставшихся измерителей и пробирок или контейнеров. Это результаты всех 10 измерений на пробу на измеритель.
e) Берут следующую пробу и повторяют этапы а)-d).
f) Рассчитывают среднее значение, стандартное (среднеквадратическое) отклонение и коэффициент вариации (КВ) для каждого измерителя по 10 измерениям.
g) Рассчитывают общее среднее, совокупную дисперсию, совокупное стандартное (среднеквадратическое) отклонение (на 95%-ном доверительном интервале) и совокупный .
Примечание - Стандартное отклонение и являются критериями повторяемости.
Эксперимент можно спланировать таким образом, чтобы получить стандартное отклонение повторяемости, а также другие составляющие дисперсии путем анализа дисперсии вместо этапов f) и g).
Аликвоты должны отбираться от каждой пробы непосредственно перед первым измерением и сразу же после последнего измерения, выполняемого системой мониторинга глюкозы в крови (минимум в параллельном режиме) в соответствии с выбранной изготовителем или постоянно действующей процедурой измерения.
Если эти результаты демонстрируют воздействие дрейфа на основе предварительно определенных критериев стабильности [например, изменение между первым и последним результатами более 4% при содержании глюкозы более 5,5 ммоль/л (100 мг/дл) или более 0,22 ммоль/л (4 мг/дл) при содержании глюкозы, более или равном 5,5 ммоль/л (100 мг/дл), то результаты для данной пробы нельзя использовать и все измерения для этой пробы необходимо повторить.
7.2.3 Оценка промежуточной прецизионности
7.2.3.1 Общие положения
Промежуточную прецизионность необходимо оценить для трех концентраций глюкозы.
Оценка должна быть получена из измерений прецизионности в нормальных условиях применения, т.е. одним отдельным пользователем, в течение нескольких дней, с использованием одного и того же измерителя и системы реактивов одной партии.
Оценка должна выполняться для нескольких измерителей и разных пользователей в течение не менее 10 дней.
Оценку можно выполнить на одной партии, если данные продемонстрировали, что промежуточная прецизионность (включая повторяемость) не зависит от партии реактивов. В противном случае необходимо использовать несколько партий и планировать эксперимент исходя из изменяемости от партии к партии.
Примечание - В отношении руководства по определению промежуточной прецизионности метода измерения см. [9].
7.2.3.2 Пробы
Оценку промежуточной прецизионности необходимо выполнять с контрольными материалами.
Предпочтительными пробами являются контрольные материалы, предоставляемые изготовителем. Альтернативные контрольные материалы можно использовать, если они утверждены для применения изготовителем системы мониторинга глюкозы в крови.
Контрольный материал необходимо готовить в соответствии с инструкциями по применению. Стабильность проб в течение периода выполнения оценки должна быть подтверждена.
Необходимо использовать три пробы с концентрациями глюкозы в интервалах, указанных в таблице 2. Концентрация глюкозы каждой пробы должна быть определена с помощью системы мониторинга глюкозы в крови.
Таблица 2 - Интервалы концентрации глюкозы для оценки промежуточной прецизионности
Интервал | Концентрация глюкозы, ммоль/л (мг/дл) |
1 | От 1,7 до 2,8 (от 30 до 50) |
2 | От 5,3 до 8,0 (от 96 до 144) |
3 | От 15,5 до 23,3 (от 280 до 420) |
7.2.3.3 Система реактивов
Необходимо исследовать партию или часть партии. Если не имеется полной партии, необходимо записать в протокол, что использовалась часть партии, а также статус материала.
Требуется 300 единиц системы реактивов из не менее 10 пробирок или контейнеров.
Если используется несколько партий, эксперимент необходимо спланировать таким образом, чтобы все результаты от одного измерителя были получены с использованием системы реактивов одной и той же партии.
7.2.3.4 Измерители
Для оценки промежуточной прецизионности системы мониторинга глюкозы в крови необходимо выбрать не менее 10 измерителей.
7.2.3.5 Процедура оценки
Следующая процедура представляет собой минимальный план эксперимента для оценки промежуточной прецизионности в течение нескольких дней. План требует выполнения одного измерения в день пробы в каждой концентрации глюкозы в соответствии с таблицей 2 в течение 10 дней для каждого из 10 измерителей.
Процедуру можно модифицировать, чтобы использовать несколько партий реактивов.
Единицы системы реактивов для каждой пробы необходимо брать из одной и той же пробирки/контейнера.
a) Определяют пробирку/контейнер единиц системы реактивов для каждого измерителя.
b) Берут единицу системы реактивов из каждой пробирки/контейнера и наносят на пробу.
Результат записывают.
Можно использовать пипетку для переноса (т.е. разные мерные пипетки), обеспечивающую перенос объемов пробы в пределах рекомендуемого изготовителем интервала, чтобы имитировать стандартное нанесение пробы.
c) Повторяют этап b) для каждой пробы.
d) Повторяют этапы b) и с) один раз каждый день на каждом из девяти оставшихся измерителей и пробирок или контейнеров всего в течение 10 дней. Для каждого измерительного устройства в течение всего периода оценки используют одну и ту же пробирку/контейнер.
e) Рассчитывают среднее значение, стандартное (среднеквадратическое отклонение) и коэффициент вариации () для каждого измерительного устройства по 10 измерениям.
f) Рассчитывают общее среднее, совокупное стандартное (среднеквадратическое) отклонение (на 95%-ном доверительном интервале) и совокупный . Стандартное (среднеквадратическое) отклонение и
являются критериями промежуточной прецизионности отдельной системы в течение нескольких дней.
Если оценка включает несколько партий и/или несколько пользователей, можно определить изменяемость от партии к партии и от пользователя к пользователю, а также промежуточную прецизионность для одного измерителя.
7.2.4 Анализ данных и представление данных для повторяемости и промежуточной прецизионности
Стандартное (среднеквадратическое) отклонение и коэффициент вариации для повторяемости и промежуточной прецизионности должны быть рассчитаны с помощью подтвержденных документально статистических методик. Анализ дисперсии является предпочтительным методом расчета промежуточной прецизионности.
Необходимо сообщить следующую информацию:
a) концентрацию глюкозы в каждой пробе;
b) среднее значение из наблюдаемых результатов концентрации глюкозы для каждой пробы;
c) стандартное (среднеквадратическое) отклонение повторяемости (на 95%-ном доверительном интервале) и коэффициент вариации () для каждой концентрации глюкозы выше 4,2 ммоль/л (75 мг/дл) и стандартное (среднеквадратическое) отклонение повторяемости (на 95%-ном доверительном интервале) для каждой концентрации глюкозы ниже 4,2 ммоль/л (75 мг/дл);
d) промежуточное стандартное (среднеквадратическое) отклонение (на 95%-ном доверительном интервале) и коэффициент вариации () для каждой концентрации глюкозы выше 4,2 ммоль/л (75 мг/дл) и стандартное (среднеквадратическое) отклонение (на 95%-ном доверительном интервале) для каждой концентрации глюкозы ниже 4,2 ммоль/л (75 мг/дл);
e) краткие сведения о выбросах (руководство по определению наличия выбросов приведено в [12] и [13]), определенных и исключенных из статистического анализа, включая метод идентификации и результаты исследования;
f) ссылку на методы статистического анализа.
7.3 Оценка точности системы
7.3.1 Требования
7.3.1.1 Общие положения
Точность системы должна оцениваться на не менее 100 различных субъектах в течение не менее 10 дней. Оценка должна выполняться в фактических условиях применения таким образом, чтобы включить влияние систематической погрешности (bias) и случайной погрешности (inprecision), которые могут вноситься отдельными пользователями.
Отдельные измерения системы мониторинга глюкозы в крови должны сопоставляться с опорными значениями концентрации глюкозы, определенными с помощью методики измерения изготовителя (то есть выбранной изготовителем или постоянно действующей методики измерения, или с помощью иной утвержденной методики измерения, которая продемонстрировала равноценные результаты).
Стандартный метод измерения глюкозы (например, в больнице или амбулаторно в клинической лаборатории), который утвержден для определения прецизионности и правильности путем сопоставления с выбранной изготовителем или постоянно действующей методикой измерения, можно использовать для назначения опорных значений.
Подробное описание метода измерения, использованного для определения значений, включая его прослеживаемость и/или равноценность, необходимо внести в протокол.
7.3.1.2 Пробы
Оценка точности системы должна быть выполнена на не менее 100 пробах свежей капиллярной крови, каждая из которых должна быть взята в достаточном объеме, чтобы провести измерение двумя измерителями и, как минимум, в параллельном режиме, с помощью методики измерения изготовителя.
Критерии исключения, такие как объемная доля кровяных телец в крови (гемокрит), должны базироваться на инструкциях изготовителя по применению.
Пробы капиллярной крови должны быть собраны путем прокола кожи (например, на кончике пальца), подготовлены и обработаны согласно инструкциям по применению, включая предварительную обработку пробы, если требуется. Следует использовать контейнеры с пробами, предназначенные для сбора капиллярной крови.
В некоторых случаях может потребоваться второй прокол кожи, чтобы получить пробы достаточного объема для выполнения программы.
Может оказаться затруднительным получение достаточного числа проб свежей капиллярной крови с очень высокой и очень низкой концентрациями глюкозы. В таких случаях можно применить измененные пробы капиллярной крови, в которых концентрация глюкозы повышена или понижена искусственно (см. ниже).
Концентрации глюкозы должны распределяться в диапазонах, установленных в таблице 3. Концентрации глюкозы необходимо определять с помощью системы мониторинга глюкозы в крови.
Таблица 3 - Концентрации глюкозы в пробах для оценки точности системы
Процент проб, % | Концентрация глюкозы, ммоль/л (мг/дл) |
5 | Менее 2,8 (менее 50) |
15 | От 2,8 до 4,3 (от 50 до 80) |
20 | От 4,4 до 6,7 (от 80 до 120) |
30 | От 6,7 до 11,1 (от 120 до 200) |
15 | От 11,2 до 16,6 (от 201 до 300) |
10 | От 16,7 до 22,2 (от 301 до 400) |
5 | Более 22,2 (более 400) |
Как только категория концентрации заполнена, к ней нельзя добавлять больше проб.
Для концентраций глюкозы от 2,8 до 22,2 ммоль/л (от 50 до 400 мг/дл) необходимо использовать только неизмененные пробы капиллярной крови. Если необходимо получить достаточно проб в диапазоне более низких или более высоких концентраций, концентрацию глюкозы можно отрегулировать следующим образом:
- чтобы получить дополнительные пробы с концентрацией глюкозы менее 2,8 ммоль/л (менее 50 мг/дл), пробы капиллярной крови следует собрать с соответствующим антикоагулянтом и инкубировать для гидролиза глюкозы. Условия инкубации (например, температура) для получения проб, совместимых с системой (например, без гемолиза), должны определяться изготовителем;
- чтобы получить дополнительные пробы с концентрацией глюкозы более 22,2 ммоль/л (более 400 мг/дл), пробы капиллярной крови следует собрать с соответствующим антикоагулянтом, а затем добавить глюкозы;
- необходимо подтвердить коммутабельность проб с отрегулированной концентрацией с оцениваемой системой.
От каждой пробы необходимо взять аликвоту непосредственно перед первым и сразу же после последнего измерения на системе мониторинга глюкозы в крови для параллельного измерения с помощью методики изготовителя.
Если методика измерения не разработана для проб крови и не задается процедура осаждения клеток, аликвоты пробы следует центрифугировать при 1000 g в течение 10 мин, сразу после забора, чтобы получить сыворотку (плазму).
7.3.1.3 Система реактивов
Необходимо исследовать всю партию или часть партии единиц системы реактивов. Если не имеется партии целиком, необходимо внести в протокол исследуемую часть партии и статус материала.
Требуется 200 единиц системы реактивов из не менее 10 пробирок или контейнеров. Необходимо иметь дополнительные единицы от той же самой партии для выполнения дополнительных измерений, по необходимости.
Можно использовать одну партию единиц системы реактивов, если характеризующие данные показали, что изменчивость от партии к партии является минимальным источником общей изменчивости. В противном случае в оценку точности системы необходимо включить несколько партий реактивов.
7.3.1.4 Измерители
Чтобы свести к минимуму промежуток времени между параллельными измерениями, может потребоваться использование более одного измерителя на субъект. Процедура, изложенная в 7.3.2, предполагает, что каждый субъект использует два измерителя.
Если используется более двух измерителей, их можно чередовать в ходе эксперимента так, чтобы каждым измерителем измерялось равное число проб.
Примечание - Увеличение числа измерителей в эксперименте уменьшает конкретное влияние каждого измерителя (систематическую погрешность), но может увеличить изменяемость в результате изменяемости от измерителя к измерителю (промежуточная прецизионность).
Если один и тот же измеритель используется разными субъектами, может потребоваться промывание прибора, чтобы избежать переноса патогенных микроорганизмов крови. Рекомендуется, чтобы изготовители утвердили подходящую методику промывания и включили информацию об этом в справочник пользователя.
7.3.1.5 Окружающие условия
Измерения с помощью системы мониторинга глюкозы в крови следует выполнять при температуре (23±5) °С.
Измерение проб капиллярной крови с помощью системы мониторинга глюкозы в крови преимущественно выполняется при амбулаторных исследованиях у пациентов, страдающих сахарным диабетом, или в больничных условиях. Интервал температур ±10 °С охватывает колебания окружающей температуры, обычно происходящие в этих местах.
7.3.2 Процедура оценки
Следующая методика является минимальным планом эксперимента для оценки точности системы. Она требует не менее 100 субъектов с концентрациями глюкозы в крови, распределенными по интервалу измерения в соответствии с таблицей 3.
Такая методика может быть приспособлена для исследования реактивов нескольких партий.
Для каждой пробы единицы системы реактивов следует брать из одной и той же пробирки/контейнера.
Этапы а)-f) следует выполнять для каждой пробы.
a) Присваивают номера пробиркам или контейнерам (например, от 1 до 10).
b) Получают пробу свежей капиллярной крови путем прокола кожи.
c) Берут аликвоту пробы для не менее двух параллельных измерений концентрации глюкозы с помощью методики измерения изготовителя. Если эта методика предназначена для проб плазмы, необходимо для каждой пробы выполнить процедуру приготовления плазмы (например, центрифугирование при 1000 g в течение 10 мин, чтобы осадить клетки).
d) Берут две единицы системы реактивов из пробирки/контейнера номер 1 и измеряют концентрацию глюкозы в пробе, используя два измерителя.
Пробы следует наносить на единицу системы реактивов одинаковым способом в соответствии с инструкциями изготовителя (например, непосредственно из прокола кожи субъекта). Если применяют пробы с отрегулированной концентрацией глюкозы в соответствии с 7.3.1.2, их наносят таким способом, чтобы имитировать методику, установленную в инструкциях изготовителя по применению, принимая в расчет возможные воздействия, такие как температура пробы. Меняют пробирки/контейнеры через каждые десять субъектов и обеспечивают, чтобы в оценке использовались единицы системы реактивов из всех пробирок. Результаты записывают.
e) Повторяют этап с), чтобы получить второй результат по методике измерения изготовителя.
f) Оценивают результаты по методике измерения изготовителя, чтобы проверить стабильность пробы.
Если эти результаты демонстрируют воздействие дрейфа на основе предварительно определенных критериев стабильности (например, изменение между первым и последним результатами более 4% при содержании глюкозы более 5,5 ммоль/л (100 мг/дл) или более 0,22 ммоль/л (4 мг/дл) при содержании глюкозы, более или равном 5,5 ммоль/л (100 мг/дл), то результаты для данного субъекта нельзя использовать. Бракованную пробу необходимо заменить другой пробой в том же самом интервале концентраций глюкозы.
Критерии дрейфа следует отнести к промежуточной прецизионности метода измерения. Если критерии слишком строгие, будет отброшено слишком много проб. Если критерии не жесткие, кажущаяся неопределенность методики измерения будет завышена.
g) Получают пробу от следующего субъекта и повторяют этапы b)-f).
7.3.3 Анализ данных и представление точности системы
7.3.3.1 Общие положения
Результаты должны быть нанесены на график и проанализированы с помощью одной из методик, описанных ниже.
Необходимо сообщить следующую информацию:
a) общее число проанализированных проб;
b) диапазон концентраций глюкозы;
c) график данных;
d) сводку данных статистики с доверительными интервалами;
е) краткие сведения о выбросах (руководство по определению наличия выбросов приведено в [12] и [14]), определенных и исключенных из статистического анализа, включая метод идентификации и результаты исследования.
Данные выбросов можно не исключать из набора данных, которые используют для определения минимальной приемлемой точности (7.4.1), но их следует исключить из расчета статистических параметров, чтобы избежать искажения среднего значения распределения и оценок дисперсии. Выбросы необходимо наносить на график с другим обозначением;
f) ссылку на методы статистического анализа.
Если результаты системы мониторинга глюкозы в крови сообщают в единицах другой матрицы пробы (например, плазмы), изготовитель должен предоставить пользователям, по запросу, детали преобразования и опорные данные достоверности.
7.3.3.2 Анализ точности системы
Расхождение между отдельными результатами системы мониторинга глюкозы в крови и средним значением опорных значений должно быть нанесено на график как зависимая переменная. Среднее значение опорных значений должно быть нанесено на график как независимая переменная.
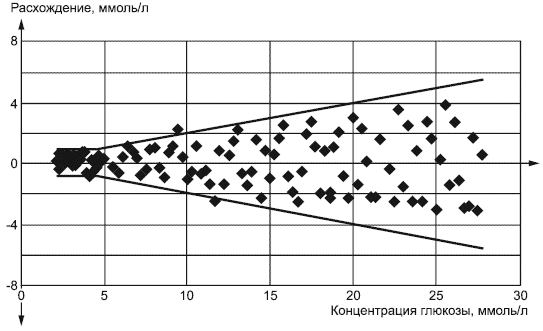
Графики расхождений являются рекомендованным подходом для изображения точности системы, поскольку статистические допущения являются минимальными, и процент точек на графике, выполняющих критерий точности системы, а также систематическая погрешность оценки легко вычисляются. См. [14] или [15].
Примечание - Нанесение на график процента расхождения в зависимости от концентрации при низких значениях концентрации обычно не подходит для графической оценки точности системы.
Пример - График результатов по оценке системы мониторинга глюкозы в крови показан на рисунке 1. Две жирные линии представляют критерии приемки из 7.4.
Рисунок 1 - График точности системы
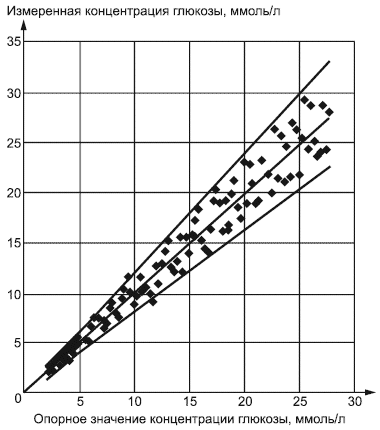
7.3.3.3 Регрессионный анализ
Отдельные результаты системы мониторинга глюкозы в крови должны быть нанесены на график как зависимая переменная, а среднее параллельных опорных значений как независимая переменная. Для осей и
должны использоваться идентичные шкалы и интервалы.
Наклон интерсепта (концентрация глюкозы, соответствующая определенной точке на графике) должен рассчитываться с помощью подходящей методики регрессионного анализа. Необходимо сообщить оценку отклонения (стандартную погрешность) (
,
), если используется линейная регрессия. Линия регрессии и линия тождественности (
) должны использоваться на графике.
Примечание 1 - Регрессионный анализ зависит от соответствия данных определенным статистическим допущениям. Для оценки регрессионных методик для исследований метода сопоставления см. [16] или [17].
Примечание 2 - Систематическую погрешность можно рассчитать из уравнения регрессии при выбранных концентрациях глюкозы (например, при медицинском выборе решения задачи о концентрациях). См. [14].
Пример - График регрессии по оценке системы мониторинга глюкозы в крови приведен ниже. Две внешние линии представляют критерии приемки из 7.4. Накладываются линии регрессии и эквивалентности.
![]()
0,9596
200
Рисунок 2 - График регрессии
7.4 Минимальная приемлемая точность системы
7.4.1 Требование к точности системы
Минимальная приемлемая точность для результатов, полученных на системе мониторинга глюкозы, должна быть следующей: девяносто пять процентов (95%) отдельных результатов концентрации глюкозы должны попадать в пределы ±0,83 ммоль/л (15 мг/дл) от результатов методики измерения изготовителя при концентрациях глюкозы менее 4,2 ммоль/л (менее 75 мг/дл) и в пределы ±20% при концентрациях глюкозы, более или равных 4,2 ммоль/л (более или равных 75 мг/дл).
Примечание 1 - Критерии минимальной приемлемой точности основаны на медицинских требованиях к мониторингу глюкозы. См. введение для дополнительной информации.
Примечание 2 - Критерии применяют к оценкам точности системы, в которых пользователи имеют соответствующую подготовку, устройство должным образом отрегулировано, выполнена требуемая настройка и методики контроля выполняются в соответствии с инструкциями изготовителя по применению.
7.4.2 Представление данных
Результаты должны быть представлены по отдельности для интервалов концентрации глюкозы менее 4,2 ммоль/л (менее 75 мг/дл) и более или равной 4,2 ммоль/л (более или равной 75 мг/дл).
a) Для концентраций глюкозы менее 4,2 ммоль/л (менее 75 мг/дл) результаты должны быть выражены как процент значений, попадающих в следующие интервалы: ±0,28 ммоль/л (±5 мг/дл), ±0,56 ммоль/л (±10 мг/дл) и ±0,83 ммоль/л (±15 мг/дл);
b) Для концентрации глюкозы, более или равной 4,2 ммоль/л (более или равной 75 мг/дл), результаты должны быть выражены как процент значений, попадающих в следующие интервалы: ±5%, ±10%, ±15% и ±20%.
Результаты должны быть представлены в таблице для каждого интервала концентраций. Рекомендуемый формат приведен в примере и таблицах 4 и 5 ниже по тексту.
Пример - Таблицы 4 и 5 иллюстрируют представление результатов для оценки, показанной в 7.3.3.2 и 7.3.3.3, в ходе которой было получено 200 результатов от 100 субъектов. Данные и критерии, используемые в определении приемлемости, выделены курсивом.
Таблица 4 - Пример представления результатов точности системы для концентрации глюкозы менее 4,2 ммоль/л (менее 75 мг/дл)
В пределах ±0,28 ммоль/л (в пределах ±5 мг/дл) | В пределах ±0,56 ммоль/л (в пределах ±10 мг/дл) | В пределах ±0,83 ммоль/л (в пределах ±15 мг/дл) |
18/40 (45%) | 28/40 (70%) | 38/40 (95%) |
Таблица 5 - Пример представления результатов точности системы для концентрации глюкозы более или равной 4,2 ммоль/л (более или равной 75 мг/дл)
В пределах 5% | В пределах ±10% | В пределах ±15% | В пределах ±20% |
36/160 (22%) | 78/160 (49%) | 136/160 (85%) | 156/160 (97%) |
7.4.3 Оценка точности системы
Чтобы определить число приемлемых результатов, приемлемость системы мониторинга глюкозы в крови должна определяться с использованием всех 200 результатов, полученных от 100 субъектов, включая все результаты, определенные как статистические выбросы. Число приемлемых результатов для концентраций глюкозы менее 4,2 ммоль/л (менее 75 мг/дл) необходимо сложить с числом приемлемых результатов для концентраций глюкозы, более или равных 4,2 ммоль/л (более или равных 75 мг/дл).
Примечание 1 - В примере в 7.4.2 38 из 40 проб с низким содержанием глюкозы были в пределах ±0,83 ммоль/л (±15 мг/дл) для концентраций глюкозы менее 4,2 ммоль/л (менее 75 мг/дл) и 156 из 160 проб с концентрацией глюкозы, более или равной 4,2 ммоль/л (более или равной 75 мг/дл) были в пределах ±20% от опорных значений. Следовательно, 194 из 200 проб (97,0%) были в пределах минимальных приемлемых эксплуатационных показателей, определенных в 7.4.1.
Примечание 2 - В каждом интервале концентраций имеется недостаточное число проб, чтобы позволить выполнить достоверную оценку приемлемости при конкретных концентрациях.
8 Оценка пользователя
8.1 Общие положения
Целью оценки показателей пользователя является демонстрация того, что пользователи способны управлять системой мониторинга глюкозы в крови, если снабдить их инструкциями и обучающими материалами, обычно прилагаемыми к системе, и получать достоверные результаты содержания глюкозы в крови. Оценка функционирования пользователя должна быть выполнена изготовителем перед поступлением в продажу новых систем мониторинга глюкозы в крови.
Примечание - Специалисты-медики, которые желают продемонстрировать работу систем мониторинга содержания глюкозы в крови для контроля состояния организма, могут обратиться для руководства к материалам [18].
Результаты, полученные непрофессионалом, должны быть сопоставлены с результатами, полученными с помощью утвержденной методики измерения содержания глюкозы, а также с результатами, полученными профессиональным медицинским работником на одной и той же пробе, с использованием одной и той же системой мониторинга содержания глюкозы в крови.
План оценки должен быть подтвержден документально в подробном протоколе. Применяют требования, установленные в EN 13612.
В каждую исследуемую партию включают не менее 50 субъектов с различными данными (возраст, пол и уровень образования).
Участники исследования должны удовлетворять требованиям системы мониторинга глюкозы [например, объемная доля кровяных телец (гематокрит) должна быть в пределах заданного для системы интервала].
Исследования пользователей должны быть выполнены с реактивами не менее чем трех разных партий.
8.2 Место выполнения оценки
Системы мониторинга глюкозы в крови для самоконтроля должны быть оценены в такой обстановке, которая позволит непрофессионалу выполнять измерения без влияния извне, то есть в соответствии с 8.1.
Основания для выбора места проведения оценки должны быть указаны в документе.
Оценка может выполняться в нескольких местах.
8.3 Оценка пользователя
Участникам исследования должны быть предоставлены инструкции по применению системы и материалы для обучения, которые обычно прилагаются к системе мониторинга глюкозы в крови.
После просмотра этих материалов пользователи должны получить пробу крови из пальца и исследовать ее с помощью системы мониторинга глюкозы в крови.
Сразу же после самоконтроля пользователя обученный медицинский персонал учреждения, где проводится исследование, должен измерить кровь пользователя на системе мониторинга глюкозы в крови.
В течение 5 мин необходимо получить вторую пробу крови. Контрольные концентрации глюкозы необходимо определить с помощью методики измерения изготовителя (то есть выбранной изготовителем или постоянно действующей методики измерения, или иной утвержденной методики измерения, которая дает равноценные результаты).
Стандартный метод измерения содержания глюкозы (например, в больнице или амбулаторно в клинической лаборатории), который утвержден для оценки прецизионности и правильности путем сопоставления с выбранной изготовителем или постоянно действующей методикой измерения, можно использовать для присвоения опорных значений.
Подробное описание методики измерения, использованной для определения значений концентрации глюкозы, включая ее прослеживаемость и/или эквивалентность выбранной изготовителем или постоянно действующей методике измерения, должно быть внесено в протокол.
Участники исследования не должны получать дополнительной подготовки, инструкций, помощи или справочных материалов, кроме тех, которые обычно поставляют вместе с системой мониторинга глюкозы в крови.
Участникам исследования может быть выдана анкета для оценки их понимания системы.
Приемы, которые применяет пользователь при работе и обслуживании системы, нанесении пробы и считывании результата, должны оцениваться профессиональным медицинским работником, участвующим в исследовании.
Результаты должны быть зафиксированы в протоколе.
8.4 Оценка инструкций по применению
Инструкции по применению должны быть оценены самими пользователями.
Участники исследования и медицинские работники должны рассмотреть инструкции по применению и представить замечания, касающиеся простоты понимания.
Такую оценку можно сопроводить исследованиями, описанными в 8.3, или исследования можно провести отдельно.
Замечания пользователей можно собрать путем опроса, анкетирования или как часть изучения человеческого фактора.
Приложение А
(обязательное)
Дополнительные требования к электромагнитной совместимости
А.1 Общие положения
Данное приложение устанавливает минимальные требования к невосприимчивости и излучениям, связанным с электромагнитной совместимостью (ЭМС), для систем мониторинга глюкозы в крови, предназначенных для самоконтроля в дополнение к требованиям 6.4.
Если анализ рисков (см. 4.5) показывает, что воздействие высоких уровней излучения или электростатического разряда представляет неприемлемый риск для пользователя, то это изделие необходимо испытывать именно при таких высоких уровнях.
А.2 Требования к тестированию восприимчивости
А.2.1 Невосприимчивость к излучениям
Применяют требования, установленные в IEC 61000-4-3.
Кроме того, невосприимчивость к излучаемым частотам должна быть расширена до диапазона частот вплоть до 2,5 ГГц при тестовом уровне 3 В/м.
А.2.2 Невосприимчивость к электростатическому разряду
Применяют требования, установленные в IEC 61000-4-2.
В отношении грозового разряда невосприимчивость к электростатическому разряду должна быть продемонстрирована при тестовых уровнях, равных ±2, ±4, ±8 кВ.
В отношении контактного разряда невосприимчивость к электростатическому разряду должна быть продемонстрирована при тестовых уровнях, равных ±2, ±4, ±6 кВ.
А.3 Требования к испытаниям системы
Если к измерителю присоединено или может быть присоединено другое оборудование, полученная система также должна выполнять требования ЭМС. При определении требований к испытаниям системы изготовитель должен учесть, возможно или нет выполнить измерение, когда к системе подсоединено другое оборудование. Конфигурации системы, установленные изготовителем или прогнозируемые конфигурации системы, идентифицированные путем анализа рисков, должны быть испытаны в соответствии с А.2, если они позволяют пользователю выполнять измерение содержания глюкозы.
Требования к испытанию системы могут не применяться, если конструкция прибора не позволяет пользователю выполнять измерения в случае присоединения к прибору другого оборудования.
А.4 Инструкции по применению
Инструкции по применению (см. 5.2) должны включать следующую информацию:
a) заявление, что оборудование соответствует требованиям, применяемым к эмиссии ЭМС, и что излучения используемой энергии вряд ли вызовут интерференцию вблизи электронного оборудования;
b) заявление, что оборудование испытывается на восприимчивость к электростатическому разряду в соответствии с IEC 61000-4-2;
c) рекомендованные меры по снижению уровня загрязнения, которые необходимо предпринять пользователю, чтобы избежать некорректной работы или повреждения прибора.
Пример 1 - "Нельзя использовать данный измеритель в сухих окружающих условиях, особенно в присутствии синтетических материалов. Синтетическая одежда, ковры и т.д. могут вызвать возникновение повреждающих электростатических разрядов в сухой атмосфере";
d) заявление, что оборудование испытывается на восприимчивость к интерференции радиочастот в диапазоне частот и тестовых уровнях, установленных в настоящем стандарте;
e) рекомендованные меры по снижению уровня загрязнения, которые необходимо предпринять пользователю, чтобы избежать интерференции радиочастот, с конкретными примерами.
Пример 2 - "Нельзя использовать данный прибор вблизи сотовых или беспроводных телефонов, переносных раций, устройств для автоматического открывания гаражных ворот или другого электрического или электронного оборудования, которые являются источниками электромагнитного излучения, поскольку они могут помешать надлежащей работе прибора".
Приложение В
(справочное)
Цепочка прослеживаемости
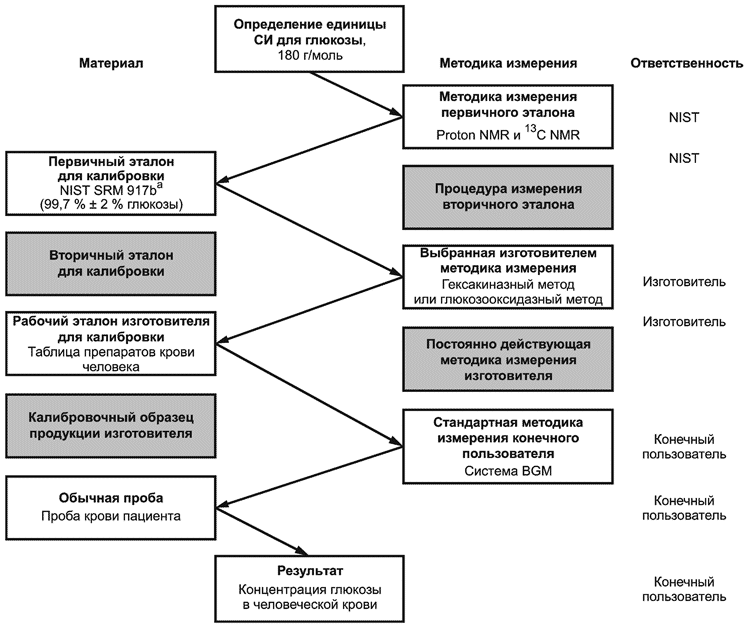
Примечание 1 - Иллюстрация полной цепочки прослеживаемости взята из ISO 17511, 4.2.2, перечисление h). Этапы, которые не используются в данной конкретной схеме калибровки, затенены серым цветом.
Примечание 2 - Данный пример не предназначен для представления единственно возможной цепочки прослеживаемости системы мониторинга глюкозы в крови.
_______________
NIST SRM 917b ссылается на Сертификат анализа, выпущенный Национальным институтом стандартов и технологии США (NIST) для стандартного образца (SRM) 917b, D-глюкозы (декстрозы), используемой для калибровки в данном примере.
Рисунок В.1 - Пример цепочки прослеживаемости для системы мониторинга глюкозы в крови, калиброванной в заводских условиях
Библиография
[1] ISO 3534-1:1993 | Statistics - vocabulary and symbols. Part 1: probability and general statistical terms (Статистические методы. Словарь и символы. Часть 1. Вероятность и общие статистические термины) |
[2] | Международный словарь основных и общих терминов в метрологии (МСМ). Женева, 2-е изд., 1993 |
[3] ISO 5725-1:1994 | Accuracy (trueness and precision) of measurement methods and results. Part 1. General principles and definitions (Точность (правильность и прецизионность) методов измерения и результатов. Часть 1. Общие принципы и определения) |
[4] ISO 15194:2002 | In vitro diagnostic medical devices - Measurement of quantities in samples of biological origin - Description of reference materials (Изделия медицинские для диагностики in vitro. Измерение величин в пробах биологического происхождения. Описание стандартных образцов) |
[5] EN 375:2001 | Information supplied by the manufacturer with in vitro diagnostic reagents for professional use (Информация, поставляемая изготовителями с диагностическими реагентами для профессионального применения) |
[6] EN 1041:1998 | Information supplied by the manufacturer with medical devices (Информация, поставляемая изготовителями с медицинскими изделиями) |
[7] EN 591:2001 | Instructions for use for in vitro diagnostic instruments for professional use (Инструкция по применению диагностических инструментов для профессионального применения) |
[8] EN 592:2002 | Instructions for use for in vitro diagnostic instruments for self-testing (Инструкция по применению диагностических инструментов in vitro для самотестирования) |
[9] ISO 5725-3:1994 | Accuracy (trueness and precision) of measurement methods and results. Part 3: Intermediate measures of the precision of a standard measurement method (Точность (правильность и прецизионность) методов измерения и результатов. Часть 3. Промежуточные меры прецизионности стандартного метода измерения) |
[10] | Council Directive 98/79/EC of the European Parliament and of the Council of the 27 October 1998 on in vitro Diagnostic Medical Devices, Official Journal of the European Union L331, December 7, 1998 |
[11] | NCCLS EP7-A, Interference testing in clinical chemistry; Approved Guideline, NCCLS document, Wayne, PA, USA, 2002 |
[12] ISO 5725-2:1994 | Accuracy (trueness and precision) of measurement methods and results. Part 2. Basic method for the determination of repeatability and reproducibility of a standard measurement method (Точность (правильность и прецизионность) методов измерения и результатов. Часть 2. Основной метод определения повторяемости и воспроизводимости стандартного метода измерения) |
[13] | NCCLS EP5-A, Evaluation of precision performance of clinical chemistry devices; Approved Guideline, NCCLS document, Wayne, PA, USA, 1999 |
[14] | NCCLS EP9-A2, Method comparison and bias estimation using patient samples; Approved Guideline, 2 |
[15] | Bland J.M. and Altman D.G. Statistical methods for assessing greement between two methods of clinical measurement. Lancet, 1, 1986, pp. 307-310 |
[16] | Linnet K. Evaluation of regression procedures for methods comparison studies. Clinical Chemistry, 1993, 39, pp.424-432 |
[17] | Stockl D., Dewitte K. and Thienpont L.M. Validity of linear regression in method comparison studies: is it limited by the statistical model or the quality of the analytical input data? Clin. Chem., 44 (11), 1998, pp.2340-2346 |
[18] | NCCLS C30-A2, Point-of-Care Blood-glucose Testing in Acute and Chronic Care Facilities; Approved Guideline, 2 |
Приложение ДА
(справочное)
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам
Таблица ДА.1
Обозначение и наименование ссылочного международного стандарта | Степень соответ- | Обозначение и наименование межгосударственного стандарта |
ISO 13485:2003 Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования | IDT | ГОСТ ISO 13485-2011 Изделия медицинские. Системы менеджмента качества. Системные требования для целей регулирования |
ISO 14971:2000 Изделия медицинские. Применение менеджмента риска к медицинским изделиям | IDT | ГОСТ ISO 14971-2011* Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
________________ * На территории Российской Федерации действует ГОСТ Р ИСО 14971-2009. - . | ||
ISO 17511:2003 Изделия медицинские для диагностики in vitro. Измерения величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам | IDT | ГОСТ ISO 17511-2011 Изделия медицинские для диагностики in vitro. Измерения величин в биологических пробах. Метрологическая прослеживаемость значений, приписанных калибраторам и контрольным материалам |
IEC 60068-2-64:1993 Испытания на воздействие внешних факторов. Часть 2. Испытания. Испытание Fh: Широкополосная случайная вибрация (цифровое управление) и руководство | - | * |
IEC 61000-4-2:95 Электромагнитная совместимость. Часть 4. Методики испытаний и измерений. Раздел 2. Испытание на невосприимчивость к электростатическому разряду | - | * |
IEC 61000-4-3:95 Электромагнитная совместимость. Часть 4-3. Методики испытаний и измерений. Испытание на устойчивость к воздействию электромагнитного поля с излучением на радиочастотах | - | * |
IEC 61010-1:2001 Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 1. Общие требования | - | * |
IEC 61010-2-101:2002 Требования к безопасности электрооборудования для проведения измерений, управления и лабораторного использования. Часть 2-101. Частные требования к медицинской аппаратуре для диагностики in vitro (IVD) | * | |
IEC 61326:97 Электрооборудование для измерения, управления и лабораторного использования. Требования к электромагнитной совместимости | - | * |
EN 376:2002 Реактивы диагностические in vitro для самоконтроля. Информация, поставляемая изготовителем | - | * |
EN 13612:2002 Оценка технических характеристик медицинских диагностических устройств in vitro | - | * |
EN 13640:2002 Оценка стабильности реактивов для диагностики in vitro | - | * |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. Примечание - В настоящем стандарте использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Электронный текст документа
и сверен по:
, 2013