ГОСТ Р ИСО 21148-2011
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ИЗДЕЛИЯ КОСМЕТИЧЕСКИЕ. МИКРОБИОЛОГИЯ
Общие требования к микробиологическому контролю
Cosmetics. Microbiology. General instructions for microbiological examination
ОКС 71.100.70*
_________________
* В ИУС N 11, 2012 ГОСТ Р ИСО 21148-2011 приводится с кодом ОКС 07.100.99, 71.100.70.
- .
Дата введения 2013-01-01
Предисловие
1 ПОДГОТОВЛЕН Рабочей группой с участием членов Технического комитета по стандартизации ТК 360 "Парфюмерно-косметическая продукция" и при содействии Российской парфюмерно-косметической ассоциации на основе собственного перевода на русский язык англоязычной версии стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации 360 "Парфюмерно-косметическая продукция"
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 6 сентября 2011 г. N 253-ст
4 Настоящий стандарт является идентичным по отношению международному стандарту ИСО 21148:2005* "Косметика. Микробиология. Общие указания по микробиологическому контролю" (ISO 21148:2005 "Cosmetics - Microbiology - General instructions for microbiological examination", IDT)
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2012 (пункт 3.5)
5 ВВЕДЕН ВПЕРВЫЕ
6 ПЕРЕИЗДАНИЕ. Апрель 2019 г.
Правила применения настоящего стандарта установлены в статье 26 Федерального закона от 29 июня 2015 г. N 162-ФЗ "О стандартизации в Российской Федерации". Информация об изменениях к настоящему стандарту публикуется в ежегодном (по состоянию на 1 января текущего года) информационном указателе "Национальные стандарты", а официальный текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ближайшем выпуске ежемесячного информационного указателя "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет (www.gost.ru)
Введение
Назначение настоящего стандарта заключается в том, чтобы общие методики, применяемые при проведении микробиологических исследований в отношении косметических изделий, оставались одинаковыми для всех лабораторий, которые признают эти стандарты, что позволит получать однородные результаты в различных лабораториях и будет способствовать охране здоровья их персонала путем предотвращения риска инфицирования.
При проведении микробиологических исследований в отношении косметических изделий особенно важным является следующее:
- необходимо выделять и подсчитывать только те микроорганизмы, которые присутствуют в пробах;
- следует исключить загрязнение окружающей среды микроорганизмами.
Чтобы достичь этого, необходимо уделять особое внимание личной гигиене и использовать рабочие методики, гарантирующие, насколько это возможно, исключение внешнего загрязнения.
При проведении микробиологических исследований является важным знание микробиологических методов и исследуемых микроорганизмов. Важно, чтобы испытания проводились, насколько это возможно, точно, включая подсчет числа микроорганизмов.
Значительное количество манипуляций может, например, непреднамеренно привести к перекрестному загрязнению, и поэтому лаборанту-микробиологу всегда требуется проверять точность результатов, полученных с помощью методик, используемых в лаборатории.
Необходимо предпринимать специальные меры предосторожности не только по соображениям гигиены, но также для обеспечения хорошей воспроизводимости полученных результатов. Невозможно предусмотреть все меры предосторожности для всех возможных ситуаций, но настоящий стандарт, по меньшей мере, предусматривает основные правила приготовления, стерилизации и хранения питательных сред и использование соответствующего оборудования.
Приведенные рекомендации позволят осуществлять подсчет и обнаружение мезофильных микроорганизмов, которые могут произрастать в аэробных условиях. Данные рекомендации распространяются на определение отсутствия или ограниченной встречаемости заданных микроорганизмов, которые представляют интерес для косметических изделий.
Методы испытаний приводятся в отдельных стандартах. Также могут использоваться другие альтернативные микробиологические методики при условии, что была продемонстрирована их равнозначность или метод был проверен иначе. Выбор определенного метода или сочетания методов, упоминаемых в этих международных стандартах, будет зависеть от цели проведения данного испытания, и пользователю решать, какой именно подход наиболее эффективен для применения.
ИСО 21148:2005 "Косметика. Микробиология. Общие указания по микробиологическому контролю" разработан Техническим комитетом ИСО/ТК 217, Косметика.
1 Область применения
Настоящий стандарт приводит общие требования к проведению микробиологических исследований косметических изделий для обеспечения их качества и безопасности в соответствии с надлежащим анализом риска (например, низкой активностью воды, водно-спиртовым содержанием, экстремальными значениями рН).
Из-за исключительно большого разнообразия изделий и их потенциального применения в данной области эти требования в полном объеме могут оказаться неподходящими для отдельных изделий (например, ряд не смешивающихся с водой продуктов).
2 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
2.1 изделие (product): Часть идентифицированного косметического изделия, полученного лабораторией для испытания.
2.2 проба (образец) (sample): Часть изделия (не менее 1 г или 1 см), которая используется в испытании для приготовления исходной суспензии.
2.3 исходная суспензия (initial suspension): Суспензия (или раствор) пробы в определенном объеме соответствующей жидкости (разбавитель, нейтрализатор, бульон или их сочетания).
2.4 разбавление пробы (образца) (sample dilution): Разбавление исходной суспензии.
3 Помещения
3.1 Площади для проведения испытаний
Площади, требуемые для специальной работы микробиологической лаборатории, отводятся для следующего:
- приемка, хранение, приготовление и обработка проб;
- приготовление и стерилизация культуральных сред, аппаратов и стеклянной посуды;
- проведение испытаний: взвешивание, разбавление, инокуляция, субкультивирование, инкубация, сохранение штаммов и т.д.;
- обеззараживание и чистка аппаратуры, стеклянной посуды и обработка отработанного материала после испытаний.
3.2 Дополнительные площади
Площади, включенные в эту категорию, являются, например, следующими:
- входы, коридоры, лестницы, лифты;
- административные площади (например, для секретариата, офисов, хранения документации и т.д.);
- гардеробы и туалеты;
- архивы;
- склады.
3.3 Местоположение помещений
Окружающая среда, в которой проводятся микробиологические испытания, не должна влиять на их надежность.
Следует выбирать такие помещения, которые исключали бы риск перекрестного загрязнения.
Необходимо соблюдать меры предосторожности с целью защиты от экстремальных условий, например, повышенной температуры, пыли, влажности, пара, шума, вибрации, воздействия прямого солнечного света и т.д.
Площадь поверхности должна быть достаточно большой, чтобы содержать рабочие места в чистоте и в надлежащем порядке.
Во время проведения испытаний доступ к месту их проведения должен быть ограничен только теми лицами, которые должны проводить эти испытания.
Раздельные помещения, и/или разделенные площади, и/или специально огороженные участки должны быть предусмотрены для следующего:
- приемка, хранение и приготовление проб;
- манипулирование с культурами микроорганизмов;
- подготовка культуральных сред, аппаратуры и стеклянной посуды;
- зоны для обеззараживания и мойки;
- стерилизация;
- термостаты, холодильники и морозильные камеры.
3.4 Оснащение помещений
3.4.1 Испытательные помещения должны быть оснащены таким образом, чтобы уменьшить риск загрязнения пылью и, следовательно, микроорганизмами:
- стены, потолки и полы должны быть гладкими, непористыми, легко моющимися и стойкими к детергентам и дезинфектантам, используемым в лабораториях;
- трубы верхней разводки для перекачки жидкостей не должны пересекать помещения, если они герметически не закрыты;
- солнцезащитные системы, если они используются, должны монтироваться снаружи окон, где это практически возможно;
- окна и двери должны закрываться при проведении испытаний, для того чтобы свести к минимуму сквозняки. Кроме того, они должны проектироваться таким образом, чтобы исключить образование мест скопления пыли и, следовательно, облегчить уборку помещений.
3.4.2 Окружающая температура и качество воздуха (содержание микроорганизмов, влажность, скорость распространения пыли и т.д.) должны соответствовать условиям проведения испытаний.
В соответствии с нуждами для этой цели рекомендуется фильтрующая вентиляция и/или микробиологический бокс.
3.4.3 Крышки лабораторных столов и мебель должны изготавливаться из гладких, непористых непроницаемых материалов, которые можно легко чистить и дезинфицировать. К верхним частям шкафов и оборудования должен быть обеспечен доступ для их чистки.
Нефиксированная лабораторная мебель должна проектироваться таким образом, чтобы облегчить чистку полов.
Документы и книги, которыми не часто пользуются, целесообразно хранить вне площадей для проведения испытаний.
3.5 Техническое обслуживание
Полы, стены, потолок, крышки лабораторных столов и мебель должны поддерживаться в хорошем рабочем состоянии, исключающем образование трещин, особенно в тех местах, где может скапливаться грязь, служащая, таким образом, источником заражения.
Регулярная чистка и, где целесообразно, дезинфекция должны проводиться для поддержания помещения в состоянии, пригодном для проведения испытаний.
Вентиляционные системы и их фильтры должны регулярно проверяться, а фильтры заменяться, когда это необходимо.
4 Оборудование
4.1 Общие требования
В общем, все оборудование должно содержаться в чистоте и в надлежащем рабочем состоянии.
Операции по техническому обслуживанию должны контролироваться. Измерительные приборы и аппаратура должны регулярно поверяться согласно соответствующему графику, и результаты регистрироваться.
4.2 Микробиологические боксы
Боксы разделяются на два типа:
a) боксы очистки воздуха, которые предназначены для защиты продукта от внешнего загрязнения и сведения к минимуму загрязнения со стороны оператора;
b) безопасные боксы, которые предназначаются для защиты продукта от внешнего загрязнения, а также для защиты оператора и окружающей среды.
Может использоваться любой бокс. Безопасные боксы должны использоваться для всех работ, связанных с риском для оператора.
Бокс представляет собой не содержащую пыли рабочую станцию, в которой поддерживается вертикальный ламинарный воздушный поток. В микробиологии безопасный бокс используется для хранения микроорганизмов на фильтрах.
4.3 Весы
Микробиологическая лаборатория для испытания косметических изделий должна быть оснащена весами нужного диапазона и точности для взвешивания различных изделий. Обычно погрешность, требуемая для взвешивания анализируемых проб и некоторых компонентов культуральных сред и реагентов, составляет ±0,01 г.
4.4 Гомогенизатор
Это оборудование (например, смеситель, качалка и т.д.) может использоваться для приготовления исходной суспензии из тест-проб нежидких изделий.
4.5 рН-метр
рН-метр должен обладать способностью к измерению с погрешностью ±0,1 ед. рН, и его минимальный порог измерения должен составлять 0,01 ед. рН.
4.6 Автоклав
Автоклав должен поддерживаться в исправном рабочем состоянии и регулярно проверяться компетентными службами в соответствии с инструкциями изготовителя, при этом соответствующая документация подлежит записи.
Автоклав не должен использоваться одновременно для стерилизации чистых материалов и для обеззараживания использованных материалов. Где возможно, должны использоваться отдельные автоклавы для проведения этих процессов.
4.7 Термостат
Термостаты должны быть оснащены системой регулирования, которая позволяет поддерживать температуры на одном стабильном уровне в течение всего рабочего объема.
Если окружающая температура близка или превышает температуру термостата, используют термостат с системой охлаждения.
Термостаты должны быть защищены от воздействия прямого солнечного света.
Термостаты не целесообразно полностью заполнять за одну отдельную операцию, так как для культуральных сред необходим продолжительный период времени для достижения температурного равновесного состояния, не зависимо от типа термостата (конвекция принудительного охлаждения или какой-либо другой принцип).
Температура должна проверяться и регистрироваться не реже одного раза в течение каждого рабочего дня.
4.8 Водяные бани
Водяные бани делятся на два типа:
- термостатически-регулируемые бани, пригодные для инкубации инокулированных культуральных сред, для идентификационных испытаний и т.д.;
- температуро-регулируемые водяные бани для поддержания стерильных агаровых сред в расплавленном состоянии с последующим использованием в заданных методиках.
Требуемая температура и точность оговариваются в каждом методе применения.
4.9 Холодильник или кабинет холодного хранения
Температура, если не оговорено иное, должна составлять (5±3)°С.
4.10 Морозильное устройство
Температура, если не оговорено иное, должна быть ниже минус 18°С.
4.11 Суховоздушный стерилизатор
Суховоздушный стерилизатор представляет собой камеру, которая позволяет разрушать микроорганизмы посредством сухого жара. В камере температура должна распределяться равномерно.
Суховоздушный стерилизатор должен быть оснащен:
- термостатом;
- термометром или регистрирующей термопарой;
- индикатором продолжительности или программным устройством/таймером.
4.12 Устройство подсчета колоний
Может использоваться устройство для подсчета колоний.
4.13 Прочее оборудование
ПРЕДУПРЕЖДЕНИЕ! Мерная стеклянная посуда не должна стерилизоваться в суховоздушном стерилизаторе.
Прочее оборудование и аппаратура повседневного использования включают следующие:
a) фильтрационный аппарат (см. ниже);
b) стеклянные или пластиковые емкости (пробирки, колбы, бутыли);
c) бактериологические чашки Петри (как правило, диаметром от 85 до 100 мм);
d) стеклянные или пластиковые пипетки вместимостью 1; 2; 10 см, автоматические пипетки;
e) инструменты для отбора проб;
f) иглы или петли (из никеля/хрома, платины/иридия или разовые пластиковые и т.д.);
g) оптический микроскоп;
h) газовая горелка или проволочная печь для прокаливания;
i) дозатор для культуральных сред и реагентов;
j) механическая мешалка.
Если используется метод мембранной фильтрации, оборудование также должно включать:
- систему мембранной фильтрации или фильтрационный аппарат, изготовленный из соответствующего материала, с держателем фильтра вместимостью не менее 50 см, и пригодный для использования фильтров с размером диаметра от 47 до 50 мм и с размером диаметра пор не более 0,45 мкм;
- тип материала мембраны выбирают таким образом, чтобы на бактерии не влияли остаточные компоненты анализируемой пробы;
- вакуумный источник, способный обеспечить равномерную скорость фильтрования (устройство также должно быть настроено на получение фильтрования порядка 100 см жидкости не менее чем за 2 мин).
5 Штаммы микроорганизмов
Штаммы, необходимые для подтверждения методологии, указаны в каждом методе применения.
6 Требования к персоналу
6.1 Компетентность
Весь персонал, занятый в микробиологической лаборатории, должен получить соответствующую подготовку, которая помогла бы ему надлежащим образом осуществлять порученную работу.
Персонал, который проводит испытания, должен обладать хорошими знаниями и достаточным практическим опытом в сфере микробиологической методологии и исследуемых микроорганизмов. Ответственные лица должны уметь интерпретировать вопросы точности и прецизионности, требуемые для получения приемлемых результатов.
6.2 Гигиена
В области личной гигиены нижеследующие меры предосторожности должны соблюдаться не только для того, чтобы избежать загрязнения проб и культуральных сред, но также для того, чтобы исключить риск хронической инфекции:
- носят лабораторную одежду, которая является светлоокрашенной, чистой и в хорошем состоянии, изготовленную из ткани, ограничивающей риски воспламеняемости; эту одежду нельзя носить за пределами рабочих мест;
- поддерживают ногти в идеальной чистоте; они должны быть хорошо обработаны и желательно короткие;
- моют руки до и после микробиологических исследований и сразу же после посещения туалета или еды; для сушки рук используют разовые бумажные или разовые тканые полотенца;
- во время инокуляции стараются не говорить, не кашлять и т.д.;
- не курят, не пьют и не едят в местах для проведения испытаний;
- не кладут продукты для личного потребления в лабораторные холодильники;
- специальные меры предосторожности должны быть приняты теми лицами, которые инфицированы или больны, так как это может привести к загрязнению проб микроорганизмами и сделать полученные результаты недействительными.
7 Подготовка аппаратуры и стеклянной посуды
7.1 Подготовка
Аппаратуру и стеклянную посуду, используемые в микробиологии, следует подготавливать таким образом, чтобы гарантировать их чистоту и/или стерильность до времени использования.
Перед стерилизацией закрывают пробками пробирки и колпачками бутыли из соответствующего материала.
Закрывают пипетки ватой или любым другим соответствующим материалом.
Если необходимо, подлежащую стерилизации аппаратуру и стеклянную посуду помещают в специальные контейнеры или обертывают соответствующим материалом (например, специальной бумагой, алюминиевой фольгой и т.д.).
7.2 Стерилизация
7.2.1 Стерилизация сухим жаром
Нагревают в суховоздушном стерилизаторе не менее 1 ч при температуре от 170°С до 180°С или используют любые параметры времени и температуры, если их правильность будет подтверждена.
Индикаторы могут использоваться для того, чтобы убедиться, что стерилизация достигнута.
7.2.2 Стерилизация паром
Нагревают не менее 15 мин при минимальной температуре 121°С в автоклаве. Индикаторы могут использоваться для того, чтобы убедиться, что стерилизация достигнута.
7.3 Одноразовая аппаратура
Одноразовая аппаратура может использоваться таким же образом, что и стеклянная посуда повторного применения (чашки Петри, пипетки, пробирки и т.д.), если технические условия являются подобными.
В этом случае следует обращаться к изготовителю с целью определения пригодности предлагаемой аппаратуры и стеклянной посуды в микробиологии (в особенности, в отношении стерильности) и отсутствия в материале веществ, которые тормозят рост микроорганизмов.
Одноразовая аппаратура должна обеззараживаться перед и после использования. Помимо методов, описанных в 7.6, может применяться прокаливание. Если в помещении имеется печь для прокаливания, обеззараживание и удаление можно осуществлять за одну операцию.
7.4 Сохранность чистой аппаратуры и стеклянной посуды
Чистую аппаратуру и стеклянную посуду необходимо защищать от внешнего загрязнения во время хранения при условиях, которые обеспечивают их чистоту.
7.5 Сохранность стерильной аппаратуры и стеклянной посуды
Перед использованием аппаратуру и стеклянную посуду необходимо хранить при условиях, которые обеспечивают их стерильность. Одноразовую аппаратуру и стеклянную посуду необходимо хранить в соответствии с техническими условиями изготовителя, исключая любое повреждение упаковки; подготовленная в лаборатории аппаратура и стеклянная посуда должны храниться в чистых контейнерах.
При стерилизации аппаратуры и стеклянной посуды, предназначенной для микробиологии, срок годности или дата изготовления должны быть приведены на каждой упаковке. Герметичную аппаратуру и стеклянную посуду можно хранить не более 3 мес перед использованием, если не оговорено иное.
7.6 Обработка загрязненного материала
После использования культура микроорганизмов или материал, контактирующий с микроорганизмами, аппаратура, стеклянная посуда и их содержимое должны обрабатываться на предмет уничтожения микроорганизмов перед чисткой или удалением, какой бы микроорганизм не рассматривался.
В зависимости от характера материалов может использоваться дезинфекция (10.1), стерилизация (7.2) или прокаливание (7.3).
7.7 Промывка
Промывают аппаратуру и стеклянную посуду после их обработки (7.6).
Опорожняют контейнеры от их содержимого.
Перед промыванием отделяют уплотнения от пробок или колпачков соответствующим образом.
Смывают осадок детергента из оборудования водопроводной водой. Промывают оборудование водой согласно 8.2.
В отсутствие какого-либо торгового изделия раствор карбоната натрия 0,125% (массовая доля) может использоваться с последующим погружением в разбавленную кислоту [например, соляную кислоту молярной концентрацией (HCI)=0,1 моль/дм
] по [6].
Специализированная аппаратура и стеклянная посуда могут использоваться с целью облегчения операций чистки (например, пипеточные промыватели, посудомоечные машины, ультразвуковые ванны и т.д.).
8 Приготовление и стерилизация культуральных сред и реагентов
8.1 Общие требования
Точное приготовление культуральных сред - одна из фундаментальных стадий в микробиологическом анализе, и ей должно быть уделено особое внимание.
8.2 Вода
ПРЕДУПРЕЖДЕНИЕ! Вода, пропущенная через ионообменник (деионизированная), может иметь высокое содержание микроорганизмов; следовательно, целесообразно не использовать такую воду, не убедившись в том, что содержание микроорганизмов в ней является низким. Обращаются к изготовителю по поводу наиболее эффективного способа минимизации микробного загрязнения. Сильно загрязненная, деионизированная вода, которая подверглась стерилизационному фильтрованию, может все еще содержать вещества, тормозящие рост некоторых микроорганизмов.
Используют дистиллированную воду эквивалентного качества, т.е. очищенную [2], [9] и [11] или деионизированную [8]. Если дистиллированную воду приготавливают из хлорированной воды, нейтрализуют хлор перед дистилляцией.
Вода должна храниться в контейнерах, изготовленных из инертных материалов (например, нейтральное стекло, полиэтилен и т.д.).
8.3 Приготовление культуральных сред
8.3.1 Общие требования
Существуют два типа приготовления культуральных сред:
- из основных ингредиентов, дегидратированных или нет, или
- из полностью сухих сред.
Следуют заданным изготовителем условиям хранения и сроку годности.
Не допускается использование культуральных сред с просроченным сроком годности (хранения).
Предохраняют лабораторные культуральные среды, которые находятся в сухом виде, от поглощения дополнительной влаги из окружающей среды во время хранения и использования.
8.3.2 Повторная гидратация
Следуют рекомендации изготовителя в отношении повторной гидратации.
8.3.3 Измерение рН
Измеряют рН с помощью рН-метра (4.5) и калибруют его, если необходимо, таким образом, чтобы после стерилизации и охлаждения до комнатной температуры данная среда имела бы заданный рН ±0,2 ед. рН, если не оговорено иное.
Примечание - Калибровку обычно проводят, используя раствор, состоящий из приблизительно 40 г/дм (около 1 моль/дм
) гидроокиси натрия (NaOH) или из приблизительно 36,5 г/дм
(около 1 моль/дм
) хлористоводородной кислоты (HCI). [6].
8.3.4 Дозировка
Дозируют среду в соответствующие емкости вручную или с помощью автоматических приборов.
8.4 Стерилизация
8.4.1 Общие требования
Стерилизацию культуральных сред и реагентов следует проводить, используя различные методики, включая следующие:
- стерилизация паром;
- стерилизация фильтрованием.
В зависимости от используемого метода после стерилизации среды она должна контролироваться, в особенности в отношении рН, окрашенности, стерильности и микробиологических характеристик.
8.4.2 Стерилизация паром
Используют автоклав (4.6) для стерилизации. В общем, стадия стерилизации занимает 15 мин и более при температуре 121°С. Адаптируют цикл стерилизации, если необходимо, на заданный объем и количество емкостей, характер загрузки и тип сред.
Характеристики стерилизации должны контролироваться посредством соответствующих средств.
8.4.3 Стерилизация фильтрацией
Стерилизация посредством фильтрации может быть проведена в вакууме или в условиях высокого давления.
Используют стерильные мембраны и фильтровальные элементы с размером диаметра пор 0,22 мкм (за исключением отдельных случаев, где может допускаться значение 0,45 мкм). Обращаются к инструкциям изготовителя в отношении использования фильтровальных элементов или мембран, которые были приобретены в стерильном состоянии.
Стерилизуют различные компоненты фильтровального устройства, собранного или нет, в автоклаве в течение 15 мин при температуре 121°С. Если необходимо, может быть проведена асептическая сборка в микробиологическом боксе после обработки в автоклаве. Некоторые устройства могут приобретаться в стерильном состоянии.
8.5 Хранение
8.5.1 Общие требования
Каждая упаковка бутылей, пробирок и чашек Петри должна маркироваться и иметь следующую информацию:
- наименование среды;
- дату приготовления и/или срок годности.
8.5.2 Приготовленные в лаборатории культуральные среды и реагенты
Культуральные среды, дозированные в пробирках или бутылях, и реагенты, которые не подлежат немедленному использованию, должны быть защищены от света и высыхания посредством соответствующих инертных пробок или завинчивающихся колпачков, имеющих инертные прокладки.
Они должны содержаться в условиях, которые препятствуют изменению их химического состава.
Не допускается использовать высохшие среды, которые были регидратированы.
Перед использованием целесообразно, чтобы температура культуральных сред находилась в равновесном состоянии с температурой лаборатории, если не оговорено иное.
Например, TSA среда, приготовленная в лаборатории, должна содержаться в колбах и храниться в темноте, обычно не более двух месяцев, если не оговорено иное.
8.5.3 Готовые к использованию культуральные среды и реагенты
Необходимо соблюдать условия инструкций изготовителя в отношении следующего:
- срока годности;
- температуры и условий хранения;
- условий использования (рН и т.д.) и
- контроля эффективности.
8.6 Плавление агаровых культуральных сред
Плавят культуральную среду путем помещения ее в баню с кипящей водой или с помощью любого другого процесса, который дает идентичный результат (например, паровой проточный автоклав).
Избегают перегрева и удаляют культуральную среду, как только она расплавилась. Выдерживают данную культуральную среду в расплавленном состоянии в водяной бане при температуре не выше чем 48°С до тех пор, пока не наступит время ее использования. Никогда не используют культуральную среду при температуре выше 48°С. Предпочтительно не выдерживать расплавленную среду более 8 ч. В случае особо чувствительных культуральных сред продолжительность плавления может быть сокращена.
Не допускается повторное плавление неиспользованной затвердевшей среды для последующего использования.
8.7 Приготовление чашек Петри
Заполняют расплавленной агаровой культуральной средой чашки Петри таким образом, чтобы получить толщину не менее 3-4 мм (например, для чашек с размером диаметра 90 мм обычно требуется от 15 до 20 см агаровой среды).
Дают агаровой среде остыть и затвердеть помещением чашек Петри на холодную горизонтальную поверхность.
Приготовленные подобным образом чашки Петри сразу же используют или хранят их (в темноте и при соответствующей температуре и продолжительности) в условиях, которые исключают изменение химического состава. Маркируют чашки в соответствии с 8.5.
Перед использованием необходимо провести высушивание.
Готовые к использованию чашки с агаровой средой хранят и используют в соответствии с инструкциями изготовителя.
9 Лабораторные пробы
9.1 Общие требования
Термины и их определения "изделие" и "проба" приведены в 2.1 и 2.2 соответственно.
9.2 Отбор проб косметического изделия
Важно, чтобы лаборатория получила изделие, которое полностью идентифицирует косметические изделия соответствующей партии. Изделие не должно быть повреждено при транспортировании или хранении.
Отбор проб должен проводиться в соответствии с определенными и соответствующими документами. Если требуемый документ отсутствует, рекомендуется, чтобы заинтересованные стороны пришли к соглашению по данному вопросу.
9.3 Транспортирование
Во время транспортирования изделия, подлежащие исследованию, должны находиться в условиях, которые сводят к минимуму изменения микробного содержания.
9.4 Приемка и хранение
Персонал лаборатории должен проверить состояние изделий при приемке и подтвердить, что их состояние и количество являются удовлетворительными. Если их состояние неудовлетворительное или количество недостаточное, лаборатория не сможет провести заданное испытание.
Однако в особых обстоятельствах, если испытание завершено, персонал должен зарегистрировать состояние изделия и причину его тестирования.
Изделия, допущенные в лабораторию, должны документироваться таким образом, чтобы процесс их нахождения прослеживался бы вплоть до момента составления протокола испытания.
Следующая информация должна быть указана:
- дата приемки;
- характеристики операции отбора проб (дата отбора проб, условия отбора проб и т.д.);
- наименование, справочная информация, происхождение и запрашивающая сторона;
- характеристики изделия.
Если необходимо, изделия, подлежащие тестированию, хранят при комнатной температуре. Изделия (2.1) и пробы (2.2) до или после испытания не инкубируют, не охлаждают или не замораживают.
9.5 Обращение с изделиями и пробами
Для устранения загрязнения окружающей среды, продукции и проб обращаются с ними таким образом, чтобы исключить какой бы то ни было риск загрязнения.
Для достижения результата:
- любой инструмент, который используется для открытия упаковки, должен быть стерильным;
- любой инструмент, который используется для удаления пробы из изделия, должен быть стерильным;
- если необходимо, санируют упаковку и открываемую крышку соответствующим образом.
9.6 Консервация и уничтожение продуктов
За исключением специальных случаев хранят изделия до тех пор, пока не будут получены все нужные результаты, или более продолжительный период, если необходимо.
Отбраковывают изделия, из которых отбирались пробы, исключая случаи, когда характер и уровень загрязнения заставляет рассматривать их как загрязненный материал (7.6).
10 Технологические режимы
10.1 Гигиенические меры предосторожности во время тестирования
Меры предосторожности должны быть приняты для проведения работы (насколько это возможно) в асептических условиях, например следующие:
a) убедиться, что рабочее место чистое и не имеет сквозняков (двери и окна закрыты);
b) до и после работы обеззараживают рабочую поверхность с помощью соответствующего дезинфектанта;
c) перед тем как приступать к работе, убеждаются в том, что в наличии имеется все для ее проведения;
d) в случае работы, проводимой в микробиологическом боксе, используют стерильные перчатки или обеззараживают руки перед тем как приступить к работе и избегают скрещивания рук и ладоней;
e) когда работают не в микробиологическом боксе, открывают контейнер с пробами вблизи очага пламени, удерживая их в наиболее возможном наклонном положении;
f) проводят работу как можно скорее, не совершая ненужных движений;
g) если общее количество разовых пипеток, чашек Петри и т.д. в упаковке не используют во время исследования, убеждаются в том, что данная упаковка закрыта надлежащим образом после отбора соответствующего количества единиц продукции;
h) стерилизуют петли и инокуляционные иглы и т.д. до и после использования вместе с рамкой, чтобы избежать расплескивания субстанций и микроорганизмов, предпочтительно используя печь для прокаливания петель, где это возможно, или одноразовые стерильные петли и иглы;
i) помещают использованные пипетки, шпатели и т.д. в специальные приемники, содержащие соответствующий дезинфектант (например, раствор гипохлорита натрия для пипеток) перед их обработкой (7.6);
j) помещают повторно используемое оборудование, которое может содержать микроорганизмы, в специальные контейнеры перед стерилизацией, до того, как их подвергнут промывке;
k) помещают используемую одноразовую аппаратуру в соответствующие контейнеры перед стерилизацией или прокаливанием (7.6);
I) сразу же удаляют протечку с помощью ватных тампонов или любого другого соответствующего материала, пропитанного соответствующим дезинфектантом, затем очищают и дезинфицируют рабочую поверхность, перед тем как продолжить работу.
Манипулирование с изделиями и последующими культурами, которые, возможно, содержат патогенные бактерии, требует введения специальных мер предосторожности. Рекомендуются следующие:
- микробиологический бокс для всех манипуляций, требуемых для проведения анализа;
- автоматические пипетки (пипетирование посредством всасывания в полость рта строго запрещено).
Примечание - Капли - основная причина загрязнения окружающей среды и инфекции. Капли могут образовываться, например:
- при использовании качалок, шприцев и т.д.;
- при опорожнении пипеток путем продувания;
- при стерилизации инокуляционных петель или игл.
Следовательно, необходимо минимизировать их образование.
10.2 Приготовление исходной суспензии и пробных разбавлений
10.2.1 Общие требования
В случае приготовления исходной суспензии и пробных разбавлений время, которое прошло между окончанием приготовления и моментом вступления инокулята в контакт с культуральной средой, не должно превышать 45 мин, если в соответствующих документах не оговорено иное.
Исходную суспензию приготавливают из пробы не менее 1 г или 1 см хорошо смешанного, испытываемого изделия.
Приготовление, калибровка инокулята - по приложению С.
Регистрируют точную массу или объем пробы .
10.2.2 Смешивающееся с водой изделие
Переносят пробу () изделия в любую подходящую емкость и проводят точное и соответствующее разбавление в соответствии с установленным стандартом.
Регистрируют коэффициент разбавления .
10.2.3 Не смешивающееся с водой изделие
Переносят пробу () изделия в любую подходящую емкость, содержащую соответствующее количество солюбизирующего агента (например, полисорбата 80) и проводят точное и соответствующее разбавление в соответствии с установленным стандартом.
Регистрируют коэффициент разбавления .
10.3 Методы подсчета
Следуют стандартному методу применения. Относительно информации см. приложение В.
10.4 Методы обнаружения
Следуют стандартному методу применения.
Основные методы идентификации изложены в приложении А.
11 Обработка результатов
Следуют стандартному методу применения.
12 Нейтрализация антимикробных свойств изделия
Перед обнаружением жизнеспособных микроорганизмов в косметическом изделии возможное торможение микробного роста со стороны пробы должно быть нейтрализовано. Во всех случаях и независимо от методологии нейтрализация антимикробных свойств изделия должна быть подтверждена.
Следуют стандартному методу применения.
Приложение А
(справочное)
Основные методы идентификации
А.1 Приготовление чистой культуры
А.1.1 Общее требование
Приготовление чистой культуры начинают с селекции колонии на или в агаровой среде, которая была инокулирована разбавлением тест-пробы или культурой.
Затем выбранную колонию инокулируют на неселективной агаровой культуральной среде. После инкубации выбирают хорошо изолированную колонию. Повторяют операцию, если это необходимо.
Используют методы чашечного высевания, описанные в А.1.2. Различные методы могут оказаться необходимыми в специальных случаях.
А.1.2 Чашечное высевание
А.1.2.1 Общие требования
Отбирают небольшое количество с поверхности хорошо изолированной колонии кончиком стерильной петли.
Затем высевают либо непосредственно с клетками, присутствующими на петле (А.1.2.2), либо приготавливают суспензию из этих клеток (А.1.2.3).
А.1.2.2 Прямой метод: Пример
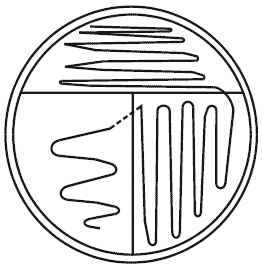
Кончиком петли инокулируют (близко расположенными штрихами) часть, приблизительно в одну треть площади, поверхности агаровой среды. Стерилизуют и охлаждают петлю. С края инокулированной площади получают другой ряд штрихов, менее плотно расположенных, чем в первый раз, на одной половине оставшейся еще не инокулированной площади поверхности. Повторяют операцию на оставшейся площади поверхности, располагая штрихи еще более широко (см. рисунок А.1).
|
Рисунок А.1 - Пример чашечного посева: прямой метод
А.1.2.3 Метод с использованием разбавления
Суспендируют клетки в селективном разбавлении объемом 1-2 см, проводя инокулированной петлей по стенке пробирки у поверхности жидкости, затем хорошо перемешивают.
Стерилизуют и охлаждают петлю. С помощью петли отбирают небольшое количество микробной суспензии и продолжают согласно А.1.2.2.
А.1.3 Инкубация
Переворачивают инокулированные чашки Петри и помещают их в термостат на заданный период времени при заданной температуре.
А.1.4 Селекция
После инкубации выбирают хорошо изолированную колонию из чашки либо для последующего высевания, либо для проводимых испытаний.
Если возможно, то окончательные испытания следует проводить, используя клетки, выращенные из одной единственной колонии. В случае недостаточного клеточного материала в одной колонии, сначала необходимо осуществить субкультивирование в жидкой среде или на скошенной агаровой среде, после чего субкультуру можно использовать для проведения испытаний.
А.2 Окраска по Граму (модифицированный метод Хакера)
А.2.1 Общие требования
Данное окрашивание бактериальных клеток допускает описание морфологии бактерий и их классификацию на две группы в зависимости от того, способны они удерживать фиолетовую окраску кристаллического фиолетового красителя в условиях испытаний или нет. Подобное деление обусловлено, главным образом, различиями в структуре клеточных стенок двух групп и коррелируется с другими существенными различиями между этими двумя группами. Существует ряд способов рассмотрения окраски по Граму, однако все они следуют последовательностям, приводимым ниже.
А.2.2 Растворы
А.2.2.1 Общие требования
Могут использоваться технически чистые растворы. В этом случае следуют рекомендациям изготовителя.
А.2.2.2 Раствор кристаллический фиолетовый
А.2.2.2.1 Химический состав
Кристаллический фиолетовый | - 2,0 г; |
Этиловый спирт (95%) | - 20 см |
Оксалат аммония ( | - 0,8 г; |
Вода | - 80 см |
А.2.2.2.2 Приготовление
Растворяют фиолетовый кристаллический в этиловом спирте и оксалат аммония - в дистиллированной воде. Смешивают два раствора и дают отстояться смеси в течение 24 ч перед применением.
А.2.2.3 Раствор йода
А.2.2.3.1 Химический состав
Йод | - 1,0 г; |
Йодид калия (KI) | - 2,0 г; |
Вода | - 100 см |
А.2.2.3.2 Приготовление
Йодид калия растворяют в 10 см дистиллированной воды, добавляют частями йод. После растворения доводят объем раствора в мерной колбе до 100 см
.
А.2.2.4 Раствор сафранина
А.2.2.4.1 Химический состав
Сафранин О | - 0,25 г; |
Этиловый спирт (95%) | - 10 см |
Вода | - 100 см |
А.2.2.4.2 Приготовление
Растворяют сафранин в этиловом спирте, затем смешивают с дистиллированной водой. Доводят объем раствора до 100 см.
При использовании раствора фиолетового кристаллического проверяют стабильность раствора. Для проверки смешивают одну каплю раствора кристаллического фиолетового с одной каплей раствора йода на предметном стекле, чтобы проследить за химической реакцией. Если на стекле видна кристаллизация, раствор фиолетового кристаллического не используют.
А.2.2.5 Метод окрашивания
После фиксации на предметном стекле (например, пламенем) бактериального мазка, приготовленного из 18-24-часовой культуры или из помутневшего бульона, покрывают мазок раствором кристаллического фиолетового (А.2.2.2). Дают реагировать в течение 1 мин.
Осторожно промывают наклоненное предметное стекло водой в течение нескольких секунд.
Покрывают предметное стекло раствором йода (А.2.2.3). Дают ему реагировать в течение 1 мин. Затем осторожно промывают наклоненное предметное стекло водой в течение нескольких секунд.
Наносят осторожно и непрерывно пленку этилового спирта (95%) на наклонное предметное стекло не более чем 30 с и до тех пор, пока не перестанет выступать фиолетовый цвет.
Наклоненное предметное стекло осторожно промывают водой в течение нескольких секунд.
Предметное стекло покрывают раствором сафранина (А.2.2.4) в течение 10 с.
Осторожно промывают наклоненное предметное стекло водой.
Предметное стекло высушивают.
А.2.2.6 Интерпретация
Исследуют предметное стекло под объективом микроскопа с большим увеличением (4.13). Те бактериальные клетки, которые окрасились в синий или фиолетовый цвет, относят к числу грамположительных, окрашенные в темно-розовый и красный - к грамотрицательным.
В отношении чистой культуры некоторых бактериальных типов как грамположительные, так и грамотрицательные клетки могут быть получены в одном и том же поле зрения микроскопа.
Примечание - У плотноупакованных клеток может отмечаться нехарактерная реакция.
А.3 Тест на каталазу
А.3.1 Общие требование
Обнаружение этого фермента, который разлагает перекись водорода (![]() ) на воду и кислород, может быть проведено с помощью бульонной культуры, агаровой культуры или одной единственной колонии на агаровой среде.
) на воду и кислород, может быть проведено с помощью бульонной культуры, агаровой культуры или одной единственной колонии на агаровой среде.
А.3.2 Из бульонной культуры
Добавляют в 1 см культуры 0,5 см
10-объемного [3% (массовая доля)] раствора перекиси водорода. Отмечают возникновение пузырьков кислорода (каталазоположительных) или их отсутствие (каталазоотрицательных).
А.3.3 Из агаровой культуральной среды
Покрывают культуру 1-2 см 10-объемного [3% (массовая доля)] раствором перекиси водорода.
Наблюдают сразу же и по истечении 5 мин независимо от того, сформировались ли пузырьки кислорода или нет.
А.3.4 Из колонии
Вводят раздельно две капли 10-объемного раствора перекиси водорода на предметное стекло микроскопа.
Отбирают колонию с помощью стерильной стеклянной или пластиковой палочки (но только не металлической иглы) и осторожно эмульгируют ее в одну из этих двух капель. Наблюдают сразу же и через несколько минут (не менее 1 мин), сформировались или нет пузырьки кислорода. В случае сомнения покрывают каждую каплю покровным стеклом и сравнивают возникновение пузырьков под обоими покровными стеклами.
Наблюдение можно проводить макроскопически или используя микроскоп с малым увеличением.
А.4 Тест на оксидазу
А.4.1 Общее требование
Обнаружение оксидазы выявляют путем изменения цвета соединения во время окисления под действием данного фермента.
А.4.2 Реагент
А.4.2.1 Химический состав
N,N,N',N'-тетраметил-3-р-фенилендиаминдигидрохлорид (![]() ) 1,0 г.
) 1,0 г.
Вода 100 см.
А.4.2.2 Приготовление
Растворяют реагент в холодной воде. Приготавливают реагент непосредственно перед его использованием.
Могут использоваться технически чистые диски или палочки. В этом случае следуют рекомендациям изготовителя.
А.4.2.3 Метод
Увлажняют фильтровальную бумагу реагентом. Берут пробу бактериальной культуры, полученной из агаровой среды, с помощью платиновой иглы или стеклянной или пластиковой палочки (никельхромовая игла дает ложный положительный результат) и наносят ее на смоченную фильтровальную бумагу.
А.4.2.4 Интерпретация полученного результата
В случае присутствия оксидазы появляется фиолетово-пурпурный цвет в течение 5-10 с. Если цвет не изменился в течение 10 с, тест рассматривается как отрицательный.
А.5 Использование биохимических тестов на идентификацию микроорганизмов
Для идентификации могут использоваться существующие в настоящее время биохимические тесты. Вместе с тем, все коммерческие тесты не обеспечивают одинаковый уровень надежности. Следовательно, их рабочие характеристики должны оцениваться перед использованием, если только они не были подтверждены изготовителем и/или независимой организацией.
Приложение В
(справочное)
Основные методы подсчета и засева
В.1 Инокуляция для разлитых планшетов
Приготавливают среду, чашки Петри, разбавители и разбавления, подлежащие исследованию, в количествах с параметрами, соответствующими плану инокуляции.
Вводят определенные объемы разбавлений, подлежащих исследованию, в чашки Петри (маркированные). Вливают определенный объем среды, оговоренный в 8.7, в каждую чашку. Сразу же осторожно смешивают расплавленную среду и инокулят таким образом, чтобы получить однородное распределение микроорганизмов в массе среды. Дают остыть и затвердеть, помещая чашки Петри на горизонтальную холодную поверхность (время затвердевания агара не должно превышать 10 мин).
В.2 Поверхностная инокуляция
Помещают инокулят в центр маркированной чашки Петри на агаровую культуральную среду (приготовленную в соответствии с 8.7). Распределяют ее равномерно и как можно скорее по поверхности среды, используя стерильный стеклянный или пластиковый шпатель, или вращают чашку до тех пор, пока нельзя будет заметить какого-либо количества жидкости на поверхности агара.
В.3 Мембранная фильтрация
Переносят соответствующее количество пробы, приготовленной и рассматриваемой как действительная, в фильтрационное устройство, смоченное небольшим объемом соответствующего стерильного разбавителя, сразу же фильтруют и промывают согласно установленной процедуре.
Переносят мембранный фильтр в чашку Петри на поверхность агаровой среды.
Приложение С
(справочное)
Приготовление и калибровка инокулятов
С.1 Культура эталонных штаммов
Чтобы улучшить повторяемость и воспроизводимость результатов, рекомендуется использовать третью (по крайней мере, вторую) субкультуру, выращенную на агаровой среде, полученной от культур, хранимых и приготовленных согласно [4]. При использовании Е. coli, P. aeruginosa, S. aureus субкультуры активируют в течение интервалов времени от 18 до 24 ч. При использовании С. albicans пригодна первая субкультура или вторая субкультура, выращенная в течение от 36 до 48 ч.
С.2 Приготовление клеточных суспензий
Берут 10 см разбавителя и вводят в 100 см
стерильную колбу, содержащую 5 г стеклянных микрошариков. Переносят полные петли клеток, выращенных на агаровой среде, в разбавитель. Клетки должны быть суспендированы в разбавителе путем погружения петли в разбавитель и трения ее о стенку колбы с целью смешивания клеток. Встряхивают колбу 2-3 мин (используя, если возможно, механическую мешалку). Отбирают пипеткой верхнюю часть суспензии (избегая любого контакта со стеклянными микрошариками) и переносят полученную суспензию в стерильную емкость.
С.3 Калибровка суспензий
Регулируют число клеток в суспензии до значений 1х10 КОЕ/см
- 3х10
КОЕ/см
(с С. albicans от 1х10
КОЕ/см
до 3х10
КОЕ/см
), используя разбавитель, и в соответствии с данными калибровки, полученными в лаборатории. Например, используют спектрофотометр [длиной волны (620±20) нм] и одноразовую кювету толщиной 10 мм. Измеряют спектральную поглощательную способность аликвоты и, если необходимо, разбавляют раствор, чтобы довести эту способность суспензии до определенного значения. Соответствующие значения оптической плотности суспензии были получены между 0,150 и 0,460, в зависимости от штаммов.
Библиография
[1] | CTFA, Microbiology Guidelines, pub. Cosmetic, Toiletry and Fragrance Assn., ISBN 1-88261-32-8, 2001 |
[2] | EP, Microbiological examination of non-sterile products (2.6.12 to 2.6.13), 4th edn., pub. European Pharmacopoeia, 2002 |
[3] | FDA, Bacteriological Analytical Manual, 8th edn., pub. U.S. Food and Drug Administration, 1995 |
[4] | EN 12353:1999, Chemical disinfectants and antiseptics - Preservation of microbial strains used for the determination of bactericidal and fungicidal activity |
[5] | ISO 6887-1:1999, Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 1: General rules for the preparation of the initial suspension and decimal dilutions)* |
[6] | ISO 7218:1996, Microbiology of food and animal feeding stuffs - General rules for the microbiological examinations)* |
[7] | ISO/IEC 17025:2005, General requirements for the competence of testing and calibration laboratories)* |
[8] | ISO/TS 11133-2:2003, Microbiology of food and animal feeding stuffs - Guidelines on preparation and production of culture media - Part 2: Practical guidelines on performance testing of culture media* |
_______________ * Официальный перевод этого стандарта находится в Федеральном информационном фонде. | |
[9] | J.P. 14:2001, General tests - Microbial limit test, pub. Japanese Pharmacopoeia |
[10] | JCIA, Microbial test methods for cosmetics, pub. Japanese Cosmetic Industry Association, 1997 |
[11] | USP 28:2005, Microbial limit test<61>, pub. U.S. Pharmacopoeia |
УДК 665.58:006.354 | ОКС 71.100.70 |
Ключевые слова: косметические изделия, микробиологический контроль, культуральные среды, помещения, оборудование, лабораторные пробы, интерпретация полученных результатов | |
Электронный текст документа
и сверен по:
, 2019