ГОСТ 33463.6-2016
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
СИСТЕМЫ ЖИЗНЕОБЕСПЕЧЕНИЯ НА ЖЕЛЕЗНОДОРОЖНОМ ПОДВИЖНОМ СОСТАВЕ
Часть 6
Методы гигиенической оценки системы водоснабжения
Life support systems on railway rolling stock. Part 6. Methods of hygienic assessment of water supply system
МКС 45.040
ОКП 31 8000
Дата введения 2017-01-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным унитарным предприятием "Всероссийский научно-исследовательский институт железнодорожной гигиены Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека" (ФГУП ВНИИЖГ Роспотребнадзора)
2 ВНЕСЕН Межгосударственным техническим комитетом по стандартизации МТК 524 "Железнодорожный транспорт"
3 ПРИНЯТ Евразийским советом по стандартизации, метрологии и сертификации (протокол от 29 февраля 2016 г. N 85-П)
За принятие стандарта проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Туркмения | TM | Главгосслужба "Туркменстандартлары" |
(Поправка. ИУС N 1-2023).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 17 мая 2016 года N 324-ст межгосударственный стандарт ГОСТ 33463.6-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2017 года
5 ВВЕДЕН ВПЕРВЫЕ
Настоящий стандарт может быть применен на добровольной основе для оценки соответствия требованиям технических регламентов Таможенного союза: "О безопасности железнодорожного подвижного состава", "О безопасности высокоскоростного железнодорожного транспорта"
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты" (по состоянию на 1 января текущего года), а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет ()
ВНЕСЕНА поправка, опубликованная в ИУС N 1, 2023 год
Поправка внесена изготовителем базы данных
Введение
Настоящий стандарт является частью комплекса стандартов из семи частей, устанавливающих методы испытаний по определению значений показателей, характеризующих подвижной состав с точки зрения способности системы жизнеобеспечения создать и поддерживать в его помещениях необходимые, и в первую очередь, безопасные условия для жизнедеятельности человека (условия, безопасные по параметрам микроклимата, шума, вибрации, электромагнитных излучений, по микробиологическим показателям, санитарно-химическим и эргономическим).
Настоящий стандарт устанавливает состав, методы определения и оценки санитарно-микробиологических и санитарно-химических показателей воды в системе хозяйственно-питьевого водоснабжения железнодорожного подвижного состава, порядок отбора проб для проведения санитарно-микробиологического и санитарно-химического анализа по указанным показателям, с тем чтобы дать гигиеническую оценку системы водоснабжения, то есть определить, не ухудшает ли система водоснабжения качество исходной воды, поступающей из централизованной системы водоснабжения, и оценить соответствие качества воды в системе водоснабжения объекта испытаний гигиеническим нормативам.
Требования стандарта сформированы на основе результатов анализа методов контроля качества питьевой воды, приведенных в межгосударственных стандартах, методических документах Российской Федерации, международных стандартах, а также на основе обобщения опыта проведения разработчиками гигиенической оценки систем водоснабжения железнодорожного подвижного состава, позволяющего отразить специфику этой оценки применительно к системе водоснабжения локомотивов, моторвагонного подвижного состава и специального железнодорожного подвижного состава.
1 Область применения
Настоящий стандарт распространяется на локомотивы, моторвагонный подвижной состав (МВПС) и специальный железнодорожный подвижной состав (СПС), оснащенный системой хозяйственно-питьевого водоснабжения (далее - система водоснабжения) и устанавливает методы гигиенической оценки этой системы по санитарно-химическим и санитарно-микробиологическим показателям.
Примечание - Настоящий стандарт может быть использован для гигиенической оценки систем водоснабжения, применяемых в изотермических вагонах со служебными и вспомогательными помещениями и иных объектах железнодорожного транспорта. Методы, установленные настоящим стандартом, могут быть использованы для гигиенической оценки системы водоснабжения (или ее элементов) до установки на подвижной состав.
2 Нормативные ссылки
В настоящем стандарте использованы ссылки на следующие межгосударственные стандарты:
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.4.004-74 Респираторы фильтрующие противогазовые РПГ-67. Технические условия
ГОСТ 12.4.253-2013 (EN 166:2002) Система стандартов безопасности труда. Средства индивидуальной защиты глаз. Общие технические требования
ГОСТ 83-76* Реактивы. Натрий углекислый. Технические условия
________________
* Вероятно, ошибка оригинала. Следует читать: ГОСТ 83-79. - .
ГОСТ 245-76 Натрий фосфорнокислый однозамещенный 2-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2156-76 Натрий двууглекислый. Технические условия
ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 4159-79 Реактивы. Йод. Технические условия
ГОСТ 4170-78 Реактивы. Натрий-аммоний фосфорнокислый двузамещенный 4-водный. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 4209-77 Магний хлористый 6-водный. Технические условия
ГОСТ 4232-74 Реактивы. Калий йодистый. Технические условия
ГОСТ 4233-77 Реактивы. Натрий хлористый Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4523-77 Реактивы. Магний сернокислый 7-водный. Технические условия
ГОСТ 4530-76 Реактивы. Кальций углекислый. Технические условия
ГОСТ 5556-81 Вата медицинская гигроскопическая Технические условия
ГОСТ 5962-2013 Спирт этиловый ректификованный из пищевого сырья. Технические условия
ГОСТ 6038-79 Реактивы. D-глюкоза. Технические условия
ГОСТ 6552-80 Реактивы. Кислота ортофосфорная. Технические условия
ГОСТ 6672-75 Стекла покровные для микропрепаратов. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 9412-93 Марля медицинская. Общие технические условия
ГОСТ 11773-76 Реактивы. Натрий фосфорно-кислый двузамещенный. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13805-76 Пептон сухой ферментативный для бактериологических целей. Технические условия
ГОСТ 17206-96 Агар микробиологический. Технические условия
ГОСТ 17269-71 Респираторы фильтрующие газопылезащитные РУ-60м и РУ-60му. Технические условия
ГОСТ 17626-81 Казеин технический. Технические условия
ГОСТ 17726-81 Стерилизаторы медицинские паровые, воздушные и газовые. Термины и определения
ГОСТ 18300-87 Спирт этиловый ректификованный технический. Технические условия*
_______________
* На территории Российской Федерации утратил силу, действует ГОСТ Р 55878-2013 Спирт этиловый технический гидролизный ректификованный. Технические условия.
ГОСТ 20010-93 Перчатки резиновые технические. Технические условия
ГОСТ 20015-88 Хлороформ. Технические условия
ГОСТ 21241-89 Пинцеты медицинские. Общие технические требования и методы испытаний
ГОСТ 22280-76 Реактивы. Натрий лимоннокислый 5,5-водный. Технические условия
ГОСТ 23932-90 Посуда и оборудование лабораторные стеклянные. Общие технические условия
ГОСТ 24849-2014 Вода. Методы санитарно-бактериологического анализа для полевых условий
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 25706-83 Лупы. Типы, основные параметры. Общие технические требования
ГОСТ 27068-86 Реактивы. Натрий серноватистокислый (натрия тиосульфат) 5-водный. Технические условия
ГОСТ 27384-2002 Вода. Нормы погрешности измерений показателей состава и свойств
ГОСТ 29227-91 Посуда лабораторная стеклянная. Пипетки градуированные. Часть 1. Общие требования
ГОСТ 31861-2012 Вода. Общие требования к отбору проб
ГОСТ 31862-2012 Вода питьевая. Отбор проб
ГОСТ 31942-2012 (ISO 19458:2006) Вода. Отбор проб для микробиологического анализа
ГОСТ 31955-2012* (ISО 9308-1:2000) Вода питьевая. Обнаружение и количественный учет Escherichia coli и колиформных бактерий. Часть 1. Метод мембранной фильтрации
________________
* Вероятно, ошибка оригинала. Следует читать: ГОСТ 31955.1-2013, здесь и далее по тексту. - .
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями.
3.1 |
гигиенические нормативы качества питьевой воды: Совокупность научно-обоснованных и установленных нормативной документацией предельно допустимых значений показателей органолептических свойств, содержания химических веществ и микроорганизмов в питьевой воде, гарантирующих безопасность и безвредность питьевой воды для жизни и здоровья человека независимо от продолжительности ее использования. [ГОСТ 30813-2002, статья 2] |
3.2 |
проба воды: Определенный объем воды, отобранный для исследования ее состава и свойств. [ГОСТ 30813-2002, статья 33] |
3.3 |
точка отбора пробы воды: Зафиксированное местоположение отбора проб воды. [ГОСТ 30813-2002, статья 37] |
3.4 водоочистка: Процесс по очистке, доочистке, обеззараживанию воды в специальных устройствах (устройства водоочистки) с целью улучшить ее качество для питьевых и хозяйственно-бытовых нужд человека. 3.5 общее микробное число; ОМЧ (total plate count): Общее число аэробных и факультативно анаэробных гетеротрофных микроорганизмов, использующих для питания органические вещества, обладающих способностью образовывать видимые при двукратном увеличении на питательном агаре колонии при температуре (36±2)°С в течение 24 ч. Примечание - Входящие в эту группу микроорганизмы при превышении допустимого уровня указывают на биологическое загрязнение, наличие в воде легко усвояемых органических веществ и биообрастаний на поверхностях конструкций систем водоснабжения, на неблагоприятное санитарное состояние систем хранения и подачи воды и целостности распределительных систем, а также являются технологическим показателем эффективности процесса водоочистки. 3.6 |
индикаторные микроорганизмы: Условные группы микроорганизмов, присутствие которых свидетельствует о наличии антропогенного загрязнения и (или) недостаточной очистке воды. [ГОСТ 30813-2002, статья 61] |
3.7 колиформные бактерии (coliform bacteria): Грамотрицательные, оксидазоотрицательные, не образующие спор палочки семейства Enterobacteriaceae, относящиеся к типу ферментирующих бактерий, обладающие свойством образовывать колонии в аэробных условиях на селективной дифференциальной лактозной среде с образованием кислоты при температуре (36±2)°С в течение 24 ч. Примечание - Колиформные бактерии - индикаторная группа бактерий, которая указывает на фекальное загрязнение воды и возможность присутствия возбудителей водоассоциированных бактериальных кишечных инфекций. В очищенной и дезинфицированной воде их обнаружение означает, что обработка была проведена некачественно или произошло вторичное микробное загрязнение. 3.8 Esherichia coli; E.coli: Аэробные и факультативно анаэробные колиформные бактерии, обладающие свойством ферментировать лактозу при температуре (44,0±0,5)°С в течение 24 ч с образованием кислоты и газа, а также продуцировать индол из триптофана в течение (21±3) ч. Примечание - Индикаторная группа бактерий, включающая в себя преимущественно Escherichia coli - показатель фекального загрязнения, поступившего в воду недавно, наиболее опасного в эпидемическом отношении. 3.9 бактерии семейства Enterobacteriaceae: Грамотрицательные, оксидазоотрицательные, лактозоотрицательные бактерии, обладающие свойством образовывать колонии в аэробных условиях на селективной дифференциальной лактозной среде и способные ферментировать глюкозу с образованием кислоты и газа при (36±2)°С в течение 24 ч. Примечание - Бактерии семейства Enterobacteriaceae - лактозоотрицательные бактерии, в том числе патогенные и потенциально-патогенные виды, обнаружение которых указывает не только на фекальное загрязнение, но и позволяет оценить гигиеническое состояние и эпидемическую опасность анализируемой воды. 3.10 энтерококки (Enterococcus): Грамположительные, каталазоотрицательные, полиморфные, круглые или овальные с заостренными концами кокки, располагающиеся попарно или в коротких цепочках, обладающие свойством образовывать колонии на питательных средах, содержащих 0,04% азида натрия и 2,3,5 трифенилтетразолийхлорид (ТТХ), способностью роста на питательной среде, содержащей 6,5% NaCl и образующие характерные колонии на средах с эскулином. Примечание - К группе энтерококков (фекальных энтерококков) относят Enterococcus faecalis с биоварами, Enterococcus faecium, Enterococcus durans. Обнаружение их в воде, даже в отсутствие E.coli, указывает на фекальное загрязнение воды. Обладают высокой устойчивостью в объектах окружающей среды. 3.11 род Псевдомонад: Аэробные грамотрицательные оксидазоположительные каталазоположительные палочки, не образующие спор, распространенные в водной среде, участвующие в образовании биопленок на поверхностях конструкций систем водоснабжения. Примечание - Псевдомонады, в том числе Pseudomonas aeruginosa (Синегнойная палочка), способны длительно выживать в водной среде и устойчивы ко многим обеззараживающим агентам (по сравнению с колиформными бактериями), не требовательны в отношении питательных веществ и температуры размножения, выживают на внутренних поверхностях трубопроводов от 60 до 210 сут при температуре от 4°С до 44°C, выделяют эндотоксин и другие, активно действующие вещества (апастазу, коллагеназу), ввиду чего вызывают целый ряд различных заболеваний кожных покровов, верхних дыхательных путей, глаз и других слизистых, кишечные инфекции. 3.12 |
колифаги: Бактериальные вирусы, способные лизировать E.coli и формировать при температуре (36±2)°С через 18-24 ч зоны лизиса на питательном агаре. Примечание - Благодаря сходству с кишечными вирусами человека и большей устойчивости по сравнению с индикаторными группами бактерий их рассматривают как показатели возможного вирусного загрязнения воды. [ГОСТ 30813-2002, статья 68] |
3.13 легионеллы (Legionella pneumophila): Разновидность патогенных для человека грамотрицательных бактерий, колонизирующих системы горячего водоснабжения, оптимальная температура для развития которых от 30°С до 55°С. Примечание - Возбудители пневмонии "болезни легионеров" и лихорадки Понтиака. Путь передачи инфекции - через водные аэрозоли. Активно колонизируют поверхности водопроводного оборудования с образованием биопленок. 3.14 биопленка (биообрастание): Тип устойчивых микробных образований (сообществ), прикрепленных к субстрату (адгезия), у которых экспрессируются иные гены, чем у отдельных свободно живущих микроорганизмов, в результате чего биопленка ведет себя как отдельный "многоклеточный организм", сформированный специфическим образом, при этом каждый слой клеток выполняет определенную функцию: некультивируемое состояние части клеток, питание, защита от внешних воздействий и т.д. Примечание - Микроорганизмы, живущие в составе биопленок, могут вызывать инфекционные заболевания у людей и биодеструкцию материалов. 3.15 |
централизованная система питьевого водоснабжения: Комплекс устройств, сооружений и трубопроводов, предназначенных для забора, подготовки или без нее, хранения, подачи к местам потребления питьевой воды и открытой для общего пользования. [ГОСТ 30813-2002, статья 30] |
3.16 передвижная лаборатория: Средства (мобильного) передвижения и оснащения, предназначенные для проведения санитарно-микробиологического анализа воды на месте отбора проб на специально для этого предназначенных передвижных транспортных средствах (железнодорожный подвижной состав, автомобили), функционирующие при автономном режиме энергообеспечения. 3.17 переносная лаборатория: Комплект переносного оборудования для проведения санитарно-микробиологического анализа воды на месте отбора проб с последующей доставкой в стационарную лабораторию на любом транспортном средстве, специально для этих целей не предназначенном. |
4 Общие положения
4.1 Методы гигиенической оценки системы водоснабжения основываются на сравнении качества воды из системы водоснабжения железнодорожного подвижного состава, упомянутого в разделе 1 (далее - объект испытаний), и качества исходной (заправляемой) воды по санитарно-микробиологическим и санитарно-химическим показателям.
Примечание - Материалы, из которых изготовлена конструкция системы водоснабжения объекта испытаний и оборудование, используемое для водоочистки (доочистки) и водоподготовки, в процессе его эксплуатации не должны ухудшать качество исходной (заправляемой) воды по санитарно-микробиологическим и санитарно-химическим показателям: ухудшать органолептические свойства воды, приводить к поступлению в воду соединений в концентрациях, превышающих гигиенические нормативы, способствовать биообрастанию деталей конструкции и развитию микрофлоры в воде, образовывать соединения и (или) продукты трансформации в концентрациях, превышающих гигиенические нормативы.
4.2 Для оценки качества воды по указанным в 4.1, 8.1.1, 9.1.1 показателям используют методы санитарно-микробиологического и санитарно-химического анализа питьевой воды, позволяющие определить количественные значения и (или) качественные характеристики показателей.
4.3 Материал для анализа и оценки получают в ходе проведения испытаний, обеспечивающих отбор из системы водоснабжения объекта испытаний проб воды:
отражающих качество (состав и свойства) воды в системе;
в точках, позволяющих оценить различные участки системы (см. 5.1);
в количестве (и объемах), необходимых для последующего анализа (для определения исследуемых показателей);
при соблюдении требований к подготовке системы, к оборудованию для отбора и условиям отбора, хранения и транспортирования проб, обусловленных свойствами объектов анализа.
4.4 Результаты анализа проб воды из системы водоснабжения оценивают по гигиеническим нормативам качества питьевой воды и сравнивают с результатами анализа проб исходной (заправляемой) воды.
Примечание - Качество воды в системах водоснабжения объекта испытания должно соответствовать гигиеническим требованиям к качеству воды централизованных систем питьевого водоснабжения*.
_______________
* На территории Российской Федерации действует СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества".
5 Подготовка к испытаниям
5.1 Определение точек отбора
5.1.1 Перед испытаниями проводят анализ конструкторской документации, содержащей сведения, необходимые для определения точек отбора проб (схемы, чертежи или описание планировки помещений объекта испытаний), на основании которого определяют количество и места размещения водоразборных устройств системы водоснабжения: кранов (в санузлах, служебных и бытовых помещениях, кафе, барах и т.п.), душевых модулей.
5.1.2 Отбор проб воды проводят в каждой точке потребления воды (из всех кранов системы водоснабжения).
Кроме того, обязательна точка отбора воды (исходной), поступающей в систему водоснабжения объекта испытаний.
Примечание - В вагоне МВПС, СПС салонной или купейной планировки отбирают пробы из всех кранов системы водоснабжения в санузлах, служебных и бытовых помещениях, в вагоне купейной планировки с наличием точек потребления воды в каждом купе - отбирают пробы не менее чем в трех точках потребления (в начале, середине и конце вагона), в вагоне с барами (буфетами) отбирают также пробы в точках потребления воды для целей обслуживания посетителей (из каждого крана).
5.1.3 При оборудовании системы водоснабжения объекта испытания дополнительными устройствами доочистки и обеззараживания воды точки отбора проб устанавливают до и после доочистки и обеззараживания.
5.2 Подготовка системы водоснабжения
5.2.1 Система водоснабжения объекта испытаний до их проведения должна быть подготовлена к отбору проб воды: проведена дезинфекция и промывка, заправка водой. Порядок проведения дезинфекции и промывки приведен в А.1 (приложение А), порядок заправки системы водоснабжения приведен в А.2 (приложение А).
5.2.2 Система должна быть полностью заправлена водой не менее, чем за 6 ч и не более чем за 12 ч до начала отбора проб по санитарно-микробиологическим и санитарно-химическим показателям.
6 Отбор проб
6.1 Отбор проб воды для гигиенической оценки системы водоснабжения проводят в стационарных условиях.
6.2 Общий порядок отбора проб воды (для микробиологического и санитарно-химического анализа) по ГОСТ 31861.
6.3 В каждой точке (определенной в соответствии с 5.1) системы водоснабжения отбирают по одной пробе воды на санитарно-химические и санитарно-микробиологические показатели.
6.4 Отбор проб воды для микробиологического анализа
6.4.1 Пробы воды для микробиологического анализа отбирают в соответствии с требованиями ГОСТ 31942 (пункты 5.1, 5.8, 5.9-5.12, 6.1.3, 6.1.5, 6.1.6) с учетом необходимых объемов для определения исследуемых показателей и в соответствии с ГОСТ 31862 (пункт 5.3).
6.4.2 Перед отбором проб водопроводные краны следует предварительно фламбировать (обжечь пламенем), после чего произвести спуск воды продолжительностью не менее 5 и не более 10 мин при полностью открытом кране.
6.4.3 Отбор проб воды на санитарно-микробиологические показатели проводят в стерильные емкости по ГОСТ 31942 (пункты 5.3, 5.7), предназначенные для отбора проб питьевой воды, одноразового использования (из полимерных материалов) или многоразового (из стекла) с тиосульфатом натрия из расчета 20 мг/дм или 10 мг на 500 см
. Емкости при отборе, неополаскивая, заполняют на 2/3 их объема.
Примечания
1 Отбор проб воды, поступающей из разводящей сети централизованной системы питьевого водоснабжения и подвергнутой обеззараживанию с помощью дезинфектанта, проводят с нейтрализатором для нейтрализации (дезактивации) остаточного количества дезинфицирующего реагента по ГОСТ 31942 (пункт 5.7, приложение ДВ).
2 Тиосульфат натрия используют для нейтрализации хлора в воде.
6.5 Отбор проб воды для санитарно-химического анализа
6.5.1 Пробы воды отбирают в соответствии с требованиями ГОСТ 31861 (пункты 3.5-3.7) и требованиями по отбору проб межгосударственных и национальных стандартов или методических документов по 9.1.2.
6.5.2 Непосредственно перед отбором проб в течение 2-3 мин осуществляют слив воды.
6.5.3 Отбор проб воды на санитарно-химические показатели проводят в емкости с плотно закрывающимися пробками, снабженными инертными прокладками одноразового или многоразового использования, которые перед заполнением ополаскивают исследуемой водой не менее трех раз, после чего заполняют емкость водой до края, не оставляя воздушного пространства между крышкой и поверхностью воды.
6.6 На емкость (этикетку) наносится маркировка, содержащая информацию о месте отбора, точке отбора, дате и времени отбора в соответствии с ГОСТ 31942 (пункт 8.2).
Допускается кодирование проб с отражением номера в акте отбора проб в соответствии с ГОСТ 31942 (пункты 8.2, 8.3).
6.7 Хранение и транспортирование проб воды
6.7.1 Транспортирование проб воды для проведения анализа осуществляется в специальных контейнерах (термосумках), оснащенных термоэлементами, обеспечивающими поддержание температурного режима доставки по 6.7.2.
6.7.2 Допустимый срок хранения проб воды (от момента отбора проб до начала проведения анализа) для определения значений всех санитарно-микробиологических (по 8.1) и санитарно-химических показателей (по 9.1), характеризующих качество воды в системе водоснабжения объекта испытаний на момент отбора, составляет 6 ч при температуре от 4°С до 10°C.
Примечание - При необходимости определения значений отдельных показателей допустимый срок хранения проб воды по ГОСТ 31861 (пункт 5.5). Максимальный допустимый срок хранения проб воды, в соответствии с ГОСТ 31942 (приложение А), при температуре (5±3)°С составляет: для определения общего микробного числа, E.coli, колиформных бактерий, энтерококков, патогенных микроорганизмов кишечной группы 12-18 ч, для иных потенциально-патогенных бактерий семейства Enterobacteriaceae - 48 ч, Pseudomonas aeruginosa 8-12 ч, Legionella spp. - 24 ч.
6.7.3 Для правильной оценки результатов анализов фиксируют температуру воздуха при отборе проб, а также дополнительные сведения или факторы и отклонения от установленной процедуры отбора, доставки, хранения, которые могут повлиять на результат анализов по ГОСТ 31942 (пункт 8.4).
6.8 Отбор проб подтверждается актом отбора. Форма акта отбора приведена в приложении Б.
7 Требования к средствам измерений, испытательному и вспомогательному оборудованию, стандартным образцам
7.1 Применяемые средства измерений и испытательное оборудование должны соответствовать требованиям национального законодательства об обеспечении единства измерений*.
_______________
* В Российской Федерации действуют Федеральный закон "Об обеспечении единства измерений" N 102-ФЗ от 26 июня 2008 года, правила по метрологии ПР 50.2.006-94 "Государственная система обеспечения единства измерений. Порядок проведения поверки средств измерений" и ГОСТ Р 8.568-97 "Государственная система обеспечения единства измерений. Аттестация испытательного оборудования. Основные положения".
7.2 Измерение температуры воздуха производят средствами измерения температуры с пределами погрешности ±1°С, относительной влажности (для целей 8.2.3) - гигрометрами с погрешностью не более 5%.
7.3 Для регистрации времени используют часы с пределами погрешности точности хода ±1 мин в сутки, а также средства измерений температуры с функцией фиксации времени с погрешностью, не превышающей указанную.
7.4 Термостаты должны обеспечивать поддержание температуры в пределах (36±2)°С, (44,0±0,5)°С.
7.5 Для измерения массы применяют весы лабораторные с наибольшим пределом взвешивания не менее 200 г (с пределами допускаемой погрешности ±0,02 г) и не менее 1000 г (с пределами допускаемой погрешности ±0,1 г).
7.6 Для измерения водородного показателя pH используется PH-метр с диапазоном измерений от 0 до 14 ед.рН с пределами допускаемой погрешности ±0,01 ед.рН.
7.7 Для оптической стандартизации бактериальных взвесей применяют оптический стандарт мутности на 10 единиц.
7.8 Вспомогательное оборудование, обеспечивающее допустимые условия доставки проб воды (термосумки, переносной термостат, термоконтейнер или иное оборудование) подвергают периодической проверке технического состояния в соответствии с указаниями, содержащимися в инструкциях по эксплуатации этого оборудования или паспортах на них.
7.9 Оборудование для отбора проб на санитарно-химические показатели должно соответствовать требованиям ГОСТ 31861 (пункты 4.1, 4.4, 4.7-4.10), на санитарно-микробиологические показатели - ГОСТ 31942 (пункты 5.3, 5.5, 5.6).
7.10 Оборудование для санитарно-химического анализа воды должно соответствовать требованиям стандартов или методических документов по 9.1.2.
7.11 Санитарно-микробиологический анализ воды проводится в стационарной микробиологической лаборатории. Оборудование микробиологической лаборатории, расходные материалы, реактивы, питательные среды - см. приложение В.
Примечание - Для обеспечения сроков начала анализа по 6.7.2 допускается провести посев проб (начальный этап анализа) в условиях переносной или передвижной лаборатории (в случае, когда не предоставляется возможным в срок доставить пробы в стационарную лабораторию) при наличии оборудования, удовлетворяющего требованиям ГОСТ 24849 (пункт 5.3).
8 Методы санитарно-микробиологического анализа
8.1 Определяемые показатели
8.1.1 При гигиенической оценке системы водоснабжения объекта испытаний по санитарно-микробиологическим показателям определяют:
- общее микробное число;
- показатель "Escherichia coli";
- показатель "Колиформные бактерии";
- показатель "Энтерококки";
- показатель "Колифаги";
- показатель "Pseudomonas aeruginosa" (далее - Р.aeruginosa).
8.1.2 При микробиологическом анализе ОМЧ определяют количество колонии образующих единиц в 1 см исследуемой пробы воды (КОЕ/см
).
8.1.3 При определении показателей Escherichia coli (E.coli), колиформных бактерий проводят трехкратное исследование по 100 см отобранной пробы воды. Энтерококки определяют в 100 см
пробы воды.
8.1.4 При отсутствии роста E.coli и (или) колиформных бактерий, но наличии роста оксидазоотрицательных бактерий, проводят определение их принадлежности к бактериям семейства Enterobacteriaceae по ферментации глюкозы, при обнаружении роста оксидазоположительных бактерий проводят определение показателя P.aeruginosa и устанавливают "наличие-отсутствие" этих бактерий в исследованной пробе воды.
8.1.5 Обнаружение в пробе воды Escherichia coli и (или) колиформных бактерий более 5 КОЕ/100 см, и (или) колифагов более 2 БОЕ/100 см
является показанием к определению патогенных микроорганизмов (Salmonella, Shigella, Yersinia, Legionella pneumophila, P.aeruginosa, Klebsiella, Citrobacter и другие).
8.1.6 Для санитарно-микробиологического анализа используют наборы реагентов и сред питательных микробиологических, а также иные изделия медицинского назначения, разрешенные к применению на территории государства, принявшего стандарт*.
_______________
* На территории Российской Федерации обращение медицинских изделий (в том числе наборов реагентов и сред питательных микробиологических) включает государственную регистрацию, подтверждение соответствия, а также применение на основе технической документации производителя в соответствии с Федеральным законом "Об основах охраны здоровья граждан в Российской Федерации" N 323-ФЗ от 21.11.2011 г. (статья 38, пункты 3, 4, 10).
8.2 Методы определения общего микробного числа
8.2.1 Определение общего числа микроорганизмов (ОМЧ), образующих колонии на питательном агаре
8.2.1.1 Метод определяет в питьевой воде общее число мезофильных и аэробных микроорганизмов, способных образовывать колонии на питательном агаре при температуре (36±2)°С в течение 24 ч, видимые с увеличением в 2 раза.
8.2.1.2 При выполнении анализа из каждой пробы воды делают посев не менее двух объемов по 1 см без разведения.
Посев воды проводят после тщательного перемешивания пробы. Посев производят, внося по 1 см воды из пробы в стерильные чашки Петри, слегка приоткрывая крышку. Сразу после внесения воды в каждую чашку Петри наливают небольшое количество (от 8 до 10 см
на одну чашку Петри диаметром 90 или 100 мм) расплавленного и остуженного до температуры в пределах от 45°С до 48°С питательного агара (не касаясь посевной пробы), предварительно фламбируя край емкости, в которой он находился. После внесения агара содержимое чашки Петри плавно перемешивают, равномерно распределяя его по дну чашки, избегая образования пузырьков воздуха, попадания агара на края и крышку чашки, и помещают на горизонтальную поверхность.
Посев и заливку посевов питательным агаром проводят между пламенем двух горелок с целью обеспечения условий асептики.
После застывания агара чашки Петри с посевами переворачивают (вверх дном), помещают в термостат и инкубируют при температуре (36±2)°С в течение (24±4) ч.
После инкубации чашки Петри с посевами извлекают из термостата, подсчитывают все выросшие на чашках колонии микроорганизмов (X), видимые при увеличении в 2 раза, и регистрируют в журнале испытаний. Подсчет проводят только на тех чашках, на которых выросло не более 300 колоний.
Результат допускается представлять на основании подсчета колоний на одной чашке, если на другой чашке обнаружен ползучий рост колоний, или число колоний превышает 300.
Если на всех чашках имеет место рост расплывчатых колоний, который не распространился на всю поверхность чашки, подсчитывают колонии на секторе с изолированными колониями с последующим пересчетом на всю площадь чашки.
Если на чашке выросло более 300 изолированных колоний и анализ нельзя повторить, подсчитывают колонии на двух секторах, выбранных на участках чашки с максимальным и минимальным ростом и пересчитывают на всю площадь чашки.
В этих случаях в протоколе отмечают "Число КОЕ в 1 см ориентировочно".
Если подсчет колоний на чашках невозможен за счет сплошного роста изолированных колоний, в журнал испытаний вносят текст: "Сплошной рост". Если на всех засеянных чашках рост расплывчатых колоний бактерий распространился на всю поверхность чашки, то в журнал испытаний вносят текст: "Сливной рост".
Если ни на одной из засеянных чашек не выросло ни одной колонии, в протоколе исследований указывают - "КОЕ ОМЧ не обнаружено в 1 см".
Примечание - Если рост колоний на чашках с посевами не обнаружен, то допустимо продолжить инкубацию посевов до 48 ч, после чего окончательно учесть результат.
8.2.1.3 Содержание микроорганизмов (X) в 1 см анализируемой пробы воды рассчитывают по формуле
![]() , (1)
, (1)
где N - число колоний, подсчитанных и зарегистрированных по 8.2.1.2;
V - объем воды, см, использованный для посева на чашки Петри, на которых велся подсчет.
Результат округляют до целого числа и выражают числом колоний образующих единиц микроорганизмов в 1 см пробы воды.
8.2.2 Определение ОМЧ с использованием готовых к употреблению питательных подложек
Для определения ОМЧ анализируемую воду в объеме 1 см вносят на поверхность подложки (при использовании петрифильма в центр и аккуратно опускают верхнюю пленку). Посевы инкубируют при температуре (36±2)°С в течение 18-24 ч.
Подсчет колоний по 8.2.1.2.
8.2.3 Проведение посева проб воды на месте отбора проб с последующей доставкой в стационарную лабораторию
8.2.3.1 Посев проб воды на месте отбора для определения ОМЧ проводят в соответствии с 8.2.1.2.
Посевы помещают в переносной термостат или термоконтейнер с температурой внутри камеры не ниже 30°С и доставляют для дальнейшего анализа в стационарную лабораторию в срок не более 24 ч.
В стационарной лаборатории посевы переносят в термостат при температуре (36±2)°С. Через 24 ч инкубации посевов проводят учет выросших колоний. При отсутствии роста колоний общее время инкубации посевов должно составлять 48 ч.
8.2.3.2 Подсчет и идентификацию обнаруженных микроорганизмов в посеве проб воды, учет, обработку проводят в стационарной лаборатории по 8.2.1.2, 8.2.1.3.
8.2.3.3 Доставка посевов проб воды в стационарную лабораторию должна сопровождаться передачей акта отбора проб воды и документа, включающего информацию о процедуре посева: условия посева (температура и влажность воздуха), дата и время посева, фамилию, имя и отчество лица, проводившего отбор и посев проб воды.
8.3 Определение E.coli и колиформных бактерий
8.3.1 Показатели E.coli и колиформных бактерий определяют методом мембранной фильтрации в соответствии с ГОСТ 31955.
8.3.2 Для определения содержания колиформных бактерий и E.coli может быть применен ускоренный метод с использованием хромогенных сред.
Метод позволяет определить содержание колиформных бактерий и бактерий E.coli в пробе воды в течение промежутка времени от 18 до 24 ч без дальнейшей идентификации выросших колоний.
Определение содержания колиформных бактерий и бактерий E.coli в пробе анализируемой воды проводят методом мембранной фильтрации по 8.3.1, используя в качестве дифференциальной питательной среды вместо среды Эндо или среды с тергитолом-7 и ТТХ одну из хромогенных сред, например, хромокульт колиформ агар (см. Д.5 Приложения Д).
Инкубацию посевов проводят при температуре (36±2)°C.
Хромогенные среды обеспечивают одновременное определение колиформных бактерий и E.coli в одном посеве. Для дифференциации колиформных бактерий и E.coli использованы различия указанных видов бактерий по ферментативной активности. Колиформные бактерии имеют фермент -галактозидазу, а E.coli - помимо этого фермента обладают ферментом
-глюкуронидазой.
В качестве колиформных бактерий учитывают красные и красно-коричневые с окрашенным ореолом вокруг колонии. В качестве E.coli учитывают колонии бактерий сине-фиолетового цвета.
На среде хромокульт колиформ агаре иные бактерии, за исключением бактерий E.coli, обладающих ферментом -глюкуронидазой, образуют колонии светло-голубого цвета, которые при подсчете не учитывают.
Обработку и оформление результатов проводят по ГОСТ 31955 (раздел 9, 10).
Примечание - Метод с использованием хромокульт колиформ агара имеет такую же воспроизводимость результатов как при посеве на среды Эндо и тергитол-7 с ТТХ.
8.4 Определение энтерококков
8.4.1 Определение энтерококков методом мембранной фильтрации
8.4.1.1 Фильтруют 100 см пробы воды через мембранные фильтры с соблюдением требований, представленных в приложении Е. После фильтрования фильтры переносят, не переворачивая, на плотную агаризованную среду энтерококкагара (см. Д.9.1 приложения Д) или агаризованную плотную азидную среду Сланеца-Бертли (см. Д.9.2 приложения Д) и добиваются полного прилегания его к среде без образования пузырьков воздуха. Чашки Петри с посевами помещают в термостат дном вверх и инкубируют при температуре (36±2)°С в течение 24-48 ч.
При отсутствии роста колоний инкубацию посевов продолжают до 48 ч.
После инкубации посевов учитывают колонии, характерные для энтерококков - выпуклые, с ровными краями, темно-малиновые, розовые, светло-розовые, равномерно окрашенные или с темно-красным не четко оформленным центром и подсчитывают их число.
Очень мелкие (на пределе видимости невооруженным глазом), плоские разных оттенков, ярко-малиновые с четко выраженным малиновым центром и бесцветным ободком колонии не учитывают.
Регистрируют число колоний энтерококков или их отсутствие в журнале испытаний.
8.4.1.2 При необходимости подтверждают наличие энтерококков с помощью тест-систем для идентификации энтерококков (в соответствии с инструкцией производителя) или одним из следующих способов.
Пересевают по 2-3 колонии каждого типа:
- секторами на солевой агар с ТТХ (см. Д.9.3 приложения Д) и инкубируют при температуре (36±2)°С в течение 24 ч. Энтерококки на указанной среде дают равномерный нежный рост на протяжении всего штриха. Иные бактерии на этой подтверждающей среде не растут или растут на платформе штриха;
- мембранный фильтр с выросшими колониями стерильным пинцетом, не переворачивая, переносят на поверхность желчь-эскулин-азидного агара, предварительно нагретого до 44°С, и помещают в термостат на (44,0±0,5)°С (см. Д.9.4 приложения Д), инкубируют в течение 2 ч. В течение этого времени эскулин гидролизируется энтерококками с образованием характерных продуктов, что проявляется окрашиванием типичных для кишечных энтерококков колоний от коричневого до черного цвета.
8.4.1.3 Подсчитывают число колоний энтерококков на фильтрах, где выросло менее 50-70 колоний, суммируют и определяют по формуле
![]() , (2)
, (2)
где X - число КОЕ энтерококков в 100 см исследуемой воды;
а - число подсчитанных энтерококков в сумме;
V - объем воды, профильтрованный через фильтры, на которых велся учет.
В протоколе исследования выдают "Число КОЕ энтерококков в 100 см анализируемой пробы воды".
При отсутствии в пробе анализируемой воды энтерококков в протокол испытаний вносят текст: "Не обнаружено КОЕ энтерококков в 100 см пробы анализируемой воды".
8.4.2 Ускоренные методы выявления энтерококков с использованием готовых питательных сред на подложках
Подложку с питательной средой, разрешенной к применению в соответствии с 8.1.6, готовят к анализу в соответствии с технической документацией на подложку.
Пробы воды фильтруют в соответствии с приложением Е. Фильтры стерильным пинцетом накладывают на подложку и помещают в инкубатор или термостат.
Посевы инкубируют при температуре (36±2)°С в течение 18-24 ч.
Идентификацию энтерококков среди выросших колоний проводят по морфологии, цвету колоний в соответствии с технической документацией на подложку (в зависимости от используемой питательной среды).
Обработка по 8.2.1.З.
8.4.3 Сигнальный метод определения энтерококков
Навеску питательной среды для определения энтерококков вносят в 100 см исследуемой воды и тщательно перемешивают до полного растворения. Посевы инкубируют в течение 18-24 ч при температуре (36±2)°С.
Примечание - Допускается в соответствии с прилагаемой инструкцией производителя инкубирование посевов при температуре от 20°С до 25°С в течение 48 ч.
После инкубации посевов проводят учет результатов, при этом считают, что:
- энтерококки отсутствуют, если цвет среды не изменился или отмечено помутнение среды без изменения цвета;
- бактерии обнаружены, если среда приобрела цвет, описанный в инструкции производителя во всем объеме или верхнем слое. При перемешивании цвет среды не должен измениться.
8.5 Определение колифагов прямым методом
8.5.1 Общие положения
Показатель "Колифаги" предназначен для проведения текущего контроля качества питьевой воды в отношении возможного вирусного загрязнения.
Метод основан на предварительном накоплении колифагов в среде обогащения на культуре E.coli и последующем выявлении зон лизиса (просветления) посева газоном E.coli на питательном агаре.
8.5.2 Подготовка тест - культуры E.coli K12F+Str-r
На всех этапах исследования используют бактериальную взвесь, приготовленную следующим образом: культуру E.coli K12F+Str-r засевают в пробирку на скошенный питательный агар. Через (18±2) ч инкубации при температуре (36±2)°С производят смыв бактерий с косяка 5 см стерильного физиологического раствора и по стандарту мутности готовят взвесь E.coli в концентрации 10
бактериальных клеток в 1 см
.
Примечание - Допускается использование 4-часовой бульонной культуры E.coli KF
Str-r, полученной при температуре инкубации (36±2)°С, для внесения в питательный агар, расплавленный и остуженный до (44,0±0,5)°С. Концентрация 10
бактериальных клеток E.coli содержится в 2 см
питательного бульона.
8.5.3 Выполнение анализа
В исследуемую пробу воды объемом 100 см вносят 10 см
10-кратного питательного бульона и 1 см
подготовленного смыва тест-культуры или 2 см
4-часовой бульонной культуры.
Для контроля культуры 0,1 см смыва бактерий E.coli (или 0,2 см
4-часовой бульонной культуры) помещают в чашку Петри и заливают питательным агаром.
Исследуемую пробу воды (100 см) и чашку Петри с контролем E.coli помещают в термостат при температуре (36±2)°С на (18±2) ч.
В зависимости от плотности используемого агара проводят посевы воды по 10 см на 10 чашек или по 20 см
на 5 чашек. Для освобождения исследуемой воды от сопутствующей бактериальной флоры, ее обрабатывают хлороформом из расчета 1 см
хлороформа на 10 см
воды. Пробу тщательно встряхивают и отстаивают в течение 15 мин при комнатной температуре для осаждения хлороформа. На исследование берут воду над хлороформом. В питательный агар, расплавленный и остуженный до (44,0±0,5)°С, добавляют смыв E.coli К
F
Str-r (см. 8.5.2) из расчета 1,0 см
смыва на каждые 100 см
агара, после чего перемешивают. Для контроля культуры E.coli на возможную контаминацию ее посторонними колифагами в одну чашку Петри вносят 10 см
стерильной водопроводной воды, прогретой до температуры от 20°С до 25°С, заливают 25 см
приготовленного агара с E.coli К
F
Str-r и осторожно перемешивают.
Исследуемые объемы воды вносят в стерильные чашки Петри и заливают, слегка приоткрывая крышки, 25 см смеси агара с кишечной палочкой. При посеве пробы воды объемом 100 см
ее предварительно нагревают до температуры (20-25)°C.
Содержимое чашек осторожно перемешивают и оставляют при комнатной температуре до застывания. Чашки с застывшим агаром помещают в термостат дном вверх и инкубируют при температуре (36±2)°С в течение (18±2)ч.
8.5.4 Учет результатов
Просмотр посевов осуществляется в проходящем свете.
При исследовании 100 см воды (5 чашек по 20 см
) подсчитывают и суммируют все бляшки, выросшие на чашках Петри.
Если посевная доза была меньше 100 см, то число колифагов вычисляют по формуле
![]() , (3)
, (3)
где а - сумма бляшек на чашках;
V - объем исследуемой воды.
При исследовании децинормальных разведений, число колифагов в 100 см воды вычисляют по формуле
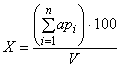 , (4)
, (4)
где а - сумма бляшек на чашке;
- i-e разведение;
n - количество разведений.
Результаты выражают в бляшкообразующих единицах (БОЕ) на 100 см пробы воды. В контрольной чашке бляшки должны отсутствовать.
Предварительный учет результатов можно проводить через промежуток времени от 5 до 6 ч инкубации. На этом этапе при наличии четких зон лизиса может быть выдан предварительный ответ о присутствии колифагов в воде.
Окончательный количественный учет прямого посева проводится через (18±2) ч. Результаты выражают количеством бляшкообразующих единиц (БОЕ) на 100 см пробы воды.
Если отмечен сливной рост бляшек и счет затруднителен, то по данным прямого посева может быть выдан качественный результат: "Обнаружено в 100 см воды".
При наличии зон лизиса в контрольной чашке результат исследования считается недействительным.
8.5.5 Постановка контролей
"Отрицательный контроль" - подтверждает отсутствие контаминации фагом питательных сред, лабораторной посуды, оборудования на этапах подготовки и проведения анализа, а также позволяет оценить способность тест-культуры Е.coli давать равномерный газон.
"Отрицательным контролем" служит исследование стерильной водопроводной воды, проводимое аналогично анализируемой пробе воды. С этой целью, в зависимости от посевной дозы исследуемой воды, в стерильную чашку Петри вносят от 1 до 20 см стерильной водопроводной воды, заливают смесью мясо-пептонного агара с Е.coli и инкубируют в течение 18-20 ч при температуре (36±2)°С.
В случае обнаружения бляшек колифагов в чашках с "отрицательным" контролем результаты исследования всей серии проб воды недействительны.
Следует проверить стерильность лабораторного оборудования, посуды, питательных сред, а также повторить контрольный посев на лизогенность тест-штамма E.coli KF
Str-r.
Для проверки культуры на лизогенность необходимо использовать новую пробирку с культурой, хранящейся на полужидком агаре. 1 см бактериальной взвеси помещают в стерильную чашку Петри и заливают расплавленным и остуженным до температуры в диапазоне от 45°С до 49°С питательным агаром, инкубируют при температуре (36±2)°С в течение (18±2) ч.
Просмотр посевов осуществляют в проходящем свете. Наличие зон лизиса в контрольном посеве свидетельствует о спонтанно проявившемся свойстве культуры продуцировать фаги или контаминации ее колифагом в процессе работы.
Использование в работе лизогенной культуры запрещается. Необходимо получить новую лиофилизированную культуру.
8.5.6 Методика подтверждения фаговой природы лизиса
С целью подтверждения фаговой природы лизиса бактериологической петлей извлекают участок агара с бляшкой колифага, вызывающей сомнение, помещают его в 5 см питательного бульона, куда добавляют каплю тест-культуры E.coli K
F
Str-r и инкубируют при (36±2)°С в течение (18±2)ч. Полученную культуру обрабатывают хлороформом или фильтруют через мембранный фильтр и исследуют на наличие фага. Высев осуществляют петлей или пипеткой на поверхность питательного агара содержащего взвесь E.coli, чашки инкубируют в термостате при (36±2)°С в течение (18±2) ч. Наличие зон лизиса на поверхности агара расценивается как подтверждение наличия фага.
8.6 Определение P.aeruginosa
8.6.1 Метод 1
При обнаружении на мембранном фильтре, помещенном на среду Эндо, при посеве пробы воды на колиформные бактерии и (или) E.coli роста изолированных оксидазоположительных бактерий проводят определение показателя P.aeruginosa и устанавливают "наличие-отсутствие" этих бактерий в исследованной пробе воды.
Для подтверждения показателя P.aeruginosa снимают с фильтра 2-3 изолированные колонии и производят посев на чашку Петри со средой "Блеск" путем укола, затем культуру растирают вокруг укола в виде бляшки диаметром от 2,0 до 2,5 см. После чего посевы инкубируют в термостате при температуре (36±2)°С в течение (24±2) ч.
В случае сливного или сплошного роста оксидазоположительных бактерий проводят рассев на чашки Петри с питательным агаром с целью получения чистой культуры, посевы инкубируют в термостате при температуре (36±2)°С в течение (24±2) ч. После чего повторяют процедуру посева на среду "Блеск".
При наличии роста на среде "Блеск" темно-малиновых колоний с золотыми вкраплениями, имеющих специфический сладковатый цветочный запах, и подтверждении наличия диффундирующего пигмента на скошенном питательном агаре отмечают наличие P.aeruginosa в исследуемой пробе воды.
8.6.2 Метод 2
Обнаружение P.aeruginosa в пробе воды состоит из трех этапов:
- накопление в жидкой среде обогащения;
- выделение P.aeruginosa на плотной селективно-дифференциальной среде;
- идентификация P.aeruginosa с использованием ограниченного набора наиболее надежных тестов.
Исследуют пробу воды объемом 1000 см. В качестве среды накопления используют минеральную среду Бонде с кристаллическим фиолетовым.
В две стерильные емкости мерно наливают по 50 см концентрата среды Бонде и по 2,5 см
0,01%-ного водного раствора кристаллического фиолетового, после чего в каждую емкость наливают по 500 см
пробы воды.
Инкубацию посевов осуществляют при температуре (36±2)°С в течение промежутка времени от 24 до 48 ч. Через 24 ч посевы просматривают. При отсутствии пленки и помутнения среды посевы инкубируют до 48 ч. Отсутствие роста в среде накопления через 48 ч позволяет выдать отрицательный ответ.
При помутнении среды "Бонде" и образовании на поверхности тонкой прозрачной пленки, поднимающейся по стенке емкости, проводят пересев из среды обогащения на сектора плотной среды "Блеск" или цетримидный агар или азидной среды. Емкость перед посевом не встряхивают. Бактериологической петлей забирают пленку с поверхности среды и производят посев уколом ближе к краю чашки Петри для снятия излишков посевного материала, потом остаток материала распределяют в виде бляшки диаметром от 2,0 до 2,5 см, далее посев проводят частыми многочисленными штрихами по поверхности среды для получения максимального количества изолированных колоний. Посевы помещают в термостат при (36±2)°С на время от 24 до 48 ч с предварительным просмотром через 24 ч инкубации.
На цетримидном агаре колонии P.aeruginosa образуют желтовато-зеленый пигмент (пиоцианин), флуоресцирующий в ультрафиолетовом свете (УФ-свете). При нечетком результате проводят идентификацию по дополнительным тестам.
На среде "Блеск" колонии P.aeruginosa сплошь покрыты золотистым налетом либо содержат многочисленные золотистые вкрапления. Иногда вокруг колонии отмечается просветление или светло-красное окрашивание среды. Часто колонии P.aeruginosa принимают веретенообразную форму, как бы распространяясь по вдавлению в агаре от штриха петлей. Появление блеска можно наблюдать уже через (21±1) ч инкубации при температуре (36±2)°С, но максимальное проявление блеска достигается через (43±1) ч. Среда "Блеск" является ингибиторной для всех грамположительных и большинства грамотрицательных бактерий и лишь немногие ТТХ-резистентные энтеробактерии могут развиваться на среде "Блеск" в виде темно-красных разного размера колоний, лишенных блеска, или выпуклых блестящих ярко-красных колоний.
При наличии множественного роста колоний с золотистым блеском достаточно отобрать для последующего исследования 1-2 изолированные наиболее типичные колонии. При росте единичных колоний с блеском или с золотистыми вкраплениями следует отбирать все типичные колонии, но не более 5-6.
Примечание - В соответствии со стандартами ИСО допускается определение P.aeruginosa методом мембранной фильтрации с помещением фильтров с посевами на цетримидный агар.
8.6.3 Подтверждение обнаружения P.aeruginosa
Для подтверждения обнаружения P.aeruginosa наиболее типичные колонии отсевают на питательный агар и идентифицируют на тест-системе "неферм-тест".
По методу 2 P.aeruginosa не должны содержаться в 1000 см исследуемой воды.
8.7 Определение патогенных бактерий семейства Enterobacteriaceae
8.7.1 Метод 1. Посев проб воды для определения патогенных бактерий семейства Enterobacteriaceae, в том числе сальмонелл
Для определения патогенных бактерий семейства Enterobacteriaceae исследуют 1000 см воды, засевая по 500 см
в две среды накопления: магниевую среду - для определения сальмонелл (см. Д.12 приложения Д) и селенитовый бульон - для определения патогенных бактерий семейства Enterobacteriaceae, в том числе сальмонелл (см. Д.15. приложения Д) или другие апробированные и разрешенные к применению для этих целей среды накопления.
При посеве пробы воды в магниевую среду в стерильную емкость с навесками по Д.12 (приложение Д) прибавляют 500 см исследуемой пробы воды, после чего добавляют дрожжевой экстракт и бриллиантовый зеленый.
При посеве пробы воды в селенитовый бульон для определения патогенных энтеробактерий к 500 см исследуемой воды добавляют 500 см
селенитового бульона двойной концентрации (см. Д.15. приложения Д).
8.7.2 Метод 2. Посев проб воды для определения сальмонелл методом мембранной фильтрации
Для посева двух объемов по 500 см отбирают 1000 см
воды. Каждый объем профильтровывают через один или несколько мембранных фильтров. Затем эти фильтры помещают в любые две из перечисленных сред накопления объемом 50 и 100 см
. При затрудненной фильтрации большого объема пробы следует на фильтр с диаметром пор 0,45 мкм наложить фильтр с большим диаметром пор для задержания взвешенных частиц с последующим помещением в питательную среду накопления обоих фильтров.
8.7.3 Проведение анализа
Посевы воды в средах накопления инкубируют при температуре (36±2)°С в течение промежутка времени от 18 до 20 ч. При отсутствии роста в течение 24 ч пробы инкубируют 48 ч. При обнаружении роста (помутнения среды) производят высев бактериологической петлей на две чашки с висмут-сульфитным агаром (см. Д.14 приложения Д) и две чашки Эндо (см. Д.4 приложения Д).
Рассев производят одним из методов получения изолированных колоний. Чашки Петри с посевами инкубируют при температуре (36±2)°С в течение промежутка времени от 18 до 24 ч.
На висмут-сульфитном агаре колонии сальмонелл круглые, черные, с металлическим блеском, с сероватым металлическим ободком вокруг колоний, так называемое "зеркало", зеленые с темным центром и без него, вызывающие потемнение среды под колонией до черного цвета.
Выросшие на среде Эндо небольшие колонии бледно-розовые, прозрачные с ровными или неровными краями идентифицируют на принадлежность к патогенным энтеробактериям. В отличие от патогенных бактерий, E.coli и колиформные бактерии образуют круглые, выпуклые, гладкие, малинового цвета колонии с металлическим блеском и без него.
При обнаружении подозрительных на сальмонеллы (Shigella или др.) колонии отсевают по 4-5 каждого вида в пробирки с комбинированными средами для определения биохимических свойств, подтверждающих принадлежность к родам Salmonella (Shigella или др.) типа Клиглера или Олькеницкого.
Окончательное определение биохимических свойств проводят по тест-системам, серологических свойств сероваров - по инструкциям производителя сывороток, разрешенных к применению в соответствии с 8.1.6.
8.8 Интерпретация полученных результатов по санитарно-микробиологическим показателям
8.8.1 Результат испытаний системы водоснабжения считается положительным, если санитарно-микробиологические показатели соответствуют гигиеническим нормативам и количественный и качественный состав микроорганизмов в пробах исходной воды идентичен количественному и качественному составу микроорганизмов в пробах воды, отобранных из системы водоснабжения объекта испытаний.
8.8.2 В случае, когда в пробах исходной воды и воды из системы водоснабжения объекта испытаний обнаруживаются идентичные по своему видовому составу микроорганизмы, но в системе водоснабжения объекта испытаний их оказывается значительно больше, значит в системе происходят процессы размножения микроорганизмов. Об интенсивности процессов размножения можно судить исходя из следующих условий испытаний:
- если система была подготовлена (осуществлена дезинфекция, промывка и др., см. приложение А) и пробы воды отобраны в соответствии с 5.2.2, но при этом наблюдается значительное увеличение количества микроорганизмов, можно сделать вывод, что система способствует быстрому процессу размножения и способна в короткие сроки подвергнуться биообрастанию;
- если пробы исходной воды отличаются от проб воды из системы водоснабжения объекта испытаний по видовому составу микроорганизмов, и в пробах воды из системы водоснабжения обнаруживаются индикаторные и (или) потенциально-патогенные и (или) патогенные микроорганизмы, значит система загрязнена и должна подвергнуться дезинфекции.
9 Методы санитарно-химического анализа
9.1 Определяемые показатели и методы определения
9.1.1 При гигиенической оценке системы водоснабжения объекта испытаний по санитарно-химическим показателям определяют химический состав и свойства воды. Погрешность определения показателей состава и свойств воды не должна превышать норм, установленных ГОСТ 27384.
Номенклатура определяемых санитарно-химических показателей приведена в таблице 1.
Таблица 1
Группа определяемых показателей | Наименование показателя |
Обобщенные показатели | Водородный показатель |
Общая минерализация (сухой остаток) | |
Жесткость общая | |
Окисляемость перманганатная | |
Нефтепродукты (суммарно) | |
Поверхностно-активные вещества (ПАВ) анионо-активные | |
Фенольный индекс | |
Показатели состава | Азот аммонийный (NH |
Алюминий (Al | |
Железо (Fe, суммарно) | |
Кобальт (Со, суммарно) | |
Кадмий (Cd, суммарно) | |
Марганец (Mn, суммарно) | |
Медь (Cu, суммарно) | |
Молибден (Мо, суммарно) | |
Мышьяк (As, суммарно) | |
Никель (Ni, суммарно) | |
Показатели состава | Нитраты (по No |
Нитриты (NO | |
Полифосфаты (по РО | |
Свинец (Pb, суммарно) | |
Сульфаты (SO | |
Фториды (F | |
Формальдегид | |
Хлориды | |
Хром | |
Цинк (Zn | |
Органолептические показатели | Запах |
Привкус | |
Цветность | |
Мутность |
9.1.2 Для определения показателей, приведенных в таблице 1, применяют межгосударственные и национальные стандарты на определение конкретного показателя в воде.
При отсутствии межгосударственных (национальных) стандартов допускается использовать национальные методики на определение конкретных показателей, стандартизованные и аттестованные в установленном национальным законодательством порядке*, имеющие характеристики погрешности, не превышающие норм погрешности, установленных в ГОСТ 27384.
_______________
* В Российской Федерации могут применяться методики количественного химического анализа вод, аттестованные в соответствии с требованиями Федерального закона от 26.06.2008 N 102-ФЗ "Об обеспечении единства измерений" (статья 5) и ГОСТ Р 8.563-2009 "Государственная система обеспечения единства измерений. Методики (методы) измерений", а также методики, утвержденные Министерством здравоохранения Российской Федерации.
9.2 Результаты испытаний по санитарно-химическим показателям
9.2.1 Определяют значения всех указанных в таблице 1 показателей в каждой отобранной пробе воды в соответствии со стандартами или методиками по 9.1.2.
За результат принимается содержание контролируемого показателя без учета значений погрешности. При этом погрешность должна соответствовать нормам, установленным ГОСТ 27384.
9.2.2 Результат испытаний системы водоснабжения считается положительным, если количественный и качественный состав определяемых показателей в пробах исходной воды идентичен количественному и качественному составу этих показателей в пробах воды, отобранных из системы водоснабжения объекта испытаний, и значения этих показателей соответствуют гигиеническим нормативам.
9.2.3 Если в пробах воды из системы водоснабжения объекта испытаний определяются показатели химического состава, не обнаруженные в исходной воде, и (или) их значения больше соответствующих значений показателей в исходной воде на величину, превышающую погрешность методов определения соответствующих показателей, делается вывод о том, что система водоснабжения объекта испытаний ухудшает качество исходной воды, в частности по причинам, связанным с процессами деструкции материалов в системе.
9.2.4 Если санитарно-химические показатели в исходной воде (и, соответственно, в пробах воды из системы водоснабжения) не соответствуют санитарно-гигиеническим нормативам, результат считается недействительным.
10 Оформление результатов
Результаты испытаний (анализа) оформляют в виде протокола, который должен содержать следующую информацию:
- основание для проведения испытаний (номер договора, дата заключения, с кем заключен, или номер иного документа и его реквизиты);
- наименование объекта испытаний, его заводской (бортовой) номер, дата выпуска;
- наименование завода-изготовителя объекта испытаний;
- вид и цель испытаний;
- место и дата проведения отбора, проведения анализа;
- перечень средств измерений, испытательного оборудования, использованных для проведения испытаний (наименование, завод-изготовитель, заводской или инвентарный номер, сведения о поверке или иные сведения о выполнении требований по 7.1);
- условия проведения отбора проб воды, их хранения (транспортировки);
- наименования определяемых при испытаниях показателей, нормативные значения показателей и сведения о документе, содержащем эти значения (требования);
- обозначение и (или) наименование документа, содержащего методику проведения испытаний;
- расположение (схема) точек отбора проб воды в помещениях объекта испытаний;
- результаты гигиенической оценки системы водоснабжения подвижного состава с указанием фактических значений показателей, полученных в результате микробиологического и санитарно-химического анализа отобранных проб воды;
- наименование организации, проводящей испытания;
- дату составления протокола.
11 Требования безопасности и охраны труда
11.1 К проведению испытаний допускают работников, прошедших обучение, инструктажи и проверку знаний требований охраны труда. Порядок и виды обучения, а также организацию инструктажей участников испытаний осуществляют в соответствии с ГОСТ 12.0.004.
Во время отбора проб работники должны соблюдать требования охраны и безопасности труда и правила внутреннего трудового распорядка, установленные в организации, на территории которой проводится отбор проб.
11.2 При проведении отбора проб обеспечивают освещенность места и средств отбора не менее 200 лк.
11.3 Анализ воды на наличие возбудителей инфекционных заболеваний имеют право проводить испытательные центры (лаборатории), имеющие лицензию на осуществление деятельности, связанной с использованием возбудителей инфекционных заболеваний, и аккредитованные на проведение санитарно-микробиологических исследований воды.
Анализ воды по санитарно-химическим показателям проводят испытательные центры (лаборатории), аккредитованные на проведение исследований по методикам определения количественного химического анализа воды.
Приложение А
(справочное)
Подготовка системы водоснабжения
А.1 Дезинфекция и промывка
А.1.1 Вся вода, имеющаяся в системе водоснабжения объекта испытаний, должна быть слита.
Дезинфекцию и промывку системы водоснабжения объекта испытаний проводят, используя физические или химические методы воздействия.
Физические методы основаны на обработке системы текучим паром при температуре 100°С в течение промежутка времени от 30 до 40 мин или использовании иных технологий, разрешенных для применения в системе хозяйственно-питьевого водоснабжения.
Химические методы основаны на обработке системы дезинфицирующими средствами, разрешенными для дезинфекции трубопроводов систем хозяйственно-питьевого водоснабжения и систем водоснабжения железнодорожного подвижного состава.
А.1.2 Дезинфекцию паром следует осуществлять в следующем порядке.
Провести пропарку в течение промежутка времени от 30 до 40 мин при закрытых кранах. После пропарки открыть все краны, слить конденсат. Заправить систему чистой водопроводной водой при условии, что все краны в вагоне должны быть открыты. После заправки слить всю воду. Допускается через 20 мин после начала слива открыть патрубки для быстрого спуска воды.
Заполнить подготовленную систему водоснабжения чистой водопроводной водой, при этом в начале заполнения водопроводные краны в течение 5-10 мин должны быть открыты. После заполнения водой система готова к проведению испытаний по отбору проб воды (или эксплуатации).
А.1.3 Дезинфекцию (при использовании дезинфицирующих средств) нужно осуществлять средствами, разрешенными для профилактической дезинфекции систем питьевого водоснабжения и систем водоснабжения железнодорожного подвижного состава, на основании разрешительных документов в следующем порядке.
На всех водопроводных кранах во время дезинфекции и промывки системы водоснабжения прикрепить таблички "Внимание - дезинфекция! Водой не пользоваться!".
Подготовить чистые емкости, соответствующие объему заправочных баков системы водоснабжения вагона, заполнить их на 1/3 водой, влить необходимое количество дезинфицирующего средства и заполнить емкость до необходимого объема водой.
Заправить систему водоснабжения дезинфицирующим раствором из емкости через шланги при помощи насоса.
Открыть все краны в вагоне и слить воду в течение 5-10 мин до появления дезинфицирующего средства (слабый запах, характерный для используемого средства). Подтвердить наличие средства и необходимую концентрацию при помощи индикаторных тест-полосок, прилагающихся к средству, или прибором-индикатором.
Закрыть все краны.
Выдержать раствор дезинфицирующего средства в системе водоснабжения в соответствии с установленными в Инструкции по применению дезинфицирующего средства режимами дезинфекции, но не менее 2 ч.
Открыть все краны и спускать дезинфицирующий раствор в течение 15-20 мин, после чего допускается дополнительно открыть патрубки для быстрого спуска воды.
Промыть систему водоснабжения чистой водой согласно Инструкции по применению дезинфицирующего средства, без экспозиции слить воду в канализацию, при условии, что все краны в вагоне открыты. Подтвердить отсутствие дезинфицирующего средства в воде при помощи индикаторных тест-полосок или прибором-индикатором.
После промывки системы водоснабжения снять таблички "Внимание - дезинфекция! Водой не пользоваться!".
В журнале регистрации дезинфекционных мероприятий систем водоснабжения провести соответствующую запись.
Шланги, через которые заправляется система водоснабжения объекта испытаний, должны дезинфицироваться тем же средством и в тех же концентрациях, что и система водоснабжения, с установленной на железнодорожном транспорте периодичностью.
Примечание - При необходимости возможно осуществить оценку эффективности дезинфекции системы водоснабжения объекта испытаний с привлечением лаборатории, имеющей лицензию на осуществление деятельности, связанной с использованием возбудителей инфекционных заболеваний, и аккредитованный (аттестованный) на проведение санитарно-микробиологических исследований воды.
А.1.4 Работы по проведению дезинфекционных мероприятий проводят с выполнением требований безопасности, указанных в Инструкции по применению используемого дезинфицирующего средства.
Дезинфицирующее средство необходимо хранить плотно закрытым, в сухом прохладном, хорошо проветриваемом помещении, избегать попадания прямых солнечных лучей, отдельно от продуктов питания, лекарственных препаратов, в местах, недоступных посторонним лицам, держать вдали от взрывоопасного материала.
Приготовление рабочих растворов из концентрата дезинфицирующего средства рекомендуется проводить в помещении, оборудованном приточно-вытяжной вентиляцией, или на открытом воздухе, в отсутствие посторонних лиц, с защитой органов дыхания (респираторами типа РПГ-67 по ГОСТ 12.4.004 или РУ-60м по ГОСТ 17269 с патроном марки А или В), кожи рук (резиновыми перчатками по ГОСТ 20010), при оснащении индивидуальными средствами защиты глаз (герметичные очки по ГОСТ 12.4.253), спецодеждой.
Следует избегать попадания средства в глаза и на кожу.
При работе со средством необходимо соблюдать правила личной гигиены. Запрещается курить, пить, принимать пищу. После работы лицо и руки следует вымыть водой с мылом.
Проведение профилактической дезинфекции систем водоснабжения проводят в присутствии людей без средств защиты органов дыхания и глаз.
Все работы с рабочими растворами дезинфицирующего средства должны проводиться с защитой кожи рук резиновыми перчатками.
К проведению дезинфекции систем водоснабжения объекта испытания допускают работников, прошедших инструктажи и проверку знаний по проведению дезинфекционных мероприятий.
А.2 Порядок заправки системы водоснабжения
А.2.1 Заправка системы водоснабжения объекта испытания водой осуществляется из водозаправочных колонок, предназначенных для заправки систем водоснабжения железнодорожного подвижного состава.
А.2.2 Систему водоснабжения после дезинфекции и промывки заправляют водой из централизованной системы питьевого водоснабжения, качество которой соответствует требованиям национального законодательства*. От начала заправки в течение 5-10 мин все краны в вагоне должны быть открыты, после выдержанной экспозиции краны закрывают.
_______________
* В Российской Федерации действует СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества".
Примечания
1 Заправка водой осуществляется сразу после дезинфекции и промывки, допускаемое время отсрочки заправки не более 18 ч.
2 Установки для доочистки и дообеззараживания воды, используемые при заправке системы водоснабжения объекта испытаний, должны иметь разрешительные документы к применению, выданные органами исполнительной власти.
Приложение Б
(справочное)
Акт отбора проб
от | " | " | 20 | г. | ||||||||||||||||||||||||
Наименование и адрес изготовителя объекта испытаний: | ||||||||||||||||||||||||||||
Наименование продукции: вода из системы водоснабжения | ||||||||||||||||||||||||||||
на соответствие требованиям НД | ||||||||||||||||||||||||||||
наименование объекта испытаний | ||||||||||||||||||||||||||||
Объект испытаний модели | Зав. N | Дата выработки: | ||||||||||||||||||||||||||
Дата отбора проб: | Время отбора: | |||||||||||||||||||||||||||
Наименование места проведения испытаний: | ||||||||||||||||||||||||||||
Проведение отбора проб: отбор проведен в соответствии с ГОСТ 31861-2012; ГОСТ 31862-2012, | ||||||||||||||||||||||||||||
ГОСТ 31942-2012, ГОСТ | сотрудниками | |||||||||||||||||||||||||||
ссылка на настоящий стандарт | ||||||||||||||||||||||||||||
наименование учреждения, проводившего испытания | ||||||||||||||||||||||||||||
в присутствии представителей изготовителя | ||||||||||||||||||||||||||||
Количество отобранных проб, номер и место (точки) отбора: | ||||||||||||||||||||||||||||
Дополнительные сведения | ||||||||||||||||||||||||||||
Цель отбора проб: | ||||||||||||||||||||||||||||
Основание: Договор N от | " | " | 20 | г. | ||||||||||||||||||||||||
Акт отбора образца: | " | " | 20 | г. | ||||||||||||||||||||||||
Акт о готовности образца к испытаниям: | " | " | 20 | г. | ||||||||||||||||||||||||
Подписи исполнителей: | ||||||||||||||||||||||||||||
От "Организации, проводившей испытания" | ||||||||||||||||||||||||||||
От "Организации производителя" | ||||||||||||||||||||||||||||
Количество проб, емкости, характер упаковки | ||||||||||||||||||||||||||||
Условия транспортировки | ||||||||||||||||||||||||||||
Условия хранения | ||||||||||||||||||||||||||||
Пробы доставил (ФИО, должность) | ||||||||||||||||||||||||||||
Пробы принял (ФИО, должность) | ||||||||||||||||||||||||||||
Приложение В
(справочное)
Средства измерений, испытательное и вспомогательное оборудование, лабораторная посуда, расходные материалы, реактивы, питательные среды, эталонные микроорганизмы*
_______________
* Для Российской Федерации соответствует МУК 4.2.1018-01 "Санитарно-микробиологический анализ питьевой воды. Методические указания".
В.1 Перечень основных средств измерений, испытательного и вспомогательного оборудования для микробиологической лаборатории
Термостат с температурным режимом (36±2)°C.
Термостат с температурным режимом (44,0±0,5)°C.
Водяная баня или термостат с температурным режимом в диапазоне от 45°С до 49°С (для питательных сред).
Прибор для мембранной фильтрации под вакуумом с диаметром фильтрующей поверхности 35 или 47 мм и устройство для создания разрежения в диапазоне от 0,05 до 0,10 МПа.
Весы лабораторные общего назначения с пределом взвешивания не менее 1000 г (с пределами допускаемой погрешности ±0,1 г).
Весы лабораторные с наибольшим пределом взвешивания не менее 200 г (с пределами допускаемой погрешности ±0,02 г).
Весы торсионные с диапазоном измерений от 0 до 500 мг.
Термометр ртутный с диапазоном измерения от 0°С до 50°С с ценой деления шкалы 0,5°С.
Термометр ртутный с диапазоном измерения от 0°С до 200°С с ценой деления шкалы 1°С.
Термометр спиртовой с диапазоном измерения от минус 50°С до плюс 50°С с ценой деления шкалы 1°С.
PH-метр с диапазоном измерений от 0 до 14 ед.рН, с пределами допускаемой погрешности ±0,01 ед.рН.
Дистиллятор, обеспечивающий качество дистиллированной воды по ГОСТ 6709.
Стерилизатор суховоздушный, с температурным режимом (180±5)°С.
Стерилизатор паровой, с рабочим давлением от 0 до 2,5 кгс/см по ГОСТ 17726.
Холодильники бытовые электрические с температурой в камере (5±1)°С.
Холодильник глубокого замораживания (минус 20°С).
Вытяжной шкаф.
Нагревательный прибор для варки питательных сред, либо магнитные мешалки с подогревом до 300°С.
Прибор для счета колоний.
Лупа с двукратным увеличением по ГОСТ 25706.
Дозаторы для разлива жидких питательных сред и растворов.
Дозаторы автоматические бактериологические.
Облучатель бактерицидный.
Оптический стандарт мутности на 10 ед.
Микроскоп профессиональный биологический (с диапазоном увеличения от 40 до 2000, объективами 4х, 10х, 40х, 100х).
Часы сигнальные или песочные.
В.2 Посуда лабораторная
Пипетки вместимостью 1, 2, 5, 10 см с ценой деления 0,1 мл (многоразового или одноразового использования) по ГОСТ 29227.
Пробирки бактериологические (многоразового или одноразового использования) по ГОСТ 25336.
Посуда мерная лабораторная стеклянная 2-го класса точности вместимостью 100, 250, 500, 1000 мл по ГОСТ 1770.
Чашки Петри бактериологические одноразовые или стеклянные многократного применения по ГОСТ 23932.
Воронки стеклянные по ГОСТ 25336.
Стекла предметные по ГОСТ 9284.
Стекла покровные по ГОСТ 6672.
В.3 Расходные материалы
Мембранные фильтры для микробиологических целей с диаметром пор не более 0,45 мкм и размером диска 35 или 47 мм или другие фильтрующие мембраны с аналогичной способностью фильтрации.
Индикаторы для определения рН в диапазоне 6-8 с интервалом определения 0,2.
Петли бактериологические.
Пинцеты для работы с мембранными фильтрами по ГОСТ 21241.
Штативы для пробирок.
Емкости с крышкой из нержавеющей стали или эмалированные для стерилизации мембранных фильтров методом кипячения.
Емкости из нержавеющей стали или эмалированные для приготовления питательных сред.
Горелки газовые, спиртовые стеклянные или металлические с подставкой по ГОСТ 25336.
Пробки и колпачки различных размеров: силиконовые или иные, выдерживающие стерилизацию сухим жаром или автоклавированием.
Вата хлопковая медицинская гигроскопическая по ГОСТ 5556.
Марля медицинская по ГОСТ 9412.
Бумага фильтровальная лабораторная ГОСТ 12026.
Маркеры водостойкие.
Лейкопластырь.
В.4 Реактивы*
_______________
* Все химические реактивы должны соответствовать квалификации не ниже ч.д.а. ("чистые для анализа").
Бромтимоловый синий.
Кислота соляная по ГОСТ 3118.
Натрий серноватистокислый (тиосульфат натрия) 5-водный по ГОСТ 27068.
Натрий хлористый по ГОСТ 4233.
Натрий гидрат окиси по ГОСТ 4328.
Спирт этиловый ректификованный медицинский по ГОСТ 5962.
Спирт этиловый технический по ГОСТ 18300*.
_______________
* На территории Российской Федерации утратил силу, действует ГОСТ Р 55878-2013 Спирт этиловый технический гидролизный ректификованный. Технические условия.
Глюкоза по ГОСТ 6038.
-нафтол.
Розоловая кислота.
2,-3,-5- трифенилтетразолий хлорид (ТТХ).
Фуксин основной.
Хлороформ по ГОСТ 20015.
Калий фосфорнокислый однозамещенный по ГОСТ 4198.
Калий фосфорнокислый двузамещенный по ГОСТ 2493.
Кислота серная по ГОСТ 4204.
Натрий двууглекислый по ГОСТ 2156.
Натрий углекислый по ГОСТ 83.
Натрий фосфорнокислый двузамещенный безводный по ГОСТ 11773.
Натрий фосфорнокислый однозамещенный по ГОСТ 245.
Натрий лимоннокислый трехзамещенный по ГОСТ 22280.
Натрий аммоний фосфорнокислый по ГОСТ 4170.
Натрия азид.
Фенол.
Бриллиантовый зеленый.
Калий теллуристокислый.
Кислота ортофосфорная по ГОСТ 6552.
Магний хлористый 6-водный по ГОСТ 4209.
Магний сернокислый (сульфат магния) по ГОСТ 4523.
Пара-диметиламинобензальдегид.
Кальций углекислый по ГОСТ 4530.
Йод кристаллический по ГОСТ 4159.
Калий йодистый по ГОСТ 4232.
Триптофан.
Фуксин кислый.
Тетратионат калия.
Кристаллический фиолетовый водорастворимый.
Соли желчи.
Казеин трипсиновый ферментации по ГОСТ 17626.
L-триптофан.
Дрожжевой экстракт.
Бромтимоловый синий.
Триптон - желчный агар (ТЖА).
Триптон - соевый агар неселективный (ТСА)
Гептадецилсульфат натрия (тергитол).
Растворы для разведений.
Вода дистиллированная по ГОСТ 6709.
В5 Питательные среды для микробиологической лаборатории
Питательная среда для выделения энтеробактерий, сухая (типа Эндо).
Селективная дифференциальная лактозная среда с тергитолом 7 по ГОСТ 31955.
Хромокультколиформ агар по ГОСТ 31955.
Агар питательный сухой по ГОСТ 17206.
Сухой препарат с индикатором ВР и лактозой или среда Гисса с лактозой.
Сухой препарат с индикатором ВР и глюкозой или среда Гисса с глюкозой.
Сухой питательный бульон.
Пептон сухой ферментативный для бактериологических целей по ГОСТ 13805.
Агар с эозин-метиленовым синим, сухой (среда Левина).
Магниевая среда.
Селенитовый бульон.
Висмут-сульфит агар.
Питательная среда для первичной идентификации энтеробактерий (агар Клиглера).
Тест-системы для идентификации бактерий.
Индикаторные системы для проведения оксидазного теста (диски или полоски).
Реактив или индикатор для индольного теста.
Реактив Ковача.
Сыворотки агглютинирующие адсорбированные сальмонеллезные О и Н (сухие).
Сыворотки агглютинирующие адсорбированные поливалентные к сальмонеллам.
Молоко обезжиренное.
Антибиотики: бензилпенициллин натриевая соль, сульфат стрептомицина.
В.6 Эталонные микроорганизмы
Штамм Escherichia coli 675 или 1257, один из штаммов Pseudomonas aeruginosa 10145 АТСС или Pseudomonas fluorescens 948 АТСС*.
_______________
* Температура инкубации Pseudomonas fluorescens в диапазоне от 25°С до 28°C.
Контрольный колифаг MS-2 штамм ВКПМ РН 1505, штамм ВКПМ-3254 E.coli KF
Str-r.
Приложение Г
(обязательное)
Постановка оксидазного теста
Г.1 Для подтверждения наличия в пробе воды колиформных бактерий выполняют оксидазный тест одним из следующих способов.
Г.1.1 Способ 1
В качестве реактива для оксидазного теста используют тетраметил-п-фенилендиамин гидрохлорид.
Мембранный фильтр с выросшими на нем колониями (см. 8.3) с питательной среды пинцетом переносят на диск фильтровальной бумаги немного большего диаметра, чем мембранный фильтр, обильно смоченный реактивом для определения оксидазной активности - тетраметил-п-фенилендиамин гидрохлоридом. Оксидазный тест считают положительным, если в течение 1-4 мин появляется окрашивание колоний фиолетово-коричневого цвета. В случае необходимости дальнейшей идентификации изолированных оксидазоотрицательных бактерий, пересев колоний на другие дифференциальные среды можно проводить непосредственно с мембранного фильтра. Время пересева не ограничено.
Г.1.2 Способ 2
В качестве реактива для оксидазного теста используют диметил-п-фенилендиамин с -нафтолом.
Мембранный фильтр с выросшими на нем колониями (см. 8.3) с питательной среды пинцетом переносят на кружок фильтровальной бумаги немного большего диаметра, чем мембранный фильтр, обильно смоченный реактивом диметил-п-фенилендиамином солянокислым для определения оксидазной активности. Оксидазный тест считают положительным, если появляется окрашивание колоний в синий цвет.
После появления первых признаков положительного теста, но не позднее, чем через 3-4 мин, мембранный фильтр переносят обратно на питательную среду. В случае необходимости дальнейшей идентификации оксидазоотрицательных бактерий пересев колоний на дифференциальные среды проводят непосредственно с мембранного фильтра, расположенного на питательной среде. Посев целесообразно проводить не сразу после определения оксидазной активности, а после выдерживания на питательной среде свыше 5 мин.
Г.1.3 Способ 3
Тест проводят с использованием готовых к употреблению дисков или полосок OXI-тест, разрешенных к применению в соответствии с 8.1.6, в соответствии с инструкциями по их применению, разработанными производителем.
Приложение Д
(обязательное)
Приготовление питательных сред, растворов, реактивов
Д.1 Общие положения
Сухие питательные среды хранят в сухих проветриваемых помещениях, в темноте, при комнатной температуре. Открытые упаковки тщательно закупоривают. Среды с измененным внешним видом (уплотненные, с комками), а также с истекшим сроком годности не используют.
Для приготовления растворов, реактивов и питательных сред применяют воду дистиллированную по ГОСТ 6709.
Питательные среды готовят в посуде из инертного материала.
Учитывая возможное изменение рН питательных сред после кипячения и стерилизации, окончательный контроль рН проводят из контрольного флакона с готовой средой при температуре 25°С с использованием индикаторных полосок или потенциометрическим методом с применением стеклянного электрода.
После стерилизации питательные среды оставляют для охлаждения при комнатной температуре. При необходимости розлива в чашки Петри среды охлаждают до температуры (50-60)°С.
Температура сред, хранящихся в холодильнике, перед посевом должна быть доведена до комнатной.
Д.2 Питательный бульон
Д.2.1 Питательный бульон готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
Д.2.2 Питательный бульон (десятикратный) для колифагов готовят путем увеличения в 10 раз навески сухого препарата, указанной на этикетке.
Д.3 Питательный агар
Д.3.1 Питательный агар готовят из сухого препарата промышленного производства по способу, указанному на этикетке.
Д.3.2 Питательный агар для определения колифагов прямым методом готовят, увеличивая навеску сухого препарата в 2 раза от рецептуры приготовления (см. Д.3 приложения Д).
Д.3.3 Питательный агар запрещается выдерживать в расплавленном состоянии более 8 ч. Оставшийся неиспользованным агар повторному расплавлению не подлежит.
Д.3.4 Полужидкий питательный агар готовят следующим образом: сухой питательный бульон (15 г) и агар микробиологический (3 г) растворить при нагревании в 1000 см дистиллированной воды. Довести рН до 7,0-7,2, разлить в пробирки и стерилизовать автоклавированием при 121°С в течение 15 мин.
Д.3.5 Питательный агар со стрептомицином готовят из расчета содержания 100 мкг стрептомицина на 1 см питательного агара, приготовленного по стандартной рецептуре. В стерильных условиях на стерильной дистиллированной воде готовят раствор стрептомицина в концентрации 10 мг на 1 см
. В готовый питательный агар, отмеренный по объему и остуженный до температуры (47±2)°С, вносят приготовленный стерильный раствор стрептомицина из расчета 0,1 см
на 10 см
питательного агара. Разливают в пробирки для приготовления скошенного агара.
Повторное расплавление питательной среды со стрептомицином запрещается.
Д.4 Фуксин-сульфитная среда Эндо
Д.4.1 Основная модификация
Готовят из сухого препарата по способу, указанному на этикетке. Если на поверхности среды заметны следы влаги, чашки перед посевом необходимо подсушить в термостате. Срок хранения чашек со средой - не более 2-3 сут в темноте, если производителем не оговорены другие сроки.
Д.4.2 Повышение дифференцирующих свойств среды
Для повышения дифференцирующих свойств среды в готовую и охлажденную до (60-70)°С среду перед разливкой в чашки допускается прибавлять на 100 см среды 0,2 см
5%-ного спиртового раствора основного фуксина. Срок хранения раствора фуксина - не более 1 мес.
Д.4.3 Модификация среды с добавлением розоловой кислоты
В случаях, когда мембранные фильтры зарастают посторонней микрофлорой, не относящейся к бактериям кишечной группы, помимо фуксина, допускается добавление на 100 см среды Эндо 0,2 см
5%-ного спиртового раствора розоловой кислоты. Срок хранения раствора розоловой кислоты - не более 1 мес.
Модификацию среды Эндо с добавлением розоловой кислоты используют только при работе методом мембранной фильтрации.
Д.5 Приготовление хромокультколиформ агара для ускоренного одновременного определения E.coli и колиформных бактерий в одном посеве
Агар готовят из сухого препарата, разрешенного к применению по 8.1.6, по способу, указанному производителем.
Нагревают навеску агара на кипящей водяной бане, периодически помешивая, до полного растворения частиц в течение 35 мин. Не допускается автоклавировать и перегревать.
Готовую среду охлаждают до температуры (45-50)°С и разливают в чашки Петри.
Срок хранения питательной среды при температуре от 2°С до 8°С в защищенном от света месте - не более 21 сут.
Для предотвращения от высыхания чашки со средой рекомендуется поместить в пластиковые мешки.
Готовая среда должна иметь желтоватый цвет.
Д.6 Лактозо-пептонная среда
10 г пептона, 5 г натрия хлористого, 5 г лактозы растворяют при нагревании в 1 л дистиллированной воды. После растворения ингредиентов устанавливают рН 7,4-7,6, разливают по 10 см в пробирки, стерилизуют при (112±2)°С 12 мин.
Для приготовления концентрированной лактозо-пептонной среды все ингредиенты, кроме воды, увеличивают в 10 раз, разливают по 1 см в пробирки и по 10 см
во флаконы.
Д.7 Питательные среды для подтверждения способности ферментировать лактозу до кислоты и газа
Д.7.1 Полужидкая среда с лактозой из сухого препарата
Готовят по способу, указанному на этикетке.
Срок хранения - не более двух недель при комнатной температуре.
Посев производят уколом до дна пробирки. При образовании кислоты цвет питательной среды изменяется в соответствии с использованным индикатором. При газообразовании газ скапливается по уколу или на поверхности, или в толще среды появляются разрывы. При инкубации посевов более 5 ч газ может улетучиться. В таких случаях на присутствие газа указывают оставшиеся в толще среды "карманы" - потемнения среды на месте бывшего пузырька газа.
Д.7.2 Полужидкая среда с лактозой
Готовят при отсутствии сухого препарата.
В 1 л дистиллированной воды растворяют 10 г пептона, 5 г натрия хлористого, (4-5) г агар-агара, доводят до кипения, устанавливают рН 7,2-7,4, добавляют 1 см1,6%-ного спиртового раствора бромтимолового синего. Стерилизуют при температуре (120±2)°С 20 мин. В расплавленную среду вносят 5 г лактозы, нагревают до кипения, разливают в стерильные пробирки на высоту от 3 до 5 см и стерилизуют при (112±2)°С 12 мин. Срок хранения - не более двух недель при комнатной температуре.
Готовая среда имеет зеленый цвет с синеватым оттенком. При образовании кислоты цвет среды изменяется на желтый.
Д.8 Реактивы для оксидазного теста
Д.8.1 Вариант 1
1%-ный водный раствор тетраметил-п-фенилендиамина гидрохлорид. Готовят непосредственно перед использованием.
Д.8.2 Вариант 2
Реактив N 1: 1%-ный спиртовой раствор -нафтола.
Реактив N 2: 1%-ный водный раствор фенкпендиаминового соединения.
Растворы сохраняют в темных флаконах с притертыми пробками:
1 - до одного месяца, 2 - до одной недели. Перед употреблением к трем частям первого раствора добавляют семь частей второго раствора.
Могут быть использованы коммерческие тест-системы для постановки оксидазного теста.
Перед работой с каждой серией проб реактивы или тест-системы на оксидазу следует испытывать на эталонных тест-микроорганизмах, дающих положительную (P.aeruginosa или P.fluorescens) и отрицательную оксидазную реакцию (E.coli).
Д.9 Приготовление энтерококкагара
Д.9.1 Энтерококк агар готовят из сухого препарата по способу, указанному производителем.
При приготовлении следует обратить внимание на следующие приемы, необходимые для предохранения от разрушения ТТХ при нагревании:
- навеску питательной среды следует предварительно замочить на время от 0,5 до 1 ч в небольшом объеме дистиллированной воды;
- раствор питательной среды довести до кипения и кипятить при постоянном помешивании в течение не более 1 мин до полного расплавления агара, строго соблюдая время кипячения;
- раствор расплавленного агара быстро охладить до температуры от 45°С до 50°С следующим способом: емкость, в которой готовили энтерококкагар, поместить в сосуд с водой температурой от 45°С до 50°С, постоянно перемешивая питательную среду до охлаждения; затем разлить в чашки Петри до застывания. Готовую питательную дифференциальную среду в чашках Петри хранить в защищенном от света месте при температуре (5±3)°С не более двух недель.
Д.9.2 Приготовление азидной среды Сланеца-Бертли (модификация)
Сухой питательный агар в количестве, указанном производителем, и 4 г калия фосфорнокислого однозамещенного расплавляют при нагревании в 1000 см дистиллированной воды. Разливают в термостойкие емкости и стерилизуют при температуре (120±2)°С в течение 20 мин.
Перед применением в расплавленную и слегка остуженную основу среды из расчета на 100 см добавляют 2 см
дрожжевого экстракта, 1 г глюкозы, 0,04 г азида натрия и 1 см
1%-ного водного раствора 2,-3,-5-трифенилтетразолий хлорида (ТТХ). Тщательно перемешивают, устанавливают рН раствора 7,1 и разливают в чашки Петри слоем толщиной 0,5 см. Готовую среду в чашках Петри хранить в защищенном от света месте при температуре (5±3)°С не более двух недель.
Примечание - Азид натрия - высокотоксичное и мутагенное вещество. При работе с ним должны применяться средства защиты органов дыхания. Азидсодержащие среды не должны смешиваться с сильными кислотами во избежание образования токсичных компонентов. Растворы, содержащие азид натрия, могут образовывать взрывоопасные компоненты при контакте с металлическими трубопроводами.
Д.9.3 Приготовление солевого агара с ТТХ для подтверждения наличия энтерококков
Сухой питательный агар в количестве, указанном производителем, и 65 г хлорида натрия растворяют при нагревании в 1000 см дистиллированной воды, после чего разливают мерно в термостойкие емкости и стерилизуют при температуре (120±2)°С в течение 20 мин.
Перед применением в расплавленную основу среды из расчета на 100 см добавляют 1 г глюкозы, 2 см
дрожжевого экстракта или другого дрожжевого препарата, 1 см
водного 1%-ного раствора ТТХ. Тщательно перемешивают и разливают в чашки Петри. Готовую среду в чашках Петри хранят в защищенном от света месте при (5±3)°С не более двух недель.
Д.9.4 Приготовление желчь-эскулин-азидного агара
Компоненты среды приведены в таблице Д.1.
Таблица Д.1
Компоненты среды | Масса (объем) |
Триптон, г | 17,0 |
Пептон, г | 3,0 |
Дрожжевой экстракт, см | 5,0 |
Дегидратированная желчь, г | 10,0 |
Хлорид натрия, г | 5,0 |
Цитрат аммония-железа (III), г | 0,5 |
Эскулин, г | 1,0 |
Азид натрия, г | 0,15 |
Агар (в зависимости от инструкций производителя), г | От 8 до 18 |
Вода дистиллированная, см | Доводится до 1000 |
Составляющие растворяют в воде при кипячении и стерилизуют при температуре (121±1)°С в течение 15 мин. рН раствора после стерилизации (при температуре 25°С) - (7,1±0,1). Среду охлаждают, медленно выливают в стерильные чашки Петри слоем 3-5 мм и оставляют для остывания на горизонтальной поверхности.
Срок хранения готовой среды в темноте - не более двух недель при температуре (5±3)°С.
Д.9.5 Приготовление растворов для разведений
Д.9.5.1 Приготовление солевого (физиологического) раствора
8,5 г хлорида натрия растворяют в 1000 см дистиллированной воды. Устанавливают pH раствора, равное (7,0±0,1). Раствор разливают в термостойкие емкости и стерилизуют при температуре (120±2)°С в течение 15 мин. После стерилизации при необходимости корректируют рН раствора: значение рН раствора должно быть (7,0±0,1).
Срок хранения раствора при температуре (23±2)°С - не более 1 мес.
Д.9.5.2 Приготовление пептонного раствора
1 г пептона растворяют при кипячении в 1000 см дистиллированной воды. Устанавливают рН раствора. Значение рН должно быть равно (7,0±0,1). Раствор стерилизуют при температуре (120±2)°С в течение 20 мин. После стерилизации при необходимости корректируют рН раствора: значение рН раствора должно быть (7,0±0,1).
Срок хранения раствора при температуре (23±2)°С - не более 1 мес.
Д.9.5.3 Приготовление пептонно-солевого раствора
8,5 г хлорида натрия и 1 г пептона растворяют при кипячении в 1000 см дистиллированной воды. Устанавливают рН раствора. Значение рН должно быть равно (7,0±0,1). Стерилизуют при температуре(120±2)°С в течение 20 мин. После стерилизации при необходимости корректируют рН раствора: значение рН раствора должно быть (7,0±0,1).
Срок хранения раствора при температуре (23±2)°С - не более 1 мес.
Д.10 Минеральная среда Бонде
Компоненты среды приведены в таблице Д.2.
Таблица Д.2
Компоненты | Масса (объем) |
Натрий лимоннокислый трехзамещенный, г | 28 |
Натрий аммоний фосфорнокислый, г | 15 |
Калий фосфорнокислый однозамещенный, г | 10 |
Магний сернокислый (сульфат магния), г | 2 |
Вода дистиллированная, см | 1000 |
Ингредиенты растворяют при нагревании, стерилизуют при 1 атм. 20 мин. Перед посевом добавляют 5 см 0,01%-ного водного раствора кристаллического фиолетового на 100 см
среды.
Д.11 Среда Блеск
100 см питательного агара, стерильного, приготовленного из сухого препарата по рецептуре на этикетке, расплавляют на водяной бане. После охлаждения до температуры (45-50)°С добавляют 0,3 г L-аргинина, 8 см
10%-ного водного раствора трифенилтетразолий хлорида (ТТХ), 10 см
стерильного обезжиренного теплого молока, тщательно перемешивают и разливают в чашки слоем не менее 25 см
.
Д.12 Магниевая среда накопления в экспедиционной модификации
Предварительно готовят навески всех ингредиентов среды в расфасованном виде, которые затем вносят в исследуемую воду в соответствии с рецептурой, указанной в таблице Д.3:
Таблица Д.3
Компоненты среды | Масса (объем) компонентов | |
при объеме исследуемой пробы воды: | ||
500 см | 100 см | |
Магний хлористый кристаллический, г | 19,5 | 3,9 |
Натрий хлористый, г | 4,0 | 0,8 |
Калий фосфорно-кислый однозамещенный безводный, г | 0,8 | 0,16 |
10%-ный раствор пептона, см | 25,0 | 5,0 |
Дрожжевой экстракт, см | 11,0 | 2,5 |
Бриллиантовый зеленый 0,1%-ный водный раствор, см | 2,5 | 0,5 |
Каждую навеску ингредиента вносят в исследуемый объем воды по одному, сразу после полного растворения предыдущего. Далее добавляют 10%-ный раствор пептона, дрожжевой экстракт и 0,1%-ный раствор бриллиантового зеленого в соответствии с рецептурой.
Допускается использование стерильных емкостей, в которые в условиях стационарной лаборатории внесены сухие ингредиенты. Срок хранения не более 7 сут.
Д.13 Приготовление дрожжевого экстракта
1000 г прессованных (пекарских) дрожжей распределяют равномерно в 2000 см дистиллированной воды, прогревают в автоклаве при 100°С 30 мин, отстаивают в холодильнике от 4 до 5 сут. Надосадочную жидкость разливают во флаконы объемом 50 и 100 см
, прибавляют на каждые 100 см
экстракта 1,25 см
0,01%-го водного раствора кристаллического фиолетового, вновь прогревают при 100°С 30 мин. Хранят экстракт в холодильнике.
Применяют также сухой дрожжевой экстракт промышленного производства (в соответствии с инструкцией производителя).
Д.14 Висмут-сульфит агар
Готовят из сухого препарата промышленного производства по указанию на этикетке.
Д.15 Селенитовый бульон для выделения патогенных энтеробактерий
Готовят из сухого препарата промышленного согласно инструкции, указанной производителем на этикетке, с соблюдением срока реализации среды.
Для приготовления селенитового бульона двойной концентрации увеличивают навеску сухого препарата в два раза на тот же объем дистиллированной воды.
Д.16 Приготовление разбавлений
Для посева объемов воды, меньших чем 1 см, используют разбавления анализируемой воды. Перед посевом растворы для разбавления разливают по 9 см
в пробирки с соблюдением правил стерильности. Затем в первую пробирку с 9 см
раствора вносят 1 см
анализируемой воды. При этом пипетка не должна быть опущена ниже поверхности воды, чтобы избежать смывания бактерий с наружной стороны. Другой стерильной пипеткой продуванием воздуха тщательно перемешивают содержимое пробирки, отбирают из нее 1 см
и переносят в чашку Петри, что будет соответствовать посеву 0,1 см
анализируемой воды. При необходимости посева меньших объемов этой же пипеткой переносят 1 см
содержимого первой пробирки в следующую пробирку с 9 см
раствора для разбавления. Другой стерильной пипеткой делают посев 1 см
из второй пробирки, что будет соответствовать посеву 0,01 см
анализируемой воды. В случаях высокого уровня загрязнения воды разбавление продолжают аналогично, каждый раз меняя пипетку.
Время от момента приготовления разбавлений и их использования не должно превышать 30 мин.
Приложение Е
(обязательное)
Подготовка мембранных фильтров и фильтровального аппарата
Е.1 Подготовку мембранных фильтров, разрешенных к применению в соответствии с 8.1.6, проводят в соответствии с рекомендациями производителя. Если производитель поставляет нестерильные фильтры, их стерилизуют до начала исследований. После стерилизации фильтры используют "ex tempore" (тотчас) или высушивают в асептических условиях и упаковывают стерильно в чашки Петри или стерильные пакеты. Срок хранения фильтров стерилизованных в лаборатории - 10 дней.
Перед началом проведения анализа стерильные сухие фильтры смачивают в стерильной дистиллированной воде, накладывая стерильным пинцетом отдельно каждый фильтр на поверхность воды, налитой в стерильную чашку Петри.
Е.2 Воронку и столик фильтровального аппарата обтирают марлевым (ватным) тампоном, смоченным 96%-ным спиртом ректификованным по ГОСТ 18300, и фламбируют. После сгорания спирта и охлаждения воронку снимают, а на столик фильтровального аппарата кладут фламбированным пинцетом стерильный мембранный фильтр и снова присоединяют фильтровальную воронку. (При использовании одноразовых стерильных фильтровальных аппаратов процедуры по стерилизации фильтровального аппарата не проводят).
В воронку аппарата для фильтрования наливают отмеренный объем воды, затем создают разрежение и отфильтровывают содержимое воронки.
После окончания фильтрования и осушения фильтра отключают вакуум, воронку снимают, фильтр осторожно поднимают за край фламбированным пинцетом и переносят его, не поворачивая, на дифференциальную питательную среду согласно видовой принадлежности микроорганизмов, разлитую в чашки Петри, добиваясь отсутствия пузырьков воздуха между средой и фильтром. Поверхность фильтра с осевшими на ней бактериями должна быть обращена вверх.
При фильтровании 1 см пробы воды в воронку до внесения проб воды добавляют от 4 до 5 см
стерильного физиологического раствора, чтобы обеспечить равномерное распределение бактерий на поверхности фильтра.
При посеве нескольких объемов из одной пробы воды фильтрование проводят через один фильтровальный аппарат без повторной стерилизации фламбированием, в первую очередь фильтруют меньшие, а затем большие объемы воды, используя для каждого объема отдельный фильтр. Перед фильтрованием новой пробы аппарат стерилизуют фламбированием.
УДК 629.4.018:629.4.082 | МКС 45.040 | ОКП 31 8000 | |
Ключевые слова: железнодорожный подвижной состав, методы гигиенической оценки, система водоснабжения, санитарно-микробиологические показатели, санитарно-химические показатели | |||
Редакция документа с учетом
изменений и дополнений подготовлена

