ГОСТ 26075-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ЖИВОТНЫЕ
Методы лабораторной диагностики бешенства
Animals. Methods of Laboratory Diagnostic of Rabies
МКС 11.220
Дата введения 2015-01-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 РАЗРАБОТАН Федеральным государственным бюджетным учреждением "Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов" (ФГБУ "ВГНКИ")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии Российской Федерации
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 июня 2013 г. N 57-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по МК (ИСО 3166) 004-97 | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Киргизия | KG | Кыргызстандарт |
Молдова | MO | Молдова-Стандарт |
Россия | RU | Росстандарт |
Туркмения | ТМ | Главгосслужба "Туркменстандартлары" |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС N 12-2021).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 30 сентября 2013 г. N 1127-ст межгосударственный стандарт ГОСТ 26075-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 января 2015 года
5 ВЗАМЕН ГОСТ 26075-84
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячно издаваемом информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНЫ: поправка, опубликованная в ИУС N 12, 2021 год; поправка, опубликованная на официальном сайте Росстандарта России rst.gov.ru по состоянию на 13.11.2022
Поправки внесены изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на все виды млекопитающих животных и устанавливает следующие методы лабораторной диагностики бешенства:
- метод флуоресцирующих антител (МФА);
- метод выделения вируса бешенства в культуре клеток мышиной нейробластомы CCL-131 (или невриномы Гассерова узла крысы - НГУК-1);
- биопроба на белых мышах;
- метод иммуноферментного анализа (ИФА);
- реакция диффузионной преципитации (РДП).
Примечания
1 Данные методы применимы ко всем представителям рода Lyssavirus.
2 Уличный вирус бешенства относится к микроорганизмам 2 класса патогенности (представляет смертельную опасность для человека и животных).
3 При необходимости генотипирования вируса бешенства с помощью готовых тест-систем применяют метод обратно транскриптазной полимеразной цепной реакции (от-ПЦР).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.008-76 Система стандартов безопасности труда. Биологическая безопасность. Общие требования
ГОСТ 12.4.011-89 Система стандартов безопасности труда. Средства защиты работающих. Общие требования и классификация
ГОСТ 17.0.0.01-76 Система стандартов в области охраны природы и улучшения использования природных ресурсов. Основные положения
ГОСТ 177-88 Водорода перекись. Технические условия
ГОСТ 2603-79 Реактивы. Ацетон. Технические условия
ГОСТ 2768-84 Ацетон технический. Технические условия
ГОСТ 4204-77 Реактивы. Кислота серная. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия.
ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ГОСТ 8074-82 Микроскопы инструментальные. Типы, основные параметры и размеры. Технические требования.
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9284-75 Стекла предметные для микропрепаратов. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 13739-78 Масло иммерсионное для микроскопии. Технические требования. Методы испытаний
ГОСТ 16317-87 Приборы холодильные электрические бытовые. Общие технические условия
ГОСТ 21241-89 Пинцеты медицинские. Общие технические условия.
ГОСТ 22967-90 Шприцы медицинские инъекционные многократного применения. Общие технические требования и методы испытаний
ГОСТ 24861-91 (ИСО 7886-84) Шприцы инъекционные однократного применения
ГОСТ 25046-81 (ИСО 7864-81) Иглы инъекционные однократного применения. Основные размеры. Технические требования. Методы испытаний
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 29230-91 (ИСО 835-4-81) Посуда лабораторная стеклянная. Пипетки градуированные. Часть 4. Пипетки выдувные
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодному информационному указателю "Национальные стандарты", который опубликован по состоянию на 1 января текущего года, и по выпускам ежемесячного информационного указателя "Национальные стандарты" за текущий год. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины, определения и сокращения
3.1 В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1.1 бешенство: Инфекционное заболевание человека и животных, вызываемое представителями семейства Rhabdoviridae рода Lyssavirus (рабдовирус), и приводящее к летальному исходу в 100% случаев.
3.1.2 вирус бешенства: Возбудитель инфекционного заболевания человека и животных.
3.1.3 антиген вируса бешенства: Поверхностные белковые структуры вируса бешенства, на которые вырабатываются антитела.
3.1.2* метод флуоресцирующих антител (МФА): Метод выявления антигена вируса бешенства меченными флуоресцеинизотиоцианатом антирабическими антителами, с образованием характерных светящихся комплексов-включений, обнаруживаемых в поле зрения люминесцентного микроскопа.
________________
* Нумерация соответствует оригиналу. - .
3.1.3 метод выделения вируса бешенства в культуре клеток мышиной нейробластомы CCL-131 (или невриномы Гассерова узла крысы - НГУК-1): Метод выделения антигена вируса бешенства, основанный на размножении вируса в культуре клеток и его идентификации методом флуоресцирующих антител.
3.1.3* биопроба: Метод выделения вируса бешенства на белых мышах путем введения им суспензии патологического материала с последующей идентификацией вируса методом флуоресцирующих антител.
________________
* Нумерация соответствует оригиналу. - .
3.1.4 метод иммуноферментного анализа (ИФА): Метод выявления антигена вируса бешенства, основанный на его специфическом взаимодействии с антирабическим антителом, иммобилизованном на твердом носителе, с последующим выявлением связавшегося антигена с помощью второго меченного ферментом антитела путем окрашивания продукта реакции хромогеном.
3.1.5 реакция диффузионной преципитации (РДП): Метод выявления вируса бешенства, основанный на способности антител и вирусного антигена бешенства диффундировать в агаровом геле и при специфическом взаимодействии образовывать комплекс "антиген-антитело", наблюдаемый невооруженным глазом в виде линии преципитации.
3.1.6 метод обратно транскриптазной полимеразной цепной реакции (от-ПЦР): Метод выявления генома вируса бешенства путем перевода специфической последовательности РНК вируса в ДНК с последующим многократным копированием полученной ДНК и обнаружением продуктов реакции, осуществляемый in vitro.
3.2 В настоящем стандарте применены следующие сокращения:
ФАГ - флуоресцирующий антирабический иммуноглобулин;
АнГ - антирабический глобулин;
КФГ - контрольный флуоресцирующий глобулин;
ФБР - фосфатно-буферный раствор;
НГУК-1 - невринома Гассерова узла крысы;
ФИТЦ - флуоресцеинизотиоцинат;
РНК - рибонуклеиновая кислота;
ДНК - дезоксирибонуклеиновая кислота;
CCL-131 - культура клеток мышиной нейробластомы;
ОФД - ортофенилдиамин;
ТМБ - тетраметилбензидин.
4 Условия выполнения исследований и требования безопасности
4.1 Условия выполнения исследований
4.1.1 Общие требования проведения микробиологического анализа и работы с микроорганизмами I-II групп патогенности - по ГОСТ ISO 7218.
4.1.2 Общие требования к помещениям - по ГОСТ ISO 7218.
4.1.3 Требования к персоналу - по ГОСТ ISO 7218, ГОСТ ИСО/МЭК 17025, [1].
К проведению исследований допускаются квалифицированные сотрудники, имеющие опыт работы с микроорганизмами I-II групп патогенности, изучившие методики микробиологических работ, вакцинированные против бешенства.
4.2 Требования безопасности
4.2.1 Общие требования безопасности при проведении работ согласно ГОСТ 12.1.008.
4.2.2 Средства защиты работающих должны соответствовать требованиям ГОСТ 12.4.011.
4.2.3 Воздух рабочей зоны должен соответствовать требованиям ГОСТ 12.1.005.
4.2.4 Обучение персонала безопасности труда в соответствии с ГОСТ 12.0.004.
4.2.5 Утилизацию полученного для исследования материала, а также использованных индивидуальных средств защиты, инструментов и т.д. проводят путем кипячения в течение 30 мин или автоклавирования в течение 15 мин при давлении (0,11±0,20) МПа.
5 Средства измерений, оборудование, материалы, реактивы и животные
5.1 Для проведения исследований используют:
- спектрофотометр сканирующий со спектральным диапазоном измерения длин волн от 190 до 1100 нм с погрешностью не более ±0,5 нм и диапазоном измерения оптической плотности (ОП) от 0,1 до 3,0;
- планшеты для иммунологических реакций 96-луночные;
- термостат, обеспечивающий поддержание температуры от 20 °С до 50 °С;
- холодильник бытовой, обеспечивающий поддержание температуры от 0 °С до 10 °С по ГОСТ 16317;
- центрифугу лабораторную;
- баню водяную;
- микроскоп люминесцентный инвертированный по ГОСТ 8074;
- ступки фарфоровые с пестиком по ГОСТ 9147 или гомогенизатор по ГОСТ ИСО/МЭК 17025;
- стекла предметные по ГОСТ 9284;
- пробирки стеклянные по ГОСТ 25336;
- чашки Петри по ГОСТ 25336;
- кювету по ГОСТ 25336;
- пипетки вместимостью 1,0; 2,0 и 10,0 см по ГОСТ 29230;
- пипетки автоматические вместимостью от 0,05 до 0,20 см с наконечниками;
- пинцеты медицинские по ГОСТ 21241;
- шприцы инсулиновые вместимостью 1,0 см по ГОСТ 22967 или ГОСТ 24861;
- иглы инъекционные по ГОСТ 25046;
- стекла культуральные на восемь лунок;
- клетки для содержания мышей;
- ацетон по ГОСТ 2603 или ГОСТ 2768;
- флуоресцирующий антирабический иммуноглобулин (ФАГ);
- антирабический глобулин (АнГ);
- контрольный флуоресцирующий глобулин (КФГ);
- масло нефлуоресцирующее иммерсионное по ГОСТ 13739;
- воду дистиллированную по ГОСТ 6709;
- раствор фосфатно-буферный молярной концентрации 0,01 моль/дм (ФБР), рН 7,2-7,4;
- раствор натрия хлорида стерильный 0,9%-ный изотонический;
- культуру клеток мышиной нейробластомы CCL-131 или невриномы Гассерова узла крысы - НГУК-1;
- пенициллин;
- стрептомицин;
- среду Игла МЕМ с двойным набором аминокислот и витаминов (ДМЕМ), рН 7,2;
- раствор трипсина 0,25%-ный;
- сыворотку эмбриональную крови крупного рогатого скота для культур клеток 10%-ную;
- глютамин 3%-ный:
- перекись водорода 3%-ную по ГОСТ 177;
- набор препаратов для лабораторной диагностики бешенства животных методом ИФА;
- раствор серной кислоты молярной концентрации 2 моль/дм по ГОСТ 4204;
- бумагу фильтровальную по ГОСТ 12026;
- штамп для приготовления лунок;
- мертиолят;
- агар "Дифко" или аналогичный;
- раствор метилового оранжевого 1%-ный в 50%-ном этиловом спирте;
- антигены положительный и отрицательный;
- сыворотку антирабическую или иммуноглобулин;
- мышей белых клинически здоровых массой 6-8 г.
5.2 Допускается применение других средств измерений с метрологическими характеристиками и оборудования с техническими характеристиками не хуже, а также реактивов и материалов по качеству не ниже указанных выше. Допускается использование посуды одноразового применения.
6 Отбор проб
6.1 Для проведения исследований на наличие вируса бешенства в лабораторию направляют патологический материал - свежий труп или голову мелких животных, голову или головной мозг крупных животных.
6.2 Отобранный для исследований патологический материал упаковывают во влагонепроницаемую тару и доставляют в лабораторию в металлических контейнерах. Замороженный материал помещают в криоконтейнер.
6.3 Патологический материал сопровождают документом, содержащим следующие данные: наименование и адрес отправителя, вид животного, анамнестические и клинико-эпизоотологические данные.
6.4 Лабораторные исследования проводят сразу же при получении патологического материала.
6.5 Для исследования отбирают от крупных животных кусочки ткани из каждого отдела головного мозга (аммоновы рога, мозжечок, кору больших полушарий, продолговатый мозг) размером 0,5-1,0 см, мозг мелких животных, например мышей, исследуют целиком.
Для исследования МФА и методом выделения вируса бешенства в культуре клеток мышиной нейробластомы CCL-131 (или НГУК-1) пригодны только свежие или свежезамороженные пробы ткани головного мозга. Не допускаются для исследований пробы мозга животных, разлагающиеся (в стадии загнивания), консервированные глицерином, фиксированные метиловым спиртом, формалином или другими средствами, способствующими возникновению неспецифической флуоресценции.
Для постановки биопробы допускается использовать пробы мозга, консервированные в 30%-50%-ном растворе глицерина. Использование других консервантов не допускается. Для сохранности патологический материал может быть заморожен при температуре не выше минус 10 °С.
7 Метод флуоресцирующих антител (МФА)
7.1 Сущность метода
Сущность метода флуоресцирующих антител заключается в специфическом взаимодействии флуоресцирующих антирабических антител с гомологичным антигеном вируса бешенства. Образующийся при этом комплекс "антиген-антитело", меченный ФИТЦ, обнаруживается визуально по характерному свечению в поле зрения при рассмотрении под люминесцентным микроскопом.
7.2 Подготовка к исследованию
7.2.1 Подготовка проб
7.2.1.1 Из кусочков ткани, отобранных по 6.5, готовят не менее трех препаратов (отпечатков или мазков) из каждого отдела мозга на тщательно обезжиренных предметных стеклах. Если состояние патологического материала позволяет, то готовят отпечатки, в остальных случаях делают мазки.
7.2.1.2 Приготовление отпечатков
Кусочки ткани, отобранные по 6.5, кладут на фильтровальную бумагу, сложенную в четыре-шесть слоев. Мозг мелких животных разрезают поперек, захватывая все его отделы, и кладут его пинцетом срезом вверх на фильтровальную бумагу, сложенную в четыре-шесть слоев. К поверхности среза прикасаются предметным стеклом, слегка надавливая его до получения на стекле тонкого отпечатка.
7.2.1.3 Приготовление мазков
Кусочек ткани из каждого отдела мозга (у мелких животных весь мозг целиком), отобранный по 6.5, растирают в фарфоровой ступке пестиком до образования гомогенной массы, из которой делают мазки на предметных стеклах.
7.2.1.4 Для контроля делают мазки или отпечатки из мозга здоровых, не болевших бешенством и не вакцинированных против бешенства, белых мышей, как описано в 7.2.1.2 и 7.2.1.3.
(Поправка).
7.2.1.5 После приготовления мазки или отпечатки высушивают на воздухе в течение 20-30 мин, фиксируют в охлажденном ацетоне при температуре 4 °С в течение 4-12 ч или при температуре минус 20 °С в течение 1 ч, после чего извлекают из ацетона и высушивают на воздухе в течение 10-15 мин.
7.2.2 Подготовка реактивов
ФАГ, АнГ и КФГ растворяют дистиллированной водой до указанного на этикетке ампулы первоначального объема. Срок хранения растворенных ФАГ, АнГ и КФГ при температуре (5±2) °С - не более двух недель.
Непосредственно для исследования необходимое количество растворенных ФАГ, АнГ и КФГ разводят ФБР до рабочего разведения, указанного на этикетке ампулы. Рабочие разведения растворенных ФАГ, АнГ и КФГ используют в день приготовления.
7.3 Проведение исследования
Предметные стекла с препаратами (мазками или отпечатками) по 7.2.1 помещают во влажную камеру (чашку Петри или кювету с увлажненным дном). Затем на один из трех приготовленных препаратов наносят ФАГ в рабочем разведении равномерно на всю поверхность мазка или отпечатка при помощи пипетки. На второй препарат наносят рабочее разведение КФГ. Закрывают камеру с препаратами, помещают в термостат при температуре (37±1) °С и выдерживают в течение 30 мин. Параллельно окрашивают контрольные препараты. По окончании окрашивания препараты трехкратно промывают, погружая их каждый раз на 10 мин в сосуд с ФБР, ополаскивают дистиллированной водой и высушивают на воздухе в течение 20-30 мин.
На третий препарат наносят рабочее разведение АнГ, помещают в термостат при температуре (37±1) °С и выдерживают в течение 30 мин. Затем препарат трехкратно промывают, погружая каждый раз на 10 мин в сосуд с ФБР, ополаскивают дистиллированной водой, высушивают на воздухе в течение 20-30 мин и окрашивают рабочим разведением ФАГ, как описано выше.
На окрашенные препараты наносят нефлуоресцирующее иммерсионное масло и просматривают в люминесцентном микроскопе.
7.4 Обработка результатов
В окрашенных препаратах не пораженная вирусом бешенства мозговая ткань светится тусклым, серовато-желтым цветом.
Антиген вируса бешенства выявляется в нейронах и вне клеток в виде ярких зеленых гранул различной формы и величины - от едва заметных до имеющих размер в диаметре 15-20 мкм. Иногда отмечается большое количество мелких ярких зеленых частиц (размером до 1 мкм) округлой и овальной формы.
Диагноз бешенство считается установленным, если в нескольких полях зрения микроскопа в исследуемом препарате обнаруживают типичные желтовато-зеленые гранулы. При этом в контрольных препаратах (в мазках или отпечатках из мозга здоровых не болевших бешенством белых мышей, окрашенных ФАГ), а также в исследуемых препаратах, окрашенных КФГ и предварительно обработанных АнГ и окрашенных ФАГ, подобных образований быть не должно.
О результатах исследования сообщают компетентным органам в соответствии с порядком, действующим на территории государства, принявшего стандарт.
В случае отрицательного результата проводят исследования по 8 или 9.
8 Метод выделения вируса бешенства в культуре клеток мышиной нейробластомы CCL-131 (или невриномы Гассерова узла крысы - НГУК-1)
8.1 Сущность метода
Сущность метода заключается в выделении вируса бешенства в культуре клеток мышиной нейробластомы CCL31 или НГУК-1 с последующей его идентификацией методом флуоресцирующих антител.
Метод является альтернативным биопробе на белых мышах по 9.
8.2 Подготовка к исследованию
8.2.1 Подготовка проб
Равные части ткани, стерильно отобранные из каждого участка головного мозга мелкого животного (аммоновы рога, мозжечок, кора больших полушарий, продолговатый мозг), или кусочки ткани из каждого отдела головного мозга крупного животного, отобранные по 6.5, измельчают ножницами и растирают в ступке или гомогенизаторе, постепенно добавляя стерильный 0,9%-ный изотонический раствор натрия хлорида до получения 10%-ной суспензии. В суспензию мозга добавляют пенициллин и стрептомицин по 100 ЕД/см и 1 мг/см
соответственно.
Полученную суспензию тщательно перемешивают и центрифугируют в течение 5-10 мин при скорости 2000 об./мин. Надосадочную жидкость переносят в стерильную пробирку и хранят при температуре не выше 4 °С до использования.
8.2.2 Подготовка культуральных стекол
Суточную культуру клеток мышиной нейробластомы CCL-131 (или НГУК-1) снимают с культурального флакона при помощи 0,25%-ного раствора трипсина и разводят средой ДМЕМ с 10%-ной эмбриональной сывороткой крови крупного рогатого скота и 3%-ным глютамином до концентрации 210
клеток/см
. В лунки культурального стекла вносят по 0,1 см
полученной суспензии клеток, накрывают крышкой и помещают во влажный
-инкубатор с содержанием
5% при температуре (37±1) °С на 18-20 ч.
8.3 Проведение исследования
В две лунки культурального стекла по 8.2.2 вносят по 0,05 см суспензии из каждого отдела головного мозга. На каждом стекле оставляют две лунки для положительного и отрицательного контроля. В качестве положительного контроля используют суспензию мозга мыши, зараженной вирусом бешенства - штаммом CVS. В качестве отрицательного контроля вносят суспензию мозга клинически здоровой мыши. Культуральное стекло помещают во влажный
-инкубатор с содержанием
5% при температуре (37±1) °С на 42-48 ч.
По окончании инкубации с помощью автоматической пипетки из лунок культурального стекла удаляют среду, один раз промывают клетки ФБР (с помощью автоматической пипетки вносят по 0,2 см раствора в каждую лунку) и подсушивают в ламинарном потоке воздуха в течение 20-30 мин. Затем в каждую лунку вносят по 0,1 см
охлажденного до температуры минус 20 °С ацетона и оставляют при комнатной температуре на 30 мин.
После фиксации клеток культуральное стекло переворачивают и встряхивают для удаления ацетона, а затем высушивают в ламинарном потоке воздуха в течение 20-30 мин. С помощью скальпеля и пинцета удаляют пластиковую насадку и подсушивают стекло еще в течение 5-10 мин. В каждую лунку добавляют по 0,05-0,10 см ФАГ в рабочем разведении (подбирают опытным путем), приготовленном в ФБР, помещают во влажную чашку Петри и инкубируют при температуре (37±1) °С в течение 30 мин.
По окончании окрашивания стекла трехкратно промывают, погружая их каждый раз на 10 мин в сосуд с ФБР. Затем препараты ополаскивают дистиллированной водой и высушивают на воздухе в течение 20-30 мин.
На окрашенные препараты наносят нефлуоресцирующее иммерсионное масло и просматривают в люминесцентном микроскопе.
8.4 Обработка результатов
В окрашенных препаратах не пораженная вирусом бешенства культура клеток светится тусклым, серовато-желтым цветом (отрицательный контроль). Антиген вируса бешенства выявляется в цитоплазме культуры клеток в виде ярких зеленых гранул различной формы и величины с четкими очерченными краями (положительный контроль).
Диагноз на бешенство считается установленным, если в нескольких полях зрения микроскопа в исследуемом препарате обнаруживают типичные желто-зеленые гранулы.
Если в культуре клеток вирус бешенства не выявлен, то ставится отрицательный диагноз.
Результаты выделения вируса бешенства в культуре клеток окончательные, дальнейшие исследования не проводят.
9 Биопроба на белых мышах
9.1 Сущность метода
Сущность метода заключается в выделении вируса бешенства путем интрацеребрального введения патологического материала белым мышам с последующей идентификацией вируса методом флуоресцирующих антител по 7.
9.2 Подготовка проб к исследованию - по 8.2.1.
9.3 Проведение исследования
Пять-шесть белых мышей заражают 10%-ной суспензией патологического материала интрацеребрально в объеме 0,02-0,03 см. Зараженных мышей помещают в отдельную клетку, на которую наклеивают этикетку с указанием даты заражения, количества мышей, способа заражения и номера экспертизы патологического материала. Наблюдение за животными проводят не менее 30 дней. Количество здоровых, больных и погибших мышей регистрируют в журнале.
9.4 Обработка результатов
При оценке результатов учитывают наличие клинических признаков у зараженных мышей (взъерошенность шерсти, поедаемость корма, нарушение координации движения, параличи, тремор, прострация). Гибель мышей в первые двое суток после заражения не учитывают. Пробы мозга от больных и погибших животных, начиная с третьих суток, исследуют МФА по 7.
Биопробу считают положительной, если, начиная с третьих суток после заражения, заболела и погибла хотя бы одна мышь и в пробе мозга с помощью МФА обнаружены специфические включения вируса бешенства.
Отрицательный диагноз может быть дан только по истечении 30 сут наблюдения при условии, что все зараженные животные останутся живыми и здоровыми.
Результаты биопробы считаются окончательными, дальнейшие исследования не проводят.
10 Метод иммуноферментного анализа (ИФА)
10.1 Сущность метода
В основе ИФА лежит специфическое взаимодействие антигена вируса бешенства с антителом, иммобилизованным на твердом носителе. Связанный антиген выявляется с помощью второго антирабического антитела, меченного пероксидазой, продукт реакции которой окрашивается при добавлении хромогена. Интенсивность окрашивания продукта реакции прямо пропорциональна количеству антигена.
10.2 Подготовка к исследованию
10.2.1 В качестве исследуемого материала (антиген) используют пробы ткани головного мозга павших, вынужденно убитых, подозреваемых в заболевании бешенством или экспериментально зараженных вирусом бешенства животных.
10.2.2 Приготовление исследуемого антигена
Пробы ткани головного мозга, полученные по 6.5, измельчают, растирают в ступке и готовят 10%-ные суспензии в 0,9%-ном изотоническом растворе хлористого натрия, прогревают в водяной бане при температуре 60 °С в течение 15 мин и центрифугируют в течение 5-10 мин при скорости 2000 об./мин. Надосадочную жидкость используют в качестве исследуемого антигена.
10.2.3 Подготовка реагентов
Все растворы и реагенты перед постановкой реакции необходимо выдержать не менее 30 мин при температуре (22±1) °С.
Подготовку компонентов набора проводят согласно инструкции по применению.
10.3 Проведение исследования
10.3.1 ИФА проводят в сэндвич-варианте с использованием компонентов, входящих в набор для выявления антигена возбудителя бешенства в патологическом материале.
Для проведения ИФА используют планшеты для иммунологических реакций с плоским дном.
Объем ингредиентов, вносимых поэтапно в лунки планшета, равен между собой и составляет 0,1 см.
10.3.2 Сенсибилизация планшета
В лунки полистиролового планшета вносят АнГ в рабочем разведении, указанном на этикетке. Планшет с АнГ накрывают крышкой и инкубируют в термостате при температуре (37±0,5) °С в течение 3 ч или при температуре 4 °С в течение 18 ч. По окончании инкубации лунки планшета трехкратно промывают отмывающим буферным раствором. При каждой отмывке содержимое лунок вытряхивают, а остатки раствора удаляют постукиванием о фильтровальную бумагу.
10.3.3 Внесение антигенов
В ряды планшета A, B и C вносят отмывающий буфер. В лунки планшета вносят контрольные положительный (лунка A1) и отрицательный (лунка A2) антигены, входящие в состав набора, а также исследуемые пробы (лунки A3, A4 и т.д.) и титруют по вертикали, получая разведения от 1:2 до 1:8. При большом количестве проб заполняют и другие ряды планшета. Планшет накрывают крышкой и инкубируют в термостате при температуре (37±0,5) °С в течение 1 ч. По окончании инкубации проводят трехкратную отмывку лунок планшета от не связавшихся с иммуноглобулином антигенов, как описано в 10.3.2.
10.3.4 Внесение антирабического пероксидазного конъюгата
В лунки планшета вносят антирабический пероксидазный конъюгат в рабочем разведении, после чего накрывают крышкой и инкубируют в термостате при температуре (37±0,5) °С в течение 1 ч. Затем лунки планшета трехкратно отмывают, как описано в 10.3.2.
10.3.5 Внесение субстратной смеси
Для проявления реакции в лунки планшета вносят готовую субстратную смесь. Реакцию проявляют в течение 15-30 мин при температуре (22±0,5) °С в темноте. Реакцию останавливают добавлением раствора серной кислоты молярной концентрации 2 моль/дм.
10.4 Обработка результатов
Учет реакции проводят визуально или на сканирующем спектрофотометре в соответствии с инструкцией по применению набора.
Если в субстратной смеси в качестве хромогена используют ОФД, то измерение оптической плотности проводят при 490 нм, если используют ТМБ, то при 450 нм.
Реакцию учитывают только в том случае, если в лунках с контрольным отрицательным антигеном специфическое окрашивание отсутствует при интенсивном окрашивании в лунках с контрольным положительным антигеном. При визуальном учете пробу считают положительной, если хотя бы в одном (первом) разведении наблюдается специфическое окрашивание.
При спектрофотометрическом учете результата ИФА проводят расчет коэффициента специфичности , который равен отношению оптической плотности (ОП) продукта реакции в лунках с контрольным положительным антигеном или исследуемым материалом (ОП
) к оптической плотности субстратной смеси в лунках с контрольным отрицательным антигеном (ОП
). Реакцию считают положительной, если коэффициент специфичности
более 2,1 и отрицательной, если менее 2,1.
Пример
ОП0,641, ОП
0,120,
![]() 5,34 - реакция положительная или ОП
5,34 - реакция положительная или ОП0,180, ОП
0,120
![]() 1,5 - реакция отрицательная.
1,5 - реакция отрицательная.
В случае положительной реакции диагноз считают установленным. Отрицательный результат должен быть подтвержден другими методами по 7-9.
11 Реакция диффузионной преципитации (РДП)
11.1 Сущность метода
Сущность метода РДП заключается в способности антител и вирусного антигена диффундировать в агаровом геле и при специфическом взаимодействии образовывать комплекс "антиген-антитело", наблюдаемый невооруженным глазом в виде линии преципитации.
11.2 Подготовка к исследованию
11.2.1 Подготовка проб
Подготовка проб к исследованию - по 8.2.1.
Для исследования допускаются несвежие пробы мозга животных, контаминированные бактериальной микрофлорой.
11.2.2 Подготовка агара
Для приготовления агара смешивают 1,5 г агара "Дифко", 1 см 1%-ного раствора метилового оранжевого в 50%-ном этиловом спирте, 0,01 г мертиолята, 100 см
изотонического раствора натрия хлорида. Полученную смесь кипятят до полного расплавления агара, разливают по пробиркам, автоклавируют при давлении 0,5 атм в течение 30 мин и хранят в холодильнике при температуре 4 °С.
11.2.3 Подготовка предметных стекол (чашек Петри)
Реакцию ставят либо на предметных стеклах, либо на чашках Петри. На обезжиренное стекло наносят каплю расплавленного агара, равномерно распределяют ее по стеклу и оставляют при комнатной температуре на 20-30 мин для застывания агара. Затем наносят на стекло 2,5 см расплавленного агара, образуя слой толщиной около 2 мм, и оставляют на 20-30 мин. В застывшем слое агара с помощью специального штампа или металлической тонкостенной трубочки диаметром 4-5 мм делают лунки. Столбики агара осторожно извлекают, не повреждая и не допуская отслаивания от стекла тонкого слоя агарового геля, с помощью глазного пинцета или другого инструмента.
Чашки Петри готовят аналогично, внося в них 10-15 см расплавленного агара для получения слоя толщиной 2-3 мм.
11.3 Проведение исследования
Непосредственно перед постановкой реакции готовят разведения антирабической сыворотки (иммуноглобулина), для чего в четыре пробирки вносят по 1,0 см изотонического раствора натрия хлорида. В первую пробирку добавляют 1,0 см
антирабической сыворотки, получая разведение 1:2, перемешивают, и переносят 1,0 см
смеси во вторую пробирку и т.д. Таким образом, получают четыре пробирки с разведениями 1:2, 1:4, 1:8 и 1:16.
В приготовленные лунки вносят по 0,05-0,07 см пробы мозга (каждую пробу в отдельную лунку), полученной по 8.2.1, и разведения антирабической сыворотки или иммуноглобулина (1:2; 1:4; 1:8; 1:16) согласно рисунку 1.
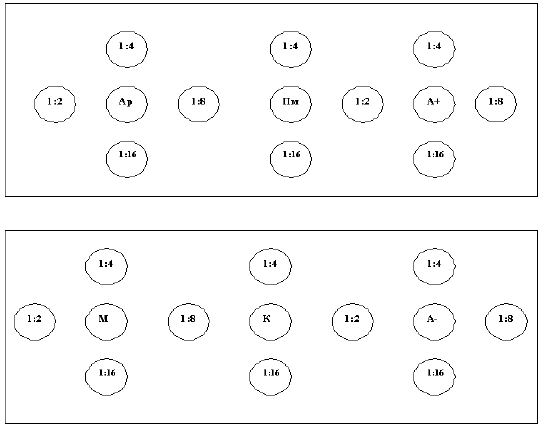
Рисунок 1 - Схема внесения материала
Ар - аммонов рог; Пм - продолговатый мозг; А+ - положительный контрольный антиген; М - мозжечок; К - кора больших полушарий; А- - отрицательный контрольный антиген
Возможно применение других схем внесения материала, но при этом обязательно использование положительного и отрицательного антигенов.
Предметные стекла с исследуемым материалом помещают в чашки Петри с увлажненным дном или влажный эксикатор, а затем в термостат при температуре (37±1) °С на 48 ч (чашки Петри накрывают крышкой и помещают в термостат).
Реакцию учитывают через 6, 24 и 48 ч.
11.4 Обработка результатов
Реакцию считают положительной при появлении даже одной линии преципитации любой интенсивности между лунками, содержащими исследуемый материал и антирабическую сыворотку (иммуноглобулин).
При этом между положительным антигеном и антирабической сывороткой (иммуноглобулином) должна наблюдаться заметная линия преципитации, а между отрицательным антигеном и антирабической сывороткой (иммуноглобулином) линии преципитации быть не должно.
В случае положительной реакции диагноз считают установленным. Отрицательный результат должен быть подтвержден другими методами по 7-10.
Библиография
[1] ЕС Guide to Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use
____________________________________________________________________________________
УДК 619:616.98:579.852.1:615371 МКС 11.220
Ключевые слова: бешенство, диагностика, метод флуоресцирующих антител, иммуноферментный анализ, биопроба, реакция диффузионной преципитации
____________________________________________________________________________________
Редакция документа с учетом
изменений и дополнений подготовлена

