ГОСТ ISO 21871-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МИКРОБИОЛОГИЯ ПИЩЕВЫХ ПРОДУКТОВ И КОРМОВ ДЛЯ ЖИВОТНЫХ
Метод обнаружения и подсчета наиболее вероятного числа Bacillus cereus
Microbiology of food and animal feeding stuffs. Most probable number count and detection method for Bacillus cereus
МКС 07.100.30
Дата введения* 2014-07-01
________________
* Дату введения стандарта в действие на территории присоединившихся государств устанавливают их национальные органы по стандартизации.
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2-2009 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Государственным научным учреждением "Всероссийский научно-исследовательский институт консервной и овощесушильной промышленности" Российской академии сельскохозяйственных наук (ГНУ ВНИИКОП Россельхозакадемии) и ОАО "Всероссийский научно-исследовательский институт сертификации" (ОАО "ВНИИС")
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 7 июня 2013 г. N 43)
За принятие проголосовали:
Краткое наименование страны по | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
(Поправка. ИУС N 6-2019).
4 Приказом Федерального агентства по техническому регулированию и метрологии от 27 июня 2013 г. N 229-ст межгосударственный стандарт ГОСТ ISO 21871-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2014 г.
5 Настоящий стандарт идентичен международному стандарту ISO 21871:2006* Microbiology of food and animal feeding stuffs - Horizontal method for the determination of low numbers of presumptive Bacillus cereus - Most probable number technique and detection method (Микробиология пищевых продуктов и кормов для животных. Горизонтальный метод определения малых количеств презумптивных бактерий Bacillus cereus. Метод обнаружения и метод наиболее вероятного числа).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный стандарт разработан подкомитетом ISO/TC 34/SC 9 "Микробиология" технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO).
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
Сведения о соответствии межгосударственных стандартов ссылочным международным стандартам приведены в дополнительном приложении ДА.
Перевод с английского языка (en)
Официальный экземпляр международного стандарта, на основе которого подготовлен настоящий межгосударственный стандарт, имеется в Федеральном агентстве по техническому регулированию и метрологии Российской Федерации.
Степень соответствия - идентичная (IDT).
6 Настоящий стандарт подготовлен на основе применения ГОСТ Р ИСО 21871-2010
7 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодном информационном указателе "Национальные стандарты", а текст изменений и поправок - в ежемесячном информационном указателе "Национальные стандарты". В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячном информационном указателе "Национальные стандарты". Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
ВНЕСЕНА поправка, опубликованная в ИУС N 6, 2019 год с учетом уточнения, опубликованного в ИУС 11-2019
Поправка внесена изготовителем базы данных
1 Область применения
Настоящий стандарт распространяется на пищевые продукты и корма для животных и устанавливает методы выявления и подсчета наиболее вероятного числа жизнеспособных презумптивных Bacillus cereus.
Данный метод не предусматривает дифференциации Bacillus cereus от других близких видов рода Bacillus, таких как Bacillus weihenstephanensis, Bacillus anthracis, Bacillus thuringiensis, Bacillus mycoides и Bacillus pseudomycoides.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты*:
_______________
* Таблицу соответствия национальных стандартов международным см. по ссылке. - .
ISO 6887-1:1999 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений
ISO 6887-2:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходной суспензии и десятичных разведений для микробиологических исследований. Часть 2. Специальные правила для приготовления мяса и мясных продуктов
ISO 6887-3:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов
ISO 6887-4:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов
ISO 7218:2007 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям
ISO 8261:2001 Молоко и молочные продукты. Общие правила приготовления проб для анализа, исходных суспензий и десятичных разведений для микробиологических исследований
ISO/TS 11133-1:2000 Микробиология пищевых продуктов и кормов для животных. Правила приготовления и производства питательных сред. Часть 1. Общие правила по обеспечению качества приготовления питательных сред в лаборатории
ISO/TS 11133-2:2003 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству питательных сред. Часть 2. Практические руководящие указания по определению эффективности питательных сред
3 Термины и определения
В настоящем стандарте применен следующий термин с соответствующим определением:
3.1 презумптивные Bacillus cereus (presumptive Bacillus cereus): Микроорганизм, который образует типичные или атипичные колонии на поверхности селективной питательной среды и который дает положительные реакции по морфологическим и биохимическим свойствам, установленным в настоящем стандарте
Примечание - Для реализации метода испытаний данное определение презумптивных Bacillus cereus применяют для установленной процедуры идентификации.
4 Сущность метода
4.1 Метод подсчета
4.1.1 Посев в три пробирки с жидкой селективной обогатительной средой двойной концентрации [5.3.1.1 a)] установленным количеством первичного разбавления (исходная суспензия).
4.1.2 Посев в три пробирки с жидкой селективной обогатительной средой нормальной концентрации [5.3.1.1 b)] установленным количеством первичного разбавления (исходная суспензия). Затем, в тех же условиях, пересев на жидкую селективную обогатительную среду нормальной концентрации [5.3.1.1 b)] установленными количествами десятичных разбавлений десятикратных разведений первичного разбавления (исходная суспензия).
4.1.3 Инкубирование пробирок с жидкой селективной обогатительной средой двойной и нормальной концентрации (5.3) в течение 48 ч при температуре 30 °C.
4.1.4 Пересев на твердую селективную среду (5.4 или 5.5) из жидкой селективной обогатительной среды (5.3).
4.1.5 Инкубирование твердой селективной среды (5.4 или 5.5) в течение 18-48 ч при температуре 37 °C (5.4) или 30 °C (5.5) и исследование чашек с целью проверки присутствия колоний, которые, согласно своим характеристикам, должны быть презумптивными бактериями Bacillus cereus.
4.1.6 Подтверждение принадлежности типичных колоний к презумптивным Bacillus cereus проводят при проверке предполагаемых колоний при помощи гемолиза (9.1.5.3) или исследования под микроскопом (9.1.5.4).
4.1.7 Расчет наиболее вероятного числа презумптивных бактерий Bacillus cereus в выражении на грамм или на см пробы выбранных разбавлений проводят с использованием таблиц наиболее вероятного числа.
4.2 Метод обнаружения
4.2.1 Посев на жидкую селективную обогатительную среду (5.3) установленным объемом исходной суспензии пробы для испытаний.
4.2.2 Инкубирование пробирки в течение 48 ч при температуре 30 °C.
4.2.3 Пересев на твердую селективную среду (5.4 или 5.5) из жидкой селективной обогатительной среды (5.3).
4.2.4 Инкубирование твердой селективной среды (5.4 или 5.5) в течение 18-48 ч при температуре 37 °C (5.4) или 30 °C (5.5) и анализ чашек с целью проверки присутствия колоний, которые, согласно своим характеристикам, могут соответствовать презумптивным бактериям Bacillus cereus.
4.2.5 Подтверждение наличия предполагаемых колоний при помощи гемолиза (9.1.5.3) или исследования под микроскопом (9.1.5.4).
4.2.6 Результат приводится в форме "присутствие" или "отсутствие" презумптивных бактерий Bacillus cereus в граммах или кубических сантиметрах продукции.
5 Питательные среды и реактивы
5.1 Общие положения
В лабораторной практике применяют ISO 7218, ISO/TS 11133-1 и ISO/TS 11133-2.
5.2 Разведение - по ISO 6887 (все части), ISO 8261 и любой конкретный стандарт, распространяющийся на анализ продукции.
5.3 Жидкая селективная обогатительная среда: триптон-соевый полимиксиновый бульон (TSPB) по [1].
5.3.1 Основа среды
5.3.1.1 Состав
Наименование компонента | a) | b) |
Продукт ферментативного переваривания казеина, г | 34,0 | 17,0 |
Продукт ферментативного переваривания сои, г | 6,0 | 3,0 |
Хлорид натрия ( | 10,0 | 5,0 |
Глюкоза, г | 5,0 | 2,5 |
Фосфорнокислый калий двузамещенный ( | 5,0 | 2,5 |
Вода, см | 1000 | 1000 |
5.3.1.2 Приготовление
Ингредиенты или готовую основу среды растворяют в воде, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании. При необходимости корректируют pH так, чтобы после стерилизации он был равен 7,3±0,2 ед. pH при температуре 25 °C.
Среды распределяют в объеме по 10 см [среда двойной концентрации (5.3.1.1 a)] и по 9 см
[среда нормальной концентрации (5.3.1.1 b)] в пробирки размером 16 мм
160 мм (6.7).
Стерилизуют в автоклаве (6.1) при температуре 121 °C в течение 15 мин.
5.3.2 Раствор сульфата полимиксина B
5.3.2.1 Состав
Сульфат полимиксина B, ЕД активности (или г) | 500000 (или 0,05) |
Вода, см | 50 |
5.3.2.2 Приготовление
Сульфат полимиксина B растворяют в воде. Стерилизуют путем фильтрации.
5.3.3 Полная среда
Непосредственно перед использованием добавляют 0,2 см (для среды двойной концентрации) или 0,1 см
(для среды нормальной концентрации) раствора сульфата полимиксина B (5.3.2) в каждую пробирку, содержащую основу среды (5.3.1).
5.3.4 Проверка эксплуатационных характеристик с целью гарантии качества питательной среды
Определение селективности и продуктивности - по ISO/TS 11133-1. Тестирование эффективности питательного триптон-соевого полимиксинового бульона (TSPB) проводится по ISO/TS 11133-2 и в соответствии с таблицей 1.
Таблица 1 - Результаты проверки эксплуатационных характеристик триптон-соевого полимиксинового бульона (TSPB)
Функция | Инкуби- | Контрольные штаммы | Метод контроля | Критерии | Характерные реакции |
Производи- | 48 ч при 30 °C | B. cereus ATCC 11778 или тот же штамм, зарегистрированный в других коллекциях | Полуколичест- |
| Характерные колонии на PEMBA или MYP (см. 5.4.5 или 5.5.6) |
Селектив- | 48 ч при 30 °C | E. coli ATCC 25922 или 8739 или тот же штамм, зарегистрированный в других коллекциях | Полуколичест- | Полное ингибирование | - |
5.4 Твердая селективная среда: агар с полимиксином, пируватом, яичным желтком, маннитом и бромтимоловым синим (PEMBA) по [2]
5.4.1 Основа питательной среды
5.4.1.1 Состав
Продукт ферментативного переваривания казеина, г | 1,0 |
D-Маннит, г | 10,0 |
Пируват натрия, г | 10,0 |
Сульфат магния ( | 0,1 |
Хлорид натрия, г | 2,0 |
Гидрофосфат динатрия ( | 2,5 |
Дигидрофосфат калия ( | 0,25 |
Бромтимоловый синий, г | 0,12 |
Агар, г | 9-18 |
Вода, см | 940 |
| |
5.4.1.2 Приготовление
Компоненты или готовую сухую основу питательной среды растворяют в воде, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании.
При необходимости корректируют pH так, чтобы после стерилизации он был равен 7,2±0,2 ед. pH при температуре 25 °C.
Стерилизуют в автоклаве (6.1) при температуре 121 °C в течение 15 мин.
5.4.2 Раствор сульфата полимиксина B
Готовят по 5.3.2.
5.4.3 Эмульсия яичного желтка
Используют свежие чистые куриные яйца с неповрежденной скорлупой. Яйца промывают в жидком моющем средстве, используя щетку. Ополаскивают в проточной воде, погружают в 70%-ный (по объему) раствор этилового спирта на 30 с и высушивают. Соблюдая стерильность, разбивают каждое яйцо и отделяют желток от белка путем многократного переноса желтка с одной половины яичной скорлупы на другую. Желтки помещают в стерильный мерный цилиндр и добавляют четыре объемные части стерильной воды. Соблюдая стерильность, переносят содержимое в стерильную колбу (6.7) и интенсивно перемешивают.
Смесь нагревают в течение 2 ч на водяной бане (6.4), при температуре 47 °C. Затем оставляют на 18-24 ч при температуре (3±2) °C для образования осадка.
Надосадочную эмульсию собирают в стерильных условиях.
Эмульсию можно хранить при температуре (3±2) °C не более 72 ч.
Обе твердые селективные среды, описываемые в настоящем стандарте, были первоначально приготовлены из 20%-ной эмульсии яичного желтка, как это изложено в [3]. Допускается использовать готовые эмульсии яичного желтка с различной концентрацией. Вместе с тем, необходимо следовать инструкциям производителя, особенно касающихся времени хранения. Следует принять меры для обеспечения того, чтобы данная эмульсия была пригодна для использования в питательных средах, описанных в 5.4 и 5.5.
5.4.4 Полная среда (агар PEMBA)
5.4.4.1 Состав
Основа питательной среды (5.4.1), см | 940 |
Раствор сульфата полимиксина B (5.4.2), см | 10 |
Эмульсия яичного желтка (5.4.3), см | 50 |
5.4.4.2 Приготовление
В основу питательной среды (5.4.1), расплавленную и охлажденную до температуры 47 °C, добавляют другие компоненты, раздельно при непрерывном перемешивании.
5.4.4.3 Приготовление чашек Петри с агаром
Переносят около 12,5 см аликвоты полной среды в чашки Петри (6.9) и дают им затвердеть.
Примечание - Ввиду технических причин [2], вместо обычного количества 15 см используют 12,5 см
.
Чашки хранят при температуре (3±2) °C до четырех дней.
Непосредственно перед использованием чашки с агаром подсушивают при снятых крышках и наклонив поверхность агара вниз, в сушильном шкафу, или термостате (6.2) при температуре от 25 °C до 50 °C, до тех пор, пока с поверхности агара не исчезнут капли влаги, но не более 20-30 мин.
5.4.5 Проверка качества питательной среды
Проверка качества питательной среды - по ISO/TS 11133-2. В таблице 2 представлены результаты проверки качества агара с полимиксином, пируватом, яичным желтком, маннитом и бромтимоловым синим.
Таблица 2
Функция | Инкуби- | Контрольные штаммы | Метод контроля | Критерии | Харак- |
Производи- | 18-48 ч при 37 °C | B. cereus ATCC 11778 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Значительный рост | Колонии бирюзового цвета с ореолом осадка |
Селектив- | 18-48 ч при 37 °C | Е. coli ATCC 25922 или 8739 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Полное ингибирование | - |
5.5 Твердая селективная среда: агар с маннитом, яичным желтком и полимиксином (MYP) по [4]
5.5.1 Основа питательной среды
5.5.1.1 Состав
Мясной экстракт, г | 1,0 |
Продукт ферментативного переваривания казеина, г | 10,0 |
D-Маннитол, г | 10,0 |
Хлорид натрия ( | 10,0 |
Феноловый красный, г | 0,025 |
Агар, г | 9-18 |
Вода, см | 900 |
| |
5.5.1.2 Приготовление
Компоненты или готовую сухую основу питательной среды растворяют в воде, нагревают на слабом огне до кипения и кипятят 2-3 мин при постоянном перемешивании.
При необходимости корректируют pH так, чтобы после стерилизации он был равен 7,2±0,2 ед. pH при температуре 25 °C.
Разливают среду по 90 см в колбы (6.7) вместимостью 250 см
.
Стерилизуют в автоклаве (6.1) при температуре 121 °C в течение 15 мин.
5.5.2 Раствор полимиксина сульфата B
Готовят по 5.3.2.
5.5.3 Эмульсия яичного желтка
Готовят по 5.4.3.
5.5.4 Полная среда (агар MYP)
5.5.4.1 Состав
Основа питательной среды (5.5.1), см | 90,0 |
Раствор полимиксина сульфата B (5.3.2), см | 1,0 |
Эмульсия яичного желтка (5.5.3), см | 10,0 |
5.5.4.2 Приготовление агара MYP
В основу питательной среды (5.5.1), расплавленную и охлажденную до температуры 47 °C, добавляют другие компоненты, раздельно при непрерывном перемешивании.
5.5.5 Приготовление чашек Петри с агаром MYP
Готовый агар MYP (5.5.4) разливают по 15-20 см в стерильные чашки Петри (6.9) и дают затвердеть.
Чашки можно хранить при температуре (3±2) °С до четырех дней.
Непосредственно перед использованием чашки с агаром подсушивают при снятых крышках и наклонив поверхность агара вниз, в сушильном шкафу, или термостате (6.2) при температуре от 25 °C до 50 °C, до тех пор пока с поверхности агара не исчезнут капли влаги, но не более 20-30 мин.
5.5.6 Проверка качества питательной среды - по ISO/TS 11133-2 и в соответствии с таблицей 3.
Таблица 3 - Результаты проверки эксплуатационных характеристик агара с маннитолом, яичным желтком и полимиксином (MYP)
Функция | Инкуби- | Контрольные штаммы | Метод контроля | Критерии | Харак- |
Производитель- | 24-48 ч при 30 °С | B. cereus ATCC 11778 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Значительный рост | Колонии розового цвета с ореолом осадка |
Селективность | 48 ч при 30 °С | E. coli ATCC 25922 или 8739 или тот же штамм, зарегистрированный в других коллекциях | Качественный | Полное ингибирование | - |
5.6 Окрашивающие растворы для микроскопической идентификации
5.6.1 Раствор оксалата малахитового зеленого
5.6.1.1 Состав
Оксалат малахитового зеленого, г | 5,0 |
Вода, см | 100 |
5.6.1.2 Приготовление
Оксалат малахитового зеленого растворяют в воде.
5.6.2 Раствор Судана черного B
5.6.2.1 Состав
Судан черный B, г | 0,3 |
Этиловый спирт, 70%-ный (по объему), см | 100 |
5.6.2.2 Приготовление раствора Судана черного B
Судан черный B растворяют в этиловом спирте.
5.6.3 Ксилол
5.6.4 Раствор сафранина
5.6.4.1 Состав
Сафранин, г | 0,5 |
Вода, см | 100 |
5.6.4.2 Приготовление раствора сафранина
Сафранин растворяют в дистиллированной воде.
5.7 Агар с бараньей кровью
5.7.1 Основа питательной среды
5.7.1.1 Состав
Продукт ферментативного переваривания казеина, г | 15 |
Продукт ферментативного переваривания сои, г | 5 |
Хлорид натрия ( | 5 |
Агар, г | 9-18 |
Вода, см | 1000 |
| |
5.7.1.2 Приготовление агара с бараньей кровью
В основу питательной среды (5.7.1) добавляют другие компоненты раздельно при непрерывном перемешивании. Компоненты или полную сухую среду растворяют в воде и доводят до кипения.
При необходимости корректируют pH так, чтобы после стерилизации он был равен 7,3 ±0,2 ед. pH при температуре 25 °C.
Распределяют в колбы (6.7) и стерилизуют в автоклаве (6.1) при температуре 121 °C в течение 15 мин.
5.7.2 Баранья кровь без фибрина
5.7.3 Полная среда
5.7.3.1 Состав
Основа питательной среды (5.7.1), см | 100 |
Баранья кровь без фибрина (5.7.2), см | 5-7 |
5.7.3.2 Приготовление
В основу питательной среды (5.7.1), расплавленную и охлажденную до температуры 47 °C, добавляют баранью кровь без фибрина (5.7.2) и перемешивают.
Готовую среду хорошо перемешивают и разливают в чашки Петри (6.9) в количестве по 15 см и дают затвердеть.
6 Оборудование и стеклянная посуда
Применяют микробиологическое лабораторное оборудование по ISO 7218.
6.1 Оборудование для сухой стерилизации (сушильный шкаф) или влажной стерилизации (автоклав).
6.2 Шкаф сушильный или термостат, проветриваемый конвекционными потоками, для сушки агарового слоя, работающий при температуре в диапазоне от 25 °C до 50 °C.
6.3 Термостат, работающий при температуре (30±1) °C или (37±1) °C.
6.4 Баня водяная, работающая при температуре (47±2) °C и приблизительно 80 °C.
6.5 Петли, изготовленные из платиново-иридиевой или никеле-хромовой проволоки или платмассы, с размером диаметра приблизительно 3 мм.
6.6 pH-метр, с точностью ±0,1 единицы pH при температуре 25 °C.
6.7 Пробирки достаточных размеров с объемом 20 см (например, 16 мм
160 мм), и колбы для культур для стерилизации и сохранности питательной среды.
6.8 Мешалка вихревая.
6.9 Чашки Петри, изготовленные из стекла или пластмассы, с размером диаметра от 90-100 мм или 140 мм, при необходимости.
6.10 Пипетки градуированные, номинальной вместимостью 10 см или 1 см
, соответственно, градуированные на 0,5 или 0,1 см
.
6.11 Микроскоп с объективом для масляно-иммерсионной микроскопии.
6.12 Стекла предметные для микроскопа с размерами 76 мм 26 мм.
6.13 Бумага мелкопористая фильтровальная.
6.14 Колбы соответствующей вместимости.
7 Отбор проб
В лабораторию необходимо доставить представительную пробу. Проба не должна быть повреждена или модифицирована при транспортировании или хранении.
Отбор проб не является частью метода, устанавливаемого в настоящем стандарте. В случае отсутствия конкретного стандарта на отбор проб продукта рекомендуется, чтобы заинтересованные стороны достигли согласия по процедуре отбора проб.
8 Приготовление анализируемой пробы
Анализируемую пробу приготовляют в соответствии с ISO 6887 или ISO 8261 или конкретным стандартом, распространяющимся на конкретный продукт. Допускается в случае отсутствия конкретного стандарта, чтобы заинтересованные стороны достигли согласия по данному вопросу.
9 Методика проведения анализа
9.1 Метод подсчета
9.1.1 Анализируемая проба, исходная суспензия и порядок разбавления разведения - по ISO 6887, в зависимости от конкретного продукта, или ISO 8261.
Примечание - Для подсчета только презумптивных бактерий Bacillus cereus, исходное разбавление может быть нагрето на водяной бане (6.4) при температуре 80 °С в течение 10 мин.
9.1.2 Посев и инкубирование
Проводят посев на три пробирки, каждая из которых содержит среду двойной концентрации [5.3.1.1 a)], в каждую добавляют по 10 см исходного разбавления (исходная суспензия) (равной 1 г пробы в каждой пробирке) и перемешивают пробы со средой при помощи перемешивающего устройства для пробирок (6.8).
Проводят посев на три пробирки, каждая из которых содержит среду нормальной концентрации [5.3.1.1 b)], добавляют 1 см в каждую пробирку исходного разбавления (исходная суспензия) (равной 0,1 г пробы в каждой пробирке) или последующих разбавлений (равных 0,01 г, 0,001 г и т.д. пробы в каждой пробирке) и перемешивают пробы со средой при помощи перемешивающего устройства для пробирок (6.8).
Инкубируют пробирки в термостате (6.3) при температуре 30 °С в течение (48±4) ч.
9.1.3 Выделение чистой культуры
После тщательного перемешивания с использованием перемешивающего устройства для пробирок (6.8) делают посев культуры инокуляционной петлей из каждой пробирки на поверхность агара с полимиксином, пируватом, яичным желтком, маннитом и бромотимольным синим (PEMBA) (5.4) или агара с маннитом, яичным желтком и полимиксином (MYP) (5.5).
Инкубируют чашки Петри с питательной средой крышками вниз при температуре 37 °С (PEMBA) или 30 °С (MYP) 18-24 ч. Если колонии нельзя четко определить, продолжают выращивание в термостатах дополнительно в течение 24 ч. При использовании агара PEMBA дальнейшее инкубирование может быть продолжено при комнатной температуре.
9.1.4 Отбор чашек Петри
9.1.4.1 Общие положения
После завершения инкубирования чашки Петри анализируют на наличие типичных или атипичных колоний.
9.1.4.2 Типичные колонии
На PEMBA типичные колонии презумптивных бактерий Bacillus cereus имеют размеры от 2 мм до 5 мм, неровные края с зазубринами и разветвлениями на гладкой стеклянной поверхности, цвет от бирюзового до голубого (допускается беловато-серый цвет в центре колонии и синий фон) и ореол осадка (реакция на яичный желток) шириной до 5 мм.
На MYP типичные колонии имеют размеры от 2 мм до 5 мм и имеют зазубрины. Они обладают розовой окраской, темно-красным фоном и окружены ореолом осадка (реакция на яичный желток) шириной до 5 мм.
9.1.4.3 Атипичные колонии
Если на чашках Петри имеется неоднородный рост бактерий, которые ферментируют маннит, характерная окраска колоний и фон могут быть ослаблены или стать невидимыми.
Некоторые штаммы презумптивных бактерий Bacillus cereus обладают слабой реакцией на яичный желток или не обладают никакой реакцией. В подобных случаях и в других сомнительных случаях такие колонии подлежат дополнительной проверке.
9.1.5 Подтверждение
9.1.5.1 Общие положения
Типичные колонии (9.1.4.2) и атипичные колонии (9.1.4.3) на PEMBA или MYP должны быть подтверждены посредством испытания с помощью гемолиза на агаре с бараньей кровью. В качестве альтернативы типичные колонии на среде PEMBA или среде MYP проверяют с использованием микроскопа.
9.1.5.2 Отбор и очистка колоний для подтверждения
Отбирают по три колонии с каждой чашки Петри, выбранные по 9.1.4. Если на поверхности агара находится менее трех колоний, отбирают все имеющиеся колонии. Данные колонии проверяются по 9.1.5.3 или 9.1.5.4.
Если на чашках Петри получен сплошной рост микроорганизмов по линии пересева, то отбирают посевной материал из трех точек этого пересева и проводят посев на другие чашки Петри, содержащие твердую селективную среду (5.4 или 5.5). Эффективней предварительно перед посевом отобранный материал развести. Если слои переполнены колониями и нет возможности отобрать четко изолированные колонии, отбирают материал колоний из трех точек и производят посев на слоях, содержащих твердую селективную среду (5.4 или 5.5). Инкубируют в термостате (6.3) при температуре 37 °C (PEMBA) или при 30 °C (MYP) от 18 до 24 ч. Отбирают с каждого слоя по меньшей мере одну четко изолированную колонию. Подтверждают эти колонии, как это указано в 9.1.5.3 или 9.1.5.4.
9.1.5.3 Подтверждение тестом на гемолитическую активность на агаре с бараньей кровью (MYP или PEMBA)
Проводят посев отобранных (9.1.4.2 или 9.1.4.3) с MYP или PEMBA колоний на поверхность агара с бараньей кровью (5.7) таким образом, чтобы получить рост изолированных колоний и дать возможность четко разделенным колониям развиваться.
Инкубируют при температуре 30 °C в течение 24 ч и фиксируют реакцию гемолиза.
Каждая колония, окруженная зоной просветления, рассматривается как гемолиз-положительная.
9.1.5.4 Подтверждение с использованием микроскопа (PEMBA)
9.1.5.4.1 Окрашивание
Переносят часть материала из центра колонии в случае, если возраст культуры составляет 24 ч, или с периферии, если культуры более старые; переносят, используя петлю для посева (6.5), на обезжиренное предметное стекло (6.12) и растирают в малой капле воды. Высушивают на воздухе и фиксируют путем нагрева. Затем окрашивают споры над кипящей водой раствором малахитового зеленого (5.6.1) или нагревают в течение одной минуты до появления паров жидкости. Через две минуты смывают избыток красителя водой, высушивают предметное стекло и покрывают его слоем раствора Судана черного B (5.6.2) для окрашивания внутриклеточного жира. Процедуру проводят 15 мин, затем промывают ксилолом (5.6.3), высушивают при помощи фильтровальной бумаги (6.13) и окрашивают снова раствором сафранина (5.6.4) для окрашивания спорангий и вегетативных клеток спор. Через 20 с сливают избыток красителя, промывают водой и сушат на воздухе.
9.1.5.4.2 Исследование с помощью микроскопа
Окрашенный препарат на предметном стекле. Предметное стекло исследуют под микроскопом (6.11), используя иммерсионное масло. Клетки презумптивных бактерий Bacillus cereus в форме кирпичиков располагаются цепочками и имеют длину от 4 до 5 мкм, ширину - от 1 до 1,5 мкм и содержат довольно большие количества внутриклеточного жира, который окрашен в черный цвет. Окрашенные в зеленый цвет споры могут быть в центре или почти в конце, но они никогда не раздувают спорангии, окрашенные в красный цвет.
9.2 Метод определения
9.2.1 Анализируемые пробы и исходную суспензию готовят по ISO 6887 в зависимости от конкретного продукта или ISO 8261.
9.2.2 Посев и инкубирование
1 см исходной суспензии добавляют к 9 см
TSPB (5.3) нормальной концентрации (т.е. 0,1 г или 0,1 см
пробы) или 10 см
исходной суспензии к 10 см
TSPB (5.3) двойной концентрации (т.е. 1 г или 1 см
пробы). Для больших объемов анализируемые пробы готовят исходную суспензию добавлением
см
или
г к 9
см
разбавителя (см. соответствующую часть ISO 6887 или ISO 8261), затем добавляют все количество исходной суспензии к 90
см
TSPB (5.3) нормальной концентрации (например, добавляют 5 см
или 5 г пробы к 45 см
разбавителя, и затем добавляют весь объем этой исходной суспензии к 450 см
TSPB нормальной концентрации).
Инокулированную пробирку (6.7) или колбу (6.14) инкубируют в термостате (6.3) при температуре 30 °C в течение (48±4) ч.
9.2.3 Чистая культура
После тщательного перемешивания проводят посев культуры инокуляционной петлей из пробирки или колбы на поверхность агара PEMBA (5.4) или агара MYP (5.5). Далее поступают, как это указано в 9.1.3.
9.2.4 Отбор чашек Петри
Отбор чашек Петри - по 9.1.4.
9.2.5 Подтверждение
Подтверждение - по 9.1.5.
10 Обработка результатов
10.1 Метод подсчета для определения наиболее вероятного числа (НВЧ)
Для каждого посева жидкой селективной обогатительной среды (9.1.2) фиксируют количество пробирок, в которых было подтверждено (9.1.5) присутствие презумптивных бактерий Bacillus cereus. Обозначают данные пробирки как положительные.
Выражение результатов определения наиболее вероятного числа (НВЧ) - по ISO 7218.
10.2 Метод определения
В соответствии с обработкой результатов, фиксируют "присутствие" или "отсутствие" презумптивных Bacillus cereus в анализируемой пробе, указывая массу в граммах или объем в см.
Приложение A
(обязательное)
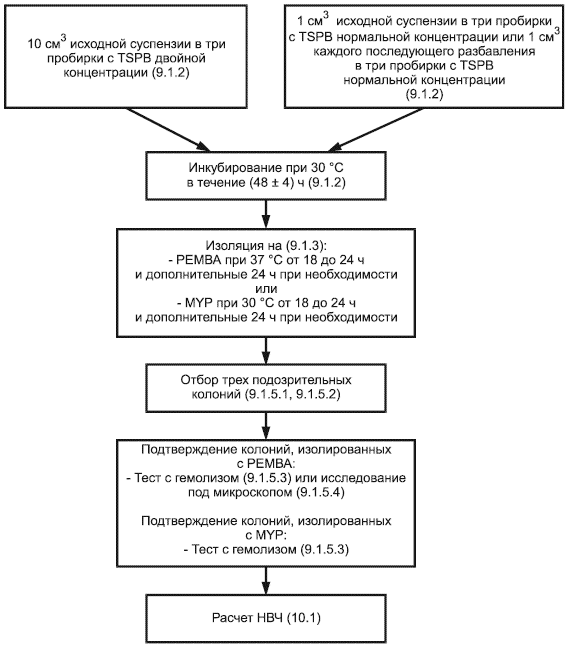
Диаграмма процедуры подсчета
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов ссылочным межгосударственным стандартам
Таблица ДА.1
Обозначение и наименование ссылочного международного стандарта | Степень соответ- | Обозначение и наименование межгосударственного стандарта |
ISO 6887-1:1999 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений | - | * |
ISO 6887-2:2003 Микробиология пищевых продуктов и кормов для животных. Подготовка проб, исходной суспензии и десятикратных разведений для микробиологических исследований. Часть 2. Специальные правила подготовки мяса и мясных продуктов | - | * |
ISO 6887-3:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 3. Специальные правила для приготовления рыбы и рыбных продуктов | - | * |
ISO 6887-4:2003 Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 4. Специальные правила для приготовления продуктов, кроме молока и молочных продуктов, мяса и мясных продуктов и рыбы и рыбопродуктов | - | * |
ISO 7218:2007 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям | IDT | ГОСТ ISO 7218-2011 Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям |
ISO 8261:2001 | - | * |
ISO 11133-1:2000 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культурных сред в лаборатории | IDT | ГОСТ ISO 11133-1-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 1. Общие руководящие указания по обеспечению качества приготовления культурных сред в лаборатории |
ISO 11133-2:2003 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред | IDT | ГОСТ ISO 11133-2-2011 Микробиология пищевых продуктов и кормов для животных. Руководящие указания по приготовлению и производству культуральных сред. Часть 2. Практические руководящие указания по эксплуатационным испытаниям культуральных сред |
* Соответствующий межгосударственный стандарт отсутствует. До его принятия рекомендуется использовать перевод на русский язык данного международного стандарта или гармонизированный с ним национальный (государственный) стандарт страны, на территории которой применяется настоящий стандарт. Информация о наличии перевода данного международного стандарта в национальном фонде стандартов или в ином месте, а также информация о действии на территории страны соответствующего национального (государственного) стандарта может быть приведена в национальных информационных данных, дополняющих настоящий стандарт. | ||
Библиография
[1] | Lancette, G.A. и Harmon S.M. Подсчет и подтверждение Bacillus cereus в пищевых продуктах: совместное исследование. J. Assoc. Off. Anal. Chem., 63, 1980, с.581-586 |
[2] | Holbrook R. и Anderson J.M. Усовершенствованная селективная и диагностическая среда для изоляции и подсчета Bacillus cereus в пищевых продуктах. Can. J. Microbiol. 26, 1980, с.753-759 |
[3] | Billing E. и Luckhurst E.R. Упрощенный метод приготовления сред с яичным желтком. J. Appl. Bact., 20, 1957, с.90 |
[4] | Mossel D.A.A., Koopman M.J. и Jongerius E. Подсчет Bacillus cereus в пищевых продуктах. Appl. Microbiol., 15, 1967, с.650-653 |
Редакция документа с учетом
изменений и дополнений подготовлена

