ГОСТ ISO/TS 22964-2013
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
МОЛОКО И МОЛОЧНЫЕ ПРОДУКТЫ
Определение содержания Enterobacter sakazakii
Milk and milk products. Detection of Enterobacter sakazakii
МКС 07.100.30
67.100.01
Дата введения 2017-07-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Республиканским унитарным предприятием "Белорусский государственный институт метрологии" (БелГИМ) на основе собственного перевода на русский язык англоязычной версии международного документа, указанного в пункте 5
2 ВНЕСЕН Государственным комитетом по стандартизации Республики Беларусь
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 14 ноября 2013 г. N 44)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Молдова | MD | Молдова-Стандарт |
Россия | RU | Росстандарт |
Таджикистан | TJ | Таджикстандарт |
Узбекистан | UZ | Узстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 23 сентября 2016 г. N 1211-ст межгосударственный стандарт ГОСТ ISO/TS 22964-2013 введен в действие в качестве национального стандарта Российской Федерации с 1 июля 2017 г.
5 Настоящий стандарт идентичен международному документу ISO/TS 22964:2006/IDF/ RM 210:2006* "Молоко и молочные продукты. Определение содержания Enterobacter sakazakii" ("Milk and milk products - Detection of Enterobacter sakazakii", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Международный документ ISO/TS 22964:2006/IDF/RM 210:2006 разработан подкомитетом SC 5 "Молоко и молочные продукты" Технического комитета по стандартизации ISO/TC 34 "Пищевые продукты" Международной организации по стандартизации (ISO) и Международной молочной федерацией (IDF).
В стандарт внесены следующие редакционные изменения: единица измерения миллилитр (мл) заменена на кубический сантиметр (см); единица измерения литр (л) заменена на кубический дециметр (дм
); единица измерения микролитр (мкл) заменена на кубический миллиметр (мм
); подраздел 5.1 дополнен примечанием; пункт 6.5 дополнен значениями температуры (37±1)°С и (44±0,5)°С, так как в методе применяются термостаты, способные поддерживать данные температуры; в таблице 1 (графа 3, абзацы 3 и 5) знак "±" заменен на знак "
" с целью его однозначного толкования; в приложении А в "Блок-схеме метода" при инкубации 25°С интервал времени "(48±4) ч" приведен в соответствие с 9.5.1.2.
В разделе "Нормативные ссылки" и тексте стандарта ссылки на международные стандарты актуализированы.
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Декабрь 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
1 Область применения
Настоящий стандарт устанавливает метод определения бактерий Enterobacter sakazakii в сухом молоке и сухой смеси для детского питания.
Настоящий метод может применяться также к пробам окружающей среды, отобранным изготовителем сухого молока или смесей для детского питания.
2 Нормативные ссылки
Для применения настоящего стандарта необходимы следующие нормативные ссылочные стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных ссылок применяют последнее издание ссылочного стандарта (включая все его изменения).
ISO 6887-5:2010 Microbiology of food and animal feeding stuffs - Preparation of test samples, initial suspension and decimal dilutions for microbiological examination - Part 5: Specific rules for the preparation of milk and milk products (Микробиология пищевых продуктов и кормов для животных. Подготовка проб для анализа, исходной суспензии и десятичных разведений для микробиологического исследования. Часть 5. Специальные правила подготовки молока и молочных продуктов)
__________________
Действует взамен ISO 8261:2001/IDF 122:2001.
ISO 7218:2007 Microbiology of food and animal feeding stuffs - General requirements and guidance for microbiological examinations (Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям)
3 Термины и определения
В настоящем стандарте применены следующие термины с соответствующими определениями:
3.1 презумптивные бактерии Enterobacter sakazakii (presumptive Enterobacter sakazakii): Микроорганизмы, которые образуют типичные колонии на хромогенном селективном агаре при проведении испытаний в соответствии с настоящим стандартом.
3.2 Enterobacter sakazakii (Enterobacter sakazakii): Микроорганизмы, которые образуют типичные колонии на хромогенном селективном агаре, а также образуют желтые колонии на триптон-соевом агаре и обладают указанными биохимическими свойствами при проведении испытаний в соответствии с настоящим стандартом.
4 Сущность метода
4.1 Предварительное обогащение в неселективной жидкой питательной среде
Питательную среду для предварительного обогащения инокулируют пробой и инкубируют при (37±1)°С в течение 16-20 ч.
4.2 Обогащение в селективной жидкой питательной среде
Питательную среду для селективного обогащения инокулируют суспензией, полученной согласно 4.1, и инкубируют при (44±0,5)°С в течение 22-26 ч.
4.3 Выделение и идентификация
На хромогенный агар делают высев из обогащения, полученного согласно 4.2, и инкубируют при (44±1)°С в течение 22-26 ч.
4.4 Подтверждение
Типичные изолированные колонии с поверхности хромогенного агара и колонии, вырабатывающие желтый пигмент на триптон-соевом агаре, подвергают биохимическому исследованию.
5 Питательные среды и реактивы
5.1 Общие положения
Используют реактивы признанной аналитической чистоты, если не указано иное, и дистиллированную или деминерализованную воду или воду эквивалентной чистоты. Вода должна быть очищена от веществ, которые могут подавлять рост микроорганизмов в условиях испытаний, описанных в настоящем стандарте. Необходимая информация приведена также в [2] и ISO 6887-5.
В целях повышения воспроизводимости результатов рекомендуется при приготовлении питательной среды использовать дегидратированные основные компоненты среды или полностью дегидратированную питательную среду. В этом случае следует строго следовать инструкциям изготовителей. Информация приведена также в ISO 6887-1.
Значения рН питательных сред приведены для температуры 25°С. При необходимости корректировка проводится путем добавления либо раствора соляной кислоты [с(HCL) =1 моль/дм], либо раствора гидроокиси натрия [с(NaOH) =1 моль/дм
].
Если не предусматривается немедленное использование, то приготовленные питательные среды и реактивы хранят в условиях, которые исключают возможность любого изменения их состава, в недоступном для света месте при температуре от 0°С до 5°С не более одного месяца, если не указано иное.
Примечание - Допускается применение готовых дегидратированных сред, если их состав идентичен составу сред, приведенных в настоящем стандарте.
5.2 Питательные среды
5.2.1 Забуференная пептонная вода (BPW)
5.2.1.1 Состав
Ферментативный гидролизат казеина, г | 10,0 |
Хлористый натрий (NaCI), г | 5,0 |
Натрий фосфорнокислый двузамещенный 12-водный ( | 9,0 |
Калий фосфорнокислый однозамещенный ( | 1,5 |
Вода, см | 1000 |
5.2.1.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости.
Регулируют рН до (7,0±0,2) ед. рН при температуре 25°С. Разливают забуференную пептонную воду (BPW) по колбам или пробиркам согласно аналитическим потребностям. Затем стерилизуют при температуре 121°С в течение 15 мин.
5.2.2 Модифицированный лаурил сульфат триптозный бульон (mLST)/ванкомициновая среда
5.2.2.1 Модифицированный лаурил сульфат триптозный бульон (mLST)
5.2.2.1.1 Состав
Хлористый натрий (NaCI), г | 34,0 |
Ферментативный гидролизат животных и растительных тканей, г | 20,0 |
Лактоза ( | 5,0 |
Калий фосфорнокислый однозамещенный ( | 2,75 |
Калий фосфорнокислый двузамещенный ( | 2,75 |
Лаурил сульфат натрия ( | 0,1 |
Вода, см | 1000 |
5.2.2.1.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости.
Регулируют рН до (6,8±0,2) ед. рН при температуре 25°С. Разливают по 10 см среды mLST в пробирки размером 18х160 мм.
Пробирки со средой стерилизуют при температуре 121°С в течение 15 мин.
5.2.2.2 Раствор ванкомицина
5.2.2.2.1 Состав
Ванкомицин, мг | 10 |
Вода, см | 10 |
5.2.2.2.2 Приготовление
Ванкомицин растворяют в дистиллированной воде. Перемешивают и стерилизуют посредством фильтрации.
Раствор ванкомицина может храниться при температуре от 0°С до 5°С в течение 15 дней.
5.2.2.3 mLST/ванкомициновая среда
Для получения конечной концентрации ванкомицина 10 мкг на кубический сантиметр mLST следует добавить 0,1 см раствора ванкомицина (см. 5.2.2.2.2) к 10 см
раствора mLST (см. 5.2.2.1.2).
Готовая mLST/ванкомициновая среда может храниться при температуре от 0°С до 5°С в течение одного дня.
5.2.3 Селективный агар для Enterobacter sakazakii (ESIA™)
_____________
__
ESIA™ - торговое название материала, поставляемого лабораторией AES Laboratoire, Maryse Bastie, Ker Lann, F-35172 Bruz (Франция). Эта информация приводится для удобства пользователей настоящего стандарта. Возможно применение идентичного продукта, если может быть подтверждено, что его использование дает такие же результаты.
5.2.3.1 Состав
Панкреатический гидролизат казеина, г | 7,0 |
Дрожжевой экстракт, г | 3,0 |
Хлористый натрий (NaCI), г | 5,0 |
Дезоксихолат натрия, г | 0,6 |
5-бромо-4-хлоро-3-индолил- | 0,15 |
Кристаллический фиолетовый, мг | 2 |
Агар, г | 12,0-18,0 |
Вода, см | 1000 |
| |
5.2.3.2 Приготовление
Все компоненты растворяют в воде при помощи кипячения. Регулируют рН до (7,0±0,2) ед. рН при температуре 25°С. Стерилизуют при температуре 121°С в течение 15 мин.
Охлаждают до температуры 44°С-47°С. В пустые стерильные чаши Петри наливают около 15 см среды ESIA™ и оставляют до полного застывания на холодной ровной поверхности.
Среда может храниться при температуре от 0°С до 5°С до 14 дней.
5.2.4 Триптон-соевый агар (TSA)
5.2.4.1 Состав
Ферментативный гидролизат казеина, г | 15,0 |
Ферментативный гидролизат сои, г | 5,0 |
Хлористый натрий (NaCI), г | 5,0 |
Агар, г | 9,0-18,0 |
Вода, см | 1000 |
| |
5.2.4.2 Приготовление
Все компоненты растворяют в воде при помощи кипячения. Регулируют рН до (7,3±0,2) ед. рН при температуре 25°С. Стерилизуют при температуре 121°С в течение 15 мин. Охлаждают до температуры 44°С-47°С. В пустые стерильные чаши Петри наливают около 15 см TSA и оставляют до полного застывания на холодной ровной поверхности.
5.2.5 Среды и реактивы для биохимического подтверждения
5.2.5.1 Реактив для определения оксидазы
5.2.5.1.1 Состав
N,N,N',N'-тетраметил- | 1,0 |
Вода, см | 100 |
5.2.5.1.2 Приготовление
Компонент растворяют в воде непосредственно перед использованием.
5.2.5.2 Декарбоксилированная среда на основе L-лизина
5.2.5.2.1 Состав
L-лизин моногидрохлорид ( | 5,0 |
Дрожжевой экстракт, г | 3,0 |
Глюкоза ( | 1,0 |
Бромкрезоловый пурпуровый, г | 0,015 |
Вода, см | 1000 |
5.2.5.2.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости. Регулируют рН так, чтобы после стерилизации он составлял (6,8±0,2) ед. рН при температуре 25°С. Разливают по 5 см декарбоксилированной среды на основе L-лизина в пробирки размером 18х160 мм.
Пробирки со средой стерилизуют при температуре 121°С в течение 15 мин.
5.2.5.3 Декарбоксилированная среда на основе L-орнитина
5.2.5.3.1 Состав
L-орнитин моногидрохлорид ( | 5,0 |
Дрожжевой экстракт, г | 3,0 |
Глюкоза ( | 1,0 |
Бромкрезоловый пурпуровый, г | 0,015 |
Вода, см | 1000 |
5.2.5.3.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости. Регулируют рН так, чтобы после стерилизации он составлял (6,8±0,2) ед. рН при температуре 25°С.
Разливают по 5 см декарбоксилированной среды на основе L-орнитина в пробирки размером 18х160 мм.
Пробирки со средой стерилизуют при температуре 121°С в течение 15 мин.
5.2.5.4 Дегидрированная среда на основе L-аргинина
5.2.5.4.1 Состав
L-аргинин моногидрохлорид ( | 5,0 |
Дрожжевой экстракт, г | 3,0 |
Глюкоза ( | 1,0 |
Бромкрезоловый пурпуровый, г | 0,015 |
Вода, см | 1000 |
5.2.5.4.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости. Регулируют рН так, чтобы после стерилизации он составлял (6,8±0,2) ед. рН при температуре 25°С.
Разливают по 5 см дегидрированной среды на основе L-аргинина в пробирки размером 18х160 мм.
Пробирки со средой стерилизуют при температуре 121°С в течение 15 мин.
5.2.5.5 Среда для определения ферментации углеводов (пептонная вода с феноловым красным, D-сорбитом, L-рамнозой, D-сахарозой, D-мелибиозой и амигдалином)
5.2.5.5.1 Основная среда
5.2.5.5.1.1 Состав
Ферментативный гидролизат казеина, г | 10 |
Хлористый натрий (NaCI), г | 5 |
Феноловый красный, г | 0,02 |
Вода, см | 1000 |
5.2.5.5.1.2 Приготовление
Все компоненты растворяют в воде, нагревая при необходимости. Регулируют рН так, чтобы после стерилизации он составлял (6,8±0,2) ед. рН при температуре 25°С.
Разливают основную среду в колбы подходящей вместимости.
Стерилизуют при температуре 121°С в течение 15 мин.
5.2.5.5.2 Растворы углеводов (D-сорбит, L-рамноза, D-сахароза, D-мелибиоза или амигдалин), 80 мг/см
5.2.5.5.2.1 Состав
Углевод, г | 8 |
Вода, см | 100 |
5.2.5.5.2.2 Приготовление
Растворяют в воде отдельно друг от друга каждый из четырех компонентов с целью получения четырех растворов углеводов. Все полученные растворы стерилизуют посредством фильтрации.
5.2.5.5.3 Полноценные среды для определения ферментации углеводов
5.2.5.5.3.1 Состав
Основная среда (5.2.5.5.1), см | 875 |
Раствор углевода (5.2.5.5.2), см | 125 |
5.2.5.5.3.2 Приготовление
Каждый приготовленный углеводный раствор (см. 5.2.5.5.2) добавляют в асептических условиях к основной среде (см. 5.2.5.5.1.) и перемешивают. В асептических условиях разливают по 10 см полноценной среды для ферментации углеводов в пробирки размерами 18х160 мм.
5.2.5.6 Цитратный агар Симмонса
5.2.5.6.1 Состав
Цитрат натрия ( | 2,0 |
Хлорид натрия (NaCI), г | 5,0 |
Калий фосфорнокислый двузамещенный ( | 1,0 |
Аммоний фосфорнокислый однозамещенный ( | 1,0 |
Сульфат магния однозамещенный ( | 0,2 |
Бромтимоловый синий, г | 0,08 |
Агар, г | 8,0-18,0 |
Вода, см | 1000 |
| |
5.2.5.6.2 Приготовление
Все компоненты или дегидратированную полноценную среду растворяют в воде путем кипячения. Регулируют рН так, чтобы после стерилизации он составлял (6,8±0,2) ед. рН при температуре 25°С.
Разливают по 10 см цитратного агара Симмонса в пробирки (см. 6.7) размером 18х160 мм.
Пробирки стерилизуют при температуре 121°С в течение 15 мин.
Пробирки устанавливают в наклонном положении таким образом, чтобы столбик среды составлял 2,5 см в глубину.
6 Оборудование и лабораторная посуда
Одноразовая лабораторная посуда является приемлемой альтернативой многоразовой лабораторной посуде при условии наличия на нее технических условий.
Применяют следующее стандартное лабораторное оборудование для микробиологических исследований:
6.1 Оборудование для суховоздушной (сухожаровой шкаф) или паровой (автоклав) стерилизации
См. ISO 7218.
6.2 Пипетки с полным сливом номинальной вместимостью 1 см.
6.3 Водяная баня, способная поддерживать температуру (44±0,5)°С.
6.4 Чашки Петри из стекла или пластика диаметром 90-100 мм.
6.5 Термостаты, способные поддерживать температуру (25±1)°С, (30±1)°С, (37±1)°С, (44±0,5)°С и (44±1)°С соответственно.
6.6 Петля из платины/иридия или никеля/хрома диаметром около 3 мм или одноразовые петли.
6.7 Пробирки диаметром 18 мм и длиной 160 мм (снабженные пробками или крышками с резьбой).
6.8 рН-метр с точностью измерения до 0,1 единицы рН при температуре (25±1)°С.
7 Отбор проб
Важно, чтобы проба, полученная лабораторией, была действительно представительной, не была повреждена или изменена в ходе транспортирования или хранения.
Отбор проб не описан в настоящем стандарте. Рекомендации по методу отбора проб даны в ISO 707/IDF 050.
8 Приготовление пробы для испытаний
Пробы для испытаний готовят в соответствии с ISO 6887-5.
9 Проведение испытания
9.1 Навеска
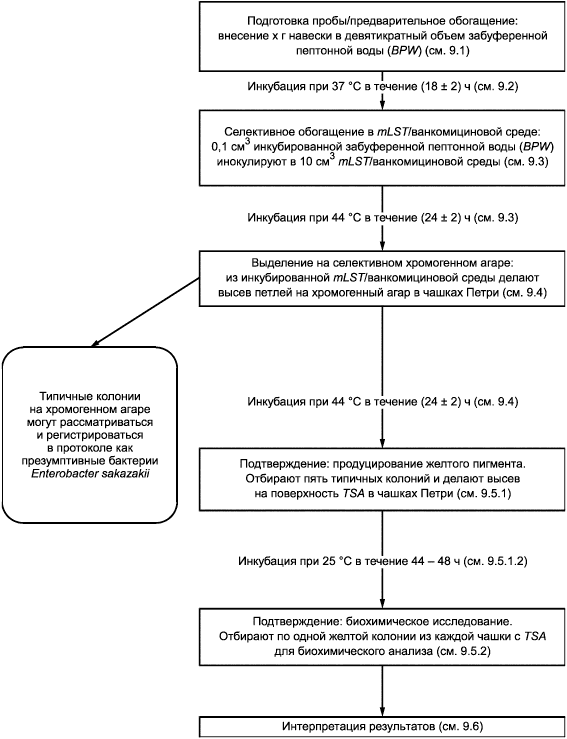
Для приготовления первичной суспензии к г пробы для испытаний (см. раздел 8) добавляют девятикратный объем среды для предварительного обогащения (см. 5.2) согласно пропорции, установленной в данном методе.
Дают сухой пробе раствориться в жидкости без перемешивания. Если спустя 30 мин проба полностью не растворилась, аккуратно перемешивают ее с питательной средой.
9.2 Предварительное обогащение
Инокулированную среду для предварительного обогащения (см. 9.1) инкубируют при температуре (37±1)°С в течение (18±2) ч.
9.3 Селективное обогащение
После инкубации инокулированной среды для предварительного обогащения переносят 0,1 см полученной культуры (см. 9.2) в 10 см
mLST/ванкомициновой питательной среды (см. 5.2.2.3). Инкубируют при температуре (44±0,5)°С в течение (24±2) ч.
Рекомендуется использовать водяную баню (см. 6.3) или термостат с принудительной вентиляцией, чтобы гарантировать, что максимальный температурный порог в 44,5°С не будет превышен.
9.4 Выделение презумптивных колоний Enterobacter sakazakii
Из посевов после инкубации инокулированной mLST/ванкомициновой питательной среды (см. 9.3) с помощью петли делают пересев штрихом аликвоты (около 10 мм) на поверхности чашки Петри с селективным агаром для Enterobacter sakazakii (см. 5.2.3.2). Инкубируют при температуре (44±1)°С в течение (24±2) ч.
После инкубации исследуют чашку с хромогенной средой на наличие типичных колоний презумптивных бактерий Enterobacter sakazakii.
Примечание - Типичные колонии имеют размер от 1 до 3 мм и окрашены в зеленый или сине-зеленый цвет. Нетипичные колонии часто слегка прозрачны и окрашены в фиолетовый цвет.
9.5 Подтверждение
9.5.1 Образование желтого пигмента
9.5.1.1 Выбор колоний
Выбирают от одной до пяти типичных колоний презумптивных бактерий Enterobacter sakazakii на исследованной инкубированной чашке с хромогенной средой (см. 9.4).
9.5.1.2 Инкубация
Делают посев выбранных колоний (9.5.1.1) на поверхность чашек с TSA (см. 5.2.4.2) таким образом, чтобы после инкубации можно было наблюдать изолированные колонии. Инкубируют чашку при температуре (25±1)°С в течение 44-48 ч. После инкубации исследуют чашки с TSA на наличие колоний, содержащих желтые пигменты.
Если была выбрана только одна колония (см. 9.5.1.1) и ее пересеяли в чашку с TSA, а после инкубации не наблюдалось наличие колоний, содержащих желтый пигмент, то выбирают еще четыре типичные колонии (см. 9.5.1.1) и повторяют действия согласно 9.5.1.2 сначала. При наличии менее 5 типичных колоний следует выбрать все.
ПРЕДОСТЕРЕЖЕНИЕ - Некоторые редкие штаммы Enterobacter sakazakii не образуют желтый пигмент при условиях испытаний, описанных в настоящем стандарте, или пигмент может быть потерян в результате пересевов. Таким образом, подобные штаммы могут быть не распознаны как штаммы Enterobacter sakazakii при использовании данного метода.
9.5.2 Биохимическое подтверждение
9.5.2.1 Общие положения
Могут быть применены тест-системы для биохимической идентификации, которые в данный момент доступны в продаже и позволяют определить бактерии вида Enterobacter sakazakii.
9.5.2.2 Выбор колоний
Для дальнейшего биохимического анализа согласно 9.5.2.3-9.5.2.8 выбирают одну колонию, содержащую желтый пигмент, из каждой чашки с триптон-соевым агаром (см. 9.5.1.2).
9.5.2.3 Оксидаза
Используя стеклянную палочку или одноразовую иглу для посевов, отбирают часть из каждой выбранной характерной колонии (см. 9.5.2.2).
Наносят штрихи на фильтровальную бумагу, смоченную реактивом для определения оксидазы (см. 5.2.5.1), или на имеющийся в продаже диск. Не допускается использовать петлю или иглу, изготовленную из никеля/хрома.
Результат испытания считается отрицательным, если в течение 10 с фильтровальная бумага не поменяет цвет на сиреневый, фиолетовый или темно-синий.
9.5.2.4 L-лизиндекарбоксилаза
Используя петлю, иглу для посевов или стеклянную палочку, инокулируют среду на основе L-лизиндекарбоксилазы (см. 5.2.5.2) каждой из отобранных колоний (см. 9.5.2.2) чуть ниже поверхности жидкой среды. Инкубируют пробирки при температуре (30±1)°С в течение (24±2) ч.
Фиолетовый цвет после инкубации говорит о положительной реакции. Желтый цвет указывает на отрицательную реакцию.
9.5.2.5 L-орнитиндекарбоксилаза
Используя петлю, иглу для посевов или стеклянную палочку, инокулируют среду на основе L-орнитиндекарбоксилазы (см. 5.2.5.3) каждой из отобранных колоний (см. 9.5.2.2) чуть ниже поверхности жидкой среды. Инкубируют пробирки при температуре (30±1)°С в течение (24±2) ч.
Фиолетовый цвет после инкубации говорит о положительной реакции. Желтый цвет указывает на отрицательную реакцию.
9.5.2.6 L-аргининдигидролаза
Используя петлю, иглу для посевов или стеклянную палочку, инокулируют среду на основе L-аргининдигидролазы (см. 5.2.5.4) каждой из отобранных колоний (см. 9.5.2.2) чуть ниже поверхности жидкой среды. Инкубируют пробирки при температуре (30±1)°С в течение (24±2) ч.
Фиолетовый цвет после инкубации говорит о положительной реакции. Желтый цвет указывает на отрицательную реакцию.
9.5.2.7 Ферментация различных сахаров
Используя петлю, иглу для посевов или стеклянную палочку, инокулируют каждую среду для определения ферментации углеводов (см. 5.2.5.5.3) каждой из отобранных колоний (см. 9.5.2.2) чуть ниже поверхности жидкой среды. Инкубируют пробирки при температуре (30±1)°С в течение (24±2) ч.
Желтый цвет после инкубации говорит о положительной реакции. Красный цвет указывает на отрицательную реакцию.
9.5.2.8 Утилизация цитрата
Используя петлю, иглу для посевов или стеклянную палочку, делают посев отобранных колоний (см. 9.5.2.2) на скошенную поверхность цитратной среды Симмонса (см. 5.2.5.6). Инкубируют пробирки при температуре (30±1)°С в течение (24±2) ч.
Если питательная среда приобретает синий цвет, то реакция положительная.
9.6 Интерпретация результатов испытаний на подтверждение
Результаты интерпретируют согласно таблице 1.
Таблица 1 - Интерпретация результатов
Проверка соответствия | Положительная или отрицательная реакция | Процент штаммов Enterobacter sakazakii, проявляющих реакцию |
Выработка желтого пигмента | + | >99 |
Оксидаза | - | >99 |
L-лизиндекарбоксилаза | - | >99 |
L-орнитиндекарбоксилаза | + |
|
L-аргининдигидролаза | + | >99 |
Выделение кислот при: | ||
- ферментации D-сорбита | - |
|
- ферментации L-рамнозы | + | >99 |
- ферментации D-сахарозы | + | >99 |
- ферментации D-мелибиозы | + | >99 |
- ферментации амигдалина | + | >99 |
- утилизации цитрата | + | >95 |
10 Контрольные штаммы микроорганизмов
В целях проверки способности среды для обогащения и селективной среды поддерживать рост Enterobacter sakazakii, в контрольные колбы со средой для предварительного обогащения (см. 9.2) высевают бульонную культуру с низким уровнем контаминации. Для этого используют недавно выделенный штамм Enterobacter sakazakii или контрольный штамм из центра коллекций. С этой контрольной колбой осуществляют те же действия, что и с исследуемыми пробами, чтобы продемонстрировать, что среда для обогащения способна восстанавливать и обогащать культуру Enterobacter sakazakii.
11 Выражение результатов
В соответствии с интерпретацией результатов испытаний на подтверждение (9.6) составляют заключение о наличии или отсутствии в навеске презумптивных бактерий Enterobacter sakazakii. В случае отсутствия презумптивных бактерий Enterobacter sakazakii на хромогенной среде дальнейшее подтверждение не проводится.
После биохимического подтверждения в ходе процедуры, описанной в 9.5, одной или нескольких презумптивных бактерий Enterobacter sakazakii, полученных согласно 9.4, оформляют заключение о наличии или отсутствии Enterobacter sakazakii в навеске.
Конечный результат испытания выражают из расчета на массу (в граммах) или на объем (в кубических сантиметрах) анализируемой пробы для испытаний.
12 Протокол испытания
Протокол испытания должен включать следующее:
a) всю необходимую информацию для полной идентификации пробы;
b) используемый метод отбора проб, если известен;
c) используемый метод испытания со ссылкой на настоящий стандарт;
d) все особенности рабочего процесса, не представленные в настоящем стандарте или рассматриваемые как дополнительные, вместе с описанием любых обстоятельств, которые могли повлиять на результаты испытания;
e) полученные результаты испытания.
Приложение А
(справочное)
Блок-схема метода
|
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 6887-5:2010 | - | * |
ISO 7218:2007 | IDT | ГОСТ ISO 7218-2011 "Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям" |
* Соответствующий межгосударственный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. | ||
Библиография
[1] | ISO 707:2008/IDF 050:2008 | Milk and milk products - Guidance on sampling |
(Молоко и молочные продукты. Руководство по отбору проб) | ||
[2] | ISO 6887-1:1999 | Microbiology of food and animal feeding stuffs. Preparation of test samples, initial suspension and decimal dilutions for microbiological examination. Part 1: General rules for the preparation of the initial suspension and decimal dilutions |
(Микробиология пищевых продуктов и кормов для животных. Приготовление проб для испытаний, исходных суспензий и десятичных разведений для микробиологических исследований. Часть 1. Общие правила приготовления исходной суспензии и десятичных разведений) | ||
[3] | ISO/TS 11133-1:2009* | Microbiology of food and animal feeding stuffs. Guidelines on preparetion and production of culture media. Part 1: General guidelines on quality assurance for the preparation of culture media in the laboratory |
_______________ * Заменен на ISO 11133:2014 "Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и испытания для определения рабочих характеристик питательных сред". | ||
(Микробиология пищевых продуктов и кормов для животных. Руководство по подготовке и приготовлению культуральных сред. Часть 1. Общее руководство по обеспечению качества подготовки культуральных сред в лаборатории) | ||
[4] | Guillaume-Gentil, O., Sonnard, V., Kandhal, M.C., Marugg, J.D., and Joosten, H. Simple and Rapid Cultural Method for Detection of Enterobacter sakazakii in Environmental Samples. Journal of Food Protection, 68 (1), 2005, pp.64-69 | |
(Простой и быстрый метод выращивания культуры для определения Enterobacter sakazakii в образцах окружающей среды) | ||
УДК 637.1:579.842:006.35 | МКС 07.100.30 | IDT |
Ключевые слова: молоко, продукты молочные, презумптивные бактерии, питательные среды, контрольные штаммы микроорганизмов, Enterobacter sakazakii | ||
Электронный текст документа
и сверен по:
, 2019