ГОСТ ISO 10993-7-2016
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ
ИЗДЕЛИЯ МЕДИЦИНСКИЕ. ОЦЕНКА БИОЛОГИЧЕСКОГО ДЕЙСТВИЯ МЕДИЦИНСКИХ ИЗДЕЛИЙ
Часть 7
Остаточное содержание этиленоксида после стерилизации
Medical devices. Biological evaluation of medical devices. Part 7. Ethylene oxide sterilization residuals
МКС 01.020
Дата введения 2017-10-01
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 "Межгосударственная система стандартизации. Основные положения" и ГОСТ 1.2 "Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены"
Сведения о стандарте
1 ПОДГОТОВЛЕН Автономной некоммерческой организацией "Институт медико-биологических исследований и технологий" (АНО "ИМБИИТ") на основе собственного перевода на русский язык англоязычной версии международного стандарта, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 25 октября 2016 г. N 92-П)
За принятие проголосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97 | Код страны по | Сокращенное наименование национального органа по стандартизации |
Армения | AM | Минэкономики Республики Армения |
Беларусь | BY | Госстандарт Республики Беларусь |
Казахстан | KZ | Госстандарт Республики Казахстан |
Киргизия | KG | Кыргызстандарт |
Россия | RU | Росстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 31 октября 2016 г. N 1532-ст межгосударственный стандарт ГОСТ ISO 10993-7-2016 введен в действие в качестве национального стандарта Российской Федерации с 1 октября 2017 г.
5 Настоящий стандарт идентичен международному стандарту ISO 10993-7:2008/Cor.1:2009* "Оценка биологического действия медицинских изделий. Часть 7. Остаточное содержание этиленоксида после стерилизации" ("Biological evaluation of medical devices - Part 7: Ethylene oxide sterilization residuals", IDT).
________________
* Доступ к международным и зарубежным документам, упомянутым в тексте, можно получить, обратившись в Службу поддержки пользователей. - .
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им межгосударственные стандарты, сведения о которых приведены в дополнительном приложении ДА
6 ВВЕДЕН ВПЕРВЫЕ
7 ИЗДАНИЕ (май 2020 г.) с Поправкой (ИУС 11-2017)
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге "Межгосударственные стандарты"
Введение
ИСО (Международная организация по стандартизации) является Всемирной федерацией национальных органов по стандартизации (органов-членов ИСО). Работу по подготовке международных стандартов проводят через ИСО технические комитеты. Каждый комитет-член, заинтересованный в деятельности, для которой был создан технический комитет, имеет право быть представленным в этом комитете. Международные организации, правительственные и неправительственные, имеющие связи с ИСО, также принимают участие в работе. ИСО тесно сотрудничает с Международной электротехнической комиссией (МЭК) по всем вопросам электротехнической стандартизации.
Международные стандарты проектируют в соответствии с правилами, приведенными в ИСО/МЭК Директивах, часть 2.
Основной задачей технических комитетов является подготовка международных стандартов. Проекты международных стандартов, принятые техническими комитетами, рассылают членам ИСО для голосования. Их опубликование в качестве международных стандартов требует одобрения не менее 75% комитетов-членов, принимающих участие в голосовании.
Обращает на себя внимание то, что некоторые из элементов этого документа могут быть объектом прав на патент. ИСО не должна нести ответственность за идентификацию какого-либо или всех патентных прав. ISO 10993-7 был подготовлен Техническим комитетом ISO/TC 194 "Биологическая оценка медицинских устройств".
Второе издание отменяет и заменяет первое издание (ISO 10993-7:1995), которое было технически пересмотрено.
В серию ISO 10993 входят следующие части под общим названием "Оценка биологического действия медицинских изделий":
- часть 1 - Оценка и испытания в рамках процесса менеджмента риска;
- часть 2 - Требования к охране здоровья животных;
- часть 3 - Испытания на генотоксичность, канцерогенность и токсичность, влияющую на репродуктивность;
- часть 4 - Выбор испытаний, относящихся к взаимодействию с кровью;
- часть 5 - Испытания на цитотоксичность in vitro;
- часть 6 - Испытания для определения локальных эффектов после имплантации;
- часть 7 - Остаточное содержание этиленоксида после стерилизации;
- часть 9 - Структура идентификации и квантификации потенциальных продуктов разложения;
- часть 10 - Пробы на раздражение и аллергическую реакцию кожи;
- часть 11 - Испытания на системную токсичность;
- часть 12 - Приготовление проб и стандартные образцы;
- часть 13 - Идентификация и количественная оценка продуктов разложения в полимерных медицинских устройствах;
- часть 14 - Идентификация и количественная оценка продуктов разложения керамики;
- часть 15 - Идентификация и количественная оценка продуктов разложения металлов и сплавов;
- часть 16 - Концепция токсикокинетических исследований продуктов разложения и выщелачиваемых веществ;
- часть 17 - Установление допустимых пределов выщелачиваемых веществ;
- часть 18 - Определение химических характеристик материалов;
- часть 19 - Физико-химическая, морфологическая и топографическая характеристика материалов (технические требования);
- часть 20 - Принципы и методы исследования иммунотоксикологических испытаний медицинских изделий (технические требования).
Требования к разработке, утверждению и регулярному контролю процесса стерилизации этиленоксидом для медицинских изделий приведены в международных стандартах, разработанных ISO/TC 198. Определенные требования, касающиеся медицинских изделий, для биологического тестирования, выбора испытаний и распределения изделий по категориям, приведены в различных международных стандартах, разработанных ISO/TC 194. Определенные требования для этиленоксида и других остаточных веществ процесса стерилизации были рассмотрены ISO/TC 194. Другие международные стандарты описывают специфические требования к биологическому тестированию конкретных продуктов.
Во введении к ISO 11135-1:2007, при определении пригодности этиленоксида (ЭО) для стерилизации медицинских изделий, важно убедиться, что уровни остаточного ЭО, этиленхлоргидрина (ЭХГ) и этиленгликоля (ЭГ) представляют минимальный риск для пациента при нормальном использовании продукта. Таким образом, важно, чтобы во время планирования и разработки продукта рассматривалось применение альтернативных материалов и процессов стерилизации. Известно, что ЭО может вызывать различные биологические эффекты. При разработке настоящего стандарта учитывались эти эффекты, которые включают раздражение, повреждение органов, мутагенность и канцерогенность у человека и животных и влияние на репродуктивную функцию у животных. Также учитывались вредные эффекты ЭХГ и ЭГ. На практике для большинства изделий воздействие ЭО и ЭХГ значительно ниже, чем максимальные значения, обозначенные в настоящем стандарте.
Более того, при выборе стерилизации ЭО, вне зависимости от положений настоящего стандарта, воздействие остаточных количеств ЭО должно быть сведено к минимуму. Требования настоящего стандарта являются дополнением к биологической оценке и требованиям к испытаниям каждого отдельно созданного медицинского изделия, как обозначено в ISO 10993-1. Биологическая оценка и требования к испытаниям в сочетании с предельными значениями остаточных веществ процесса стерилизации ЭО формируют обоснование того, что изделие, стерилизованное ЭО, приемлемо для использования. Также обозначены максимальные доступные предельные значения остаточных веществ для ЭХГ, если он был обнаружен в медицинских изделиях, стерилизованных ЭО. Местные эффекты (например, раздражение) также учитывались и включены в предел переносимого контакта (TCL), как представлено в п.4.3.5.2 и приложении G для допустимых значений ЭО и в п.4.3.5.3 и приложении Н для допустимых значений ЭХГ.
1 Область применения
Настоящий стандарт устанавливает допустимые предельные значения для остаточного количества этиленоксида (ЭО) и этиленхлоргидрина (ЭХГ) в индивидуальных медицинских изделиях, стерилизованных ЭО, методы измерения ЭО и ЭХГ и требования, в соответствии с которыми могут осуществлять выпуск изделий. Дополнительная информация, включая руководство и блок-схему, демонстрирующую применение настоящего стандарта, приведена в справочных приложениях.
Стандарт не распространяется на изделия, стерилизованные ЭО, но не имеющие контакта с пациентом (например, диагностические устройства, использующиеся in vitro).
Примечание - Настоящий стандарт не устанавливает предельных значений для этиленгликоля (ЭГ).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты. Для датированных ссылок применяют только указанное издание ссылочного стандарта, для недатированных - последнее издание (включая все изменения).
ISO 10993-1, Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process (Оценка биологического действия медицинских изделий. Часть 1. Оценка и испытания в рамках процесса менеджмента риска)
________________
Заменен на ISO 10993-1:2018.
ISO 10993-3, Biological evaluation of medical devices - Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity (Оценка биологического действия медицинских изделий. Часть 3. Испытания на генотоксичность, канцерогенность и токсичность, влияющую на репродуктивность)
ISO 10993-10, Biological evaluation of medical devices - Part 10: Tests for irritation and delayed-type hypersensitivity (Оценка биологического действия медицинских изделий. Часть 10. Пробы на раздражение и аллергическую реакцию кожи)
ISO 10993-12, Biological evaluation of medical devices - Part 12: Sample preparation and reference materials (Биологическая оценка медицинских изделий. Часть 12. Приготовление проб и стандартные образцы)
ISO 10993-17:2002, Biological evaluation of medical devices - Part 17: Establishment of allowable limits for leachable substances (Оценка биологического действия медицинских изделий. Часть 17. Установление допустимых пределов выщелачиваемых веществ)
(Поправка, ИУС 11-2017)
3 Термины и определения
В настоящем стандарте применены термины по ISO 10993-1, ISO 10993-17, а также следующие термины с соответствующими определениями:
3.1 экстракция, моделирующая условия применения изделий: Экстракция с использованием воды в качестве модельной среды, моделирующая реальные условия применения, выполняемая в соответствии с требованиями настоящего стандарта и позволяющая оценить остаточные количества ЭО и ЭХГ, воздействующие на пациента или пользователя изделий в процессе их применения по назначению.
3.2 исчерпывающая экстракция: Экстракция, выполняемая до тех пор, пока количество ЭО и ЭХГ в последующей порции модельной среды не будет составлять менее 10% определенного при первой экстракции или пока не будет аналитически значимого увеличения в определяемых совокупных остаточных уровнях.
Примечание - Так как невозможно показать исчерпывающий характер при оценке остаточных количеств, определение исчерпывающей экстракции принимают в указанном выше виде.
4 Основные требования
Примечание - Информация по источникам ограничений в настоящем стандарте, а также другая важная дополнительная информация и руководство к использованию настоящего стандарта приведены в справочных приложениях.
4.1 Общие положения
В настоящем подразделе устанавливают максимально допустимые уровни остаточного содержания ЭО для отдельных изделий, стерилизованных ЭО. Как указано в предисловии к ISO 11135-1:2007, при определении пригодности ЭО для стерилизации медицинских изделий, важно убедиться, что уровни остаточного ЭО, ЭХГ и этиленгликоля (ЭГ) представляют минимальный риск для пациента при обычном использовании продукта. Более того, при избрании стерилизации ЭО, вне зависимости от положений настоящего стандарта, воздействие остаточных количеств ЭО должно быть сведено к минимуму. Регламентируют также максимальное содержание ЭХГ в тех случаях, когда его обнаруживают в медицинских изделиях, стерилизованных ЭО. Местные эффекты (например, раздражение) были учтены и включены в предел переносимого контакта (TCL), как обозначено в п.4.3.5.2 и приложении G для ЭО и в п.4.3.5.3 и приложении Н для ЭХГ. Для содержания ЭГ никакие ограничения не устанавливают, поскольку оценка степени риска (см. приложение I) показывает, что вычисленные допустимые уровни выше, чем те, которые могут появиться в медицинском изделии. Тем не менее существует потенциал острых гемодинамических и гемолитических эффектов после быстрого внутривенного введения гиперосмолярных соединений как ЭГ. Не ожидается, что стерилизация медицинских изделий ЭО приведет к образованию гиперосмолярных растворов. Методы для определения ЭО и ЭХГ приведены в 4.4.
Требования, изложенные в настоящем стандарте, являются дополнением к программам биологических исследований, представленным в ISO 10993-1. При применении изделий, стерилизованных ЭО, следует обратить особое внимание на ISO 10993-3 и ISO 10993-10. При выполнении требований ISO 10993-1 следует учитывать остаточные количества ЭО в момент выпуска продукции для каждого конкретного изделия.
Результаты биологической оценки изделия могут обусловить более жесткие, чем приведенные в 4.3 требования, предназначенные для учета системных реакций.
4.2 Категории изделий
Для установления максимальной суточной дозы ЭО и ЭХГ, которая может выделяться из изделия и воздействовать на пациента, изделие в зависимости от продолжительности контакта относят к определенной категории. Согласно ISO 10993-1, подразделу 5.3 изделия по продолжительности контакта относят к одной из трех категорий:
a) кратковременный контакт (А) - изделия, чье общее однократное, многократное или повторное использование не превышает 24 ч;
b) длительный контакт (В) - изделия, чье общее однократное, многократное или повторное использование может превысить 24 ч, но не более 30 сут;
с) постоянный контакт (С) - изделия, чье общее однократное, многократное или повторное использование превышает 30 сут.
Если материал или изделие могут быть отнесены более чем к одной категории по длительности контакта, следует выбирать более жесткие условия исследований. При многократном применении изделия для принятия решения, к какой категории следует отнести изделие, учитывают возможный кумулятивный эффект, принимая во внимание период времени между повторными применениями.
Примечание - В настоящем стандарте термин "многократное применение" означает применение одного и того же изделия более одного раза (например, картриджи для диализатора).
4.3 Допустимые предельные значения
4.3.1 Общие положения
Для каждого медицинского изделия максимально допустимые дозы ЭО и ЭХГ, которые воздействуют на пациента, не должны превышать значений, приведенных ниже для соответствующей категории, в которую изделие было отнесено в соответствии с 4.2.
Предельные значения для изделий постоянного и длительного контакта выражены в максимальной среднесуточной дозе. Для изделий, имеющих постоянный контакт, введены дополнительные ограничения для первых 24 ч и для первых 30 сут, а для изделий длительного контакта - для первых 24 ч. Эти ограничения устанавливают предельные значения ЭО и ЭХГ, которые могут воздействовать на пациента в ранние периоды времени. Если существуют данные, необходимо рассмотреть пропорциональное снижение пределов, если одновременно применяют несколько изделий с возможными остаточными веществами, или пропорциональное повышение, если изделие применяется только частично во время рассматриваемого периода. Эти сопутствующие факторы воздействия (CEF) и пропорциональные факторы воздействия (PEF) приведены в ISO 10993-17. Методика, которую использовали для установки допустимых предельных значений, описана в приложении G для ЭО, в приложении Н - для ЭХГ, а обоснование для рассмотрения установления допустимых пределов для ЭГ - в приложении I.
4.3.2 Допустимая доза при постоянном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 0,1 мг/сут. Дополнительные требования к максимальной дозе ЭО должна быть не более:
- 4 мг - в течение первых 24 ч;
- 60 мг - в течение первых 30 сут;
- 2,5 г - в течение жизни.
Среднесуточная доза ЭХГ для пациента должна быть не более 0,4 мг/сут. Дополнительные требования к максимальной дозе ЭХГ должна быть не более:
- 9 мг - в течение первых 24 ч;
- 60 мг - в течение первых 30 сут;
- 10 г - в течение жизни.
4.3.3 Допустимая доза при длительном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 2 мг/день. Дополнительные требования к максимальной дозе ЭО должны быть не более:
- 4 мг - в течение первых 24 ч;
- 60 мг - в течение первых 30 сут.
Среднесуточная доза ЭХГ должна быть не более 2 мг/сут.
Дополнительные требования к максимальной дозе ЭХГ должна быть не более:
- 9 мг - в течение первых 24 ч;
- 60 мг - в течение первых 30 сут.
4.3.4 Допустимая доза при кратковременном контакте изделия с поверхностью тканей пациента
Среднесуточная доза ЭО для пациента должна быть не более 4 мг. Среднесуточная доза ЭХГ для пациента не должна превышать 9 мг.
4.3.5 Предельное значение допустимой дозы при контакте изделий и имплантатов с поверхностью тканей пациента
4.3.5.1 Общее представление
Предельное значение допустимой дозы (TCL) выражено в количестве микрограммов на квадратный сантиметр для ЭО и миллиграммов на квадратный сантиметр для ЭХГ. Единица квадратного сантиметра представляет собой площадь поверхности контакта пациент-изделие.
Примечание - Целью данного положения является предотвращение местного раздражения за счет выделения ЭО или ЭХГ из изделия.
4.3.5.2 Предельное значение допустимой дозы для ЭО
Либо предельное значение допустимого контакта ЭО для изделий и имплантатов, входящих в контакт с поверхностью, не должен превышать 10 мкг/см, либо должно быть продемонстрировано незначительное раздражение как обозначено в ISO 10993-10.
4.3.5.3 Предельное значение допустимой дозы для ЭХГ
Либо предельное значение допустимого контакта ЭХГ для изделий и имплантатов, входящих в контакт с поверхностью, не должно превышать 5 мг/см, либо может быть выявлено незначительное раздражение, как обозначено в ISO 10993-10.
4.3.6 Особые случаи
Для систем, состоящих из нескольких изделий, предельные значения допустимой дозы следует рассчитывать отдельно для каждого изделия, входящего в контакт с пациентом.
Остаточное содержание ЭО в интраокулярных линзах должно быть не более 0,5 мкг ЭО на линзу в сутки и 1,25 мкг на линзу. Предельные значения допустимой дозы для других интраокулярных изделий устанавливают пропорционально массе изделия, причем масса интраокулярной линзы принята за 20 мг. Может понадобиться оценить приемлемость уровней ЭХГ в интраокулярных изделиях, сделанных из вязко-эластичных материалов, содержащих хлор, так как уровень ЭХГ, приводящий к офтальмологической токсичности, примерно в четыре раза выше, чем соответствующий уровень ЭО.
Для сепараторов клеток крови, используемых при заборе крови пациентов и доноров, максимальной допустимой дозой ЭО является 10 мг, а максимальная допустимая доза ЭХГ не должна превышать 22 мг.
Для оксигенаторов и сепараторов крови максимальной допустимой дозой ЭО для пациента является 60 мг, а максимальная допустимая доза ЭХГ не должна превышать 45 мг.
Для изделий, используемых в процедурах сердечно-легочного шунтирования, максимально допустимыми пределами являются 20 мг для ЭО и 9 мг для ЭХГ.
Для изделий, предназначенных для экстракорпоральной очистки крови, используют предельные содержания ЭО и ЭХГ из расчета 4,6 мг/изделие, но допустимая доза ЭО в течение всей жизни может быть превышена.
Для простыней, которые предназначены для контакта только с неповрежденной кожей, максимально допустимыми пределами являются предел переносимого контакта 10 мкг/см для ЭО и 5 мг/см
для ЭХГ, или может быть выявлено незначительное раздражение, как обозначено в ISO 10993-10.
Примечание - Обоснование для определения предельного содержания ЭО для некоторых изделий, не соответствующих общим требованиям, представлено в приложении F.
Блок-схема, предоставляющая руководство по применению настоящего стандарта к определению остаточного содержания ЭО в медицинских изделиях, представлена в приложении С.
4.4 Определение остаточного содержания ЭО и ЭХГ
4.4.1 Общие положения
4.4.1.1 Процедура
Метод определения остаточного содержания ЭО и ЭХГ для проверки соответствия требованиям, изложенным в 4.3, заключается в экстрагировании остаточных количеств из образцов, количественной оценке, определении контактной поверхности изделия, анализе и интерпретации полученных данных.
ОПАСНОСТЬ - Специалистам следует выполнять все работы, связанные с использованием химических реагентов и растворителей, необходимых для данных методов, под вытяжным шкафом в соответствующей защитной одежде, а также ознакомиться с информацией по безопасности материалов перед использованием каждого химического вещества. Работники здравоохранения, использующие медицинские изделия, стерилизованные ЭО, должны применять соответствующие меры предосторожности для защиты от воздействия остаточных количеств в соответствии с требованиями правил охраны труда и техники безопасности.
4.4.1.2 Этиленоксид
Это воспламеняющийся и высокоактивный газ, оказывающий раздражающее действие на поверхность тела. Обладает мутагенным действием при многих условиях, проявляет фетотоксичные и тератогенные свойства и может негативно влиять на тестикулярную функцию и повреждать многие системы органов человека. При изучении канцерогенных свойств на животных ингаляционное воздействие вызывало неопластические изменения нескольких типов, включая лейкемию, опухоли мозга и молочной железы, в то время как прием внутрь и внутрикожное введение вызывали опухоли лишь в месте контакта. В одном исследовании сообщается о высоком уровне рака и смертности в некоторых субпопуляциях работников, оказавшихся под воздействием ЭО. Однако в нескольких подобных исследованиях не нашли такой корреляции (см. ссылки [177], [178] и [181]). В 1994 г. Международное агентство по изучению рака (IARC) классифицировало ЭО как человеческий канцероген (класс 1), основываясь в первую очередь на его механизме действия (см. ссылку [75]).
4.4.1.3 Этиленхлоргидрин
Это воспламеняющаяся жидкость, которая оказывает раздражающее действие на поверхность тела, вызывает острую токсичность и легко всасывается в кожу в количествах, оказывающих токсическое действие. Обладает слабым мутагенным действием, может вызывать фетотоксические и тератогенные изменения, повреждать различные органы, включая легкие, почки, центральную нервную систему и сердечно-сосудистую систему. Исследования канцерогенности на животных дали отрицательные результаты.
4.4.2 Определение остаточного содержания
Для определения остаточных количеств ЭО и, при необходимости, ЭХГ, воздействующих на пациента, необходимо использовать узаконенные методики экстракции и анализа.
Если по результатам анализов, проведенных по методикам, представленным в К.4.2 или К.4.7 приложения К, ЭХГ не обнаружен, в дальнейшем его определение не требуется.
Примечание - Многие методы газовой хроматографии (GC), применяющие капиллярную, а не наполненную колонку, произведут результаты ЭО, ЭХГ и ЭГ при одном анализе образца.
Основным принципом выбора пригодных методов экстракции (п.4.4.6) для количественного определения ЭО или, при необходимости, ЭХГ является оценка дозы, воздействующей на пациента, для того, чтобы показать соответствие требованиям, приведенным в 4.3.
Если обосновано, что остаточное содержание ЭО и ЭХГ, определяемое методом исчерпывающей экстракции, соответствует требованиям 4.3, экстракцию, моделирующую условия применения в медицинской практике, не проводят. При применении исчерпывающей экстракции обращают особое внимание на предельные значения для первых 24 ч и 30 сут в соответствии с 4.3.
Известно много аналитических методов для определения остаточного содержания ЭО после стерилизации; их обзоры представлены в библиографии.
Однако большое разнообразие материалов и конструкторских решений при создании медицинских изделий в ряде случаев может вызвать трудности в определении остаточного содержания ЭО и ЭХГ методами, приведенными в Библиографии. Поэтому любой аналитически значимый метод (т.е. обеспечивающий достоверность, точность, линейность, чувствительность и селективность) может быть использован при условии, что он обоснован.
Приложение А содержит общие требования утверждения для методов газовой хроматографии.
4.4.3 Приготовление образцов и контроля
4.4.3.1 Приготовление образцов
Образцы, которые предназначены для определения остаточного содержания ЭО и ЭХГ, должны быть отобраны таким образом, чтобы они в достаточной степени отражали свойства изделия в целом. При отборе образцов следует обратить внимание на ряд факторов, указанных в приложении D. Так как многие из этих факторов влияют не только на первоначальные значения остаточных веществ во всех компонентах изделия, но и на скорость диссипации этих веществ, их также необходимо учитывать, начиная с забора образцов из готовой партии и предоставления в лабораторию для проведения анализа. Извлечение образцов изделий из готовой партии сразу после окончания цикла стерилизации и отправка их в лабораторию, находящуюся удаленно от места стерилизации, а также хранение отобранных образцов в лаборатории для последующего анализа могут нарушить корреляцию в содержании остаточных количеств ЭО и ЭХГ в отобранных образцах и в оставшихся в готовой партии. Более того, если образцы изделий из готовой партии не могут быть отобраны и доставлены таким образом, чтобы эффект дегазации был незначительным, проводят исследование для установления соответствия дегазации анализируемых образцов и изделий из партии в разное время года.
Следует контролировать или минимизировать влияние лабораторных условий на скорость дегазации образцов, которые отобраны из партии изделий (см. D.1.5 приложения D). При проведении анализа соблюдают меры безопасности для оператора и аналитика.
Образцы, предназначенные для анализа, должны оставаться в составе партии вплоть до дня проведения анализа или до забора и немедленной заморозки образцов. Время между изъятием образца из зоны контролируемой дегазации и началом экстракции должно быть сведено к минимуму. Образцы герметично закрывают, перевозят и хранят в замороженном виде, если анализ откладывается. Образцы перевозят с сухим льдом с привлечением службы круглосуточной доставки. Сухой лед должен находиться в контейнере для перевозки в течение всего времени транспортирования и быть в наличии при вскрытии упаковки в лаборатории. Образцы для анализа могут быть отобраны непосредственно из партии изделий после соответствующего интервала дегазации и сразу помещены в емкость для анализа (флакон для хроматографических исследований), затем их герметично закрывают и затем перевозят в лабораторию для анализа. В качестве альтернативы образцы могут быть экстрагированы, и жидкий экстракт отправлен в аналитическую лабораторию для анализа. Если экстрагирующей жидкостью является вода, то перевозку осуществляют таким образом, что жидкость содержится при пониженных температурах (<10°С) до прибытия. Исследование проводят путем измерения степени гидролиза ЭО в ЭГ.
Анализируемые образцы помещают в вытяжной шкаф и освобождают от упаковки. Образцы готовят в соответствии с инструкцией по предварительной подготовке, указанной на этикетке изделия.
Экстракцию следует начинать, по возможности, сразу после того, как образец извлечен из упаковки или закончена предварительная подготовка.
4.4.3.2 Контрольный образец
Для того чтобы убедиться в отсутствии в веществе, составляющем основу образца, других компонентов со временем удерживания таким же, как и определяемые остаточные продукты, необходимо оценить контрольный образец, не подвергавшийся стерилизации, путем его экстракции с использованием тех же процедур, что и для образцов, стерилизованных ЭО. При наличии материалов, экстрагируемых из такого контрольного образца, для которых времена удерживания совпадают или близки к временам удерживания определяемых веществ, изменяют условия хроматографирования таким образом, чтобы отделить мешающие пики от анализируемого пика, или используют другую аналитическую методику.
4.4.4 Соотношение между размерами образца и жидкостью
Объем жидкости, используемой для извлечения остаточных количеств определяемых веществ из изделий или их представительных частей, должен быть таким, чтобы обеспечить максимальную эффективность экстракции при достаточной чувствительности определения анализируемых веществ в экстракте. Таким образом, материал и размер образца изделия обусловливают оптимальный объем модельной среды.
Таким образом, для максимального увеличения аналитической чувствительности необходимо использовать минимальное количество жидкости для экстракции в зависимости от требуемого метода экстракции и размера образца. Для изделий, изготовленных из материалов с высокими поглотительными свойствами, или для тех, экстракцию остаточных количеств из которых проводят методом заполнения, может потребоваться соотношение масса образца/объем модельной среды, отражающее повышенный объем жидкости. В любом случае соотношение масса образца/объем модельной среды не должно приводить к уменьшению чувствительности определения.
4.4.5 Время и условия экстракции
Задача экстракции из изделий состоит в извлечении максимального количества вредных веществ, которые могут оказать воздействие на пациента в процессе применения изделия: выход за сутки - для изделий кратковременного контакта; выход за сутки и за месяц - для изделий длительного контакта; выход за сутки, за месяц и на протяжении жизни - для изделий постоянного контакта. Как указано в приложениях Е и F, исчерпывающая экстракция, описанная ниже, является полезным альтернативным методом для оценки изделий постоянного контакта, если учтены ограничения для более короткого периода применения.
4.4.6 Экстракция из изделий
4.4.6.1 Общее представление
Существуют два основных метода экстракции, которые используют для определения остаточного содержания ЭО после стерилизации в медицинских изделиях: экстракция, моделирующая условия применения в медицинской практике, являющаяся эталонным методом, и исчерпывающая экстракция, которая в ряде случаев является приемлемым альтернативным методом. Выбор метода экстракции должен быть основан на предполагаемом способе применения изделия. Примеры рекомендуемых методов экстракции приведены в приложении К.
Выбранный метод экстракции должен учитывать предполагаемый способ применения изделия с учетом максимального воздействия на пациента, а не избран из-за скорости анализа или занижения реальных концентраций остаточных количеств веществ.
Температуру и время экстракции выбирают с учетом вида и длительности контакта пациента с изделием в соответствии с 4.2 и 4.3 (см. ISO 10993-12 для температур экстракции).
Исследователь должен быть готов к тому, что для некоторых изделий экстракция, моделирующая условия применения, может привести к относительно большим объемам элюирования. В таких случаях предел обнаружения для остаточного материала может значительно увеличиться до такой степени, что возможно несоответствие с настоящим стандартом.
Небольшие изделия экстрагируют в соответствующем контейнере. Когда изделие является слишком большим для экстракции полностью, может стать необходимым экстрагировать несколько репрезентативных порций компонентов изделия для обеспечения уверенности в полученных данных.
Эти репрезентативные порции выбирают одним из двух способов. Если используют несколько различных материалов, пропорция каждого компонента, по сравнению с общей массой образца, должна соответствовать соотношению данного компонента с общей массой исследуемого изделия. В качестве альтернативы можно выбрать один из компонентов для исследования после оценки, демонстрирующей, что он представляет максимальный случай содержания остаточных веществ. Выбранный метод должен быть утвержденным.
4.4.6.2 Экстракция, моделирующая условия применения изделия в медицинской практике (эталонный метод)
Водная экстракция, моделирующая условия применения, является эталонным методом в том смысле, что это - единственный метод, который дает результаты, напрямую сравнимые с предельными содержаниями остаточных количеств веществ в соответствии с требованиями 4.3.
Эти предельные содержания выражены в дозах ЭО и ЭХГ, воздействующих на пациента.
Так как необходимо оценить остаточные количества веществ, воздействующих на пациента или пользователя в процессе применения изделия в нормальных условиях, требуются методы экстракции, моделирующие условия применения в медицинской практике. Экстракцию, моделирующую условия применения изделия, следует проводить с учетом максимального приближения к процессу применения.
Например, для многих парентеральных изделий или изделий, контактирующих с кровью, может быть использована водная экстрация путем заполнения или пропускания модельной среды через те пути, по которым протекает кровь или жидкость, там, где это возможно. Экстракцию из образцов проводят в течение времени, равного или превышающего максимальное время использования при однократном применении и при температуре, приближенной к максимальному реалистичному воздействию.
Для определения дозы ЭО и, где необходимо, ЭХГ, воздействующей на пациента или пользователя в течение времени применения изделия, используют метод водной экстракции, моделирующей условия применения.
Примечание - Количества ЭО (или ЭХГ), выделенные путем экстракции, моделирующей условия применения, необязательно должны совпадать с их общим содержанием в изделии.
Для извлечения остаточных количеств ЭО и ЭХГ (и ЭГ, если существует вероятность гидролиза ЭО) методом экстракции, моделирующей условия применения, в качестве модельной среды обычно используют воду [92]. Воду используют для экстрагирования остаточных количеств ЭО, а не для растворения материала самого образца. Если предполагается при проведении экстракции заполнение изделия водой, то это выполняют таким образом, чтобы не образовывалось воздушных пузырей. Изделия, предназначенные для полного или частичного контакта с телом, экстрагируют при 37°С (температура тела); изделия, не предназначенные для непосредственного контакта с телом (например, шприцы для подкожных инъекций), экстрагируют при 25°С (комнатная температура) (см. ISO 10993-12). Если анализ проводят не сразу, экстракт сливают в емкость и герметично закрывают крышкой с уплотнительной прокладкой из политетрафторэтилена. Свободное пространство в емкости с любым раствором или экстрактом должно составлять менее 10% общего объема. Экстракт можно хранить в холодильнике в течение нескольких суток (см. приложение F), но если использовали водную экстракцию, следует соблюдать осторожность, так как ЭО может превратиться в ЭГ или ЭХГ (или в оба продукта) в процессе экстракции, а также в период хранения экстракта [35]. Исследователь должен оценить возможность такого превращения в месте проведения анализа при водной экстракции образца.
4.4.6.3 Исчерпывающая экстракция (приемлемый альтернативный метод)
4.4.6.3.1 Общее представление
Исчерпывающая экстракция представляет собой приемлемый альтернативный метод и может дать полезную информацию. Как правило, остаточные количества веществ, полученные этим методом, соответствуют дозе, большей или равной той, которую может получить пациент. Поскольку экстракция данного вида исключает возможность определения дозы в зависимости от времени, она не гарантирует, что масса остаточного количества ЭО не поступит к пациенту в первые 24 ч или 30 сут воздействия. Однако если все допустимые предельные значения согласно 4.3 соблюдаются и показано, что остаточное содержание веществ укладывается в требования для изделий, подвергаемых исчерпывающей экстракции, нет необходимости проводить в дальнейшем экстракцию, моделирующую условия применения. Когда используют исчерпывающую экстракцию, обращают особое внимание на предельные значения, рассчитанные для первых 24 ч и 30 сут согласно 4.3. Методы исчерпывающей экстракции предназначены для определения полного содержания остаточных веществ в изделии. Для определения ЭО применяют методы экстракции, включающие в себя температурную экстракцию с последующим анализом равновесной паровой фазы, экстракцию растворителем, когда экстракт анализируют методом равновесной паровой фазы, прямым хроматографированием экстракта или путем получения бромгидринового производного ЭО, которое определяют с использованием более чувствительного ГХ-детектора, такого как детектор захвата электронов.
4.4.6.3.2 Остаточное содержание ЭО
Для определения остаточного содержания ЭО методом исчерпывающей экстракции существует ряд модельных сред. Примером метода, в котором не используют модельную среду, является десорбция при повышенной температуре с последующим анализом равновесной паровой фазы, как описано в К.4.3 приложения К. При проведении анализа подобным образом методы с использованием равновесной паровой фазы считают исчерпывающими, поскольку они предназначены для выделения всех остаточных количеств ЭО в образце. Однако данным методам нельзя отдать предпочтение или они могут быть вообще невыполнимыми при анализе цельных крупных или сложных изделий. Выполняя анализы методом равновесной паровой фазы при определении остаточного содержания ЭО в полимерных материалах, таких как полиметилметакрилат, исследователь должен обратить особое внимание на то, чтобы обеспечить полное выделение ЭО.
Для методов жидкостной экстракции выбор подходящей модельной среды зависит от состава материала изделия и его фрагментов. Чтобы облегчить полное выделение ЭО из образца, в методе исчерпывающей экстракции предпочтение следует отдать жидкостям, которые растворяют материал образца, при условии, что данным методом в раствор не будут внесены мешающие вещества. Методы жидкостной экстракции в сочетании с анализом равновесной паровой фазы описаны в К.4.4 приложения К. Такие методы могут оказаться удобными для отделения ЭО от мешающих химических веществ, соэкстрагируемых из вещества, составляющего основу образца. Модельные среды, приведенные в В.3.2 приложения В, были оценены в ходе сравнительных межлабораторных исследований [112], [113] и [114]. Аналитическая методика предписывает в случае использования метода исчерпывающей экстракции при первичном анализе исследуемого образца проводить более чем одну процедуру экстракции, чтобы убедиться в количественном извлечении. Для изделий, содержащих относительно малые количества остаточного ЭО, общепринятые методы могут не обеспечить экстракцию этих количеств даже после относительно продолжительной экстракции.
4.4.6.3.3 Остаточное содержание ЭХГ
Для экстракции остаточных количеств ЭХГ из медицинских изделий обычно используют воду, привлекая методы, схожие с ранее описанными для определения остаточного количества ЭО.
4.4.7 Результаты анализа и их интерпретация
4.4.7.1 Вычисление количества экстрагируемых остаточных веществ
Концентрацию остаточных веществ, обнаруженных в экстрактах, преобразовывают в количество, полученное пациентом, мг,
, как описано далее.
Остаточные вещества, полученные экстракцией, моделирующей условия применения в медицинской практике, рассчитывают по следующей формуле
![]() . (1)
. (1)
Остаточные вещества, полученные исчерпывающей экстракцией, рассчитывают по следующей формуле
![]() , (2)
, (2)
где - остаточное количество в экстракте, мг;
- число экстракций;
- количество ЭО, определенное по калибровочной кривой, мг/мл экстракта;
- объем экстракта, мл;
- общая масса изделия, г;
- масса образца, г.
Примечание - Это применимо только при экстракции порции изделия.
4.4.7.2 Расчет средней действующей дозы дпя сравнения с допустимыми значениями, представленными в 4.3
Для изделий постоянного контакта среднесуточную дозу в миллиграммах в день рассчитывают по формуле
![]() , (3)
, (3)
где 2500 - продолжительность жизни, сут;
- остаточное количество в экстракте, мг.
Изделия постоянного контакта также должны соответствовать допустимым значениям, установленным для изделий длительного и кратковременного контакта.
Для изделий длительного контакта
![]() , (4)
, (4)
где 30 - количество суток в месяце;
- остаточное количество в экстракте, мг.
Изделия длительного контакта также должны соответствовать допустимым значениям, установленным для изделий кратковременного контакта.
Для изделий кратковременного контакта
![]() . (5)
. (5)
5 Выпуск продукции
5.1 Общие положения
Изделия соответствуют настоящему стандарту, если они отвечают требованиям по содержанию ЭО и, при необходимости, ЭХГ. Если имеются соответствующие экспериментальные данные по диффузионной кинетике остаточных веществ, изделия для оценки их качества можно сгруппировать по сходству материалов, процессу изготовления и применению (см. приложение D).
Для выпуска партий изделий, стерилизованных ЭО, используют один из методов, описанных в 5.2 и 5.3.
5.2 Выпуск продукции без использования данных по кривым дегазации
Когда результаты по кривым дегазации изделий отсутствуют, изделия могут быть выпущены, если они соответствуют настоящему стандарту, а данные, полученные в результате исследований, проведенных по методикам, описанным в приложении К, соответствуют требованиям по содержанию ЭО и, при необходимости, ЭХГ, установленным в 4.3.
5.3 Процедура выпуска продукции с использованием кривых дегазации
Кривые дегазации используют для определения времени после стерилизации, необходимого для того, чтобы содержание остаточных веществ в изделиях или группах однородных изделий достигло значений, особенно в отношении значений ЭО, соответствующих требованиям 4.3. Изделия должны поставляться на рынок с учетом предварительно установленного времени после окончания стерилизации и условий, определяемых по экспериментальным кривым дегазации так, чтобы остаточные содержания ЭО в изделиях удовлетворяли требованиям 4.3. Вопросы дегазации продукции, изложенные в приложении D, следует рассматривать на основе данных о качестве стерилизованных партий, которые хранились в условиях контролируемой дегазации или карантина в разные времена года, если температуры дегазации различались. Для получения экспериментальных данных при построении кривых дегазации необходимо учитывать повторную стерилизацию продукта и наличие других, находящихся рядом, изделий, стерилизованных ЭО.
Выпуск изделий, произведенных и стерилизованных в контролируемых условиях, как описано в ISO 11135-1, осуществляют, если собраны данные минимум от трех партий изделий, простерилизованных в разное время. Миграция ЭО из большинства материалов и изделий протекает как кинетическая реакция первого порядка, то есть ([ЭО])
(время после стерилизации). График зависимости натурального логарифма экспериментально определенной концентрации ЭО от времени, прошедшего после стерилизации, линейный. Выпуск изделий определен временем, прошедшим после стерилизации, соответствующим точке пересечения средней линии регрессии со значением максимально допустимого уровня содержания остаточных веществ. Этот подход можно использовать для изделий, которые стерилизуются в количестве (число стерилизуемых партий), не достаточном для использования в методе, описанном ниже, или пока собираются данные по кривым дегазации. Возможно применение различных альтернативных методов; например, если кривые дегазации установлены, в результате чего образцы были исследованы, после того как были достигнуты предельные уровни остаточных веществ, интерполяция кривой дегазации может быть использована для установления выпуска продукта после стерилизации.
Использование для построения кривых дегазации регрессионного анализа данных, собранных в результате обработки достаточного числа временных точек, по меньшей мере, для трех партий изделий, обеспечивает выпуск изделий с допустимым содержанием остаточных веществ на прогнозируемом уровне с доверительной вероятностью 95%. Кривые времени - концентрация для изделий, выполненных из комбинации различных материалов, могут не соответствовать этой простой модели во всей рассматриваемой области и потребовать отдельного рассмотрения.
Прогнозируемый уровень вычисляют по формулам:
![]() , (6)
, (6)
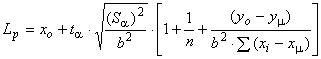 , (7)
, (7)
где - расчетное среднее значение времени выпуска изделия, соответствующее допустимому содержанию ЭО;
- значение логарифма допустимого содержания ЭО;
- отрезок прямой линейной регрессии, полученной от графика
[ЕО]
время;
- угол наклона линии регрессии;
- прогнозируемое предельное значение для одной единицы изделия;
- значение коэффициента Стьюдента при доверительной вероятности
с (
) степенями свободы;
![]() - дисперсия линии регрессии для остаточных веществ;
- дисперсия линии регрессии для остаточных веществ;
- среднее значение логарифма ЭО;
- число измеряемых величин;
- индивидуальное время, прошедшее с момента стерилизации, при котором были проведены измерения;
- среднее время, прошедшее с момента стерилизации;
![]() - сумма квадратов для х (время).
- сумма квадратов для х (время).
Все данные, используемые для выпуска медицинских изделий в соответствии с настоящим стандартом, должны быть получены в процессе экспериментов и анализов, выполненных по стандартизованным методикам.
При изменении условий стерилизации, перечисленных в приложении D, следует провести проверку содержания остаточных веществ в изделии. Если эта проверка показывает увеличение уровня остаточного содержания ЭО, чтобы убедиться в пригодности изделий, следует получить новые кривые дегазации остаточных веществ. Если эта проверка показывает снижение уровня остаточного содержания ЭО, нужно рассмотреть разработку новых кривых дегазации.
Примечание - Утверждение кривых дегазации обычно производят во время планового утверждения стерилизации в соответствии с ISO 11135-1.
Приложение А
(обязательное)
Оценка хроматограмм, полученных методом газовой хроматографии
А.1 Общие положения
В настоящем приложении установлен минимальный набор требований при выполнении аналитических методик, используемых для определения ЭО и ЭХГ. Эти требования относятся к системам газовой хроматографии как с наполненной, так и с капиллярной колонкой.
А.2 Источники
Эти требования приведены в справочниках по газовой хроматографии и перед выполнением определенной процедуры должны быть рассмотрены исследователем. Рекомендуется также обзор статей по пределам обнаружения [15], [35], [74].
А.3 Обозначения
Символы в таблице А.1 использованы в рисунках А.1 и А.2.
Таблица А.1 - Обозначения
Символ | Описание |
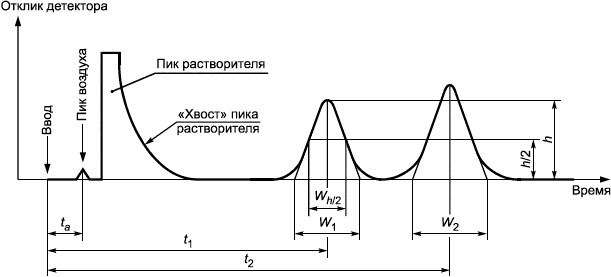
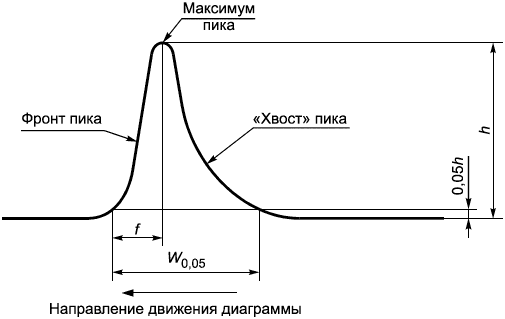
Расстояние от максимума пика до начала фронта пика | |
Фактор емкости | |
Разрешение | |
Фактор образования "хвоста" пика | |
Время удерживания основного пика определяемого остаточного вещества (ЭО или ЭХГ) | |
Время удерживания компонентов, не удерживающихся на колонке, таких как воздух | |
| Время удерживания хроматографических пиков 1 и 2, где |
| Соответствующая ширина пиков, экстраполированная к базовой линии для пиков 1 и 2, выраженная в тех же единицах, что и время удерживания |
Ширина пика на уровне 5% высоты |
А.4 Минимальные требования
А.4.1 Для выполнения методик рекомендуется, чтобы параметры отвечали следующим минимальным требованиям (см. рисунки А.1, А.2).
Разрешение рассчитывают по формуле
![]() . (А.1)
. (А.1)
Значение разрешения при расчете по площади или высоте пика должно быть больше или равно 2,0.
Альтернативно фактор емкости , который должен превышать 1,5 для пиков с хорошим разрешением, рассчитывают по формуле
![]() . (А.2)
. (А.2)
Фактор образования "хвоста" пика рассчитывают по формуле
![]() . (А.3)
. (А.3)
Значение "хвоста" пика для ЭО и ЭХГ должно быть меньше или равно 1,8.
А.4.2 Номинальное относительное отклонение калибровочного графика RSD не должно превышать 5% для ЭО и ЭХГ для ряда используемых контрольных растворов (см. ссылки [13] и [14]).
![]() , (А.4)
, (А.4)
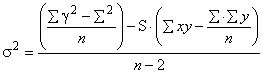 , (А.5)
, (А.5)
![]() , (А.6)
, (А.6)
где - общее количество исследованных образцов;
- площадь или высота хроматографического пика;
- среднее значение;
- концентрация контрольного раствора;
- стандартное отклонение;
- вариативность;
- наклон линии регрессии для калибровочного графика, рассчитанный по методу наименьших квадратов.
Эти критерии рассчитаны при многократных анализах, по крайней мере трех контрольных растворов, приготовленных таким образом, чтобы они охватывали всю линейную область калибровочного графика, используемого в анализе ЭО и ЭХГ.
А.5 Базовая линия хроматограммы
Рекомендуется, чтобы между отдельными хроматографическими измерениями базовая линия возвращалась на уровень, не превышающий 5% первоначальной базовой линии.
А.6 Дополнительные источники информации
Когда необходимо внести изменения в аналитические методики, изложенные выше, рекомендуют использовать следующие источники информации: руководство по эксплуатации используемого газового хроматографа, различные учебники по газовой хроматографии.
|
- время;
- реакции обнаружения; 1 - "ввод" (инъекция); 2 - пик воздуха; 3 - пик растворителя; 4 - растворитель "хвост"
Рисунок А.1 - Хроматографическое разделение двух веществ
|
Рисунок А.2 - Ассиметричный хроматографический пик
Приложение В
(справочное)
Газохроматографическое определение ЭО и ЭХГ
В.1 Хроматографические методики
В.1.1 Подготовка контрольных растворов
Исследователи должны убедиться в стабильности растворов, используемых для калибровки хроматографических процедур, и в том, что растворы не применяют после истечения установленного срока действия.
В.1.2 Общие положения
В следующих параграфах описана процедура приготовления растворов для ГХ. Обычно используют два варианта:
a) использование готовых растворов из коммерческих источников;
b) приготовление растворов либо волюмометрически - разведением известных объемов газа ЭГ, либо гравиметрически - разведением известной массы жидкого ЭО. Во всех случаях нужно подготовить калибровочный график значений высоты или площади пика относительно концентрации ЭО.
Примечание - При определении концентраций ЭО калибровка по площади пика с помощью программного обеспечения ГХ является более точной, чем измерение высоты пика.
Примеры процедур, применяемых для приготовления растворов ЭО и ЭХГ, приведены в приложении J.
В.2 Критерии валидации методов газовой хроматографии
В.2.1 Общее представление
Для количественного определения ЭО в экстрактах используют различные методы. Описан ряд методик проведения исчерпывающей экстракции с последующим определением ЭО методом газовой хроматографии. Возможно, также существует ряд неопубликованных методов для определения остаточного содержания ЭО. Опубликованные методы не всегда могут оказаться подходящими в связи с разнообразием изделий. Поэтому допускается использовать любой метод, являющийся аналитическим и отвечающий критериям, изложенным в настоящем стандарте.
Метод является аналитическим, когда он обладает соответствующими тщательностью, точностью, селективностью, линейностью, устойчивостью и чувствительностью, достаточными для определения конкретного уровня содержания ЭО в изделии, предназначенном для анализа на соответствие предельным значениям остаточных количеств, установленным в 4.3, и когда он применим к анализируемому изделию.
Несколько аналитических методов для оценки уровней остаточных количеств ЭО и ЭХГ были рассмотрены на основе данных научной литературы (см. библиографию). Для более детального ознакомления с каждым методом необходимо обратиться к оригинальным статьям. Далее перечислены рекомендуемые критерии для утверждения метода.
В.2.2 Точность
Точность является измерением близости результатов теста, полученных методом тестирования, к истинному значению. Точность выражается в терминах восстановления, измеряемой величины, выражаемой как процент принятого или истинного значения. Она требует сравнения измерения методом тестирования с известной величиной. Известная величина может быть приготовлена из аналита известной чистоты или из образцов с внутренним контролем.
Образцы с внутренним контролем как средство определения тщательности могут быть отражены как процентное восстановление известного добавленного количества аналита к образцу. Тем не менее для ЭО данный метод определения тщательности является очень сложным для выполнения из-за летучести данного соединения. В качестве альтернативы рекомендуется применение коммерчески доступных сертифицированных растворов. Таким образом измерение тщательности становится средними измеренными результатами, поделенными на принятую истинную величину вместе с доверительным интервалом. В любом случае процентное восстановление может быть вычислено как
![]() , (В.1)
, (В.1)
где - восстановление, %;
- полученный результат;
или
- принятая или истинная величина.
Тщательность следует оценивать с использованием по меньшей мере девяти определений при минимум трех уровнях концентрации, захватывающих определенный диапазон (т.е. три повтора на каждой из трех разных концентраций).
В.2.3 Прецизионность
В.2.3.1 Общее представление
Прецизионность является измерением того, насколько близко значения данных находятся друг к другу для ряда измерений при тех же аналитических условиях. Прецизионность содержит три компонента: повторяемость, промежуточная точность и воспроизводимость.
В.2.3.2 Повторяемость
Воспроизводимость может быть оценена при использовании по меньшей мере девяти определений, захватывающих определенный диапазон применяемых растворов (т.е. три повтора на каждой из трех разных концентраций). Данные, полученные по точности метода, такие как в В.2.2, могут быть использованы для оценки повторяемости.
Повторяемость может быть вычислена как относительное стандартное отклонение (коэффициент вариации) пиковой области как обозначено в уравнении (приложение А.4).
Процент RSD (отклонения калибровочного графика) для ЭО и ЭХГ не должен превышать 5% для диапазона используемых растворов. Процент RSD вычисляют как описано в А.4.2.
В.2.3.3 Промежуточная точность
Промежуточную точность оценивают установлением эффектов случайных событий на точность аналитической процедуры. Примером случайных эффектов могут быть дни, исследователи, оборудование и т.д. Необязательно изучать эти события по отдельности. Рекомендуется применение экспериментального плана (матрицы).
Для обозначения промежуточной точности тестового метода рекомендуется использовать данные, полученные, как описано в В.2.2, для тщательности по меньшей мере двух отдельных событий. Необходимо включить в отчет стандартное отклонение, относительное стандартное отклонение (коэффициент вариации) и доверительный интервал.
В.2.3.4 Устойчивость/воспроизводимость
Устойчивостью аналитического метода является степень воспроизводимости результатов исследования, полученных анализом тех же образцов при различных условиях, таких как разные лаборатории, разные исследователи, разные инструменты, разные партии реагентов, разные длительности времени проб, разные температуры проб, разные дни и т.д. Выносливость обычно выражена как отсутствие влияния на результаты анализов переменных рабочей и окружающей среды аналитического метода. Выносливость является измерением воспроизводимости исследования при вариации условий, обычно ожидаемых от лаборатории к лаборатории и от исследователя к исследователю.
Так как процедура утверждения будет производиться в отдельной лаборатории для введения новой колонки или нового метода, данная часть утверждения может быть выполнена путем комбинирования различных исследователей, различных дней, различных инструментов и т.д. Воспроизводимость обычно не ожидается, если достигнута промежуточная точность. Межлабораторные исследования в данной части не являются важными.
В.2.4 Линейность
Линейность является измерением корреляции между ответом метода и концентрацией аналита. Линейность должна быть установлена по диапазону применяемых растворов. Анализ регрессии стандартной концентрации по сравнению с пиковой площадью или пиковой высотой следует выполнять с использованием по меньшей мере пяти концентраций.
Исследователь должен определить линейность данных калибровки вместе с воспроизводимостью наклона и отрезка. Минимальный коэффициент корреляции для стандартной кривой должен составлять 0,95.
В.2.5 Ограничение метода определения MDL
В.2.5.1 Общее представление
Предел обнаружения метода является наименьшим количеством, которое может быть обнаружено с разумной уверенностью. Предел обнаружения может быть определен путем анализа образцов с известными концентрациями аналита и установления минимального уровня, при котором аналит может быть достоверно обнаружен.
Существует много способов определения предела обнаружения метода. Кроме перечисленных ниже могут быть приемлемыми и другие подходы.
В.2.5.2 MDL на основе "сигнал/шум"
Определение соотношения "сигнал/шум" производят путем сравнения измеренных сигналов от образцов с известными низкими концентрациями аналита с сигналами от контрольных образцов и установления минимальной концентрации, при которой аналит может быть достоверно обнаружен. Соотношение "сигнал/шум" 3:1 обычно является приемлемым.
В.2.5.3 MDL на основе стандартного отклонения ответа
Для определения предела обнаружения метода следует приготовить известный раствор нужного аналита, приближаясь к примерному MDL, и определить стандартное отклонение для семи инъекций раствора.
![]() , (B.2)
, (B.2)
где - стандартное отклонение инъекций;
- значение
Стьюдента при
степени свободы при 99% уровня достоверности.
В.2.6 Предел количественного обнаружения (QL)
В.2.6.1 Общее представление
Предел количественного обнаружения обычно определяется анализом образцов с известными концентрациями аналита и определением минимального уровня, при котором аналит может быть измерен количественно с приемлемыми тщательностью и точностью.
Существует много способов определения предела количественного обнаружения. Кроме перечисленных ниже могут быть приемлемыми и другие подходы.
В.2.6.2 QL на основе "сигнал/шум"
Определение соотношения "сигнал/шум" производят путем сравнения измеренных сигналов от образцов с известными низкими концентрациями аналита с сигналами от контрольных образцов и установления минимальной концентрации, при которой аналит может быть достоверно измерен количественно. Соотношение "сигнал/шум" 10:1 обычно является приемлемым.
В.2.6.3 QL, основанный на стандартном отклонении ответа
Предел количественного обнаружения может быть выражен как
![]() . (В.3)
. (В.3)
Приложение С
(справочное)
Блок-схема и руководство по применению настоящего стандарта для определения остаточных количеств этиленоксида и этиленхлоргидрина в медицинских изделиях
С.1 История
Данное приложение предлагает руководство по применению отдельных частей серии ISO 10993 при биологической оценке медицинских изделий, которые были стерилизованы ЭО. Данное приложение в основном относится к применению настоящего стандарта, но ограниченное руководство также приведено для других частей серии ISO 10993.
Настоящий стандарт обозначает требования для установления допустимых пределов для остаточных количеств ЭО и аналитические процедуры, демонстрирующие, что изделие, стерилизованное ЭО, соответствует допустимым пределам. Также обозначены максимально допустимые пределы для остаточных количеств ЭХГ, если он был обнаружен в медицинских изделиях, стерилизованных ЭО. Для ЭГ пределы воздействия не были установлены, так как оценка риска показала, что при контроле остаточных количеств ЭО наличие биологически значительных остаточных количеств ЭГ маловероятно. Доза пациенту является основой устанавливания допустимых пределов и эталонного метода для демонстрации соответствия настоящему стандарту. Второй параграф предисловия отмечает, что при разработке и планировании продукта необходимо рассмотреть альтернативные материалы и методы стерилизации для сведения к минимуму воздействия остаточных количеств ЭО.
В дополнение к требованиям настоящего стандарта изделие, стерилизованное ЭО, должно отвечать требованиям биологического тестирования других частей серии ISO 10993. Требования других частей серии ISO 10993 также должны учитывать.
Существуют определенные обстоятельства (например, серьезная операция), когда необходимость использования по жизненным показаниям терапии значительно изменяет анализ рисков и преимуществ использования медицинского изделия, стерилизованного ЭО. Предельно допустимые дозы ЭО, приведенные в 4.3, основаны на рисках и преимуществах, связанных с менее критическими ситуациями. Следовательно, существует диапазон снижения предлагаемых пределов в тех ситуациях, где существует угроза для жизни, если соблюдение обозначенных пределов не является возможным.
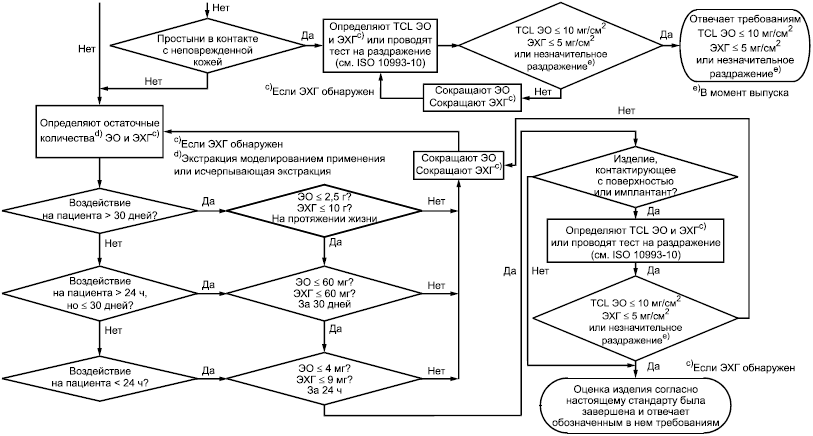
Данное приложение включает блок-схему, предназначенную для лучшего понимания этапов, необходимых для применения настоящего стандарта. Блок-схема показывает точки принятия решения и предоставляет руководство для выбора соответствующих действий, если в стандарте приводят различные варианты. Отдельные части руководства представляют собой практические способы применения стандарта к различным продуктам, основываясь на таких факторах, как: природа воздействия; длительность воздействия; частота применения; особые случаи при применении (например, как приведено в 4.3.6); размер продукта. Блок-схема сопровождается более подробным текстом. Дополнительно таблица С.1 предоставляет четкий обзор допустимых пределов для медицинских изделий в различных категориях.
Подраздел 4.4 приводит требования для обнаружения остаточных количеств ЭО и ЭХГ, а аналитические процедуры описаны в приложении В. Условия экстракции для определения остаточных количеств ЭО приведены в приложении Е. Руководство по разработке подходящей процедуры экстракции, моделирующей условия применения, приведено в С.З. Это позволяет пользователям разработать и отразить документально обоснование для соответствующей процедуры экстракции, моделирующей условия применения, для своих продуктов, стерилизованных ЭО.
Аналитическая лаборатория должна сотрудничать с производителем изделия, чтобы продемонстрировать, что экстракция, моделирующая условия применения, проводится при условиях, предоставляющих наибольшую нагрузку при предназначенном использовании. Моделирование применения продукта следует проводить с учетом того, что изделие отнесено к наиболее жесткой категории на всю длительность воздействия и принимая во внимание контактирующие ткани и температуру воздействия.
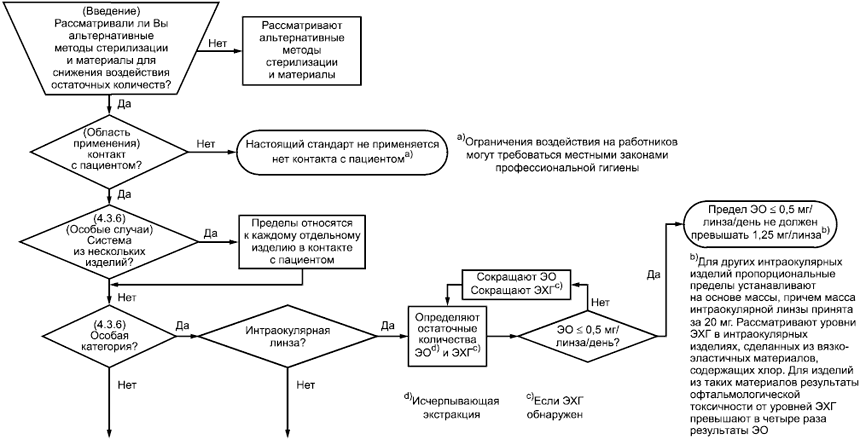
Данный текст следует применять в сочетании с блок-схемой на рисунке С.1.
Таблица С.1 - Обзор допустимых предельных доз ЭО и ЭХГ для изделий
Продолжительность контакта изделия с тканями пациента | ЭО | ЭХГ |
Кратковременный (<24 ч) | 4 мг | 9 мг |
Длительный (>24 ч <30 д) | 60 мг/30 д | 60 мг/30 д |
Постоянный (>30 д) | 2,5 г/в течение жизни | 10 г/в течение жизни |
Предельное значения допустимой дозы TCL | 10 мкг/см | 5 мг/см |
Интраокулярная линза | 0,5 мкг/линза/д | См. 4.2 допустимые предельные значения ЭО |
Сепаратор клеток крови (аферез) | 10 мг | 22 мг |
Оксигенаторы крови | 60 мг | 45 мг |
Устройства сердечно-легочного шунтирования | 20 мг | 9 мг |
Устройства очистки крови (гемодиализаторы) | 4,6 мг | 4,6 мг |
Простыни, вступающие в контакт с неповрежденной кожей | 10 мкг/см | 5 мг/см |
С.2 Руководство
С.2.1 При разработке и планировании продукта необходимо рассмотреть альтернативные материалы и методы стерилизации в целях сведения к минимуму воздействия остаточных веществ. Обоснование и основа для этого решения должны быть отражены документально.
С.2.2 Если изделие не имеет контакта с пациентом, настоящий стандарт не применяют
.
_______________
Примеры включают диагностические устройства in vitro, покрытия для инструментального стола, покрытия для стойки "Мэйо", рукоятки освещения и т.д.
Ограничения воздействия на работников могут требоваться местными законами профессиональной гигиены.
С.2.3 Если это система из нескольких изделий, пределы применяют к каждому отдельному изделию в контакте с пациентом.
С.2.4 Если изделие относится к особой категории, применимо следующее.
a) Если изделие является интраокулярной линзой, то предельные значения допустимой дозы 0,5 мкг/линза/сут, не превышая 1,25 мкг в сумме. Предельные значения допустимой дозы для других интраокулярных изделий могут быть пропорционально рассчитаны на основе массы изделия, при том что масса интраокулярной линзы берется как 20 мг. Если остаточные количества ЭО контролируют, как обозначено для интраокулярных изделий, то маловероятно, что будут в наличии значительные количества ЭХГ. Это может не являться верным для интраокулярных изделий из вязко-эластичных материалов, содержащих хлор. В таких случаях ссылки [44], [118], [119] и [120] отмечают, что уровень ЭХГ, приводящий к офтальмологической токсичности, примерно в четыре раза выше, чем соответствующий уровень ЭО. Это нужно учитывать при оценке приемлемости уровней ЭХГ, связанных с этими изделиями.
_______________
Процедура исчерпывающей экстракции, как обозначено в таблице Е.1 и определено в 3.2, требуется для определения остаточных количеств ЭО. Исследователь должен установить и отразить документально примененную процедуру.
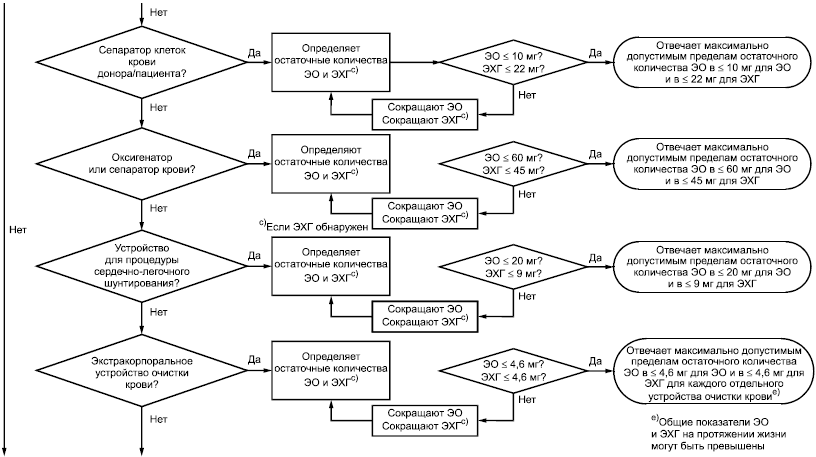
b) Если изделие является сепаратором клеток крови, применяемым при заборе крови донора и пациента, определяют остаточные количества ЭО и ЭХГ. Максимально допустимый предел для ЭО и ЭХГ не должен превышать 10 и 22 мг на изделие соответственно. Если эти предельные значения превышены, моделируют применение продукта для определения остаточных количеств ЭО путем экстракции изделия при температуре 37°С продолжительностью до 24 ч, но не менее 1 ч (см. С.3.2 и С.3.3). Если ЭО при моделировании применения превышает 10 мг и/или ЭХГ при моделировании применения превышает 22 мг, сокращают ЭО и/или ЭХГ; в других случаях требования к остаточным количествам ЭО и ЭХГ удовлетворены, если выполнены требования, отмеченные в сноске к С.2.9.
_______________
Процедура исчерпывающей экстракции может не быть практичной для этих продуктов, в этом случае следует применить процедуру, моделирующую применение.
c) Если изделие является оксигенатором или сепаратором крови, следует определить остаточные количества ЭО и ЭХГ. Максимально допустимая доза ЭО пациенту не должна превышать 60 мг, а максимально допустимая доза ЭХГ - 45 мг. Если превышение происходит, определяют остаточные количества ЭО моделированием применения продукта путем экстракции изделия при температуре 37°С продолжительностью не более 24 ч, но не менее 1 ч (см. С.3.2 и С.3.3). Если ежедневная доза ЭО и/или ЭХГ при моделировании применения продукта превышает 60 и/или 45 мг соответственно, сокращают ЭО и/или ЭХГ. В других случаях, если ежедневная доза ЭО не более чем 60 мг и/или ежедневная доза ЭХГ менее 45 мг, требования к остаточным количествам ЭО и ЭХГ для данного изделия выполнены.
_______________
Процедура исчерпывающей экстракции может не быть практичной для этих продуктов, в этом случае следует применить процедуру, моделирующую применение.
d) Если изделие используют в процедуре сердечно-легочного шунтирования, определяют остаточные количества ЭО и ЭХГ. Максимально допустимая ежедневная доза ЭО пациенту не должна превышать 20 мг, а максимально допустимая доза ЭХГ - 9 мг.
e) Если изделие применяют для очистки крови, предельные значения ЭО и ЭХГ не должны превышать 4,6 мг на изделие, но допустимая доза ЭО и ЭХГ в течение жизни может быть превышена.
f) Если изделие является простыней в контакте с неповрежденной кожей, TCL должен быть 10 мкг/смдля ЭО и 5 мг/см
для ЭХГ или простыня должна причинять незначительное раздражение, как обозначено в ISO 10993-10.
С.2.5 Если изделие не относится к особой категории, как описано в С.2.4, определяют остаточные количества ЭО и ЭХГ.
_______________
Исчерпывающая или моделирующая применение процедура экстракции, как обозначено в таблице Е.1 и определено в 3.1 и 3.2, необходима для определения остаточных количеств ЭО. Исследователь устанавливает и отражает документально примененную процедуру. Для очень крупных продуктов процедура исчерпывающей экстракции может не быть практичной. В таких случаях продолжают по С.2.6 и выполняют требование использовать процедуру моделирования применения для соответствующей категории длительности.
С.2.6 Для изделий постоянного воздействия (в контакте с пациентом более чем 30 дней и на протяжении жизни) выполняют следующие требования:
a) Если измеренные остаточные количества ЭО и ЭХГ не превышают 2,5 и 10 г соответственно, переходят к С.2.6 b). В других случаях используют соответствующие температуры (37°С или 25°С) и продолжительности времени (основываясь на ожидаемом времени применения) с водой в качестве экстрагирующей среды для моделирования применения изделия (см. С.3). Если измеренная доза ЭО не более чем 2,5 г или измеренная доза ЭХГ не более чем 10 г, если ЭХГ был обнаружен, переходят к С.2.6 b). В других случаях сокращают ЭО и/или ЭХГ;
b) Если измеренные остаточные количества ЭО и ЭХГ не превышают 60 мг, переходят к С.2.6 с). В других случаях используют соответствующие температуры (37°С или 25°С) в течение 30 сут с водой в качестве экстрагирующей среды для моделирования применения изделия (см. С.3). Если измеренная доза ЭО и ЭХГ (если ЭХГ был обнаружен) не превышает 60 мг, переходят к С.2.6 с). В других случаях сокращают ЭО и/или ЭХГ, как в С.2.6 а) и с);
c) Если измеренные ЭО и ЭХГ не превышают 4 и 9 мг соответственно, переходят к С.2.9. В других случаях используют соответствующие температуры (37°С или 25°С) 24 ч с водой в качестве экстрагирующей среды для моделирования применения продукта (см. С.3). Если измеренные дозы ЭО и ЭХГ при моделировании применения не превышают 4 или 9 мг соответственно, переходят к С.2.9. В других случаях сокращают ЭО и/или ЭХГ.
С.2.7 Для изделий длительного применения (контакт с пациентом более чем 24 ч до 30 сут) выполняют следующие действия.
Если измеренные ЭО и/или ЭХГ не превышают 60 мг, переходят к С.2.6 с). В других случаях используют соответствующие температуры (37°С или 25°С) и продолжительности времени (основываясь на ожидаемом времени применения) с водой в качестве экстрагирующей среды для моделирования применения изделия (см. С.3). Если измеренная доза ЭО и ЭХГ (если ЭХГ был обнаружен) не превышает 60 мг, переходят к С.2.6 с). В других случаях сокращают ЭО и ЭХГ.
С.2.8 Для изделий кратковременного применения (контакт с пациентом до 24 ч) выполняют следующие действия:
Если измеренные остаточные количества ЭО и ЭХГ не превышают 4 и 9 мг соответственно, переходят к С.2.9. В других случаях используют соответствующие температуры (37°С или 25°С) и продолжительности времени (основываясь на ожидаемом времени применения, но по меньшей мере 1 ч) с водой в качестве экстрагирующей среды для моделирования применения изделия (см. С.3). Если измеренные дозы ЭО и ЭХГ при моделировании применения не превышают 4 и 9 мг соответственно, переходят к С.2.9. В других случаях сокращают ЭО и/или ЭХГ.
С.2.9 Изделие не должно иметь раздражающего действия с количеством ЭО и ЭХГ, разрешенным на изделии в момент выпуска. Если изделие контактирует с поверхностью или имплантируемое, это означает, что пределы переносимого контакта TCL для ЭО и ЭХГ не должны превышать 10 и 5 мг/см соответственно или что изделие должно причинять незначительное раздражение как обозначено в ISO 10993-10. В других случаях оценка изделия согласно настоящему стандарту завершена
.
_______________
Соответствие требованиям биологического тестирования для каждого отдельно созданного медицинского изделия как обозначено в ISO 10993-1, а также пределам остаточных количеств процесса стерилизации ЭО формируют обоснование того, что изделие, стерилизованное ЭО, приемлемо для применения с точки зрения его биологической оценки.
С.3 Моделирование процедуры экстракции
С.3.1 Экстракционная жидкость
Необходимо использовать воду для экстракции остаточных количеств ЭО моделированием применения (см. ссылку [92]).
С.3.2 Температура экстракции
Экстрагируют изделия полностью или частично контактирующие с телом при применении при температуре 37°С, а изделия, не имеющие прямого контакта с телом при применении (например, шприцы для подкожных инъекций) при температуре 25°С. Когда изделия экстрагируют при температуре 37°С, оценивают конверсию ЭО в ЭГ.
С.3.3 Время экстракции
При установлении времени экстракции рассматривают ожидаемый разумный в худшем случае диапазон временных отрезков, в которые рекомендовано или ожидаемо использование изделия. Дополнительно может быть полезным собрать данные для установления скорости экстракции ЭО и ЭХГ из изделия при температуре использования, установленной в С.3.2 (п.4.4.6.2). Оценивают эти данные или другую соответствующую информацию для определения времени экстракции, подходящего для изделия, которое учитывает имеющиеся данные. Минимальное время экстракции - 1 ч.
С.3.4 Экстракция изделия
Если требуется предварительная обработка изделия перед применением, проводят эту обработку перед экстракцией изделия. Если изделие наполняют для экстракции, то стараются избегать механических воздушных пузырей. Проводят водную экстракцию изделия при установленных показателях температуры и времени. Если применение изделия включает циркуляцию жидкостей (например, кровь, жидкость для диализа), экстрагируют изделие, используя воду для имитации циркуляции жидкости способом, соответствующим применению продукта. Обращают внимание, что, когда кровь возвращается из изделия к пациенту, необходимо предполагать, что любые остаточные количества ЭО останутся в организме. Таким образом, вода, имитирующая кровь, проходящую из изделия к пациенту, не должна циркулировать повторно. Отражают документально обоснование для созданных условий.
С.3.5 Группирование изделий
Изделия одинакового дизайна, но разных размеров могут быть объединены, и наиболее плохой случай выбран для тестирования как репрезентативный для группы. Отражают документально обоснование этого решения.
С.3.6 Комплекты и наборы изделия
Изначально определяют остаточные количества в комплектах и наборах для каждого изделия, абсорбирующего ЭО и ЭХГ в контакте с пациентом, и устанавливают наихудший случай изделия или изделий. Дополнительные данные могут затем быть собраны, используя наихудшие случаи. Отражают документально обоснование решения.
|
Рисунок С.1 - Блок-схема, отображающая этапы, необходимые для применения настоящего стандарта
|
Рисунок С.2 - Блок-схема, отображающая этапы, необходимые для применения настоящего стандарта (продолжение рисунка С.1)
|
Рисунок С.3 - Блок-схема, отображающая этапы, необходимые для применения настоящего стандарта (продолжение рисунка С.2)
Приложение D
(справочное)
Факторы, влияющие на содержание остаточных веществ в изделии
D.1 Параметры процесса стерилизации
D.1.1 Общий обзор
Параметры определены в ISO 11135-1. Однако, касаясь определения содержания остаточных веществ в изделиях, обработанных ЭО, необходимо выяснить, какие именно параметры влияют на уровень содержания остаточных веществ. Понимание кинетики миграции ЭО позволяет охарактеризовать целое семейство однотипных изделий, анализируя образец с наибольшим содержанием остаточного ЭО. Выделение семейства однотипных изделий, то есть изделий, сходных по размеру и применению, составу материала, упаковке, содержанию воды, подвергавшихся воздействию ЭО и окружающих условий, может исключить необходимость проведения анализа изделий каждого вида. Ниже приведены параметры, которые влияют на содержание остаточных веществ и могут потребовать проведения анализа одного или более с наибольшим содержанием остаточного ЭО образцов.
D.1.2 Состав материала
Материалы могут различаться в значительной степени по своей способности абсорбировать, удерживать и десорбировать ЭО. Когда возможно превращение ЭО в ЭХГ, появляется вероятность, что состав остаточных веществ будет весьма различен для двух сходных изделий, изготовленных из различных материалов. Например, материалы, содержащие источник свободных хлорид-ионов, дают большой разброс в концентрации образующегося ЭХГ.
Аналогично, чтобы убедиться в достоверности результатов анализа целого изделия, в состав которого входят два различных материала, может потребоваться проведение анализа представительных образцов обоих материалов. Состав и размеры исследуемого образца играют особенно важную роль, когда рассматривают модель, отражающую условия применения изделий в медицинской практике.
D.1.3 Упаковка
Упаковочные материалы сильно отличаются по своей способности пропускать и удерживать как ЭО, так и другие возможные остаточные вещества, что может, в свою очередь, влиять на остаточное содержание ЭХГ. Дополнительные источники разброса - плотность упаковки и плотность грузовых контейнеров.
D.1.4 Цикл стерилизации ЭО
Условия процесса обработки изделия ЭО влияют на содержание остаточных веществ. Эти условия включают в себя концентрацию газа, время обработки, температуру, вид обработки (то есть используют чистый ЭО или смесь, содержащую ЭО), влажность (включая качество источника воды), воздушную продувку, плотность самих изделий и плотность их загрузки при стерилизации, а также расположение партии изделий в стерилизаторе.
D.1.5 Дегазация
Остаточное содержание ЭО в изделиях также зависит от температуры дегазации, плотности и расположения партии изделий при дегазации, воздушного потока, процесса загрузки, площади поверхности изделий, которые подвергаются дегазации, и времени дегазации. Для ряда материалов известно, что при увеличении температуры на каждые 10°С скорость дегазации может вырастать почти вдвое (время дегазации уменьшается наполовину).
Влажность, температура и воздушный поток могут повлиять на образование ЭХГ, зависящее от содержания ЭО в изделии после удаления из стерилизатора.
Исследователи должны иметь информацию о сезонных колебаниях в скорости дегазации, если лабораторные условия хранения образцов отличаются от условий хранения на складе. При определенных обстоятельствах, которые лучше всего могут быть определены опытным путем, может оказаться необходимым до начала анализа держать образцы при температуре, близкой к наименьшей температуре, при которой изделия будут храниться во время дегазации.
D.1.6 Отбор образца
При оценке результатов анализа в следующих случаях соблюдают осторожность:
- когда образцы изделий регулярно отбирают для анализа из стерилизуемой партии вскоре после окончания процесса стерилизации;
- когда образцы изделий или экстрактов из них переносят на место анализа, расположенное удаленно от места стерилизации.
В таких случаях возникает возможность появления ошибок, связанных с распространением результатов определения количества остаточных веществ в образцах на всю партию. Следует экспериментально установить связь между этими условиями.
D.2 Контроль переменных величин
При наличии достаточных экспериментальных данных по диффузионной кинетике остаточных веществ (то есть по скорости улетучивания газообразного ЭО из упаковки для ряда конкретных изделий) изделия могут быть сгруппированы для оценки их качества на основании сходства материалов, процессов производства и применения. Чтобы такая система классификации была действенна, необходимо контролировать переменные условия, рассмотренные выше. Недостаточность контроля может привести к тому, что данные анализа уровней остаточных веществ окажутся применимы лишь к анализируемым образцам.
Приложение Е
(справочное)
Условия экстракции для определения остаточного содержания ЭО
Условия экстракции для определения остаточного содержания ЭО для демонстрации соответствия с настоящим стандартом изложены в 4.4. Рекомендуемые условия экстракции, которые могут облегчить лабораторные операции, представлены в таблице Е.1.
Конкретные методы исчерпывающей экстракции и экстракции, моделирующей условия применения, приведены в 4.4.6.2 и 4.4.6.3.
Таблица Е.1 - Предлагаемые условия экстракции
Продолжительность контакта с изделием (см. 4.3) | ||
Постоянный контакт (более 30 сут) | Длительный контакт (от 24 ч до 30 сут) | Кратковременный контакт (менее 24 ч) |
Исчерпывающая экстракция | Экстракция, моделирующая условия применения | Экстракция, моделирующая условия применения |
Если, согласно 3.2, требуется процедура исчерпывающей экстракции, она может не являться практичной для больших и/или сложных изделий. В таких случаях может быть необходимым экстрагировать репрезентативные порции изделия, а затем экстраполировать результат на все изделие (также см. п.4.4.6).
В некоторых исключительных случаях, когда экстракция, моделирующая применение, не является ни возможной, ни практичной (например, для больших изделий, контактирующих с поверхностью, таких как халаты или простыни), доза ЭО, перенесенная на пациента, может быть вычислена на основе пропроциональности весу или площади поверхности, используя, например, подход фактора редукции переноса, описанный в разделе "Воздействие" при применении в [154].
Приложение F
(справочное)
Логическое обоснование введения предельных значений
б F.1 Общие положения
Настоящее приложение содержит пояснения к введению предельных значений остаточного содержания ЭО в медицинских изделиях после стерилизации в зависимости от продолжительности контакта. Сюда также включено обоснование введения предельных значений для ЭО, ЭХГ и ЭГ.
F.2 Обоснование особых случаев
F.2.1 Общие положения
Существуют особые обстоятельства, например обширные хирургические операции, когда лечение, спасающее жизнь, значительно изменяет отношение к учету риска. Приведенные здесь предельные значения, зависящие от длительности воздействия, основаны на учете преимуществ и недостатков в менее критических условиях. Таким образом, ISO 10993-17 позволяет изменения пользы от изделия в допустимых пределах в индивидуальных случаях. Вследствие этого существует диапазон, в котором могут изменяться предельные значения в тех ситуациях, когда идет борьба за жизнь и невозможно соблюдать требования, установленные к предельным значениям. Также может появиться необходимость ужать предельные значения в конкретных ситуациях, если того требует оценка риска.
В процессе разработки настоящего стандарта было признано, что существуют шесть особых случаев, когда предельные значения, приведенные в 4.3, практически не будут обусловлены ограничениями, связанными с самими изделиями, а также существуют данные, полученные при проведении исследований на человеке, которые указывают, что уровни доз, представленные в 4.3, неприменимы. Были получены данные на пациентов с интраокулярными линзами, которые следует учитывать при пересмотре требований по содержанию остаточных веществ в таких изделиях. Сепараторы клеток крови, используемые при заборе крови донора и пациента, могут быть многократно использованы, и было показано, что доноры и пациенты сенсибилизируются к ЭО. Допустимые предельные значения ЭО для этих изделий должны быть снижены для сведения к минимуму возможности сенсибилизации. Признано, что при обработке крови в оксигенаторах, или сепараторах, или устройствах для сердечно-легочного шунтирования польза перевешивает риск применения таких изделий, и это вызывает необходимость рассмотрения допустимых кратковременных пределов для таких изделий. В случае использования устройств для экстракорпоральной очистки крови в течение длительного времени может возникнуть потребность в превышении максимальной дозы на протяжении жизни, и это тоже требует рассмотрения. В случае простыней, контактирующих с неповрежденной кожей, не ожидается какой-либо системной токсичности, и безопасность пациента должна быть гарантирована соответствием требованиям TCL или теста на раздражение.
F.2.2 Предельные значения для интраокулярных линз
Предельное значение для остаточных веществ в интраокулярных линзах (изделия, имплантируемые в глаз) составляет 0,5 мкг ЭО на линзу в день. Это предельное значение не соответствует предельным значениям при постоянном воздействии со средней дневной дозой в 0,1 мг (100 мкг) в день в течение всей жизни. Это особый случай, в котором максимальная действующая доза не должна превышать предельного значения 0,5 мкг/сут на линзу. Такое ограничение необходимо для того, чтобы предотвратить раздражающее действие ЭО на ткани глаза (см. ссылки [44], [117], [118], [119] и [167]). Пропорционально рассчитанные предельные значения применяют для других интраокулярных изделий на основе массы изделия, причем массу интраокулярной линзы принимают равной 20 мг.
Если остаточные количества ЭО контролируют, как указано для интраокулярных изделий, маловероятно, что будут в наличии значительные количества ЭХГ. Это может не быть верным для интраокулярных изделий, сделанных из вязко-эластичных материалов, содержащих хлор. В таких случаях ссылки [44], [117], [118] и [119] указывают, что уровень ЭХГ, приводящий к офтальмологической токсичности, примерно в четыре раза выше, чем соответствующий уровень ЭО. Это необходимо принимать во внимание при оценке приемлемости уровней ЭХГ, связанных с такими изделиями.
F.2.3 Сепараторы клеток крови, применяемые в заборе крови донора или пациента
Максимально допустимым предельным значением для ЭО является 10 мг на изделие. Максимально допустимое предельное значение для ЭХГ не должно превышать 22 мг на изделие. Эти изделия используют для забора афереза. Этот предел учитывает многократное использование таких изделий с индивидуальными донорами или пациентами.
В данном случае предположенное по умолчанию одновременное использование пяти изделий кажется достаточно консервативным. Если предположить, что только два изделия имеют худшие результаты, UTF увеличится с 0,2 до 0,5. Это повысит допустимый предел до 10 мг ЭО (округлен с 10,5 мг) (см. уравнения F.1 и F.2).
Для ЭО:
![]() . (F.1)
. (F.1)
Для ЭХГ:
![]() . (F.2)
. (F.2)
F.2.4 Оксигенаторы и сепараторы крови
Предельное значение допустимой дозы для таких изделий составляет 60 мг для ЭО и 45 мг для ЭХГ за 24 ч. Данные изделия применяют в ряде серьезных операций, таких как хирургические операции на открытом сердце. Такие процедуры проводят на индивидуальных пациентах не более чем один или два раза на протяжении жизни. Так как эти изделия применяют один день или менее, стандартный UTF в 0,2 кажется чересчур консервативным. UTF в 1,0 кажется более разумным. При таком UTF допустимый предел увеличится до 21 мг ЭО и 45 мг ЭХГ (см. уравнения F.3 и F.4). Предел ЭО отражает текущую способность производителя удалять ЭО из этих достаточно больших изделий. При таких обстоятельствах это дальнейшее трехкратное смягчение предела ЭО обосновано.
Для ЭО:
![]() . (F.3)
. (F.3)
Учитывая один день применения или менее: 21 мг/сут·1 сут = 21 мг/изделие.
Для ЭХГ:
![]() . (F.4)
. (F.4)
Учитывая один день применения или менее: 44,8 мг/сут·1 сут = 44,8 мг/изделие.
F.2.5 Изделия, применяемые при сердечно-легочном шунтировании
Предельным значением допустимой дозы для таких изделий является 20 мг для ЭО в 24-часовой период. Эти изделия применяют в ряде серьезных операций, таких как хирургические операции на открытом сердце. Такие процедуры проводят на индивидуальных пациентах не более чем один или два раза на протяжении жизни. Так как эти изделия используют один день или менее, стандартный фактор утилизации (UTF) в 0,2 кажется чересчур консервативным. UTF в 1,0 кажется более разумным. При таких обстоятельствах это дальнейшее трехкратное смягчение предела ЭО обосновано. Пределы для ЭХГ применимы.
Для ЭО:
![]() . (F.5)
. (F.5)
Примечание - Обратить внимание, это значение округлено до 20 мг/сут для этих изделий.
Учитывая один день применения или менее: 20 мг/д·1 сут = 20 мг/изделие.
F.2.6 Устройства для экстракорпоральной очистки крови
Эти изделия применяются для пациентов многократно, часто в течение многих лет. При установлении допустимых предельных значений для этих изделий необходимо учитывать пользу, полученную от очистки крови. Максимально допустимое предельное значение для каждого изделия, применяемого на пациента, было установлено с учетом использования тринадцати (13) таких изделий в каждый месяц при условии максимально допустимого предела как одну тринадцатую максимально допустимого предела за 30 дней, которым является 4,6 мг для ЭО и 4,6 мг для ЭХГ. Максимально допустимая доза ЭО в 2,5 г на протяжении жизни может быть превышена, если соблюден допустимый предел ЭО в 4,6 мг при каждом использовании. Дополнительно максимально допустимая доза ЭХГ в 10 г на протяжении жизни может быть превышена, если соблюден допустимый предел ЭХГ в 4,6 мг при каждом использовании. Чтобы превысить дозу ЭО в 2,5 г на протяжении жизни, пациент, подвергающийся очистке крови, должен получать 4,6 мг ЭО 13 раз каждый месяц, и такое воздействие должно продолжаться 3,5 года. Таким же образом, предельно допустимая доза ЭХГ на протяжении жизни может быть превышена после примерно 14 лет применения пациентами в терминальной стадии заболевания почек.
Для ЭО:
- Доза на протяжении жизни в 2,5 г = 2500 мг.
- Максимально допустимой дозой ЭО при использовании 13 экстракорпоральных изделий очистки крови в месяц является 60 мг.
- т.е. потребуется 2500 мг/(60 мг/мес) = 42 мес или примерно 3,5 года, чтобы достичь максимально допустимой дозы ЭО на протяжении жизни при использовании таких изделий.
Для ЭХГ:
- доза на протяжении жизни в 10 г = 10000 мг;
- максимально допустимой дозой ЭХГ при использовании 13 экстракорпоральных изделий очистки крови в месяц является 60 мг;
- т.е. потребуется 10000 мг/(60 мг/мес) = 167 мес или примерно 14 лет, чтобы достичь максимально допустимой дозы ЭХГ на протяжении жизни при использовании таких изделий.
F.2.7 Простыни в контакте с неповрежденной кожей
Простыни в контакте с неповрежденной кожей приносят пользу пациентам с минимальным риском. Хирургические простыни используют для сведения к минимуму распространения инфекционных агентов пациенту и от него, таким образом способствуя сокращению послеоперационных инфекций. Не показано, что медицинские изделия, контактирующие с неповрежденной кожей, вызывают системную токсичность. Значения предела переносимого контакта TCL для ЭО и ЭХГ основаны на местных токсических эффектах. Таким образом, значения TCL в 10 мг/см для ЭО и 5 мг/см
для ЭХГ или изделие, вызывающее незначительное раздражение при испытании согласно ISO 10993-10, являются подходящими связующими пределами для простыней в контакте с неповрежденной кожей.
F.3 Обоснование для 4.4
F.3.1 Общие положения
Этот параграф дает общие обоснования для каждой из основных частей 4.4.
F.3.2 Экстракция из изделий
Критическим параметром в регулировании остаточного содержания ЭО при стерилизации является доза, которую может получить пациент или пользователь при применении изделий, стерилизованных данным способом. Для того чтобы оценить дозу, полученную пациентом или пользователем, необходимо применять экстракционные методы, которые моделируют условия обычного применения изделия. В некоторых случаях этого можно достигнуть путем заполнения изделия водой, в то время как в других случаях может потребоваться более сложное моделирование, включающее постоянный поток жидкости. Установлено, что если в исчерпывающей экстракции при определении остаточных веществ, присутствующих в изделии, соблюдаются все требования, тогда экстракция, моделирующая условия применения, может оказаться ненужной.
Используемое понятие исчерпывающей экстракции включает положение, согласно которому экстракция должна продолжаться до тех пор, пока на последнем этапе полученный выход анализируемого вещества будет составлять менее 10% выхода анализируемого вещества при первой экстракции. Данное требование не подходит, когда выход при первой экстракции очень мал. Последнее бывает в случае изделий с малым содержанием остаточных веществ или в образцах, из которых анализируемое вещество выделяется с очень малой скоростью. В таких случаях экстракцию следует продолжать до тех пор, пока увеличение общего содержания анализируемого вещества, экстрагируемого за несколько этапов, становится аналитически незначимым.
F.3.3 Аналитические методы
F.3.3.1 Стабильность ЭО в растворе
Каждая лаборатория должна провести собственное исследование стабильности для определения срока годности своих контрольных растворов остаточного количества ЭО. Эффективный контрольный раствор должен содержать не менее, чем обозначенный процент исходной концентрации в последний день утвержденного срока годности стабильности. В противном случае все контрольные растворы следует изготавливать на ежедневной основе.
Во время межлабораторных сравнительных испытаний метода определения ЭО, описанного в К.4.4 (см. [140]) было проведено исследование стабильности контрольных растворов ЭО в этиловом спирте. Контрольные растворы ЭО в концентрациях 25, 50 и 100 мкг/мл были приготовлены и хранились как при температуре холодильной камеры, так и при температуре 40°С. Эти контрольные растворы анализировали в разные периоды времени в течение 6 нед. Данное исследование показало, что за 2 нед при температуре 40°С концентрация ЭО снижалась до 70% исходной концентрации для контрольных растворов концентрацией 50 и 100 мкг/мл. В случае хранения при температуре холодильной камеры (плюс 5°С) вплоть до 60 сут все контрольные растворы оставались стабильными в пределах 10% исходной концентрации.
F.3.3.2 Стабильность ЭХГ в растворе
Перед межлабораторными сравнительными испытаниями ЭХГ 11 лабораторий участвовали в изучении стабильности контрольных растворов ЭХГ. Водные контрольные растворы ЭХГ были приготовлены в одной лаборатории и переданы всем участникам эксперимента. После прибытия на место анализа контрольные растворы хранились при температуре холодильной камеры. Эти контрольные растворы анализировали, применяя различные типы колонок, в разные периоды времени: сразу после доставки, спустя неделю и через 2, 3, 4, 8 и 12 нед после доставки. Изучение показало, что в течение первых 2 нед концентрация значительно не изменялась. Было сделано заключение, что контрольные растворы ЭХГ стабильны в случае хранения при температуре холодильной камеры в течение по крайней мере 14 сут.
F.3.3.3 Линейность стандартной кривой
В идеале методики, представленные в настоящем стандарте, должны быть применимы ко всей области концентраций, необходимых для оценки соответствия предельным значениям, установленным в 4.3. Точность метода, пределы обнаружения, пределы количественного определения и линейность калибровочной кривой должны быть утверждены.
F.3.4 Обоснование для п.4.4.7.1, данные анализа и их интерпретация
Представлена соответствующая обработка данных, которая дает возможность исследователю вычислить уровни остаточных веществ в изделии и на основании этого - возможную дозу, воздействующую на пациента. Это позволяет выпускать продукцию в соответствии с требованиями, перечисленными в 4.3.
Приложение G
(справочное)
Установление предельных значений для ЭО
G.1 Общие положения
Подход, описанный в ISO 10993-17, был использован для получения значений ограниченного, длительного и постоянного переносимого потребления TI для ЭО. Отдельные значения TI не вычислялись для разных путей воздействия. Полученные значения TI для ЭО были преображены в значения допустимого предела и предела изделия и сравнены с предельными значениями, приведенными в ISO 10993-7. Для категории ограниченного воздействия были приняты полученный TI и соответствующий предел изделия из представленной здесь оценки. Для категорий длительного и постоянного контакта были сохранены существующие пределы из издания 1995 года, хотя полученные значения TI и соответствующие пределы изделия из представленной оценки поддерживают более высокие уровни. Обоснованием для сохранения текущих пределов служит успешная клиническая история после принятия издания 1995 года и способность производителей соответствовать этим пределам. Кроме того, на данный момент не существует клинической или производственной причины для повышения существующих пределов для категорий длительного и постоянного контакта до уровней, поддерживаемых описанной в настоящем стандарте оценкой.
В категории ограниченного/длительного воздействия TI в 0,3 мг/кг/сут было получено, основываясь на результатах [82], [83], [84], [169], [170] и [171]. Данные этих исследований ранее использовались в качестве поддержки для предела длительного воздействия ЭО. Модифицирующий фактор MF-30 был применен к данным, основываясь на UF1-30 для учета межиндивидуальной вариабильности* и UF2 в 1 для учета межвидовой разницы в действенности. Предоставлено обоснование выбора значений для UF1 и UF2.
________________
* Текст документа соответствует оригиналу. Здесь и далее. - .
В категории постоянного воздействия TI в 0,02 мг/кг/д было получено, основываясь на канцерогенных эффектах, и было выведено, используя моделирование "доза-ответ" человеческих данных. Другие подходы к оценке канцерогенного риска были также исследованы для получения TI на основе рака.
Неканцерогенный TI постоянного воздействия в 0,03 мг/кг/д может быть получен, основываясь на негативном влиянии на сперматогенез, наблюдаемом после длительного ингаляционного воздействия ЭО на макак Cynomolgus (см. [107], [108] и [109]) и MF-60. MF, использованный для получения неканцерогенного TI при постоянном воздействии включает UF3 для экстраполяции LOAEL в NOAEL.
G.2 Введение
С момента публикации настоящего стандарта появились новые данные о негативном влиянии ЭО на человека и экспериментальных животных. Дополнительно появились данные для снижения неопределенности при оценке относительной чувствительности человека и экспериментальных животных к этому соединению и вариативности ответа среди человеческой популяции на ЭО. Кроме того, появились новые инструменты (например, ориентировочная доза и фармакокинетическое моделирование на физиологической основе), позволяющие более точно оценить риск воздействия ЭО. Эта оценка риска служит основой выбора TI, используемого в настоящем стандарте.
G.3 Методы
G.3.1 Общие положения
Подход, описанный в ISO 10993-17, был использован для получений значений TI для ЭО при различной продолжительности воздействия.
Существует возможность, что пациент будет в контакте с ЭО, выделяемым медицинскими изделиями при коротких или долгих сроках; в результате следует выводить значения ограниченного/длительного и постоянного TI для данного соединения. Дополнительно пациенты могут контактировать с ЭО различными путями воздействия. Хотя обычно пациенты контактируют с ЭО парентеральными путями воздействия в клинических условиях, существует очень мало данных по токсичности для получения значений TI для этих путей воздействия. Напротив, существует обширная база данных по воздействию ЭО на экспериментальных животных и человека ингаляционным путем. Для использования этого богатого источника данных ингаляционной токсичности для установления парентеральных значений TI для ЭО, был разработан метод экстраполяции дозы ЭО для одного способа введения на дозы ЭО для другого способа введения для получения предполагаемых значений внутренней дозы после ингаляционного воздействия.
G.3.2 Экстраполяция дозы ЭО для одного способа введения на дозы ЭО для другого способа введения
Для ЭО проводили достаточно большое количество исследований, однако только относительно небольшая часть из них касалась оценки парентеральных путей воздействия. Тем не менее известна степень, с какой абсорбируется ЭО после ингаляционного воздействия, следовательно, должно быть возможным примерно вычислить внутреннюю дозу ЭО, основываясь на знании концентрации воздействия ЭО о степени, в какой соединение абсорбируется через дыхательные пути.
Абсорбированную дозу можно также вычислить, основываясь на знании концентрации воздействия, скорости вентиляции в животных под воздействием, длительности воздействия и степени абсорбции через дыхательные пути. Используя данные [186] и [22], были установлены примерные вычисления относительной абсорбции воздушного ЭО при разных концентрациях воздействия (см. таблицу G.1).
Таблица G.1 - Абсорбированная доза ЭО в крысах при воздействии разных концентраций ЭО в воздухе
Концентрация воздействия, ppm | Абсорбированный процент, % |
10 | 94 |
33 | 74 |
50 | 68 |
100 | 61 |
1000 | 36 |
Вычисление абсорбированной дозы в макаках Cynomolgus основана на средней скорости вентиляции (0,83 м/сут), полученной из значений, сообщенных Фишером [52], для макак Cynomolgus под воздействием метанола.
G.3.3 Подход оценки неканцерогенного риска
Значения TI для неканцерогенных эффектов ЭО были получены путем деления наиболее соответствующих значений NOAEL или LOAEL из исследований на факторы неопределенности, учитывая данные по вариативности ответа на ЭО в человеческих популяциях UF1, потенциальной межвидовой разницы в действенности UF2 и недостатков данных UF3. ISO 10993-17 подчеркивает использование научных данных, при их наличии, для получения факторов неопределенности, применяемых к данным из ключевых исследований токсичности при получении значений TI. Используя тот же подход, данные по вариативности в ответе на ЭО в человеческих популяциях и по действенности ЭО от вида к виду были использованы для получения значений UF1 и UF2 соответственно. Факторы, принятые во внимание при выборе значения UF1, включают полиморфическую экспрессию ферментов, метаболизирующих ЭО в человеческой популяции, способность разных стадий заболевания ингибировать эти ферменты и вариативность способности восстанавливать ущерб ДНК. Учет этих факторов привел к выбору значения для UF1, который выше, чем стандартное значение 10, которое обычно используют для этого параметра. По контрасту научные данные и результаты фармакокинетического моделирования на физиологической основе РВРК предполагают, что действенность ЭО мало различается от вида к виду, а следовательно, значение ниже, чем 10, является подходящим для UF2 по сравнению со стандартным 10, которое обычно используют для этого параметра.
G.3.4 Подход к оценке канцерогенного риска
Применение теста весомости доказательств показывает, что ЭО является генотоксичным канцерогеном и что опухоли, наблюдаемые у животных, также применимы и к людям. ISO 10993-17 позволяет различные подходы, которые могут быть рассмотрены при вычислении канцерогенного значения TI для генотоксичного канцерогена. Таким же образом канцерогенные значения TI были получены, используя множественные подходы, а именно: простая линейная экстраполяция из LOAEL, применение факторов неопределенности UF к LOAEL и применение моделирования "доза-ответ".
G.3.5 Эффекты, не учитываемые при вычислении значений TI для ЭО
Значения TI для ЭО, основанные на канцерогенных или неканцерогенных эффектах, необязательно учитывают иммунологические эффекты, такие как реакции гиперчувствительности и анафилаксия, а также необязательно включают такие эффекты, как гемолиз. Могут потребоваться другие подходы, чтобы защитить пациентов от этих эффектов, которые связаны с воздействием ЭО.
G.4 Неканцерогенные значения TI для ЭО
G.4.1 Общее представление
Вычисление значения TI не на основе рака для ЭО включает:
- выбор соответствующих значений NOAEL и LOAEL из литературы и
- выбор факторов неопределенности для учета вариативности в человеческой популяции, межвидовой разницы в действенности и недостатков данных.
Эти шаги описаны в G.4.2 и G.4.3.
G.4.2 Выбор научных исследований
G.4.2.1 Категория ограниченного/длительного воздействия
Не существует адекватных данных по токсичности разовой дозы для установления TI категории ограниченного воздействия для ЭО. Тем не менее в ISO 10993-17 отмечено, что все доступные данные должны быть учтены в контексте понимания общего профиля токсичности вещества. Основным подходом является использование данных по острой токсичности (например, данные исследований 14 д или менее) для установления пределов ограниченного воздействия или краткосрочных пределов.
Следовательно, данные более долгосрочных исследований были использованы для установления TI категории ограниченного воздействия.
В таблице G.2 суммированы наиболее значимые данные для получения TI категории ограниченного/длительного воздействия. Тем не менее нужно учесть, что другие исследования, кроме включенных в следующие таблицы, были рассмотрены в процессе установления значений TI для ЭО.
Вудард и Вудард [203] описали исследование, в котором собаки получали подкожные инъекции ЭО в дозах 6, 18 и 54 мг/кг (позже адаптировано на 36 мг/кг) в течение 30 последовательных суток. Тем не менее так как использовалось небольшое количество животных, эти результаты нельзя с уверенностью использовать для установления ограниченного/длительного TI.
Таблица G.2 - Исследования, использованные для вычисления TI категории ограниченного/длительного воздействия для ЭО
Вид | Путь | Воздействие | NOAEL, мг/кг/д | LOAEL, мг/кг/д | Эффекты при LOAEL | Исследование |
Собака | ПК | 6, 18 или 54 мг/кг ежедневно·30 сут | 6 | 18 | Потеря веса, изменения в коагуляции, повышенный вес печени, почек и селезенки | [203] |
Кролик | ВВ | 9, 18 и 36 мг/кг ежедневно на гестационный день 4-16 | 9 | 18 | Сниженная материнская прибавка веса | [82] |
Крысы | Ингаляция | 10, 33 или 100 мкг/кг 6 ч/сут на гестационный день 6-15 | 9 | 27,5 | Снижение фетального веса | [169] |
Сходное значение NOAEL для ЭО было получено в ингаляционном исследовании, проведенном Снеллингсом [169]. Сниженный фетальный вес наблюдался при воздействии на 344 беременные крысы Фишера 100 ррт ЭО в течение 6 ч/сут на 6-15-й день гестации. После воздействия 33 ppm ЭО негативных эффектов не наблюдалось. Используя данные абсорбированной дозы исследования в [22], абсорбированной дозой, равной 33 ppm в [169], является
33 ppm·1,8 мг/м/ppm·0,29 м
/сут·6/24·0,74/0,35 кг = 9,1 мг/кг/сут.
Идентичные значения NOAEL исследований в [82] и [169] повышают уверенность в использовании этого значения в качестве базы для значений TI категории ограниченного/длительного воздействия.
G.4.2.2 Категория постоянного воздействия
Наименьшая абсорбированная доза, связанная с негативными неканцерогенными эффектами после долгосрочного ингаляционного воздействия ЭО на экспериментальных животных, составляет 2,0 мг/кг/сут, основываясь на результатах, сообщенных Линчем [107]. Эти исследователи подвергли макак Cynomolgus 0 ррт ЭО, 50 ррт ЭО или 100 ррт ЭО в течение 7 ч/сут, 5 сут/нед в течение 24 мес. Статистически значимые снижения в численности и подвижности сперматозоидов наблюдались в обеих группах, подвергнутых ЭО, по сравнению с контролями.
Основываясь на средней скорости вентиляции, измеренной в макаках Cynomolgus, подвергнутых метанолу в исследовании Фишера и др. [52] и предположении, что процент абсорбированного ЭО при 50 ppm является одинаковым для крыс и обезьян, абсорбированной дозой после воздействия ЭО является
50 ppm·1,8 мг/м/ppm·0,83 м
/сут·7/24·5/7·0,68/5,3 кг = 2,0 мг/кг/сут.
Эффекты на численности и подвижности сперматозоидов, наблюдаемые в исследовании Линча, соответствуют наблюдаемым у людей, подвергнутым ЭО [5], и другим параметрам сперматозоидов, выявленных у экспериментальных животных (например, [128]). Более того, статистически значимые снижения в численности, подвижности или морфологии сперматозоидов рассматривают как негативные эффекты в целях установления пределов воздействия для соединений (см. [126] и [188]). Наконец, не существует механистической причины для предположения, что результаты, наблюдаемые в макаках Cynomolgus, не будут применимы для человека. В результате обосновано использовать результаты, сообщенные в [107], для вычисления постоянного парентерального TI для ЭО, основываясь на неканцерогенных эффектах.
G.4.3 Выбор факторов неопределенности для неканцерогенных эффектов
Таблица G.3 - Факторы неопределенности для вычисления TI
Назначение фактора неопределенности | Диапазон | Величина стандартного UF | Описание |
UF1, индивидуальная вариативность в человеческой популяции | От 1 до 10 | 10 | Для учета вариативности ответа между средним показателем здоровой популяции и ответа некоторой пропорции чувствительной субпопуляции |
UF2, межвидовая экстраполяция | От 1 до 10 | 10 | Для учета возможности, что человек более чувствителен к негативным эффектам соединения, чем экспериментальные животные |
UF3, качество и релевантность экспериментальных данных | От 1 до 100 | Нет | Для учета ограничений токсикологических данных в наличии для вычисления TI, включая отсутствие значения NOAEL, отсутствие NOAEL из долгосрочных исследований и недостаток данных по клинически соответствующему пути воздействия |
G.4.3.1 Индивидуальная вариабильность UF1
G.4.3.1.1 Общее представление
В ISO 10993-17 отмечено, что предпочтительно иметь актуальные данные для оценки человеческой вариативности для того, чтобы определить величину значения, выбранного для UF1. К счастью, существуют данные для характеристики вариабельности ответов на ЭО различных биомаркеров в человеческих популяциях, в основном в производственных когортах. Например, Фукс [54] наблюдал "заметные индивидуальные различия в подверженности" в работниках, подвергшихся ЭО, разрывам одноцепочечной ДНК в мононуклеарных клетках периферической крови. Эти исследователи идентифицировали две субпопуляции среди работников, профессионально подвергшихся ЭО, "более чувствительную" группу и "менее чувствительную" группу. Среди некурящих в менее чувствительной группе самая низкая концентрация ЭО (4 ч средневзвешенной концентрации, TWA), связанная с разрывами одноцепочечной ДНК, была 3,5 мг/м. Среди некурящих в более чувствительной группе самая низкая концентрация ЭО, связанная с разрывами одноцепочечной ДНК, была 0,6 мг/м
. Следовательно, значение UF1 по меньшей мере 6 (3,6/0,6) необходимо для защиты чувствительных лиц в "более чувствительной" группе от этого конкретного генотоксичного эффекта. Различные факторы могут быть причиной этой вариативности ответа на ЭО, включая полиморфическую экспрессию ферментов, ответственных за метаболизм ЭО (изоформ тета 1 глутатион-трансферазы и эпоксидгидролазы), и вариабильность в механизмах восстановления ДНК. Дополнительно существуют факторы, которые могут повысить чувствительность тяжелобольных и раненых пациентов к негативным эффектам ЭО относительно общей популяции, таким как ингибирование метаболических ферментов, которые играют роль в детоксификации ЭО и снижении уровней сопряженных факторов, необходимых для осуществления ферментных реакций (например, глутатион). Как следствие, вариативность, наблюдаемая в ответе на ЭО в общей популяции, не обязательно отражает вариативность ответа, наблюдаемую в популяции пациентов. Следовательно, вариабельность ответа, наблюдаемая в здоровых взрослых популяциях, профессионально подвергаемых ЭО (см. [54]), может неполно представить вариантность, наблюдаемую среди пациентов, подверженных ЭО.
Каждый из факторов, который может дополнять вариативность в человеческой популяции по отношению к негативным эффектам, связанным с воздействием ЭО, будет исследован в данной секции с целью определения значения UF1, которое будет адекватно защищать чувствительные субпопуляции.
G.4.3.1.2 Полиморфизм ферментов детоксификации ЭО
G.4.3.1.2.1 Общие положения
ЭО метаболизируется и, следовательно, детоксифицируется в грызунах и человеке двумя ферментами: изоформом тета 1 глутатион-трансферазы GSTT1 и эпоксидгидролазой ЕН. Оба этих фермента полиморфически выражены в человеческой популяции (например, [182], [183] и [184]). Следствием этих полиморфизмов является то, что определенный процент человеческой популяции ожидаемо имеет сниженную способность метаболизации ЭО по отношению к остальной популяции. Так как ЭО детоксифицируется этими ферментами, ожидаемо, что люди со сниженной метаболизацией ЭО находятся в группе повышенного риска негативных эффектов по отношению к остальной популяции. Значительное внимание было уделено роли, играемой полиморфизмом GSTT1, в вариативности ответа на ЭО, наблюдаемой в человеческих популяциях (например, [50]). Тем не менее ЭО в человеке в основном метаболизируется ЕН; следовательно, можно предположить, что полиморфизм GSTT1 не должен значительно влиять на вариабельность ответа в человеческой популяции. Несмотря на принятую основную роль ЕН в метаболизме ЭО в человеке, мало внимания уделялось потенциальной роли полиморфизма ЕН или ингибирования метаболизма ЭО, и, как следствие, риску, вызванному воздействием ЭО. Влияние полиморфизма GSTT1 и ЕН на ответ на ЭО в человеческой популяции обсуждается в G4.3.1.2.2 и G4.3.1.2.3.
G.4.3.1.2.2 Роль полиморфизма GSTT1 в вариативности ответа человеческой популяции на ЭО
Частота нулевого генотипа GSTT1 может достигать 54% в некоторых популяциях (см. [6]), но большинство научных докладов сообщает о значениях в диапазоне от 17% до 25% (например, [158]) в зависимости от популяции. Так как нулевой генотип GSTT1 связан со сниженной активностью фермента GSTT1, значительный процент популяции может находиться в группе повышенного риска негативных эффектов, связанных с ЭО.
Нулевой генотип GSTT1 оказывает особое влияние на уровни аддуктов гемоглобина у лиц, подвергшихся ЭО (см. таблицу G.4).
Таблица G.4 - Эффект полиморфизма GSTT1 на уровни аддуктов гемоглобина в конъюгаторных и неконъюгаторных популяциях
Исследование | Средняя разница в ответе между популяциями GSTT1+ и нулевым GSTT1 |
[53] | 3 |
[130] | 2 |
[182] | 1,5 |
[50] | 1,5 |
[205] | 2,1 |
Результаты, приведенные в таблице G.4, предполагают, что популяции с нулевым генотипом GSTT1 имеют внутреннюю дозу ЭО в полтора-три раза выше, тем не менее сравнение средней разницы между двумя популяциями недооценивает разницу между дозой, связанной со средним ответом в GSTT1+ и нижнем процентиле популяции нулевого GSTT1.
Хотя данные показывают ясную зависимость экспрессии GSTT1 от уровней аддуктов гемоглобина у лиц, подвергшихся ЭО, данные по влиянию полиморфизма GSTT1 на индукцию СХО неоднородны. Халлиер [64] сообщает, что индукция СХО в периферических лимфоцитах лиц с нулевым GSTT1 была гораздо выше, чем в GSTT1; тем не менее Шродер [163] и Винке [202] сообщают об очень скромных повышениях в фоновых уровнях СХО у лиц с нулевым GSTT1 по сравнению с носителями генотипа GSTT1. В сочетании эти результаты предполагают, что полиморфизм GSTT1 ведет к повышенным уровням аддуктов Hgb, но лишь скромно увеличивают генотоксические эффекты ЭО у слабых конъюгатов.
Важно отметить, что нулевой генотип GSTT1 связан с повышенным риском определенных видов рака (например, [48] и [207]), но необязательно с видами рака, связанными с воздействием ЭО.
G.4.3.1.2.3 Роль полиморфизма эпоксидгидролазы в вариативности ответа человеческих популяций на ЭО
Так же как и GSTT1, экспрессия ЕН полиморфически выражается в человеческой популяции (см. [69] и [144]), в результате вариативность в активности ЕН у человека может быть значительной. Например, Мертес [123] обнаружил 63-кратную вариативность в метаболизме субстрата ЕН образцами печени человека; тем не менее 90% образцов отклонялись менее чем на фактор 3 от медианы. Киттерингэм и др. [90] суммировали влияние полиморфизма ЕН на активность ЕН в человеческой популяции, отмечая, что: "При обобщении результатов этих исследований кажется, что ни у одного человека не отсутствует полностью HYL1 (микросомальная эпоксидгидролаза), но существует некоторая степень индивидуальной вариативности в гепатической активности, хотя большинство популяции охватывает 10-кратный диапазон".
Если весь диапазон активности ЕН в человеческой популяции (включая слабых и быстрых метаболизаторов) может быть охвачен фактором 10, разница в активности между средним показателем популяции и самыми слабыми метаболизаторами, возможно, может быть описана фактором 5, в зависимости от формы распределения.
Вариативность в активности ЕН, наблюдаемой в человеческой популяции, была связана с повышенным риском некоторых видов рака, но не обязательно с видами рака, связанными с воздействием ЭО. Например, Макглинн и др. [121] наблюдали двукратное повышение гепатоцеллюлярных карцином в китайском населении с полиморфизмом, который привел к сниженной активности ЕН. Дополнительно сниженная способность метаболизировать эпоксиды эпоксидгидролазой была связана с повышенным риском синдрома фетального гидантоина и других токсичностей, связанных с применением антиконвульсантов (см. [93]). Предположительно, так как ЭО детоксифицируется путем ЕН, лица со сниженной активностью ЕН в результате сниженной полиморфической экспрессии фермента могут быть в группе повышенного риска негативных эффектов, связанных с ЭО, по отношению к лицам в популяции, которые эффективно метаболизируют эпоксиды.
G.4.3.1.3 Ингибирование ферментов детоксификации ЭО
G.4.3.1.3.1 Ингибирование при болезненных состояниях
Активность эпоксидгидролазы ингибирована при определенных болезненных состояниях, таких как эндотоксикоз и травматический шок. Введение бактериального эндотоксина крысам ингибировала как активность ЕН (см. [49]), так и экспрессию гена ЕН (см. [36]). Микросомальная ЕН была ингибирована примерно 50% в животной модели травмы (см. [60]).
Предположительно, метаболизм ЭО может быть нарушен при болезненных состояниях, которые приводят к ограниченной способности ЕН.
G.4.3.1.3.2 Ингибирование лекарствами и другими соединениями
Было продемонстрировано, что антиконвульсанты, вальпроевая кислота и вальпромид ингибируют активность ЕН в человеке при терапевтических концентрациях [88]. Считается, что это ингибирование играет роль в повышенной тератогенности, наблюдаемой после совместного воздействия вальпроевой кислоты и других противоэпилептических лекарств у пациентов с эпилепсией.
Значение ингибирования фермента
Фармакокинетическая модель ЭО на физиологической основе РВРК, разработанная Феннеллом и Брауном [51], может быть использована для специфичного определения влияния ингибиторов GSTT1 и ЕН на внутреннюю дозу ЭО. Анализ чувствительности, проведенный этими исследователями, который каждый параметр имеет на моделированные концентрации ЭО в венозной крови, показал, что изменения значений для параметра GST в модели имели значительное влияние на концентрацию ЭО в венозной крови мышей и крыс, но не людей. Напротив, изменения значений для параметра ЕН
в модели имели серьезное влияние на концентрацию ЭО в венозной крови человека, но не мышей и крыс. Коэффициент чувствительности для параметра ЕН
у людей был примерно - 0,4%. Таким образом, при каждом сокращении на 1% значения для ЕН
, ожидается, что концентрация ЭО в венозной крови увеличится на 0,4%. Следовательно, 50%-ное ингибирование ЕН, которая может произойти при некоторых болезненных состояниях (например, травма, сепсис), будет связано с 20%-ным повышением концентрации ЭО в венозной крови. Ожидается, что ингибитор GSTT1 будет мало влиять на концентрацию ЭО в венозной крови у людей. Таким образом, хотя ингибирование ЕН может привести к важным клиническим последствиям (например, взаимодействие лекарств), влияния ингибитора ЕН на оцененные внутренние дозы ЭО у человека могут быть учтены фактором 2 или менее, основываясь на результатах моделирования РВРК.
G.4.3.1.4 Уровни глутатиона
Детоксификация ЭО через путь GSTT1 требует достаточных уровней эндогенного глутатиона в тканях в качестве сопутствующего фактора. Несколько исследований показали, что тяжелобольные или послеоперационные пациенты обычно имеют более низкие тканевые уровни сокращенного глутатиона GSH, чем здоровые люди. Например, Вернерман [197] обнаружил, что операция и тяжелое заболевание снижают уровни глутатиона на 40%. В результате тяжелобольные пациенты могут быть в группе повышенного риска при развитии эффектов, связанных с ЭО, по сравнению со здоровыми людьми.
G.4.3.1.5 Полиморфизм способности восстановления ДНК
Другой фармакодинамический фактор, полиморфизм в генах, связанных с восстановлением ДНК, а также метаболизмом канцерогенов, может иметь влияние на риск рака (см. [73]). Предполагается, что лица с неэффективными механизмами восстановления ДНК могут быть в группе повышенного риска негативных эффектов, связанных с ЭО, чем большинство лиц в основной популяции. Существуют некоторые данные исследований в поддержку этого утверждения. Нивард [138] обнаружил до 20-кратного увеличения скорости мутации при отсутствии материнской эксцизионной репарации нуклеотидов NER в дрозофилах, подвергнутых высоким концентрациям ЭО, по сравнению с условиями, позволяющими восстановление. Тем не менее эта повышенная скорость мутации не наблюдалась у дрозофил при более низких дозах. Таким образом, несмотря на то, что неэффективное восстановление ДНК может поместить некоторых лиц в группу повышенного риска негативных эффектов, связанных с ЭО, не является возможным оценить данные полиморфизма восстановления ДНК в количественном выражении для определения значения UF1 для ЭО.
Совокупная вариативность
Как обсуждалось выше, различные фармакокинетические факторы могут привести к сниженной способности метаболизировать и, следовательно, детоксифицировать ЭО у некоторых пациентов. Эти факторы включают полиморфическую экспрессию GSTT1 и ЕН, ингибирование ЕН лекарствами и другими соединениями, а также сниженную активность ЕН при определенных болезненных состояниях. Дополнительно различные фармакодинамические факторы, такие как сниженные уровни глутатиона в тканях тяжелобольных пациентов и полиморфизм в способности восстановления ДНК, могут сделать ткани-мишени отдельных лиц более подверженными ущербу от ЭО. Невозможно использовать эти данные в количественном выражении для выбора значения для UF1; тем не менее эти факторы, рассматриваемые в совокупности, могут предоставить информацию в процессе выбора UF для характеристик индивидуальной вариабельности ответа на ЭО.
Возможно обосновать значение UF1 по меньшей мере в 6, основываясь на вариантности в данных биомаркеров гемоглобина, сообщенных Фуксом [54]; тем не менее это значение, возможно, недостаточно отражает разницу между средним ответом в здоровой популяции и ответом чувствительных лиц в популяции тяжелобольных пациентов.
Кнудсен [91] рассматривал влияние множественных факторов, воздействующих на метаболическую способность по величине UF для учета индивидуальной вариабельности и отметил: "При оценке риска "фактор" безопасности, равный 10, обычно общепринят для учета межиндивидуальной изменчивости. Обзор литературы обосновывает фактор со значением 10, при рассмотрении одиночных полиморфизмов. Тем не менее у некоторых лиц с генетическими нарушениями обмена веществ, а также другими патологиями, например дефектное восстановление ДНК, низкий алиментарный статус и т.д., риск может быть выше фактора безопасности, равного 10".
Общий эффект этих факторов неизвестен; тем не менее данные в целом предполагают, что значение для UF1 выше, чем стандартное 10, было бы приемлемым. В результате наиболее чувствительные популяции будут адекватно защищены UF1-30 для учета индивидуальной вариантности.
G.4.3.2 Межвидовые различия UF2
G.4.3.2.1 Общее представление
Прежде чем будут рассмотрены межвидовые различия в действенности при вычислении значения для UF2, важно задаться вопросом, объективны ли результаты, наблюдаемые в экспериментальных животных, подверженных ЭО, для человека. Как обсуждалось в G.4.2.1 и G.4.2.2, критическими конечными точками для вычисления TI для ЭО являются сниженный вес у кроликов (категория ограниченного/длительного воздействия LOAEL) и измененный сперматогенез и тестикулярный эффект у макак Cynomolgus (категория длительного воздействия LOAEL для неканцерогенных эффектов). Сокращенное повышение веса в экспериментальных животных является общим эффектом, рассматриваемым как негативный и объективный для установления значений TI. Сперматогенез в не человекообразных приматах организационно схож с процессом, происходящим у человека, с точки зрения продолжительности цикла сперматогенеза, длительности сперматогенеза и количества митотических делений (см. [124] и [195]). Следовательно, нечеловекообразные приматы были описаны как подходящая модель для экспериментальных исследований сперматогенеза человека. По аналогии, можно предположить, что эффекты, оказанные на этот процесс и вызванные ЭО, наблюдаемые в макаках Cynomolgus, будут применимы к человеку. Так как считается, что ЭО оказывает канцерогенный эффект как прямой действующий генотоксичный канцероген, эффекты, наблюдаемые в экспериментальных животных, прямо применимы к человеку.
Основываясь на аллометрических принципах, предполагается, что человек является более чувствительным к негативным эффектам химических соединений, чем экспериментальные животные (см. [127]). В результате стандартный UF-10 рекомендуется в ISO 10993-17 для учета предполагаемой разницы в действенности соединения для экспериментальных животных и для человека. Тем не менее некоторые наборы доказательств предполагают, что действенность ЭО эквивалентна для всех видов. Как более детально описано ниже, результаты фармакокинетического моделирования на физиологической основе РВРК предполагают, что ожидаемая внутренняя доза в крови мышей, крыс и человека будет одинаковой после ингаляционного воздействия определенной концентрацией ЭО. Результаты эксперимента РВРК-моделирования подтверждаются данными по эквивалентности видов по внутренней дозе ЭО и схожих соединений (пропиленоксид, стиролоксид) после ингаляционного воздействия. Все эти факторы поддерживают выбор значения в 1 для UF2 для использования при вычислении значений TI для ЭО.
G.4.3.2.2 Результаты РВРК-моделирования
Используя модель РВРК, упомянутую ранее, Феннелл и Браун [51] обнаружили, что рассчитанные внутренние дозы ЭО [площадь под кривой (AUC) в крови] были эквивалентны у мышей, крыс и человека после ингаляции низких концентраций ЭО в течение 6 ч (см. таблицу G.5).
Таблица G.5 - Рассчитанная внутренняя доза после ингаляции ЭО
Концентрация ЭО, ppm | Вид AUC, мг·ч/л | ||
Мышь | Крыса | Человек | |
1 | 0,044 | 0,059 | 0,056 |
10 | 0,44 | 0,59 | 0,57 |
Сходства видов в ответе
Используя уровни аддуктов гемоглобина как индекс внутренней дозы, Эренберг и Торнквист [45] обнаружили, что степень повышения в уровнях аддуктов была постоянной для всех видов, подвергнутых одинаковой концентрации ЭО. Также внутренняя доза ЭО от воздействия одинаковой концентрации ЭО была схожей для всех видов (см. таблицу G.6).
Таблица G.6 - Межвидовые сравнения внутренней дозы ЭО [45]
Метрика дозы | Вид | ||
Мышь | Крыса | Человек | |
HOEtVal повышение аддукта от 1 ppmh | 12 | 16 | 12 |
Доза в крови, mMh ppm | 0,5 | 0,35 | 0,3 |
Межвидовое сравнение действенности сходных эпоксидов
Сегербак [165] сообщил, что уровни аддуктов ДНК in vivo после ингаляционного воздействия пропиленоксидом были межвидово эквивалентны. С точки зрения фармакодинамики Бьорге и др. [23] обнаружили схожие уровни разрывов одноцепочечной ДНК в изолированных тестикулярных клетках человека и крысы, подверженных in vitro стиролоксиду. Учитывая сходства в структуре и механизме действия пропиленоксида, стиролоксида и ЭО, эти обнаружения поддерживают заключение, что ЭО одинаково действует на все виды.
G.4.3.2.3 Межвидовые различия в скорости восстановления ДНК
Восстановление ДНК, по-видимому, происходит с одинаковой скоростью у всех видов, что еще более поддерживает выбор значения 1 для UF2. Например, клетки человека и крысы восстанавливают повреждения ДНК, вызванные метилметансульфанатом MMS, с одинаковой скоростью (см. [142]). Так как ЭО и MMS оказывают эффект на зародышевые клетки посредством сходного механизма (см. [192]), можно предположить, что скорость восстановления ДНК для ЭО будет эквивалентной для всех видов.
Основываясь на межвидовом сходстве в моделированной или измеренной внутренней дозе ЭО после воздействия одинаковой концентрации ЭО и межвидовом сходстве в скорости восстановления ДНК, существует научное обоснование для выбора значения 1 для параметра UF2.
G.4.3.3 Качество и релевантность экспериментальных данных UF3
UF3 учитывает ограничения в токсикологических данных в наличии для вычисления TI, включая отсутствие значения NOAEL, отсутствие NOAEL долгосрочного исследования и отсутствие данных клинически объективного пути воздействия.
Использование подходов экстраполяции дозы ЭО для одного способа введения на дозы ЭО другого способа введения при отсутствии данных по клинически релевантным путям воздействия обсуждалось в G.3 и не должно быть непосредственно использовано для получения значения для UF3. Тем не менее значение для UF3 необходимо при отсутствии значения NOAEL в [107].
При отсутствии экспериментальных данных для определения значения NOAEL в крови макак Cynomolgus одним из подходов для оценки этого значения может быть:
- оценка внутренней дозы ЭО при NOAEL в крови мышей;
- соизмерение этой дозы с эквивалентной внутренней дозой в крови макак Cynomolgus monkeys;
- сравнение значений.
Основываясь на результатах [186], внутренняя доза, соответствующая воздействию на крыс 10 ppm ЭО в течение 6 ч, составляет 2,7 мг/кг. Оцененная внутренняя доза в макаках Cynomolgus monkeys после воздействия ЭО в течение 6 ч при LOAEL в [107] составляет 3,3 мг/кг (не нормализована для воздействия в течение 5 сут в неделю). Так как считается, что дозы ЭО соизмеримы по видам, являясь прямой функцией массы тела, пропорция внутренней дозы при LOAEL обезьяны и внутренней дозы при NOAEL крысы является 3,3/2,7 = 1,2. Эта пропорция действительна, если предположить фармакодинамическую эквивалентность в межвидовом ответе спермы на эффекты ЭО.
Следовательно, UF в 3, примененный к LOAEL, должен быть адекватным при вычислении NOAEL в [107]. Это значение соответствует UF в 3 от LOAEL-к-NOAEL, применяемый Управлением по контролю за продуктами питания и лекарственными средствами США (2000) для получения значения парентерального TI для диэтилгексилфалата DEHP. Далее Абдель-Рахман и Кадри [3] нашли среднее соотношение в 3,5 для оральных пропорций от LOAEL-к-NOAEL для 24 химических веществ и сообщили о 96% соотношений ниже 10. Как следствие, существует прямая научная поддержка для UF в 3, примененная к LOAEL, сообщенной в [107] для вычисления TI для ЭО, и существуют прецеденты для выбора этого значения.
G.4.4 Вычисление неканцерогенных значений TI для ЭО
Выше предоставлено обоснование для поддержки выбора следующих значений для каждого из факторов неопределенности, необходимых для вычисления неканцерогенного TI для ЭО:
- UF1 индивидуальная вариативность 30;
- UF2 межвидовая экстраполяция 31;
- UF3 недостатки данных 33 (при отсутствии NOAEL).
В результате совокупный MF для использования при наличии NOAEL равен 30 и 90 при наличии только LOAEL.
Применение выбранных MF к значениям NOAEL или LOAEL из научных исследований дает значения TI при неканцерогенного действия ЭО, показанные в таблице G.7.
Таблица G.7 - Вычисление TI (категория ограниченного/длительного воздействия) при неканцерогенном действии ЭО
Исследование | NOAEL/LOAEL, мг/кг/сут | UF | TI, мг/кг/сут |
[169] | 9 (NOAEL) | 30 | 0,3 |
[82] | 9 (NOAEL) | 30 | 0,3 |
[107] | 2 (LOAEL) | 90 | 0,02 |
G.5 Значения TI для канцерогенного действия ЭО
G.5.1 Общий обзор
ISO 10993-17 предлагает гибкий подход при выборе наиболее подходящего подхода для установления TI на основе рака в зависимости от данных в наличии и регулятивных норм. Так как ЭО оказывает свой канцерогенный эффект путем генотоксического механизма, подход линейной экстраполяции обычно считается наиболее подходящим методом для оценки рисков низкой дозы. Этот подход линейной экстраполяции может использовать статистические модели "доза-ответ" для оценки дозы, связанной с данным риском для человека при низких дозах или применять простую линейную экстраполяцию от наинизшей дозы, связанной с повышенным риском рака у людей или экспериментальных животных к дозе, связанной с нулевым риском. В качестве альтернативы подход LOAEL или NOAEL/UF, сходный с используемым для оценки неканцерогенного риска, рекомендуется некоторыми надзорными органами, особенно европейскими. Наконец, был предложен нелинейный подход на биологической основе для оценки риска ЭО, но этот подход не был полностью утвержден или принят.
Значения TI для ЭО на канцерогенной основе были вычислены, используя следующие подходы:
- линейная экстраполяция данных по человеку;
- линейная экстраполяция данных по животным;
- применение UF к значениям LOAEL;
- моделирование "доза-ответ".
G.5.2 Подход 1: линейная экстраполяция данных по животным
Гэйлор [56] вычислил избыточную случаемость лейкемии в 0,043 у работников в [71], подвергнутых 20 ppm ЭО в среднем в течение 3,9 лет.
Абсорбированная доза, связанная с 0,043 избыточным канцерогенным риском:
20 ppm·1,8 мг/м/ppm·10 м
/сут·0,8 (фактор абсорбции)·5/7
70 кг = 2,94 мг/кг/сут.
Удельный канцерогенный риск:
0,043/2,94 мг/кг/сут = 0,015 (мг/кг/сут).
Доза, связанная с 10 избыточным канцерогенным риском:
10/0,015 (мг/кг/сут)
= 0,0067 мг/кг/сут.
G.5.3 Подход 2: линейная экстраполяция данных по животным
Увеличение случаев лейкемии было отмечено в самцах крыс при обеих дозах воздействия [108]. Увеличение случаев лейкемии у крыс с низкой дозой (50 ppm) была 0,072 (0,11 в подверженных по сравнению с 0,038 в контроле).
Абсорбированная доза при этой концентрации воздействия была:
50 ppm·1,8 мг/м/ppm·0,29 м
/сут·0,68 (фактор абсорбции)·5/7·7/24
0,35 кг = 10,56 мг/кг/сут.
Удельный канцерогенный риск:
0,072/10,56 мг/кг/сут = 0,0068 (мг/кг/сут).
Доза, связанная с 10 избыточным канцерогенным риском:
10/0,0068 (мг/кг/сут)
= 0,015 мг/кг/сут.
G.5.4 Подход 3: подход фактора неопределенности
Увеличение случаев лейкемии, опухолей мозга и мезотелиомы наблюдали у крыс, подверженных 33 ppm ЭО в течение двух лет [172] и [173]. Эта концентрация воздействия эквивалентна:
33 ppm·1,8 мг/м/ppm·0,29 м
/сут·0,68·5/7·6/24/0,35 = 6,0 мг/кг/сут.
Применение MF в 90 к этой дозе LOAEL дает канцерогенный TI в 0,07 мг/кг/сут.
G.5.5 Подход 4: линейное моделирование "доза-ответ" по данным человека
ISO 10993-17 предписывает, что, при наличии данных по человеку для оценки риска воздействия на пациентов канцерогенным соединением, эти данные превалируют над данными по животным. Сайлкен и Валдес-Флорес [166] вычислили удельные значения риска при ингаляции (риск, связанный с воздействием 1 мкг/м ЭО), используя подход моделирования данных "доза-ответ" в корпорации "Юнион Карбайд" (UCC) [181] и таблиц данных Национального института США по профессиональной безопасности и здравоохранению (NIOSH) [176].
Таблица G.8 - Эквивалентная доза, связанная с риском 10, основываясь на значениях удельного риска, полученных в ссылке [166]
Набор данных | Удельный риск, (мкг/м | Эквивалентная доза, связанная с риском 10 |
UCC | 5,1·10 | 0,020 |
NIOSH | 5,8·1 | 0,019 |
| ||
G.5.6 Сравнение значения TI по данным оценки канцерогенного риска
Таблица G.9 - Сравнение значений TI по данным оценки канцерогенного риска для ЭО
Подход | TI по данным оценки риска рака, мг/кг/сут |
Подход 1: линейная экстраполяция (данные человека) | 0,007 |
Подход 2: линейная экстраполяция (данные животных) | 0,015 |
Подход 3: фактор неопределенности (данные животных) | 0,07 |
Подход 4: линейное моделирование" доза-ответ" (данные человека) | 0,020 |
| |
Значения TI по данным оценки риска рака, полученные с использованием подходов 1, 2 и 4, находятся в диапазоне от 0,007 до 0,02 мг/кг/д. TI по данным оценки риска рака, вычисленный с использованием подхода 4, был вычислен применением моделирования "доза-ответ" и, предположительно, является более точным отражением взаимоотношения "доза-ответ" у человека. TI, вычисленный с использованием подхода 4, служит основой для TI на основе рака.
Данные [54] поддерживают выбор этого TI по данным оценки риска рака. В этом исследовании самая низкая концентрация ЭО, связанная с разрывами одноцепочечной ДНК в работниках группы "наибольшей чувствительности", была 0,6 мг/м.
Эта концентрация ЭО эквивалентна абсорбированной дозе в:
0,6 мг/м·10 м
/сут
70 кг = 0,085 мг/кг/сут.
TI на основе рака в 0,02 мг/кг/сут должен быть адекватным для защиты от генотоксических эффектов в чувствительной популяции.
G.5.7 Сравнение значений TI для ЭО
В соответствии с ISO 10993-17 пользователь сравнивает значения TI на основе рака и при его отсутствии и выбирает низшее значение как основу TI категории постоянного воздействия.
Таблица G.10 - Сравнение значений TI для ЭО на основе данных по канцерогенности
Подход | TI, мг/кг/сут |
На основе рака | 0,020 |
Неканцерогенные - постоянная категория | 0,022 |
Как показано в таблице G.10, значения TI по данным оценки риска рака и без для категории постоянного воздействия практически идентичны.
G.6 Вычисление уровней переносимого воздействия ТЕ
G.6.1 Переносимое воздействие ТЕ
Значения TI модифицированы для учета характера использования конкретного изделия и для возможности практического вычисления пределов отдельного изделия. Переносимое воздействие ТЕ является продуктом TI, массы тела и фактора утилизации UTF:
![]() .
.
Фактор массы тела, обычно используемый при отсутствии конкретной информации по популяции пациентов, составляет 70 кг.
Фактор утилизации UTF является продуктом фактора, который учитывает воздействие ЭО от нескольких изделий или фактор сопутствующего воздействия CEF, и фактор для пропорционального учета ситуаций, в которых изделие не используют в течение всего периода длительности, называемый фактор пропорционального воздействия PEF:
![]() .
.
При отсутствии конкретной информации стандартные значения для CEF и PEF соответствуют 0,2 и 1,0 соответственно.
G.6.2 ТЕ ограниченного воздействия
0,30 мг/кг/сут·70 кг·0,2.
ТЕ равняется 4,2 мг/сут, округленное для удобства вычислений пределов отдельных изделий до 4 мг/сут.
Таким образом, средняя ежедневная доза ЭО не будет превышать 4 мг/сут (см. G.1).
G.6.3 ТЕ длительного воздействия
0,30 мг/кг/сут·70 кг·0,2.
ТЕ равняется 4,2 мг/сут, округленное для удобства вычислений пределов отдельных изделий до 4 мг/сут.
Таким образом, средняя ежедневная доза ЭО не будет превышать 4 мг/сут. Существующий предел в 2,0 мг/сут был сохранен.
G.6.4 ТЕ постоянного воздействия
0,02 мг/кг/сут·70 кг·0,2.
ТЕ равняется 0,28 мг/сут, округленное для удобства вычислений пределов отдельных изделий до 0,3 мг/сут.
Таким образом, средняя ежедневная доза ЭО не будет превышать 0,3 мг/сут. Как отмечено в 4.3.2, существующий предел в 0,1 мг/сут был сохранен.
G.6.5 Вычисление предела переносимого контакта TCL
G.6.5.1 Обоснование
Так как ЭО может быть раздражителем, имеет смысл вычислить TCL. TCL необходим для изделий, стерилизованных ЭО, которые имплантируются или входят в контакт с поверхностью. Подход, описанный в ISO 10993-17, был использован для вычисления значений TCL для ЭО.
G.6.5.2 Выбор научных исследований
Несколько исследований (см. [12], [117], [168] и [179]) содержат данные "доза-ответ", которые могут быть использованы для вычисления TCL для ЭО.
Матцумото [117] стерилизовал ЭО сегменты сердечных и мочевых катетеров и оставил их для аэрации на 6, 24, 48, 72, 96 или 168 ч. Количество ЭО, остающееся на катетерах, было определено водной экстракцией в течение трех дней. Двухсантиметровые секции катетеров были подкожно имплантированы крысам, и животные были умерщвлены через 24, 48, 72 ч и одну неделю после имплантации. NIL и MIL на сердечном катетере составляли 0,46 и 1,02 мг ЭО/г катетера соответственно.
Андерсен [12] также провел исследование раздражения, вызванного ЭО в имплантируемых материалах; но количество ЭО в материале определялось разницей в весе до стерилизации и в различное время после нее. Из-за неточности этого метода такие данные не будут применять для вычисления TCL для ЭО.
Шупак [168] изучал местное действие повязок, стерилизованных ЭО, нанесенных на спины людей-волонтеров. Материалом, производившим эффект при самых низких уровнях ЭО, был отрезок поливинилхлорида. Раздражение наблюдалось после контакта с отрезками поливинилхлорида, содержащими ЭО при 893 ppm. В исследовании отрезков поливинилхлорида NIL не сообщался. Отрезки, использованные в исследовании, весили 719 мг, так что MIL эквивалентен 0,642 мг ЭО (0,893 мг ЭО/г материала·0,719 г поливинилхлорида). Два квадратных сантиметра материала были в контакте с кожей, так что MIL для этого исследования, выраженный на основе площади поверхности, составлял 0,32 мг/см (321 мкг/см
).
Танака [179] провел исследование кожного раздражения ЭО-напитанными марлевыми повязками у кроликов. Наивысшая доза, не вызывающая раздражения, была 0,75 мг на повязке. Площадь поверхности повязки составляла 1,77 см, так что NIL, выраженный на основе площади поверхности, составлял 0,424 мг/см
(424 мкг/см
).
Ананд [11] пропитал ватный шарик 0,5 мл раствора ЭО, затем поместил шарик в защечный мешок хомяка. После воздействия в 4 ч наивысшая концентрация ЭО, не приводящая к раздражению после периода наблюдения в 14 сут, составляла 2500 мкг/мл. Так как эффективная площадь поверхности защечного мешка хомяка составляет примерно 1,5 см, NIL, выраженный на основе площади поверхности, составлял 833 мкг/см
.
Значения NIL, полученные в этих исследованиях, суммируются в таблице G.11.
Таблица G.11 - Сравнение исследований раздражающих эффектов ЭО
Исследование | Изделие/материал | NIL или MIL, мкг/см |
[117] | Сердечный катетер | 103 |
[168] | Отрезок поливинилхлорида | 321 |
[179] | Марлевая повязка | 424 |
[11] | Ватный шарик | 833 |
G.6.5.3 Выбор факторов неопределенности для вычисления TCL
Как и при вычислении значений TI для ЭО, факторы неопределенности используют при вычислении TCL для учета индивидуальной вариативности в человеческой популяции в раздражающем ответе на соединение UF4, межвидовых различий в ответе на раздражитель UF5 и недостатков данных UF6.
G.6.5.4 Индивидуальная вариативность UF4
Не существует данных для установления UF4, специфичного для ЭО. Хотя вариативность в человеческой популяции при определенной дозе различных контактных раздражителей хорошо доказана (например, [21]), эти данные недостаточны для обоснования стандартного значения для UF4. Тем не менее индивидуальная вариативность считается минимальной при эффектах, наблюдаемых после имплантации материалов, стерилизованных ЭО. Немногим более высокая вариативность может ожидаться от материалов, контактирующих с кожей, особенно если кожа повреждена. В результате значение UF4, равное 3, будет использовано для вычисления TCL для ЭО, если данные по раздражению получены в исследованиях имплантации или мукозального иммунитета, а значение UF4, равное 5, когда исследования включали эффект ЭО на кожу.
G.6.5.5 Межвидовые различия (UF5)
Нет доступных данных для вычисления значения UF5, специфичного для ЭО. Тем не менее предполагается, что ответы, конкретные для вида, не происходят при местных эффектах, производимых ЭО, особенно для имплантируемых материалов. Таким образом, значение, равное 1, будет использовано для UF5.
G.6.5.6 Недостатки данных
Разные ткани отличаются в своей относительной чувствительности к местным раздражающим эффектам. Таким образом, для ЭО-стерилизованных изделий существует возможность потенциального контакта с тканями (например, паренхимой мозга), которые могут быть более чувствительными к эффектам ЭО, чем участки, использованные в исследованиях, доступных для вычисления TCL. Фактор, равный 3, применяется для учета возможности, что ЭО-стерилизованные материалы могут вступать в контакт с чувствительными тканями.
Значение NIL не определено в [168]. Фактор, равный 2, использовался для учета отсутствия NIL.
Как указано в ISO 10993-17, критической концепцией в вычислении TI или TCL для соединения является "доза пациенту" или биодоступная доза. Когда исследования местного раздражения проводят путем контактирования с кожей или слизистой, определенное количество ЭО может остаться в изделии, а определенное количество может улетучиться. Любой из этих процессов приводит к меньшему количеству ЭО для произведения раздражающего эффекта в месте ткани-мишени. Нет данных по биодоступной дозе ЭО в [11], [168] или [179], но предполагается, что 50% дозы достигает место-мишень. В результате фактор, равный 2, будет использоваться для учета вопросов по биодоступным дозам в этих исследованиях.
Воздействие [11] происходило только 4 ч; тем не менее существует вероятность, что материалы, стерилизованные ЭО, могут находиться в контакте с тканями более 4 ч. Фактор, равный 2, был использован для учета возможности того, что негативные эффекты могут наблюдаться при более низких дозах ЭО в контакте с тканями в течение более длительного периода.
Значения UF4, UF5 и UF6, примененные к каждому исследованию, полученный MF и соответствующие значения TCL приведены в таблице G.12.
Таблица G.12 - Факторы неопределенности и модифицирующие факторы, вычисленные для исследований раздражения ЭО, и TCL, вычисленный по этим данным
Исследование | Место | NIL/MIL, мкг/см | UF4 | UF5 | UF6 | MF | TCL, мкг/см |
[117] | Имплантация | 103 | 3 | 1 | 3 | 10 | 10,3 |
[168] | Кожа | 321 | 5 | 1 | 12 | 60 | 5,4 |
[179] | Кожа | 424 | 5 | 1 | 6 | 30 | 14,1 |
[11] | Слизистая | 833 | 3 | 1 | 12 | 36 | 23,1 |
Основываясь на значениях, полученных в этих четырех различных исследованиях, и учитывая клиническую значимость контактирующих тканей (слизистая и имплантация), более низкий TCL в 10 мкг/см будет адекватно защищающим от местных эффектов, вызванных ЭО, в различных тканях.
G.7 Вычисление допустимых пределов
Допустимым пределом AL является наибольшее количество ЭО, признанное приемлемым в результате воздействия медицинского изделия, и выражается в единицах миллиграммов вдень. Допустимые пределы легко преобразовываются в пределы отдельного изделия, и эти вычисления выделены в G.8. AL является продуктом ТЕ и фактором пользы BF:
![]() .
.
Фактор пользы BF имеет значение в таких случаях, когда воздействие конкретного вымываемого вещества или осадка неизбежно при использовании медицинского изделия и существует значительная польза для здоровья благодаря применению этого конкретного медицинского изделия. Так как не существует легко вычисляемой и/или значительной пользы для здоровья от использования изделий, стерилизованных ЭО (по сравнению с изделием, стерилизованным альтернативным способом), значение BF установлено как равное 1, кроме некоторых конкретных категорий изделий, которые рассмотрены отдельно в приложении F. Таким образом, для всех категорий длительности воздействия допустимый предел равен значению переносимого воздействия, если противное не обозначено в приложении F.
G.8 Вычисление пределов изделия
G.8.1 Общие положения
Максимальное количество ЭО, выраженное как масса от медицинского изделия, является продуктом допустимого предела AL и количества дней возможного использования изделия в конкретной категории длительности воздействия:
![]() ·сут в категории.
·сут в категории.
G.8.2 Изделия ограниченного контакта
Медицинские изделия в категории ограниченного воздействия могут использовать не более 1 сут:
![]() 4,0 мг/сут·1 сут = 4 мг.
4,0 мг/сут·1 сут = 4 мг.
G.8.3 Изделия длительного контакта
Медицинские изделия в категории длительного контакта могут использовать от 2 до 30 сут. Если использовался AL для длительной категории, вычисленной далее, то предел изделия будет соответствовать:
![]() 4,0 мг/сут·30 сут = 120 мг
4,0 мг/сут·30 сут = 120 мг
Тем не менее был сохранен существующий предел в 2,0 мг/сут, и, таким образом, предел длительного изделия соответствует:
![]() 2,0 мг/сут·30 сут = 60 мг.
2,0 мг/сут·30 сут = 60 мг.
Дополнительно, максимальная доза ЭО не должна превышать 4,0 мг в любой период в течение одних суток.
G.8.4 Изделия постоянного контакта
Медицинские изделия в категории постоянного воздействия могут использовать от 31 до 25000 сут. Если использовался AL для постоянной категории, вычисленный далее, то предел изделия будет соответствовать:
![]() 0,28 мг/сут·25000 сут = 7,0 г.
0,28 мг/сут·25000 сут = 7,0 г.
Тем не менее был сохранен существующий предел в 0,1 мг/д, и, таким образом, предел постоянного изделия соответствует:
![]() 0,1 мг/сут·25000 сут = 2,5 г.
0,1 мг/сут·25000 сут = 2,5 г.
Дополнительно максимальная доза ЭО не должна превышать 60 мг в первые 30 сут или 4 мг в любой период в течение одних суток.
G.8.5 Предел, основанный на значении TCL
Для изделий, контактирующих с поверхностью, имеет значение предел, основанный на TCL. Формула для вычисления массового предела, основанного на TCL, следующая:
![]() ,
,
где ![]() - масса на изделие, т.е. максимальная доза пациенту, в миллиграммах;
- масса на изделие, т.е. максимальная доза пациенту, в миллиграммах;
TCL - предел переносимого контакта, мг/см;
- площадь поверхности медицинского изделия в контакте с организмом, см
.
Таким образом, для отдельных изделий примерная площадь, см, будет умножена на TCL в 10 мг/см
для получения предела изделия.
Пример - Площадь поверхности изделия в контакте с телом равна 100 см:
![]() 10 мкг/см
10 мкг/см·100 см
= 1 мг.
Приложение Н
(справочное)
Установление допустимых пределов для ЭХГ
Н.1 Общие положения
Данные по острой токсичности и результаты, полученные при многократном введении доз, показывают что при кожном, оральном и парентеральном введениях ЭХГ легко включается в обменные процессы. Анализ средних летальных доз и доз, не оказывающих воздействия NOAEL, также приводит к выводу, что воздействие ЭХГ в установленные интервалы времени, кратковременное воздействие и т.д. сравнимы при оральном и парентеральном введениях. Согласно данным, полученным при изучении подострой и хронической токсичности, ЭХГ не оказывает более сильного действия при увеличении продолжительности воздействия. Несмотря на то что не замечено проявление токсичности ЭХГ по отношению к органам-мишеням, установленное действие на органы-мишени может изменяться при изменении способа введения и продолжительности воздействия. Предельные значения допустимых суточных доз, которые представлены в последующих разделах, отражают эти общие наблюдения. Для категорий длительного и постоянного контакта были сохранены существующие пределы из стандарта 1995 года, хотя вычисленные значения TI и соответствующие пределы изделия из представленной далее оценки поддерживают более высокие уровни. Обоснованием сохранения существующих пределов являются успешная клиническая история с момента принятия стандарта 1995 года и способность производителей соответствовать этим пределам. В то же время на данный момент не существует клинической или производительной причины для поднятия существующих пределов для длительной и постоянной категорий до уровней, поддерживаемых данной оценкой.
Н.2 Введение
Уровни остаточных веществ для ЭХГ в медицинских изделиях, содержащиеся в данном приложении, были установлены, используя методологию, описанную в 4 ISO 10993-17:2002 для установления переносимого потребления TI. Пределы для ЭХГ в медицинских изделиях основаны на оценке многочисленной научной литературы. Данные по острой токсичности, эффектам на органы-мишени и хронической токсичности у животных были сочтены наиболее подходящими для вычисления этих пределов, как описано в Н.4.
Н.3 Методы
Н.3.1 Общее представление
Подход, описанный в ISO 10993-17, был использован для вычисления значений TI для ЭХГ при различной длительности воздействия.
Пациенты могут потенциально оказаться под воздействием ЭХГ, выделяемого из медицинских изделий от ограниченной до постоянной длительности в результате степени воздействия медицинского изделия. В результате было необходимым вывести отдельные ограниченные, длительные и постоянные значения TI для этого соединения. Хотя в клинических условиях пациенты обычно контактируют с ЭХГ путем парентерального воздействия, существуют очень ограниченные данные по токсичности для получения значений TI для этого пути воздействия. Напротив, существует база данных по эффектам ЭХГ на экспериментальных животных.
Н.3.2 Экстраполяция дозы для одного способа введения по данным для другого способа
Существуют ограниченные данные, относящиеся к воздействию ЭХГ на пациентов ингаляционным путем. Воздействие ЭХГ происходит в результате деривации ЭО в ЭХГ с добавлением молекулы хлора, и, таким образом, существует за счет факторов окружающей среды. Экстраполяция дозы для одного способа введения по данным для другого способа не проводилась в рамках этой оценки риска ЭХГ.
Н.3.3 Подход к неканцерогенной оценке риска
Значения TI для неканцерогенных эффектов ЭХГ были вычислены путем деления наиболее релевантных значений NOAEL или LOAEL из научной литературы на факторы неопределенности для учета данных по вариативности ответа на ЭО в человеческих популяциях UF1, потенциальной межвидовой разницы в действенности UF2 и недостатков данных UF3. ISO 10993-17 подчеркивает использование научных данных при их наличии для вычисления факторов неопределенности, примененных к данным основных исследований токсичности при вычислении значений TI. Следуя этой же философии, данные по вариативности ответа на ЭХГ в человеческих популяциях и по действенности ЭХГ в разных видах использовались для вычисления значений для UF1 и UF2 соответственно.
Н.3.4 Метод оценки канцерогенного риска
ЭХГ не продемонстрировал потенциала вызывать рак в биопробах на животных и не считается возможным человеческим канцерогеном регулирующими органами или консенсусными группами. Значение TI на основе рака не вычислялось для ЭХГ в рамках этой оценки.
Н.3.5 Эффекты, не рассмотренные при вычислении значений TI для ЭХГ
Необходимо отметить, что значения TI для ЭХГ, основанные на неканцерогенных эффектах, необязательно являются защищающими от иммунологических эффектов, таких как реакции гиперчувствительности и анафилаксия, а также от таких эффектов, как гемолиз. Могут быть необходимыми другие подходы для защиты пациентов от этих эффектов, которые были связаны с воздействием ЭХГ.
Н.4 Значения TI для ЭХГ не на основе канцерогенного риска
Н.4.1 Выбор научной литературы
Н.4.1.1 Предел ограниченного воздействия
Допустимый предел AL для предела ограниченного воздействия ЭХГ для продолжительности менее 24 ч составляет 9 мг/сут. Этот предел основан на данных, собранных в исследовании субхронической интраперитонеальной инъекции 6,4 мг/кг ЭХГ крысам в течение 30 сут в качестве уровня ненаблюдаемого негативного эффекта NOAEL (см. [103]). Эта доза была получена от одной десятой уровня дозы более раннего исследования теми же учеными, которое привело к вычислению значения в 64 мг/кг (см. [102]). Сходные результаты острой токсичности
сообщались несколькими исследователями ([104], [116], [159], [162], [194] и [203]) в нескольких видах при различных путях введения. Данные острой токсичности, включая средние летальные дозы
, были доступны и оценены, хотя они не были приемлемы для этой оценки. Данные по
суммированы в таблице Н.1.
Анализ данных в таблице Н.1 указывает, что токсичность ЭХГ для ограниченного воздействия, т.е., менее 24 ч, практически идентична вне зависимости от пути воздействия и относительно сходна для разных видов.
Так как данные отражают значения в таблице Н.1, а не NOAEL или LOAEL, то использовалось значение, определенное как уровень ненаблюдаемого негативного эффекта NOAEL, приведенное в [103], как обозначено выше. В этом исследовании доза в 6,4 мг/кг/сут была выбрана исследователями для показателя одной десятой значения
в изначальном исследовании острой токсичности. Результаты субхронического исследования установили уровень без эффекта и значение в 6,4 мг/кг/сут использовали в сочетании с положениями ISO 10993-17 для формулирования допустимого предела AL для ЭХГ, используя надлежащие факторы неопределенности и модифицирующие факторы:
NOAEL = 6,4 мг/кг/сут.
Таблица Н.1 - Средние летальные дозы для допустимого предела ограниченного воздействия для ЭХГ
Оральная | Внутривенная | Интраперитонеальная | Подкожная | Другая |
Кожа | ||||
Крыса: 50 | Крыса: 67 | Крыса: 44 | Крыса: 60 | |
Крыса: 60 | Кролик: 80 | Крыса: 58 | Крыса: 72 | Кролик: 67,8 |
Кролик: 60 | Крыса: 84 | Крыса: 60 | Кролик: 100 | Морская свинка: 84 |
Крыса: 70 | Крыса: 100 | Крыса: 63 | Мышь: 120 | |
Крыса: 71,3 | Крыса: 110 | Крыса: 64 | Мышь: 150 | |
Крыса: 72 | Мышь: 120 | Крыса: 70 | ||
Мышь: 80 | Кролик: 80 | |||
Мышь: 81,4 | Кролик: 84,6 | |||
Мышь: 91 | Морская свинка: 85 | |||
Мышь: 95 | Морская свинка: 85,5 | |||
Морская свинка: 110 | Кролик: 90 | |||
Мышь: 150 | Мышь: 97 | |||
Мышь: 180 | Мышь: 98,4 | |||
Мышь: 120 | ||||
Мышь: 130 |
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность у человека) = 10;
- UF2 (межвидовая вариация) = 1;
- UF3 (качество/релевантность данных) = 1.
Стандартное значение UF1 = 10 применяют у человека для индивидуальной изменчивости, так как значение вычислено из среднего значения для животных и предположения, что вариативность будет такой же у человека.
Значение UF2 = 1 для межвидовой вариации основано на понимании [80] и [81], обозначающих, что низкие концентрации ЭХГ детоксифицируются в печени конъюгацией глутатиона в -карбоксиметилглутатион. Детоксификация поддерживается, пока в наличии достаточные концентрации глутатиона. При более сильном воздействии ЭХГ концентрации глутатиона будут сокращены, что приведет к общей явной токсичности. Так как животные и человек имеют этот сходный механизм детоксификации, а концентрация в 6,4 мг/кг/сут приводит к NOAEL, то значение UF2 соответственно установлено равным 1.
Значение UF3, равное 1, также установлено, учитывая релевантность и надежность данных:
a) Модифицирующий фактор MF:
- MF = UF1·UF2·UF3; или
- MF = 10·1·1 = 10;
- Tl = NOAEL/MF, или TI = 6,4 мг/кг/сут/10 = 0,64 мг/кг/сут.
b) Фактор утилизации UTF:
- UTF = CEF (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
- CEF = 0,2;
- PEF = 1;
- UTF = 0,2·1 = 0,2.
c) Переносимое воздействие ТЕ:
- ТЕ = TI·BW·UTF;
- ТЕ = 0,64 мг/кг/сут·70 кг·0,2 = 9 мг/сут.
d) Допустимый предел AL:
- это смещение включает применение фактора пользы BF посредством положений ISO 10993-17 на индивидуальной основе. В данном случае достижение ТЕ возможно для ЭХГ, и следовательно, BF принимает стандартное значение, равное 1. Допустимый предел вычисляют следующим образом:
- допустимый предел = ТЕ·BF;
- AL = 9·1 = 9 мг/сут при воздействии менее чем 24 ч;
- предел приемлем в контексте NOAEL, вычисленных по данным хронической/репродуктивной токсичности, основанных на низкой NOAEL в 6,4 мг/кг/сут для 70-килограммового взрослого для повторного введения.
Н.4.1.2 Предел длительного воздействия
Предельное значение при воздействии от 24 ч до 30 сут составляет 3,8 мг/сут и не должно превышать 9 мг для отдельно взятых суток или 114 мг/мес (3,8 мг·30 сут). В основе этого предельного значения лежат данные по изучению подострой токсичности и влияния на репродуктивную функцию (тератогенность), полученные для животных нескольких видов. Эти данные приводят многие исследователи (см. [8], [10], [18], [38], [83], [85], [103], [145] и [203]). При многократных оральном и парентеральном введениях, продолжавшихся различные периоды времени вплоть до 403 сут, ЭХГ оказывал разнообразные вредные эффекты, включая летальный исход (сопровождающийся увеличением массы отдельных органов, явлением мускатной печени, геморрагией в ткани надпочечников, геморрагией в ткани гипофиза, кровоизлияниями в желудочно-кишечный тракт, миокардитами, гиперемией щитовидной железы, застойными явлениями в легких, наблюдавшимися в одном исследовании), уменьшение массы тела и замедление роста, увеличение массы мозга, надпочечников, почек, легких и щитовидной железы, небольшое уменьшение и повреждение яичек, рвоту, уменьшение гемоглобина, гематокритного числа и гематокрита, повреждения печени, эктопический гемопоэз, гиперплазию костного мозга, а также сдвиг лейкоцитарной формулы в сторону образования лимфоцитов. Дозы варьировались от 2,7 до 93 (мг/кг)/сут и более. Изучение влияния на репродуктивную функцию включало в себя исключительно тератологические исследования, в которых ЭХГ вводили на разных стадиях беременности. В этих исследованиях ЭХГ оказывал токсическое действие на материнский организм, проявлял фетотоксическое действие и в одном из исследований приводил к увеличению пороков развития плода. Последний эффект проявлялся только в потомстве мышей, которым вводили ЭХГ внутривенно в дозе 120 (мг/кг)/сут. Данная доза соответствует области острой летальности [80]. Результирующие данные, которые положены в основу расчета предельного значения при длительном воздействии, представлены в таблице Н.2.
Таблица Н.2 - Данные, использованные для установления предела длительного воздействие для ЭХГ
Вид исследования | Доза NOEL, орально | Доза NOEL, парентерально |
(мг/кг)/сут [ссылка] | ||
Субхроническая токсичность | 13 [145] | 2,7, пропорционально рассчитанное от 6,4 три раза в неделю [103] |
Изучение влияния на репродуктивную функцию | 50 [38] | 9 [83] |
Анализ этих данных позволяет прийти к выводу, что не оказывающие действия дозы ЭХГ для периода длительного воздействия, то есть от 1 до 30 сут, сравнимы, независимо от того, является ли это действием на специфический орган-мишень или репродуктивную функцию, и не зависят от способа введения. Животные могут оказаться более чувствительными к общему токсическому действию ЭХГ на организм, чем к его способности оказывать вредное влияние на репродуктивную функцию. Субхроническое исследование, проведенное Лоуренсом и др. [103] использовало одну десятую дозы в 6,4 мг/кг/сут, которая была рассчитана из дозы их изначального исследования, ранее сообщаемой как 64 мг/кг. Исследование показало, что 6,4 мг/кг/сут ЭХГ, вводимое три дня в неделю в течение 30 дней, привело к вычисленной NOAEL в 2,7 мг/кг/сут при парентеральном введении. Эту дозу крысам использовали как основу для вычисления допустимого предела для длительного воздействия следующим образом:
NOAEL = 6,4 мг/кг/сут·3 сут/7 сут = 2,7 мг/кг/сут.
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность у человека) = 10;
- UF2 (межвидовая вариация) = 1;
- UF3 (качество/релевантность данных) = 1.
Факторы неопределенности, используемые в данном подпункте, являются теми же, которые были использованы в разделе по ограниченному воздействию, так как дата и обоснования те же.
a) Модифицирующий фактор MF:
- MF = UF1·UF2·UF3;
- MF = 10·1·1=10;
- Tl = NOAEL/MF, или Tl = 2,7 мг/кг/сут/10 = 0,27 мг/кг/сут.
b) Фактор утилизации UTF:
UTF = CEF (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
CEF = 0,2;
PEF = 1;
UTF = 0,2·1 = 0,2.
c) Переносимое воздействие ТЕ:
- ТЕ = TI/MF·BW·UTF;
- ТЕ = 0,27 мг/кг/сут·70 кг·0,2 = 3,8 мг/сут
d) Допустимый предел AL:
- это смещение включает применение фактора пользы BF посредством положений ISO 10993-17 на индивидуальной основе. В данном случае достижение ТЕ возможно для ЭХГ, и, следовательно, BF принимает стандартное значение, равное 1.
Допустимый предел вычисляют следующим образом:
- допустимый предел = ТЕ·BF;
- AL = 3,8·1 = 3,8 мг/сут в течение периода в 30 сут;
- этот предел считается достаточным для 70-килограммового мужчины при наблюдении, фиксирующем, что ЭХГ не повышается в показателях токсичности после хронического воздействия по сравнению с длительным воздействием. Предел основан на данных животных.
Н.4.1.3 Предел постоянного воздействия
Допустимый предел при постоянном воздействии от 30 сут или более и на протяжении всей жизни составляет 10 г. Оно не должно превышать 9 мг для отдельно взятых суток или 114 мг/мес. Эти предельные значения получены на основе данных по хронической токсичности, генотоксичности и канцерогенности, которые приведены в работах [81], [116] и [133]. В этих исследованиях крысы до возраста двух лет получали ЭХГ в питьевой воде. ЭХГ вводили крысам путем подкожных инъекций дважды в неделю, по меньшей мере, в течение года, а также путем накожных аппликаций крысам и мышам в течение 103-104 нед. Дозы варьировались от 0,086 до 71 (мг/кг)/сут или более. При этом не наблюдалось увеличения числа случаев возникновения опухолей, связанных с введением ЭХГ, или проявления хронической токсичности, кроме возможного снижения жизнеспособности крыс [81]. Результирующие данные, послужившие основой для расчета прогнозируемых предельных значений при постоянном воздействии, приведены в таблице Н.3.
Анализ этих данных, полученных при оральном и парентеральном введениях, позволяет прийти к выводу, что дозы ЭХГ, не оказывающие эффекта при постоянном воздействии, то есть от 30 сут и на протяжении жизни, сравнимы и сходны с теми, которые были получены при изучении подострой токсичности и влияния на репродуктивную функцию. Животные более чувствительны к общетоксическому действию, оказываемому ЭХГ, чем к его способности, если она существует, вызывать рак.
Таблица Н.3 - Данные, использованные для установления предела постоянного воздействия для ЭХГ
Вид исследования | Оральная NOAEL | Парентеральная NOAEL | Дермальная NOAEL |
Хроническая токсичность | 4·LOAEL | 2,9 - значение, рассчитанное исходя из введения 10 дважды в неделю [116] | Нет данных |
Канцерогенность | 16 [81] | Нет данных | 71 - значение, рассчитанное исходя из введения 100 пять раз в неделю |
| |||
Минимальная доза, не оказывающая действия при изучении хронической токсичности, составляющая 2,9 (мг/кг)/сут при подкожном введении крысам в течение, по меньшей мере, года, а при изучении возникновения опухолей составляющая 16 (мг/кг)/сут при оральном введении крысам не старше 24 мес, положена в основу расчета прогнозируемого предельного значения при постоянном воздействии в 10 г следующим образом: LOAEL = 2,9 мг/кг/сут.
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность у человека) = 10;
- UF2 (межвидовая вариация) = 10;
- UF3 (качество/релевантность данных) = 1.
Стандартное значение UF1 = 10 для индивидуальной вариативности у человека используется, так как значение получено из среднего значения для животных и предполагается сходная вариативность у человека.
Стандартное значение UF2 = 10 для межвидовой вариации используется, так как нет четкого понимания долгосрочных эффектов на метаболической деятельности после воздействия ЭХГ на человека. Считается, что низкие концентрации ЭХГ детоксифицируются в печени энзиматической глюкоронидацией в -карбоксиметилглутатион (см. [81]), но этого недостаточно для экстраполяции на воздействие в течение жизни.
Значение UF3 = 1 соответственно установлено, учитывая релевантность и надежность данных.
a) Модифицирующий фактор MF:
- MF = UF1·UF2·UF3;
- MF = 10·10·1 =100;
- Tl = LOAEL/MF, или 2,9 мг/кг/сут/100 = 0,029 мг/кг/сут.
b) Фактор утилизации UTF:
- UTF = (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
- CEF = 0,2;
- PEF = 1;
- UTF = 0,2.
c) Переносимое воздействие ТЕ:
- ТЕ = TI/MF·BW·UTF;
- ТЕ = 2,9 мг/кг/сут/100·70 кг·0,2 = 0,4 мг/сут.
d) Допустимый предел (AL):
- это смещение включает применение фактора пользы BF посредством положений ISO 10993-17 на индивидуальной основе. В данном случае достижение ТЕ возможно для ЭХГ, и, следовательно, BF принимает стандартное значение, равное 1.
Допустимый предел вычисляют следующим образом:
- допустимый предел = ТЕ·BF;
- AL = 9·1 = 9 мг в любые отдельные сутки;
- AL = 2,9 мг/кг/сут/100·70 кг·0,2·25000 сут = 10 г в течение жизни.
После анализа этих прогнозируемых пределов 9 мг/сут и 10 г/жизнь было определено, что 9 мг/сут будут адекватно защищающими от негативных эффектов ЭХГ, происходящих от постоянного воздействия. Таким образом, на основе данных животных предел предоставляет по меньшей мере 100-кратный запас безопасности для 70-килограммового взрослого от потенциальных негативных эффектов ЭХГ в результате постоянного воздействия.
Н.4.2 Выбор факторов неопределенности для неканцерогенных эффектов
Таблица Н.4 - Факторы неопределенности для вычисления TI
Назначение фактора неопределенности | Диапазон | Величина стандартного UF | Описание |
UF1, индивидуальная вариативность в человеческой популяции | От 1 до 10 | 10 | Для учета вариативности ответа между средним показателем здоровой популяции и ответом некоторой пропорции чувствительной субпопуляции |
UF2, межвидовая экстраполяция | От 1 до 10 | 1 | Для учета возможности, что человек более чувствителен к негативным эффектам соединения, чем экспериментальные животные |
UF3, качество и релевантность данных исследований | От 1 до 100 | 1 | Для учета ограничений доступных токсикологических данных для вычисления TI, включая отсутствие значения NOAEL, отсутствие NOAEL долгосрочных исследований и отсутствие данных по клинически релевантному пути воздействия |
Н.5 Вычисление предела переносимого контакта TCL
Существуют ограниченные опубликованные данные по раздражающим эффектам ЭХГ. Вычисление TCL релевантно. Предполагается, что предел, вычисленный из TCL, приемлем для изделий, контактирующих с поверхностью и, возможно, имплантируемых изделий.
Гесс [61] провел исследование, в котором кожное нанесение неразбавленного ЭХГ привело к незначительному раздражающему ответу у кроликов. Тем не менее внутрикожные и внутримышечные инъекции ЭХГ привели к сильному раздражению в месте инъекции. Разбавленные растворы ЭХГ вызвали умеренный ответ внутрикожных тканей и слизистой пениса. При разбавлении до 80% несколько исследователей не обнаружили раздражающего ответа (см. [59], [61], [102] и [103]), продемонстрировав, что при кожном нанесении ЭХГ на модель кролика при средней концентрации в 68 мг/кг эффект на был незначителен и не наблюдалось никакого местного раздражения. Предполагается, что это происходит по причине крайне быстрой скорости абсорбции химического соединения, которое затем быстро преобразовывается печенью в токсичный метаболит. Дополнительные внутрикожные исследования и тесты на раздражение глаз, проведенные исследователями, привели к высоким показателям раздражения для неразбавленного ЭХГ. Тем не менее растворы ЭХГ в 5% и 1% (по объему) показали незначительное раздражение или его отсутствие, соответственно. Эти данные указывают, что ЭХГ является высоким раздражителем для внутрикожных и глазных тканей. В результате TCL и внутрикожный TCL будут вычислены для концентраций ЭХГ нераздражающего уровня NIL и минимально раздражающего уровня MIL соответственно.
TCL для ЭХГ вычисляют следующим образом. Используется подход модифицирующего фактора для вычисления TCL. Этот подход включает применение факторов неопределенности (см. выше) для предоставления приемлемого запаса безопасности против раздражения. Формула для вычисления TCL, мг/см, применяя подход модифицирующего фактора, следующая:
![]() ,
,
где MFTCL - модифицирующий фактор (UF4·UF5·UF6);
NIL - нераздражающий уровень, мг;
MIL - минимально раздражающий уровень, мг;
- площадь поверхности контакта с организмом, см
.
Выше приведено обоснование для поддержки выбора следующих значений для каждого фактора неопределенности, необходимого для вычисления TCL:
- UF4 индивидуальная вариативность = 10;
- UF5 межвидовая экстраполяция = 1;
- UF6 недостатки данных = 1.
MFTCL = 10·1·1 = 10.
Лоуренс и др. [103] нанесли в виде кожной аппликации кроликам максимальное количество 80%-ого раствора ЭХГ в объеме в 0,2 мл на площадь поверхностью 3,27 см (0,5 квадратных дюйма). Это исчислялось как 160 мг ЭХГ на 3,27 см
и не привело к наблюдаемому раздражению кожи, таким образом наблюдаемый нераздражающий уровень NIL:
NIL = 80%-ный раствор = 0,2 мл·80 г/100 мл = 160 мг дозы.
TCL соответствует:
TCL = 160 мг/(10·3,27 см) = 4,89 мг/см
.
TCL таким образом равен 5 мг/см.
Лоуренс и др. [103] провели вторичное внутрикожное исследование раздражения у кролика, используя различные разбавления ЭХГ. В этом исследовании все разбавления вызвали резкое местное кожное раздражение, за редким исключением приводящее к местному некрозу тканей. Растворы 1% и 5% ЭХГ были оба нераздражающими и минимально раздражающими (сомнительно) соответственно согласно используемому стандартному методу измерения. Предполагалось, что это было результатом задерживания ЭХГ в местной области, который затем не биотрансформировался и, таким образом, привел к местному токсичному ответу тканей. Не игнорируя это, вторичный минимальный уровень раздражения MIL был вычислен исходя из этих внутрикожных доз:
MIL = 0,5%-ный раствор = 0,2 мл·5 г/100 мл = 10 мг внутрикожного ЭХГ.
Это означает, что внутрикожное воздействие не является раздражающим при дозе в 10 мг на животное. Для этой цели используют приближенное значение в 2,5 кг на кролика. Если затем применяют те же факторы неопределенности, как при первоначальном TCL, то для человека будет следующее вычисление:
- внутрикожный TCL = доза кролика (мг/кг)/MFTCL·70-килограммовый мужчина;
- внутрикожный TCL = [(10 мг/2,5 кг)/100]·70-килограммовый мужчина;
- внутрикожный TCL = 17,5 мг/кг.
Это означает, что внутрикожный MIL для человека составляет 17,5 мг/кг.
Приложение I
(справочное)
Установление допустимых пределов для ЭГ
_______________
Эта информация включена для полноты, так как не считается необходимым устанавливать допустимые пределы для ЭГ, если пределы ЭО контролируются на уровнях, обозначенных в настоящем стандарте.
I.1 История
Пределы остаточного содержания ЭГ в медицинских изделиях были установлены, используя методологию, описанную ранее для ЭО и ЭХГ для неканцерогенных конечных точек. ЭГ не является генотоксином (см. [17], [135] и [136]), он не продемонстрировал никакого канцерогенного потенциала в животных биопробах (см. [41]) и не считается канцерогеном (см. [135] и [136]). По этим причинам и потому что для большинства материалов, используемых в производстве медицинских изделий, стерилизованных ЭО, конверсия ЭО в ЭГ будет незначительной, не считалось необходимым устанавливать допустимые пределы для ЭГ. Это приложение использует тот же метод, который применялся для установления допустимых пределов для ЭО и ЭХГ, чтобы продемонстрировать, что допустимые пределы для ЭГ будут значительно выше, чем пределы для ЭО и ЭХГ, и вряд ли будут достигнуты большинством материалов изделия.
Когда некоторые естественные материалы (например, коллаген, хлопок и т.д.) становятся частью ЭО-стерилизованных медицинских изделий, возможно наблюдать крайне высокие концентрации ЭГ. Производитель должен учитывать, что, если такие высокие уровни ЭГ наблюдаются, это не становится опасностью для пациента и не мешает функционированию медицинского изделия.
I.2 Общие положения
I.2.1 Общее представление
Данные острой токсичности и данные повторной дозы показывают, что, хотя ЭГ не очень эффективен, он доступен системному кровообращению после орального и парентерального воздействия. Анализ средних летальных доз и уровней с ненаблюдаемым эффектом NOAEL также предполагает, что эффект ЭГ при конкретных временных интервалах, ограниченном воздействии и т.д. сравним при оральном и парентеральном путях. Основываясь на данных, полученных в исследованиях субхронической и хронической токсичности, ЭГ не становится более действенным, если длительность воздействия увеличена. Почки являются основным органом-мишенью для ЭГ.
I.2.2 Ограниченное воздействие
ЭГ не представляет собой практической опасности для здоровья при воздействии медицинских изделий длительностью менее чем 24 ч. Это заключение основано на данных острой токсичности, полученных от разных видов животных и научных отчетов об отравлении человека после проглатывания ЭГ или продуктов, его содержащих (см. [85], [101], [116], [160], [162], [203] и [204]). Также существуют многочисленные отчеты о смерти человека в результате поглощения ЭГ. Основываясь на этих данных, примерной летальной дозой ЭГ для человека является 1,4 мл/кг (см. [160]) или около 111 г на взрослого. Так как известно, что насыщение человеческого метаболизма ЭГ происходит при 125 мг/кг (см. [20] и [148]) и что данные по человеку всегда более убедительны при установлении пределов безопасности, эта доза использовалась как основа для вычисления допустимого предела для ограниченного воздействия следующим образом: NOAEL = 125 мг/кг/сут.
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность человека) = 10 (стандартное значение);
- UF2 (межвидовая вариация) = 1 (существуют данные по человеку);
- UF3 (качество/релевантность данных) = 1 (релевантные данные).
Модифицирующий фактор MF:
- MF = UF1·UF2·UF3 или MF = 10·1·1 или MF = 10;
- ![]() , или
, или ![]() , или TI = 12,5 мг/кг/сут.
, или TI = 12,5 мг/кг/сут.
Фактор утилизации UTF:
- UTF = CEF (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
- CEF = 0,2 (стандартное значение);
- PEF = 1 (однодневное воздействие);
- UTF = 0,2.
Переносимое воздействие ТЕ:
- ТЕ = TI·BW·UTF или ТЕ = 12,5 мг/кг/сут·70 кг·0,2 или ТЕ = 175 мг/сут.
Допустимый предел AL:
- фактор пользы (BF) = 1 (стандартное значение);
- AL = ТЕ·BF или AL = 175 мг/сут·1 или AL = 175 мг/сут или 175 мг/изделие.
После анализа этого допустимого предела было определено, что будет крайне маловероятным, что человек может быть под воздействием такого количества ЭГ при ограниченном контакте с медицинскими изделиями.
I.2.3 Длительное воздействие
Предел длительного воздействия для ЭГ основан на анализе данных субхронической токсичности и репродуктивных эффектов (тератогенность, доминантная летальность и репродуктивная токсичность), вызванных у животных (см. [42], [55], [67], [115], [122], [137], [149], [150], [152], [153], [164], [185], [203] и [204]).
В оральных и парентеральных исследованиях повторной дозы различной продолжительности периодами до 157 дней ЭГ произвел разнообразные негативные эффекты, происходящие в основном его метаболизма с оксалатом*, включающие оксалурию, повреждения почек (нефроз, расширение канальцев, воспаление), повышенные мочевинный азот и креатинин, почечные кристаллы, кристаллы мозга, сниженный рост, центродолевую дегенерацию печени, сдвиг в лейкоцитах к нейтрофилам, а также повышенное содержание паренхиматозных клеток костного мозга и эктопический гематопоэз. Дозировки были в диапазоне от 50 до 2200 мг/кг или более. Исследования репродуктивности включали исследования тератологии, в которых ЭГ вводился в различные временные периоды гестации и общие исследования, в которых оценивали эффект ЭГ на фертильность, репродуктивную функцию, тератогенность и фетальное развитие, а также потенциал ЭГ вызывать доминантные летальные эффекты. Последние исследования по длительности включали несколько поколений.
________________
* Текст документа соответствует оригиналу. - .
Дозировки были в диапазоне от 40 до 5000 мг/кг или более. В тератологических исследованиях (все проводились с оральным введением) ЭГ привел к токсичности материнского организма, эмбриональной токсичности, фетальной токсичности и аномалиям в тканях скелета и внутренних органов при дозировках свыше 150 мг/кг. В исследованиях нескольких поколений (также проводимых только оральным введением) дозировка в 1840 мг/кг (вычисленная по исследованию, в котором ЭГ вводился при концентрации в 0,5% в питьевой воде (см. [97]) не произвела никаких негативных эффектов, а для признаков фетальной токсичности (сниженный вес детенышей), эмбриональной токсичности (сниженная численность потомства) и тератогенности потребовалась дозировка свыше 1000 мг/кг.
Анализ данных показал, что уровни ЭГ без наблюдаемого эффекта для периодов длительного воздействия, то есть от 1 до 30 сут, были сопоставимы вне зависимости от пути воздействия на конкретные органы-мишени или репродуктивную функцию. Животные были немного более чувствительны к общей системной токсичности ЭГ, чем к его способности производить негативные изменения в репродуктивности. Для обеспечения большей защиты пациента была использована самая низкая NOEL, 50 мг/кг, полученная в исследовании подкожной токсичности у собак (см. [203]), в качестве основы для вычисления допустимого предела при длительном воздействии следующим образом:
NOAEL = 50 мг/кг/сут.
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность человека) = 10 (стандартное значение);
- UF2 (межвидовая вариация) = 5 (сходный ответ);
- UF3 (качество/релевантность данных) = 1 (релевантные данные).
Модифицирующий фактор MF:
- MF = UF1·UF2·UF3 или MF = 10·5·1 или MF = 50;
- ![]() , или
, или ![]() , или TI = 1,0 мг/кг/сут.
, или TI = 1,0 мг/кг/сут.
Фактор утилизации UTF:
- UTF = CEF (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
- CEF = 0,2 (стандартное значение);
- PEF = 1 (стандартное значение);
- UTF = 0,2.
Переносимое воздействие ТЕ:
- ТЕ = TI·BW·UTF или ТЕ = 1,0 мг/кг/сут·70 кг·0,2 или ТЕ = 14 мг/сут.
Допустимый предел AL:
- фактор пользы (BF) = 1 (стандартное значение);
- AL = ТЕ·BF или AL = 14 мг/сут·1 или AL = 14 мг/сут или 420 мг/изделие.
I.2.4 Постоянное воздействие
Предел постоянного воздействия был основан на анализе данных хронической токсичности и канцерогенности (см. [24], [25], [41], [116] и [129]). В этих исследованиях крысы, мыши и обезьяны получали ЭГ в корме два или три года, а крысы получали ЭГ путем подкожной инъекции дважды в неделю по меньшей мере в течение года. В исследованиях орального воздействия животные продемонстрировали почечные изменения (склероз, кальцификация, нефрит, гиперплазия клеток почечного канальца), отложение оксалата, повышенные мочевинный азот и креатинин, сниженные гематологические параметры (гематокрит, гемоглобин и количество эритроцитов), минерализацию мягких тканей, паращитовидную гиперплазию и повреждения печени (жировые изменения). Эти изменения не сообщались после подкожного введения, а также не было повышения в формировании опухолей в этих исследованиях. Дозировки были в диапазоне от 8,6 до 800 мг/кг или более.
Анализ этих данных выявил некоторую чувствительность к пути воздействия при уровнях ненаблюдаемого эффекта для ЭГ при периоде постоянного воздействия, т.е. от 30 дней до протяжения жизни; тем не менее они сопоставимы с данными, полученными в исследованиях субхронической и репродуктивной токсичности. Для предоставления наибольшей защиты для пациента использовалась самая низкая NOEL для хронической токсичности, 40 мг/кг/д, вводимая в диету крыс в течение двух лет, как основа для вычисления допустимого предела при постоянном воздействии следующим образом:
NOAEL = 40 мг/кг/д.
Факторы неопределенности UF:
- UF1 (индивидуальная вариативность человека) = 10 (стандартное значение);
- UF2 (межвидовая вариация) = 5 (сходный ответ);
- UF3 (качество/релевантность данных) = 1 (релевантные данные).
Модифицирующий фактор MF:
- MF = UF1·UF2·UF3 или MF = 10·5·1 или MF = 50;
- ![]() , или
, или ![]() , или TI = 0,8 мг/кг/сут.
, или TI = 0,8 мг/кг/сут.
Фактор утилизации UTF:
- UTF = CEF (фактор сопутствующего воздействия)·PEF (фактор пропорционального воздействия);
- CEF = 0,2 (стандартное значение);
- PEF = 1 (стандартное значение);
- UTF = 0,2.
Переносимое воздействие ТЕ:
- ТЕ = TI·BW·UTF или ТЕ = 0,8 мг/кг/сут·70 кг·0,2 или ТЕ = 11,2 мг/сут.
Допустимый предел AL:
- фактор пользы (BF) = 1;
- AL = TE·BF или AL = 5,6 мг·1 или AL = 11,2 мг/сут или 280 мг/изделие.
I.2.5 Предел переносимого контакта (TCL)
Для ЭГ не были разработаны глобальные пределы переносимого контакта, так как местная концентрация и конкретные пути воздействия играют ключевую роль при определении потенциала к местному раздражению. Рекомендуется обращаться с местным раздражением ЭГ, следуя ISO 10993-10 и ISO 10993-4. Обзор научной литературы показал, что у ЭГ в целом низкий потенциал к кожному раздражению. Однократное воздействие 10% ЭГ было отрицательным в накожной пробе на человеке (см. [96]), в то время как в другом исследовании на человеке повторное воздействие показало, что ЭГ является незначительным кожным раздражителем (см. [168]). Нераздражающая концентрация для острого раздражения глаза находилась в диапазоне от 0,4% до 5% (см. [118], [119] и [120]), а нераздражающая концентрация для повторного глазного воздействия была 20% (см. [120]).
Приложение J
(справочное)
Приготовление контрольных растворов ЭО и ЭХГ
J.1 Приготовление контрольных растворов ЭО
J.1.1 Сбор газа ЭО
Соединяют стандартный баллон, содержащий ЭО, с флаконом объемом приблизительно 30 мл, как показано на рисунке J.1. Протыкают инъекционной иглой пробку флакона таким образом, чтобы кончик иглы находился в верхней части флакона. Присоединяют полихлорвиниловую трубку к выходной игле 2 и опускают конец трубки в колбу с водой.
Внимание! Крайне важно для защиты исследователя от вредного действия проводить данную процедуру в вытяжном шкафу (см. п.4.4.1.1).
|
1 - клапан; 2 - второй регулирующий клапан; 3 - полихлорвиниловые трубки; 4 - стакан с водой (300 мл); 5 - сыворотка флакон (30 мл); 6 - ЭО входа иглы 1; 7 - ЭО выхода иглы 2; 8 - обжимной колпачок с PFTE перегородки; 9 - баллон с газообразным ЭО
Рисунок J.1 - Устройство для приготовления стандартов ЭО
Другой трубкой связывают регулятор баллона с иглой для инъекций. Протыкают второй иглой или входной иглой (1) пробку флакона и опускают ее конец вниз до дна. Начинают пропускать ЭО через систему таким образом, чтобы пузырьки вытесняемого газа выходили из трубки со скоростью один пузырек в секунду. Продувают сосуд в течение приблизительно 15 мин. Удаляют входную иглу из флакона и уравновешивают давление газообразного ЭО в сосуде с атмосферным, что достигается удалением выходной иглы, как только появится последний пузырек из трубки в колбе. В приближении к закону для идеальных газов можно показать, что концентрация ЭО во флаконе составит 1,83 мкг/мл при давлении 760 мм рт.ст. и температуре 20°С.
_______________
1 мм рт.ст. = 133,322 Па или 760 мм рт.ст. = 101,325 кПа.
Концентрация этиленоксида , мкг/мкл, согласно закону для идеальных газов, может быть рассчитана для конкретной температуры
, °С, и давления
, мм рт.ст., по формуле
![]() ,
,
где 0,706 - значение, обратное газовой постоянной для определения ЭО, гК/мм рт.ст.л.
J.1.2 Разбавления контрольных растворов ЭО для анализа методом равновесной паровой фазы
Разбавляют контрольный раствор, приготовленный согласно J.1.1, во флаконе (номинальный объем 15 мл). Объем флакона должен быть предварительно определен с погрешностью до 0,01 мл (при анализе образцов необходимо использовать флаконы такой же вместимости). Сначала во флакон пропускают сухой азот в течение 1 мин. Из первого флакона с газообразным ЭО отбирают около 10 мкл с помощью газового шприца. Удаляют шприц из флакона и поршнем шприца получают желаемый объем в 10 мкл в положении с поднятой вверх иглой.
Помещают флакон, продутый азотом, на конец направленной вверх иглы и вводят 10 мкл ЭО во флакон. Не прокачивая шприц, немедленно удаляют его из флакона. Теперь флакон содержит 18,3 мкг ЭО при температуре 20°С и давлении 760 мм рт.ст. Уравновешивают концентрацию ЭО с окружающими условиями, как описано в J.1.1.
Вводят пробу газа 100 мкл из второго флакона в газовый хроматограф для получения хроматограммы. Анализ повторяют дважды. Приготавливают более высококонцентрированные контрольные растворы путем разбавления больших аликвот чистого газообразного ЭО из первого флакона. Так как во флаконах содержится свободный газообразный ЭО, контрольные растворы не нужно нагревать в отличие от других образцов.
В остальное время хранят основные стандартные растворы в холодильнике, а приобретенные - согласно условиям, указанным производителем (см. приложение F). Устанавливают стабильность хранения и срока годности для основных растворов ЭО. Изготавливают свежие калибровочные стандартные растворы ежедневно. Утилизируют после использования.
J.1.3 Разбавления стандартных образцов ЭО для методов с участием растворителя
_______________
Удобнее переносить жидкий ЭО с помощью предварительно охлажденного шприца. Следует принять меры предосторожности, чтобы игла шприца не касалась растворителя.
Опыт показал, что ошибки измерения, связанные с приготовлением основных растворов, постоянны и не зависят от объема приготовленного раствора. Относительная ошибка будет меньше, если приготовить и использовать большие объемы.
Для повышенной безопасности и точности рекомендуется приобретать контрольные растворы ЭО и ЭХГ известных и сертифицированных концентраций у коммерческих источников. Если это невозможно, основные контрольные растворы ЭО могут быть приготовлены из чистого соединения, как описано ниже.
Устанавливают баллон, содержащий газообразный ЭО с нормированными характеристиками, как описано в J.1.1, соединив его с флаконом, предварительно продутым, как описано выше, и помещенным в баню со смесью сухого льда с изопропанолом или аналогичную, чтобы сконденсировать газообразный ЭО в жидкость. К флакону через иглу для инъекций присоединяют только трубку, по которой поступает ЭО из баллона. Нет необходимости вставлять выходную иглу (2), так как ЭО собирают в жидком виде.
Заполняют флакон нужным объемом жидкого ЭО, перекрывают регулятор на баллоне и удаляют иглу для инъекций с трубкой. Достают флакон из бани со льдом.
Взвешивают герметично закрытую мерную колбу объемом 100 мл (с пробкой с покрытием из ПТФЭ), содержащую 60 мл растворителя, с погрешностью 0,1 мг. Добавляют в колбу пять капель жидкого ЭО и вновь взвешивают. Заполняют колбу растворителем до отметки 100 мл, переворачивают и перемешивают.
_______________
Если необходимо временное хранение флакона, было обнаружено, что контрольные растворы наиболее стабильны, если флакон хранится в перевернутом виде.
Вводят от 1 до 5 мкл аликвот каждого контрольного раствора в колонку хроматографа для получения значения площади или высоты пика. Определение повторяют дважды.
В остальное время хранят основные стандартные растворы в холодильнике, а приобретенные - согласно условиям, указанным производителем (см. приложение F). Изготавливают свежие калибровочные стандартные растворы ежедневно. Утилизируют после использования.
Опыт практической газовой хроматографии показывает, что при введении образцов в колонку газового хроматографа точность ввода улучшается при увеличении вводимого объема образца. Относительная ошибка, связанная с неточностью калибровки шприца, уменьшается при увеличении вводимого объема. Для повышения точности объем вводимой пробы должен составлять не менее 10% объема шприца.
При попытке увеличить точность вводимого объема за счет реального вводимого объема, необходимо убедиться в том, что колонка не перегружается. Учитывая современную технологию автодозаторов, вопрос точности и правильности вводимого объема не должен быть проблемой.
J.2 Приготовление контрольных растворов ЭХГ
Взвешивают мерную колбу объемом 100 мл, содержащую 60 мл воды, с погрешностью 0,1 мг. По каплям добавляют ЭХГ (около 100 мг). Вновь взвешивают колбу, определяют разницу в массах; затем доводят объем до метки водой и перемешивают. Если контрольные растворы используют не сразу, их хранят в холодильнике (см. приложение F). Устанавливают стабильность хранения и срока годности для основных растворов ЭХГ. Изготавливают рабочие стандартные растворы ежедневно и утилизируют после использования. Доводят контрольные растворы ЭХГ до комнатной температуры. Готовят как минимум три рабочих раствора различной концентрации. До использования контрольных растворов для построения калибровочного графика проверяют линейность параметров хроматографического пика в этих областях концентраций. Готовят контрольные растворы таким образом, чтобы они охватывали всю область ожидаемых содержаний ЭХГ в анализируемом образце. Для определения значения площади или высоты пика вводят аликвоты каждого контрольного раствора от 1 до 5 мкл в колонку хроматографа. Определение повторяют дважды.
Примечание - Эту процедуру также могут применять для приготовления контрольных растворов ЭГ.
Приложение K
(справочное)
Методы измерения остаточного содержания этиленоксида
K.1 Результаты межлабораторной оценки методов
K.1.1 Методы определения ЭО
Межлабораторная оценка ряда методов определения ЭО (см. [112], [113] и [114]) была проведена в 13 лабораториях с использованием серий образцов, содержащих ЭО от 40 до 350 мг/кг. Вычисленный общий коэффициент вариации изложенных методов представлен в таблице K.1.
Таблица K.1 - Сравнение коэффициентов вариации при внутри- и межлабораторном изучении методов
Определение ЭО | Межлабораторное изучение, % | Внутрилабораторное изучение, % |
Метод равновесного пара | 3,7 | 21,3 |
Метод с использованием ацетона | 4,1 | 16,3 |
Метод с использованием DMF | 2,9 | 8,3 |
Метод с использованием воды | 2,7 | 17,0 |
При других межлабораторных испытаниях проведена оценка одного и того же метода определения ЭО (см. [89]). Данные линейной регрессии были получены при сравнении результатов двух лабораторий для серий образцов, содержащих ЭО от 3,6 до 26 мг/кг.
Рассчитанное уравнение регрессии ![]() ; коэффициент корреляции
; коэффициент корреляции 0,974 (
0,00001). Рассчитанный коэффициент вариации метода при межлабораторном исследовании составлял 4,0% при содержании ЭО в анализируемой матрице 14 мг/кг или 8,3% при содержании ЭО 30 мг/кг (неопубликованные данные, представленные А.Nakamura, Н.Kikuchi и К.Tsuji). В двух лабораториях были получены данные анализа образцов с тремя различными содержаниями ЭО с использованием как метода экстракции растворителем с последующим анализом равновесной паровой фазы (см. [136]), так и метода бромирования (см. [89]). Результаты сравнивали, используя линейный регрессионный анализ. Были получены следующие характеристики регрессии:
![]() , коэффициент корреляции
, коэффициент корреляции 0,999. При межлабораторном изучении методики, представленной в К.4.4, коэффициент вариации составлял 4,7%; 1,8% и 2,7% при содержании ЭО в анализируемой матрице 12, 25 и 56 мг/кг соответственно [132].
K.1.2 Методы определения ЭХГ
Межлабораторную оценку проводили с использованием метода определения ЭХГ (см. [14]). Вычисленный коэффициент вариации был следующим:
- 7,46% - при внутрилабораторном исследовании;
- 10,99% - при межлабораторном исследовании.
Эти данные были получены для концентраций ЭХГ от 3,0 до 100 мг/кг.
K.2 Оборудование и реагенты
K.2.1 Оборудование
К.2.1.1 Газовый хроматограф, оснащенный пламенно-ионизационным детектором FID или детектором электронного захвата ECD и регистрирующим устройством.
Примечание 1 - ECD не обнаружит ЭО, если он вначале не дериватизирован бромводородом.
Примечание 2 - Для получения воспроизводимых результатов предпочтительно использовать электронный интегратор.
K.2.1.2 Инъекционные иглы и трубки из поливинилхлорида, необходимые для приготовления контрольных растворов.
K.2.1.3 Мерная стеклянная посуда, снабженная пробками, покрытыми ПТФЭ, или прокладками из ПТФЭ, для приготовления контрольных растворов. Следует соблюдать меры предосторожности при выборе стеклянной посуды подходящей вместимости, с тем чтобы уменьшить пространство, занятое равновесным паром, над раствором экстракта или контрольным раствором. При приготовлении жидких контрольных растворов или экстрактов пространство, занятое равновесным паром, должно быть менее или равно 10% объема экстракта или контрольного раствора.
K.2.1.4 Микрошприц (объемом 5 или 10 мкл) для ввода аликвот экстракта в газовый хроматограф.
K.2.1.5 Вытяжной шкаф для обеспечения соответствующей вентиляции при приготовлении контрольных и других растворов.
K.2.1.6 Аналитические весы, обеспечивающие взвешивание с погрешностью не более 0,1 мг.
K.2.1.7 Газовый регулятор для емкости, содержащей ЭО.
K.2.1.8 Газонепроницаемые шприцы объемом 10, 50, 100 и 1000 мкл для приготовления контрольных растворов и ввода равновесной паровой фазы в колонку газового хроматографа.
K.2.1.9 Лабораторный термошкаф для нагревания образцов до температуры (100±2)°С.
K.2.1.10 Лабораторный термошкаф для нагревания образцов до температуры (37±1)°С.
K.2.1.11 Водяная баня для термостатирования образцов при температуре (70±2)°С.
K.2.1.12 Механический встряхиватель.
K.2.1.13 Стеклянные емкости для проведения анализа методом равновесного пара, снабженные прокладками с покрытием из ПТФЭ, номинальным объемом 20 мл для приготовления контрольных растворов при построении калибровочного графика.
K.2.1.14 Емкость с плоским дном и завинчивающейся крышкой размером, позволяющим вместить образец и экстракционную жидкость, снабженная силиконовой прокладкой с покрытием из ПТФЭ и тонкой пленкой из ПТФЭ, которую используют для экстракции ЭО и реакции ЭО с бромгидрином, если применимо.
K.2.1.15 Инъекционная игла для ввода бромистоводородной кислоты диаметром 0,65 мм и длиной 25 мм.
K.2.1.16 Миллипоровый фильтр с порами размером 45 мкм для фильтрации реакционной смеси перед хроматографическим определением.
K.2.1.17 Холодильная камера для хранения образцов при температуре от 2°С до 8°С.
K.2.2 Реагенты
K.2.2.1 Эпоксиэтан (ЭО) в подходящем газовом баллоне; содержание основного вещества - 99,7%.
K.2.2.2 2-Хлорэтанол (ЭХГ); 99%-ная проба.
K.2.2.3 1,2-Эпоксипропан (пропиленоксид), реактив.
K.2.2.4 Свежеперегнанная (дважды) бромистоводородная кислота, приготовленная следующим образом.
Перегоняют 100 мл 47%-ной бромисто-водородной* кислоты в присутствии 100 мг хлорида олова (II). Первые 25 мл дистиллята отбрасывают, а следующие 50 мл собирают. Вновь перегоняют 50 мл дистиллята в присутствии 50 мг хлорида олова (II), отбрасывают первые 15 мл дистиллята и собирают следующие 20 мл бесцветной жидкости (температура кипения от 125°С до 126°С). Хранят в стеклянном контейнере со стеклянной пробкой и используют в течение недели.
________________
* Текст документа соответствует оригиналу. - .
K.2.2.5 Хлорид олова (II) (двуххлористое олово), реактив.
K.2.2.6 Вода, пригодная для газовой хроматографии по степени чистоты.
K.2.2.7 Этиловый спирт, пригодный для газовой хроматографии по степени чистоты.
K.2.2.8 Пропанон (ацетон), пригодный для газовой хроматографии по степени чистоты.
K.2.2.9 Диметилформамид (ДМФА), пригодный для газовой хроматографии по степени чистоты.
K.3 Приготовление контрольных растворов
K.3.1 Приготовление контрольных растворов ЭО
Соответствующие контрольные растворы готовят методом, изложенным в J.1.
K.3.2 Приготовление контрольных растворов ЭХГ
Контрольные растворы ЭХГ готовят методом, изложенным в J.2.
K.3.3 Приготовление контрольных растворов пропиленоксида (ПО)
Готовят контрольные растворы растворением ПО в этиловом спирте таким образом, чтобы получить раствор концентрацией 0,5 мкг/мл.
K.4 Экстракция из изделий
K.4.1 Общие положения
Готовят экстракты в соответствии с указаниями, представленными в 4.4.
K.4.2 Экстракция, моделирующая условия применения изделия
Для моделирования условий применения изделия в медицинской практике применяют воду. Осуществляют экстракцию в условиях, представляющих наибольшую нагрузку при предназначенном использовании.
Например, выполняют экстрагирование из изделий, контактирующих с кровью, и парентеральных изделий водой путем их полного заполнения или промывания тех каналов, по которым протекает кровь или жидкость (подходит любой метод).
Примечание - При полном заполнении необходимо убедиться в том, что отсутствуют пустоты.
Когда невозможно заполнить составные части изделия, контактирующие с пациентом, помещают все изделие или основной и репрезентативный фрагмент изделия в подходящий контейнер и добавляют воду, соблюдая нужное соотношение образец/модельная среда. Для того чтобы убедиться в достоверности данных, полученных при анализе небольших образцов изделий большого размера, отбирают несколько представительных фрагментов изделия.
Образцы подвергают экстракции в течение времени, равного или превышающего наибольшее время контакта изделия с пациентом при однократном применении, и выбирают температуру экстракции, которая предоставит наибольшую моделированную нагрузку в соответствии с п.4.4.6.2. В качестве альтернативного метода готовят серию экстрактов (рекомендуется как минимум три), соответствующих нескольким более коротким периодам времени, и используют скорость экстракции для вычисления влияния при более длительном или многократном воздействии.
Если анализ не проводят сразу, декантируют экстракт во флакон и хранят, закрыв пробкой с прокладкой, покрытой ПТФЭ. Пространство, занятое равновесным паром, во флаконе с контрольным раствором или экстрактом должно быть менее 10% общего объема. Экстракт хранят в холодильной камере при температуре (5±3)°С. Исследователь должен установить срок годности и хранения. Когда для определения ЭО используют водные экстракты, соблюдают меры предосторожности, так как в процессе хранения водного экстракта [35], ЭО может превратиться в ЭГ или ЭХГ, или в оба этих продукта.
K.4.3 Методика исчерпывающей экстракции при повышенной температуре
Взвешивают 1 г образца с погрешностью 0,1 мг и помещают его во флакон с пробкой. Помещают герметично закрытый флакон в термошкаф, нагретый до подходящей температуры, и термостатируют в течение подходящего периода времени. Режим времени и температуры относительно произволен. Варьируют время для достижения равновесия парциального давления ЭО с паровой фазой.
Вынимают флакон из термошкафа. Вводят 100 мкл пробы равновесной паровой фазы в колонку хроматографа (анализ повторяют дважды) и определяют высоты и площади пиков, соответствующих ЭО. Рассчитывают среднее значение для двух измерений.
Примечание - Следует быть осторожным. При введении пробы игла не должна соприкасаться с наполнителем колонки. Опыт показал, что анализ горячих образцов сразу после того, как они были удалены из термошкафа, часто приводит к ошибке более 20% из-за потери материала в шприце, так как при удалении шприца из флакона давление в шприце уравновешивается с атмосферным давлением. Некоторые материалы ресорбируют ЭО во время уравновешивания их температуры с комнатной. Существуют также некоторые материалы, которые полностью ресорбируют ЭО при охлаждении. При проведении анализа таких материалов может оказаться необходимым вводить исследуемые образцы и контрольные растворы в колонку хроматографа, пока они еще горячие или теплые, а затем прокачать шприц (как описано выше) без дальнейшего охлаждения.
Коммерчески доступны автоматизированные анализаторы равновесной паровой фазы. Тем не менее эту процедуру можно выполнить вручную.
Используя вытяжной шкаф, удаляют крышку с флакона и продувают его в течение 30 с сухим азотом. Используя новую мембрану, снова закатывают крышку и повторяют нагревание и ввод пробы до полного извлечения ЭО. Полное извлечение достигается, когда экстрагируемое количество ЭО составляет менее 10% полученного при первой экстракции или когда нет аналитически значимого увеличения в обнаруженных кумулятивных уровнях осадка. С использованием калибровочного графика рассчитывают количество ЭО в образце, суммируя количества ЭО, полученные для средних значений измерений площадей или высот пиков при каждом из нескольких нагреваний образца.
K.4.4 Исчерпывающая экстракция этиловым спиртом с последующим анализом этанольных экстрактов методом равновесной паровой фазы
K.4.4.1 Контрольные растворы для построения калибровочного графика
Готовят контрольные растворы, разбавляя ЭО в этиловом спирте таким образом, чтобы получить растворы с концентрацией ЭО 0,4; 0,8; 1,2; 1,6 и 2 мкг/мл. Готовят контрольный раствор ПО в этиловом спирте концентрацией 0,5 мкг/мл в соответствии с K.3.3. Охлаждают эти растворы и соответствующее число специальных флаконов для анализа методом равновесной паровой фазы (см. рисунок K.1) в бане, заполненной смесью сухого льда с изопропанолом, или аналогичным образом. Переносят соответствующие аликвоты каждого контрольного раствора ЭО и те же самые объемы контрольного раствора ПО во флаконы для проведения анализа методом равновесной паровой фазы. Флаконы термостатируют при температуре 70°С в течение 30 мин и вводят от 100 мкл до 1 мл аликвот равновесной паровой фазы из каждого флакона в колонку газового хроматографа (анализ проводят дважды). Чтобы получить калибровочный график, измеряют высоты или площади пиков ЭО и ПО и строят зависимость отношения высот или площадей пиков (ось ) от концентрации ЭО.
Добавление ПО к контрольным растворам ЭО используют как внутренний стандарт для оценки точности приготовления контрольных растворов ЭО. Построение соотношения ЭО/ПО против намеченных концентраций ЭО в контрольных растворах в идеале приведет к коэффициенту линейной корреляции , составляющему 1,000, и линейному уравнению
![]() . Такие параметры обозначают абсолютно прямую калибровочную линию, которая имеет наклон в 0,5 с нулевой точкой пересечения с осью
. Такие параметры обозначают абсолютно прямую калибровочную линию, которая имеет наклон в 0,5 с нулевой точкой пересечения с осью . Можно использовать коэффициент корреляции в 0,999 или лучше. Линейный наклон выше 0,5 с нулевой точкой пересечения с осью
означает, что все контрольные растворы ЭО были ниже, чем намеченные концентрации. Наклон менее чем 0,5 с нулевой точкой пересечения с осью
означает, что все контрольные растворы ЭО были выше, чем намечено. Следует обратить внимание, что калибровочные линии с точкой пересечения с осью
выше или ниже нуля приведут к результатам образца ЭО, которые выше или ниже, чем реальная концентрация, соответственно, особенно при более низких результатах образца ЭО. Степень неточности зависит от расстояния оси
от нуля. Наконец, высота или площадь самого пика ЭО должна оставаться относительно постоянной. Флуктуация высоты или площади пика ЭО означает вариативность объема инъекции образца в ГХ. Тем не менее это не должно стать проблемой при современном уровне технологии ГХ.
|
1 - жидкость; 2 - О-образное кольцо; 3 - самоуплотняющаяся мембрана; 4 - равновесная паровая фаза; 5 - зажим
Рисунок K.1 - Специальный флакон для проведения анализа методом равновесной паровой фазы
K.4.4.2 Методика анализа
Взвешивают 5 (или 0,5) г исследуемого образца, разрезанного на небольшие кусочки (длиной 5 мм для трубок, площадью 10 мм для пластин), с погрешностью до 0,1 мг и помещают во флакон объемом 100 (или 10) мл для проведения анализа методом равновесной паровой фазы. Добавляют во флакон 50 (или 5) мл контрольного раствора ПО (0,25 мкг/мл). Закрывают флакон, закатывают крышку и термостатируют герметично закрытый флакон при температуре 70°С в течение 3 ч с легким встряхиванием. Вводят от 100 мкл до 1 мл равновесной паровой фазы в колонку газового хроматографа и определяют отношения параметров пиков ЭО/ПО (определение повторяют дважды). Используя калибровочный график, описанный в K.4.4.1, вычисляют среднее содержание ЭО для двух параллельных образцов.
K.4.5 Исчерпывающая экстракция с использованием растворителя
Взвешивают около 1 г образца изделия и помещают в мерную стеклянную посуду с крышкой такой вместимости, чтобы объем равновесной паровой фазы был минимален. С помощью пипетки добавляют в мерную колбу 10 мл выбранного растворителя. Закрывают колбу и оставляют при температуре (25±2)°С на 24 ч.
Эти значения температуры и времени использовались в исследовании Марлоу [112], [113], [114]. Могут потребоваться другие утвержденные значения времени и температур для достижения исчерпывающей экстракции (см. K.4.3). Вводят аликвоты от 1 до 5 мкл в колонку хроматографа (анализ повторяют дважды). Вычисляют содержание ЭО в образцах, используя калибровочный график, и рассчитывают среднее значение для двух анализов.
K.4.6 Исчерпывающая экстракция этиловым спиртом с последующим получением бромгидринового производного и газохроматографическим определением с использованием ECD
K.4.6.1 Контрольные растворы для построения калибровочного графика
Готовят контрольные растворы, растворяя ЭО в этиловом спирте, чтобы получить растворы, содержащие ЭО в концентрациях 0,4; 0,8; 1,2; 1,6 и 2 мкг/мл. Готовят контрольный раствор, содержащий ПО в этиловом спирте с концентрацией 0,5 мкг/мл, в соответствии с K.3.3. Готовят контрольные смеси, смешивая равные объемы каждого контрольного раствора ЭО и контрольного раствора ПО. Это построение выполняют по той же причине, что и построение соотношения ЭО/ПО по сравнению с концентрациями контрольных растворов ЭО, как описано в K.4.4.1.
Переносят 1 мл каждой смеси во флакон с завинчивающейся крышкой. Добавляют две капли (около 0,015 г) бромистоводородной кислоты к смеси через мембрану с помощью инъекционной иглы. Оставляют флакон при комнатной температуре на 1 ч. Нагревают флакон в течение 1 ч при температуре 50°С на водяной бане с легким перемешиванием, затем охлаждают до комнатной температуры.
Добавляют 0,02 г бикарбоната натрия во флакон и перемешивают путем встряхивания в вертикальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин. Встряхивают флакон в горизонтальном направлении в течение 30 мин. Оставляют флакон стоять на 10 мин, а затем центрифугируют с частотой вращения 3000 об/мин (50 s) в течение 5 мин. Фильтруют смесь через миллипоровый фильтр.
_______________
Использование емкостей с U- или V-образной формой дна иногда вызывает неполную нейтрализацию, что приводит к плохим хроматограммам.
Для того чтобы получить значения отношений высоты пика этиленбромгидрина (ЭБГ) и пропиленбромгидрина (ПБГ), вводят от 1 до 5 мкл аликвоты каждого фильтрата в колонку газового хроматографа (определение повторяют дважды).
K.4.6.2 Процедура анализа
Вычисляют среднее двух образцов и определяют ЭО в образце согласно калибровочной линии, описанной в K.4.4.1.
Так как некоторые изделия медицинских материалов могут содержать ионы бромида (например, бутилированные резины), существует потенциал для формирования ЭБГ как продукта деградации ЭО, сходного с формированием ЭХГ из-за присутствия ионов хлора. Таким образом, порция образца должна быть проанализирована на предмет присутствия ЭБГ в качестве осадка стерилизации до приготовления производного бромгидрина.
K.4.7 Экстракция этиленхлоргидрина с использованием воды, моделирующая применение изделий
Используют процедуру, описанную в K.4.2.
K.4.8 Исчерпывающая экстракция этиленхлоргидрина с использованием воды
Взвешивают от 1 до 50 г фрагмента образца (или целый образец) и помещают в стеклянную посуду с пробкой такой вместимости, чтобы объем равновесной паровой фазы был минимален. Вводят воду в достаточных количествах для покрытия образца в контейнер и закрывают. Оставляют на 24 ч при температуре (25±2)°С. Энергично перемешивают контейнер с содержимым в механической мешалке приблизительно 10 мин.
_______________
Эти температуры и периоды времени использовались в референтной оценке (AAMI, 1989 [14]). Для достижения исчерпывающей экстракции могут потребоваться другие значения температуры и времени (см. K.4.3). Возможно потребуется энергичное встряхивание в течение всего периода времени. Некоторым материалам встряхивание может не понадобиться.
Вводят от 1 до 5 мкл пробы в колонку газового хроматографа. Рассчитывают концентрацию ЭХГ в образце по относительной площади пика или высоте пика, используя предварительно построенный калибровочный график.
K.5 Газовая хроматография
K.5.1 Общие положения
Выбирают наиболее пригодные методы и процедуры. Используют подходящую хромотографическую процедуру, которая удовлетворяет требования, приведенные в приложении А.
Может потребоваться оптимизация условий.
Примечание - Для улучшения точности измерения и для обнаружения проблем с инъекцией многие хроматографисты используют внутренние стандарты в своих процедурах.
K.5.2 Экстракция, моделирующая условия применения изделия для определения ЭО или ЭХГ
Вводят от 1 до 5 мкл аликвот водного экстракта, приведенного в K.4.2 или K.4.7.
K.5.3 Методика исчерпывающей экстракции при повышенной температуре
Вводят от 100 мкл до 1 мл аликвот равновесной паровой фазы.
K.5.4 Исчерпывающая экстракция этиловым спиртом с последующим анализом методом равновесной паровой фазы этанольного экстракта
Вводят от 100 мкл до 1 мл аликвот водного экстракта, приведенного в K.4.4.
K.5.5 Исчерпывающая экстракция этиловым спиртом с последующим приготовлением бромгидринового производного и определением методом газовой хроматографии с детектором ECD
Вводят от 1 до 5 мкл аликвот водного экстракта, приведенного в K.4.6.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов межгосударственным стандартам
Таблица ДА.1
Обозначение ссылочного международного стандарта | Степень соответствия | Обозначение и наименование соответствующего межгосударственного стандарта |
ISO 10993-1 | IDT | ГОСТ ISO 10993-1-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 1. Оценка и исследования" |
ISO 10993-3 | IDT | ГОСТ ISO 10993-3-2018 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 3. Исследования генотоксичности, канцерогенности и токсического действия на репродуктивную функцию" |
ISO 10993-10 | IDT | ГОСТ ISO 10993-10-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 10. Исследования раздражающего и сенсибилизирующего действия" |
ISO 10993-12 | IDT | ГОСТ ISO 10993-12-2015 "Оценка биологического действия медицинских изделий. Часть 12. Приготовление проб и контрольные образцы" |
ISO 10993-17:2002 | IDT | ГОСТ ISO 10993-17-2011 "Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 17. Установление пороговых значений для вымываемых веществ" |
Примечание - В настоящем стандарте использовано следующее условное обозначение степени соответствия стандартов: - IDT - идентичные стандарты. | ||
Библиография
[1] | ISO 11135-1:2007 | Sterilization of health care products - Ethylene oxide - Part 1: Requirements for the development, validation and routine control of a sterilization process for medical devices |
__________________
| ||
[2] | AAMI EO-VRSU 3/81; superseded by AAMI GVR-1987, Good hospital practice: Ethylene oxide gas - Ventilation recommendations and safe use, Arlington, VA, 1981 | |
[3] | ABDEL-RAHMAN M.S. and KADRY A.M. Studies on the use of uncertainty factors in deriving RfDs, Hum. Ecolog. Risk Assess., 1, p.614-624, 1995 | |
[4] | ABDEL-RAHMAN S.Z., EL-ZEIN R.A., AMMENHEUSE M.M., YANG Z., STOCK Т.Н., MORANDI M. and WARD, J.B. Jr. Variability in human sensitivity to 1,3-butadiene: Influence of the allelic variants of the microsomal epoxide hydrolase gene, Environ. Mol. Mutagen., 41(2), p.140-6 | |
[5] | ABRAHAMS R.H. Recent studies with workers exposed to ethylene oxide, in: Jorkasky J.F., ed., Safe use of ethylene oxide, Proceedings of the Educational Seminar, Washington DC, Health Industries Manufacturers Association, 27-38, pp.211-220, HIMA Report No. 80-4, 1980 | |
[6] | ADAMS C.H., WERELY C.J., VICTOR T.C., HOAL E.G., ROSSOUW G., VAN HELDEN P.D. Allele frequencies for glutathione S-transferase and N-acetyltransferase 2 differ in African population groups and may be associated with oesophageal cancer or tuberculosis incidence, Clin. Chem. Lab. Med. 41(4), p.600-605, 2003 | |
[7] | ADLER N. Residual ethylene oxide and ethylene glycol in ethylene oxide sterilized pharmaceuticals, J. Pharm. Sci. 1965; 54(5), p.735-742 | |
[8] | ALLEVA F. (Cited in BALAZS[18], 1976) | |
[9] | ALOMAR A., CAMARASA J.M. and NOGUERA J.E.A. Ethylene oxide dermatitis, Contact Dermatitis, 7, p.205-207, 1981 | |
[10] | AMBROSE A. Toxicological studies of compounds investigated for use as inhibitors of biological processes. II Toxicity of ethylene chlorohydrin. Arch. Ind. Hyg. Occup. Med. 1950; 2:582-597. | |
[11] | ANAND V.P., COGDILL C.P., KLAUSNER K.A., LISTER L., BARBOLT T., PAGE B.F.J., URBANSKI P., WOSS CASIMIR J., BOYCE J. Reevaluation of ethylene oxide hemolysis and irritation potential, J. Biomed. Mater. Res. 64A, p.648-654, 2003 | |
[12] | ANDERSEN S. Ethylene oxide toxicity, J. Lab. Clin. Med., 77(2), p.346-356, 1971 | |
[13] | AAMI ST29-1988, Recommended practice for determining residual ethylene oxide in medical devices, Association for the Advancement of Medical Instrumentation, American National Standard. Arlington, VA, AAMI, 1988 | |
[14] | AAMI ST30-1989, Determining residual ethylene chlorohydrin and ethylene glycol in medical devices, Association for the Advancement of Medical Instrumentation, American National Standard. Arlington, VA, AAMI, 1989 | |
[15] | ASTM E691-05, Standard practice for conducting an interlaboratory study to determine the precision of a test method | |
[16] | ATSDR Tp-90-16:1990, Toxicological profile for ethylene oxide. Atlanta, GA, US Department of Health and Human Services, Public Health Service | |
[17] | ATSDR (1997), Toxicological profile for ethylene glycol and propylene glycol, Atlanta, GA | |
[18] | BALAZS T. Toxicity of ethylene oxide and chloroethanol, FDA By-lines No. 3, p.150-155, 1976 | |
[19] | BALL N.A. Determination of ethylene chlorohydrin and ethylene glycol in aqueous solutions and ethylene oxide in associated plastics, J. Pharm. Sci., 73(9), p.1305-1307, 1984 | |
[20] | BARTELS M.J. Comparison of in vitro metabolism of ethylene glycol in rat and human liver S-9 homogenate, Midland Ml, R&D Report of the Dow Chemical Company, 2001 | |
[21] | BASKETTER D.A., GRIFFITHS H.A., WANG X.M., WILHELM K.P. and MCFADDEN J. Individual, ethnic and seasonal variability in irritant susceptibility of the skin: the implications for a predictive human patch test, Contact Dermatitis, 35(4), p.208-213, 1996 | |
[22] | BELILES R.P., PARKER J.С. Risk assessment and oncodynamics of ethylene oxide as related to occupational exposure, Toxicol Ind Health 3(3), p.371-82, 1987 | |
[23] | BJORGE С., BRUNBORG G., WIGER R., HOLME J.A., SCHOLZ Т., DYBING E. and SODERLUND E.J. A comparative study of chemically induced DNA damage in isolated human and rat testicular cells, Reprod Toxicol. 10(6), p.509-519, 1996 | |
[24] | BLOOD F. Chronic toxicity of ethylene glycol in the rat, Fd. Cosmet. Tox., 3, p.229-234, 1965 | |
[25] | BLOOD F., ELLIOTT G. and WRIGHT M. Chronic toxicity of ethylene glycol in the monkey, Tox. Appl. Pharm. 4, p.489-491, 1962 | |
[26] | BOMMER J. and RITZ E. Ethylene oxide as a major cause of anaphylactoid reactions in dialysis (a review). Artif. Organs, 11, p.111-117, 1987 | |
[27] | BOUSQUET J. and MICHEL F.B. Allergy to formaldehyde and ethylene-oxide, Clin. Rev. Allergy 9, p.357-370, 1991 | |
[28] | BROBST K.M. and HAN T. Determination of chlorohydrins in hydroxypropyl starch ethers, J. Assoc. Off. Anal. Chem., 54(5), p.1093-1094, 1971 | |
[29] | BROWN D.J. Determination of ethylene oxide and ethylene chlorohydrin in plastic and rubber surgical equipment sterilized with ethylene oxide, J. Assoc. Off. Anal. Chem., 53(2), pp.263-267, 1970 | |
[30] | BRUCH C.W. Industrial Sterilization, eds. Phillips, G.B., Miller, W.S., Duke University Press, Durham, NC, p.49-77, 1973 | |
[31] | BUA, Ethylene oxide, German Chemical Society (GDCh) Advisory Committee on Existing Chemicals of Environmental Relevance (Beratergremium | |
[32] | BUEHLER, B.A., RAO, V., FINNELL, R.H. Biochemical and molecular teratology of fetal hydantoin syndrome, Neurol Clin., 12(4), p.741-748, 1994 | |
[33] | CARPENTER C., SMYTH H. and POZZANI U. The assay of acute vapor toxicity, and the grading and interpretation of results on 96 chemical compounds, J. Ind. Hyg. Toxicol. 31, p.343-349, 1949 (cited in EPA, 1985) | |
[34] | Center for Drug Evaluation and Research (CDER), Review Guidance, Validation of Chromatographic Methods, November 1994 | |
[35] | CHESLER S.N., REBBERT R.E. and ENAGONIO D.P. Evaluation of AAMI EO residues recommended practice and a determination of EO kinetics in water, National Bureau of Standards, Department of Commerce, Washington, DC, October 1985 | |
[36] | CHOI, S. and KIM, S. Lipopolysaccharide inhibition of rat hepatic microsomal epoxide hydrolase and glutathione S-transferase gene expression irrespective of nuclear factor-kappaB activation, Biochem. Pharmacol., 56(11), p.1427-1436, 1988 | |
[37] | CONINE D., NAUMANN B. and HECKER L. Setting health-based residue limits for contaminants in pharmaceuticals and medical devices, Quality Assurance: Good Practice, Regulation, and Law, 1, p.171-180, 1992 | |
[38] | COURTNEY K., ANDREWS J. and GRADY M. Teratogenic evaluation of ethylene chlorohydrin (Ech, 2-chloroethanol) in mice, J. Environ. Sci. Health, B17(4), p.381-391, 1982 | |
[39] | CYR W.H., GLASER Z.R. and JACOBS M.E. CDRH risk assessment of EO residues on sterilized medical devices, in: Jorkasky, J.; ed. Sterilization in the 1990s (Health Industry Manufacturers Association Report No. HIMA 89-1). Washington, DC: HIMA, p.269-285, 1989 | |
[40] | DANIELSON J.W., SNELL R.P. and OXBORROW G.S. Detection and quantitation of ethylene oxide, 2-chloroethanol, and ethylene glycol with capillary gas chromatography, J. Chromatogr., 28, p.97-101, 1990 | |
[41] | DEPASS L., GARMAN R., WOODSIDE M., GIDDENS W., MARONPOT R. and WEIL С. Chronic toxicity and carcinogenicity studies of ethylene glycol in rats and mice, Fund. Appl. Tox., 7, p.547-565, 1986 | |
[42] | DEPASS L., WOODSIDE M., MARONPOT R. and WEIL С. (1986b) Three-generation reproduction and dominant lethal mutagenesis studies of ethylene glycol in the rat, Fund. Appl. Tox., 7, p.566-572, 1986 | |
[43] | DUNKELBERG H. Carcinogenicity of ethylene oxide and 1,2-propylene oxide upon intragastric administration to rats, Br. J. Cancer, 46, p.924-933, 1982 | |
[44] | EDELHAUSER H., ANTOINE M., PEDERSON H., HIDDEMAN J. and HARRIS R. Intraocular safety evaluation of ethylene oxide and sterilant residues, J. Toxicol. Cut. Ocular Toxicol., 2, p.7-39, 1983 | |
[45] | EHRENBERG L., TORNQVIST M. The research background for risk assessment of ethylene oxide: aspects of dose, Mutat. Res., 330(1-2), p.41-54, 1995 | |
[46] | Ethylene Oxide Residues on Sterilized Medical Devices, Environ Corporation, Washington, DC, 1987 (also in: Health Industry Manufacturers Association, HIMA Report 88-6. Washington, DC, 1988) | |
[47] | ETTRE L.S. and JONES E. Quantitative analysis with headspace gas chromatography using multiple headspace extraction, Chromatography Newsletter, 12(1), July 1984 | |
[48] | EVANS A.J., HENNER W.D., EILERS K.M., MONTALTO M.A., WERSINGER E.M., ANDERSEN P.E., COHEN J.I., EVERTS E.C., MCWILLIAMS J.E. and BEER T.M. Polymorphisms of GSTT1 and related genes in head and neck cancer risk. Head Neck, 26(1), p.63-70, 2004 | |
[49] | FALZON M., MILTON A.S., BURKE M.D. Are the decreases in hepatic cytochrome P-450 and other drug-metabolising enzymes caused by indomethacin in vivo mediated by intestinal bacterial endotoxins? 16,16-Dimethylprostaglandin F2 alpha prevents decreases in hepatic drug-metabolising enzymes due to exogenous endotoxin, Biochem. Pharmacol., 33(8), p.1285-1292, April 15, 1984 | |
[50] | FENNELL T.R., MACNEELA J.P., MORRIS R.W., WATSON M., THOMPSON C.L., BELL D.A. Hemoglobin adducts from acrylonitrile and ethylene oxide in cigarette smokers: effects of glutathione S-transferase T1-null and M1-null genotypes, Cancer Epidemiol Biomarkers Prev., 9(7), p.705-712, 2000 | |
[51] | FENNELL T.R. and BROWN C.D. A physiologically based pharmacokinetic model for ethylene oxide in mouse, rat, and human, Toxicol. Appl. Pharmacol., 173(3), p.161-75, 2001 | |
[52] | FISHER J.W., DORMAN D.C., MEDINSKY M.A., WELSCH F., CONOLLY R.B. Analysis of respiratory exchange of methanol in the lung of the monkey using a physiological model, Toxicol. Sci., 53(2), p.185-193, 2000 | |
[53] | FOST U., TORNQVIST M., LEUTBECHER M., GRANATH F., HALLIER E., EHRENBERG L. Effects of variation in detoxification rate on dose monitoring through adducts, Hum. Exp. Toxicol., 14(2), p.201-3, 1995 | |
[54] | FUCHS J., WULLENWEBER U., HENGSTLER J.G, BIENFAIT H.G, HILTL G.F., OESCH F. Genotoxic risk for humans due to work place exposure to ethylene oxide: remarkable individual differences in susceptibility, Arch Toxicol., 68(6), p.343-8, 1994 | |
[55] | GAUNT J., HARDY J., GANGOLLI S., BUTTERWORTH K. and LLOYD A. Bibra, 14, p.109, 1975 (cited in Rowe and Wolf, 1982 and Environ, 1987) | |
[56] | GAYLOR D.W. Quantitative Cancer Risk Assessment for Exposure to Ethylene Oxide from Medical Devices, submitted to the CDRH Toxicology Risk Assessment Committee, June 29, 1993 | |
[57] | GLASER Z.R. Ethylene oxide: Toxicology review and field study results of hospital use, J. Environ. Path. Tox., 2, p.173-208, 1979 | |
[58] | GOLBERG L. Hazard Assessment of Ethylene Oxide, CRC Press, Boca Raton, FL, 1986 | |
[59] | GOLDBLATT M.W. Brit. J. Ind. Med., 1, p.213, 1944 | |
[60] | GRIFFETH L.K., ROSEN G.M. and RAUCHMAN E.J. Effects of model traumatic injury on hepatic drug metabolism in the rat. VI. Major detoxification/toxification pathways, Drug Metab. Dispos., 15(6), p.749-59, 1987 | |
[61] | GUESS W. Tissue reactions to 2-chloroethanol in rabbits, Tox. Appl. Pharm., 16, pp.382-390, 1970 | |
[62] | Guidelines for data acquisition and data quality evaluation in environmental chemistry. Anal. Chem., 52(14), 1980 | |
[63] | HACKETT P., BROWN R., BUSCHBOOM R., CLARK M., MILLER R., MUSIC R., ROWE S., SCHIRMER R. and SIKOV M. Teratogenic Study of Ethylene Oxide and Propylene Oxide and n-Butyl Acetate (NIOSH Contract No. 210-80-0013), Battelle Pacific Northwest Laboratories, Richland, WA, 1982 (cited in EPA, 1985) | |
[64] | HALLIER E., LANGHOF T., DANNAPPEL D., LEUTBECHER M., SCHRODER K., GOERGENS H.W., MULLER A. and BOLT H.M. Polymorphism of glutathione conjugation of methyl bromide, ethylene oxide and dichloromethane in human blood: influence on the induction of sister chromatid exchanges (SCE) in lymphocytes, Arch. Toxicol., 67(3), p.173-178, 1993 | |
[65] | HANDLOS V. Determination of gas residuals in ethylene oxide sterilized materials - A literature survey. Archiv. Pharm. Chemi. Sci., 4, p.73-80, 1976 | |
[66] | HANDLOS V. The hazards of ethylene oxide sterilization. Arch. Pharm. Chemi. Sci., 7, pp.939-949, 1979 | |
[67] | HANZLIK P., SEIDENFELD M. and JOHNSON С. General properties, irritant and toxic actions of ethylene glycol, J. Pharm. Exp. Ther., 41(4) p.387-406, 1931 | |
[68] | HARTMAN P.A. and BOWMAN P.B. Simple GLC determination of ethylene oxide and its reaction products in drug and formulations, J. Pharm. Sci., 66(6), p.789-792, 1977 | |
[69] | HASSETT C., LIN J., CARTY C.L., LAURENZANA E.M. and OMIECINSKI C.J. Human hepatic microsomal epoxide hydrolase: comparative analysis of polymorphic expression, Arch. Biochem. Biophys., 337(2), p.275-283, 1997 | |
[70] | Health Industry Manufacturers Association. Guidelines for the Analysis of Ethylene Oxide Residues in Medical Devices (HIMA Document No. 1, Vol. 2). Washington, DC: HIMA, 1980 | |
[71] | HOGSTEDT C., ROHLEN O., BERNDTSSON B.S., AXELSON О. and EHRENBERG L. A cohort study of mortality and cancer incidence in ethylene oxide production workers, Br. J. Ind. Med., 36(4), p.276-80, 1979 | |
[72] | HOLLINGSWORTH R., ROWE V., OYEN F., MCCALLISTER D. and SPENCER H. Toxicity of ethylene oxide determined on experimental animals. AMA Arch. Ind. Health., 13, p.217-227, 1956 | |
[73] | HU J.J., MOHRENWEISER H.W., BELL D.A., LEADON S.A. and MILLER M.S. Symposium overview: genetic polymorphisms in DNA repair and cancer risk, Toxicol. Appl. Pharmacol., 185(1), p.64-73, 2002 | |
[74] | HUBAUX A. and GILBERT V. Decision and detection limits for linear calibration curves, Anal. Chem., 42(8), p.849-855, 1970 | |
[75] | IARC (1994) Some industrial chemicals. Ethylene oxide, Lyons, pp.73-159 (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 60) | |
[76] | Improved detection and separation of glycols and ethylene oxide residues using GC (Bulletin 789), Supelco, Inc., 1980 | |
[77] | International Conference On Harmonization; ICH Harmonised Tripartite Guideline; Text on the Validation of Analytical Procedures: Recommended for adoption at step 4 of the ICH process on 27 October 1994 | |
[78] | JACOBSON K., HACKLEY E. and FEINSILVER L. The toxicity of inhaled ethylene oxide and propylene oxide vapors, AMA Arch. Ind. Health., 13, p.237-244, 1956 | |
[79] | Japan Association of Disposable Medical Device Industries, Guideline for ethylene oxide sterilization of disposable medical devices (second edition), December 1989 | |
[80] | JOHNSON M. Metabolism of chloroethanol in the rat, Biochem. Pharmacol., 16, p.185-199, 1967 | |
[81] | JOHNSON M. Detoxication of ethylene chlorohydrin, Fd. Cosmet. Tox., 5, p.449, 1967 | |
[82] | JONES-PRICE C., KIMMEL T., MARKS T., LEDOUX T., REEL J., FISHER P., LANGHOFF-PASCHKE L. and MARR M. Teratologic Evaluation of Ethylene Oxide (CAS No. 75-78-8) in New Zealand White Rabbits (Final report RB80-EO, NIEHS Contract No. 1-ES-2127). Research Triangle Park, NC, National Institute of Environmental Health Sciences, 1982 (cited in EPA, 1985) | |
[83] | JONES-PRICE C., MARKS T., LEDOUX T., REEL J., FISCHER P., LANGHOFF-PASCHKE L., MARR M. and KIMMEL, С. Teratologic Evaluation of Ethylene Chlorohydrin (CAS No. 107-07-3) in New Zealand White Rabbits (PB85-170959). Research Triangle Park, NC, National Institute of Environmental Health Sciences, 1985a | |
[84] | JONES-PRICE C., MARKS T., LEDOUX T., REEL J., FISCHER P., LANGHOFF-PASCHKE L., MARR M. and KIMMEL С. Teratologic Evaluation of Ethylene Chlorohydrin (CAS No. 107-07-3) in CD-1 mice (PB85-172104). Research Triangle Park, NC, National Institute of Environmental Health Sciences, 1985b | |
[85] | KAREL L., LANDING B. and HARVEY T. The intraperitoneal toxicity of some glycols, glycol ethers, glycol esters and phthalates in mice. Fed. Proceedings, 1947; 6:342 | |
[86] | KASHTOCK M. Use of specific retention volumes in evaluation of various types of columns for use in the trace determination of ethylene glycol by gas chromatography, J. Chromatogr., 176, p.25-35, 1979 | |
[87] | KAYE M.M. and NEVELL T.G. Statistical evaluation of methods using headspace gas chromatography for the determination of ethylene oxide. Analyst, 110, p.1067-1071, 1985 | |
[88] | KERR B.M., RETTIE A.E., EDDY A.C., LOISEAU P., GUYOT M., WILENSKY A.J., LEVY R.H. Inhibition of human liver microsomal epoxide hydrolase by valproate and valpromide: in vitro/in vivo correlation, Clin. Pharmacol. Ther., 46(1), p.82-93, 1989 | |
[89] | KIKUCHI H., NAKAMURA A. and TSUJI K. Gas chromatographic determination with electron capture detection of residual ethylene oxide in intraocular lenses, J. Assoc. Off. Anal. Chem., 71, p.1057-1062, 1988 | |
[90] | KITTERINGHAM N.R., DAVIS C., HOWARD N., PIRMOHAMED M., PARK B.K. Interindividual and interspecies variation in hepatic microsomal epoxide hydrolase activity: studies with cis-stilbene oxide, carbamazepine 10, 11-epoxide and naphthalene, J. Pharmacol. Exp. Ther., 278(3), p.1018-1027 | |
[91] | KNUDSEN L.E., LOFT S.H., AUTRUP H. Risk assessment: the importance of genetic polymorphisms in man, Mutat. Res., 482(1-2), p.83-88, 2001 | |
[92] | KROES R., BOCK B. and MARTIS L. Ethylene oxide extraction and stability in water and blood, Personal communication to the AAMI committee, January 1985 | |
[93] | KROETZ D.L., KERR B.M., MCFARLAND L.V., LOISEAU P., WILENSKY A.J. and LEVY R.H. Measurement of in vivo microsomal epoxide hydrolase activity in white subjects, Clin. Pharmacol. Ther., 53(3), p.306-315, March 1993 | |
[94] | KULKARNI R.K., BARTAK D., OUSTERHOUT D.K. and LEONARD F. Determination of residual ethylene oxide in catheters by gas-liquid chromatography, J. Biomed. Mat. Res., 2, p.165-171, 1968 | |
[95] | LABORDE J. and KIMMEL С. The teratogenicity of ethylene oxide administered intravenously to mice. Tox. Appl. Pharm., 56, p.16-22, 1980 | |
[96] | LAKIND J.S., MCKENNA E.A., HUBNER R.P. and TARDIFF R.G. A review of the comparative mammalian toxicity of ethylene glycol and propylene glycol, Crit. Rev. Toxicol., 29(4), p.331-365, 1999 | |
[97] | LAMB J. IV, MARONPOT R., GULATI D., RUSSELL V., HOMMEL-BARNES L. and Sabharwal P. (1985). Reproductive and developmental toxicity of ethylene glycol in the mouse, Tox. Appl. Pharm. 81, p.100-112, 1985 | |
[98] | LANDEN W.O., THOMPSON D.W. and FLOYD K.M. Determination of ethylene oxide and ethylene glycol in wet surgical dressings, FDA By-Lines, No. 2, 1971 | |
[99] | LANDIN H.H., GOLKAR S.O., ZORCEC V., TORNQVIST M. Biomonitoring of Epicholorhydrin by Hemoglobin Adducts, Anal. Biochem., 240, p.1-6, 1996 | |
[100] | LANDIN H.H., GRUMMT T., LAURENT С. and TATES. A. Monitoring of occupational exposure to epichlorohydrin by genetic effects and hemoglobin adduct, Mut. Res., 381, p.217-226, 1997 | |
[101] | LATVEN A. and MOLITOR H. Comparison of the toxic, hypnotic and irritating properties of eight organic solvents, J. Pharm. Exp. Ther., 65, p.89-94, 1939 | |
[102] | LAWRENCE W., TURNER J. and AUTIAN J. Toxicity of ethylene chlorohydrin I: Acute toxicity studies, J. Pharm. Sci., 60(4), p.568-571, 1971 | |
[103] | LAWRENCE W., ITOH K., TURNER J. and AUTIAN J. Toxicity of ethylene chlorohydrin II: Subchronic toxicity and special tests, J. Pharm. Sci., 60(8), p.1163-1168, 1971 | |
[104] | LAWRENCE W., DILLINGHAM E., TURNER J. and AUTIAN J. Toxicity profile of chloroacetaldehyde, J. Pharm. Sci., 61(1), p.19-25, 1972 | |
[105] | LEE H.T., DANIEL A. and WALKER С. Conformance test procedures (CTP) for verifying the labeling claims for precision, bias, and interferences in in-vitro diagnostic devices used for the quantitative measurement of analytes in human body fluids, in Bureau of Medical Devices Biometrics Report 8202, Food and Drug Administration, Silver Spring, MD, April 1982 | |
[106] | LONG G.L. and WINEFORDNER J.D. Limit of detection - A closer look at the IUPAC definition, Anal. Chem., 55(7), p.712A-724A, 1983 | |
[107] | LYNCH D., LEWIS T., MOORMAN W., SABHARWAL P. and BURG J. Toxic and mutagenic effects of ethylene oxide and propylene oxide on spermatogenic functions in Cynomolgus monkeys, Toxicologist., 3, p.60, 1982 | |
[108] | LYNCH D., LEWIS Т., MOORMAN W., BURG J., GROTH D., KHAN A., ACKERMAN L. and COCKERELL B. Carcinogenic and toxicologic effects of inhaled ethylene oxide and propylene oxide in F 344 rats, Tox. Appl. Pharm., 76, p.69-84, 1984 | |
[109] | LYNCH D., LEWIS Т., MOORMAN W. et al., Effects on monkeys and rats of long-term inhalation exposure to ethylene oxide: Major findings of the NIOSH study, in In-hospital ethylene sterilization, Current issues in ETO toxicity and occupational exposure, AAMI Technology Assessment Report No. 8-84, Association for the Advancement of Medical Instrumentation, Arlington, VA, p.7-10, 1984 | |
[110] | MALANOSKI A.J. Analyst performance standards: Determination for and from collaborative studies, J. Assoc. Off. Anal. Chem., 65(6), p.1333-1338, 1982 | |
[111] | MANIUS G.J. Determination of ethylene oxide, ethylene chlorohydrin, and ethylene glycol residues in ophthalmic solution at proposed concentration limits, J. Pharm. Sci., 68(12), p.1547-1549, 1979 | |
[112] | MARLOWE D.E., LAO N.T., LAO C.S., EATON A.R. and PAGE B.F.J. Interlaboratory Comparison of Ethylene Oxide Residue Analysis Test Methods (HHS Publication FDA 86-4204), March 1986 | |
[113] | MARLOWE D.E. Summary of results from interlaboratory comparison of ethylene oxide residue analysis test methods, Paper presented at AAMI Conference on In-hospital EO sterilization, Arlington, VA, November 1983 | |
[114] | MARLOWE D.E., LAO N.T., EATON A.R., PAGE B.F.J, and LAO C.S. An interlaboratory comparison of analytical methods for ethylene oxide, J. Pharm. Sci., 76, p.333-337, 1986 | |
[115] | MARONPOT R., ZELENAK J., WEAVER E. and SMITH N. Teratogenicity study of ethylene glycol in rats, Drug Chem. Tox., 6(6), p.579-594, 1983 | |
[116] | MASON M., CATE С. and BAKER J. Toxicology and carcinogenesis of various chemicals used in the preparation of vaccines, Clin. Toxicol., 4(2):185-204, 1971 | |
[117] | MATSUMOTO T., HARDAWAY R.M., PANI K.С., SATER С.М., BARTAK D.E. and MARGETIS P.M. Safe standard of aeration for ethylene oxide sterilized supplies, Arch. Surg., 96, p.464-470, 1968 | |
[118] | MCDONALD T., ROBERTS M. and BORGMANN A. Ocular toxicity of ethylene chlorohydrin and ethylene glycol in rabbit eyes, Tox. Appl. Pharm., 21, p.143-150, 1972 | |
[119] | MCDONALD T., KASTEN K., HERVEY R., GREGG S., BORGMANN A. and MURCHESON T. Acute ocular toxicity of ethylene oxide, ethylene glycol and ethylene chlorohydrin, Bull. Parent. Drug Assoc, 27(4), p.153-164, 1973 | |
[120] | MCDONALD T., KASTEN K., HERVEY R., GREGG S. and BUTTON B. Acute ocular toxicity for normal and irritated rabbit eyes and subacute ocular toxicity for ethylene oxide, ethylene chlorohydrin and ethylene glycol, Bull. Parent. Drug Assoc, 31(1), p.25-32, 1977 | |
[121] | MCGLYNN K.A., HUNTER K., LEVOYER T., ROUSH J., WISE P., MICHIELLI R.A., SHEN F.M., EVANS A.A., LONDON W.T., BUETOW K.H. Susceptibility to a flatoxin B1-related primary hepatocellular carcinoma in mice and humans, Cancer Res., 63(15), p.4594-4601, 2003 | |
[122] | MELNICK R. (1984). Toxicities of ethylene glycol and ethylene glycol monoethyl ether in Fischer 344/N rats and B6C3F1 mice, Env Hlth. Perspect, 57, p.147-155, 1984 | |
[123] | MERTES I., FLEISCHMANN R., GLATT H.R. and OESCH F. Interindividual variations in the activities of cytosolic and microsomal epoxide hydrolase in human liver, Carcinogenesis, 6(2) p.219-223, February 1985 | |
[124] | MILLAR M.R., SHARPE R.M., WEINBAUER G.F., FRASER H.M., SAUNDERS P.T. Marmoset spermatogenesis: organizational similarities to the human, Int. J. Androl., 23(5) p.266-77, October 2000 | |
[125] | MOGENHAN J.A., WHITBOURNE J.E. and ERNST R.R. Determination of ethylene oxide in surgical materials by vacuum extraction and gas chromatography, J. Pharm. Sci., 60(2), p.222-224, 1971 | |
[126] | MOORE J.A., DASTON G.P., FAUSTMAN E., GOLUB M.S., HART W.L., HUGHES С. Jr, KIMMEL C.A., LAMB J.C., SCHWETZ B.A. and SCIALLI A.R. An evaluative process for assessing human reproductive and developmental toxicity of agents, Reprod. Toxicol., 9(1), p.61-95, 1995 | |
[127] | MORDENTI J. Man versus beast: pharmacokinetic scaling in mammals, J. Pharm. Sci., 75(11), p.1028-1040, 1986 | |
[128] | MORI K., KAIDO M., FUJISHIRO K., INOUE N., KOIDE O., HORI H. and TANAKA I. Dose dependent effects of inhaled ethylene oxide on spermatogenesis in rats, Br. J. Ind. Med., 48(4), p.270-274, April 1991 | |
[129] | MORRIS Т., NELSON M. and CALVERY A. Observations on the chronic toxicities of propylene glycol, ethylene glycol, diethylene glycol, ethylene glycol mono-ethyl-ether, and diethylene glycol mono-methyl-ether, J. Pharm. Exp. Then, 74, p.266-273, 1942 | |
[130] | MULLER M., KRAMER A., ANGERER J. and HALLIER E. Ethylene oxide-protein adduct formation in humans: influence of glutathione-S-transferase polymorphisms, Int. Arch. Occup. Environ. Health, 71(7), p.499-502, 1998 | |
[131] | MUZENI R.J. Rapid gas chromatographic determination of ethylene oxide, ethylene chlorohydrin, and ethylene glycol residues in rubber catheters, J. Assoc. Off. Anal. Chem., 68(3), p.506-508, 1985 | |
[132] | NAKAMURA A., KIKUCHI H. and TSUJI K. Determination of ethylene oxide residue in commercially available intraocular lenses by new sensitive method (Electron capture detection/gas chromatography), IOL, 3, p.4-8, 1989 | |
[133] | National Toxicology Program, Toxicology and Carcinogenicity Studies of 2-Chloroethanol (Ethylene Chlorohydrin) (CAS. No 107-07-3) in F344/N Rats and Swiss CD-1 Mice (Dermal Studies) (NTP TR275, NIH Publication 86-2531). Research Triangle Park, NC, NTP, 1985 | |
[134] | National Toxicology Program, Toxicology and Carcinogenicity Studies of Ethylene Oxide (CAS No. 75-21-8) in B6C3F1 Mice (Inhalation Studies) (NTP Technical Report 326, U.S. Department of Health and Human Services, Public Health Services, National Institute of Health). Research Triangle Park, NC, NTP, 1987 | |
[135] | National Toxicology Program, Toxicology and Carcinogenesis Studies of Ethylene Glycol (CAS No. 107-21-1) in B6C3F1 mice (feed studies) (NTP Technical Report 413, U.S. Department of Health and Human Services). Research Triangle Park, NC, NTP, 1993 | |
[136] | National Toxicology Program - Center for the Evaluation of Risks to Human Reproduction Expert Panel, Report on the Reproductive and Developmental Toxicity of Ethylene Glycol. NTP-CERHR-EG-03, 2003 | |
[137] | NEEPER-BRADLE, T. Developmental Toxicity Evaluation of Ethylene Glycol Administrated by Gavage to CD(R) (Sprague-Dawley) Rats: Determination of a "No Observable Effect Level" (NOEL), Report 52-656, Bushy Run Research Center, Union Carbide Corporation, Export, PA (Study sponsored by Ethylene Glycol Panel, Chemical Manufacturers Association. Washington, D.C.), 1990 | |
[138] | NIVARD M.J., CZENE K., SEGERBACK D. and VOGEL E.W. Mutagenic activity of ethylene oxide and propylene oxide under XPG proficient and deficient conditions in relation to N-7-(2-hydroxyalkyl)guanine levels in Drosophila, Mutat. Res., 529(1-2), p.95-107, 2003 | |
[139] | NORTHUP S., WEINCKOWSKI D., MARTIS L. and DARBY T. Toxicity caused by acute and subacute intravenous administration of ethylene oxide in the rat, J. Environ. Pathol. Toxicol., 5, p.617-623, 1981 | |
[140] | OBA T., TSUJI K., MIZUMACHI S., KIKUCHI H., SHINTANI H., IIDA K. and MEGURO K. Studies on residual ethylene oxide in medical devices (I) - Gas chromatographic determination of ethylene oxide in plastics. Ikakikaigaku, 52(3), p.134-139, 1982 | |
[141] | OHBA T. Safety of residual ethylene oxide and ethylene oxide concentrations in the working environment of sterilization facilities, in Gaughren, E.; Morrissey, R.; You-sen, W; eds., Sterilization of Medical Products Volume IV, Polyscience Publications, Montreal, p.172-177, 1986 | |
[142] | OLSEN A.K., BJORTUFT H., WIGER R., HOLME J., SEEBERG E., BJORAS M. and BRUNBORG G. Highly efficient base excision repair (BER) in human and rat male germ cells, Nucleic Acids Res. 29(8), p.1781-90, 2001 | |
[143] | OMIECINSKI C.J., AICHER L and SWENSON L. Developmental expression of human microsomal epoxide hydrolase, J. Pharmacol. Exp. Ther. 269(1), p.417-23, 1994 | |
[144] | OMIECINSKI C.J., HASSETT С. and HOSAGRAHARA V. Epoxide hydrolase-polymorphism and role in toxicology. Toxicol. Lett., 112-113, p.365-70, 2000 | |
[145] | OSER В., MORGAREIDGE K., COX G. and CARSON J. Short-term toxicity of ethylene chlorohydrin (ECH) in rats, dogs and monkeys, Fd. Cosmet. Tox., 13, p.313-315, 1975 | |
[146] | Pharmaceutical Manufacturers Association. Procedures for setting limits for volatile organic solvents with methylene chloride as an example of the process. Committee on Rational Specifications for Impurities in Bulk Drug Substances - Pharmaceutical Manufacturers Association. In: Pharmacopeial Forum. Washington, DC: PMA, 1989; November-December, p.5748-5759 | |
[147] | Pharmaceutical Manufacturers Association. Application of the PMA procedure for setting residue limits for organic volatile solvents in pharmaceuticals to ethylene oxide. Prepared by D.L. Conine and the PMA subcommittee of Industrial Toxicologists. Procedures for setting limits for organic volatile solvents with chloroform, 1,4-dioxane, ethylene oxide, and trichloroethylene as examples of the process. Committee on Rational Specifications for Impurities in Bulk Drug Substances - Pharmaceutical Manufacturers Association. In: Pharmacopeial Forum. Washington, DC: PMA, May-June: 557-572, 1990 | |
[148] | POTTENGER L.H., CARNEY E.W. and BARTELS M.J. Dose-dependent nonlinear pharmacokinetics of ethylene glycol metabolites in pregnant (GD 10) and nonpregnant Sprague-Dawley rats following oral administration of ethylene glycol, Toxicol. Sci. 62, p.10-19, 2001 | |
[149] | PRICE C., KIMMEL C., TYL R. and MARR M. The developmental toxicity of ethylene glycol in rats and mice, Tox. Appl. Pharm., 81, p.113-127, 1985 | |
[150] | PRICE C., TYL R., MARR M. and KIMMEL С. Teratologic evaluation of ethylene glycol (EG) in CD rats and CD-1 mice, Teratology, 29(2): 52A, 1984 | |
[151] | RAGELIS E.P., FISHER B.S., KIMECK B.A. and JOHNSON С. Isolation and determination of chlorohydrins in foods fumigated with ethylene oxide or propylene oxide. J. Assoc. Off. Anal. Chem., 51(3), p.709-717, 1968 | |
[152] | ROBERTS J. and SEIBOLD H. Ethylene glycol toxicity in the monkey, Tox. Appl. Pharm. 15, p.624-631, 1969 | |
[153] | ROBINSON M., POND C., LAURIE R., BERCZ J., HeNNINGSEN G. and CONDIE L. Subacute and subchronic toxicity of ethylene glycol administered in drinking water to Sprague-Dawley rats, Drug Chem. Tox., 13(1), p.43-70, 1990 | |
[154] | RODRICKS J.V. and BROWN S.L. Data requirements for assessment of device risks, J. Am. Coll. Toxicol., 7, p.509-518, 1988 | |
[155] | ROMANO S.J. and RENNER J.A. Comparison of analytical methods for residual ethylene oxide analysis, J. Pharm. Sci., 64(8), p.1412-1417, 1975 | |
[156] | ROMANO S.J., RENNER J.A. and LEITNER P.M. Gas chromatography determination of residual ethylene oxide by head space analysis, Anal. Chem., 45(14), p.2327-2330, 1973 | |
[157] | ROMAGUERA С. and VILAPLANA J. Airborne occupational contact dermatitis from ethylene oxide, Contact Dermatitis, 39, p.85, 1997 | |
[158] | ROSSINI A., RAPOZO D.C., AMORIM L.M., MACEDO J.M., MEDINA R., NETO J.F., GALLO C.V. and PINTO L.F. Frequencies of GSTM1, GSTT1, and GSTP1 polymorphisms in a Brazilian population, Genet. Mol. Res., 1(3), p.233-40, 2002 | |
[159] | ROWE V. and MCCOLLISTER S. Alcohols. Chapter Fifty-Five, in: Clayton, G., Clayton, F., eds. Patty's Industrial Hygiene and Toxicology (3rd ed. Vol. 2C Toxicology), John Wiley & Sons, New York, p.4675-4684, 1982 | |
[160] | ROWE V. and WOLF M. GLYCOLS. Alcohols. Chapter Fifty, in: Clayton, G., Clayton, F., eds. Patty's Industrial Hygiene and Toxicology (3rd ed. Vol. 2C Toxicology). John Wiley & Sons, New York, p.3817-3832, 1982 | |
[161] | RTECS, Registry of Toxic Effects of Chemical Substances 1985-1986, National Institute for Occupational Safety and Health, DHHS (NIOSH) Publication No. 87-114, Rockville, MD, p.2361-2362, 1987 | |
[162] | RTECS, Registry of Toxic Effects of Chemical Substances. National Institute for Occupational Safety and Health, On-line, Rockville, MD, 2006 | |
[163] | SCHRODER K.R., WIEBEL F.A., REICH S., DANNAPPEL D., BOLT H.M. and HALLIER E. Glutathione-S-transferase (GST) theta polymorphism influences background SCE rate, Arch. Toxicol., 69(7), p.505-507, 1995 | |
[164] | SCHULER R., HARDIN В., NIEMEIER R., BOOTH G., HAZELDEN K., PICCIRILLO V. and SMITH K. Results of testing fifteen glycol ethers in a short-term in vivo reproductive toxicity assay, Env Hlth. Perspect. 57, p.141-146, 1984 | |
[165] | SEGERBACK D., OSTERMAN-GOLKAR S., MOLHOLT B. and NILSSON R. In vivo tissue dosimetry as a basis for cross-species extrapolation in cancer risk assessment of propylene oxide, Regul. Toxicol. Pharmacol. 20(1 Pt 1), p.1-14 | |
[166] | SEILKEN R. and VALDEZ-FLORES С. Cancer Dose-Response Modeling and Risk Characterizations Based on Animals Exposed to Ethylene Oxide FINAL REPORT, Submitted to Ethylene Oxide Industry Council, 2000 | |
[167] | SHIMIZU H., OHARA K. and SAWA M. Sterile anterior segment inflammation presumably due to absorbed ethylene oxide to the implanted intraocular lens, Rinsho Ganka (Japanese J. Clin. Ophthalmol.), 40(11), p.1219-1225, 1986 | |
[168] | SHUPACK J.L., ANDERSEN S.R. and ROMANO S.J. Human skin reactions to ethylene oxide. J. Lab. Clin. Med., 98, p.723-729, 1981 | |
[169] | SNELLINGS W.M., MARONPOT R.R., ZELENAK J.P. et al. Teratology study in Fischer 344 rats exposed to ethylene oxide by inhalation, Toxicol. Appl. Pharmacol., р.64, 476-481, 1982 | |
[170] | SNELLINGS W., MARONPOT R., ZELENAK J. and LAFFOON С. Teratology study in Fischer 344 rats exposed to ethylene oxide by inhalation, Tox. Appl. Pharm., 64, p.476-481, 1982a | |
[171] | SNELLINGS W., ZELENAK J. and WEIL С. Effects on reproduction in Fischer rats exposed to ethylene oxide by inhalation for one generation, Tox. Appl. Pharm., 63, p.382-388, 1982b | |
[172] | SNELLINGS W., WEIL С. and MARONPOT R. A subchronic inhalation study on the toxicologic potential of ethylene oxide in B6C3F1 mice, Tox. Appl. Pharm., 76, p.510-518, 1984a | |
[173] | SNELLINGS W., WEIL С. and MARONPOT R. A two-year inhalation study of the carcinogenic potential of ethylene oxide in Fischer 344 rats, Tox. Appl. Pharm., 75, p.105-117, 1984b | |
[174] | SNYDER L.R. A rapid approach to selecting the best experimental conditions for high-speed liquid column chromatography - Part 1 - Estimating initial sample resolution and the final resolution required by a given problem, J. Chromatogr. Sci.; 10, p.201-212, 1972 | |
[175] | SPITZ H.D. and WEINBERGER J. Determination of ethylene oxide, ethylene chlorohydrin and ethylene glycol by gas chromatography, J. Pharm. Sci., 60(2), p.271-274, 1971 | |
[176] | STAYNER L., STEENLAND K., GREIFE A., HORNUNG R., HAYES R.B., NOWLIN S., MORAWETZ J., RINGENBURG V., ELLIOT L. and HALPERIN W. Exposure-response analysis of cancer mortality in a cohort of workers exposed to ethylene oxide, Am. J. Epidemiol., 138(10), p.787-98, 1993 | |
[177] | STEENLAND K., STAYNER L., GREIFE A. et al. A cohort mortality study of workers exposed to ethylene oxide, N. Engl. J. Med., 324, p.402-407, 1991 | |
[178] | STEENLAND K., STAYNER L. and DEDDENS J. Mortality analysis in a cohort of 18235 ethylene oxide exposed workers: follow up extended from 1987 to 1998, Occup. Environ. Med., 61, p.2-7, 2004 | |
[179] | TANAKA S., NAKAURA S., KAWASHIMA K., KASUYA Y. and OMORI Y. Studies on the hemolytic activity and dermal irritability of ethylene oxide and its reaction products. Jap. J. Med. Instrum. 52(1), p.21-28, 1982 | |
[180] | TAYLOR J.S. Dermatologic hazards from ethylene oxide, Cutis, 19, p.189-192, 1977 | |
[181] | TETA M.J., SIELKEN R.L. jr.m and VALDEZ-FLORES С. Ethylene oxide cancer risk assessment based on epidemiological data: application of revised regulatory guidelines, Risk Anal. 19(6), p.1135-55, 1999 | |
[182] | THIER R., LEWALTER J., KEMPKES M., SELINSKI S., BRUNING T. and BOLT H.M. Haemoglobin adducts of acrylonitrile and ethylene oxide in acrylonitrile workers, dependent on polymorphisms of the glutathione transferases GSTT1 and GSTM1, Arch. Toxicol., 73(4-5), p.197-202, 1999 | |
[183] | THIER R., BRUNING T., ROOS P.H., RIHS H.P., GOLKA K., КО Y. and BOLT H.M. Markers of genetic susceptibility in human environmental hygiene and toxicology: the role of selected CYP, NAT and GST genes, Int. J. Hyg. Environ. Health., 206(3), p.149-71, 2003 | |
[184] | THIER R., BALKENHOL H., LEWALTER J., SELINSKI S., DOMMERMUTH A. and BOLT H.M. Influence of polymorphisms of the human glutathione transferases and cytochrome P450 2E1 enzyme on the metabolism and toxicity of ethylene oxide and acrylonitrile, Mutat. Res., 482(1-2), p.41-46, 2001 | |
[185] | TYL R. Developmental Toxicity Evaluation of Ethylene Glycol Administrated by Gavage to DC(R)-1 Mice: Determination of a "No-Observable-Effect Level" (NOEL), Report 51-591, Bushy Run Research Center. Union Carbide Corporation, Export, PA. (Study sponsored by Ethylene Glycol Panel.) Washington, DC, Chemical Manufacturers Association, 1988 | |
[186] | TYLER T.R., MCKELVEY J.A. Dose dependent disposition of 14C labelled ethylene oxide in rats, Export, PA, Bushy Run Research Center (TSCATS/017061; EPA/OTS Document No. 878212056), 1982 | |
[187] | U.S. ENVIRONMENTAL PROTECTION AGENCY. Health Assessment Document for Ethylene Oxide (EPA 600/8-84-009F). Research Triangle Park, NC, EPA, 1985 | |
[188] | U.S. ENVIRONMENTAL PROTECTION AGENCY (1996) Guidelines for Reproductive Toxicity Risk Assessment EPA/630/R-96/009 http://www.epa.gov/ncea/raf/pdfs/repro51.pdf | |
[189] | U.S. FOOD AND DRUG ADMINISTRATION. EO, ECH & EG, Proposed maximum residue limits and maximum levels of exposure (HEW/FDA), Federal Register. Washington, DC, June 23, 1978; 43(122) | |
[190] | USP Chromatography (section 621) in: United States Pharmacopeia 29th Edition, United States Pharmacopeial Convention 2006 | |
[191] | USP Validation of Compendial Methods (section 1225) in: United States Pharmacopeia 29th Edition, United States Pharmacopeial Convention 2006 | |
[192] | VOGEL E.W. and NATARAJAN A.T. DNA damage and repair in somatic and germ cells in vivo, Mutat. Res., 330(1-2), p.183-208, 1995 | |
[193] | WARREN B. The determination of residual ethylene oxide and halogenated hydrocarbon propellants in sterilized plastics, J. Pharm. Pharmacol., 23(suppl.), p.170S-175S, 1971 | |
[194] | WEIL С. Statistics vs. safety factors and scientific judgement in the evaluation of safety for man, Tox. Appl. Pharm., 21, p.454-463, 1972 | |
[195] | WEINBAUER G.F., ASLAM H., KRISHNAMURTHY H., BRINKWORTH M.H., EINSPANIER A. and HODGES J.K. Quantitative analysis of spermatogenesis and apoptosis in the common marmoset (Callithrix jacchus) reveals high rates of spermatogoniai turnover and high spermatogenic efficiency, Biol. Reprod. 64(1), p.120-126, 2001 | |
[196] | WEINBERGER J. GLC Determination of ethylene chlorohydrin following co-sweep extraction, J. Pharm. Sci., 60(4), p.545-547, 1971 | |
[197] | WERNERMAN J., LUO J.L. and HAMMARQVIST, F. Glutathione status in critically-ill patients: possibility of modulation by antioxidants, Proc. Nutr. Soc., 58(3), p.677-680, 1999 | |
[198] | WESLEY F., ROURKE B. and DARBISHIRE О. The formation of persistent toxic chlorohydrins in foodstuffs by fumigating with ethylene oxide and propylene oxide, J. Food Sci., 30, p.1037-1042, 1965 | |
[199] | WHITBOURNE J.E., MOGENHAN J.A. and ERNST R.R. Determination of 2-chloroethanol in surgical materials by extraction and gas chromatography, J. Pharm. Sci., 58(3), p.1024-1025, August 1969 | |
[200] | WHITE J.D. and BRADLEY T.J. Residual ethylene oxide in methyl methacrylate polymer powders by GLC, J. Pharm. Sci., 62(10), p.1623-1637, 1973 | |
[201] | WHO, Ethylene Oxide. Concise International Chemical Assessment Document 54, World Health Organization, Geneva, 2003 http://www.who.int/pcs/cicad/full_text/cicad54.pdf | |
[202] | WIENCKE J.K., PREMBLE S., KETTERE B. and KELSEY K.T. Gene deletion of Glutathione-S-transferase theta: correlation with induced genetic damage and potential role in endogenous mutagenesis, Cancer Epidemiol. Biomarkers Prev., 4(3), p.253-259, 1995 | |
[203] | WOODARD G. and WOODARD M. Toxicity of residuals from ethylene oxide gas sterilization. Proceedings of the Health Industry Association Technical Symposium, Washington, DC, p.140-161, 1971 | |
[204] | YIN L., LIU C., SHIH L. and PO K. A study of the teratogenic action of ethylene glycol in rats, Zhonghua Yugangyixue Zazhi, 20(5), р.289-290, 1986 | |
[205] | YONG L.C., SCHULTE P.A., WIENCKE J.K., BOENIGER M.F., CONNALLY L.B., WALKER J.T., WHELAN E.A. and WARD E.M. Hemoglobin adducts and sister chromatid exchanges in hospital workers exposed to ethylene oxide: effects of glutathione S-transferase T1 and M1 genotypes, Cancer Epidemiol. Biomarkers Prev, 10(5), p.539-550, 2001 | |
[206] | ZAGAR L.A. Determination of residual ethylene oxide in methyl methacrylate polymer powders by GLC, J. Pharm. Sci., 61(11), p.1801-1803, 1972 | |
[207] | ZHENG W., WEN W.Q., GUSTAFSON D.R., GROSS M., CERHAN J.R. and FOLSOM A.R. GSTM1 and GSTT1 polymorphisms and postmenopausal breast cancer risk, Breast Cancer Res. Treat., 74(1), p.9, 2002 | |
УДК 615.46:002:006.354 | МКС 01.020 |
Ключевые слова: медицинские изделия, экстракция, исчерпывающая экстракция | |
Электронный текст документа
и сверен по:
, 2020